全球超过30%的食品和饲料受到多种真菌毒素的同时污染[1],研发高通量真菌毒素快速检测产品,是研究的重点方向之一。纸基传感器即试纸条类型的快检产品,具有价格低廉,检测快速,操作简单等优点[2],是真菌毒素常用的快检产品[3]。胶体金作为信号标记物的传统纸基传感器,大多用于检测单一毒素,信息有限且灵敏度较低,无法满足高通量快速检测的需求,因而急需研发对多种毒素进行检测的相关产品[4]。与单一毒素的纸基传感器不同,多毒素纸基传感器试剂消耗更少,成本更低[5],样品污染信息获取更加全面[6]。然而,由于多毒素纸基传感器的纸带上需要偶联多种抗原,进而增加了纸带的长度,测试线的样液减少,会影响传统的信号标记物胶体金的检测灵敏度[7]。近年来,纸基传感技术结合贵金属纳米粒子、量子点以及新型纳米材料作为信号标记应用于纸基传感器中[8],可以大大提高纸基传感器的检测灵敏度、准确度等性能[9]。本文综述纸基传感器结合先进材料在多毒素联合检测中的应用,分析先进材料在纸基传感器中的作用特点,为其对多毒素的快速、联合检测提供参考。
1 多毒素纸基传感器的组成与检测原理
纸基传感器由识别元件(生物特异性识别分子)、检测元件(信号标记物)、信号转化元件(光学仪器或智能手机)3 部分组成,形式为一个独立的纸条,也可以将纸条封闭在塑料外壳内。纸带上有样品垫、结合垫、吸收垫、硝酸纤维素(Nitrocellulose,NC)膜。将前处理后的样品滴入多毒素纸基传感器的样品垫上,信号标记物与样液混合,或将样液预先固定在结合垫,样品利用毛细管力的作用沿着NC 膜流动[10]。在含有多种真菌毒素的阳性样品中,被包覆在T 线上的毒素-蛋白偶联物捕获了游离的抗体-信号标记复合物,导致有颜色的信号标记物聚集并形成1 条或多条可见的线,肉眼可直接对待测毒素进行半定量。光学信号(吸光值、荧光强度、拉曼强度等)或颜色强度与样品中毒素的浓度成比例关系[11],与光学检测仪器[11]、智能手机等[12]联用,可以对多种真菌毒素进行定量[13]。
与单毒素纸基传感器仅有1 条测试线不同,目前研究的多毒素纸基传感器大多在NC 膜上有多条测试线(T1、T2......),纸带的长度随着待测毒素数量的增加而增加[14]。也有另一类多毒素纸基传感器,其NC 膜上只有一条T 线,纸带外观上和单毒素纸基传感器没有区别,然而它是将不同的抗原包被在同一T 线上[15]。
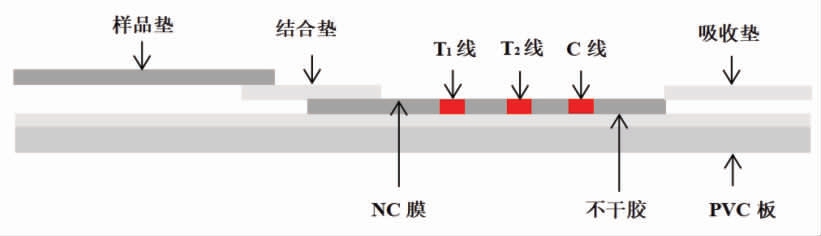
图1 纸基传感器的构造
Fig.1 The structure of the paper-based sensor
2 基于先进材料的纸基传感器在多毒素联合检测中的应用
多毒素纸基传感器因增加了纸带的长度,通过T 线的样液减少,传统的信号标记物胶体金无法满足高灵敏度检测,而贵金属纳米材料等先进材料具有独特的性质,可用于传感器的信号放大及分离[16],应用于多毒素纸基传感器可以大大提高多毒素检测的速度、灵敏度及特异性。目前,常用的先进材料有金、银等贵金属纳米粒子、量子点(Quantum dots,QDs)、磁性纳米材料(Magnetic nanoparticles,MNPs)、上转换粒子(Up-conversion nanoparticles,UCNPs)等,表1总结了各种先进材料的特点。在多种真菌毒素定量联合检测中,常常将比色法、荧光法和表面增强拉曼光谱法等与纸基传感器结合在一起,定量方式主要有2 种,一种是通过纸基传感器上输出信号位置不同来进行识别定量[17],另一种是通过输出信号颜色的强弱进行识别定量[17]。
表1 不同先进材料的特点[18]
Table 1 Characteristics of different advanced materials[18]

?
2.1 基于输出信号位置测定多种真菌毒素
基于输出信号位置的多毒素纸基传感器含有包被不同毒素抗原的多条T 线,每条T 线对应一种待测毒素。根据不同位置T 线上的抗原是否与样品中的毒素发生反应,从而引起特定位置的信号改变来进行半定量或定量(表2)。最常见的是结合贵金属纳米材料的比色法、量子点等标记的荧光法、表面增强拉曼光谱法(Surface-enhanced Raman scattering,SERS)3 种类型纸基传感器。
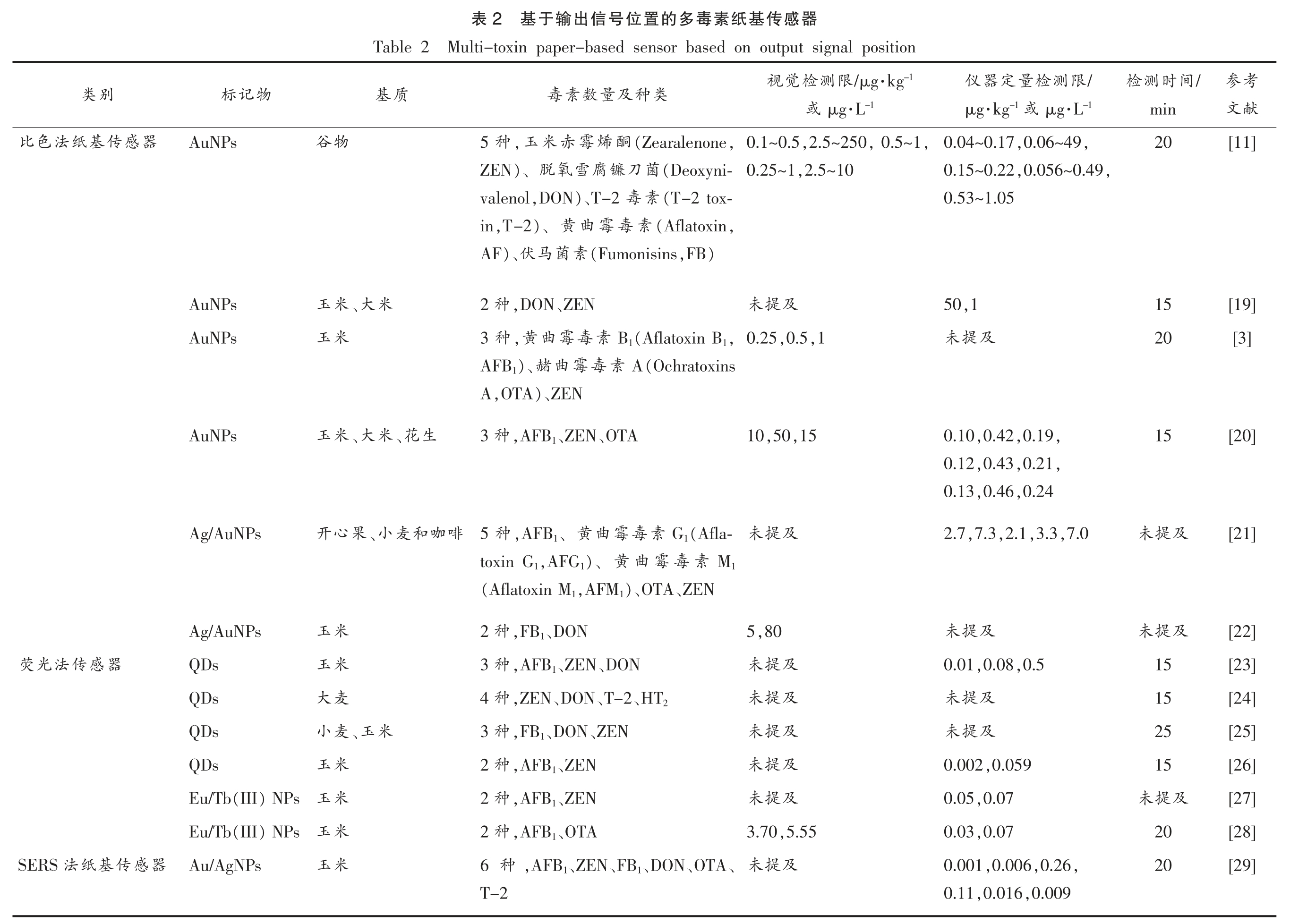
考参献文[11][19][3][20][21][22][23][24][25][26][27][28][29]/间时测检min 20 15 20 15及提未及提未15 15 25 15及提未20 20/限测检量定器仪-1·L μg-1 或·kg μg,,0.06~49 0.04~0.17,,0.056~0.49 0.15~0.22 0.53~1.05,1 50及提未,,0.19,0.42 0.10,,0.21,0.43 0.12,0.24,0.46 0.13,7.0,3.3,2.1,7.3 2.7及提未,0.5,0.08 0.01及提未及提未,0.059 0.002,0.07 0.05 0.03,0.07,,0.26,0.006 0.001,0.009,0.016 0.11器感传基纸素毒多的置位号信出输于基2表Multi-toxin paper-based sensor based on output signal position-1·kg /μg限测检觉视-1·L μg或类种及量数素毒,,0.5~1,2.5~250 0.1~0.5,(Zearalenone酮烯霉赤米,玉种5,2.5~10 0.25~1(Deoxyni-菌刀镰腐雪氧)、脱ZEN(T-2 tox-素毒)、T-2,DON valenol,(Aflatoxin素毒霉曲)、黄,T-2 in),FB(Fumonisins素菌马)、伏AF及提未、ZEN,DON种2 0.25,0.5,1,(Aflatoxin B1 B1素毒霉曲,黄3 种A(Ochratoxins 素毒霉曲)、赭AFB1 A,OTA)、ZEN,15,50 10、OTA、ZEN,AFB1种3及提未(Afla-G1素毒霉曲、黄,AFB1种啡 5 M1素毒霉曲)、黄,AFG1 toxin G1、ZEN)、OTA,AFM1(Aflatoxin M1,80 5、DON,FB1种2及提未、DON、ZEN,AFB1种3及提未,ZEN、DON、T-2、HT2 4 种及提未、ZEN、DON,FB1种3及提未、ZEN,AFB1种2及提未、ZEN,AFB1种2 3.70,5.55、OTA,AFB1 2 种及提未、、OTA、DON、FB1、ZEN,AFB1种6 T-2 Table 2 质基米、大生、花米、大咖和麦、小果米、玉物谷米玉米玉米玉心开米玉米玉麦大麦小米玉米玉米玉米玉物记标AuNPs AuNPs AuNPs AuNPs Ag/AuNPs Ag/AuNPs QDs QDs QDs QDs) NPs(III Eu/Tb Eu/Tb(III) NPs Au/AgNPs别类器感传基纸法色比器感传法光荧器感传基纸法SERS
目前报道中,基于SERS 的纸基传感器采用金、银纳米粒子作为信号标记结合电磁增强和化学增强作用机制,检测灵敏度达到了pg 级[29],检测限优于QDs、UCNPs。基于荧光法的纸基传感器,检测灵敏度为ng 级[23-26];比色法纸基传感器通常为ng 级至μg 级[3,11,19-22]。QDs、UCNPs 的光学信号强度大于金、银贵金属纳米粒子,纸基传感器表现出更高的灵敏度。在结合贵金属纳米材料的比色法纸基传感器上,金、银等纳米粒子高效吸收可见光,比传统试纸条视觉检测限更低,读取结果更快速、简便,检测时间集中在15~20 min,能实现多毒素的快速检测。目前报道文献中对于量子点等标记的荧光法借助荧光分光光度计等仪器对多毒素的定量,没有进行视觉检出限评价。在SERS 法纸基传感器中,所报道文献采用的是多T 线策略,这增加了SERS 中多波段扫描采集信号的耗时。
2.1.1 比色法纸基传感器 近年来,基于信号输出位置进行检测的比色法纸基传感器的研究越来越多,基于金纳米粒子(Au nanoparticles,AuNPs)的多毒素纸基传感器是其中研究最多的一类。Li等[3]用柠檬酸钠还原法合成AuNPs,并研究了pH值对AuNPs 与蛋白质偶联能力的影响,建立了同时快速检测AFB1、OTA、ZEN 的多毒素纸基传感器。Chen 等[20]研究发现AuNPs 在12~32 nm 范围内,粒径越大,表面积越大,则可以吸附更多的抗体,传感器的检出限越低。
也有研究者通过金纳米粒子稳定性与测试环境变化的关系,以及AuNPs 发生聚集现象进而发生颜色改变构建出多种传感器[30]。Sheini 等[21]用Ag/AuNPs 作为纸基传感器的信号标记物,目标毒素改变金、银纳米粒子的周围环境,发生聚集从而引起颜色加深,有助于识别真菌毒素的种类,提高了对AFB1、AFG1、AFM1、OTA 和ZEN 的检测灵敏度(表2中参考文献[21])。Yu[22]等开发了类似的FB1 和DON 的传感器。当银离子靠近AuNPs 时,AuNPs 向银离子传递电子,银被沉积在AuNPs 的表面[31]。银沉积使T 线上出现明显的黑色,与单纯的AuNPs 传感器相比,银沉积使FB1 和DON 的灵敏度分别提高了2.5 倍和2 倍。
2.1.2 荧光法纸基传感器 QDs 是一种半导体纳米粒子,光稳定性好,具有较宽的激发谱和较窄的发射谱,并且生物相容性好,荧光寿命长,应用于基于信号输出位置的纸基传感器中,更能明显区分各T 线上的不同种类的毒素,典型的检测方法如图2所示。QDs 表面的羧基官能团更容易与抗体偶联,从而提高检测探针的稳定性和灵敏度[23]。Foubert 等[24]分别以QDs 和AuNPs 为信号标记物构建纸基传感器,结果表明,基于QDs 的传感器呈现了更高的灵敏度,并且更容易区分阳性样品和阴性样品。科研工作者进一步研究发现核壳结构的QDs 具有更高的荧光强度,可以显著提高检测灵敏度。Hou 等[25]成功制备核壳结构的CdSe/ZnS QDs,为了提高检测速度,引入磁性纳米材料,构建检测DON、ZEN、T-2 毒素的荧光传感器,作为一种潜在的即时检验(Point-of-care testing,POCT) 平台进行使用。针对DON、ZEN、T-2 这3种真菌毒素,Duan 等[26]构建了基于QDs 的比率型传感器,传统的纸基传感器将IgG 抗体固定在控制线(C 线),当检测体系存在多种分析物时,分析物可能会相互干扰。利用T/C 比率法进行信号校正,首次引入了链霉亲和素-生物素系统作为C 线的信号输出,将生物素与抗原的偶联物固定在C线上,用QDs 偶联亲和素,生物素-链霉素系统与信号探针和样品中真菌毒素的浓度无关,C 线信号的输出值恒定,因此,T/C 比值稳定可靠,排除了分析物的干扰。
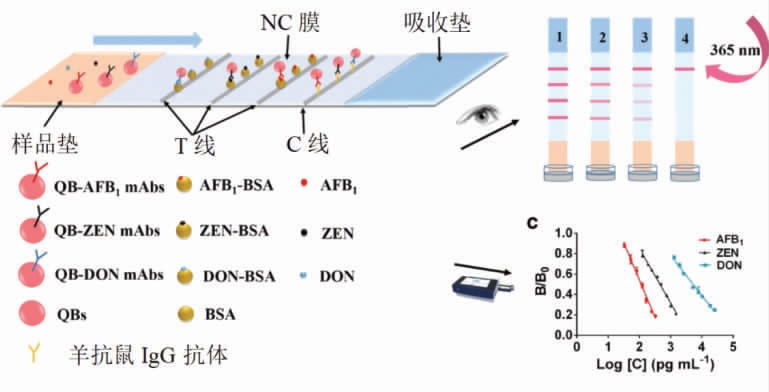
图2 基于量子点微珠的荧光纸基传感器[23]
Fig.2 Fluorescent paper-based sensor based on quantum dot beads[23]
时间分辨荧光分析法是一种特殊的荧光分析法,以镧系元素作为标记物,根据其发光特点,同时测定波长和时间进行信号分辨,可有效排除背景干扰,提高灵敏度[32-33],更有利于区分不同信号输出位置的多种毒素。有研究表明,时间分辨荧光纳米珠与量子点纳米珠相比,消耗试剂更少,测定时间更短,检测限更低[34]。Tang 等[27]以新型铕纳米球作为传感信号,分别以纳米抗体及传统抗体为识别元件,构建用于检测AFB1 和ZEN 的纸基传感器。研究发现,基于纳米抗体的传感器比传统抗体传感器的检测灵敏度高10 倍以上,这是由于纳米抗体具有较好的溶解性和化学稳定性,提高了识别元件与毒素之间的亲和力。卢迪莎等[28]构建基于铕纳米球的传感器,可同时检测玉米中AFB1和OTA,重点研究了样品前处理条件,减少样品基质对检测的干扰,在高灵敏度检测的同时提高了准确度。
2.1.3 表面增强拉曼光谱法纸基传感器 SERS技术利用电磁增强和化学增强作用机制,由于自由电子、待测物位于纳米结构之间的均匀间隙中,从而产生信号增强的作用[35]。Zhang 等[29]采用5,5-二硫双-2-硝基苯甲酸和4-巯基苯甲酸对Au/AgNPs 进行双重拉曼信号标记,检测原理如图3所示,利用3 条T 线实现对6 种毒素的测定,每条T 线检测2 种毒素,对AFB1、ZEN、FB1、DON、OTA和T-2 毒素具有较高的检测灵敏度(见表3中参考文献[29])。
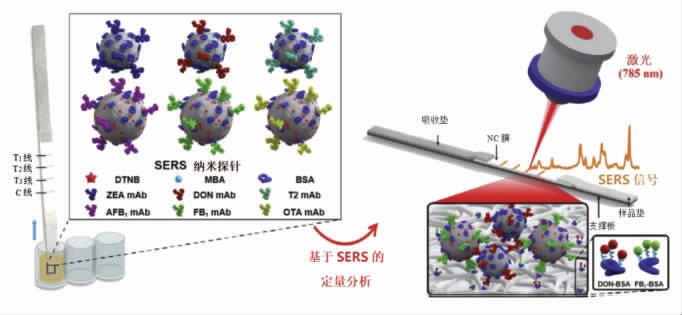
图3 双拉曼标记的多重SERS 纸基传感器[29]
Fig.3 Multi-SERS paper-based sensor with dual Raman marking[29]
2.2 基于输出信号颜色测定多毒素
基于输出信号颜色不同的多毒素纸基传感器含有1 条或者多条T 线,样品中各毒素的抗体分别与不同颜色的信号标记物偶联,在T 线上形成颜色各异的线,根据T 线的颜色进行半定量或定量(表3),最常见的是结合贵金属纳米材料的比色法、量子点等标记的荧光法纸基传感器。该类纸基传感器可产生对比度较大的颜色输出信号,降低了对多种毒素误读的概率。不同颜色的信号标记物便于区分,基于输出信号颜色的纸基传感器对多毒素的检测时间较输出信号位置的纸基传感器更短。而输出信号位置型纸基传感器中比色法的检测限较输出信号颜色型更低,可能与信号标记物的形貌、颜色和尺寸等有关。
表3 基于输出信号颜色的多毒素纸基传感器
Table 3 Multi-toxin paper-based sensor based on output signal color
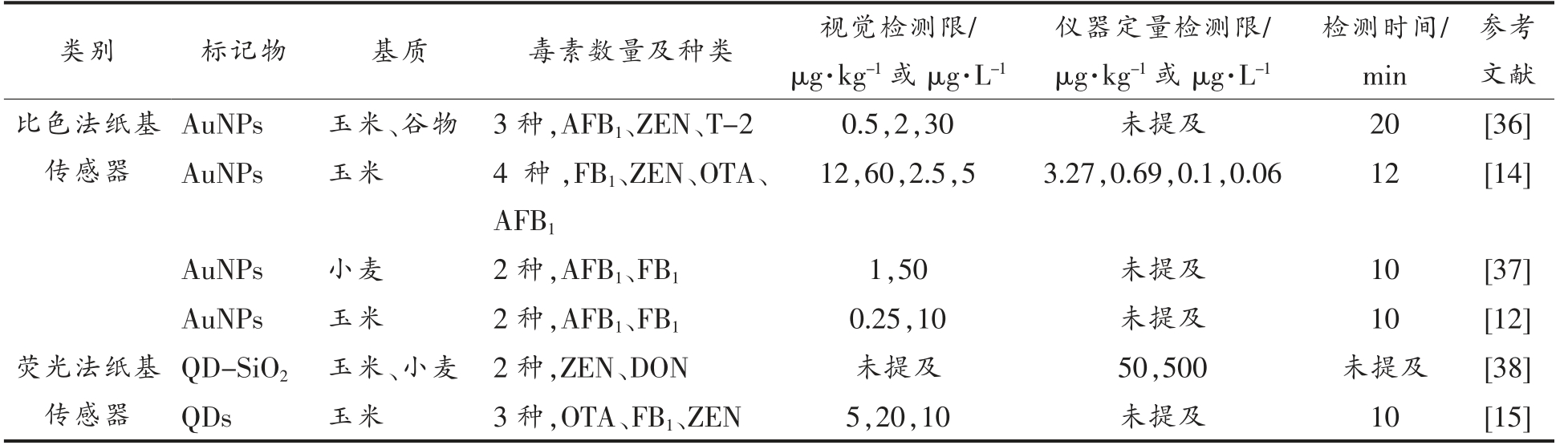
类别 标记物 基质 毒素数量及种类 视觉检测限/μg·kg-1 或μg·L-1仪器定量检测限/μg·kg-1 或μg·L-1检测时间/min参考文献比色法纸基传感器AuNPs 玉米、谷物 3 种,AFB1、ZEN、T-2 0.5,2,30 未提及 20 [36]AuNPs 玉米 4 种,FB1、ZEN、OTA、AFB1 12,60,2.5,5 3.27,0.69,0.1,0.06 12 [14]AuNPs 小麦 2 种,AFB1、FB1 1,50 未提及 10 [37]AuNPs 玉米 2 种,AFB1、FB1 0.25,10 未提及 10 [12]荧光法纸基传感器QD-SiO2 玉米、小麦 2 种,ZEN、DON 未提及 50,500 未提及 [38]QDs 玉米 3 种,OTA、FB1、ZEN 5,20,10 未提及 10 [15]
2.2.1 比色法纸基传感器 比色法纸基传感器使用AuNPs 等作为可视化比色标签,检测过程简单、迅速[39]。Xu 等[36]将不同颜色的AuNPs 作为信号标记物,成功实现AFB1、ZEN 和T-2 的同时检测。Wu 等[14]利用柠檬酸钠还原法,通过调整晶种大小以及反应溶液中对苯二酚、氯金酸和柠檬酸钠的浓度,制备出颜色和形貌均不相同的4 种AuNPs,以其分别作为FB1、ZEN、OTA 和AFB1 的响应信号,实现玉米中的多毒素检测。Nardo 等[37]成功制备出玫瑰状的蓝色和红色AuNPs,并研究其形貌及粒径。与球形AuNPs 相比,玫瑰状AuNPs 呈现特殊的形状,具有更高的表面积,因此,玫瑰状的AuNPs 可吸附更多的抗原。研发出的纸基传感器具有双条T 线,可同时快速测定玉米中的AFB1、FB1,可作为食品中真菌毒素安全评估的筛查工具。然而,实际多毒素检测需要对几种甚至是数十种毒素同时检测,上述方法增加了T线的数量,T 线间距过短难以实现不同毒素之间的分离,因此,纸基传感器的长度需要相应增加,进而增加样液的消耗量。此外,纸基传感器越长,样品流动、完成检测需要花费的时间越长[12]。
若采用多条T 线的构造方式,纸带的长度增长,检测时间也相应增长。单一T 线策略是将多条T 线集成到一条线上,从而减少检测时间及样品消耗,提高检测效率。Nardo 等[12]以2 种颜色AuNPs 为信号,开发具有单一T 线的纸基传感器,同时监测小麦及小麦制品中的AFB1 和FB1。将红色和蓝色的AuNPs 分别标记在AFB1 和FB1 抗原上,2 种抗体混合后滴加在T 线上,抗原与抗体相结合,样品中含有AFB1 时,与抗原竞争,T 线呈蓝色;当样品被FB1 污染时,T 线呈红色。目前利用智能手机对测试线进行图像采集和RGB 数据分析,用手机代替肉眼,降低了视觉检测限,实现对2 种毒素的现场高灵敏检测[40]。然而抗原数量受T线负载量的约束,每种毒素抗原的含量则有限。若样本中毒素含量较高,则会降低检测的准确度。
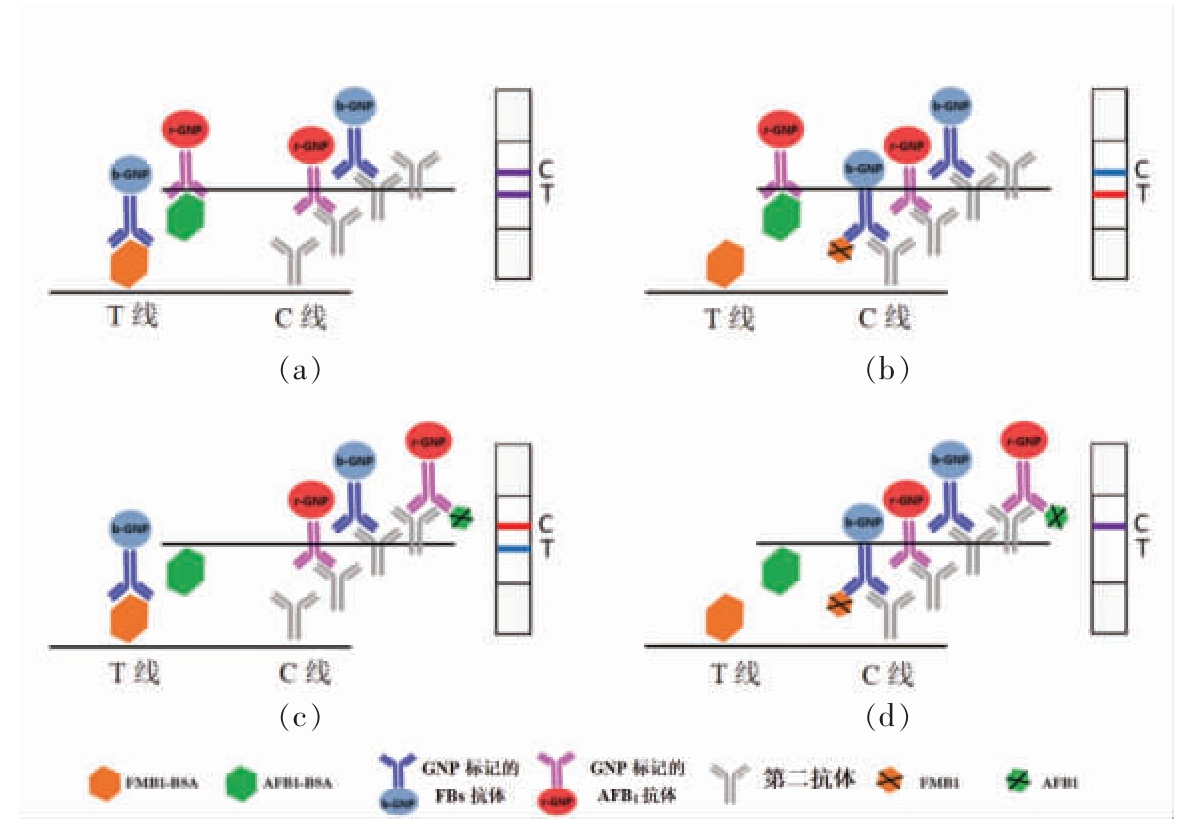
图4 单一T 线的多毒素纸基传感器[37]
Fig.4 Single T-line multiple toxins paper-based sensor[37]
2.2.2 荧光法纸基传感器 荧光纸基传感器结合纳米材料往往可以进一步提高灵敏度,抗背景干扰,避免基质效应[41]。在实际多毒素检测中往往需要同时监测多条T 线,容易出现误读的情况,利用多种光学信号颜色不同的识别元件标记不同毒素可以有效避免这一问题[14]。近年来的研究显示,信号标记物由单色逐渐转变为多色,可更加直观地识别多毒素。Beloglazova 等[38]制备出橙色、黄色的InP/ZnS QDs,包裹在SiO2 外壳中,采用硅烷试剂在QDs 表面修饰羧基,构建荧光纸基传感器检测小麦和玉米中的ZEN 和DON。InP/ZnS 量子点与传统QDs 比,毒性较低,可以广泛应用在食品检测中。为了进一步提高检测速度,将MNPs 引入传感器中。Duan 等[15]制备了黄色、橙色、红色的核-壳结构QDs-MNPs,以此复合材料为信号标记物。结果表明,传感器的检测限较单独使用QDs 时降低,检测时间在10 min 以内。目前,应用在多毒素联合检测的纸基传感器的信号标记物主要集中在AuNPs[12]和QDs[15]。其它先进材料作为信号标记物的纸基传感器还有待开发。例如:有机金属框架(Metal-organic frameworks,MOF)具有极高的表面积,超高孔隙率和独特的化学性质,可以显著提高传感器的灵敏性和稳定性[42]。
3 结语与展望
根据近年的研究文献,笔者对纸基传感器在多毒素联合检测中存在的问题以及研发趋势进行了分析。基于信号输出位置和信号输出颜色的多毒素纸基传感器的差异在于信号标记物的选择上,信号输出位置纸基传感器采用颜色、尺寸和形状相同的信号标记物,简化了试验过程。信号输出颜色纸基传感器中,通过控制材料合成的温度和pH 等条件,制备出颜色、尺寸和形状各异的信号标记物,对多毒素区分更明显,降低误读的概率。
两类传感器共同存在的问题和未来发展趋势:
1)目前两类传感器检测的毒素数量都较为有限,利用微阵列技术可在传感器上喷洒检测点,多T 线转化为多点,构建点状策略纸基传感器,大幅增加检测样本量。
2)所报道多毒素纸基传感器应用在玉米、大米和花生等基质中,而在酱油、醋等复杂基质类发酵食品的应用还未见报道。此外,还应研究样品在纸带上流动的均一性以及基质效应的干扰,以解决干扰检测准确度的问题。
3)研究基于广谱的抗体、适配体和分子印迹聚合物,识别检测某一类毒素或多种毒素是未来发展的趋势之一。
4)目前的研究存在纸带上颜色较浅,显色不明显的问题,导致基于输出位置或颜色的信号区分不明显,更多性能优异的先进材料将应用于多毒素纸基传感器。
5)机器学习方法(神经网络模型、支持向量机和决策树等) 可以简化待测毒素数量增多导致的数据量庞大,使数据处理过程更精准、更高效。此外,智能手机的应用程序代替肉眼和仪器读取信号,优化了视觉检测限,检测过程更加快速、简便。
[1]GORYACHEVA I Y,DE SAEGER S,EREMIN S A,et al.Immunochemical methods for rapid mycotoxin detection:Evolution from single to multiple analyte screening:A review[J].Food Additives and Contaminants Part A-Chemistry Analysis Control Exposure & Risk Assessment,2007,24(10):1169-1183.
[2]IBRAHIM M I M.Immunochromatographic techniques for mycotoxin analysis[M]//Food Toxicology and Contaminants Department,National Research Centre,Cairo,Egypt.2020:71-86.https://doi.org/10.1016/B978-0-12-817998-7.00004-5.
[3]LI X,LI P,ZHANG Q,et al.Multi-component immunochromatographic assay for simultaneous detection of aflatoxin B-1,ochratoxin A and zearalenone in agro-food[J].Biosensors & Bioelectronics,2013,49:426-432.
[4]ZHANG K,LI H,WANG W,et al.Application of multiplexed aptasensors in food contaminants detection[J].ACS Sensors,2020,5(12):3721-3738.
[5]WU Y,ZHOU Y,LENG Y,et al.Emerging design strategies for constructing multiplex lateral flow test strip sensors[J].Biosensors & Bioelectronics,2020,157:112168.
[6]ZHOU S,XU L,KUANG H,et al.Immunoassays for rapid mycotoxin detection:State of the art[J].Analyst,2020,145(22):7088-7102.
[7]TRIPATHI P,UPADHYAY N,NARA S.Recent advancements in lateral flow immunoassays:A journey for toxin detection in food[J].Critical Reviews in Food Science and Nutrition,2018,58(10):1715-1734.
[8]ZHAO S,BU T,HE K,et al.A novel alpha-Fe2O3 nanocubes-based multiplex immunochromatographic assay for simultaneous detection of deoxynivalenol and aflatoxin B1 in food samples[J].Food Control,2021,123:107811.
[9]KURUP C P,TLILI C,ZAKARIA S N A,et al.Recent trends in design and development of nanomaterial-based aptasensors[J].Biointerface Research in Applied Chemistry,2021,11(6):14057-14077.
[10]LI L,CHEN H,LV X,et al.Paper-based immune-affinity arrays for detection of multiple myco toxins in cereals[J].Analytical and Bioanalytical Chemistry,2018,410(8):2253-2262.
[11]KONG D,LIU L,SONG S,et al.A gold nanoparticle-based semi-quantitative and quantitative ultrasensitive paper sensor for the detection of twenty mycotoxins[J].Nanoscale,2016,8(9):5245-5253.
[12]DI NARDO F,ALLADIO E,BAGGIANI C,et al.Colour-encoded lateral flow immunoassay for the simultaneous detection of aflatoxin B1 and type-B fumonisins in a single test line[J].Talanta,2019,192:288-294.
[13]POHANKA M.Point-of-care diagnoses and assays based on lateral flow test[J].International Journal of Analytical Chemistry,2021:6685619.
[14]WU Y,ZHOU Y,HUANG H,et al.Engineered gold nanoparticles as multicolor labels for simultaneous multi-mycotoxin detection on the immunochromatographic test strip nanosensor[J].Sensors and Actuators B-Chemical,2020,316:128107.
[15]DUAN H,LI Y,SHAO Y,et al.Multicolor quantum dot nanobeads for simultaneous multiplex immunochromatographic detection of mycotoxins in maize[J].Sensors and Actuators B-Chemical,2019,291:411-417.
[16]ALHAMOUD Y,YANG D,KENSTON S S F,et al.Advances in biosensors for the detection of ochratoxin A:Bio-receptors,nanomaterials,and their applications [J].Biosensors & Bioelectronics,2019,141:111418.
[17]HU X,ZHANG G.An Immunochromatographic test strip to detect ochratoxin a and zearalenone simultaneously[J].Methods in Molecular Biology (Clifton,NJ),2017,1600:95-105.
[18]GUPTA R,RAZA N,BHARDWAJ S K,et al.Advances in nanomaterial-based electrochemical biosensors for the detection of microbial toxins,pathogenic bacteria in food matrices[J].Journal of Hazardous Materials,2021,401:123379.
[19]KIM K Y,SHIM W B,KIM J S,et al.Development of a simultaneous lateral flow strip test for the rapid and simple detection of deoxynivalenol and zearalenone[J].Journal of Food Science,2014,79(10):2048-2055.
[20]CHEN Y,CHEN Q,HAN M,et al.Development and optimization of a multiplex lateral flow immunoassay for the simultaneous determination of three mycotoxins in corn,rice and peanut[J].Food Chemistry,2016,213:478-484.
[21]SHEINI A.Colorimetric aggregation assay based on array of gold and silver nanoparticles for simultaneous analysis of aflatoxins,ochratoxin and zearalenone by using chemometric analysis and paper based analytical devices[J].Microchimica Acta,2020,187(3):167.
[22]YU Q,LI H,LI C,et al.Gold nanoparticlesbased lateral flow immunoassay with silver staining for simultaneous detection of fumonisin B1 and deoxynivalenol[J].Food Control,2015,54:347-352.
[23]LI R,MENG C,WEN Y,et al.Fluorometric lateral flow immunoassay for simultaneous determination of three mycotoxins (aflatoxin B1,zearalenone and deoxynivalenol) using quantum dot microbeads[J].Microchimica Acta,2019,186(12):748.
[24]FOUBERT A,BELOGLAZOVA N V,DE SAEGER S.Comparative study of colloidal gold and quantum dots as labels for multiplex screening tests for multi-mycotoxin detection[J].Analytica Chimica Acta,2017,955:48-57.
[25]HOU S,MA J,CHENG Y,et al.Quantum dot nanobead-based fluorescent immunochromatographic assay for simultaneous quantitative detection of fumonisin B1,dexyonivalenol,and zearalenone in grains[J].Food Control,2020,117.
[26]DUAN H,XIONG Y.Quantum dot nanobead-based multiplexed immunochromatographic assay for simultaneous detection of aflatoxin B1 and zearalenone[J].Toxicon,2019,158:S58-S59.
[27]TANG X,LI P,ZHANG Q,et al.Time-resolved fluorescence immunochromatographic assay developed using two idiotypic nanobodies for rapid,quantitative,and simultaneous detection of aflatoxin and zearalenone in maize and its products[J].Analytical Chemistry,2017,89(21):11520-11528.
[28]卢迪莎,王序,杨金易,等.同时检测玉米中黄曲霉毒素B1 和赭曲霉毒素A 的时间分辨荧光免疫层析试纸条的研制[J].食品科学,2022,43(2):2346-2354.
LU D S,WANG X,YANG J Y,et al.Simultaneous determination of aflatoxin B1 in maize preparation of time-resolved fluorescence immunochromatographic strip for ochratoxin A and ochratoxin A[J].Food Science,2022,43(2):2346-2354.
[29]ZHANG W,TANG S,JIN Y,et al.Multiplex SERS-based lateral flow immunosensor for the detection of major mycotoxins in maize utilizing dual Raman labels and triple test lines[J].Journal of Hazardous Materials,2020,393:122348.
[30]WANG S,HUANG X,AN Q,et al.Gold nanostar as an ultrasensitive colorimetric probe for picomolar detection of lead ion[J].Analytica Chimica Acta,2021,1160:338380.
[31]ANFOSSI L,DI NARDO F,GIOVANNOLI C,et al.Increased sensitivity of lateral flow immunoassay for ochratoxin A through silver enhancement[J].Analytical and Bioanalytical Chemistry,2013,405(30):9859-9867.
[32]WANG Z,SUN Y,LIANG D,et al.Highly sensitive chromatographic time-resolved fluoroimmunoassay for rapid onsite detection of streptomycin in milk[J].Journal of Dairy Science,2020,103(10):8750-8760.
[33]ZHANG Y,WANG K,ZHAO Y,et al.Dual-label time-resolved fluoroimmunoassay for simultaneous measurement of human epidermal growth factor receptor 2 and human epididymis protein 4 in serum[J].Journal of Analytical Science and Technology,2020,11(1):1-11.
[34]WANG X,WU X,LU Z S,et al.Comparative study of time-resolved fluorescent nanobeads,quantum dot nanobeads and quantum dots as labels in fluorescence immunochromatography for detection of aflatoxin B1 in grains[J].Biomolecules,2020,10(4):575.
[35]YU S,HE L,YU F,et al.A lateral flow assay for simultaneous detection of deoxynivalenol,fumonisin B1 and aflatoxin B1[J].Toxicon,2018,156:23-27.
[36]XU L,ZHANG Z,ZHANG Q,et al.An on-site simultaneous semi-quantification of aflatoxin B1,zearalenone,and T-2 toxin in maize-and cerealbased feed via multicolor immunochromatographic assay[J].Toxins,2018,10(2):87.
[37]DI NARDO F,BAGGIANI C,GIOVANNOLI C,et al.Multicolor immunochromatographic strip test based on gold nanoparticles for the determination of aflatoxin B1 and fumonisins[J].Microchimica Acta,2017,184(5):1295-1304.
[38]BELOGLAZOVA N V,SOBOLEV A M,TESSIER M D,et al.Fluorescently labelled multiplex lateral flow immunoassay based on cadmium-free quantum dots[J].Methods,2017,116:141-148.
[39]GE L,LAI Q,LIU Y,et al.A universal and sensitive sensing platform for biomolecular detection based on the hybridization chain reaction amplification and gold nanoparticles colorimetry[J].Microchemical Journal,2021,167:106319.
[40]TANG X,SU R,LUO H,et al.Colorimetric detection of aflatoxin B1 by using smartphone-assisted microfluidic paper-based analytical devices[J].Food Control,2022,132:108497.
[41]WU J,ALI S,OUYANG Q,et al.Highly specific and sensitive detection of aflatoxin B1 in food based on upconversion nanoparticles-black phosphorus nanosheets aptasensor[J].Microchemical Journal,2021,171:106847.
[42]HUANG X,HUANG D,CHEN J,et al.Fabrication of novel electrochemical sensor based on bimetallic Ce-Ni-MOF for sensitive detection of bisphenol A[J].Analytical and Bioanalytical Chemistry,2020,412(4):849-860.