大多数天然存在人体肠道中的益生菌,如粪肠球菌(Enterococcus faecalis),通常是来源于发酵食品。例如:酸奶、奶酪、发酵香肠、酸菜等。其中能代谢合成细菌素的菌株,因细菌素对致病菌的抑制作用[1]以及不具有抗药性,而极大地增强了对人体健康的益生功效[2]。粪肠球菌Gr17 分离自中国传统发酵酸鱼,可以代谢合成新型广谱IIa 细菌素enterocin Gr17。enterocin Gr17 具有良好的酸碱耐受性和热稳定性,在pH 2~10 条件下仍具有抑菌能力,100 ℃加热30 min 与121 ℃加热15 min 后,其抑菌活性可分别保留95.26%和90.35%[3]。粪肠球菌Gr17 有作为发酵食品功能性菌株的巨大应用潜力。
许多IIa 类细菌素代谢合成受种群内部 (种内)三组分群体感应系统[4-5](Quorum sensing,QS)调控,该系统包括担当种内信号分子的自诱导肽 (Autoinducing peptide,AIP) 和双组分系统(Two component system,TCS),其中TCS 由组氨酸蛋白激酶(Histidine protein kinase,HPK)和反应调节蛋白 (Response regulator protein,RR)组成[4-5],AIP 的分泌需要ABC 转运蛋白的协助。前期研究表明,添加AIP 粗提液可诱导粪肠球菌Gr17 合成细菌素,且在粪肠球菌Gr17 中发现细菌素ABC 转运基因[6](as-48E、as-48F、as-48G、as-48H)、双组分基因(entPK、entR)、自诱导肽基因(entIP)和细菌素编码基因(entGr17),这表明种内三组分群体感应系统参与调控细菌素enterocin Gr17 的代谢合成过程[3]。
实际发酵环境中粪肠球菌Gr17 会面临多种胁迫条件[7],包括酸胁迫[8-10]、盐胁迫[11]、温度胁迫[12]、氧胁迫[13]、乙醇胁迫[14]和营养胁迫[15]等。因发酵过程会积累大量的酸[16],而大部分乳酸菌是嗜中性微生物[17],不耐受酸性环境,导致生长代谢缓慢甚至死亡,因此说酸胁迫是重要的胁迫因素。不过,酸胁迫具有双重效应,一些微生物经过弱酸胁迫处理会产生一定的适应性[17],对自身产生一定的保护作用,甚至可促使某些代谢产物的过量合成[18]。董颖颖等[19]研究发现,与强酸胁迫(pH 1.5)相比,弱酸胁迫(pH 3.5)条件处理产朊假丝酵母(Candida utilis)SZU 07-01 可促进谷胱甘肽的过量合成。
目前,尚不清楚酸胁迫能否增强粪肠球菌Gr17 合成细菌素的能力,能否通过影响种内三组分群体感应系统以增加粪肠球菌Gr17 的合成量。为此,本研究探讨不同酸胁迫条件对菌株Gr17 生长及代谢合成细菌素的影响,筛选可正向影响细菌素合成的酸胁迫条件参数。通过确定群体检测系统和与细菌素生物合成有关的基因表达水平,初步分析酸胁迫正向调控粪肠球菌Gr17 合成细菌素的机理。全面揭示实际发酵环境中分子水平上乳酸菌细菌素合成的调控行为,最大限度地提高乳酸菌生产菌素的应用价值,具有重要的科学和现实意义。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株 粪肠球菌 (Enterococcus faecalis)Gr17 于实验室分离保藏;指示菌:大肠杆菌(Escherichia coli)1.90,由中国普通微生物菌种保藏管理中心提供。
1.1.2 主要试剂 硫酸铵、NaOH、HCl、无水乙醇、96 孔细胞培养板、SYB Green 染料,上海抚生实业有限公司;胰蛋白胨大豆肉汤(TSB)培养基、胰蛋白胨大豆固体(TSA)培养基,上海恪敏生物科技有限公司;DNA Maker、琼脂糖、RNA 制备Pure Cell/Bacterla 试剂盒RNA 提取试剂盒、DNaseI(无RNase)和RNase 抑制剂、细菌基因组DNA 提取试 剂 盒(DP302)、qPCR Master Mix、SuperReal PreMix Plus(SYBR 绿色),翌圣生物科技(上海)有限公司。
1.1.3 种子培养基与发酵培养基 种子培养基:MRS 肉汤培养基。发酵培养基:酪蛋白胨、牛肉提取物各10.0 g/L,酵母提取物、葡萄糖、乙酸钠各5.0 g/L,柠檬酸二胺、K2HPO4 各2.0 g/L,Tween 80 1.0 g/L,MgSO4·7H2O 0.2 g/L,MnSO4·H2O 0.05 g/L。
1.2 仪器与设备
UB-7pH 计,美国DENVER 仪器公司;C1000 Touch PCR 仪,闳龙生物科技(上海)有限公司;Bio Spectrum 凝胶成像仪,美国UVP 公司;多功能酶标仪,美国赛默飞世尔科技公司;CFX96 Touch荧光定量PCR 仪,美国伯乐公司;BG-Power 300型电泳仪,上海洪纪仪器设备有限公司;牛津杯(10 mm×7.8 mm×6 mm),广州标迈生物科技有限公司;TGL-20M 低温离心机,邢台润联科技开发有限公司;SPX-150B 生化培养箱,杭州聚莱仪器有限公司;LDZX-75KB 立式压力灭菌器,济南鑫贝西生物技术有限公司;Supra 22K 大容量高速冷冻离心机,北京中仪远大科技有限公司;涡旋振荡器,上海鼎科科技有限公司。
1.3 试验方法
1.3.1 不同酸胁迫条件下粪肠球菌Gr17 的培养将储存在-80 ℃超低温冰箱中的菌株(1 mL)接种到装有50 mL 种子培养基的500 mL 锥形烧杯中,在振荡器中以180 r/min 速度37 ℃培养24 h。
将种子液接种到装有3 L 发酵培养基的发酵罐中,接种量为10%,起始速度为350 r/min,通气率为3.0 L/min。手动调节搅拌转速 (300~900 r/min)将溶氧水平控制在30%以上,使用梅特勒电极监测pH 值,并且添加3 mol/L HCl 溶液或3 mol/L NaOH 将溶液pH 值调至4.0,4.5,5.0,5.5,6.0,6.5,以pH 7.0 的正常状态为对照,在37℃下培养28 h,得粪肠球菌Gr17 发酵液。
1.3.2 可正向调控细菌素合成的最佳酸胁迫条件筛选 测定不同酸胁迫条件对菌株Gr17 生长的影响。分别取200 μL 不同酸胁迫条件下培养的粪肠球菌Gr17 发酵液至96 孔细胞培养板中,用酶标仪测定其在波长600 nm 处的吸光值。
测定不同酸胁迫条件下细菌素enterocin Gr17 的效价。将1.3.1 节中获得的粪肠球菌Gr17发酵肉汤以8 000 r/min 的转速在4 ℃下离心20 min,提取上清液,用2.5 mol/L NaOH 调节pH 值至7.0,并用0.22 μm 过滤器过滤。将80%硫酸铵溶液添加到上清液中,置4 ℃冰箱中过夜沉淀。以10 000 r/min、4 ℃离心10 min,收集沉淀物。将沉淀物重新溶解在0.02 mol/L 磷酸盐溶液(pH 7.0)中,即不同酸胁迫条件下细菌素enterocin Gr17 粗提液。
取不同酸胁迫和正常条件下的细菌素enterocin Gr17 粗提液,参照抗生素效价测定方法--管碟法[20]测定其对指示菌大肠杆菌1.90 的效价(AU/mL),代表enterocin Gr17 的分泌情况。与正常条件为对照,以增加enterocin Gr17 效价最显著的酸胁迫条件为可正向调控细菌素合成的最佳酸胁迫条件。
1.3.3 最佳酸胁迫条件下粪肠球菌Gr17 菌体生长代谢及细菌素分泌情况 通过比较最佳酸胁迫条件下和粪肠球菌Gr17 在不同发酵时间菌体生长代谢及细菌素分泌情况,探究酸胁迫对菌株Gr17 合成细菌素在表观水平上的影响程度。
1.3.3.1 最佳酸胁迫条件下粪肠球菌Gr17 菌体生长代谢情况 分别取200 μL 不同发酵时期的粪肠球菌Gr17 发酵液至96 孔细胞培养板中,用酶标仪测定其在600 nm 处的吸光值。
1.3.3.2 最佳酸胁迫条件下粪肠球菌Gr17 细菌素分泌情况 参照1.3.2 节方法,测定不同发酵时期细菌素enterocin Gr17 的效价,代表enterocin Gr17 的分泌情况。
1.3.4 最佳酸胁迫下细菌素合成相关基因转录水平变化 在1.3.2 节确定的最佳酸胁迫条件下,采用RT-qPCR 技术研究不同发酵时期菌株Gr17 所分泌细菌素编码的结构基因(entGr17);细菌素调控相关的双组分系统的基因(entPK、entR),调节该系统的信号分子自诱导肽基因(entIP);转运自诱导肽AIP 的ABC 转运系统基因[6](as-48E、as-48F、as-48G、as-48H) 的差异表达情况及变化规律,从分子水平全面揭示细菌素enterocin Gr17 在实际发酵环境中的合成调控行为。
1.3.4.1 粪肠球菌Gr17 总RNA 提取 每4 h 取酸胁迫和正常条件(pH 7.0)下的发酵液,10 000 r/min 离心获得细菌细胞。使用RNAprep 纯多糖多酚植物总RNA 提取试剂盒,按照说明操作从粪肠球菌Gr17 中提取总RNA,并将其储存在-80 ℃下。
1.3.4.2 反转录RNA 使用Tiangen FastQuant cDNA 的第一个链合成组,具体操作方法:1)融化RNA 模板,5×gDNA 缓冲液、FQ-RT 引物混合物、10×快速RT 缓冲液、冰上无RNase 的ddH2O,涡旋并在使用前短暂混合每种溶液。2)将2 μL 5×gDNA 缓冲液、50 ng 总RNA 和无RNase 的ddH2O制成10 μL 混合溶液并充分混匀,然后42 ℃孵育3 min,置于冰上。3)将2 μL 10×快速RT 缓冲液、1 μ LRT 酶混合物,2 μL FQ-RT 引物混合物和5 μL 不含RNase 的ddH2O 充分混合。4)混合步骤2和步骤3 中获得的液体混合物,42 ℃孵育15 min后在95 ℃孵育3 min,然后置于冰上以获得cDNA。
1.3.4.3 RT-qPCR 分析 以粪肠球菌Gr17 基因entGr17、entIP、entPK、entR、as-48H、as-48G、as-48F、as-48E 为检测目标,16s RNA 作为内参基因,通过Primers Blast 软件设计引物,引物序列见表1。RT-qPCR 使用天根生化科技(北京)有限公司的增强定量荧光SuperReal 阵列(SYBR Green)预混合试剂(SYBR Green)。设计并放大了反应体系,具体操作方法如下:
表1 RT-qPCR 引物
Table 1 Primers uesd for RT-qPCR

?
表2 RT-qPCR 反应体系
Table 2 RT-qPCR reaction system

?
实时PCR 反应条件:采用两步法PCR 反应程序进行反应,即:95.0 ℃变性2 min,94.0 ℃扩增20 s,63.0 ℃退火45 s,40 个循环,60.0 ℃延伸5 min。以16s RNA 为内参基因,以对应空白试验组作为对照,采用2-ΔΔCt 法进行相对定量计算。
2 结果与分析
2.1 可正向调控细菌素合成的最佳酸胁迫条件
粪肠球菌Gr17 在弱酸性条件下生长良好,在强酸性条件下生长受到抑制,enterocin Gr17 的抑菌活性与菌体密度的变化趋势一致。如图1所示,弱酸性条件 (pH 5.0,5.5,6.0,6.5) 下粪肠球菌Gr17 的菌体密度显著高于正常条件(pH 7.0);强酸性条件(pH 4.0,4.5)下粪肠球菌Gr17 的菌体密度显著低于正常条件。enterocin Gr17 的抑菌活性与菌体密度的变化成正比,当pH 值为5.5 时,粪肠球菌Gr17 的菌体密度和enterocin Gr17 的抑菌活性达到最高,抑菌活性是正常条件下的150%;当pH 值在4.0~5.5 之间时,粪肠球菌Gr17的菌体密度和enterocin Gr17 的抑菌活性随pH的增加而上升;当pH 值在5.5~7.0 之间时,enterocin Gr17 的抑菌活性随pH 值的增加而下降。上述结果表明,弱酸胁迫可使粪肠球菌Gr17 过量代谢合成enterocin Gr17,在pH 5.5 的酸胁迫条件下提高enterocin Gr17 抑菌活性的效果最显著。
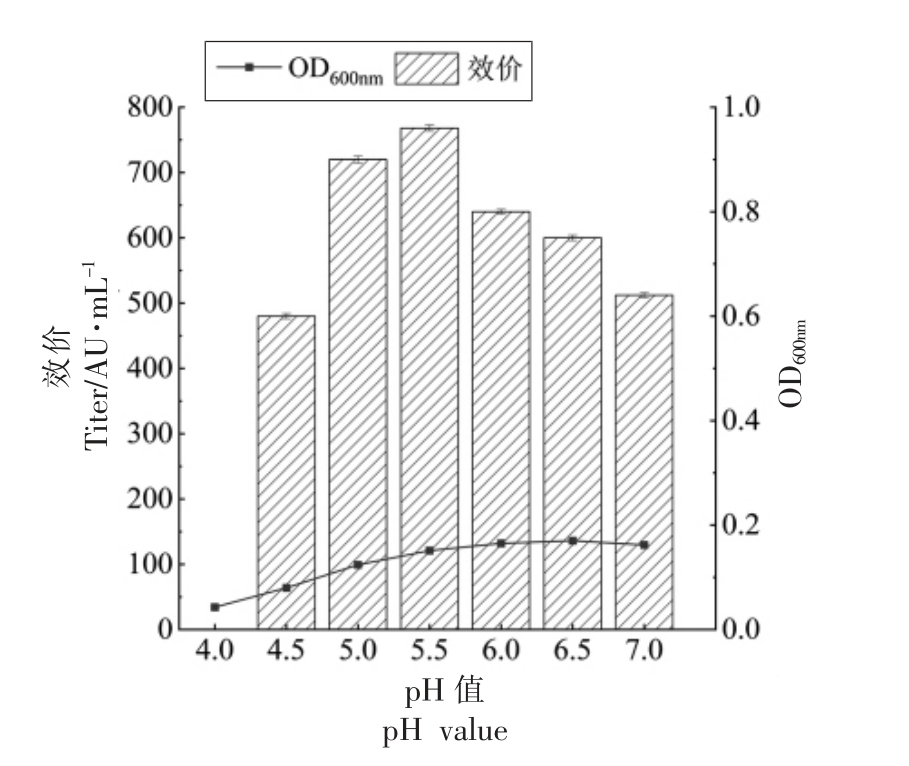
图1 不同pH 条件下粪肠球菌Gr17 的菌体密度与抑菌活性
Fig.1 Cell density and antibacterial activity of Enterococcus faecalis Gr17 under different pH conditions
2.2 最佳酸胁迫条件下粪肠球菌Gr17 菌体生长代谢情况
比较pH 5.5 的弱酸胁迫条件与正常条件下,粪肠球菌Gr17 的菌体密度与抑菌活性随时间的变化情况。如图2所示,0~4 h 时,pH 5.5 的酸胁迫下粪肠球菌Gr17 的菌体密度低于正常条件;4~8 h 时,pH 5.5 的酸胁迫条件下粪肠球菌Gr17 的菌体密度略高于正常条件;12~40 h 时,pH 5.5 的酸胁迫下粪肠球菌Gr17 的菌体密度远低于正常条件。上述结果表明,弱酸胁迫有利于粪肠球菌Gr17 在延滞期适应发酵环境,从而快速繁殖。在稳定期弱酸胁迫显著抑制其生长,这可能是后期粪肠球菌所产有机酸抑制自身生长的缘故。
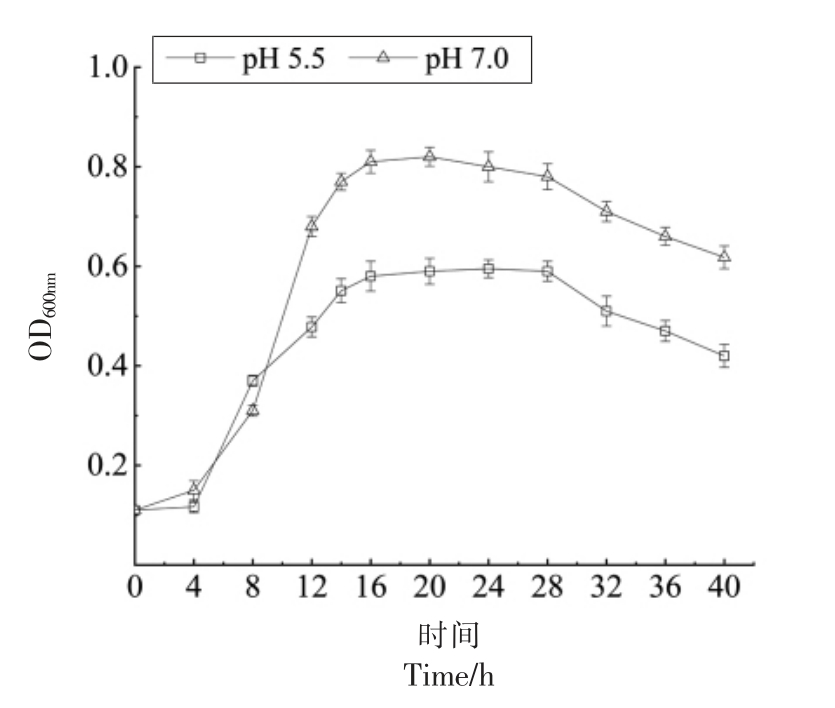
图2 pH 5.5 与pH 7.0 下粪肠球菌Gr17 的生长曲线
Fig.2 Growth curve of Enterococcus faecalis Gr17 at pH 5.5 and pH 7.0
2.3 最佳酸胁迫条件下粪肠球菌Gr17 细菌素分泌情况
比较pH 5.5 的酸胁迫与正常条件下,粪肠球菌Gr17 的抑菌活性随时间的变化情况。如图3所示,粪肠球菌Gr17 在两种条件下均从8 h 开始合成enterocin Gr17,分别在28 h 和32 h 开始降解enterocin Gr17。两种条件下到达抑菌活性最大峰值的时间有所不同,正常条件下,enterocin Gr17的合成量在24 h 达到峰值。pH 5.5 的酸胁迫条件下,enterocin Gr17 的合成量在28 h 达到峰值。虽然pH 5.5 的酸胁迫条件下enterocin Gr17 到达最大合成量的时间有所延迟,但是各时间点enterocin Gr17 合成量均比在正常条件下有明显提高。
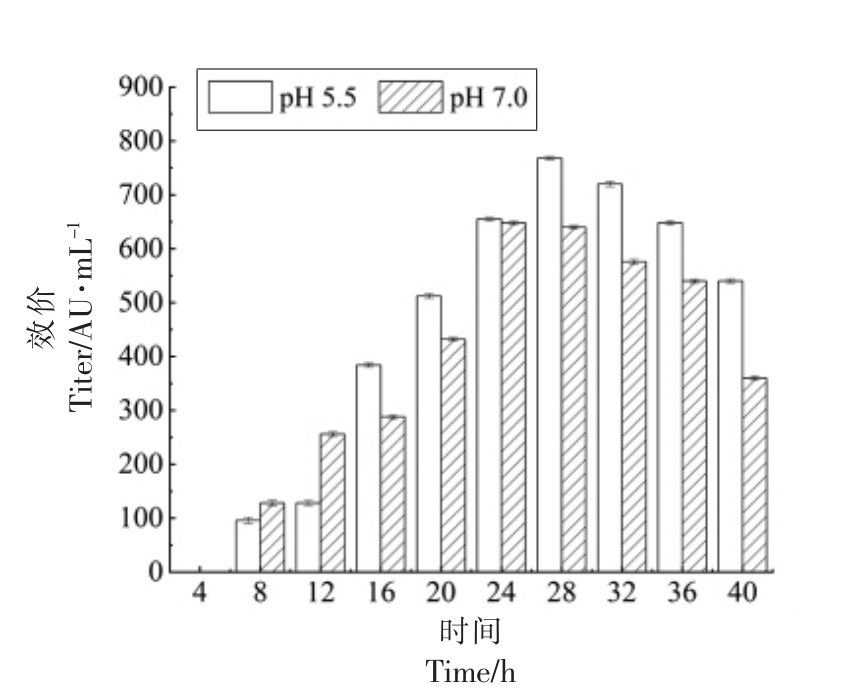
图3 pH 5.5 与pH 7.0 下粪肠球菌Gr17 的抑菌活性
Fig.3 Antibacterial activity of Enterococcus faecalis Gr17 at pH 5.5 and pH 7.0
2.4 最佳酸胁迫下细菌素合成相关基因转录水平
2.4.1 细菌素编码基因转录水平 如图4所示,细菌素编码基因(entGr17)的相对表达的变化方向对应于生长曲线和抗菌活性的变化方向。4~8 h时,pH 5.5 的酸胁迫条件与正常条件下entGr17基因的相对表达量相近;12~36 h 时,pH 5.5 的酸胁迫条件下entGr17 基因的相对表达量显著高于正常条件;36~40 h 时,entGr17 基因的相对表达量骤然下降,这与36~40 h 时enterocin Gr17 分泌量的下降趋势一致。
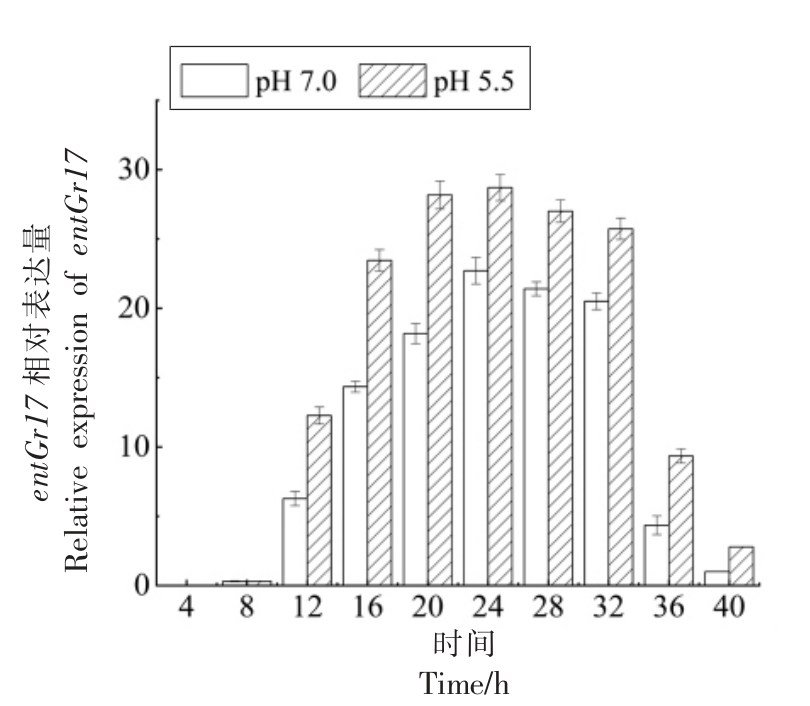
图4 entGr17 相对表达量
Fig.4 Relative expression of entGr17
2.4.2 细菌素调控相关基因转录水平 自诱导肽基因(entIP)和双组分基因(entPK、entR)的相对表达方向对应于生长曲线和抗菌活性的方向。如图5所示,在pH 5.5 的酸胁迫条件下,粪肠球菌Gr17 的entIP 基因的相对表达从8 h 开始急剧增加,在20 h 达到峰值,在36 h 开始有所下降。20~36 h 时,entIP 基因的相对表达量与峰值几乎持平。这表明粪肠球菌在8 h 时开始产生AIP,在20 h 时AIP 的浓度达到最大,并在20~36 h 持续处于高水平,从36 h 开始AIP 浓度下降,仍然高于8 h时的浓度。正常条件下,entIP 基因相对表达量的变化趋势与pH 5.5 的类似,在24 h 达到峰值。比较酸胁迫与正常条件下entIP 基因的相对表达量,发现8~40 h 内pH 5.5 的酸胁迫条件下entIP 基因的相对表达量显著高于正常条件。

图5 entIP 相对表达量
Fig.5 Relative expression of entIP
双组分基因(entPK、entR)相对表达量的变化与entIP 基因一致,不同点在于12 h 时pH 5.5 的酸胁迫条件下entPK、entR 基因的相对表达量才开始高于正常条件,比entIP 基因滞后4 h,且entPK、entR 基因在各个时间点的相对表达量都低于entIP 基因。
2.4.3 细菌素ABC 转运系统转录水平 如图8所示,ABC 转运系统相关基因 (as-48E、as-48F、as-48G、as-48H)的相对表达量整体而言呈先增长后减少的变化趋势,变化程度远小于entGr17、entIP、entPK、entR 基因,结果不显著。对于as-48E、as-48F、as-48G 基因,12~40 h 内pH 5.5 的酸胁迫条件下其相对表达量显著高于正常条件;对于as-48H 基因,16~24 h 内pH 5.5 的酸胁迫条件下其相对表达量显著高于正常条件。

图6 entPK 相对表达量
Fig.6 Relative expression of entPK
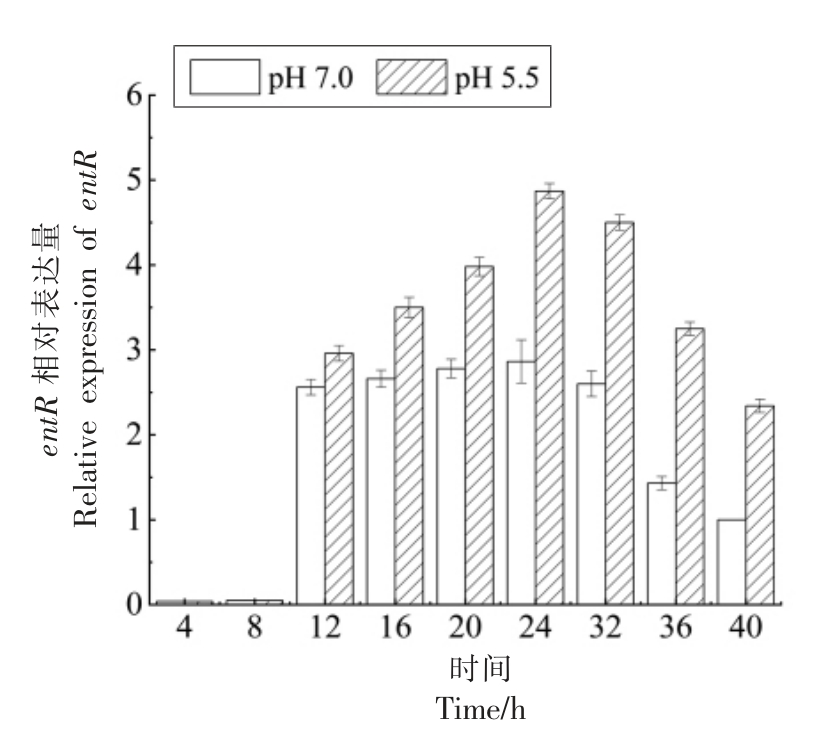
图7 entR 相对表达量
Fig.7 Relative expression of entR
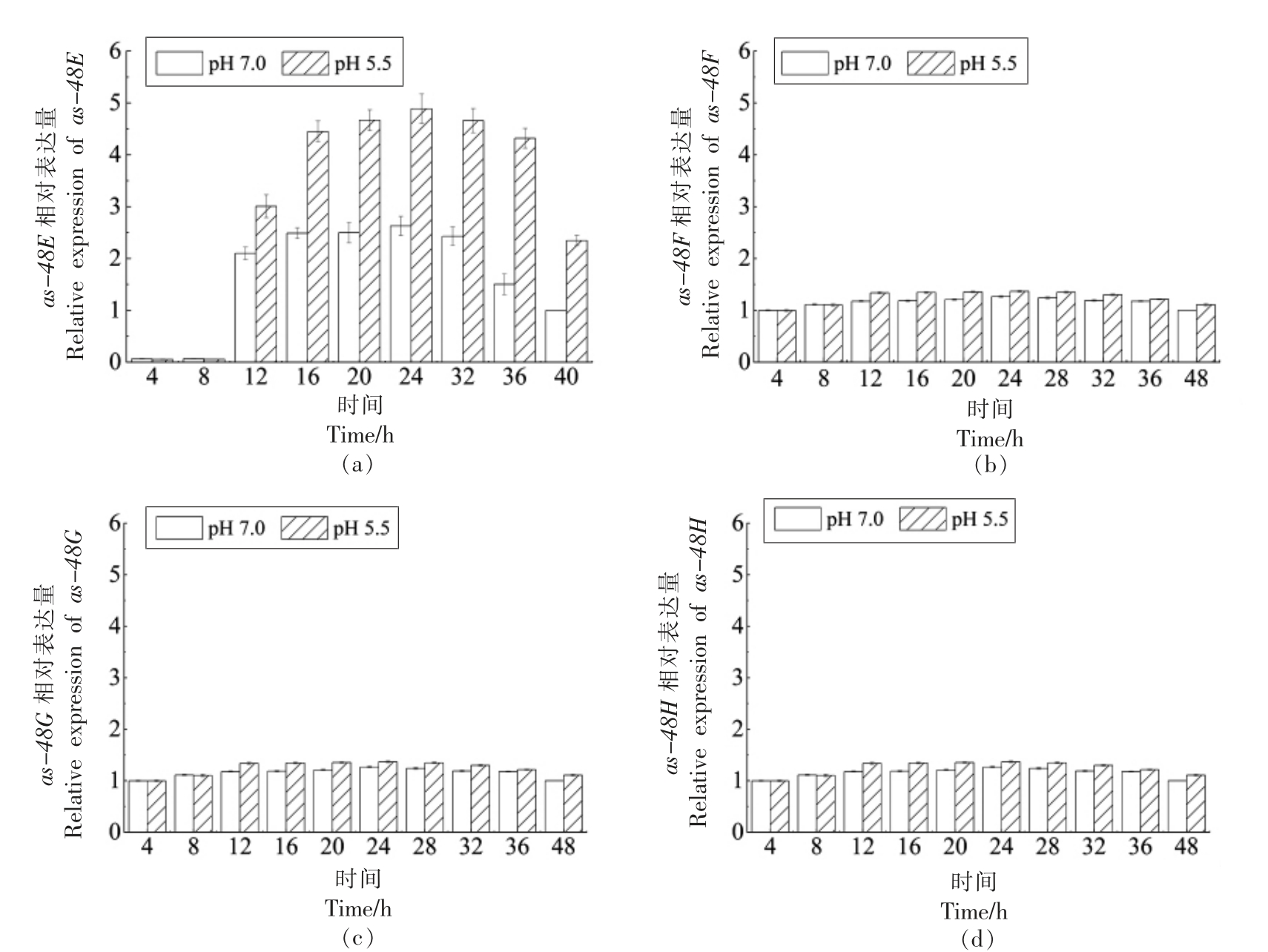
图8 ABC 转运系统相关基因相对表达量
Fig.8 Relative expression of ABC transport system related genes
3 讨论与结论
本研究表明,pH 5.5 的酸胁迫条件使粪肠球菌Gr17 过量代谢合成enterocin Gr17。不论是在酸胁迫条件下,还是在正常条件下,enterocin Gr17的合成量都呈现出菌体密度依赖性,这是enterocin Gr17 合成受种内群体感应系统调控的表观体现。pH 5.5 的酸胁迫条件下,粪肠球菌Gr17 的菌体密度小于正常条件,这不利于其产生细菌素,然而细菌素enterocin Gr17 的产量却在此条件下更高。为此,对pH 5.5 的酸胁迫条件与正常条件下与enterocin Gr17 代谢合成的相关基因进行转录水平比较,发现pH 5.5 的酸胁迫条件较正常条件,细菌素结构基因(entGr17)的相对表达量在12~40 h 显著增加,与抑菌活性的变化趋势一致;自诱导肽基因(entIP)的相对表达量在8~40 h 显著增加;双组分基因(entPK、entR)的相对表达量在12~40 h 显著增加;ABC 转运系统相关基因(as-48E、as-48F、as-48G)的相对表达量在12~40 h 增加,ABC 转运系统相关基因(as-48H)在16~40 h 增加。上述结果表明,酸胁迫通过影响种内三组分群体感应系统,进而影响粪肠球菌Gr17 代谢合成enterocin Gr17。
种内群体感应系统在乳酸菌代谢产细菌素中发挥调控作用的过程[4]可分为以下几步:1)乳酸菌合成前体信号分子,然后修饰其成为成熟的自诱导肽AIP[21],AIP 无法自行分泌到胞外,需借助ABC 转运系统或其它膜通道蛋白[22];2)当细菌大量繁殖,种群密度不断增加使胞外的信号分子AIP 大量积累,达到阈值;3)AIP 激活位于细菌细胞膜上的双组分系统[23],通过磷酸化的方式将种内群体感应信号传递给下游靶基因,并调控相应靶基因的表达。相应的,RT-qPCR 试验结果表明,弱酸胁迫与正常条件中的粪肠球菌Gr17 相比,自诱导肽基因(entGr17)转录水平率先增高,弱酸胁迫使粪肠球菌Gr17 更早地合成AIP;ABC 转运系统相关基因 (as-48E、as-48F、as-48G、as-48H)和双组分基因 (entPK、entR) 的相对表达量随后增高,然而ABC 转运系统相关基因的转录水平的增加量小于双组分基因的增加量,一方面可能是由于粪肠球菌Gr17 依赖其它膜通道蛋白转运AIP,另一方面由于这些蛋白质活性位点的氨基酸通常含有可电离基团,外部pH 值可能会影响蛋白质的活性和亲和力[24]。同时,收到传递信号的细菌素结构基因(entGr17)的转录水平也明显增强。
乳酸菌双组分系统和LuxS/AI-2 介导的种群之间(种间)群体感应系统,即种间信息交流机制,对乳酸菌的耐酸性有影响。Azcarate-Peril 等[25]构建缺失HPK 突变株,发现嗜酸乳杆菌NCFM 的耐酸性明显下降,并且该过程中LuxS 基因的表达水平上调。Moslehi-Jenabian 等[26]在pH 3.0,4.0,5.0,6.5(作为对照)条件下,分别对鼠李糖乳杆菌(Lactobacillus rhamnosus,LGG)和嗜酸乳杆菌(Lactobacillus acidophilus,NCFM)进行酸性休克试验,测定了AI-2 活性和LuxS 基因的转录水平。AI-2活性随pH 值的降低而增加,而菌株适应酸性环境后AI-2 的活性下降。LuxS 基因转录水平的变化与AI-2 一致,酸适应能减弱LuxS 基因的转录。或许,酸胁迫也影响粪肠球菌Gr17 由LuxS/AI-2介导的种间群体感应系统,甚至该系统与细菌素的增产有密切关系。
本课题组接下来会构建种内信号分子entIP基因缺失突变株,并针对弱酸胁迫下LuxS/AI-2介导的种间群体感应系统对细菌素enterocin Gr17 代谢合成的影响展开研究,探究种内或种间群体感应调控系统在细菌素enterocin Gr17 合成中的调控效应。
[1]NETTLES C G,BAREFOOT S F.Biochemical and genetic characteristics of bacteriocins of food-associated lactic acid bacteria[J].J Food Prot,1993,56(4):338-356.
[2]PENA J A,ROGERS A B,GE Z,et al.Probiotic Lactobacillus spp.diminish Helicobacter hepaticusinduced inflammatory bowel disease in interleukin-10-deficient mice[J].Infect Immun,2005,73(2):912-920.
[3]LIU G R,WANG Y,LI X,et al.Genetic and biochemical evidence that Enterococcus faecalis Gr17 produces a novel and sec-dependent bacteriocin,enterocin Gr17[J].Front Microbiol,2019,10:1806.
[4]逄晓阳,朱青,芦晶,等.乳酸菌群体感应系统研究进展[J].生物加工过程,2020,18(2):141-149.
PANG X Y,ZHU Q,LU J,et al.Progress in quorum sensing system of lactic acid bacteria [J].Chinese Journal of Bioprocess Engineering,2020,18(2):141-149.
[5]黄雨霞,武瑞赟,李平兰.群体感应系统调控乳酸菌细菌素合成的研究进展[J].生物加工过程,2019,17(3):251-256.
HUANG Y X,WU R Y,LI P L.Advances in the regulation of bacterial synthesis by quorum sensing system[J].Chinese Journal of Bioprocess Engineering,2019,17(3):251-256.
[6]DIAZ M,VALDIVIA E,MARTINEZ-BUENO M,et al.Characterization of a new operon,as-48EFGH,from the as-48 gene cluster involved in immunity to enterocin AS-48[J].Appl Environ Microbiol,2003,69(2):1229-1236.
[7]TRIPATHI M K,GIRI S K.Probiotic functional foods:Survival of probiotics during processing and storage[J].Journal of Functional Foods,2014,9:225-241.
[8]NICOLAOU S A,GAIDA S M,PAPOUTSAKIS E T.A comparative view of metabolite and substrate stress and tolerance in microbial bioprocessing:From biofuels and chemicals,to biocatalysis and bioremediation[J].Metab Eng,2010,12(4):307-331.
[9]LUND P,TRAMONTI A,DE BIASE D.Coping with low pH:Molecular strategies in neutralopH ilic bacteria[J].FEMS Microbiol Rev,2014,38 (6):1091-1125.
[10]WU C D,HUANG J,ZHOU R Q.Progress in engineering acid stress resistance of lactic acid bacteria[J].Appl Microbiol Biotechnol,2014,98 (3):1055-1063.
[11]林松洋,郝利民,刘鑫,等.乳酸菌耐盐分子机制研究进展[J].食品科学,2018,39(3):295-301.
LIN S Y,HAO L M,LIU X,et al.Progress in molecular mechanism of salt tolerance in lactic acid bacteria[J].Food Science,2018,39(3):295-301.
[12]ABDEL-BANAT B M,HOSHIDA H,ANO A,et al.High-temperature fermentation:How can processes for ethanol production at high temperatures become superior to the traditional process using mesopH ilic yeast?[J].Appl Microbiol Biotechnol,2010,85(4):861-867.
[13]PORTELA C A,SMART K F,TUMANOV S,et al.Global metabolic response of Enterococcus faecalis to oxygen[J].J Bacteriol,2014,196(11):2012-2022.
[14]HU X H,WANG M H,TAN T,et al.Genetic dissection of ethanol tolerance in the budding yeast Saccharomyces cerevisiae[J].Genetics,2007,175(3):1479-1487.
[15]JAWAN R,ABBASILIASI S,TAN J S,et al.Influence of culture conditions and medium compositions on the production of bacteriocin-like inhibitory substances by Lactococcus lactis Gh1[J].Microorganisms,2020,8(10):1454.
[16]吕嘉枥,伍金金,周冰洋,等.酸和盐胁迫对乳酸菌活性的影响[J].中国酿造,2020,39(10):90-95.
LÜ J L,WU J J,ZHOU B Y,et al.Effect of acid and salt stress on lactic acid bacteria growth[J].China Brewing,2020,39(10):90-95.
[17]顾悦.环境胁迫及酵母菌对乳酸菌LuxS/AI-2 群体感应系统的影响[D].呼和浩特:内蒙古农业大学,2017.
GU Y.The effects of environmental stresses and yeast on LuxS/AI-2 quorum sensing system of lactic acid bacteria[D].Hohhot:Inner Mongolia Agricultural University,2017.
[18]王大慧,徐若烊,黎德超,等.酸胁迫对S-腺苷甲硫氨酸和谷胱甘肽生物合成的影响及其生理机制[J].食品科学,2020,41(10):61-67.
WANG D H,XU R Y,LI D C,et al.Effect of acid stress on the biosynthesis of S-adenosylmethionine and glutathione and the underlying physiological mechanism[J].Food Science,2020,41 (10):61-67.
[19]董颖颖,卫功元,张君丽,等.谷胱甘肽生物合成过程中酸胁迫的作用及其机制[J].化工学报,2011,62(11):3228-3235.
DONG Y Y,WEI G Y,ZHANG J L,et al.Mechanism and effect of acid stress on glutathione biosynthesis by Candida utilis[J].Journal of Chemical Industry and Engineering (China),2011,62(11):3228-3235.
[20]中国药品生物制品检定所.中国药品检验标准操作规范[M].北京:中国医药科技出版社,2001:287-301.
China Institute for the Control of Pharmaceutical and Biological Products.China standard practice for drug testing[M].Beijing:China Pharmaceutical Science and Technology Press,2001:287-301.
[21]DI CAGNO R,DE ANGELIS M,CALASSO M,et al.Proteomics of the bacterial cross-talk by quorum sensing[J].J Proteomics,2011,74(1):19-34.
[22]LUBKOWICZ D,HO C L,HWANG I Y,et al.Reprogramming probiotic Lactobacillus reuteri as a biosensor for StapH ylococcus aureus derived AIP-I detection[J].ACS Synth Biol,2018,7(5):1229-1237.
[23]STURME M,FRANCKE C,SIEZEN R J,et al.Making sense of quorum sensing in lactobacilli:A special focus on Lactobacillus plantarum WCFS1[J].Microbiology (Reading),2007,153(Pt 12):3939-3947.
[24]POOLMAN B,DRIESSEN A J,KONINGS W N.Regulation of solute transport in streptococci by external and internal pH values[J].Microbiol Rev,1987,51(4):498-508.
[25]AZCARATE-PERIL M A,MCAULIFFE O,ALTERMANN E,et al.Microarray analysis of a twocomponent regulatory system involved in acid resistance and proteolytic activity in Lactobacillus acidophilus[J].Appl Environ Microbiol,2005,71(10):5794-5804.
[26]MOSLEHI-JENABIAN S,GORI K,JESPERSEN L.AI-2 signalling is induced by acidic shock in probiotic strains of Lactobacillus spp.[J].Int J Food Microbiol,2009,135(3):295-302.