大豆种皮多糖是从大豆加工副产物(大豆种皮) 中分离提取的一种富含同聚半乳糖醛酸和Ⅰ型鼠李半乳糖醛酸的果胶类多糖。它以半乳糖醛酸、阿拉伯糖、甘露糖和半乳糖为主,分子质量范围为104~106 u[1]。Wang 等[2]研究发现Na+和Mg2+可诱导大豆种皮多糖凝胶形成,且温度越高其凝胶结构越稳定。大豆种皮多糖具有良好的乳化性和凝胶性[3-4],被应用到食品、化妆品及医药等领域。
Zuo 等[5]研究发现,红松叶多糖经乙醇分级沉淀后,单糖组成的类型、主要官能团及抗氧化活性不变,而其单糖组成的物质的量比有显著差异,且随乙醇浓度的增加,多糖相对分子质量显著降低。Chou 等[6]通过乙醇分级沉淀美洲楠多糖,结果发现经60%乙醇沉淀的楠多糖组分具有较好的吸湿性;此外,80%乙醇沉淀的楠多糖组分的β-葡聚糖、蛋白质及糖醛酸含量均较低,抗氧化能力较强。Jia 等[7]探究不同浓度梯度乙醇分级沉淀对玉米丝多糖理化性质和生物活性的影响时发现,80%乙醇沉淀的多糖组分的抗氧化活性最高。Guan 等[8]发现可以利用硫酸铵分级沉淀不同分子质量的半纤维素,低浓度硫酸铵可沉淀出更多线性、分子质量高的半纤维素,而高浓度硫酸铵分级沉淀的半纤维素具有支链更多且分子质量低的特点。此外,经较低浓度硫酸铵分级沉淀的鱼鳞明胶具有更高的分子质量、更强的氢键、更多的三螺旋结构、更致密的微观结构和更高的凝胶强度等特点[9]。Shi 等[10]研究发现,经硫酸铵分级的芦荟多糖是一类具有高度乙酰化的葡甘露聚糖,且随硫酸铵浓度的增加,芦荟多糖的重均分子质量从339 ku 降到67.6 ku。研究发现不同提取剂对提取的多糖组成、分子链构象及特性有显著影响,常用的提取剂有乙醇、草酸铵、硫酸铵等[1,11]。
本研究采用硫酸铵法分级大豆种皮多糖组分,探究分级组分的理化性质、微观结构、热稳定性及流变学特性等性质,旨在探寻不同特性多糖组分,并为硫酸铵法提取大豆种皮多糖提供理论依据。
1 材料与方法
1.1 材料、试剂与设备
大豆种皮(黑河43)购于辽宁锦州大豆皮经销公司(蛋白质12%,纤维34%和水14%)。硫酸铵及盐酸等其它试剂均为分析纯级,国药集团化学试剂有限公司。
JA21002 型精密电子天平,上海舜宇恒平科学仪器;800A 粉碎机,永康市红太阳机电有限公司;PHS-25 型pH 计,上海雷磁仪器有限公司;RE-3000 旋转蒸发仪,上海亚荣生化仪器厂;TD5A-WS 型低速离心机,湘仪离心机仪器有限公司;IRTracer-100 傅里叶变换红外光谱仪、UV-2550 紫外-可见分光光度计,日本岛津公司;S-4800 冷场发射扫描电镜,日本Hitachi 公司;XE-70 原子力显微镜,韩国Park Systems 公司;PYRIS DIAMOND TG/DTA 热分析仪,美国PE 公司;Rigaku Ultima IV X 射线散射仪,日本理学公司;Discovery HR-1 流变仪,美国TA 公司。
1.2 试验方法
1.2.1 大豆种皮多糖的提取 将大豆种皮粉碎并过筛(60 目)后,与体积分数80%乙醇溶液按1∶8(料液比)混合,搅拌24 h。在4 800 r/min 条件下离心10 min。收集沉淀物并通风干燥过夜,然后按照料液比1∶20 加入去离子水,在80 ℃水浴磁力搅拌2 h。待冷却后过滤,该提取过程重复两次。合并提取两次的滤液,在65 ℃下旋转蒸发至原体积的2/3,缓慢加入3 倍体积的95%乙醇使其醇沉,在室温下放置12 h,于65 ℃恒温干燥箱烘干[10],得到水提大豆种皮粗多糖 (Water extraction of soy hull polysaccharide,WSHP)。
1.2.2 大豆种皮多糖的硫酸铵分级沉淀 配制2%的WSHP 水溶液,在5 000 r/min 条件下离心20 min。在上清液中缓慢加入硫酸铵,待上清液中硫酸铵质量浓度达到40 mg/mL 静置12 h 后在同样离心条件下再次离心。收集沉淀物并进行透析(Mw<3 500 u)3 d。并用丙酮和无水乙醚混合液(v 丙酮∶v 无水乙醚=1∶4) 洗涤沉淀物。得到40 mg/mL硫酸铵分级沉淀的大豆种皮多糖后(ASHP40),采用同样的方法得到60 mg/mL 硫酸铵分级沉淀的大豆种皮多糖(ASHP60)[10]。
1.2.3 多糖及蛋白含量测定 采用苯酚-硫酸法测定样品的总糖含量[12],以葡萄糖为标品,在波长490 nm 处测定吸光度。
采用BCA 蛋白浓度试剂盒比色法测定样品的蛋白质含量[13],在波长562 nm 处测定吸光度。
1.2.4 相对分子质量 采用高效凝胶渗透色谱法测定WSHP、ASHP40 和ASHP60 的相对分子质量。将20 mg WSHP、ASHP40 和ASHP60 分别溶解于2 mL 0.1 mol/L NaNO3 溶液中,并在15 000 r/min 离心10 min。将20 μL 样品过0.22 μm 滤膜,并注入300 mm×7.8 mm×2 mm 的 UltrahydrogelTM Linear 柱,流速为0.9 mL/min,柱温保持45 ℃,利用DextranT 系列标准品(1.338×105,4.11×104,2.5×103,1×103 u)建立标准曲线[14]。
1.2.5 单糖组成 利用高效离子色谱(Carbopac PA20 column,150 mm ×3 mm) 分析 WSHP、ASHP40 和ASHP60 的单糖组成[15]。将5 mg 多糖样品分别溶解于10 mL 的4 mol/L 三氟乙酸,于100~110 ℃水解6 h,多次添加甲醇并利用旋转蒸发仪去除,氮吹仪吹干后,用去离子水稀释20 倍。
1.2.6 傅里叶变换红外光谱(FT-IR) 利用压片机 将WSHP、ASHP40 和ASHP60 分别与KBr 压片,扫描范围为400~4 000 cm-1[14]。
1.2.7 扫描电镜 (SEM) 取粉碎后的WSHP、ASHP40 和ASHP60 样品各1 mg,喷金15 min,在0.5~30 kV 下放大400 倍、10 000 倍观察多糖样品的微观结构。
1.2.8 原子力显微镜(AFM) 将WSHP、ASHP40和ASHP60 样品溶解于去离子水,配制成5 mg/mL溶液。取5 μL 多糖于云母片上,待干燥后,利用原子力显微镜观察多糖的分子构象(5 μm×5 μm)[16]。
1.2.9 热分析(TG) 将一定量的WSHP、ASHP40和ASHP60 放入坩埚中,在氮气流速为50 mL/min的环境下,升温速率为10 ℃/min 条件下,检测样品在25~800 ℃范围内的失重情况[17]。
1.2.10 流变学特性 将120 mg WSHP,ASHP40和ASHP60 溶解在6 mL 去离子水中,在室温下使用直径40 mm 的平行板,间隙0.5 mm,剪切速率0.1~100 s-1 的条件下测定其流变学特性[11]。
1.2.11 统计分析 所有试验均重复3 次,利用Origin 9.0 软件绘图,采用SPSS 20 软件进行差异显著性分析,显著性检验标准为P<0.05。
2 结果与分析
2.1 总糖、蛋白质含量及相对分子质量
WSHP、ASHP40 和ASHP60 的多糖含量,蛋白质含量和相对分子质量结果见表1。由表1可知,ASHP40 中的总糖含量最高,可达55.67%,其次是ASHP60,总糖含量为38.47%,比WSHP 的多糖含量分别高25.60%和8.4%。硫酸铵分级组分的总糖含量提高,而其蛋白质含量显著降低(P<0.05),且随着硫酸铵质量浓度增加,组分中蛋白质含量也随之降低。此外,WSHP、ASHP40 和ASHP60 的相对分子质量分别为2 031.1,1 140.4 ku 和1 103.3 ku,说明经过硫酸铵分级沉淀后多糖的相对分子质量降低。最后,ASHP40 的Wi 值最高,可达13.82,表明经过40%硫酸铵分级沉淀的大豆种皮多糖组分其多分散性最高。
表1 WSHP、ASHP40 和ASHP60 的相对分子质量、总糖含量和蛋白含量
Table 1 Relative molecular weight,polysaccharide content,protein content of WSHP,ASHP40 and ASHP60
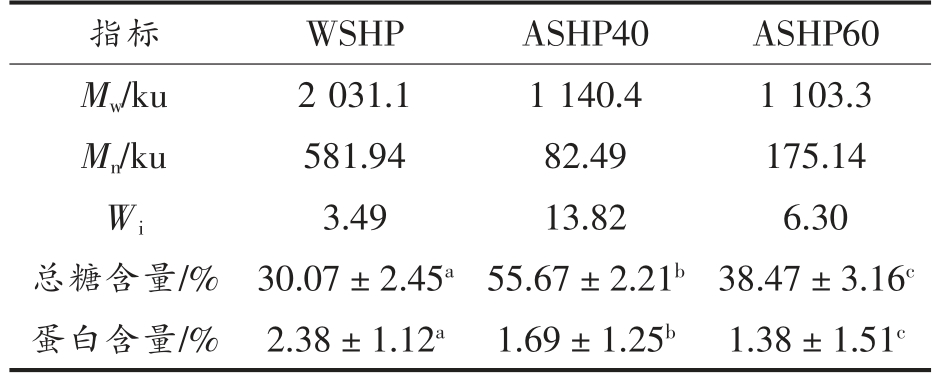
注:Mw 为质均分子质量;Mn 为数均分子质量;Wi=Mw/Mn,代表多分散系数;同一行不同字母代表不同多糖间存在显著性差异,P<0.05。
?
2.2 单糖组成
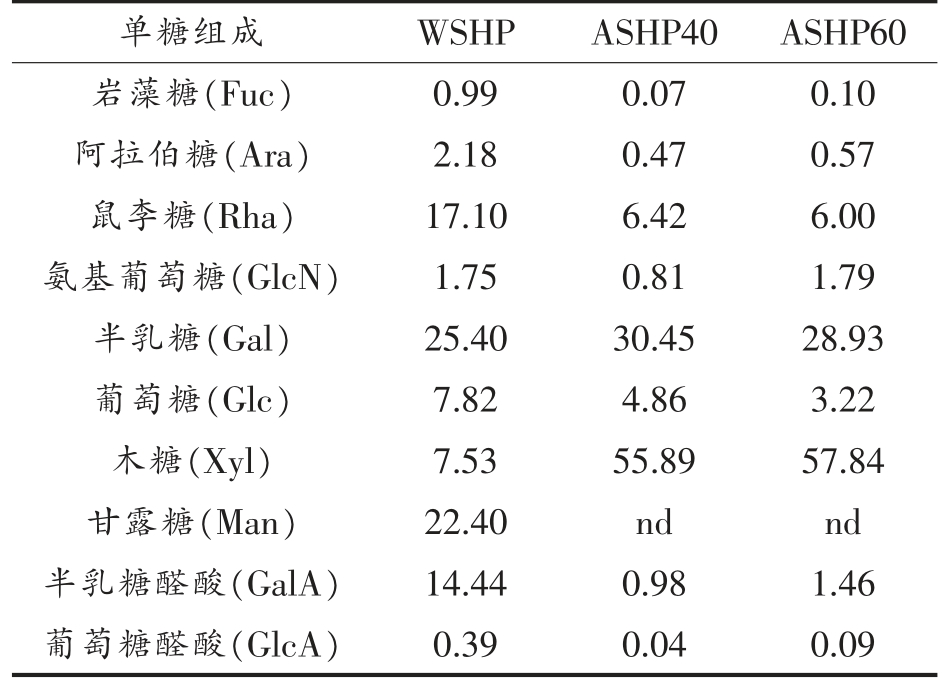
WSHP、ASHP40 和ASHP60 的单糖组成见表2。从表2可知3 种多糖均含有半乳糖、鼠李糖、半乳糖醛酸、阿拉伯糖、岩藻糖、葡萄糖、氨基葡萄糖、葡萄糖醛酸和木糖等9 种单糖组成。WSHP 主要由半乳糖(25.40%),甘露糖(22.40%),鼠李糖(17.10%) 和半乳糖醛酸(14.44%) 组成。然而,ASHP40 和ASHP60 均主要由木糖和半乳糖组成且均不含甘露糖。由此可见,大豆种皮多糖经过硫酸铵分级沉淀后,各多糖组分的单糖组成发生明显变化。ASHP40 和ASHP60 的木糖含量分别比WSHP 高48.36%和50.31%;半乳糖含量分别比WSHP 高5.05%和3.53%;且阿拉伯多糖含量分别比WSHP 低1.71%和1.61%。因此,硫酸铵分级沉淀大豆种皮多糖可能是主要通过改变其单糖组成,进而对其微观结构和性能产生影响。
2.3 结构分析
采用FT-IR 研究3 种多糖组分的结构差异,WSHP、ASHP40 和ASHP60 红外光谱图见图1。由图可知在3 410 cm-1 附近的宽而强的吸收峰归因于O-H 的拉伸振动。此外,从红外光谱图可以看出,ASHPA40 和ASHP60 在3 410 cm-1 附近有朝高频方向移动的趋势,即出现了蓝移现象,这是由于电子受体内部结构的重组[18]。在2 930 cm-1 附近的窄而弱的吸收峰是糖环中含CH,CH2 和CH3 的C-H 的共振引起的[18]。WSHP、ASHPA40 和ASHP60在1 550,1 400 cm-1 和1 320 cm-1 处均有吸收峰,分别是N-H 变角振动,C-O 拉伸振动和O-H 变角振动产 生的[15]。然而,ASHP40 和ASHP60 在1 320 cm-1 处有红移现象的出现,这是多糖分子形成氢键缔合后,电偶极距增大,逐渐形成分子内部氢键。同时,WSHP、ASHP40 和ASHP60 在1 423,1 143 cm-1 和1 082 cm-1 处的峰值处具有C-O 拉伸振动,这可能是C-O-C 键或-COOH 基的特征吸收峰[19]。此外,从多糖的指纹图谱区域可观察到,WSHP、ASHP40 和ASHP60 的糖环类型均是吡喃糖,且在810 cm-1 处有α-D-半乳糖苷的特征吸收峰。然而,WSHP 在894 cm-1 处有β-D-甘露糖糖苷的特征吸收峰,ASHP40 和ASHP60 在871~875 cm-1 处出现了明显的尖锐的吸收峰,这是α-D-木糖糖苷的特征峰[20]。关于糖苷类型的判断与上述单糖组成结果一致(表2)。总之,WSHP、ASHP40 和ASHP60 是含有羟基、羧基、氨基和醚键的α-D-吡喃半乳糖,而WSHP 与ASHP40 和ASHP60 氢键的形成和单糖糖苷类型的不同可能对多糖分子的微观结构产生影响。
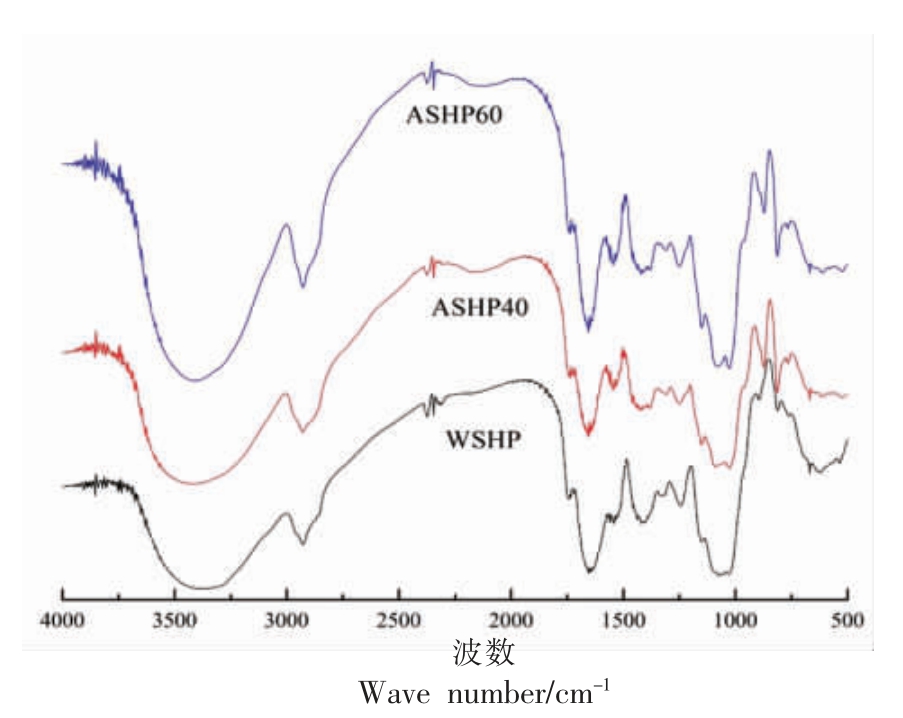
图1 WSHP、ASHP40 和ASHP60 红外光谱图
Fig.1 Infrared spectrum of WSHP,ASHP40 and ASHP60
表2 WSHP、ASHP40 和ASHP60 的单糖组成(%)
Table 2 Monosaccharide composition of WSHP,ASHP40 and ASHP60 (%)
?
2.4 微观结构
为了进一步探究多糖组分的微观结构差异,采用了扫描电镜观察了WSHP、ASHP40 和ASHP60 表面微观结构(见图2)。从图2(a,d)可以观察到,WSHP 呈不规则片状,表面结构致密,略有碎屑。这是可能是由于在热水浸提的过程中,没有引入其它的盐离子等多余物质,对其表面微观结构产生破坏作用较小。然而,从图2(b 和e,c 和f)中可以看出,ASHP40 和ASHP60 均呈不规则块状的形态,ASHP40 表面粗糙且没有可见的网络结构,而ASHP60 具有疏松多孔且清晰的多层网状结构。原因可能是随着硫酸铵质量浓度的增加,多糖中的某些支链与其结合,并在透析脱盐的过程中被除去,从而导致多糖表面微观结构的粗糙程度增加[21]。这与ASHP40 和ASHP60 的相对分子质量低于WSHP 的结果相吻合(表1)。然而,在本研究中,从单糖组成的结果中可以看出 (表2),ASHP40 和ASHP60 的半乳糖和木糖含量均高于WSHP,阿拉伯糖含量低于WSHP,多糖组分中单糖的含量变化也可能对多糖表面粗糙程度产生影响。同样,Peng 等[22]的研究也证明从竹子中分离提取半纤维素的微观结构与其单糖组成密切相关,且研究发现高含量的阿拉伯糖使得半纤维素结构更致密,这是由于阿拉伯糖可以与带电基团形成氢键。此外,还可能是随着硫酸铵质量浓度的增加,导致多糖组分分子内部氢键的增加,使其网络结构逐渐清晰可见,这与前述的FT-IR 的结果可以相互印证(图1)。Hou 等[23]的研究也发现,多糖微观结构的变化主要归因于分子间和分子内部氢键的形成。上述研究结论与本文的研究现象相一致。因此,多糖微观结构的改变与其相对分子质量、单糖组成及官能团是否键合成氢键的变化息息相关。

图2 WSHP、ASHP40 和ASHP60 的扫描电镜图
Fig.2 SEM of WSHP,ASHP40 and ASHP60
2.5 分子链构象
为了深入探究硫酸铵分级对大豆种皮多糖微观结构的影响,本研究采用原子力显微镜表征了多糖分子链构象。质量浓度为5 mg/mL 的WSHP、ASHP40 和ASHP60 在云母片上干燥后所观察到的多糖链构象及形貌如图3所示。图3a 可以观察到WSHP 的多糖构象主要是由规则且表面光滑的球状体组成,其球状体的长度约为220~659 nm,宽度约为293~366 nm,高度约为40~120 nm。ASHP40(图3b)的多糖构象呈现出不规则形态,且表面粗糙度增加。ASHP60 的多糖构象如图3c所示,其表面最粗糙的且形貌类似棉花。这与WSHP、ASHP40 和ASHP60 的扫描电镜结果相一致。此外,在图3b 和c 中可以观察到ASHP40 和ASHP60 的高度分别为20~40 nm 和25~50 nm,均低于WSHP,这可能是由于ASHP40 和ASHP60的半乳糖醛酸含量的降低,羧基或羧基中的氢原子与多糖的氧原子结合形成氢键,使其多糖高度显著增加[24]。Anna 等[25]研究也发现,糖醛酸含量对多糖的构象和聚集有显著影响。

图3 WSHP、ASHP40 和ASHP60 的原子力显微镜图
Fig.3 AFM of WSHP,ASHP40 and ASHP60
2.6 热稳定性
本研究利用热重分析仪分析了WSHP、ASHP40 和ASHP60 的热稳定性。如图4所示,3种多糖在30~800 ℃的温度范围内均有3 个明显的失重阶段,第1 个失重阶段发生在30~200 ℃,失重率约10%左右。这个阶段主要是由于多糖中少量的游离水的蒸发所致[26];其次,第2 个失重阶段是在200~400 ℃,也是最主要的失重阶段,样品的失重率大约60%。主要是多糖中结合水的减少导致[27];最后1 个失重阶段在400~800 ℃,是多糖链碳化裂解产生的,失重率大约在20%。从图4中可以看出,失重率最高的是ASHP60,最低的是WSHP,说明硫酸铵分级的多糖组分热稳定性较差。多糖的热稳定性与其微观表面结构息息相关[28],从扫描电镜(图2)和原子力显微镜(图3)的结果可知,ASHP40 和ASHP60 的结构较为疏松,而WSHP 的表面微观结构更为致密,这是导致WSHP、ASHP40 和ASHP60 热稳定性差异的主要原因。

图4 WSHP、ASHP40 和ASHP60 的热重图
Fig.4 Thermogravimetric of WSHP,ASHP40 and ASHP60
2.7 流变学特性
本研究主要通过界面剪切流变学探究了不同质量浓度的硫酸铵分级大豆种皮多糖组分的流变学特性。如图5所示WSHP、ASHP40 和ASHP60(质量浓度为20 mg/mL)均是假塑性流体[29]。在低剪切速率条件下 (0.1~1 s-1),WSHP、ASHP40 和ASHP60 的表观黏度均随剪切速率的增加而降低,可能是分子间作用力降低,多糖溶液中的网络结构被破坏以及多糖分子向特定方向重新排列,从而产生较小的流动阻力,即出现了剪切稀化现象[30]。同时,当剪切速率接近1 s-1 时,3 种多糖的表观黏度均趋于一致,并且剪切速率的增加对多糖溶液黏度的影响逐渐降低。此外,3 种多糖溶液在不同剪切速率下的黏度变化率不同。在低剪切速率下,多糖溶液的黏度变化快,而在高剪切速率下,溶液黏度的变化慢,这可能是由于多糖分子在低剪切速率的相互作用较大[31]。
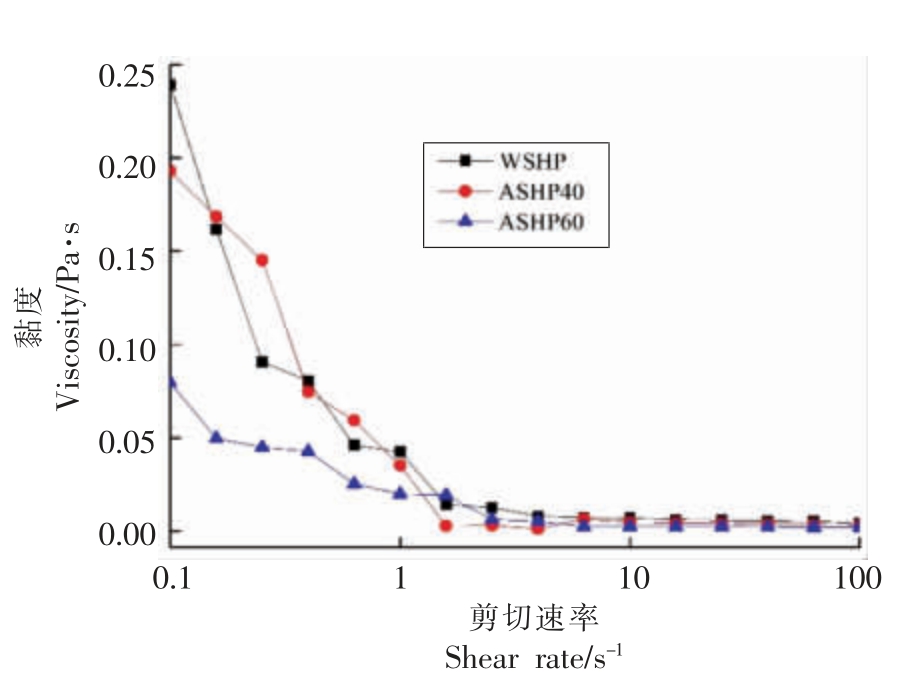
图5 WSHP、ASHP40 和ASHP60 的稳态剪切流变图
Fig.5 Steady shear flow curves of WSHP,ASHP40 and ASHP60
3 结论
本研究对比了WSHP、ASHP40 和ASHP60 的组成成分和表面微观结构,发现WSHP 主要由半乳糖、甘露糖、鼠李糖和半乳糖醛酸等单糖组成,且相对分子质量最大,可达2 031.1 ku,表面微观结构致密。然而,ASHP40 和ASHP60 主要由木糖和半乳糖组成,且相对分子质量较WSHP 低,表面也呈疏松多孔的网络结构,3 种多糖组成成分和微观结构差异显著。进一步地探究了WSHP、ASHP40 和ASHP60 热稳定性和流变学特性,发现硫酸铵分级大豆种皮多糖组分的热稳定性降低,表观黏度低。因此,本研究证实了硫酸铵分级沉淀法分离的大豆种皮多糖组分具有不同的组成成分和微观结构,致使其热稳定性和流变特性差异显著。本研究为深入研究大豆种皮多糖提取方法及其性质的研究提供了一定的理论基础。
[1]张红运.不同提取工艺对大豆种皮多糖结构的影响[D].锦州:渤海大学,2019.
ZHANG H Y.Effects of different extraction processes on the structure of soy hull polysaccharide[D].Jinzhou:Bohai University,2019.
[2]WANG S N,ZHAO L L,LIU H,et al.Impact of Mg2+,K+,and Na+ on rheological properties and chain conformation of soy hull soluble polysaccharide[J].Food Hydrocolloids,2019,92(14):218-227.
[3]赵玲玲,张红运,范宏亮,等.pH,Na+和Ca2+对大豆种皮果胶类多糖乳化稳定性的影响[J].中国粮油学报,2019,34(1):30-36.
ZHAO L L,ZHANG H Y,FAN H L,et al.Effects of pH,Na+ and Ca2+ on the emulsion stability of soybean hull pectic polysaccharide[J].Journal of the Chinese Cereals and Oils Association,2019,34(1):30-36.
[4]刘俊山,李清华,朱丹实,等.柠檬酸及单糖复合钾离子对大豆种皮多糖凝胶性质的影响[J].食品科学,2015,36(1):27-30.
LIU J S,LI Q H,ZHU D S,et al.Combined influence of citric acid,monosaccharide and potassium ion on properties of soybean pectin gel[J].Food Science,2015,36(1):27-30.
[5]ZUO P,YANG X,HUANG W W,et al.Characterization and bioactivity of polysaccharides obtained from pine cones of Pinus koraiensis by graded ethanol precipitation[J].Molecules,2013,18(8):9933-9948.
[6]CHOU C H,SUNG T J,HU Y N,et al.Chemical analysis,moisture-preserving,and antioxidant activities of polysaccharides from Pholiota nameko by fractional precipitation[J].International Journal of Biological Macromolecules,2019,131(6):1021-1031.
[7]JIA Y N,XUE Z H,WANG Y J,et al.Chemical structure and inhibition on α-glucosidase of polysaccharides from corn silk by fractional precipitation[J].Carbohydrate Polymers,2021,252(3):117185.
[8]GUAN Y,ZHANG B,QI X M,et al.Fractionation of bamboo hemicelluloses by graded saturated ammonium sulphate[J].Carbohydrate Polymers,2015,129(18):201-207.
[9]SHA X M,TU Z C,LIU W,et al.Effect of ammonium sulfate fractional precipitation on gel strength and characteristics of gelatin from bighead carp (Hypophthalmichthys nobilis) scale[J].Food Hydrocolloids,2014,36(10):173-180.
[10]SHI X D,NIE S P,YIN J Y,et al.Polysaccharide from leaf skin of,Aloe barbadensis,Miller:Part I.Extraction,fractionation,physicochemical properties and structural characterization [J].Food Hydrocolloids,2017,73(24):176-183.
[11]WANG S N,ZHAO L,LIU H,et al.Rheological properties and chain conformation of soy hull watersoluble polysaccharide fractions obtained by gradient alcohol precipitation[J].Food Hydrocolloids,2019,91(11):34-39.
[12]韩苗苗,高阳,徐多多.杏鲍菇等4 种食用真菌多糖的理化性质及含量的测定[J].食品科技,2013,38(9):157-159.
HAN M M,GAO Y,XU D D.Physicochemical property and content of the polysaccharides from four different edible fungus[J].Food Science and Technology,2013,38(9):157-159.
[13]LUIS R P,PRAZERES D M F,MATEUS M.Impact of plasmid size on the purification of model plasmid DNA vaccines by phenyl membrane adsorbers[J].Journal of Chromatography A,2013,1315(44):145-151.
[14]赵丽.大豆种皮多糖的乳化特性及机制研究[D].锦州:渤海大学,2016.
ZHAO L.Studies on emulsifying properties of soy hull polysaccharide and mechanisms[J].Jinzhou:Bohai University,2016.
[15]ZHU J,CHEN Z,CHEN L,et al.Comparison and structural characterization of polysaccharides from natural and artificial Se-enriched green tea[J].International Journal of Biological Macromolecules,2019,130(6):388-398.
[16]LEUNLSSEN M E,BLAADEREN A,HOLLINGSWORTH A D,et al.Electrostatics at the oil-water interface,stability,and order in emulsions and colloids[J].Proceedings of the National Academy of the Sciences of the United States of America,2006,104(8):2585-2590.
[17]PARHAT R,AYTURSUN A,PAIHEERDING M,et al.Sequential extraction,characterization and antioxidant activity of polysaccharides from Fritillaria pallidiflora Schrenk[J].International Journal of Biological Macromolecules,2019,131(6):97-106.
[18]XU G Y,LIAO A M,HUANG J H,et al.Evaluation of structural,functional,and anti-oxidant potential of differentially extracted polysaccharides from potatoes peels[J].International Journal of Biological Macromolecules,2019,129(5):778-785.
[19]BARKER S A,BOURNE E J,STACEY M,et al.Infrared spectra of carbohydrates.Part I.Some derivatives of D-glucopyranose[J].Journal Chemical Society,1954,1(1):171-176.
[20]XU Q X,SHI J J,ZHANG J G,et al.Thermal,emulsifying and rheological properties of polysaccharides sequentially extracted from Vaccinium bracteatum thunb leaves[J].International Journal of Biological Macromolecules,2016,93(12):1240-1252.
[21]SUN F F,TANG S,LIU R,et al.Biorefining fractionation of the Camellia oleifera Abel.hull into diverse bioproducts with a two-stage organosolv extraction[J].Industrial Crops and Products,2016,94(9):790-799.
[22]PENG H,WANG N,HU Z,et al.Physicochemical characterization of hemicelluloses from bamboo(Phyllostachys pubescens Mazel) stem[J].Industrial Crops and Products,2012,37(1):41-50.
[23]HOU G,CHEN X,LI J,et al.Physicochemical properties,immunostimulatory activity of the Lachnum polysaccharide and polysaccharide-dipeptide conjugates [J].Carbohydrate Polymers,2018,206(4):446-454.
[24]ISRAEL A V,JOSÉ J C P,GEORGINA C D,et al.Microstructural characterization of chitosan and alginate films by microscopy techniques and texture image analysis[J].Carbohydrate Polymers,2012,87(1):289-299.
[25]ANNA A,PETROVA L V,KOZLOVA I Z,et al.AFM analysis reveals polymorphism of purified flax rhamnogalacturonans I of distinct functional types[J].Carbohydrate Polymers,2019,216(14):238-246.
[26]WANG S,HU Y M,BERNARD B U.Pyrolysis mechanisms of typical seaweed polysaccharides [J].Journal of Analytical and Applied Pyrolysis,2017,124(6):373-383.
[27]VANAVIL B,SELVARAJ K,ARUMUGAM M,et al.Bioactive and thermostable sulphated polysaccharide from Sargassum swartzii with drug delivery applications[J].International Journal of Biological Macromolecules,2020,153(6):190-200.
[28]AGNIESZKA N,MONIKA S C,ANTONI M,et al.Effect of dietary fibre polysaccharides on structure and thermal properties of gluten proteins-A study on gluten dough with application of FT-Raman spectroscopy,TGA and DSC[J].Food Hydrocolloids,2017,69(16):410-421.
[29]夏强.超声波降解对大粒车前子多糖流变性质、溶液构象及生物活性的影响[D].南昌:南昌大学,2016.
XIA Q.Effects of ultrasonic depolymerization on the rheological property,solution conformation and bioactivities of polysaccharide isolated from the seeds of Plantago Asiatica L.[J].Nanchang:Nanchang University,2016.
[30]LUO S Z,HU X F,JIA Y J,et al.Camellia oilbased oleogels structuring with tea polyphenol-palmitate particles and citrus pectin by emulsiontemplated method:Preparation,characterization and potential application[J].Food Hydrocolloids,2019,95(19):76-87.
[31]QIAO L,LI Y,CHI Y,et al.Rheological properties,gelling behavior and texture characteristics of polysaccharide from Enteromorpha prolifera[J].Carbohydrate Polymers,2016,136(2):1307-1314.