柑橘皮渣是柑橘加工的副产物,约占全果的40%~50%[1],含有较多的黄酮类化合物。黄酮具有降血糖[2-3]、降血脂[4]、抑菌[5]、抗氧化[6-7]、抗炎等功效,在食品、化妆品、医药工业都有很高的应用价值。很多研究表明,多酚类化合物(包括黄酮类)对蛋白酶[8]、淀粉酶[9]、脂肪酶[10-11]等消化酶活性有抑制作用。通过抑制淀粉酶、α-葡萄糖苷酶的活力来降低淀粉消化速率是多酚类化合物降低餐后血糖的机理之一[2,12]。然而,前期试验发现,柑橘黄酮(用0.05 mmol/L NaOH 溶解后HCl 调pH 值至8.0)对胰淀粉酶有激活作用,且与黄酮加入量呈正相关,而醇溶的柑橘黄酮(减压蒸馏去除酒精)无明显激活作用,推测激活作用可能与黄酮溶解方法有关。考虑到Cl-对唾液淀粉酶有激活作用[13],推测NaCl 可能对胰淀粉酶有激活作用。
为弄清Cl-和柑橘黄酮对胰淀粉酶活性的影响,本试验研究Cl-对胰淀粉酶酶学性质的影响;在有(或无)Cl-基础上研究柑橘黄酮对胰淀粉酶活性及淀粉消化的影响;通过荧光光谱法研究Cl-和柑橘黄酮与胰淀粉酶的作用机制,以期为柑橘黄酮在保健品中的应用提供一定参考。
1 材料与方法
1.1 材料与仪器
柑橘黄酮(黄酮含量≥60%),西安森冉生物工程有限公司;猪胰α-淀粉酶(12 U/mg)和柚皮苷(≥95%),上海源叶生物科技有限公司;其它试剂均为国产分析纯级。
RF-6000 荧光分光光度计,日本岛津公司;FA2104B 型电子天平,上海越平科学仪器有限公司;HH-6 型数显水浴锅,江苏国华电器有限公司;UV2150 紫外-可见分光光度计,尤尼柯(上海)仪器有限公司。
1.2 试验方法
1.2.1 胰淀粉酶酶促反应速度(酶活力)的测定方法 采用DNS 法制作麦芽糖标曲[14]。以麦芽糖含量x(mg)为横坐标,以吸光值y(OD540nm)为纵坐标,绘制标准曲线,所得回归方程为y=0.8067x-0.029,R2=0.9996。
胰淀粉酶酶促反应速度按以下方法测定[15]:以2%可溶性淀粉为底物,在一定温度、一定pH值(0.05 mol/L 磷酸缓冲液)条件下反应10 min,采用DNS 法测定酶促反应产生的麦芽糖的量,计算酶促反应速度,用来表征酶活大小。
1.2.2 Cl-对胰淀粉酶活力影响的测定方法 取4支离心管,以蒸馏水为对照,在Na+浓度相同的条件下,比较Cl-、SO42-、NO3-对胰淀粉酶活力的影响。同时,研究不同浓度Cl-对胰淀粉酶活力的影响。酶活测定方法参照1.2.1 节,试验设3 组平行,结果用“平均值±标准差”表示。
1.2.3 Cl-对胰淀粉酶酶学性质影响的测定方法研究10 mmol/L Cl-对胰淀粉酶最适温度、最适pH值、热稳定性(不同温度下处理30 min)和pH 稳定性的影响(不同pH 值下4 ℃过夜)。另外,在测定热处理(不同温度下处理30 min)后的胰淀粉酶活力时,研究10 mmol/L Cl-能否恢复(或激活)热处理失活的胰淀粉酶。通过绘制双倒数曲线,测定添加10 mmol/L Cl-对胰淀粉酶Km、Vmax 和Kcat 的影响。试验以不加Cl-为对照,至少重复3 次。
1.2.4 Cl-和柑橘黄酮对胰淀粉酶活力影响的测定方法 研究不同添加量(0.0,0.1,0.3,1.0 mg)的柑橘黄酮对胰淀粉酶活力的影响;另外,在各梯度中添加10 mmol/L Cl-,研究Cl-存在时柑橘黄酮对胰淀粉酶活力的影响,试验设3 组平行,结果用“平均值±标准差”表示。
1.2.5 Cl-和柑橘黄酮对淀粉体外消化的影响 采用体外模拟消化的方法研究Cl-和柑橘黄酮对淀粉消化的影响,试验方法参考文献[16]。柑橘黄酮终质量浓度和Cl-终浓度根据推算的浓度确定,共4 种处理,每种处理重复测定4 次,结果以“平均值±标准差”表示。
黄酮终质量浓度的推算方法如下:按照成人每次服用140 mg 柑橘黄酮、食物消化体系(含消化液) 按2.5 L 计,黄酮终质量浓度约0.056 mg/mL。Cl-终浓度推算方法如下:10 mmol/L Cl-相当于每顿从食物中摄入1.5 g NaCl,每日约4.5 g,与我国居民膳食指南提倡的每人每日食盐量 (6 g)接近。
1.2.6 Cl-和柑橘黄酮对胰淀粉酶荧光光谱的影响
1.2.6.1 柑橘黄酮与胰淀粉酶相互作用的测定[17-18]将胰淀粉酶(终质量浓度0.15 mg/mL)与柑橘黄酮溶液(终质量浓度0~0.0134 mg/mL)混合,分别在20 ℃(293 K)和35 ℃(308 K)恒温水浴锅中反应10 min,用荧光分光光度计 (激发光波长280 nm)以200 nm/min 的速度扫描发射光谱(300~420 nm),狭缝宽5 nm。每个梯度设置3 组平行,结果用平均值表示。进一步分析柑橘黄酮(质量浓度以柚皮苷计)对胰淀粉酶的荧光猝灭机理,并计算结合常数KA 和结合点数n。
1.2.6.2 Cl-与胰淀粉酶相互作用的测定 取一定量的胰淀粉酶(测定体系中胰淀粉酶的终质量浓度0.15 mg/mL)和不同浓度的Cl-,参考1.2.6.1 节中的方法进行发射光谱扫描。
1.2.6.3 Cl-对柑橘黄酮和胰淀粉酶相互作用的影响 取胰淀粉酶(终质量浓度0.15 mg/mL)、Cl-(终浓度10 mmol/L) 和不同质量浓度的柑橘黄酮,参考1.2.6.1 节中的方法进行发射光谱扫描。
2 试验结果和分析
2.1 Cl-对胰淀粉酶活力的影响
阴离子种类和Cl-浓度对胰淀粉酶酶活的影响见图1。对照组 (水) 中酶促反应速度为2.36 mg/h,加入SO42-、NO3-对酶活影响不大,加入Cl-后酶促反应速度增加到12.35 mg/h,激活效应明显(图1a)。Cl-对淀粉酶的激活具有浓度效应,0~10 mmol/L(酶促反应体系终浓度)时激活倍数迅速增加;10 mmol/L 以上,激活倍数基本保持不变 (图1b),将10 mmol/L 作为后续的试验浓度。
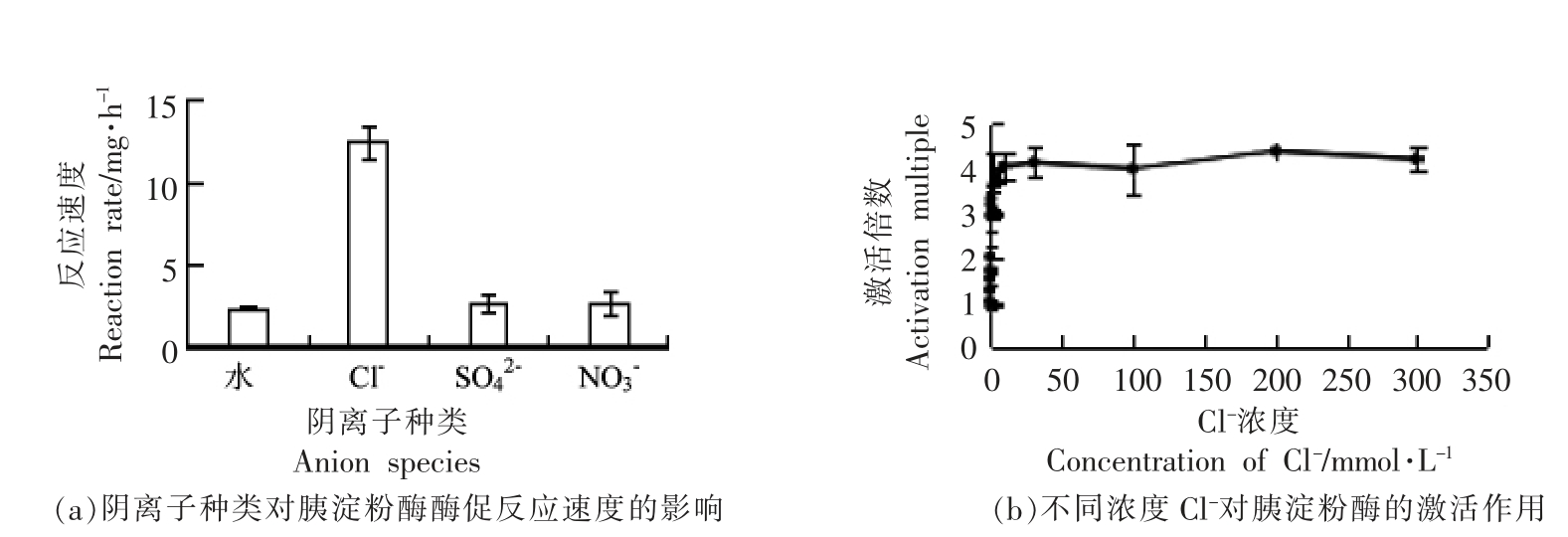
图1 不同阴离子对胰淀粉酶酶促反应速度的影响
Fig.1 Effects of different anions on the enzymatic reaction rate of pancreatic amylase
2.2 Cl-对胰淀粉酶酶学性质的影响
Cl-对胰淀粉酶酶学性质的影响见图2。无Cl-时,胰淀粉酶的最适温度是37 ℃(图2a)、最适pH 值为6 (图2b);37 ℃以上处理30 min 导致胰淀粉酶活力逐渐下降,47 ℃时,酶已基本失活(图2c),胰淀粉酶的pH 稳定范围为6~10(图2e)。添加10 mmol/L Cl-后,胰淀粉酶的最适温度提高到47 ℃(图2a)、最适pH 值变为7(图2b);热稳定性增强,42 ℃以上处理30 min 导致胰淀粉酶活力逐渐下降,57 ℃时基本失活(图2c),pH 值稳定性不变,为6~10(图2e)。此外,试验发现Cl-不能恢复热失活(47 ℃以上)淀粉酶的活性(图2d)。
胰淀粉酶双倒数曲线见图2f。无Cl-时,Vmax 为0.29 μmol/min,Km 值为0.14 mg/mL,Kcat 值为4.65×107/min;添加10 mmol/L Cl-后,Vmax(1.83 μmol/min)和Kcat 值(2.96×108/min)增加了6.3 倍,说明Cl-的激活效应明显,而Km 值增加了14.3 倍(2.00 mg/mL),这可能不是酶和底物亲和力下降的表现,而是因为淀粉是大分子,扩散能力差,酶被激活后需要更高浓度的底物才能满足酶工作的需要。
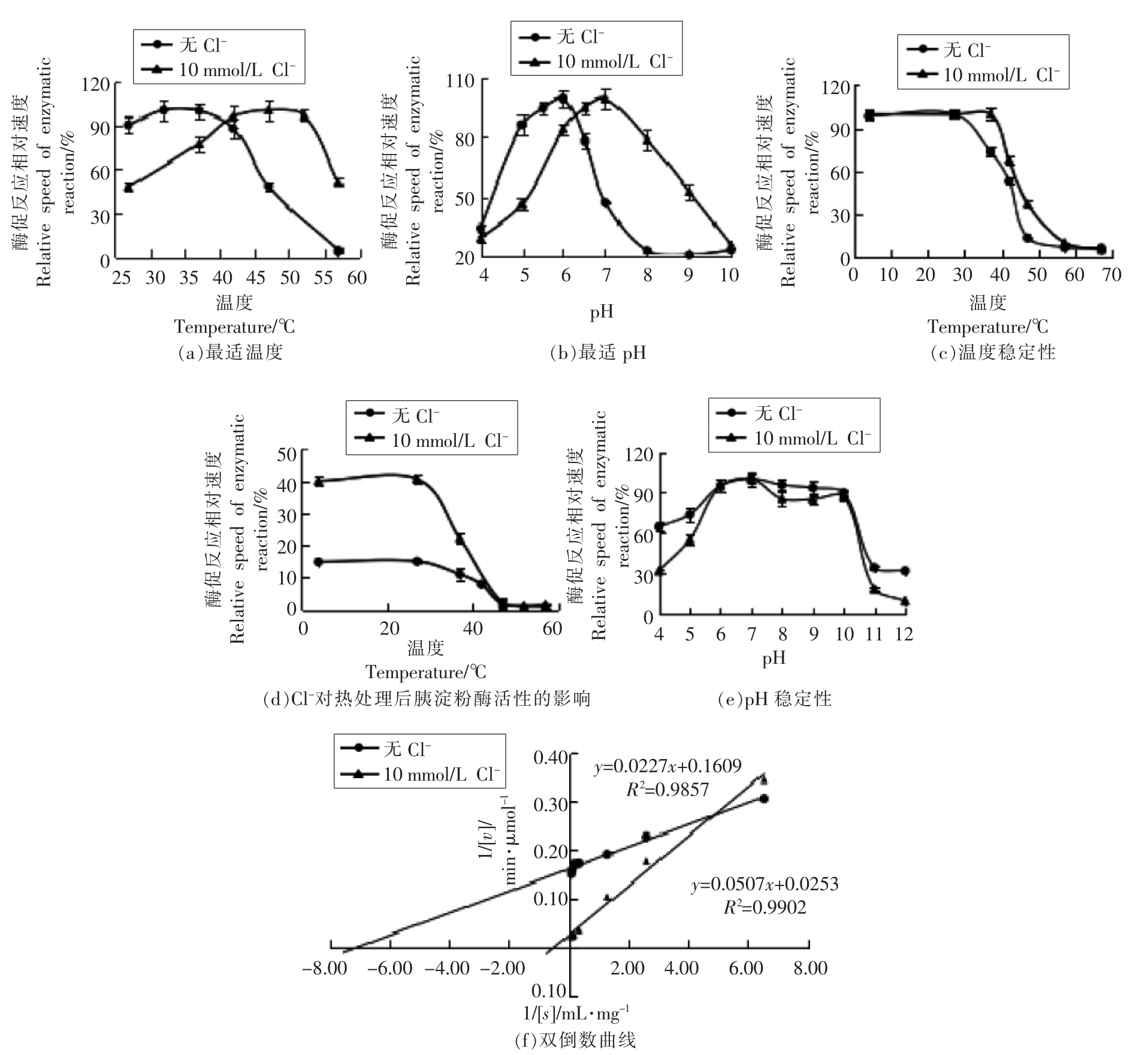
图2 Cl-对胰淀粉酶酶学性质的影响
Fig.2 Effects of Cl- on enzymatic properties of pancreatic amylase
2.3 Cl-和柑橘黄酮对胰淀粉酶活力的影响
Cl-及柑橘黄酮对胰淀粉酶酶促反应速度的影响见图3。无Cl-时,反应体系中添加0.1 mg 黄酮的酶促反应速度(28.35 mg/h)与对照(25.16 mg/h)相近,黄酮添加量0.3~1.0 mg 时,酶促反应速度稍有下降(20.86 mg/h),抑制率最高为17.1%。添加10 mmol/L Cl-时,酶促反应速度随着黄酮含量的增加变化不大,均呈现较高的水平(各梯度均高于无Cl-时,激活明显),即高浓度黄酮(0.3~1.0 mg)对胰淀粉酶没有明显抑制作用。因此,单独加Cl-对胰淀粉酶起激活作用,单独添加高质量浓度黄酮对胰淀粉酶有抑制作用,同时添加Cl-和柑橘黄酮时,柑橘黄酮基本不影响Cl-发挥激活作用。
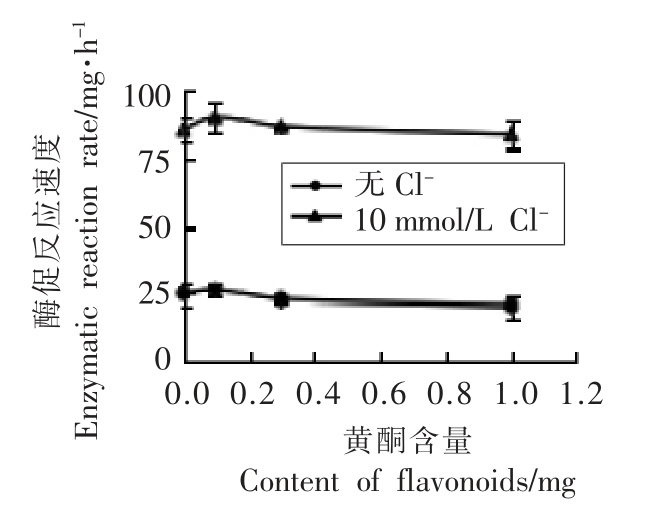
图3 Cl-及柑橘黄酮对胰淀粉酶酶促反应速度的影响
Fig.3 Effects of Cl- and citrus flavonoids on the enzymatic reaction rate of pancreatic amylase
2.4 Cl-和柑橘黄酮对淀粉消化的影响
Cl-和柑橘黄酮对胰淀粉酶体外消化的影响见图4。无Cl-时,淀粉消化产生的还原糖的量呈线性增加;添加10 mmol/L Cl-后,淀粉消化速度大幅增加,20 min 内消化了大部分的淀粉;添加终质量浓度0.056 mg/mL 柑橘黄酮,基本不影响淀粉的消化规律,这与2.3 节中酶活研究结果一致。
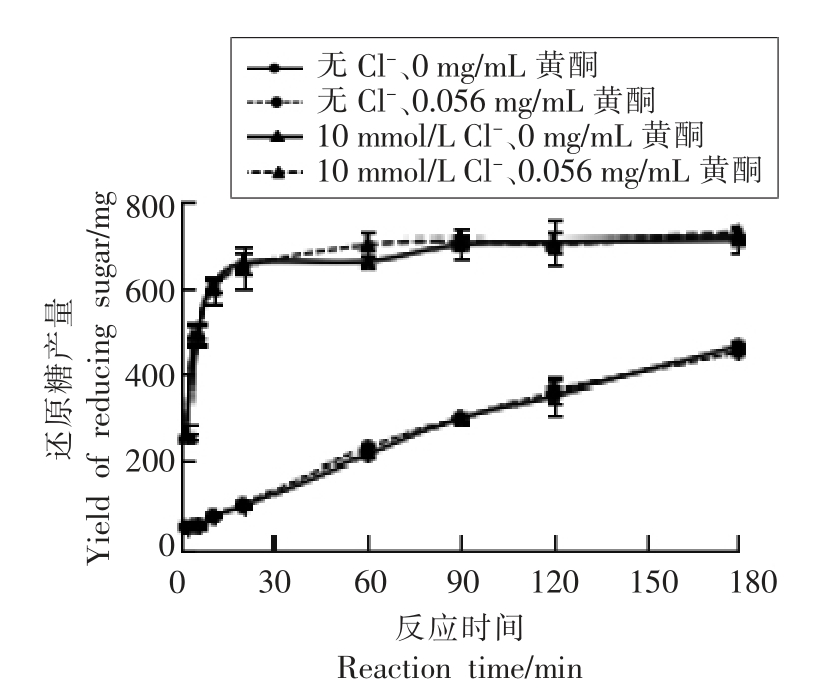
图4 Cl-和柑橘黄酮对胰淀粉酶体外消化的影响
Fig.4 Effects of Cl- and citrus flavonoids on the digestion of pancreatic amylase in vitro
2.5 Cl-和柑橘黄酮对胰淀粉酶荧光光谱的影响
2.5.1 柑橘黄酮对胰淀粉酶荧光光谱的影响 柑橘黄酮对胰淀粉酶荧光的猝灭呈现剂量效应 (见图5),质量浓度越高猝灭作用越强。同时,荧光光谱峰由337 nm 红移至344 nm,说明两者发生了相互作用,导致胰淀粉酶色氨酸残基的荧光光谱发生了变化[19]。以柑橘黄酮的主要成分柚皮苷[20]代替柑橘黄酮提取物研究胰淀粉酶荧光光谱特性 (数据未展示),两者结果高度吻合,说明柑橘黄酮提取物中与胰淀粉酶发生相互作用的成分是柚皮苷等主要成分。

图5 柑橘黄酮对胰淀粉酶荧光光谱的影响
Fig.5 Effects of citrus flavonoids on the fluorescence spectra of pancreatic amylase
注:1~8 中,柑橘黄酮的添加量依次为0,0.0013,0.0027,0.0040,0.0060,0.0080,0.0107,0.0134 mg/mL。
2.5.2 柑橘黄酮和胰淀粉酶相互作用的荧光猝灭机理和结合常数 柑橘黄酮对胰淀粉酶荧光猝灭的Stern-Volmer 曲线[21]见图6。20 ℃(293 K)和35℃(308 K)下,柑橘黄酮对胰淀粉酶的表观猝灭常数Kq 分别为13.02×1012 L/(molos)和11.29×1012 L/(molos),远高于不同猝灭剂与酶分子的最大扩散碰撞常数2.0×1010 L/(molos)[15];同时,猝灭常数Ksv由20 ℃下的13.02×104 L/mol 降低到35 ℃下的11.29×104 L/mol,说明柑橘黄酮不是通过分子动态碰撞导致胰淀粉酶荧光发生动态猝灭,而是通过结合导致了静态猝灭[18,22]。以lg[Q]为自变量、lg[(F0-F)/F]为因变量进行一元线性回归,计算得到35 ℃(308 K) 下的两者结合常数KA 为6.2×105 L/mol,结合位点数n 为1.2,即柑橘黄酮与胰淀粉酶只有一个结合位点。
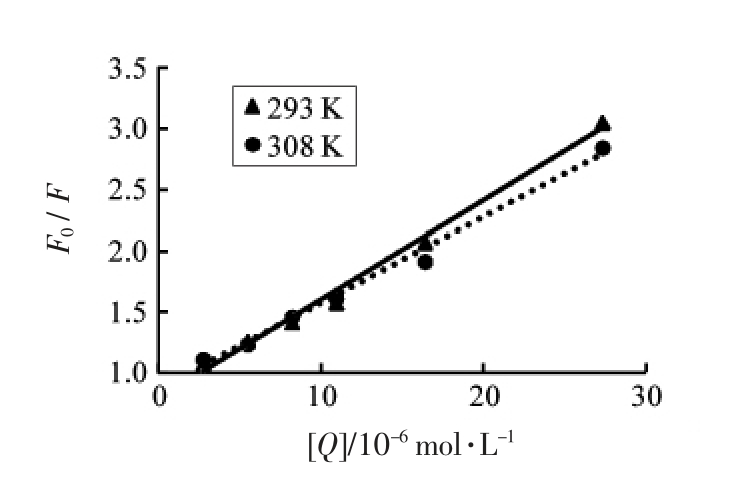
图6 柑橘黄酮对胰淀粉酶荧光猝灭Stern-Volmer 曲线
Fig.6 Stern-Volmer curve of pancreatic amylase fluorescence quenching by citrus flavonoids
2.5.3 Cl-对胰淀粉酶荧光光谱的影响 Cl-对胰淀粉酶荧光光谱的影响见图7,添加10 mmol/L Cl-后,胰淀粉酶的荧光强度与对照无明显差异(20℃);随着Cl-浓度的增加,荧光强度虽有所降低,但是变化幅度较小;当添加300 mmol/L 和570 mmol/L Cl-时,荧光强度降低较明显,试验中发现高浓度Cl-的反应体系中出现了微量絮状沉淀,这可能是因为盐溶液会对蛋白质的电荷及表面水化特性产生影响,造成少量酶蛋白析出(盐析)而降低蛋白浓度,从而降低了蛋白质的荧光强度。35℃时呈现类似的规律(数据未展示)。
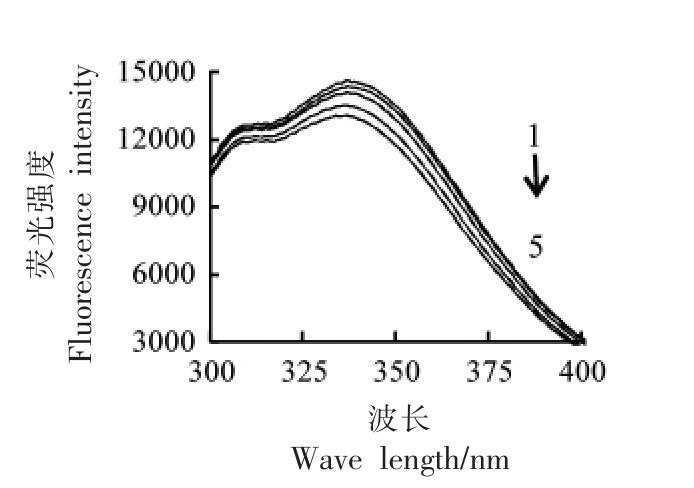
图7 20 ℃时Cl-对胰淀粉酶荧光光谱的影响曲线
Fig.7 Effects of Cl- on fluorescence spectra of pancreatic amylase at 20 ℃
注:1~5 中,Cl-浓度分别为0,10,100,300,570 mmol/L。
2.5.4 普通膳食中Cl-对柑橘黄酮和胰淀粉酶作用的荧光光谱的影响 普通饮食后消化液中的Cl-(10 mmol/L,按推荐食盐摄入量4.5 g/d 计算)对柑橘黄酮和胰淀粉酶作用后荧光光谱的影响见图8。体系中柑橘黄酮质量浓度越高,胰淀粉酶的荧光强度越低,猝灭效果与2.5.1 节中结果一致;柑橘黄酮质量浓度相同时,添加10 mmol/L Cl-对胰淀粉酶的荧光光谱没有明显影响,与2.5.3 节结果一致。以柚皮苷代替柑橘黄酮混合物测定其对胰淀粉酶的荧光猝灭规律,结果高度吻合,10 mmol/L Cl-也不影响柚皮苷对胰淀粉酶的荧光猝灭效应(图9)。
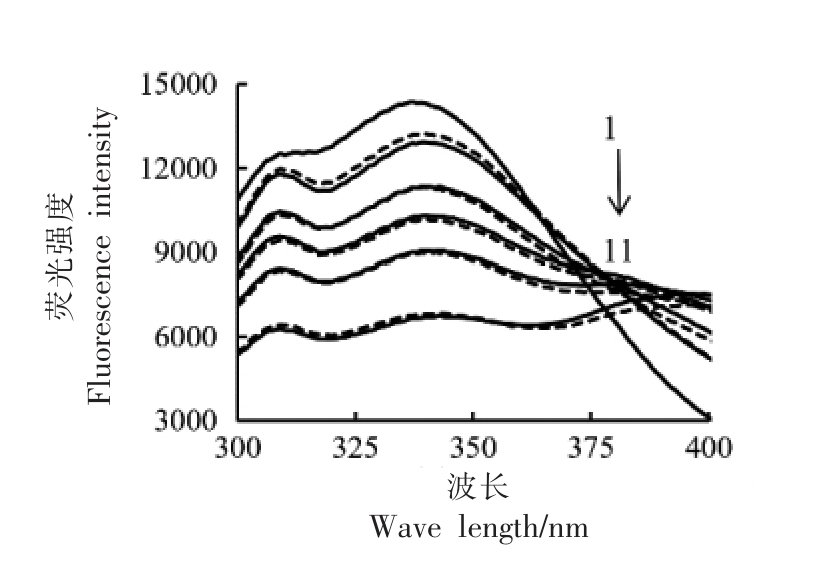
图8 Cl-和柑橘黄酮对胰淀粉酶荧光光谱的影响
Fig.8 Effects of Cl- and citrus flavonoids on fluorescence spectra of pancreatic amylase
注:虚线为无Cl-对照,实线为10 mmol/L Cl-;1~11 中,柑橘黄酮终质量浓度依次是:0,0.0017,0.0017,0.0034,0.0034,0.0051,0.0051,0.0068,0.0068,0.0102,0.0102 mg/mL。
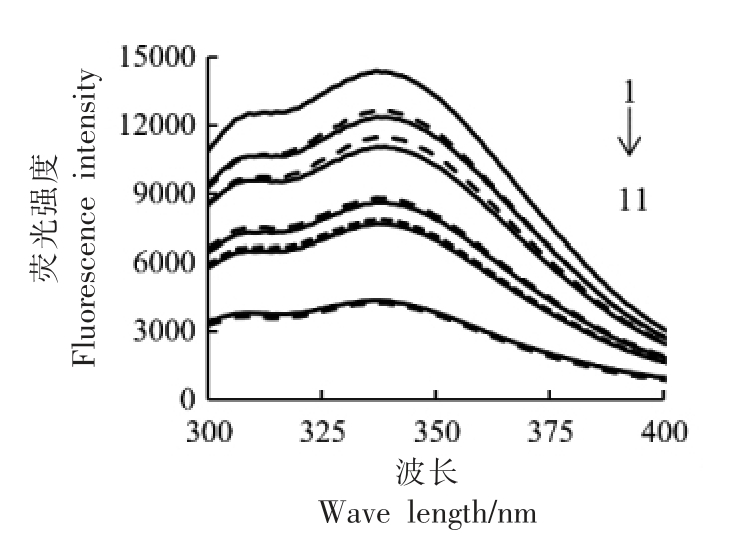
图9 Cl-和柚皮苷对胰淀粉酶荧光光谱的影响
Fig.9 Effects of Cl- and naringin on fluorescence spectra of pancreatic amylase
注:虚线为无Cl-对照,实线为10 mmol/L Cl-;1~11 中,柚皮苷终浓度(mg/mL)依次是:0,0.0014,0.0014,0.0028,0.0028,0.0059,0.0059,0.0080,0.0080,0.0160,0.0160。
综上,柑橘黄酮混合物对胰淀粉酶荧光的猝灭效应明显,其影响规律与柚皮苷(柑橘黄酮主要成分之一) 一致,普通饮食后消化液中的Cl-(10 mmol/L)对柑橘黄酮(柚皮苷)和胰淀粉酶作用后荧光光谱没有明显影响。
3 结论和讨论
本试验结果表明,Cl-是猪胰淀粉酶的激活剂,由于猪胰淀粉酶与人胰淀粉酶的同源性很高,其作用规律可类推到人胰淀粉酶。消化液中10 mmol/L Cl-相当于每餐从食物中摄入1.5 g NaCl(每日约4.5 g),接近我国居民膳食指南提倡的每人每日食盐量(6 g),说明日常食盐摄入量能保证胰淀粉酶的激活。Cl-能提高胰淀粉酶的最适温度(由37 ℃提升至47 ℃)和热稳定性(失活温度由47 ℃提升至57 ℃),然而Cl-不能让热处理失活的胰淀粉酶恢复活性;Cl-虽能改变胰淀粉酶的最适pH(由6 变为7),但会不改变其pH 值稳定性。10 mmol/L Cl-虽能极大地提高胰淀粉酶的Vmax 和Kcat值(6.3 倍),但Km 值也增加了14.3 倍,这可能是因为酶被激活后需要更高浓度的底物才能满足酶工作的需要(底物淀粉是大分子,扩散能力差),不代表酶和底物亲和力下降。无Cl-时,低质量浓度柑橘黄酮对胰淀粉酶酶活的影响不大,而高质量浓度的黄酮对胰淀粉酶具有一定的抑制作用(抑制率最高为17.1%);添加10 mmol/L Cl-,胰淀粉酶被激活后,能解除高质量浓度黄酮的抑制作用。正常膳食中的Cl-(10 mmol/L) 能大幅提高淀粉消化速率,终质量浓度0.056 mg/mL 的柑橘黄酮基本不影响淀粉消化速率。综上可以初步得出,服用柑橘黄酮类保健品不会影响胰淀粉酶对普通膳食中淀粉的消化。
人胃中会分泌胃酸,按照餐后pH 为3~4 计算,若不考虑食物中的Cl-,消化液中Cl-浓度约0.1~1 mmol/L,不足以完全激活胰淀粉酶(激活倍数为1.5~3.3 倍,见图1b),需要从膳食中补充食盐方能完全激活胰淀粉酶。这也可为高血糖人群的日常饮食提供参考,如将淀粉类食物与含NaCl的食物间隔一段时间食用,或者清淡饮食再在餐后2 h 饮用少量淡盐水补充盐分等。
荧光光谱常用来研究小分子与蛋白质的相互作用[17-18,23]。蛋白质荧光主要来自色氨酸,研究表明α-淀粉酶中至少含有16 个色氨酸残基,因此可以用荧光光谱的变化来表征其结构的变化[15,22]。本试验发现,柑橘黄酮(柚皮苷)能静态猝灭胰淀粉酶的自发荧光,且两者有1 个结合位点;Cl-对胰淀粉酶的荧光光谱影响较小,且10 mmol/L 的Cl-基本不影响柑橘黄酮(柚皮苷)对胰淀粉酶的荧光猝灭作用。
10 mmol/L 的Cl-能显著激活胰淀粉酶(Kcat 值增加到6.3 倍),推测其对胰淀粉酶的结构产生了重大影响。然而,Cl-对胰淀粉酶的荧光光谱几乎无影响,这说明Cl-与胰淀粉酶的作用与胰淀粉酶的色氨酸残基无关,作用位点应该是其它残基。后续可通过圆二色谱、X-晶体衍射、核磁共振等方法进一步研究Cl-对胰淀粉酶结构的影响,分析Cl-激活胰淀粉酶的机制。
由于日常摄入的食盐可以完全激活胰淀粉酶,正常人肠道中的胰淀粉酶会以激活状态进行工作,在研究淀粉类食物体外消化特性时,应注意添加Cl-,保证体外试验中胰淀粉酶也处于激活状态。
[1]孙海燕.柑橘类膳食纤维的制备及其性能研究[J].食品工业科技,2016,37(4):318-321,329.
SUN H Y.Preparation and performance characterization of citrus dietary fiber[J].Science and Technology of Food Industry,2016,37(4):318-321,329.
[2]SHEN W,XU Y,LU Y H.Inhibitory effects of citrus flavonoids on starch digestion and antihyperglycemic effects in HepG2 cells[J].Journal of Agricultural and Food Chemistry,2012,60:9609-9619.
[3]李萌萌,吕长鑫,芦宇,等.纤维素酶辅助提取红树莓籽黄酮及其对α-葡萄糖苷酶和α-淀粉酶的抑制作用[J].中国食品学报,2017,17(11):99-107.
LI M M,LÜ C X,LU Y,et al.Inhibitory activities on α-glucosidase and α-amylase of flavonoids cellulase-assisted extracts from red raspberry seed[J].Journal of Chinese Institute of Food Science and Technology,2017,17(11):99-107.
[4]王远,郑雯,蔡珺珺,等.辣木叶黄酮结构分析及其对胰脂肪酶的抑制作用[J].食品科学,2018,39(2):31-37.
WANG Y,ZHENG W,CAI J J,et al.Structural analysis and anti-pancreatic lipase activity of flavonoids from Moringa oleifera Lam.leaves[J].Food Science,2018,39(2):31-37.
[5]柯春林,任茂生,王娣,等.黄酮化合物抗菌机理的研究进展[J].食品工业科技,2015,36(2):388-391.
KE C L,REN M S,WANG D,et al.Research progress on the antibacterial mechanism of flavonoids[J].Science and Technology of Food Industry,2015,36(2):388-391.
[6]勾洵,黄思莹,姚雪梅,等.马齿苋总黄酮对Aβ25-35阿尔茨海默症小鼠学习记忆功能的影响[J].天然产物研究与开发,2017(11):1846-1850.
GOU X,HUANG S Y,YAO X M,et al.Effects of total flavone in Portulacaoleracea L.on learning and memory of Alzheimer's disease mice caused by Aβ25-35[J].Natural Product Research and Develop ment,2017(11):1846-1850.
[7]王飞霞,杨晓华,张华峰,等.3 种豆芽中异黄酮、多酚的体外抗氧化活性及其对果蝇SOD、GSH-Px 活力的影响[J].中国食品学报,2018,18(11):57-64.
WANG F X,YANG X H,ZHANG H F,et al.In vitro antioxidant capacities of isoflavones and polyphenols in three bean sprouts and their effects on activities of SOD and GSH-Px in Drosophila melanogaster[J].Journal of Chinese Institute of Food Science and Technology,2018,18(11):57-64.
[8]梁会丽.黄酮类化合物与胃蛋白酶的相互作用及其对酶活性影响的研究[D].郑州:郑州大学,2014.
LIANG H L.Studies on the interaction between pepsin and flavonoids and their effects on enzyme activity[D].Zhengzhou:Zhengzhou University,2014.
[9]罗芳.柑橘黄酮与α-淀粉酶、淀粉的相互作用研究[D].长沙:湖南农业大学,2017.
LUO F.Investigation of the interaction of citrus flavonoids with α-amylase and starch[D].Changsha:Hunan Agricultural University,2017.
[10]ZHANG X,JIA Y J,MA Y L,et al.Phenolic composition,antioxidant properties,and inhibition toward digestive enzymes with molecular docking analysis of different fractions from Prinsepia utilis Royle fruits[J].Molecules,2018,23:3373.
[11]ZHANG C T,MA Y L,GAO F D,et al.The free,esterified,and insoluble-bound phenolic profiles of Rhus chinensis Mill.fruits and their pancreatic lipase inhibitory activities with molecular docking analysis[J].Journal of Functional Foods,2018,40:729-735.
[12]谢星,涂宗财,王辉,等.野生和种植藜蒿不同部位提取物的抗氧化活性和酶抑制活性[J].中国食品学报,2020,20(3):58-65.
XIE X,TU Z C,WANG H,et al.Antioxidant and enzyme inhibitory activities of extracts from various parts of wild and cultivated Artemisia selengensis Turcz[J].Journal of Chinese Institute of Food Science and Technology,2020,20(3):58-65.
[13]陈建澍,郑兰娟,梅建凤,等.新琼寡糖对唾液淀粉酶活性的影响[J].食品科技,2013,38(8):71-74.
CHEN J S,ZHENG L J,MEI J F,et al.Effect of neoagaro-oligosaccharide on activity of salivary amylase[J].Food Science and Technology,2013,38(8):71-74.
[14]李继伟,龚伟发,穆素芬,等.微波辅助提取绿茶多糖条件的响应面优化[J].应用化工,2016,45(11):2009-2012.
LI J W,GONG W F,MU S F,et al.Optimization of polysaccharides extraction conditions from green tea by microwave assisted extraction method through response surface analysis[J].Applied Chemical Industry,2016,45(11):2009-2012.
[15]王静,刁翠茹,王华丽,等.鼠尾草酸对α-淀粉酶的抑制作用[J].食品科学,2020,41(3):12-17.
WANG J,DIAO C R,WANG H L,et al.Inhibitory mechanism of carnosic acid on alpha-amylase[J].Food Science,2020,41(3):12-17.
[16]李琳,张小康,周子政,等.白萝卜不溶性膳食纤维提取方法的比较及其对饼干消化的影响[J].农产品加工,2020(14):38-41.
LI L,ZHANG X K,ZHOU Z Z,et al.Comparison of extraction methods for insoluble dietary fiber of white radish and the effect of IDF on biscuits digestion [J].Farm Products Processing,2020 (14):38-41.
[17]刘硕,王萌,朱少华,等.紫甘薯花色素与胰蛋白酶相互作用特性[J].食品科学,2014,35(23):232-237.
LIU S,WANG M,ZHU S H,et al.Interaction between purple sweet potato anthocyanins and trypsin[J].Food Science,2014,35(23):232-237.
[18]张静,米佳,禄璐,等.黑果枸杞花色苷提取物对胰脂肪酶活性的影响[J].食品科学,2020,41(5):8-14.
ZHANG J,MI J,LU L,et al.Effect of anthocyanins extract from Lycium ruthenicum Murr.fruit on pancreatic lipase activity[J].Food Science,2020,41(5):8-14.
[19]SU J H,WANG H X,MA C Y,et al.Hypocholesterolaemic mechanism of bitter melon aqueous extracts via inhibition of pancreatic cholesterol esterase and reduction of cholesterol micellar solubility[J].International Journal of Food Sciences&Nutrition,2016,67(1):20-28.
[20]KHAN M K,HUMA Z E,DANGLES O.A comprehensive review on flavanones,the major citrus polyphenols [J].Journal of Food Composition and Analysis,2014,33(1):85-104.
[21]SINGHA ROY A,GHOSH P,DASGUPTA S.Glycation of human serum albumin alters its binding efficacy towards the dietary polyphenols:A comparative approach[J].Journal of Biomolecular Structure and Dynamics,2016,34(9):1911-1918.
[22]姚林锋,何强.单宁酸与胰α-淀粉酶作用特性研究[J].食品工业科技,2014,35(3):63-66.
YAO L F,HE Q.Interaction between tannic acid and pancreatic α-amylase[J].Science and Technology of Food Industry,2014,35(3):63-66.
[23]陶慧林,刘峥,王松梅,等.荧光光谱法对邻香草醛缩精氨酸席夫碱与胰蛋白酶相互作用的研究及其应 用[J].理化检验(化学分册),2010,46(11):1269-1272.
TAO H L,LIU Z,WANG S M,et al.Fluorospectrometric study on the interaction of the condensate of o-vanillin and arginine schiff base with trypsin and its analytical application[J].Physical Testing and Chemical Analysis (Part B:Chemical Analysis),2010,46(11):1269-1272.