阿尔茨海默病 (Alzheimer's disease,AD)是一种年龄依赖的神经退行性疾病,临床表现为记忆、学习和认知能力下降,并伴随一定程度的焦虑和抑郁情绪[1],严重影响老龄人群的生活质量。我国人口老龄化日益加剧,阿尔茨海默病患病率逐年上升。据《阿尔茨海默病患者家庭生存状况调研报告》 显示,我国有1 000 多万阿尔茨海默病患者,预计到2050年AD 患病人数将超过3 000 万。
氧化应激反映了体内自由基与抗氧化剂的失衡状态,被认为是包括阿尔茨海默病在内的多种神经退行性疾病发展的一个促成因素[2]。脑内氧化应激水平的升高会增加β-淀粉样蛋白(Aβ)的产生及Tau 蛋白过度磷酸化,进而影响神经细胞的功能[3-4]。越来越多的研究证实氧化应激在AD 形成中发挥着至关重要的作用[5-7]。通过膳食干预改善体内氧化水平缓解阿尔茨海默病的研究已成为国内外研究的热点[8-9]。
虾青素(3,3′-Dihydroxy-β,β′-carotene-4,4′-dione) 是海洋食品中大量存在的一种类胡萝卜素[10]。虾青素分子结构中β-紫罗兰酮环和长链共轭烯烃结构赋予其高效淬灭活性氧的能力,并且有报道显示虾青素是少数能穿透血-脑屏障进入大脑发挥神经保护功能的膳食抗氧化成分之一[11]。以往研究主要关注阿尔茨海默病发病后,利用虾青素的抗氧化功效延缓其病理进程[12-14]。越来越多的研究表明,老化是导致阿尔茨海默病的主要风险因素[15]。然而,虾青素对衰老伴随的认知能力下降的预防作用鲜有报道。
快速老化小鼠(Snescence-accelerated mouse prone 8,SAMP8) 的衰老过程伴随着脑内Aβ 沉积、氧化应激增加、Tau 过度磷酸化以及神经炎症等与认知功能障碍相关的复杂生理学改变,是目前公认的自然衰老痴呆模型[16]。本研究采用SAMP8 快速老化模型小鼠,探究膳食补充虾青素对衰老伴随的学习记忆能力的影响及其可能的作用机制。
1 材料与方法
1.1 材料与试剂
虾青素,购自桐乡市科森食品添加剂有限公司;总超氧化物歧化酶(T-SOD)试剂盒、谷胱甘肽过氧化物酶(GSH-Px)试剂盒、一氧化氮(NO)试剂盒、丙二醛(MDA)试剂盒均购自南京建成生物工程研究所;一氧化氮合酶(NOS)试剂盒、8-羟基脱氧鸟苷(8-OHdG)试剂盒、8-氧化鸟苷(8-oxo-G) 试剂盒购自美国R&D syetem 公司;BCA 蛋白浓度测定试剂盒购自碧云天生物试剂研究所;其它试剂均为国产分析纯级。
1.2 仪器与设备
Spark 10M 型酶标仪,瑞士帝肯公司;UV-2550 型分光光度计,上海元析仪器有限公司;Neofuge 23R 型台式离心机,上海力新仪器有限公司;Morris 水迷宫装置,上海赞德仪器有限公司;行为学评价软件ANY-maze,美国Stoelting 公司。
1.3 动物分组及饲料组成
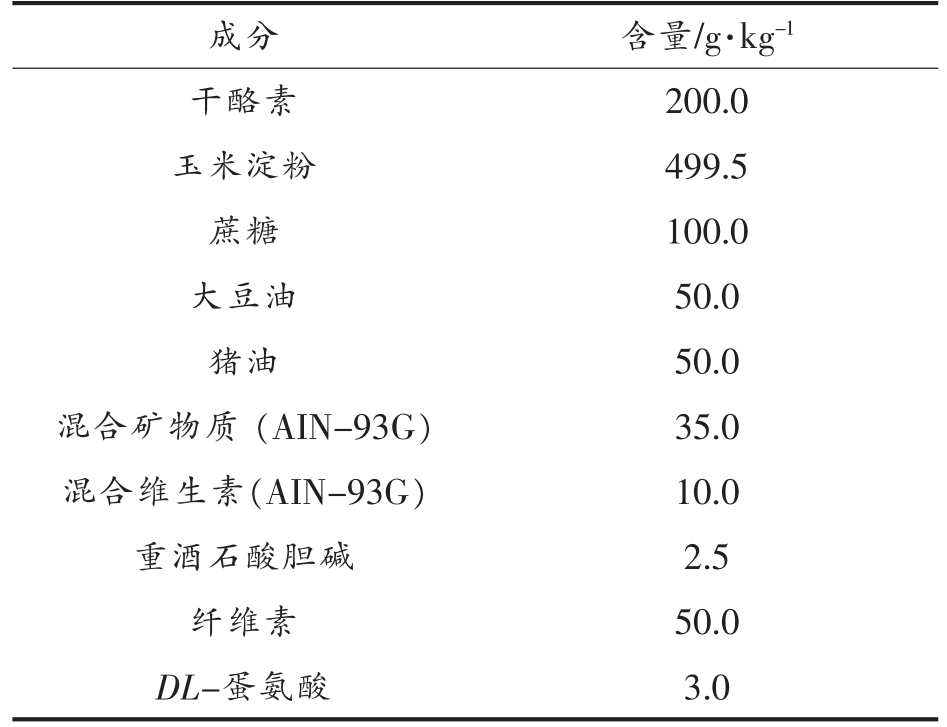
16 只健康雄性4月龄SAMP8 小鼠,适应性喂养一周,按体重随机分为SAMP8 模型对照组(n=8,SAMP8)、虾青素组(n=8,AST),同龄SAMR1小鼠(n=8,SAMR1)作为正常对照。各组小鼠基础饲料参照AIN-93G 动物饲料配制(表1),虾青素灌胃剂量为40 mg/kg bw,对照组灌胃等量的生理盐水,连续喂养4 个月。在此期间,小鼠自由取食饮水,并定期记录摄食和饮水量。
表1 动物实验饲料配方
Table 1 Animal experimental feed formula
?
1.4 行为学实验
1.4.1 Morris 水迷宫 Morris 水迷宫是评价小鼠空间学习记忆能力的典型行为学实验,具体操作步骤参照文献[17]。水迷宫由含有水下逃脱平台的圆形水池(直径130 cm,高50 cm,水深30 cm)和小鼠运动轨迹摄像系统两部分组成。水池中水温控制在 (22±1)℃,内壁等距离划分4 部分:北(N)、西(W)、南(S)、东(E),依次标有4 个不同的记号,在W 象限放置一个可移动的直径9 cm 的圆台,高度低于水面1 cm。水池中加入蓝黑色墨水使平台不可见,迷宫上方安有摄像机以用于记录和分析小鼠的游泳轨迹。
测试时平台置于W 象限,训练期间,将小鼠从4 个象限依次面向池壁放入水中各测试1 次,每次测试的时间为60 s,记录小鼠找到平台所用时间(逃避潜伏期),如果小鼠在60 s 内未找到平台,则牵引其游至平台上,并停留10 s,逃避潜伏期视为60 s,连续训练6 d,第7 天撤除水下的平台,轨迹追踪分析软件自动记录其在目标象限的停留时间以及平台穿越次数。
1.4.2 旷场实验 旷场实验方法参照Krasnova等[18]的方法。实验装置由旷场反应箱和记录装置两部分组成。箱高30 cm,长宽均为50 cm,顶部与摄像机相连。小鼠在箱中适应2 min 后,将其置于装置的中心区域并监测5 min,记录每只小鼠在敞箱中的总路程以及小鼠在中心区域逗留的时间,实验在安静的环境下进行。
1.5 样品收集与测定
1.5.1 样品收集 行为学实验结束后,所有小鼠采用眼眶取血并断头处死,在冰上迅速剥离出脑组织并分离海马,同时取出肝脏组织,所有组织置于液氮中,后转入-80 ℃冰箱备用。
1.5.2 脑组织Aβ1-42 含量和生化指标测定 取小鼠海马组织样品,加入生理盐水于冰水浴中充分匀浆,4 ℃离心,取上清液制备10%组织匀浆,BCA法测定海马组织匀浆液的蛋白含量。使用ELISA试剂盒测定样品中Aβ1-42 的含量,海马中的MDA、8-OHdG、8-oxo-G、NO、NOS、T-SOD、GSH-Px 含量参照相应试剂盒使用说明测定。
1.5.3 血清和组织氧化应激指标测定 小鼠血样取出后,室温静置30 min,3 500 r/min 离心15 min,分离血清,血清中的MDA、8-OHdG、8-oxo-G、T-SOD、GSH-Px 等氧化应激指标参照相应试剂盒的说明书测定。
肝脏组织中的MDA、8-OHdG、8-oxo-G、TSOD、GSH-Px 等氧化应激指标的测定同1.5.2 节。
1.6 数据分析
实验结果以均值±标准误差(x±s)表示。用SPSS 26.0 统计软件对数据进行方差分析,P<0.05表示差异显著,P>0.05 表示差异不显著,使用Graphpad Prism 8.4.0 软件作图。
2 结果与分析
2.1 虾青素对小鼠体质量和摄食量的影响
由图1a 可以看出,各组小鼠在不同饮食干预4 个月期间,体质量无明显差异(P>0.05),图1b 显示了饮食干预期间,3 组小鼠的平均摄食量分别为4.92,5.11,5.12 g,统计学上无显著性差异(P>0.05),表明虾青素干预对小鼠的体质量和摄食量无明显影响。
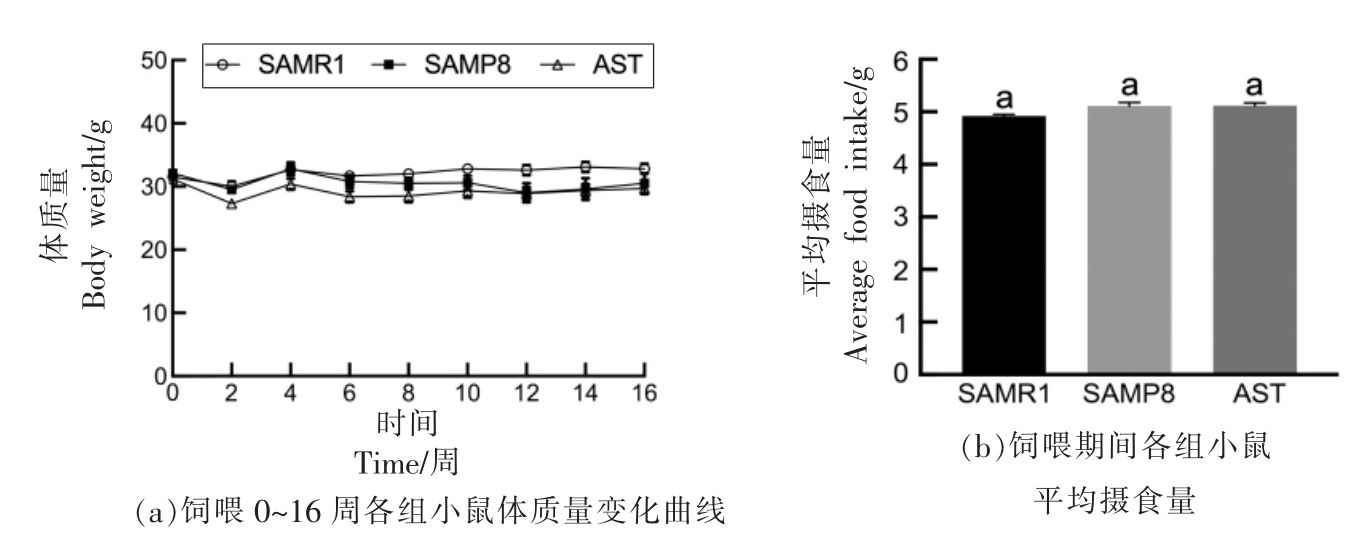
图1 虾青素对小鼠体质量、平均摄食量的影响(n=8)
Fig.1 Effects of astaxanthin on the body weight and average food intake in mice (n=8)
注:不同字母标识代表组间具有显著性差异(P<0.05)。
2.2 虾青素对小鼠空间学习和记忆能力的影响
Morris 水迷宫是动物实验中经典的空间学习和记忆能力的评价方法[19],由定位航行实验和空间探索实验两部分组成。结果如图2所示,模型组小鼠在定位航行实验中逃避潜伏期大于正常对照组(P<0.05),说明SAMP8 小鼠存在空间学习和记忆障碍,这一结果与Zhu 等[20]的研究一致。在训练期前5 d,虾青素干预组逃避潜伏期与正常对照组无显著差别(P>0.05)(图2a),第6 天相比模型组,干预虾青素后小鼠找到平台所用时间减少了23.0%,这一结果表明补充虾青素能够改善SAMP8 小鼠认知功能损伤。
在空间探索实验中使用目标象限停留时间(图2b)和平台穿越次数(图2c)作为小鼠记忆评价指标。模型组小鼠在目标象限的停留时间为7.49 s,明显低于正常组(P<0.05),虾青素干预后,小鼠在目标象限的停留时间延长至12.43 s,基本恢复至正常水平;同样的,模型组小鼠的平台穿越次数低于正常组,补充虾青素后,平台穿越次数显著提高(P<0.05)。
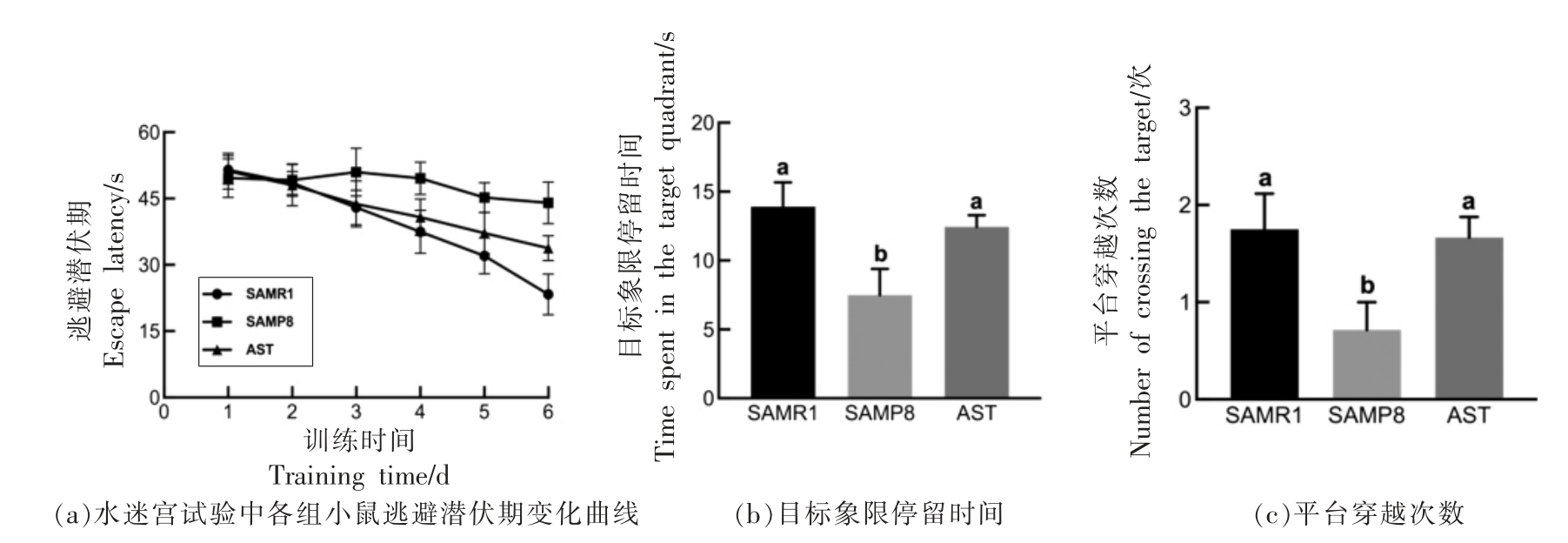
图2 虾青素对小鼠空间学习和记忆能力的影响(n=8)
Fig.2 Effects of astaxanthin on the spatial learning and memory ability in mice (n=8)
注:不同字母标识代表组间具有显著性差异(P<0.05)。
以上结果表明,膳食干预虾青素能提高痴呆小鼠的空间学习记忆能力,这一结论也在其它研究中被证实。Che 等[21]在研究虾青素改善APP/PS1双转小鼠记忆损伤中也表明虾青素干预能提高小鼠在水迷宫中平台穿越次数及在目标象限停留时间,改善痴呆小鼠记忆障碍。Al-Amin 等[22]利用东莨菪碱诱导小鼠胆碱能损伤,导致空间记忆障碍,干预虾青素明显改善了脑内神经元的氧化应激,提高了学习认知能力。
2.3 虾青素对小鼠焦虑情绪的影响
旷场实验是公认的研究啮齿动物自发探索行为和焦虑的方法[23]。有研究表明,小鼠在中心区域探索时间与焦虑程度呈负相关[24]。图3a 结果表明各组小鼠在旷场内总路程没有显著性差异(P>0.05),然而在5 min 的探索时间内,模型组小鼠在敞箱中心的停留时间相比对照组降低了45.0%(图3b),表明模型组存在一定程度的焦虑。Li 等[25]的研究表明旷场试验中SAMP8 小鼠相比SAMR1小鼠显示出更明显的焦虑状态。干预虾青素后,小鼠在敞箱中心停留时间提高至57.9 s,表明虾青素具有改善焦虑的潜在效果,而这一作用也在Al-Amin 等[22]和Nishioka 等[26]的研究中得以阐明。
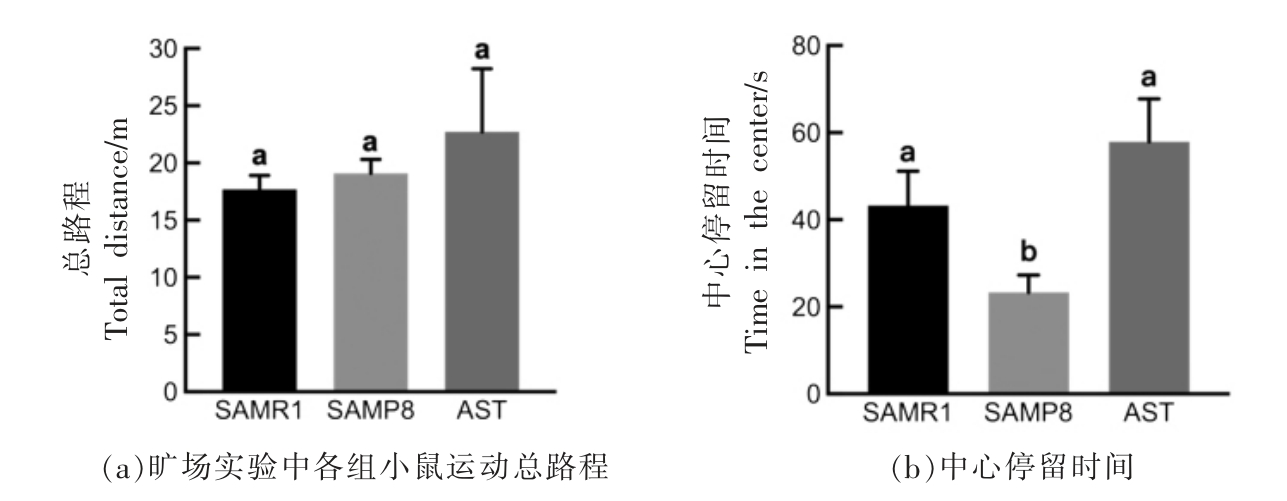
图3 旷场实验中虾青素对SAMP8 小鼠焦虑状态的影响(n=8)
Fig.3 Effects of astaxanthin on anxiety of SAMP8 mice in open-field test (n=8)
注:不同字母标识代表组间具有显著性差异(P<0.05)。
2.4 虾青素对小鼠脑内Aβ 水平的影响
众所周知,阿尔茨海默病病理特征中伴随Aβ沉积形成的老年斑块[27],会导致细胞内氧化应激、神经炎症、细胞凋亡、突触损伤等一系列级联反应[28-29]。为了探究干预虾青素后小鼠学习认知能力的提升与脑内Aβ1-42 含量的关系,测定了海马区Aβ1-42 含量。由图4可以看出模型组海马区Aβ 含量显著高于正常对照组(P<0.05),而干预虾青素后,SAMP8 小鼠脑内海马区Aβ1-42 含量下降了34.0%,Rahman 等[28]的研究表明口服虾青素能降低脑室注射Aβ 大鼠海马中Aβ1-42 的水平达到保护神经的功效。此外,有研究指出虾青素能通过降低3xTg AD 小鼠脑内APP 和BACE1 的表达量,减少脑内β-淀粉样蛋白沉积[11]。
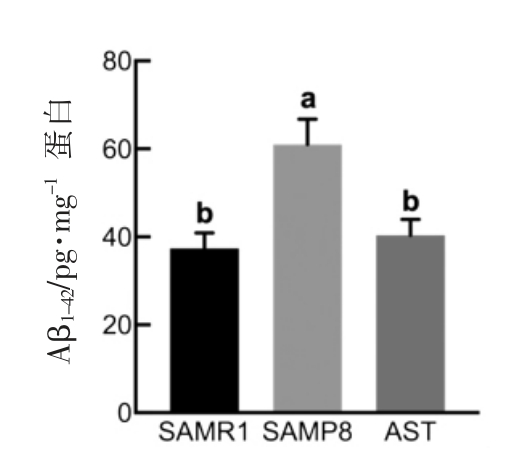
图4 虾青素对SAMP8 小鼠脑组织中Aβ1-42水平的影响(n=8)
Fig.4 Effects of astaxanthin on Aβ1-42 levels in brain tissue of SAMP8 mice (n=8)
注:不同的字母表示组间有显著差异(P<0.05)。
2.5 虾青素对SAMP8 小鼠体内氧化应激的影响
2.5.1 虾青素对小鼠脑组织氧化应激指标的影响 生物体内,自由基作用于脂质发生过氧化反应,氧化终产物为丙二醛(MDA),会引起蛋白质、核酸等生命大分子的交联聚合,且具有细胞毒性[22]。由图5a所示,模型组小鼠脑组织中MDA 含量相比正常对照组小鼠提高了30.0%,而饮食干预虾青素后,小鼠脑内MDA 的含量显著降低(P<0.05)。先前的研究表明小鼠每日口服2 mg/kg 虾青素,连续4 周,能显著降低Swiss 雄鼠脑内海马区MDA 含量[8]。
研究表明,衰老是一个伴随氧化损伤的过程,而很多包括AD 在内的神经系统疾病与氧化损伤相关[30-31],其中,8-OHdG 和8-oxo-G 是公认的评价DNA 与RNA 氧化损伤及氧化应激的重要生物标志物[32]。与对照组小鼠相比,模型组小鼠脑组织中8-OHdG 和8-oxo-G 含量提高了39.7%、37.2%,而AST 干预后脑内8-OHdG 和8-oxo-G 含量减少了20.0%、21.2%(图5b、5c)。
NO 在体内可以作为第二信使参与小鼠记忆的形成[33],而过多的NO 会与超氧化物结合形成亚硝酸盐进而诱导氧化应激,损伤脂质、蛋白、DNA等生物大分子[34]。膳食干预虾青素显著地降低了小鼠海马内NOS 的含量,进而减少了NO 的生成(图5d、5e)。
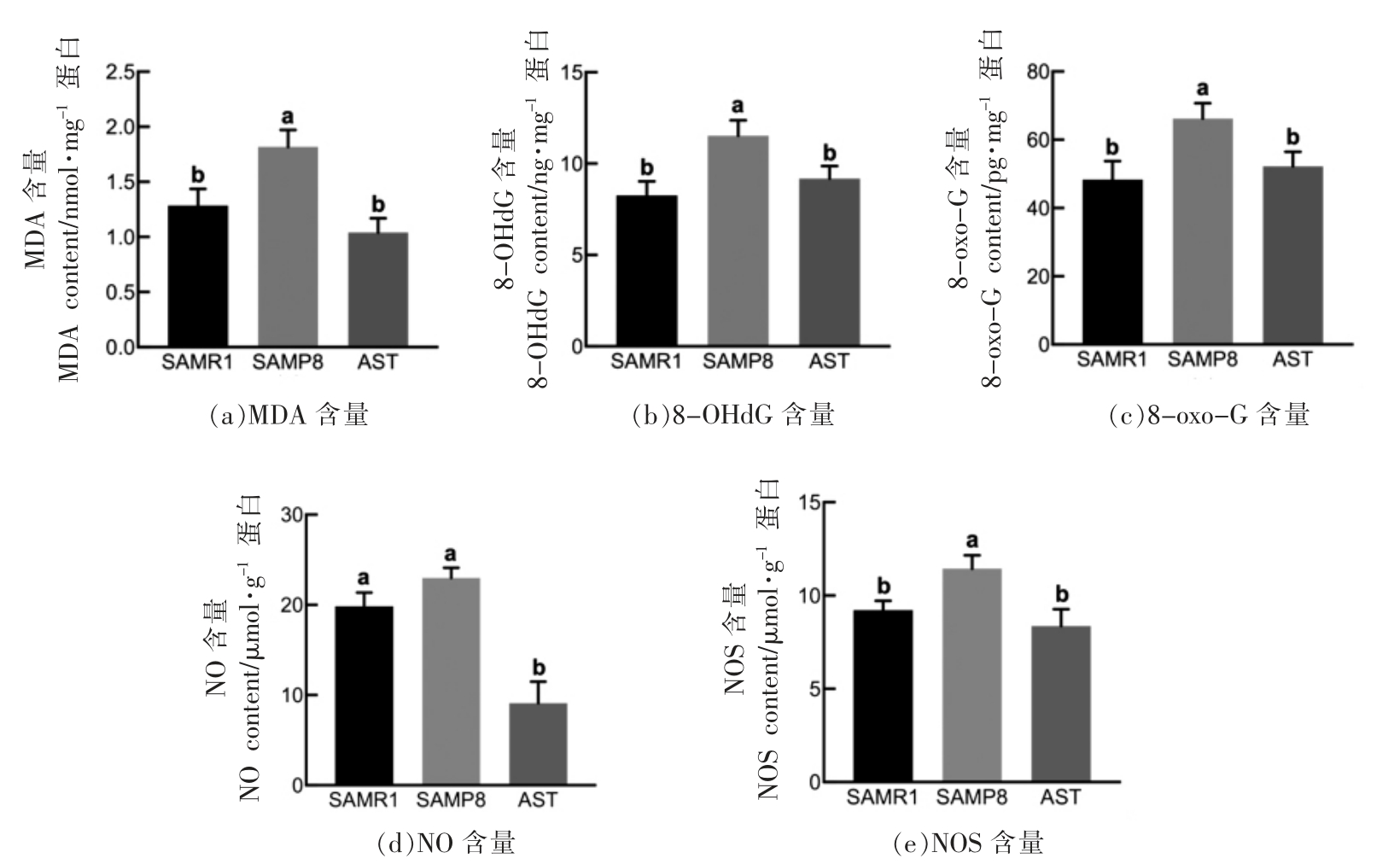
图5 虾青素对小鼠脑组织中MDA、8-OHdG、8-oxo-G、NO、NOS 含量的影响(n=8)
Fig.5 Effects of astaxanthin on the contents of MDA,8-OHdG,8-oxo-G,NO and NOS in brain tissue of mice (n=8)
注:不同的字母表示组间有显著差异(P<0.05)。
SOD、GSH-Px 活性大小可间接反映机体清除自由基的能力。由图6a、6b可知,模型组小鼠脑组织中T-SOD 与GSH-Px 活力相比正常组分别降低23.7%和41.7%,结果具有显著性差异,AST 干预后显著提高小鼠脑内的T-SOD 以及GSH-Px活力(P<0.05),表明虾青素能提高SAMP8 小鼠脑内抗氧化水平,缓解氧化应激。
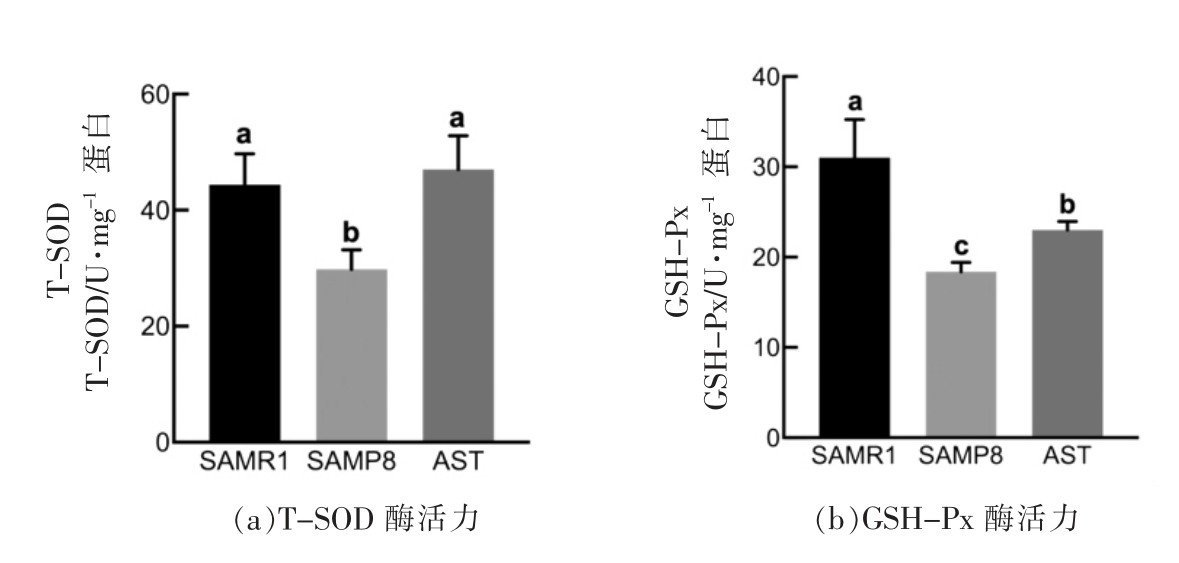
图6 虾青素对小鼠脑组织中T-SOD、GSH-Px 酶活力的影响
Fig.6 Effects of astaxanthin on the activity of T-SOD and GSH-Px in brain tissue of mice
注:不同的字母表示组间有显著差异(P<0.05)。
本研究中8月龄SAMP8 小鼠脑内氧化应激水平与正常组SAMR1 小鼠存在明显差别,表现为脂质、核酸等氧化标志物明显升高,抗氧化物质如T-SOD、GSH-Px 含量显著下降。有大量研究表明AD 早期存在线粒体功能异常导致的氧化应激,甚至在脑部淀粉样蛋白沉积斑块形成之前就已存在[35-36]。
ROS 的过度积累会影响细胞内生物大分子如蛋白质、脂质、核酸等正常的生理代谢和功能行使,从而造成细胞内代谢异常,而这一过程会加速Aβ 的产生和积累,诱导一系列对机体有害的级联反应包括Tau 蛋白磷酸化、细胞炎症、突触可塑性损伤、神经元丢失等,最终导致认知损伤[3]。因此,降低AD 体内氧化应激水平对疾病的治疗具有重要意义。虾青素作为一种自然界中抗氧化性极强的物质在本研究中降低了机体氧化应激标志物,提高了机体抗氧化水平,减少了脑部Aβ 含量,改善了小鼠认知记忆损伤。
2.5.2 虾青素对小鼠肝脏组织氧化应激的影响如图7a~c所示,各组小鼠肝脏组织中MDA 含量无显著性差异 (P>0.05);AST 干预后8-OHdG 含量显著低于模型组(P<0.05);与对照组小鼠相比,模型组小鼠肝脏组织中8-oxo-G 含量明显升高(P<0.05),AST 干预后逆转了这种变化,8-oxo-G的含量降低至模型组小鼠的76.8%(P<0.05),说明膳食干预虾青素对减轻SAMP8 小鼠肝脏氧化水平有一定作用,尤其在保护核酸氧化损伤方面。
模型组小鼠的肝脏组织中T-SOD 酶活力显著降低(P<0.05)(图7d),AST 干预后小鼠肝脏TSOD 活性恢复至正常对照组水平。崔广同等[37]的研究显示虾青素能改善氨胁迫条件下沼虾肝胰腺组织中的T-SOD 活性,提高组织抗氧化水平,减少氧化应激损伤。本研究结果中模型组谷胱甘肽过氧化物酶(GSH-Px)的活力相比正常组虽有下降趋势,但无统计学差异(P>0.05)(图7e)。
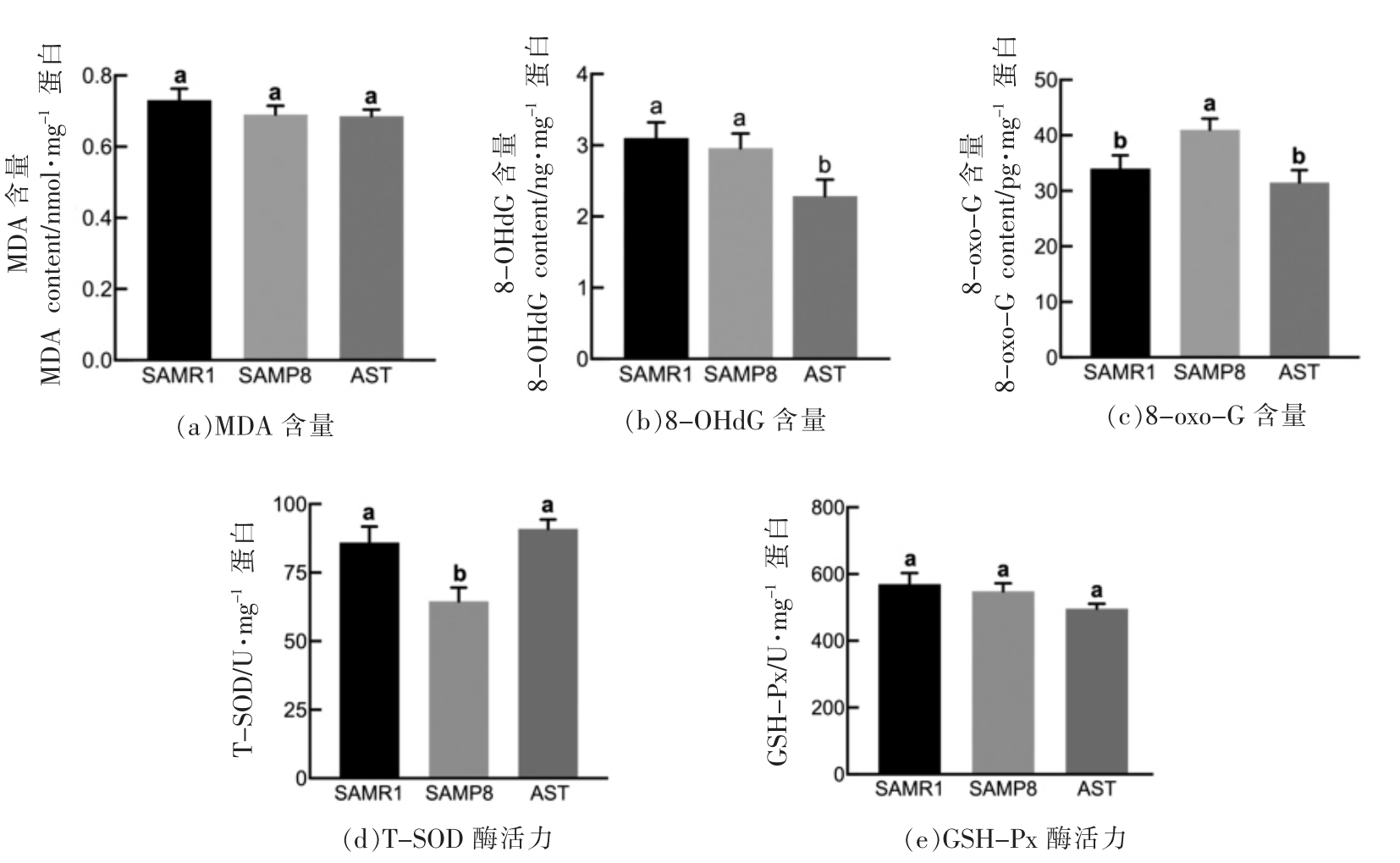
图7 虾青素对小鼠肝脏组织中MDA、8-OHdG,8-oxo-G 含量以及T-SOD、GSH-Px 酶活力的影响
Fig.7 Effects of astaxanthin on the contents of MDA,8-OHdG,8-oxo-G and the activity of T-SOD,GSH-Px in liver tissue of mice
注:不同的字母表示组间有显著差异(P<0.05)。
以上结果表明虾青素对SAMP8 小鼠肝脏中氧化应激有一定的改善效果,钟妮[38]以SAMP8 小鼠为动物模型,探究了茶多酚的主要成分表没食子儿茶素没食子酸酯(EGCG)的神经保护作用,研究结果表明EGCG 可能通过提高肝脏、肾脏等组织的SOD、GSH-Px 活性,降低MDA 含量提高SAMP8 小鼠的抗氧化能力,进而改善痴呆小鼠的病理进程,达到预防保护的作用。本研究也表明虾青素具有一定的改善脑部、肝脏组织氧化应激的作用,因此虾青素可能通过提升SAMP8 小鼠体内抗氧化水平进而缓解老化引起的认知障碍和学习记忆能力下降。
2.5.3 虾青素对小鼠血清氧化应激的影响 由图8a 可以看出,虾青素处理后血清中MDA 含量与模型组小鼠相比无统计学差异 (P>0.05),8-OHdG、8-oxo-G 的含量在各组间差异也不显著(P>0.05)(图8b、8c)。杨艳等[39]的研究结果也表明老龄昆明小鼠连续60 d 灌胃50 mg/kg 的虾青素后,血清中的8-OHdG 含量与模型组相比没有显著性差异。图8d、8e 显示了各组小鼠血清中的抗氧化指标T-SOD、GSH-Px 酶活力变化,模型组小鼠血清中T-SOD 酶活力相比对照组有所下降,而虾青素处理并没有改善这一现象;GSH-Px 酶活力在各组间也无统计学差异(P>0.05)。李勇超等[40]研究发现糖尿病小鼠灌胃不同剂量的雨生红球藻来源的虾青素后,小鼠血清中MDA 水平在各组中无明显差异,这与本研究的结果一致,而血清中T-SOD活性和GSH-Px 活性均显著升高,本实验结果未发现虾青素对血清中的T-SOD 和GSH-Px 活性有显著影响,可能因为受试物来源、喂饲时间和动物模型等因素不同所致,尚有待进一步研究。
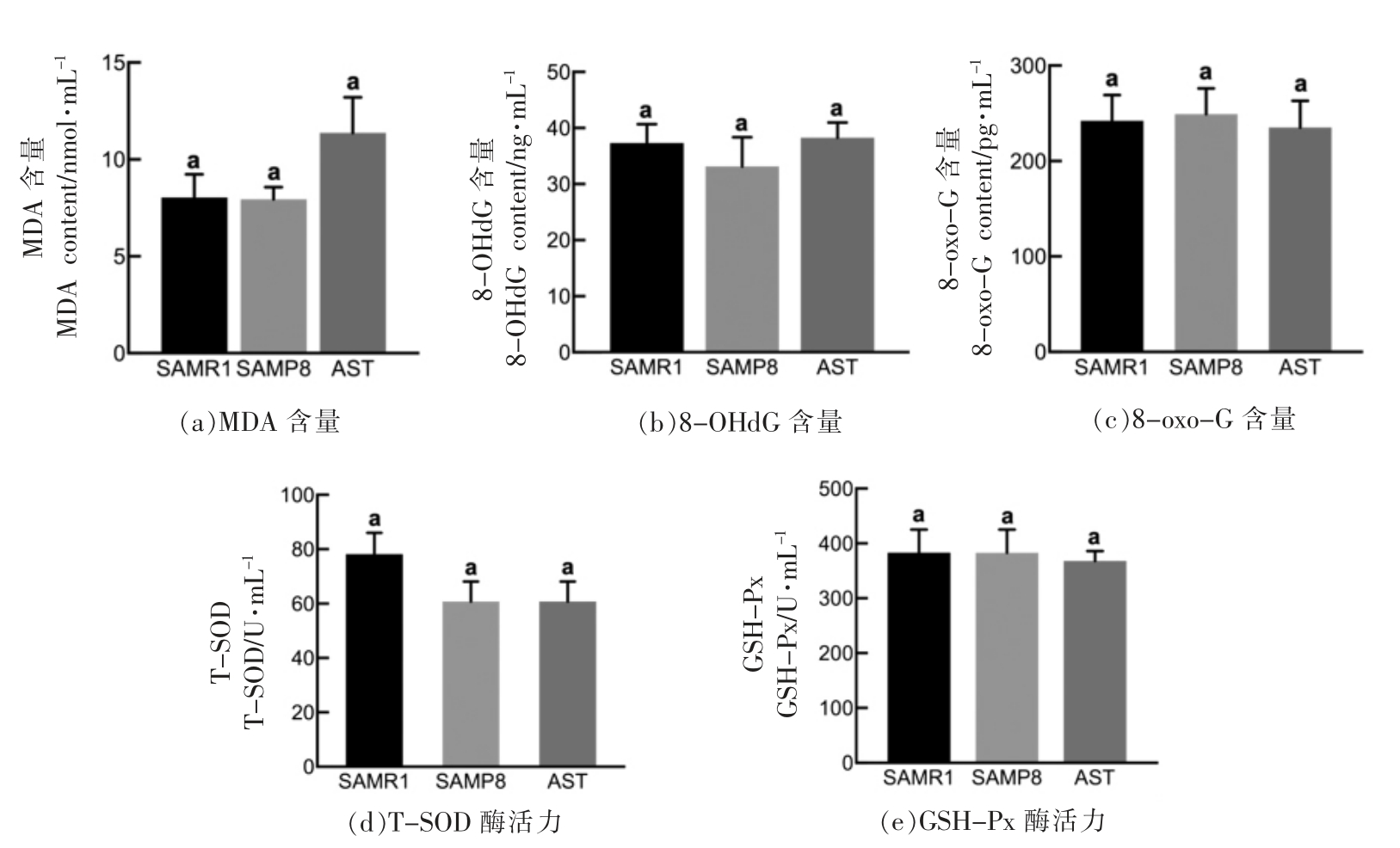
图8 AST 对小鼠血清中MDA、8-OHdG,8-oxo-G 含量以及T-SOD、GSH-Px 酶活力的影响
Fig.8 Effects of astaxanthin on the contents of MDA,8-OHdG,8-oxo-G and the activity of T-SOD,GSH-Px in serum of mice
注:不同的字母表示组间有显著差异(P<0.05)。
以上结果表明虾青素对SAMP8 小鼠血清中氧化应激的改善效果无脑组织和肝脏组织明显,虾青素对不同组织氧化应激的改善作用的选择性值得进一步探究。
3 结论
本文以SAMP8 小鼠作为研究阿尔茨海默病的动物模型,重点探究了虾青素对阿尔茨海默病的预防作用,评价了SAMP8 小鼠学习记忆能力和焦虑情绪的变化,并进一步通过测定脑内海马区、肝脏和血清中Aβ 生成、氧化应激以及抗氧化指标来探究其作用机制。结果表明,虾青素处理能显著改善SAMP8 小鼠的学习记忆能力,缓解焦虑,并且这些改善作用可能是通过虾青素的抗氧化能力发挥作用。研究结果表明虾青素作为一个安全、有效的改善神经退行性疾病的功能食品原料或食品补充剂是有潜在开发前景的。
[1]GRIÑAN-FERRÉ C,PALOMERA-ÁVALOS V,PUIGORIOL-ILLAMOLA D,et al.Behaviour and cognitive changes correlated with hippocampal neuroinflammaging and neuronal markers in female SAMP8,a model of accelerated senescence[J].Experimental Gerontology,2016,80:57-69.
[2]WANG X L,WANG W Z,LI L,et al.Oxidative stress and mitochondrial dysfunction in Alzheimer's disease[J].Biochimica et Biophysica Acta (BBA)-Molecular Basis of Disease,2014,1842(8):1240-1247.
[3]TONNIES E,TRUSHINA E.Oxidative stress,synaptic dysfunction,and Alzheimer's disease[J].Journal of Alzheimer's Disease,2017,57 (4):1105-1121.
[4]THAPA A,CARROLL N J.Dietary modulation of oxidative stress in Alzheimer's disease[J].International Journal of Molecular Sciences,2017,18 (7):1583.
[5]JIANG T F,SUN Q,CHEN S D.Oxidative stress:A major pathogenesis and potential therapeutic target of antioxidative agents in Parkinson's disease and Alzheimer's disease [J].Progress in Neurobiology,2016,147:1-19.
[6]KAMAT P K,KALANI A,RAI S,et al.Mechanism of oxidative stress and synapse dysfunction in the pathogenesis of Alzheimer's disease:Understanding the therapeutics strategies [J].Molecular Neurobiology,2016,53(1):648-661.
[7]BUTTERFIELD D A,LAUDERBACK C M.Lipid peroxidation and protein oxidation in Alzheimer's disease brain:Potential causes and consequences involving amyloid beta-peptide-associated free radical oxidative stress [J].Free Radical Biology and Medicine,2002,32(11):1050-1060.
[8]AL-AMIN M M,AKHTER S,HASAN A T,et al.The antioxidant effect of astaxanthin is higher in young mice than aged:A region specific study on brain[J].Metabolic Brain Disease,2015,30(5):1237-1246.
[9]CUI L L,XU F,WANG M K,et al.Dietary natural astaxanthin at an early stage inhibits N-nitrosomethylbenzylamine-induced esophageal cancer oxidative stress and inflammation via downregulation of NFκB and COX2 in F344 rats[J].OncoTargets and Therapy,2019,12:5087-5096.
[10]AMBATI R R,PHANG S M,RAVI S,et al.Astaxanthin:Sources,extraction,stability,biological activities and its commercial applications-A review[J].Marine Drugs,2014,12(1):128-152.
[11]FANAEE-DANESH E,GALI C C,TADIC J,et al.Astaxanthin exerts protective effects similar to bexarotene in Alzheimer's disease by modulating amyloid-beta and cholesterol homeostasis in bloodbrain barrier endothelial cells[J].Biochimica et Biophysica Acta (BBA)-Molecular Basis of Disease,2019,1865(9):2224-2245.
[12]张奕婷.虾青素对氧化应激诱导的细胞毒性的抑制作用及其机制[D].哈尔滨:哈尔滨工业大学,2014.
ZHANG Y T.Inhibitory effects of astaxanthin on oxidative stress-induced cytotoxicity and the underlined mechamisms[D].Harbin:Harbin Institute of Technology,2014.
[13]TAKSIMA T,CHONPATHOMPIKUNLERT P,SROYRAYA M,et al.Effects of astaxanthin from shrimp shell on oxidative stress and behavior in animal model of Alzheimer's disease[J].Marine Drugs,2019,17(11):628.
[14]HONGO N,TAKAMURA Y,NISHIMARU H,et al.Astaxanthin ameliorated parvalbumin-positive neuron deficits and Alzheimer's disease-related pathological progression in the hippocampus of App(NL-G-F/NL-G-F) mice[J].Frontiers in Pharmacology,2020,11:307.
[15]MEHLA J,CHAUHAN B C,CHAUHAN N B.Experimental induction of type 2 diabetes in aging-accelerated mice triggered Alzheimer-like pathology and memory deficits[J].Journal of Alzheimers Disease,2014,39(1):145-162.
[16]AKIGUCHI I,PALLAS M,BUDKA H,et al.SAMP8 mice as a neuropathological model of accelerated brain aging and dementia:Toshio Takeda's legacy and future directions[J].Neuropathology,2017,37(4):293-305.
[17]RICHARD M.Developments of a water-maze procedure for studying spatial learning in the rat[J].Journal of Neuroscience Methods,1984,11(1):47-60.
[18]KRASNOVA I N,BETTS E S,DADA A,et al.Neonatal dopamine depletion induces changes in morphogenesis and gene expression in the developing cortex[J].Neurotoxicity Research,2007,11 (2):107-130.
[19]BROMLEY-BRITS K,DENG Y,SONG W H.Morris water maze test for learning and memory deficits in Alzheimer's disease model mice[J].JoVE (Journal of Visualized Experiments),2011,20(53):2920.
[20]ZHU W L,ZHENG J Y,CAI W W,et al.Ligustilide improves aging-induced memory deficit by regulating mitochondrial related inflammation in SAMP8 mice[J].Aging,2020,12(4):3175-3189.
[21]CHE H X,LI Q,ZHANG T T,et al.Effects of astaxanthin and docosahexaenoic-acid-acylated astaxanthin on Alzheimer's disease in APP/PS1 double-transgenic mice[J].Journal of Agricultural and Food Chemistry,2018,66(19):4948-4957.
[22]AL-AMIN M M,REZA H M,SAADI H M,et al.Astaxanthin ameliorates aluminum chloride-induced spatial memory impairment and neuronal oxidative stress in mice[J].European Journal of Pharmacology,2016,777:60-69.
[23]GOULD T D,DAO D T,KOVACSICS C E.Mood and Anxiety Related Phenotypes in Mice[M].New York:Springer,2009:1-20.
[24]TATEM K S,QUINN J L,PHADKE A,et al.Behavioral and locomotor measurements using an open field activity monitoring system for skeletal muscle diseases[J].JoVE (Journal of Visualized Experiments),2014(91):51785.
[25]LI Q,WU F,WEN M,et al.The protective effect of Antarctic krill oil on cognitive fnction by inhibiting oxidative stress in the brain of senescence-accelerated prone mouse strain 8 (SAMP8) mice[J].Journal of Food Science,2018,83(2):543-551.
[26]NISHIOKA Y,OYAGI A,TSURUMA K,et al.The antianxiety-like effect of astaxanthin extracted from Paracoccus carotinifaciens[J].Biofactors,2011,37(1):25-30.
[27]CHEIGNON C,TOMAS M,BONNEFONT-ROUSSELOT D,et al.Oxidative stress and the amyloid beta peptide in Alzheimer's disease[J].Redox Biology,2018,14:450-464.
[28]RAHMAN S O,PANDA B P,PARVEZ S,et al.Neuroprotective role of astaxanthin in hippocampal insulin resistance induced by Abeta peptides in animal model of Alzheimer's disease[J].Biomedicine&Pharmacotherapy,2019,110:47-58.
[29]LAMBERT M P,BARLOW A K,CHROMY B A,et al.Diffusible,nonfibrillar ligands derived from Aβ1-42 are potent central nervous system neurotoxins[J].Proceedings of the National Academy of Sciences of the United States of America,1998,95(11):6448-6453.
[30]MECOCCI P,BOCCARDI V,CECCHETTI R,et al.A long journey into aging,brain aging,and Alzheimer's disease following the oxidative stress tracks[J].Journal of Alzheimer's Disease,2018,62(3):1319-1335.
[31]ABOU-ELELA D H,EL-EDEL R H,SHALABY A S,et al.Telomere length and 8-hydroxy-2-deoxyguanosine as markers for early prediction of Alzheimer disease[J].Indian Journal of Psychiatry,2020,62(6):678-683.
[32]CHEN Z,ZHONG C.Oxidative stress in Alzheimer's disease[J].Neuroscience Bulletin,2014,30(2):271-281.
[33]BÖHME G A,BON C,LEMAIRE M,et al.Altered synaptic plasticity and memory formation in nitric oxide synthase inhibitor-treated rats[J].Proceedings of the National Academy of Sciences of the United States of America,1993,90(19):9191-9194.
[34]KOPPAL T,DRAKE J,YATIN S,et al.Peroxynitrite-induced alterations in synaptosomal membrane proteins:Insight into oxidative stress in Alzheimer's disease[J].Journal of Neurochemistry,1999,72(1):310-317.
[35]LIN M T,BEAL M F.Mitochondrial dysfunction and oxidative stress in neurodegenerative diseases[J].Nature,2006,443(7113):787-795.
[36]NUNOMURA A,PERRY G,ALIEV G,et al.Oxidative damage is the earliest event in Alzheimer disease[J].Journal of Neuropathology and Experimental Neurology,2001,60(8):759-767.
[37]崔广同,邱小亮,任胜杰,等.磷脂对日本沼虾虾青素沉积和利用的影响[J].动物营养学报,2019,31(11):5133-5141.
CUI G T,QIU X L,REN S J,et al.Effects of phospholipid on astaxanthin deposition and utilization of Macrobrachium nipponense[J].Chinese Journal of Animal Nutrition,2019,31(11):5133-5141.
[38]钟妮.茶叶中EGCG 抑制蛋白集聚物形成延缓早老痴呆进程的功效研究[D].长沙:湖南农业大学,2016.
ZHONG N.Early intervention to stave off the progression of age-related neurodegenerative alterations:EGCG inhibit abnormal protein aggregates formation in vitro and in vivo[D].Changsha:Hunan Agricultural University,2016.
[39]杨艳,周宇红,徐海滨,等.虾青素抗氧化作用动物实验研究[J].现代预防医学,2009,36(13):2432-2433.
YANG Y,ZHOU Y H,XU H B,et al.Study on the antioxygenation of astaxanthin in mice[J].Modern Preventive Medicine,2009,36(13):2432-2433.
[40]李勇超,贺青华,刘瑞雪,等.雨生红球藻源虾青素对糖尿病小鼠的降糖作用及其机制[J].食品工业科技,2016,37(24):355-359.
LI Y C,HE Q H,LIU R X,et al.Effects of Haematococcus pluvialis astaxanthin on diabetes mice for decreasing blood glucose and its mechanisms[J].Science and Technology of Food Industry,2016,37(24):355-359.