营养是影响婴幼儿成长发育的重要环境因素之一,生命早期1 000 d 营养状态影响一生的健康[1]。世界卫生组织(WHO)推荐0~6月婴儿纯母乳喂养,母乳喂养的婴幼儿发育水平也成为WHO建议的孩子发育标准[2-4]。断乳期是从完全母乳喂养到充分利用家庭食物的过渡时期,也是婴幼儿成长发育的关键时期[5]。对于继续母乳喂养的7~12月龄婴儿,其所需要的部分能量,以及99%的铁、75%的锌、80%的维生素B6、50%的维生素C等必须从添加的辅食中获得[6-7]。肠道菌群与人的生长发育、健康情况息息相关,断乳期是肠道菌群构建的关键时期。最初,婴儿肠道菌群多样性差,辅食的添加会引起肠道菌群发生巨大改变并逐渐趋于稳定,接近成人[8]。研究营养干预对了解断乳期婴幼儿生长发育影响十分重要。
鉴于婴幼儿的脆弱敏感性以及调查的(伦理学)难度,几乎没有对健康婴幼儿的营养干预性研究。对于婴幼儿营养摄入的了解主要依赖于一些观察性研究,如不同喂养方式下的婴幼儿生长发育研究。无菌动物(Germ free animal,GF 动物)作为微生物背景最清晰的动物,可有效进行菌群、基因及其它环境因素的控制,是研究肠道菌群对人类疾病及健康影响的最有效的动物模型[9]。利用无菌动物构建携带断乳期婴儿肠道菌群的人源菌群动物(Human floral-associated animal,HFA 动物),可为饮食干预对肠道菌群的影响提供一个有效的模型。本文搭建了断乳期人源菌群小鼠模型,并验证人源菌群对小鼠大脑、肠道发育及免疫等相关指标的影响,为后续针对断乳期婴幼儿营养干预性研究提供参考。
1 材料与方法
1.1 试验材料与试剂
1.1.1 实验动物 昆明GF 小鼠,10~15 g,18 只,华中农业大学实验动物中心,许可证号:SYXK(鄂)2015-0084。
1.1.2 菌群来源 粪便样本来源于顺产母乳喂养且未接受过抗生素治疗及服用益生菌类产品的6月龄健康女婴,粪样以每管200 mg 装入无菌EP管中,装若干管,液氮速冻,-80 ℃保存。
1.1.3 试剂 E.Z.N.A.® Soil DNA Kit 抽提试剂盒,美国Omega Bio-Tek 公司;小鼠胰岛素样生长因子-1 (Insulin-like growth factor-1,IGF-1)ELISA 试剂盒,中国联科生物公司;小鼠胰岛素样生长因子结合蛋白-3(In-sulin-like growth factor binding protein-3,IGFBP-3)ELISA 试剂盒,美国RD 公司;C10∶0 脂肪酸 (Fatty acid,FA)、C16∶0 FA、C17∶0 FA、C18∶0 FA、C18∶1 FA 标品,美国Sigma 公司;甲醇、二氯甲烷、乙酰氯、正己烷、乙腈、正庚烷(色谱纯级),天津市康科德公司;无水硫酸钠、碳酸钾、丁羟甲苯(分析纯级),阿拉丁试剂(上海)有限公司;MRS 培养基,北京陆桥技术股份有限公司。
1.2 仪器与设备
无菌隔离器,华中农业大学;CP21GⅡ高速冷冻离心机,日立公司;超净工作台,新加坡ESCO公司;超低温冰箱、HM325 石蜡切片机,美国Thermo 公司;PPTHK-21B 摊片烤片机、PPDB-21C电脑程控组织包埋机,襄樊徕克生物电子仪器厂;ECLIPSE 显微镜,美国尼康公司;K3 酶标仪,上海欧颖实验设备有限公司;MX-S 可调式混匀仪,美国SCILOGEX 公司;I-Class 高效液相色谱,美国Waters 公司;TARGA C18 色谱柱 (20 mm×2.1 mm,5.0 μm),美国Higgins Analytical 公司;SCIEX QTRAP 4500 液质质联用仪,美国AB SCIEX 公司;电子秤,梅特勒公司;ABI GeneAmpR 9700 型PCR 仪,美国ABI 公司。
1.3 方法
1.3.1 实验方案 将1 周龄无菌仔鼠 (体质量10~15 g)及对应母鼠随机置于2 台隔离器中(每台隔离器9 只仔鼠),分别用于建立人源肠道菌群模型(HMC)和无菌小鼠模型(GFC)。实验周期为7周,仔鼠3 周龄断乳后与母鼠分离,实验期间小鼠在无菌隔离器中随意进食(基础日粮)和饮水,控制温度在(23±2)℃,保持相对湿度在(55±5)%之间,12 h 明暗交替周期,如图1所示。本研究的动物实验方案获得华中农业大学实验动物福利伦理审查委员会批准 (批准编号:HZAUMO-2020-0054),并且严格按照华中农业大学实验动物福利伦理审查委员会的管理要求进行实验操作。
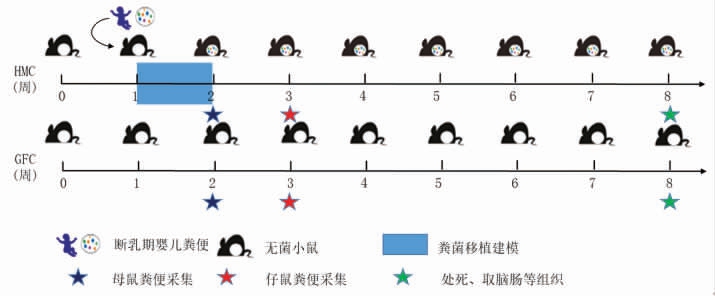
图1 实验方案图
Fig.1 Schematic of experimental design
菌群移植步骤如下:取1 管200 mg 断乳期婴儿粪便样本,于37 ℃水浴快速复苏,然后转入无菌小鼠隔离器内,加2 mL 无菌生理盐水摇匀至无明显大颗粒,静置5 min 取上清液灌胃;每只母鼠(产后1 周的母鼠)灌胃0.2 mL;灌胃后,将剩余菌液上清均匀涂抹至母鼠腹部乳头及1 周龄仔鼠全身;每天按上述操作步骤进行一次灌胃与涂抹,连续1 周,将小鼠粪便进行革兰氏染色,并使用MRS 培养基厌氧培养,根据检测结果评价模型构建是否成功。
建模成功后,每隔2 周测量小鼠体质量1 次。收集产后2 周母鼠及3 周龄仔鼠粪便样本,-80℃保存。8 周龄时,小鼠禁食12 h,称取动物体质量后,采用眼球取血法采集每只小鼠血液1.5 mL,颈椎脱臼法处死小鼠。将所得血液室温放置40 min以上,3 500 r/min 离心10 min,取上层血清于新的EP 管中,-80 ℃保存。
按以下步骤取小鼠组织样本:解剖小鼠,取完整脑组织,手术刀分为两半,一半最佳切削温度(Optimal cutting temperature,OCT) 包埋,-80 ℃保存;另一半福尔马林固定,室温保存。取肝脏,放入冻存管,立即液氮速冻,随后转移至-80 ℃保存。取结肠,PBS 清洗,福尔马林固定,室温保存。
1.3.2 粪便中菌群组成的测定
1.3.2.1 DNA 抽提和PCR 扩增 根据说明书进行微生物群落总DNA 抽提;使用338F ((5'-ACTCCTACGGGAGGCAGCAG-3') 和806R (5'-GGACTACHVGGGTWTCTAAT-3') 对16S rRNA基因V3-V4 可变区进行PCR 扩增。
1.3.2.2 Illumina Miseq 测序 利用Illumina 公司的Miseq PE300 平台进行测序(上海美吉生物医药科技有限公司)。
1.3.2.3 数据处理 使用fastp (version 0.20.0)[10]软件对原始测序序列进行质控,使用FLASH(version 1.2.7)[11] 软件进行拼接。使用UPARSE(version 7.1)[12]软件,根据97%[12-13]的相似度对序列进行OTU 聚类并剔除嵌合体。利用RDP classifier(version 2.2)[14]对每条序列进行物种分类注释,比对Silva 16S rRNA 数据库(version 138),设置比对阈值为70%。
1.3.3 海马组织和结肠组织HE 染色病理检测
1.3.3.1 组织包埋 将用福尔马林固定好的组织放入包埋盒,浸入70%酒精,过夜;按照80%乙醇、95%乙醇Ⅰ、95%乙醇Ⅱ、100%乙醇Ⅰ、100%乙醇Ⅱ、100%乙醇+二甲苯(1∶1)、二甲苯Ⅰ、二甲苯Ⅱ、石 蜡Ⅰ(54~56 ℃)、石 蜡Ⅱ(56~58 ℃)、石 蜡Ⅲ(58~60 ℃)顺序对组织进行处理。
1.3.3.2 组织切片 将组织进行连续切片(3 μm),64 ℃烤片30 min,于室温保存。
1.3.3.3 HE 染色 将组织切片进行脱蜡水化;随后用苏木精染色15 min,自来水洗,盐酸酒精分化2 s,自来水返蓝15 min,镜下观察反蓝程度;伊红染色3 min;放入100%酒精Ⅰ5 min,100%酒精Ⅱ5 min,二甲苯Ⅰ10 min,二甲苯Ⅱ10 min;最后使用中性树胶进行封片(封片过程中应避免气泡的产生);显微镜下观察,并进行拍照。
1.3.4 血清、肝脏IGF-1 与IGFBP-3 含量测定 采用夹心ELISA 方法检测。将包被抗原与固相载体联结,形成固相抗原。洗涤除去未结合的抗原及杂质,加待测样品,样品与固相抗原结合,形成固相抗原抗体复合物;然后加酶标记抗体,固相免疫复合物上的抗体与酶标抗体结合。加底物显色,固相上的酶催化底物成为有色产物。加入终止液终止显色反应并于波长450 nm 处读取OD 值。
1.3.5 大脑脂肪酸含量的测定
1.3.5.1 脑样本制备 将大脑样品制备成匀浆液,质量浓度为100 mg/mL。取100 μL 匀浆液置于1.5 mL EP 管中;加入400 μL 正己烷,涡旋1 min,10 000×g 离心10 min。取上清液250 μL 旋干,加1 mL 甲醇复溶,涡旋3 min,取上清800 μL 于液相小瓶中用于LC-ESI MS 检测FA。
1.3.5.2 色谱条件 TARGA C18 色谱柱(20 mm×2.1 mm,5.0 μm),流动相为A(水,含5 mmol/L 乙酸铵)和B(乙腈),等度洗脱(0~10 min,30%A)。流速为0.2 mL/min,柱温为35 ℃,进样量为5 μL,样品盘温度为4 ℃。
1.3.5.3 质谱条件 离子源为ESI 源,检测模式为负离子检测模式,气帘气(CUR)172 kPa,碰撞气(CAD)中等,离子源气1(GS1)310 kPa,离子源气2(GS2)345 kPa,电喷雾电压-4 500 V,加热器温度350 ℃,碰撞电压 (CE)-5 V,滞留时间35 ms。
小鼠大脑不同脂肪酸的LC-Qtrap MS 检测条件见表1。
表1 FA 的LC-Qtrap MS 检测条件
Table 1 LC-Qtrap MS detection conditions for FA
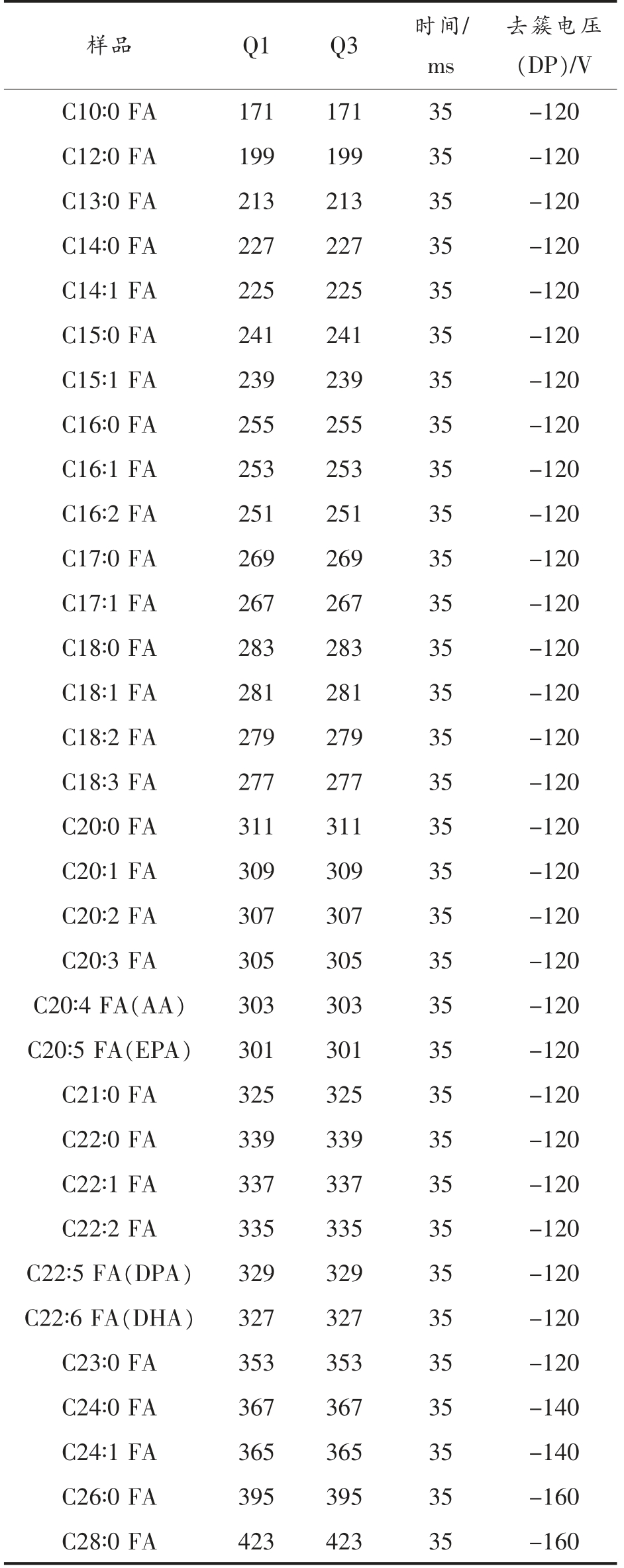
注:AA.二十碳四烯酸 (Arachidonic acid);EPA.二十碳五烯酸(Eicosapentaenoic acid);DHA.二十二碳六烯酸(Docosahexenoic acid);DPA.二十二碳五烯酸 (Docosapentaenoic acid);Q1.四级杆1;Q3.四级杆3。
样品 Q1 Q3 时间/ms去簇电压(DP)/V C10∶0 FA 171 171 35-120 C12∶0 FA 199 199 35-120 C13∶0 FA 213 213 35-120 C14∶0 FA 227 227 35-120 C14∶1 FA 225 225 35-120 C15∶0 FA 241 241 35-120 C15∶1 FA 239 239 35-120 C16∶0 FA 255 255 35-120 C16∶1 FA 253 253 35-120 C16∶2 FA 251 251 35-120 C17∶0 FA 269 269 35-120 C17∶1 FA 267 267 35-120 C18∶0 FA 283 283 35-120 C18∶1 FA 281 281 35-120 C18∶2 FA 279 279 35-120 C18∶3 FA 277 277 35-120 C20∶0 FA 311 311 35-120 C20∶1 FA 309 309 35-120 C20∶2 FA 307 307 35-120 C20∶3 FA 305 305 35-120 C20∶4 FA(AA) 303 303 35-120 C20∶5 FA(EPA) 301 301 35-120 C21∶0 FA 325 325 35-120 C22∶0 FA 339 339 35-120 C22∶1 FA 337 337 35-120 C22∶2 FA 335 335 35-120 C22∶5 FA(DPA) 329 329 35-120 C22∶6 FA(DHA) 327 327 35-120 C23∶0 FA 353 353 35-120 C24∶0 FA 367 367 35-140 C24∶1 FA 365 365 35-140 C26∶0 FA 395 395 35-160 C28∶0 FA 423 423 35-160
1.3.5.4 FA 标准曲线的绘制 分别精密称取FA标准品(C17∶0 FA)适量溶于甲醇溶液,配成浓度为10 mmol/L 的母液。取适量FA 母液混合,甲醇逐级稀释为50,25,10,2,0.4,0.08 μmol/L 和0.016 μmol/L 的混合标准品溶液,按照上面的液质检测条件进行质谱检测。以FA 标准品含量为横坐标,峰面积为纵坐标,绘制工作曲线,为样品中FA 的定量检测建立标准曲线。
1.3.6 统计学分析 在本研究中,所有试验均独立重复至少3 次,以平均值±标准方差的形式表示结果。各组数据均通过SPSS 17.0 软件进行单因素方差分析(One-way ANOVA),显著性分析有Duncan's 检验得到。P<0.05 表明结果在统计学上具有显著性差异。
2 结果与分析
2.1 小鼠模型菌群定值效果评估
2.1.1 3 周龄小鼠粪便初步评估 将3 周龄小鼠粪便进行革兰氏染色镜检,如图2所示。
从图2可以看出,GFC 组小鼠粪便镜检为无菌,HMC 组小鼠粪便镜检显示为阳性。表明无菌小鼠模型(GFC)肠道中无活体微生物。
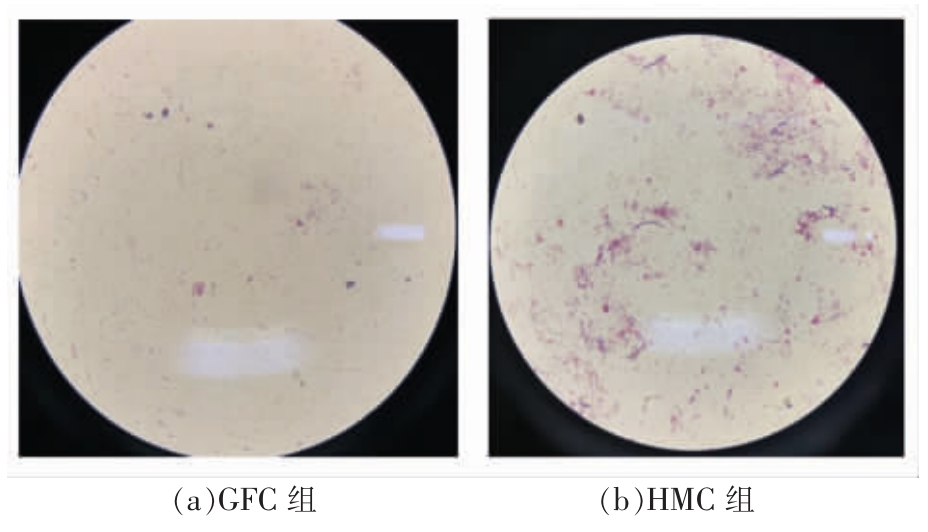
图2 3 周龄小鼠粪便革兰氏染色
Fig.2 Gram staining of feces of mice aged 3 weeks
HMC 小鼠粪便经MRS 培养基厌氧培养24 h后,结果如图3所示。

图3 HMC 组3 周龄小鼠粪便中双歧杆菌培养结果
Fig.3 Culture results of Bifidobacteria in feces of 3-weeks-old mice in HMC group
从图3可以看出,HMC 组小鼠粪便中存在双歧杆菌。双歧杆菌作为婴儿肠道菌群的代表菌株之一,该结果初步表明断乳期人源小鼠模型搭建成功。
2.1.2 菌群组成分析 从图4可以看出,母乳喂养的6月龄婴儿肠道菌群以双歧杆菌为优势菌,同时发现大肠杆菌、瘤胃球菌、肠球菌、韦荣球菌等。而菌群移植1 周后母鼠及9 只3 周龄断乳模型小鼠肠道菌群中以大肠杆菌、亨盖特拉菌、瘤胃球菌为主体,伴有双歧杆菌、肠球菌、韦荣球菌等。对比发现断乳期婴儿、菌群移植1 周后母鼠及9只3 周龄断乳模型鼠肠道菌群组成在属水平有一定的相似度,特别是双歧杆菌作为婴儿肠道菌群的代表微生物在小鼠肠道的定植,说明人源菌群移植成功,断乳期人源菌群小鼠搭建成功,能够部分模拟断乳期婴儿肠道菌群。
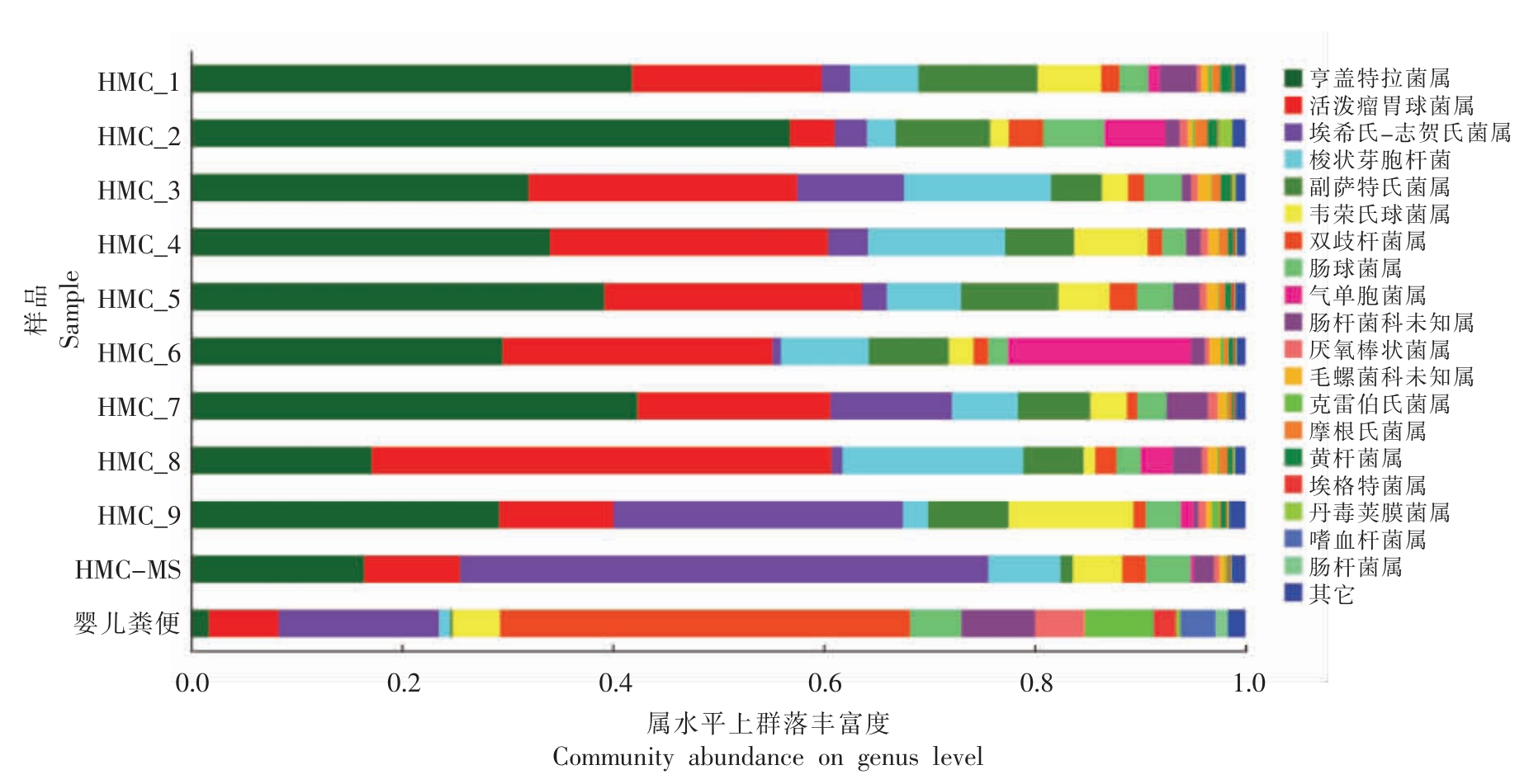
图4 断乳期婴儿、母鼠和断乳模型鼠属水平菌群组成
Fig.4 The microbial composition of weaning infants,mother mice and weaned model mice at the genus level
2.2 小鼠体质量
从表2可以看出,2 个小鼠模型体质量随饲养时间延长逐渐升高。采用SPSS 17.0 数据处理软件进行统计学分析,组间均数比较采用t 检验。结果显示,不同模型小鼠在不同饲养时期,组间无显著差异,说明肠道菌群的移植不影响小鼠体质量增长。实验期间,各模型小鼠健康状况良好,无腹泻、增肥等不良现象,未发现小鼠有中毒或自然死亡。
表2 小鼠体质量变化(n=9)
Table 2 The change of body weight in mice (n=9)

?
2.3 小鼠大脑发育
2.3.1 小鼠海马CA1 区形态结构 从图5可以看出,小鼠海马CA1 区神经元细胞形态有明显差异。HMC 组细胞排列紧密,细胞边缘清晰,细胞内核体着色深且很清楚;而在GFC 组中,细胞边缘模糊,细胞大,核体小,着色不清晰,这说明HMC组较GFC 组小鼠脑细胞生长旺盛,更有活力。此外,神经元突触间隙也有明显差异。在图5中,HMC 组箭头所指神经元突触间隙在单位空间内的数量明显多于GFC 组箭头所指的数量,且HMC组的突触发育良好,突触长度和密度都有明显优于GFC 组的趋势,这也表明HMC 组小鼠大脑海马组织神经元细胞比GFC 组神经元细胞具有活力、年轻、延缓衰老的特征。以上均说明肠道菌群对小鼠海马CA1 区发育影响显著。
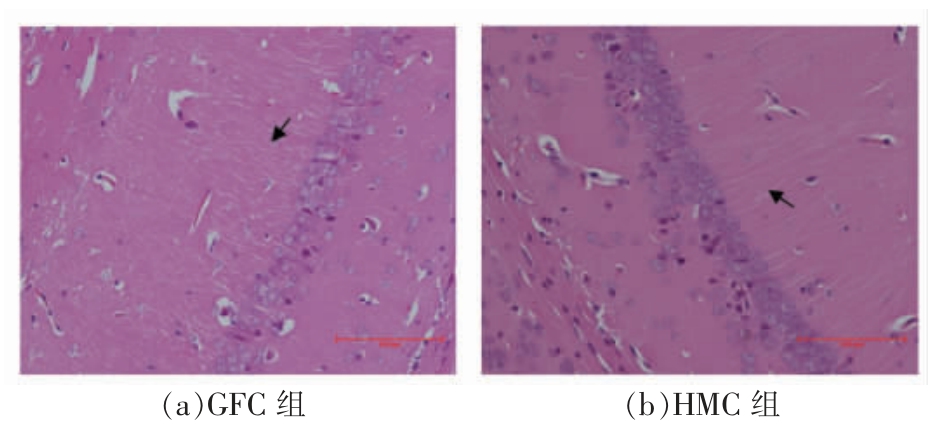
图5 小鼠海马CA1 区HE 染色
Fig.5 HE staining of hippocampal CA1 region in mice
注:标尺为100 μm。
2.3.2 小鼠大脑脂肪酸含量 从图6可以看出,两模型小鼠大脑中的脂肪酸含量存在区别。其中HMC 组的单不饱和脂肪酸C16∶1(P<0.001)、C18∶1(P < 0.01)和多不饱和脂肪酸C18∶3(P < 0.05)、C20∶3(P<0.01)、C20∶4(P<0.001)、C22∶5(P<0.05)、C22∶6(P<0.01)含量较GFC 组显著降低。饱和脂肪酸、部分不饱和脂肪酸 (C14∶1、C15∶1、C18∶2、C20∶5、C22∶1)含量组间差异均不显著。DHA(C22∶6)和AA(C20∶4)是大脑中主要的长链多不饱和脂肪酸,DHA、AA 和EPA(C20∶5)及其衍生物参与脑细胞的形成和发育,促进神经蛋白合成及神经细胞生长,对神经细胞轴突的延伸和新突触的形成有重要作用,并参与大脑思维和记忆形成过程[15]。由上文可知,在营养摄入相同的情况下,植入婴儿肠道菌群的HMC 组小鼠大脑发育效果明显高于GFC 组,而HMC 组小鼠大脑中多链不饱和酸含量明显低于GFC 组,可能是由于小鼠大脑发育过程中消耗大量多链不饱和脂肪酸导致的。

图6 小鼠大脑脂肪酸含量(n=6)
Fig.6 Brain fatty acid content in mice (n=6)
注:*.表示组间差异显著(P <0.05);**.表示组间差异极显著(P <0.01);***.表示组间差异极极显著(P <0.001),下同。
2.4 小鼠结肠发育
小肠的肠绒毛高度是衡量小肠消化吸收功能的重要指标。从图7可以看出,两个小鼠模型结肠组织的黏膜上皮结构完整清晰,腺体排列整齐,无炎症细胞浸润,其中HMC 小鼠肠内绒毛发育水平和高度要优于GFC 组。可能是由于断奶应激对小鼠肠黏膜形态有很大的影响,包括绒毛萎缩、高度下降、隐窝加深,肠绒毛上皮成熟细胞数量减少,分泌细胞(杯状细胞)增多,吸收能力下降[16]。移植人源菌群中的双歧杆菌等益生菌能够促进受损肠黏膜细胞的修复,使得肠绒毛高度增加,隐窝变浅。

图7 小鼠结肠组织HE 染色
Fig.7 HE staining of colon tissue sections in mice
注:标尺为50 μm。
2.5 小鼠免疫性能
小鼠肝脏IGF-1、IGFBP3 含量检测结果,如图8所示。
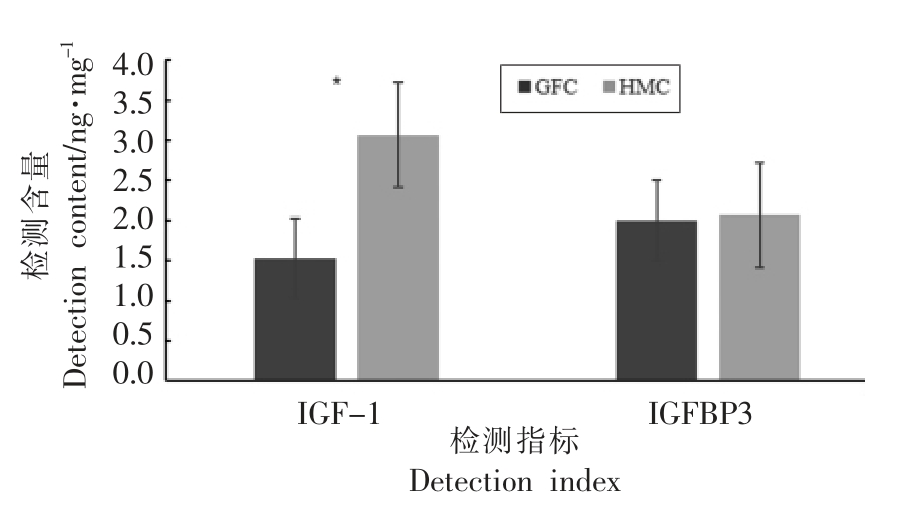
图8 肝脏中IGF-1、IGFBP3 含量检测结果
Fig.8 The determination results of liver IGF-1 and IGFBP3 content
由图8可以看出,HMC 组肝脏中的IGF-1 含量显著高于GFC 组(P<0.05),表明菌群移植能够明显提高小鼠肝脏中的IGF-1 含量。HMC 组肝脏中的IGFBP3 含量与GFC 组差异不显著。
小鼠血清IGF-1、IGFBP3 检测结果,如图9和10所示。
由图9和10 可以看出,HMC 组血清中的IGF-1 含量显著高于GFC 组(P<0.05),表明菌群移植能够明显提高小鼠血清中的IGF-1 含量。HMC 组血清中的IGFBP3 含量与GFC 组差异不显著。
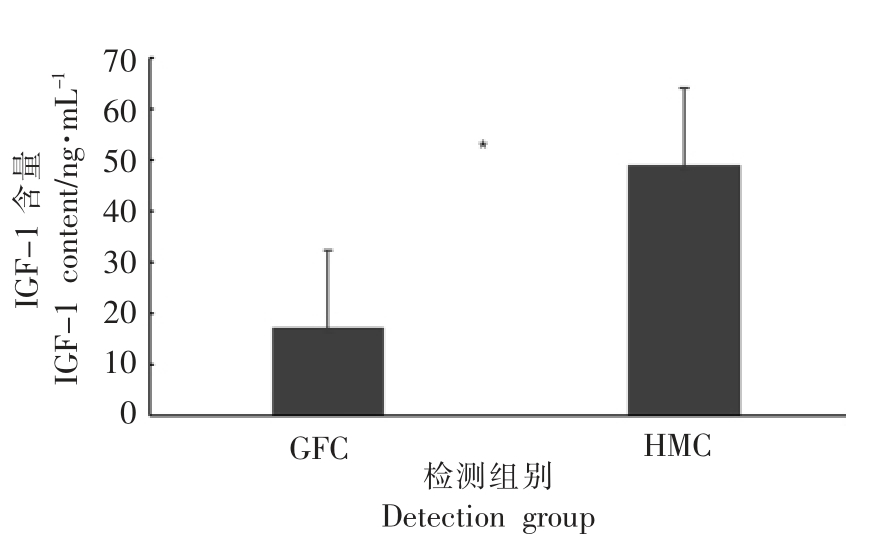
图9 血清中IGF-1 含量检测结果
Fig.9 The determination results of serum IGF-1 content
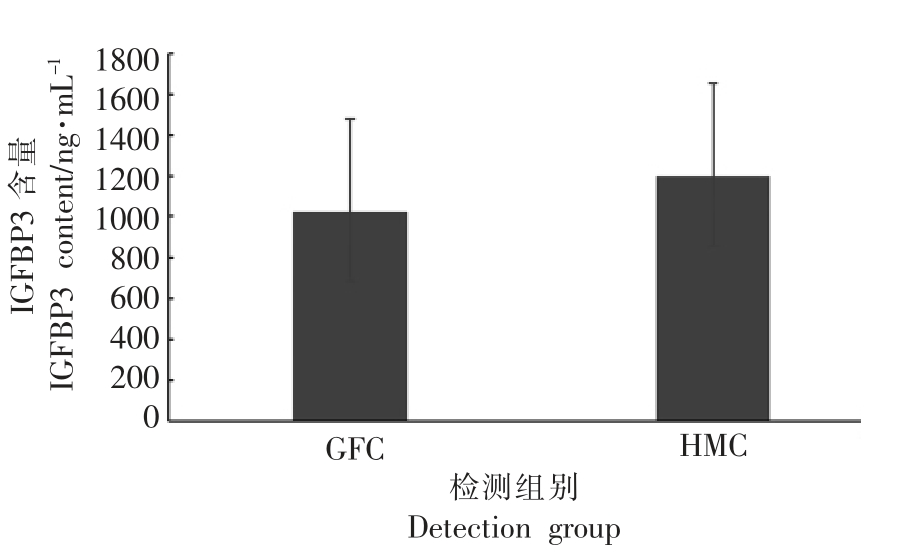
图10 血清中IGFBP3 含量检测结果
Fig.10 The determination results of serum IGFBP3 content
IGF-1 具有促进淋巴组织增生、调节T 细胞生长、分化和效应完成、控制胸腺素功能等免疫调节作用,上述结果表明肠道菌群可以显著影响宿主的免疫能力[17]。
3 结论
将断乳期婴儿肠道菌群移植至无菌昆明小鼠建立断乳期人源菌群小鼠模型,与无菌小鼠模型进行对比,评价人源菌群移植对小鼠大脑、肠道发育及免疫等相关指标的影响。结果显示:断乳期人源菌群小鼠健康状况良好,能够部分模拟断乳期婴儿肠道菌群;肠道菌群对小鼠大脑、结肠发育及免疫性能等相关指标有显著影响。断乳期人源菌群模型的建立,为断乳期婴儿肠道菌群对宿主生理功能的影响、代谢性疾病发生、药物代谢等研究领域提供了有效的动物模型。
[1]SARAH J S,MICHAEL K G.Advocacy for improving nutrition in the first 1 000 days to support childhood development and adult health[J].Pediatrics,2018,141(2):e20173716.
[2]World Health Organization.UNICEF.Global strategy for infant and young child feeding[M].Geneva:WHO,2003:7-16.
[3]World Health Organization.Infant and young child feeding:Model chapter for textbooks for medical students and allied health professionals[M].Geneva:WHO,2009:3-10.
[4]World Health Organization.Guiding principles for complementary feeding of the breastfed child [M].Geneva:WHO,2003:5-17.
[5]World Health Organization.Guiding principles for feeding non-breastfed children 6-24 months of age[M].Geneva:WHO,2005:4-19.
[6]KATHRYN G D.The challenge of meeting nutrient needs of infants and young children during the period of complementary feeding:An evolutionary per spective[J].The Journal of Nutrition,2013,143(12):2050-2054.
[7]FEREIDOUN A,PETER S.Breastfeeding and maternal and infant iodine nutrition[J].Clin Endocrinol(Oxf),2009,70(5):803-809.
[8]郑跃杰.婴幼儿肠道菌群和益生菌新进展[M].北京:人民卫生出版社,2017:36-43.
ZHENG Y J.Research progress of intestinal flora and probiotics in infants and young children [M].Beijing:People's Medical Publishing House,2017:36-43.
[9]曾本华,魏泓.无菌动物与微生态学专题教学改革实践[J].中国微生态学杂志,2017,29(3):354-356.
ZENG B H,WEI H.Innovative teaching of "Germfree animal and microecology"[J].Chinese Journal of Microecology,2017,29(3):354-356.
[10]CHEN S F,ZHOU Y Q,CHEN Y R,et al.fastp:An ultra-fast all-in-one FASTQ preprocessor[J].Bioinformatics,2018,34(17):i884-i890.
[11]MAGOCˇ T,SALZBERG S L.FLASH:Fast length adjustment of short reads to improve genome assemblies[J].Bioinformatics,2011,27(21):2957-2963.
[12]EDGAR R C.UPARSE:Highly accurate OTU sequences from microbial amplicon reads[J].Nat Methods,2013,10(10):996-998.
[13]STACKEBRANDT E,GOEBEL B M.Taxonomic note:A place for DNA-DNA reassociation and 16S rRNA sequence analysis in the present species definition in bacteriology[J].International Journal of Systematic Bacteriology,1994,44(4):846-849.
[14]WANG Q,GARRITY G M,TIEDJE J M,et al.Naive bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy[J].Appl Environ Microbiol,2007,73(16):5261-5267.
[15]MATHIEU D M,CLEMENGINE B B,SOPHIE L.PUFA and their derivatives in neurotransmission and synapses:A new hallmark of synaptopathies[J].Proc Nutr Soc,2020,79(4):388-403.
[16]NABUURS M J,HOOGENDOOM A,VANDERMOOLEN E J,et al.Villus height and crypt depth in weaned and unweaned pigs,reared under various circumstances in the Neherlands[J].Res Vet Sci,1993,55(1):78-84
[17]SPADARO O,CAMELL C D,BOSURGI L,et al.IGF1 shapes macrophage activation in response to immunometabolic challenge[J].Cell Rep,2017,19(2):225-234.