番薯【Ipomoea batatas (L.) Lam.】,又名红薯、甘薯、甜薯等,属管状花目旋花科植物,是一种高产且适应能力强的粮食作物,在世界各地区广泛种植[1]。传统番薯品种主要以块根作为食用部分,其茎叶常被作为畜禽饲料或者废弃,造成资源浪费。近年来随着叶菜型番薯市场份额的不断扩大,对叶菜型番薯的研究也越来越多[2]。番薯叶具有很高的食用价值,口感脆嫩,营养丰富[3],且具有多种医疗保健功能,备受人们的关注与喜爱。罗丹等[4]通过对西蒙1 号甘薯研究发现其茎叶多酚具有降血糖功效。吴忆微等[5]研究表明红薯叶富含绿原酸、多糖、多肽、黄酮等多种功效成分,具有抗肿瘤的功效。
多酚在植物食品中广泛存在,主要包括酚酸、类黄酮、花色苷类等化合物[6],是植物自身次生代谢而产生的一类酚羟基化合物。多酚结构多样,除了优良的抗氧化活性[7],还具有其它多种生物活性。例如:降血糖[8]、抑菌[9]、降血脂[10]、抗炎[11]、防治阿尔茨海默病[12]等。番薯叶中多酚含量较为丰富,目前有部分研究报道番薯叶多酚的提取工艺[13-14],然而番薯品种繁多,种植地区广泛以及提取方法不同,番薯叶多酚的提取量有明显的差异。超声波辅助提取设备简单、操作简便提取得率高,广泛应用于植物活性成分的提取[15-16]。
本文针对浙菜薯726,采用超声辅助提取研究番薯叶多酚提取的优化工艺,分析最佳提取条件下番薯叶多酚的体外抗氧化能力及对α-淀粉酶和α-葡萄糖苷酶的抑制能力,初步探究番薯叶多酚的体外降糖能力,为菜叶番薯的开发利用提供参考。
1 材料与方法
1.1 材料与试剂
番薯叶,品种为浙菜薯726,来自浙江省农业科学院作物与核技术利用研究所薯类育种与栽培研究室,冷冻干燥后,超微粉碎备用。
无水乙醇、冰乙酸、氯化铁、酒石酸钾钠、氢氧化钠、3,5-二硝基水杨酸、结晶酚、亚硫酸钠、可溶性淀粉、磷酸氢二钠、磷酸二氢钠、二甲基亚砜(DMSO)、碳酸钠,中国药品生物制品检定所;色谱级甲酸、甲醇,阿拉丁试剂(上海)有限公司;福林酚试剂、1,1-二苯基-2-三硝基苯肼(DPPH)、2,4,6-三吡啶基三嗪 (TPTZ)、奎诺二甲基丙烯酸酯(Trolox),美国sigma 公司;没食子酸、3-咖啡酰奎宁酸、4-咖啡酰奎宁酸、5-咖啡酰奎宁酸、3,4-咖啡酰奎宁酸、3,5-咖啡酰奎宁酸、4,5-咖啡酰奎宁酸、3,4,5-三咖啡酰奎宁酸、α-淀粉酶、α-葡萄糖苷酶、4-硝基苯基-β-D-吡喃葡萄糖苷(PNPG),上海源叶生物科技有限公司。
1.2 设备与仪器
SCIENTZ-18N 冷冻干燥机,宁波新芝生物科技股份有限公司;KQ5200DE 数控超声波清洗器,昆山市超声仪器有限公司;RE-52AA 旋转蒸发仪,上海亚荣生化仪器厂;HH-1 数显恒温水浴锅,上海力辰邦西仪器科技有限公司;Spectramax190 酶标仪,美谷分子仪器有限公司。
1.3 试验方法
1.3.1 番薯叶多酚提取 称取1 g 番薯叶冻干粉末,按一定料液比加入不同体积分数的乙醇提取液,在一定温度下超声辅助提取,提取完成后5 000 r/min 离心15 min,取上清液定容至25 mL,得样品溶液备用。
1.3.2 番薯叶多酚的测定 番薯叶多酚测定采用福林酚法,以没食子酸为标准品,准确称取0.04 g没食子酸,用10 mL 乙醇溶解,用水定容至100 mL,得400 mg/L 没食子酸标准溶液,分别取1,2,3,4,5,6 mL 定容至10 mL,得40,80,120,160,200,240 mg/L 没食子酸标准溶液,分别吸取没食子酸与番薯叶提取液,加入1 mL 福林酚试剂,充分震荡后静置3~4 min,再分别加入5 mL 7.5%碳酸钠溶液,用蒸馏水定容至25 mL,混匀,40 ℃水浴30 min,以空白试剂调零,于波长765 nm 处测定吸光值,以吸光值为纵坐标,没食子酸质量浓度为横坐标,绘制标准曲线。多酚含量计算按下式,结果表示为mg GAE/g:
式中,m1——从标曲中查得的没食子酸的含量,mg;V1——提取液总体积,mL;V——测量时所取样品体积,mL;m——样品质量,g。
1.3.3 单因素实验
1.3.3.1 乙醇体积分数(A)对多酚提取的影响选取料液比1∶20(称取1 g 番薯叶冻干粉,加入提取液20 mL),分别用40%,50%,60%,70%,80%,90%和100%的乙醇进行提取,在50 ℃下,超声辅助提取30 min。提取时间到后,5 000 r/min 离心15 min,取上清液定容至25 mL,取定容后的液体测定多酚的含量。
1.3.3.2 提取温度(B)对多酚提取的影响 选取料液比1∶20(称取1 g 番薯叶冻干粉,加入提取液20 mL),分别在30,40,50,60,70,80 ℃下,用80%乙醇进行超声辅助提取30 min。提取时间到后,5 000 r/min 离心15 min,取上清液定容至25 mL,取定容后的液体测定多酚的含量。
1.3.3.3 料液比(C)对多酚提取的影响 选取料液比1∶5,1∶10,1∶15,1∶20,1∶25,1∶30 (称取1 g番薯叶冻干粉,分别加入提取液5,10,15,20,25,30 mL),用80%乙醇在50 ℃下,超声辅助提取30 min。提取时间到后,5 000 r/min 离心15 min,,取上清液定容至25 mL,取定容后的液体测定多酚的含量。
1.3.3.4 提取时间(D)对多酚提取的影响 选取料液比1∶20(称取1 g 番薯叶冻干粉,加入提取液20 mL) 用80%乙醇,在50 ℃下,超声辅助提取10,20,30,40,50,60 min。提取时间到后,5 000 r/min 离心15 min,取上清液定容至25 mL 并测定多酚含量。
1.3.4 Box-Behnken 响应面优化 以单因素实验结果为基础,采用Box-Behnken 中心组合试验设计原理进行番薯叶多酚提取的优化设计试验。以番薯叶多酚的含量为响应值,进行四因素三水平的响应面分析(表1)。
表1 四因素三水平的响应面分析表
Table 1 The four-factor,three-level response surface analysis table
?
1.3.5 番薯叶多酚主要成分鉴定 采用高效液相色谱法测定番薯叶多酚含量[17],色谱条件:色谱柱:ZORBAX SB-C18 分析柱(4.6 mm×250 mm,5 μm);流动相:0.1%甲酸水溶液(A)和甲醇(B);进样速度:1 mL/min;进样体积:10 μL;柱温:35 ℃;梯度洗脱程序:0~6 min,10%~25% B;6~15 min,25% ~35% B;15 ~23 min,35% ~40% B;23 ~30 min,40%~80% B;30~34 min,80%~100% B;34~38 min,100%~10% B;38~45 min,10% B;检测波长:320 nm。番薯叶多酚采用外标法定量。
1.3.6 番薯叶多酚抗氧化能力的测定 根据响应面法分析确定的番薯叶多酚的最佳提取工艺对番薯叶多酚进行提取,提取液经浓缩并冷冻干燥,得到番薯叶多酚冻干粉。将该冻干粉配制成不同质量浓度的番薯叶多酚溶液,配制质量浓度分别为125,250,500,1 000,2 000,4 000 μg/mL 的番薯叶多酚溶液,对其进行DPPH 自由基清除能力、FRAP 总还原能力测定,测定方法参照文献[18]略作修改。
1.3.7 番薯叶多酚体外降糖试验 根据响应面法分析确定的番薯叶多酚的最佳提取工艺对番薯叶多酚进行提取,提取液经浓缩并冷冻干燥,得到番薯叶多酚冻干粉。将该冻干粉配制成不同质量浓度的番薯叶多酚溶液,配制质量浓度分别为125,250,500,1 000,2 000,4 000 μg/mL 的番薯叶多酚溶液,对其进行α-淀粉酶和α-葡萄糖苷酶抑制试验。测定方法参照文献[19]稍作修改。
1.4 数据处理
所有试验均重复3 次,取平均值。试验数据均采用IBM SPSS Statistics 21 软件进行统计分析,结果以平均值±标准差表示。作图采用Origin 2017 进行,响应面优化试验采用Design Expert 10 软件。
2 结果与分析
2.1 单因素实验
2.1.1 乙醇体积分数对番薯叶多酚提取的影响如图1所示,随着乙醇体积分数(40%~90%)的增加,番薯叶多酚提取量呈逐步上升趋势。当乙醇体积分数达到90%时,番薯叶多酚提取量最大,达到14.62 mg GAE/g。当乙醇体积分数大于90%时多酚提取量显著下降。多酚以游离态、酯化态和结合态等形式存在于植物体内,结合态多酚部分以与植物蛋白质结合形式存在。乙醇体积分数过高会使蛋白质变性,从而不利于部分多酚的溶出[20]。综上,确定乙醇体积分数考察范围为80%~100%。

图1 乙醇体积分数对番薯叶多酚提取的影响
Fig.1 Effects of ethanol volume fraction on the extraction of polyphenols from sweet potato leaves
2.1.2 提取温度对番薯叶多酚多酚提取的影响如图2所示,提取温度对番薯叶多酚提取量的影响呈现一定的不规则性。随着提取温度的升高,分子运动增强,提取液与番薯叶充分接触,多酚溶出量增加,提取温度为50 ℃时,番薯叶多酚提取量达到最大,为15.47 mg GAE/g。提取温度在50~70℃时,随着温度的升高乙醇易蒸发,实际参与提取的溶剂减少[21],因此多酚提取量降低。而当提取温度为80 ℃时,提取量再次升高,可能是由于过高的温度破坏了番薯叶细胞壁从而增加了多酚的溶出。出于节约能源考虑,选择提取温度考察范围为40~60 ℃。
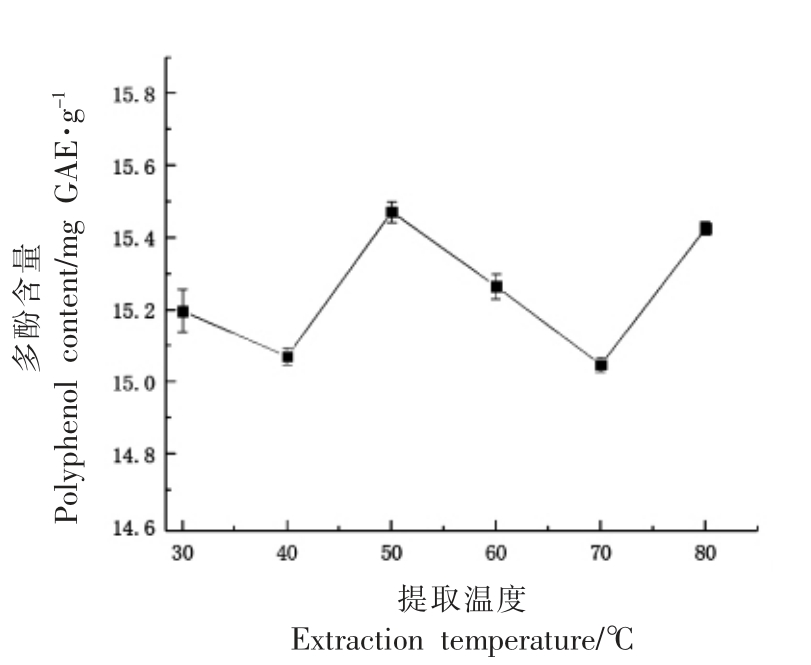
图2 温度对番薯叶多酚提取提取的影响
Fig.2 Effect of temperature on the extraction of polyphenols from sweet potato leaves
2.1.3 料液比对番薯叶多酚提取的影响 由图3可知,随着料液比的增加,番薯叶多酚提取量增加,当料液比为1∶15 时,番薯叶中多酚提取量达到最高,为15.36 mg GAE/g。料液比超过1∶15 后,随着料液比的增加,番薯叶多酚提取量逐渐下降但不明显,可能是由于此时多酚的溶出已经达到饱和,提高料液比会增加其它杂质的溶出[22]。从节约溶剂考虑,选择料液比考察范围为1∶10~1∶20。

图3 料液比对番薯叶多酚提取的影响
Fig.3 Effect of solid-liquid ratio on the extraction of polyphenols from sweet potato leaves
2.1.4 提取时间对番薯叶多酚提取的影响 理论上随着提取时间的延长,多酚溶出量增加。本研究发现番薯叶多酚提取时间为20 min 时,其多酚提取量达最高值,为14.74 mg GAE/g。当番薯叶提取时间大于20 min 时,其多酚提取量呈下降趋势,可能原因是随着时间的延长,溶出的多酚易被氧化或者结构被破坏而导致其含量下降[23]。因此,确定提取时间的考察范围为10~30 min。
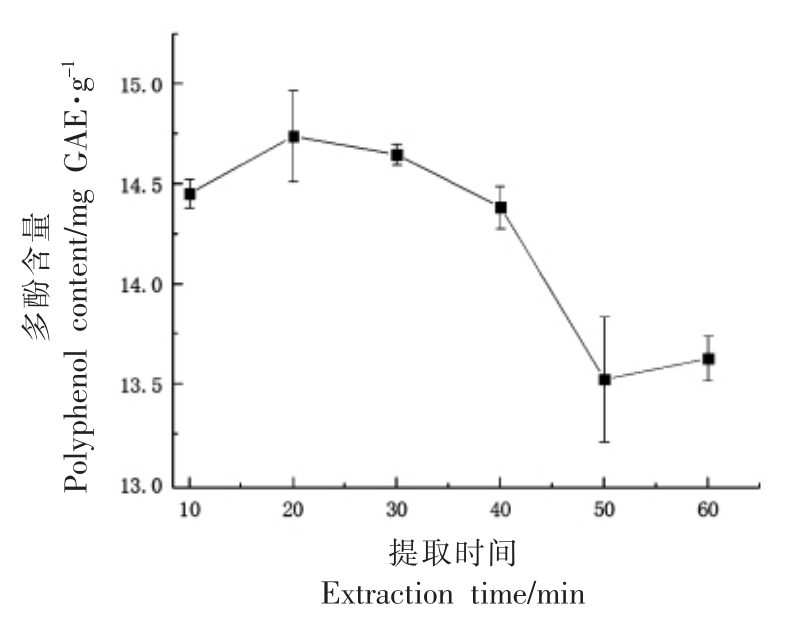
图4 时间对番薯叶多酚提取的影响
Fig.4 Effects of time on the extraction of polyphenols from sweet potato leaves
2.2 响应面试验优化
2.2.1 响应面试验设计及结果 本研究以乙醇体积分数、提取温度、料液比、提取时间为变量参数,应用Box-Benhnken 中心组合原理设计四因素三水平试验,以番薯叶多酚提取量为响应值,对提取过程进行优化,试验方案及番薯叶多酚提取结果见表2。
表2 响应面设计试验结果
Table 2 Response surface design test results
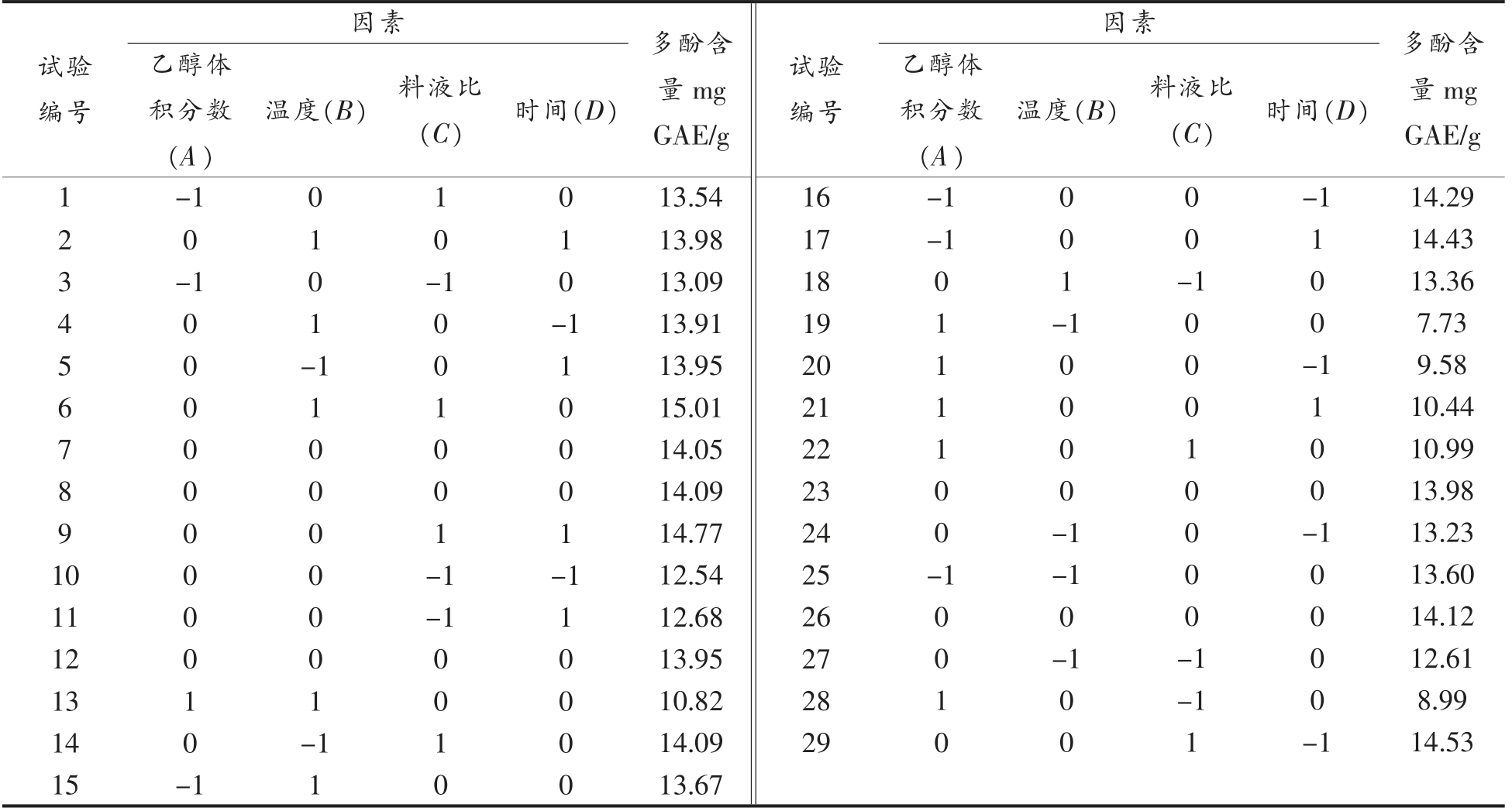
试验编号乙醇体积分数(A)温度(B) 料液比(C) 时间(D)因素 多酚含量mg GAE/g试验编号乙醇体积分数(A)温度(B) 料液比(C) 时间(D)因素 多酚含量mg GAE/g 1-1 0 1 0 13.54 16-1 0 0-1 14.29 2 0 1 0 1 3-1 0-1 0 4 0 1 0-1 5 0-1 0 1 6 0 1 1 0 7 0 0 0 0 8 0 0 0 0 9 0 0 1 1 10 0 0-1-1 11 0 0-1 1 12 0 0 0 0 13 1 1 0 0 14 0-1 1 0 15-1 1 0 0 13.98 13.09 13.91 13.95 15.01 14.05 14.09 14.77 12.54 12.68 13.95 10.82 14.09 13.67 17 18 19 20 21 22 23 24 25 26 27 28 29-1 0111100-10010 01-10000-1-1 0-1 00 0-1 00010000-1-1 1 100-1100-10000-1 14.43 13.36 7.73 9.58 10.44 10.99 13.98 13.23 13.60 14.12 12.61 8.99 14.53
将番薯叶多酚含量输入Design Expert 软件进行分析与拟合,计算获得番薯叶多酚提取量(Y)的回归方程如下:
Y=14.12-2.00A+0.56B+0.72C+0.17D+0.76AB+0.39AC+0.18AD+0.29BC-0.13BD+0.026CD-2.11A2-0.40B2-0.36C2+0.022D2。
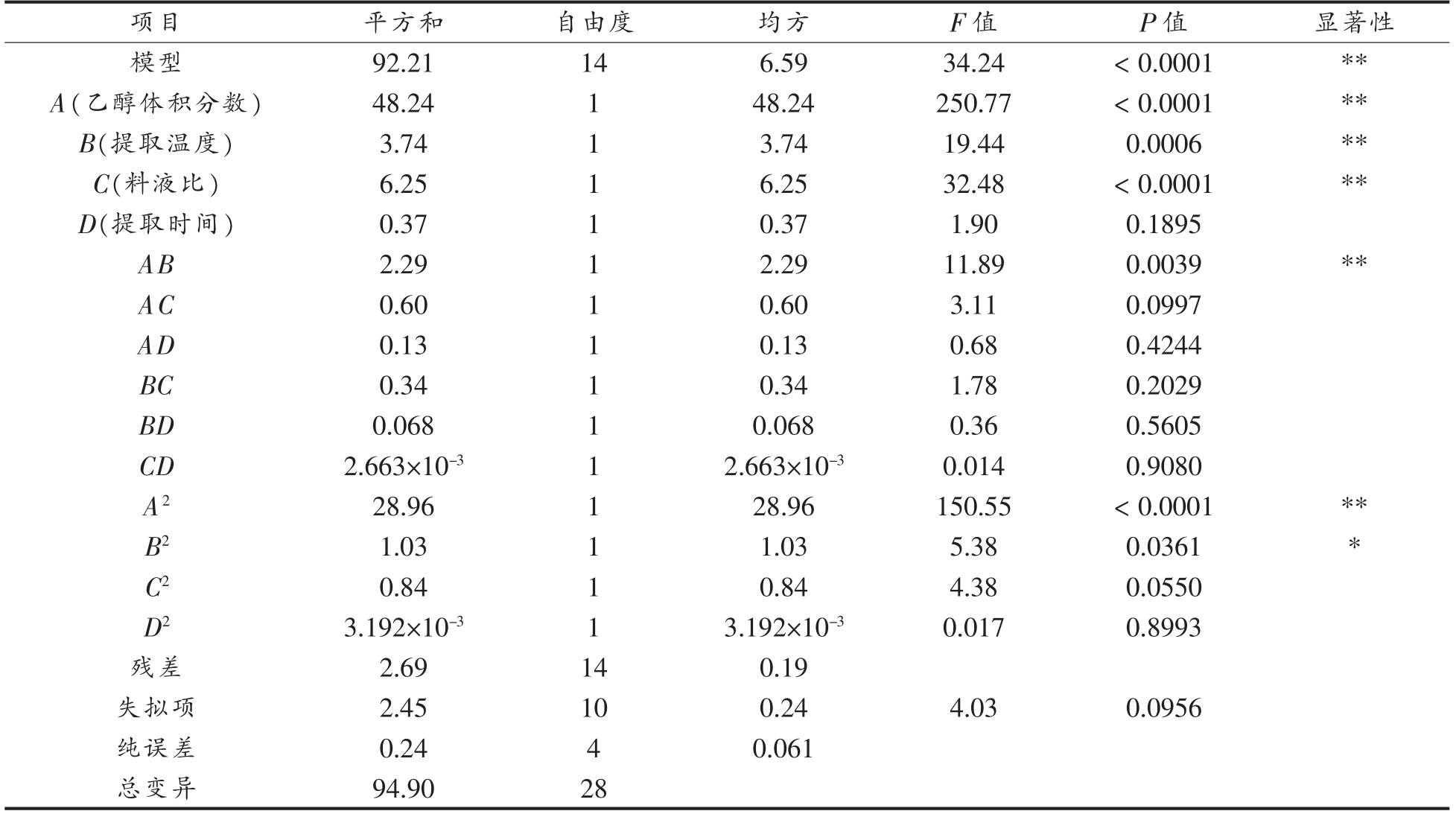
响应面分析模型的方差分析如表4所示,失拟项P 值为0.0956,大于0.05,说明模型拟合好,稳定可靠,可用本试验的二次回归方程对响应值进行预测。模型的确定系数与校正系数分别为R2=0.9716 和Radj2=0.9432,变异系数CV=3.39 较小,表明番薯叶多酚提取量的理论值与实际值拟合良好。乙醇体积分数、料液比、提取温度、提取时间的F 值分别为250.77,32.48,19.44,1.90,各因素影响番薯叶多酚提取量顺序为:乙醇体积分数(A)>料液比(C)>提取温度(B)>提取时间(D)。因素A、B、C,以及交互项AB、A2 对番薯叶多酚提取量的影响极显著(P<0.01),因素B2 对番薯叶多酚提取量的影响显著(P<0.05),因素D,以及交互项AC、AD、BC、BD、CD、C2、D2 没有显著影响 (P>0.05)。
乙醇体积分数、温度、料液比、时间4 个因素两两交互对番薯叶多酚提取量影响的响应面如图5所示,各因素两两交互的响应面开口均向下,表明多酚提取量随乙醇体积分数、提取温度、料液比和提取时间的增加而呈现先增大后减小的趋势。其中,乙醇体积分数对多酚提取量影响最大,表现曲面最为陡峭,而提取时间对多酚提取量影响最小,表现曲面平缓。从响应曲面以及等高线看,响应面坡面陡峭顺序为AB>AC>BC>AD>BD>CD,即乙醇体积分数与提取温度交互作用的响应曲面最陡峭,表明乙醇体积分数与提取温度的交互作用对番薯叶多酚提取量的影响最为明显;而料液比与提取时间交互作用响应曲面最平缓,表明料液比与提取时间的交互作用对番薯叶多酚提取量的影响相对较小。结果与表中结果相符,说明该模型可以较好的描述乙醇体积分数、提取温度、料液比和提取时间4 个因素对番薯叶多酚提取量的影响。
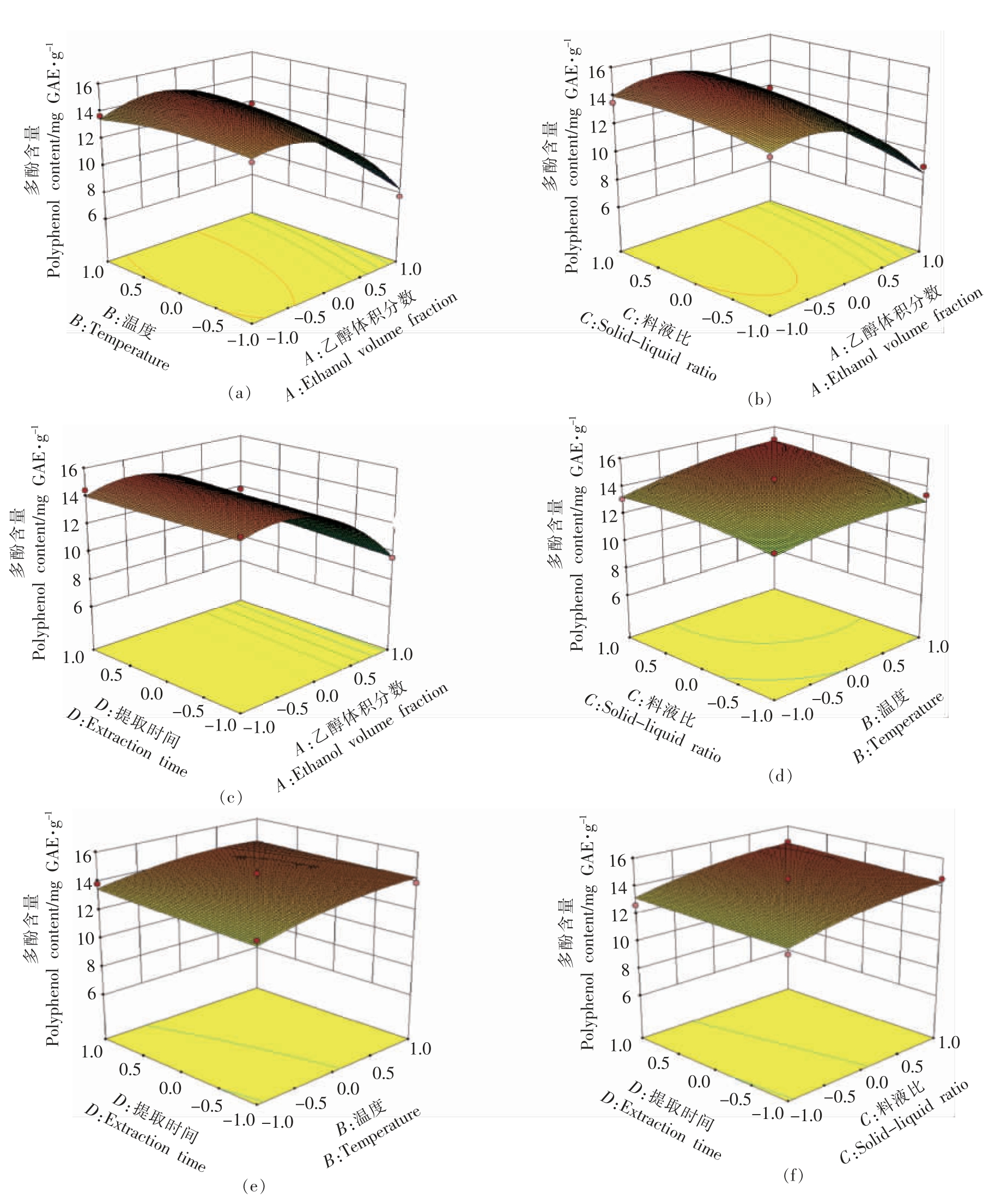
图5 乙醇体积分数、温度、料液比、时间4 因素两两交互响应面
Fig.5 Pairwise interactive response surface of four factors including ethanol volume fraction,temperature,solid-liquid ratio and time
表3 模型方差分析表
Table 3 Model analysis of variance
注:** 表示差异极显著(P<0.01);* 表示差异显著(P<0.05)。
?
2.2.2 响应面优化与验证 采用Design expert 10 软件进行响应面模型分析,结果表明番薯叶多酚的最优提取工艺为:乙醇体积分数87.85%,提取温度56.99 ℃,料液比1∶20,提取时间30 min,此时理论上番薯叶总酚酸含量为15.11 mg GAE/g。为了操作便利性,调整为:乙醇体积分数88%,提取温度57 ℃,料液比1∶20,提取时间30 min。按此工艺进行3 次平行试验,测得番薯叶的平均多酚提取量为(15.34±0.19)mg GAE/g,番薯叶多酚含量与预测的理论相近,表明模型拟合良好,模型准确可靠。此提取量结果与田燕楠等[24]研究结果相似,存在差异可能是由于试验条件以及番薯叶品种的不同。
2.3 番薯叶多酚主要成分以及生物活性分析
2.3.1 番薯叶主要成分分析 为进一步探究番薯叶多酚物质的主要成分,本研究通过高效液相色谱法测定了番薯叶多酚7 种主要单体酚,如图6为番薯叶多酚的液相色谱图。通过与混合标准品的色谱峰保留时间做对比,分析鉴定出了7 种主要单体酚,分别为5-咖啡酰奎宁酸、3-咖啡酰奎宁酸、4-咖啡酰奎宁酸、3,4-咖啡酰奎宁酸、3,5-咖啡酰奎宁酸、4,5-咖啡酰奎宁酸、3,4,5-咖啡酰奎宁酸。由图7可知,番薯叶多酚中含量最高的单体酚为3-咖啡酰奎宁酸和3,5-咖啡酰奎宁酸,分别为10.40 mg/g 和7.72 mg/g,此结果与Suárez 等[25]的研究结果相似。Sun 等[26]的研究表明番薯叶多酚比抗坏血酸、茶多酚和葡萄籽多酚等具有更高的抗氧化活性,发现3-咖啡酰奎宁酸的DPPH 自由基清除能力最强。尽管3,4,5-咖啡酰奎宁酸等含量较低,但这些化合物仍然是主要的抗氧化活性物质。因此,番薯叶是生物活性多酚类物质的良好来源,在食品、保健产品、药品和化妆品的开发中具有多种用途。
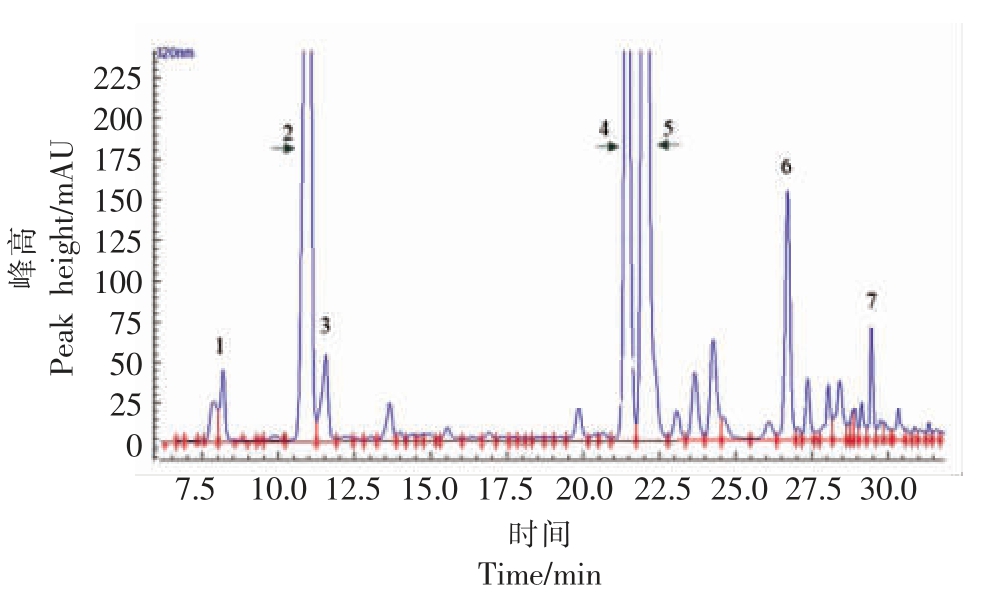
图6 番薯叶多酚样品中主要单体酚的HPLC 色谱图
Fig.6 HPLC chromatogram of main monomers in polyphenols from sweet potato leaves
注:1.5-咖啡酰奎宁酸;2.3-咖啡酰奎宁酸;3.4-咖啡酰奎宁酸;4.3,4-咖啡酰奎宁酸;5.3,5-咖啡酰奎宁酸;6.4,5-咖啡酰奎宁酸;7.3,4,5-咖啡酰奎宁酸。
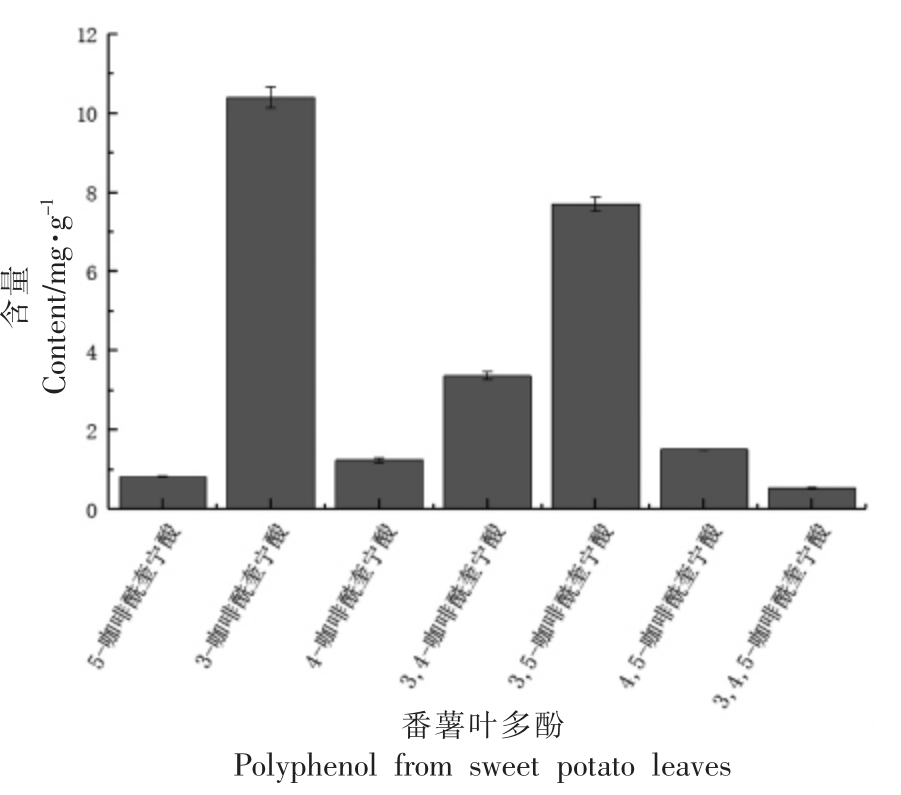
图7 番薯叶多酚中主要单体酚的含量
Fig.7 Content of main monomers in polyphenols from sweet potato leaves
2.3.2 番薯叶多酚抗氧化能力分析 近年来研究报道,番薯叶多酚含量比许多其它常见蔬菜更高,且具有更强的抗氧化活性[27-28]。番薯叶多酚对DPPH 自由基清除能力如图8a所示,随着番薯叶多酚质量浓度的增大,其清除DPPH 自由基的能力随之增强。当番薯叶多酚的质量浓度为0.125 mg/mL 时,其DPPH 自由基清除能力为0.69 mg TE/g;当多酚质量浓度增加至为2 mg/mL 时,自由基清除能力迅速增加到9.56 mg TE/g,而后缓慢增加。番薯叶多酚FRAP 总抗氧化能力由图8b 可见,随质量浓度增加,FRAP 总抗氧化能力变化与DPPH 自由基清除能力基本一致。质量浓度为4 mg/mL 时,番薯叶多酚的DPPH 自由基清除能力和FRAP 总抗氧化能力最高,分别为11.57 mg TE/g 和12.30 mg TE/g。
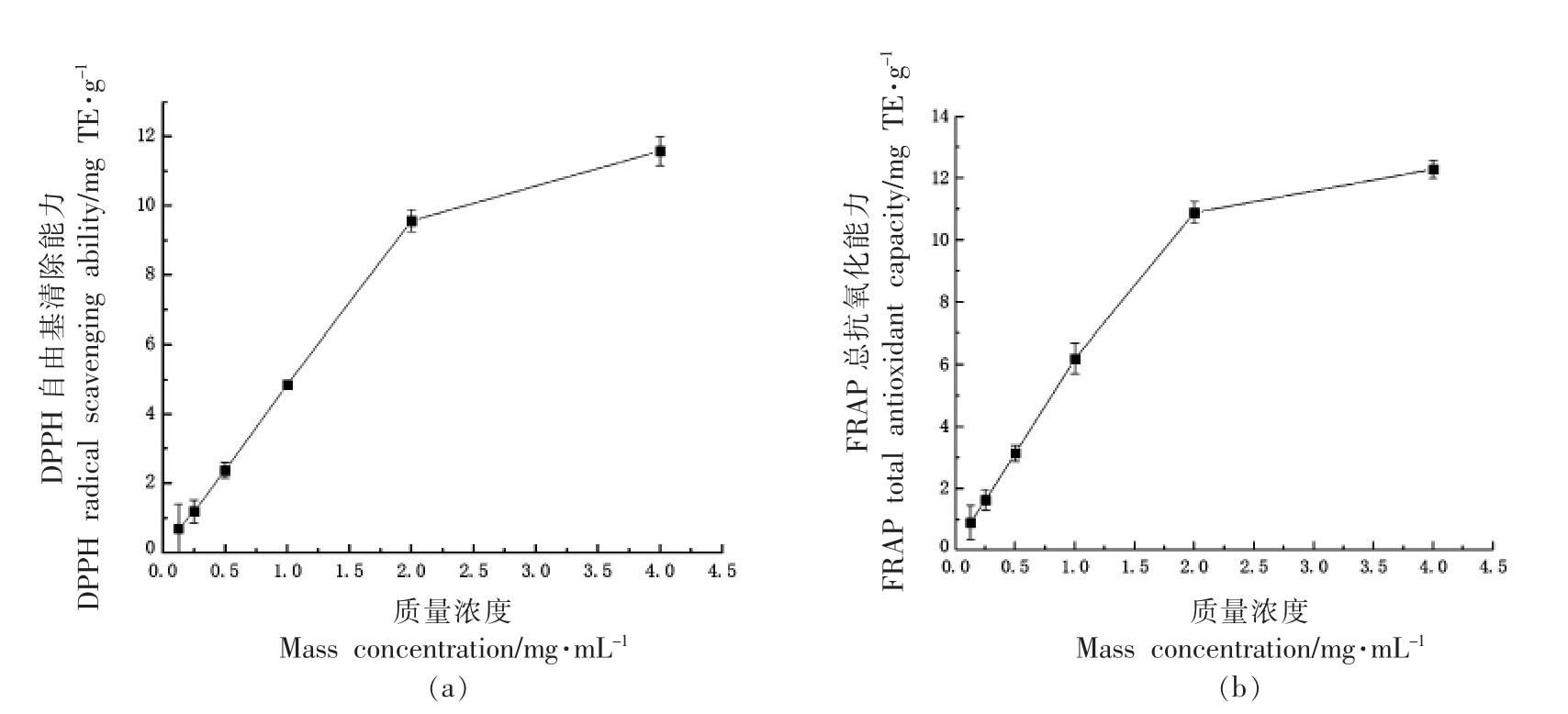
图8 番薯叶多酚抗氧化能力
Fig.8 Antioxidant capacity of polyphenols from sweet potato leaves
2.3.3 番薯叶多酚体外降血糖能力分析 食物中的碳水化合物的代谢先在α-淀粉酶作用下生成麦芽糖、糊精等,然后在α-葡萄糖苷酶的作用下分解成葡萄糖、果糖等小分子物质,再由肠道吸收利用。抑制α-淀粉酶和α-葡萄糖苷酶活性可以延缓碳水化合物在胃肠道内的分解,从而控制餐后血糖,对糖尿病患者血糖稳定具有重要意义[29],是植物降血糖活性重要的体外指标。由图9可见,番薯叶多酚的α-淀粉酶抑制活性随着质量浓度的增加而增加,在质量浓度为1 mg/mL 前抑制率增加迅速,达到78.41%,而后缓慢增加。番薯叶多酚的α-葡萄糖苷酶抑制活性随着质量浓度的增加而呈线性缓慢增加。在质量浓度为0.125 mg/mL时,番薯叶多酚对α-葡萄糖苷酶的抑制大于对α-淀粉酶的抑制,而随着质量浓度的升高番薯叶多酚对α-葡萄糖苷酶的抑制总体小于对α-淀粉酶的抑制。质量浓度为4 mg/mL 时,番薯叶多酚对α-淀粉酶与α-葡萄糖苷酶的抑制率最高,分别为89.94%和22.28%。

图9 番薯叶多酚体外降糖能力
Fig.9 Hypoglycemic effects of polyphenols from sweet potato leaves in vitro
3 结论
本文通过响应面法优化超声辅助提取番薯叶(浙菜薯726)中的多酚,得到的最佳提取工艺为:乙醇体积分数88%,提取温度57 ℃,料液比1∶20,提取时间30 min,在此条件下番薯叶多酚的提取量为(15.34±0.19)mg GAE/g,与理论值接近。采用高效液相色谱法测定出番薯叶多酚中主要的7 种单体酚分别为5-咖啡酰奎宁酸、3-咖啡酰奎宁酸、4-咖啡酰奎宁酸、3,4-咖啡酰奎宁酸、3,5-咖啡酰奎宁酸、4,5-咖啡酰奎宁酸、3,4,5-咖啡酰奎宁酸,其中含量最高的分别为3-咖啡酰奎宁酸和3,5-咖啡酰奎宁酸,分别为10.40 mg/g 和7.72 mg/g。番薯叶多酚具有较强的DPPH 自由基清除能力和FRAP 总抗氧化能力,在质量浓度为4 mg/mL 时,番薯叶多酚的DPPH 自由基清除能力和FRAP 总抗氧化能力达11.57 mg TE/g 和12.30 mg TE/g。此外番薯叶多酚还有很好的体外降糖活性,质量浓度为4 mg/mL 时,番薯叶多酚对α-淀粉酶与α-葡萄糖苷酶的抑制率最高,分别为89.94%和22.28%。本研究对番薯叶中多酚的提取工艺进行了优化,并对番薯叶多酚主要成分及主要生物活性进行了分析,为番薯叶多酚类物质在食品、保健产品、药品和化妆品的中开发提供了理论基础,为番薯资源的有效利用提供了参考。
[1]郭政铭,杨静,周成伟,等.甘薯茎叶生理功能与其加工利用[J].食品安全质量检测学报,2019,10(24):8302-8307.
GUO Z M,YANG J,ZHOU C W,et al.Advances on physiological activities and processing utilization of sweet potato stems and leaves[J].Journal of Food Safety&Quality,2019,10(24):8302-8307.
[2]沈梦兰,庞林江,陆国权,等.甘薯叶菜的营养保健及贮藏保鲜技术研究进展[J].食品工业,2019,40(5):270-274.
SHEN M L,PANG L J,LU G Q,et al.Application value and research status of storage and preservation of sweet potato leafy vegetables[J].The Food Industry,2019,40(5):270-274.
[3]杨汉,黄志谋,刘伟,等.中国菜用甘薯开发利用现状与展望[J].湖北农业科学,2017,56(17):3201-3204.
YANG H,HUANG Z M,LIU W,et al.The situation and prospect of development and utilization of sweet potato for vegetable in China[J].Hubei Agricultural Sciences,2017,56(17):3201-3204.
[4]罗丹,木泰华,孙红男.甘薯茎叶多酚分离纯化及降血糖活性研究进展[J].核农学报,2021,35(2):424-437.
LUO D,MU T H,SUN H N.Research progress in separation,purification and antihyperglycemic activity of sweet potato leaf polyphenols[J].Journal of Nuclear Agricultural Sciences,2021,35(2):424-437.
[5]吴忆微,蒋立勤.红薯叶功效成分及抗肿瘤作用研究进展[J].中国食物与营养,2013,19(12):63-65.
WU Y W,JIANG L Q.Research advancement in active components and anti-tumor activity of sweet potato leaves[J].Food and Nutrition in China,2013,19(12):63-65.
[6]王振宇,孔子浩,孔令华,等.天然多酚提取、分离及鉴定方法的研究进展[J].保鲜与加工,2017,17(4):113-120.
WANG Z Y,KONG Z H,KONG L H,et al.Research progress in extraction,purification and identification of natural polyphenols[J].Storage and Process,2017,17(4):113-120.
[7]蒋边,李卫锦,肖理峰,等.杨桃多酚提取液体外抗氧化活性研究[J].食品研究与开发,2020,41(24):50-56.
JIANG B,LI W J,XIAO L F,et al.Evaluation of antioxidant activity in vitro of polyphenols extracting solution from carambola[J].Food Research and Development,2020,41(24):50-56.
[8]黄修晴,初众,房一明,等.植物多酚降血糖机制的研究进展[J].食品工业科技,(2020-11-27)[2021-01-05].https://kns.cnki.net/kns8/defaultresult/index.
HUANG X Q,CHU Z,FANG Y M,et al.Research progress on hypoglycemic mechanism of plant polyphenols[J].Sci Technol Food Ind,(2020-11-27)[2021-01-05].https://kns.cnki.net/kns8/defaultresult/index.
[9]MENG X,HUI X,XIN L,et al.Chemical composition,antibacterial properties,and mechanism of Smilax china L.polyphenols[J].Applied Microbiology and Biotechnology,2019,103:9013-9022.
[10]傅志丰.红薯叶多酚的溶剂提取、消化性及体内降血脂作用研究[D].南昌:南昌大学,2016.
FU Z F.Solvent extraction of polyphenols from sweet potato leaves and study on its in vitro digestibility,in vivo antihyperlipidemic effects[D].Nanchang:Nanchang University,2016.
[11]WANG Y X,WANG Y N,SHEN W L,et al.Grape seed polyphenols ameliorated dextran sulfate sodium-induced colitis via suppression of inflammation and apoptosis[J].Pharmacology,2020,105(1/2):1-10.
[12]PASINETTI G M,WANG J,HO L,et al.Roles of resveratrol and other grape-derived polyphenols in Alzheimer's disease prevention and treatment [J].Biochimica et Biophysica acta,2015,1852 (6):1202-1208.
[13]衣申艳.甘薯茎叶多酚类物质的提取及其基因型差异与环境效应的研究[D].杭州:浙江大学,2011.
YI S Y.Geno typic variation and environmental effects on polyphenols in leaves,stalks and stems of sweet potatos[D].Hangzhou:Zhejiang University,2011.
[14]王永徐,李臣,邱天越,等.超声耦合双水相提取甘薯叶多酚的响应面优化[J].江苏师范大学学报(自然科学版),2018,36(4):44-48.
WANG Y X,LI C,QIU T Y,et al.Response surface optimization of polyphenols extracted from sweet potato leaves by ultrasonic coupled aqueous two-phase extraction[J].Journal of Jiangsu Normal University (Natural Science Edition),2018,36(4):44-48.
[15]刘静,黄慧福,刘继华,等.响应面优化核桃分心木多酚超声辅助提取工艺[J].食品研究与开发,2020,41(23):155-160,191.
LIU J,HUANG H F,LIU J H,et al.Optimization of ultrasonic-assisted extraction of polyphenols from diaphragma Juglandis fructus by response surface methodology[J].Food Research And Development,2020,41(23):155-160,191.
[16]闫旭宇,李娟,任潘,等.银杏叶多酚超声辅助提取工艺及其对羟自由基的清除作用[J].食品研究与开发,2020,41(19):99-104.
YAN X Y,LI J,REN P,et al.Optimization of polyphenols from Ginkgo biloba leaves by ultrasound-assisted extraction and its scavenging capacity on hydroxyl free radicials[J].Food Research And Development,2020,41(19):99-104.
[17]ZHANG C C,LIU D Q,WU L H,et al.Chemical characterization and antioxidant properties of ethanolic extract and its fractions from sweet potato (Ipomoea batatas L.) leaves[J].Foods,2019,9(1):15.
[18]LUO D,MU T H,SUN H N.Profiling of phenolic acids and flavonoids in sweet potato (Ipomoea batatas L.) leaves and evaluation of their anti-oxidant and hypoglycemic activities[J].Food Bioscience.2020,39(44):100801.
[19]李思维,卫倩倩,宋宵,等.党参多糖的抗氧化及降糖活性研究[J].临床医学研究与实践,2020,5(32):8-11.
LI S W,WEI Q Q,SONG X,et al.Study on antioxidant and hypoglycemic activities of Codonopsis pilosula polysaccharide[J].Clinical Medicine Research and Practice,2020,5(32):8-11.
[20]茹巧美,任国平,胡琼.紫苏叶多酚超声辅助聚乙二醇提取工艺优化及抗氧化活性研究[J].食品与机械,2020,36(10):136-142.
RU Q M,REN G P,HU Q.Optimization of ultrasonic-assisted extraction for polyphenols from perilla leaves by polyethylene glycol and its antioxidant ac tivity[J].Food&Machinery,2020,36(10):136-142.
[21]贺银菊,张旋俊,杨再波,等.响应面优化紫果西番莲叶多酚超声辅助提取工艺及其抗氧化活性[J].食品工业科技,2021,42(1):211-216,226.
HE Y J,ZHANG J X,YANG Z B,et al.Optimization of ultrasonic-assisted extraction of polyphenols in the purple passionfruit leaves by response surface methodology and its antioxidant activity[J].Science and Technology of Food Industry,2021,42(1):211-216,226.
[22]谢佳函,刘回民,刘美宏,等.红豆皮多酚提取工艺优化及抗氧化活性分析[J].中国食品学报,2020,20(1):147-157.
XIE J H,LIU H M,LIU M H,et al.Extraction process optimization and antioxidant activity analysis of polyphenols from azuki bean coats (Vigna angularis)[J].Journal of Chinese Institute of Food sciences and Technology,2020,20(1):147-157.
[23]张贤贤,谢玮,张绍阳,等.响应面法优化超声提取梵净山猕猴桃多酚工艺研究[J].广州化工,2017,45(21):77-79,126.
ZHANG X X,XIE W,ZHANG S Y,et al.Optimization of ultrasound extraction for Fanjing kiwifruit polyphenols by response surface methodology [J].Guangzhou Chemical Industry,2017,45(21):77-79,126.
[24]田燕楠,钟耀广.响应面法优化超声辅助提取甘薯叶多酚工艺[J].山东农业大学学报 (自然科学版),2018,49(5):894-899.
TIAN Y N,ZHONG Y G.Optimization of ultrasonic-assisted extraction of polyphenols from sweet potato leaves by response surface methodology [J].Journal of Shandong Agricultural University (Natural Science),2018,49(5):894-899.
[25]SUÁREZ S,MU T H,SUN H N,et al.Antioxidant activity,nutritional,and phenolic composition of sweet potato leaves as affected by harvesting period[J].International Journal of Food Properties,2020,23(1):178-188.
[26]SUN H N,MU B N,SONG Z,et al.The in vitro antioxidant activity and inhibition of intracellular reactive oxygen species of sweet potato leaf polyphenols[J].Oxidative Medicine and Cellular Longevity,2018,2018:9017828.
[27]YANG R Y,LIN S,KUO G.Content and distribution of flavonoids among 91 edible plant species[J].Asia Pacific Journal of Clinical Nutrition,2008,17(S1):275-279.
[28]THU N N,SAKURAI C,UTO H,et al.The polyphenol content and antioxidant activities of the main edible vegetables in northern Vietnam[J].Journal of Nutritional Science&Vitaminology,2004,50(3):203-210.
[29]刘焕举,高月滢,刘飞,等.豆腐柴果冻的制作工艺优化及其降血糖活性研究[J].食品安全质量检测学报,2018,9(10):2463-2469.
LIU H J,GAO Y Y,LIU F,et al.Study of processing technology optimization and hypoglycemic activity of jelly from Doufuchai[J].Journal of Food Safety and Quality,2018,9(10):2463-2469.