蓝莓是一种属于杜鹃花科(Ericaceae)越橘属(Vaccinium spp.)的小型浆果,初产于北美[1],深受消费者青睐[2]。蓝莓富含多种营养物质,具有很高的食用和商品价值[3-5]。同时,蓝莓具有多种保健功效[3],是五大健康食品之一,被称为“浆果之王”。蓝莓果实采后不耐贮藏,品质极易发生劣变,室温下易失水皱缩且不加任何处理的蓝莓采后仅能保存3~7 d[6-7]。蓝莓多采摘于高温、多雨的夏季,果实水分含量高,炎热的气候使得蓝莓采摘后呼吸作用旺盛,代谢加快,导致蓝莓保鲜和贮藏性差[8-9],果实软化现象严重,对蓝莓产业造成很大的经济损失。
微环境气调是基于箱式气调而发展起来的一种新兴气调方式。其特点是在传统箱式气调对O2和CO2 自发调节的基础上,加入新型气体,从而实现双控调节[10-12]。如刘振通[13]研究表明,微环境气调调控可有效延缓软枣猕猴桃和柿等果实质地的下降,并保持良好的营养价值,延长了果蔬的贮藏期和货架期;Falagán 等[14]对蓝莓研究发现,气调贮藏可有效降低腐烂率,维持较高的果实硬度和糖含量,在贮藏结束时,其果实抗坏血酸含量接近贮藏初始值。Park 等[15]研究表明气调处理在冷藏过程中延缓了番茄果实的成熟和果皮红色的形成,有效降低点蚀评分和腐烂率,减少冻害,延长番茄的货架期。早在2012年,Cantín 等[16]就证明气调有利于维持蓝莓品质,而目前尚未有研究从细胞壁降解酶角度分析对蓝莓软化的调控作用。本文采用微环境气调结合冰温技术,以蓝莓为试验对象,从果实硬度、细胞壁多糖含量、细胞壁降解酶活性及关键酶基因表达量入手,研究微环境气调对蓝莓贮藏期果实软化的影响,为改善蓝莓贮藏保鲜技术,实现无缝化全程冷链的保鲜新模式提供试验依据。
1 材料与方法
1.1 材料与试剂
“莱克西”蓝莓于2019年6月采自浙江宁波森田蓝莓农庄;1-甲基环丙烯,国家农产品保鲜工程技术研究中心(天津);浓硫酸、乙醇、丙酮、果胶、3,5-二硝基水杨酸、羧甲基纤维素、半乳糖醛酸标准品、葡萄糖标准品,天津市江天化工有限公司;植物纤维素(Cellulose)检测试剂盒、植物半纤维素(Hemicellulose)检测试剂盒、植物原果胶含量检测试剂盒、可溶性果胶(WSP)含量检测试剂盒、植物ɑ-L-阿拉伯呋喃糖酶(ɑ-Af)检测试剂盒、植物果胶甲酯酶(PME)检测试剂盒、植物β-半乳糖苷酶(β-Gal)检测试剂盒,上海邦奕生物科技有限公司;反转录试剂盒,北京艾德莱生物科技有限公司。
1.2 仪器与设备
冰温库,国家农产品保鲜工程技术研究中心(天津);气调箱(配气调元件)(长0.28 m×宽0.22 m×高0.12 m),宁波国嘉农产品保鲜包装技术有限公司;TA.XT.Plus 物性仪,英国Stable Micro Systems 公司;Infinite F50 酶标仪,瑞士TECAN(帝肯)公司;Sorvall ST 40 赛默飞离心机,赛默飞世尔科技(中国)有限公司;DHG-9240 培养箱,上海一恒科学仪器有限公司;Analytikjena-qTOWER2.2 型荧光定量PCR 仪、Easycycler 普通PCR仪、scandrop100 超微量核酸蛋白测定仪,德国耶拿仪器分析股份公司;D3024R 离心机,美国赛克捷克公司;移液器,伯乐生命医学产品(上海)有限公司。
1.3 方法
1.3.1 样品处理 将大小均匀、品质良好的果实装入气调箱相配套的小篮内,每箱蓝莓2.4 kg,在采收2 h 内放入冷库预冷,并进行如下处理:1)mMAP 组:扣盖并黏贴气调元件;2)1-MCP 组:放入1-MCP 药品(理论体积分数为0.0001%),扣盖并黏贴封闭气调元件,处理24 h 后,打开封闭气调元件;3)mMAP+1-MCP 组:放入1-MCP 药品(理论体积分数为0.0001%),扣盖并黏贴气调元件;4)CK 组:不黏贴气调元件。通过冷链物流车(宁波至天津,0~4 ℃,4 d)运至实验室并放入冰温库阶段预冷 【(4.0±0.5) ℃条件下预冷6~10 h,(-1.4±0.2) ℃温度下驯化6~8 h)】后于(-0.5±0.3)℃下贮藏,每20 d 测定一次,周期为60 d(注:在贮藏过程中,mMAP 和mMAP+1-MCP 处理的氧气含量变化范围分别为11.27%~16.10%和10%~15.13%,二氧化碳变化范围分别为5.30%~10.87%和6.13%~11.10%)。
1.3.2 软果率 每个处理随机选取400 g 左右的蓝莓果实,将软果挑出进行称重。软果率(X)计算公式如下:
式中,X——软果率,%;M0——调查时软果质量,g;M——调查时总果质量,g。
1.3.3 硬度 采用TA.XT.Plus 质构仪测定[17]。将蓝莓果实置于测定平台上,果蒂朝上,用型号为P/75 的圆柱形探头(直径为75 mm)进行测试。测试参数为:测前、测试和测后上行速度分别为2,1 mm/s 和2 mm/s,果肉受压变形30%,两次压缩间隔5 s,触发力5 g。各处理重复10 次,取平均值。
1.3.4 细胞壁物质 纤维素和半纤维素的提取及测定采用酶联免疫吸附剂法,根据试剂盒说明书进行操作;原果胶和可溶性果胶含量测定采用分光光度法,根据试剂盒说明书进行操作。
1.3.5 细胞壁降解酶活性测定
1.3.5.1 纤维素酶(Cx) 采用3,5-二硝基水杨酸法测定[18],根据葡萄糖标准曲线计算生成葡萄糖量,以37 ℃时每克果肉每小时催化生成葡萄糖的微克数来计算酶活性,单位为μg/(h·g)。
1.3.5.2 多聚半乳糖醛酸酶(PG) 采用3,5-二硝基水杨酸法测定[19],根据半乳糖醛酸标准曲线计算生成半乳糖醛酸量,以37 ℃时每克果肉每小时催化生成半乳糖醛酸的毫克数来计算酶活性,单位为mg/(h·g)。
1.3.5.3 果胶甲酯酶 (PME)、ɑ-L-阿拉伯呋喃糖酶(ɑ-Af)、β-半乳糖苷酶 均采用试剂盒进行测定,酶活单位为U/g。以上酶均做重复测定3 次,取平均值。
1.3.6 关键细胞壁降解酶基因表达测定
1.3.6.1 RNA 的提取和反转录 使用Trizol 法对蓝莓总RNA 进行提取,经琼脂糖凝胶法和紫外分光光度计检测被提取总RNA 完整性和含量。cDNA 由反转录试剂盒法制备,反转录条件为:42℃,40 min;65 ℃,10 min。反应结束后,得到cDNA,于-80 ℃保存。
1.3.6.2 引物合成信息及荧光定量PCR 检测 通过荧光定量PCR 测定Cx 和β-Gal 基因表达。在GenBank 数据库中进行检索,根据已经报道的同源植物的基因保守序列,由杭州联川生物技术股份有限公司对引物进行设计,引物信息如表1所示。荧光定量PCR 反应程序为95 ℃预变性3 min,95 ℃变性10 s,58 ℃恒温扩增30 s,一共40次循环,融解曲线(60 ℃~95 ℃,+1 ℃/循环,维持时间4 s)。以18s 为内参,利用2-△△Ct 计算各个样品的基因相对表达量。
表1 引物信息
Table 1 Primer information
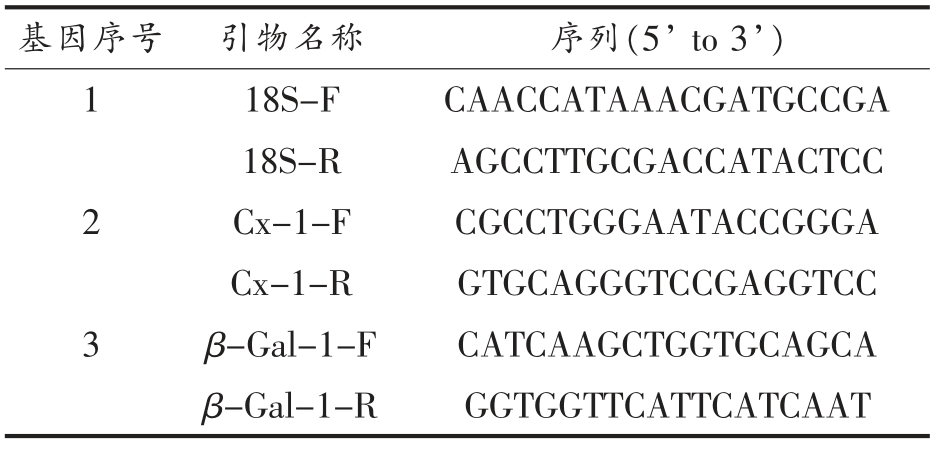
基因序号 引物名称 序列(5’ to 3’)1 18S-F CAACCATAAACGATGCCGA 18S-R AGCCTTGCGACCATACTCC 2 Cx-1-F CGCCTGGGAATACCGGGA Cx-1-R GTGCAGGGTCCGAGGTCC 3 β-Gal-1-F CATCAAGCTGGTGCAGCA β-Gal-1-R GGTGGTTCATTCATCAAT
1.3.7 数据分析 采用Excel 2010 软件进行数据统计处理;采用SPSS 23.0 软件Duncan 氏新复极差法进行数据差异显著性分析;并采用SIMCA 14.1 进行正交偏最小二乘法判别分析 (OPLADA)分析。
2 结果与分析
2.1 微环境气调对蓝莓果实软果率及硬度的影响
由图1a所示,在贮藏过程中,各组处理蓝莓果实的软果率均呈现不同幅度上升趋势,其中CK组上升速率最大,而mMAP+1-MCP 处理组最小。贮藏20~40 d 时,3 个处理组的软果率均显著低于对照组(P<0.05),且3 个处理之间差异显著(P <0.05)。由于贮藏40 d 时,对照组蓝莓软果率达30%以上,因此试验停止,没有进行贮藏60 d 测定;贮藏60 d 时,mMAP、1-MCP 和mMAP+1-MCP处理组的软果率分别为29.37%,28.25%和13.02%,且mMAP+1-MCP 处理组的软果率显著低于另外2 个处理组(P<0.05),表明mMAP+1-MCP 处理可以有效延缓果实的软化。
硬度可以体现出在贮藏过程中果实的品质变化情况[20]。如图1b所示,随着贮藏时间的延长,由于果实衰老、营养物质消耗及果实软化等因素使果实硬度呈降低趋势。贮藏40 d 时,各处理组的硬度排序如下:mMAP+1-MCP > mMAP > 1-MCP> CK,mMAP 和mMAP+1-MCP 处理组的硬度分别是CK 组的1.08 和1.11 倍,两个处理差异不明显(P>0.05)。贮藏60 d 时,mMAP 和mMAP+1-MCP 处理组的硬度为8.34 N 和8.97 N,分别为CK 组40 d 时硬度的1.02 和1.09 倍,表明mMAP处理在贮藏后期可以较好地维持果实硬度,mMAP 结合1-MCP 处理效果更佳。

图1 微环境气调对蓝莓贮藏期软果率(a)和硬度(b)的影响
Fig.1 The effects of micro-environmental modified atmosphere on soft fruit rate (a) and firmness (b)of blueberries during storage
注:不同小写字母表示每个指标的相同时间不同处理组间差异显著(P<0.05),下同。
2.2 微环境气调对蓝莓果实细胞壁多糖含量的影响
由图2a 可得,随着贮藏时间的延长,贮藏期的蓝莓果实中纤维素含量呈降低趋势。在贮藏0 d 时,不同处理组之间的纤维素含量差异显著(P<0.05),且由高到低依次为:mMAP>mMAP+1-MCP>1-MCP>CK,说明mMAP 和1-MCP 处理均会对蓝莓果实中纤维素含量产生直接的作用,mMAP 处理的纤维素含量更高。在贮藏前40 d 纤维素含量下降幅度大,40 d 后变化幅度较小。贮藏40 d 时,CK、mMAP、1-MCP 和mMAP+1-MCP 处理组纤维素含量分别为1 465.62,1 514.17,2 095.45和2 088.77 μg/g,且mMAP、1-MCP 和mMAP+1-MCP 处理分别是CK 处理的1.03、1.43 和1.43倍;贮藏60 d 时,mMAP+1-MCP 处理组纤维素含量为2 372.47 μg/g,显著(P<0.05)高于另外两个处理。
前人对蓝莓果实细胞壁在发育过程中解体的研究表明,半纤维素的溶解和解聚是蓝莓果实细胞壁发生的主要变化之一[21]。由图2b 可得,随着贮藏时间的延长,各处理的半纤维素含量虽整体呈下降趋势,但变化较小。1-MCP 和mMAP+1-MCP 在0~40 d 呈小幅上升趋势,之后快速下降;贮藏40 d 时,1-MCP 和mMAP+1-MCP 的半纤维含量分别为809.93 μg/g 和795.38 μg/g,均显著高于另外两组处理 (P<0.05),为1.68~1.86 倍,1-MCP 和mMAP+1-MCP 处理维持了贮藏后期蓝莓果实的半纤维素含量。

图2 微环境气调对蓝莓贮藏期细胞壁多糖含量的影响
Fig.2 The effects of micro-environmental modified atmosphere on the contents of cell wall polysaccharides of blueberries during storage
由图2c 可得,在贮藏过程中,mMAP、1-MCP和mMAP+1-MCP 处理组蓝莓果实原果胶含量整体呈先升后降的趋势,贮藏40 d 出现降低的趋势且在贮藏前、后含量变化不大,而CK 组蓝莓果实原果胶含量在0~20 d 快速下降,之后趋于平稳。在贮藏过程中,3 个处理组较CK 组始终维持一个更高的原果胶含量,可延缓果实变软,且mMAP+1-MCP 处理组原果胶含量始终最高。
Vicente 等[21]的研究结果表明,在成熟过程中果胶的增溶作用增强。由图2d 可得,4 个处理组的可溶性果胶含量均随贮藏期的延长整体呈增加趋势,且在0~20 d 快速上升,其中CK 组的变化最大;20 d 后含量变化相对缓慢,mMAP+1-MCP 和mMAP 处理组始终维持较低的可溶性果胶含量。
2.3 微环境气调对蓝莓果实细胞壁降解酶活性的影响
在未成熟的果实中,纤维素酶(Cx)活性很低,随着果实的成熟,编码其蛋白的mRNA 表达量增加[22]。如表2所示,在贮藏0 d 时,mMAP+1-MCP处理的Cx 活性显著低于其它处理组 (P<0.05),说明mMAP+1-MCP 处理可直接影响到贮藏初期Cx 活性。在贮藏过程中,Cx 活性整体呈上升趋势,贮藏20~40 d,CK 组酶活性大幅上升并达到最大值36.96 μg/(h·g),mMAP 和1-MCP 处理的Cx 活性在贮藏40 d 达到最大值,分别为33.72 μg/(h·g)和35.07 μg/(h·g),而mMAP+1-MCP 处理组在60 d 时达到活性高峰,为33.19 μg/(h·g)。3 种处理在贮藏中后期均可降低Cx 活性峰值,且mMAP结合1-MCP 可延缓酶活性高峰的到来并降低其峰值。
贮藏0 d 时,mMAP 和mMAP+1-MCP 处理组多聚半乳糖醛酸酶(PG)活性均高于另外两个处理组,说明mMAP 处理可直接刺激PG 活性,使之处于较高水平,而mMAP 结合1-MCP 效果更显著(P<0.05)。随着贮藏时间的延长,CK 组PG 活性上升幅度大,1-MCP 处理在0~20 d 快速上升,之后趋于平缓;mMAP 和mMAP+1-MCP 处理在0~40 d 酶活性变化不大,40 d 之后开始有小幅度的上升。3 个处理组在贮藏中后期均可降低PG 活性,mMAP+1-MCP 处理效果更佳。
贮藏0~20 d,CK 组的果胶甲酯酶(PME)活性有较高幅度的上升,并在贮藏20 d 达到活性高峰为13.18 U/g,之后稍有下降,其它3 个处理的PG活性则在贮藏20 d 之后出现不同程度的上升,mMAP 处理组在贮藏40 d 达到酶活高峰,为12.84 U/g,而1-MCP 和mMAP+1-MCP 处理则在贮藏60 d 达到活性高峰,分别为12.78 U/g 和12.65 U/g;在贮藏中后期(40~60 d),各处理之间的PG 活性差异不显著(P>0.05)。
贮藏0~20 d,各处理α-L-阿拉伯呋喃糖苷酶(α-Af)活性均不同程度上升,mMAP+1-MCP 在贮藏20 d 即达到酶活高峰为15.05 U/g,之后mMAP+1-MCP 处理组α-Af 活性缓慢下降。mMAP 和1-MCP 处理组α-Af 活性缓慢升高并在贮藏60 d 达到最高值,分别为15.80 U/g 和15.31 U/g。CK 组α-Af 活性在贮藏40 d 达酶活高峰为15.14 U/g,表明mMAP 和1-MCP 处理可以延缓α-Af 活性峰值到来的时间;贮藏中后期 (40~60 d),mMAP+1-MCP 处理果实α-Af 活性均低于其它处理组,贮藏60 d 时差异显著(P<0.05)。
各处理组的β-半乳糖醛酸糖苷酶(β-Gal)活性随贮藏时间的延长均有一个上升阶段,其中CK组在贮藏20 d 时达到酶活性高峰 (22.67 U/g),mMAP 和1-MCP 在60 d 才达到活性峰值,分别为21.27 U/g 和21.07 U/g,而mMAP+1-MCP 处理组在贮藏40 d 达到β-Gal 活性高峰为19.63 U/g,仅为20 d 时CK 组的86.59%。贮藏0~20 d,mMAP和1-MCP 处理均能有效抑制β-Gal 活性,到贮藏60 d 贮藏结束时,mMAP+1-MCP 处理仍可维持较低的酶活性,显著低于其它处理组,其活性仅为其它2 个处理组的83.07%和83.86%。
根据表2结果将果实硬度最佳的mMAP+1-MCP 处理作为组1,将其它3 个处理作为组2,对两个组的细胞壁多糖含量进行正交偏最小二乘法判别分析(OPLS-DA),探究mMAP+1-MCP 处理与其它3 个处理间的差异性指标。由图3a 可得,mMAP+1-MCP 处理与另外3 个处理组之间区分较好,mMAP+1-MCP 处理位于左边,其它3 个处理多数位于右边。以VIP>1 为筛选标准,由图3b可得,贮藏期的mMAP+1-MCP 和其它3 个处理之间的差异性指标为Cx 和β-Gal,说明mMAP+1-MCP 处理可以更有效地抑制Cx 和β-Gal活性。

图3 mMAP+1-MCP 处理与另外3 个处理的OPLS-DA 分析
Fig.3 The OPLS-DA analysis of mMAP+1-MCP and the other three treatments
表2 微环境气调对蓝莓贮藏期细胞壁降解酶活性的影响
Table 2 The effects of micro-environmental modified atmosphere on activities of cell wall degrading enzymes of blueberries during storage
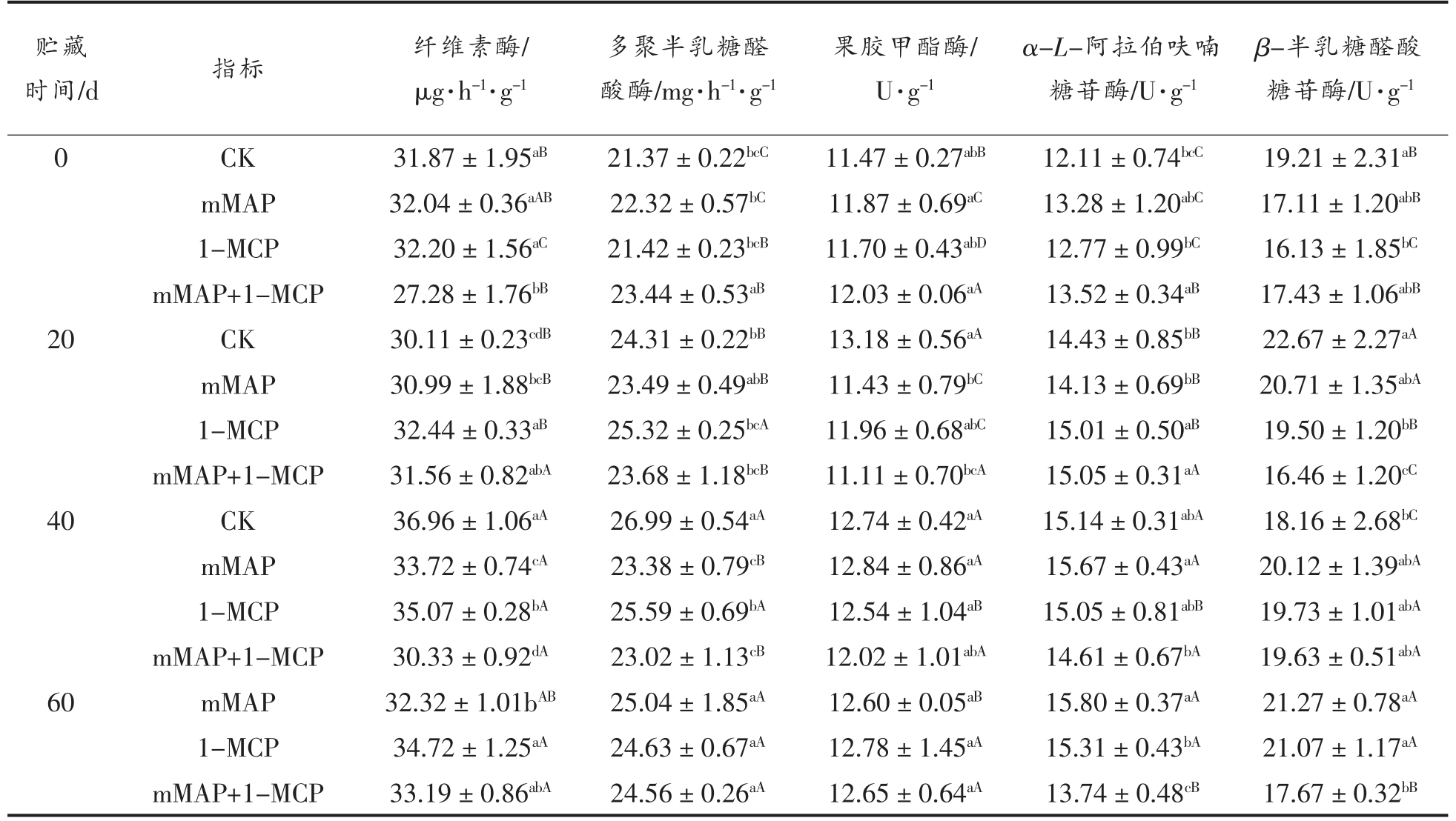
注:不同的小写字母表示相同时间不同处理组间差异显著(P<0.05);不同的大写字母表示相同处理不同时间间差异显著(P<0.05)。
时间/d 指标 纤维素酶/μg·h-1·g-1贮藏β-半乳糖醛酸糖苷酶/U·g-1 0 CK 31.87±1.95aB 21.37±0.22bcC 11.47±0.27abB 12.11±0.74bcC 19.21±2.31aB mMAP 32.04±0.36aAB 22.32±0.57bC 11.87±0.69aC 13.28±1.20abC 17.11±1.20abB 1-MCP 32.20±1.56aC 21.42±0.23bcB 11.70±0.43abD 12.77±0.99bC 16.13±1.85bC mMAP+1-MCP 27.28±1.76bB 23.44±0.53aB 12.03±0.06aA 13.52±0.34aB 17.43±1.06abB 20 CK 30.11±0.23cdB 24.31±0.22bB 13.18±0.56aA 14.43±0.85bB 22.67±2.27aA mMAP 30.99±1.88bcB 23.49±0.49abB 11.43±0.79bC 14.13±0.69bB 20.71±1.35abA 1-MCP 32.44±0.33aB 25.32±0.25bcA 11.96±0.68abC 15.01±0.50aB 19.50±1.20bB mMAP+1-MCP 31.56±0.82abA 23.68±1.18bcB 11.11±0.70bcA 15.05±0.31aA 16.46±1.20cC 40 CK 36.96±1.06aA 26.99±0.54aA 12.74±0.42aA 15.14±0.31abA 18.16±2.68bC mMAP 33.72±0.74cA 23.38±0.79cB 12.84±0.86aA 15.67±0.43aA 20.12±1.39abA 1-MCP 35.07±0.28bA 25.59±0.69bA 12.54±1.04aB 15.05±0.81abB 19.73±1.01abA mMAP+1-MCP 30.33±0.92dA 23.02±1.13cB 12.02±1.01abA 14.61±0.67bA 19.63±0.51abA 60 mMAP 32.32±1.01bAB 25.04±1.85aA 12.60±0.05aB 15.80±0.37aA 21.27±0.78aA 1-MCP 34.72±1.25aA 24.63±0.67aA 12.78±1.45aA 15.31±0.43bA 21.07±1.17aA mMAP+1-MCP 33.19±0.86abA 24.56±0.26aA 12.65±0.64aA 13.74±0.48cB 17.67±0.32bB多聚半乳糖醛酸酶/mg·h-1·g-1果胶甲酯酶/U·g-1 α-L-阿拉伯呋喃糖苷酶/U·g-1
2.4 微环境气调对蓝莓果实细胞壁关键降解酶基因表达的影响
由图4a 可得,贮藏0~20 d,mMAP 和1-MCP处理后蓝莓果实中Cx 基因表达量高于对照,说明气调和1-MCP 处理均可刺激蓝莓中Cx 的启动。CK 和1-MCP 处理组在贮藏0 d 时Cx 基因表达量达到最高,mMAP 和mMAP+1-MCP 处理则在贮藏60 d 时基因表达量达到最高值,而在2.3 节Cx活性分析中得CK、mMAP 和1-MCP 处理组蓝莓在贮藏40 d 时达到峰值,mMAP+1-MCP 处理在贮藏60 d 达到活性峰值,说明CK 和1-MCP 处理组的Cx 基因表达优先于其酶活,mMAP 和mMAP+1-MCP 处理均可通过延缓基因表达峰值到来从而有效抑制蓝莓贮藏过程中Cx 基因表达。
由图4b 可得,随着贮藏时间的延长,mMAP+1-MCP 处理β-Gal 基因表达量呈现先降低后上升的趋势,而其它3 组呈现出先上升后降低的趋势。CK 组在贮藏20 d 时β-Gal 基因表达量达到峰值,与β-Gal 活性峰值出现时间相同,mMAP 在贮藏20 d 时基因表达量达到峰值,1-MCP 在贮藏40 d 时基因表达量达到峰值,对应表2可知,mMAP 和1-MCP 处理的β-Gal 基因表达量优先于β-Gal 活性,而mMAP+1-MCP 处理的β-Gal 基因表达量则晚于其β-Gal 活性,在贮藏60 d 时才达到基因表达量峰值,而在贮藏20 d 和40 d β-Gal 基因表达量均低于其它处理组,表明mMAP+1-MCP 可通过延缓β-Gal 基因表达量峰值到来,从而有效抑制蓝莓中β-Gal 的基因表达。

图4 微环境气调对蓝莓贮藏期Cx(a)和β-Gal(b)基因相对表达量的影响
Fig.4 The effects of micro-environmental modified atmosphere on relative expression of Cx (a) and β-Gal (b) gene of blueberries during storage
3 讨论
mMAP 和mMAP+1-MCP 处理组中气调元件的渗透作用和蓝莓果实的呼吸作用使箱内气体成分保持一个适合蓝莓贮藏的低氧高二氧化碳的动态平衡。3 个处理均可降低软果率,mMAP+1-MCP处理效果最显著(P<0.05)且mMAP 结合1-MCP处理在贮藏结束时可以保持更高的果实硬度。
Wang 等[23]的研究表明蓝莓果实软化与品质劣变和果实衰老密切相关,软化是蓝莓果实采后品质劣变的主要原因,人们普遍认为水果软化部分与细胞壁聚合物发生的改变有关[24]。Wang 等[25]指出,果胶物质的降解、PE 及PG 的表达导致蓝莓软化。Chea 等[26]指出,阿拉伯糖的大量流失及半纤维素含量的降低与蓝莓果实软化息息相关。从本文的研究结果来看,随着贮藏期延长,纤维素和半纤维素不断被降解,果胶由不溶转化为可溶,从而使果实质地不断变软,mMAP 和1-MCP 处理有效地保持较高的纤维素、半纤维素和原果胶含量,抑制贮藏中前期可溶性果胶含量的增加,与以往研究结果具有相似之处。
细胞壁多糖的降解与果实中的相关酶密切相关。Cx 是一种复合酶类,在成熟果实中含量丰富,可降解羧甲基纤维素、木葡聚糖和具有葡聚糖结构的物质[27]。PG 是重要的水解酶,其可水解多聚半乳糖醛酸[28],破坏细胞壁结构,使果实变软。PME主要通过作用于半乳糖醛酸残基中的C-6 酯化基团来参与果胶物质的脱甲基化反应,促进高酯化的果胶转化为去酯化的果胶酸,为PG 提供作用基质[29]。α-Af 是一种糖苷酶类,它可以通过水解非还原呋喃阿拉伯糖残基来降解细胞壁中的阿拉伯半乳聚糖、阿拉伯甘露聚糖等中性糖,增加果胶的可溶性,促进其降解[30]。β-Gal 主要降解果胶和半纤维素,同时对糖蛋白和糖脂也有降解作用[31]。纪淑娟等[32]研究表明蓝莓的软化和Cx、PG 及β-Gal 活性密切相关。Chen 等[33]研究表明,冷藏可以通过抑制Cx、PG 和β-Gal 酶活性延缓果胶的增溶,抑制蓝莓果实软化。本研究结果表明,mMAP+1-MCP在贮藏中后期能够抑制Cx、PG、PME、β-Gal 和α-Af 活性,利用OPLS-DA 分析可得,mMAP+1-MCP与其它处理组差异性指标为Cx、β-Gal,通过这两种关键细胞壁降解酶的基因表达分析表明,mMAP+1-MCP 处理延缓了贮藏期间Cx 和β-Gal基因表达量的出峰时间。
4 结论
微环境气调(mMAP+1-MCP)可以延缓抑制细胞壁降解酶的活性以及Cx 和β-Gal 基因表达量出峰时间,延缓细胞壁多糖的降解,有效减缓蓝莓果实贮藏过程中的软化,维持果实的硬度。
[1]黄晓杰.采后处理对蓝莓果实衰老的作用及机理研究[D].沈阳:沈阳农业大学,2016.
HUANG X J.Effect and mechanism of postharvest treatment on blueberry fruit senescence[D].Shenyang:Shenyang Agricultural University,2016.
[2]李丽敏.中国蓝莓产业发展研究[D].长春:吉林农业大学,2011.
LI L M.Research on the development of blueberry industry in China[D].Changchun:Jinlin Agricultural University,2011.
[3]CHU W J,GAO H Y,CHEN H J,et al.Effects of cuticular wax on the postharvest quality of blueberry fruit[J].Food Chemistry,2018,239(15):68-74.
[4]孙文丽,郜海燕,韩延超,等.EPE 减振包装对蓝莓贮藏品质的影响[J].中国食品学报,2020,20(10):232-239.
SUN W L,GAO H Y,HAN Y C,et al.Effects of EPE vibration-damping packaging on the storage quality of blueberry[J].Journal of Chinese Institute of Food Science and Technology,2020,20(10):232-239.
[5]王秀.蓝莓果实采后软化与细胞壁代谢关系研究[D].南京:南京农业大学,2014.
WANG X.Study on the relationship between postharvest softening and cell wall metabolism of blueberry fruit[D].Nanjing:Nanjing Agricultural University,2014.
[6]高雅,王琛,魏宝东,等.蓝莓保鲜技术研究进展[J].辽宁农业科学,2017(6):53-55.
GAO Y,WANG C,WEI B D,et al.Research progress of blueberry preservation technology[J].Liaoning Agricultural Sciences,2017(6):53-55.
[7]王琛.60Co γ 辐照处理对蓝莓保鲜效应及其细胞壁降解机理的研究[D].沈阳:沈阳农业大学,2016.
WANG C.Study on the preservation effect of 60Co γ irradiation treatment on blueberry and the degradation mechanism of cell wall[D].Shenyang:Shenyang Agricultural University,2016.
[8]刘永国,蔡琦玮,王友升.蓝莓果实的品质劣变及其控制技术[J].食品科技,2013,38(8):85-88.
LIU Y G,CAI Q W,WANG Y S.Mechanism of quality deterioration and controlling technology of blueberry fruit [J].Food Science and Technology,2013,38(8):85-88.
[9]李天元.贮藏微环境气体调控保鲜浆果的技术研究[D].大连:大连工业大学,2016.
LI T Y.Study on the technology of keeping berries fresh by regulating the storage microenvironment gas[D].Dalian:Dalian Polytechnic University,2016.
[10]张鹏,李天元,李江阔,等.贮藏微环境气体调控对精准相温贮藏后阳丰甜柿货架品质的影响[J].食品与发酵工业,2017,43(10):121-128.
ZHANG P,LI T Y,LI J K,et al.Effect of microenvironment gas regulation on the quality of sweet persimmon after accurate phase temperature storage[J].Food and Fermentation Industries,2017,43(10):121-128.
[11]赵杰,佟伟,李振茹,等.不同气调贮藏方式对水蜜桃保鲜效果的影响[J].中国果树,2017(3):38-40.
ZHAO J,TONG W,LI Z R,et al.Effects of different controlled atmosphere storage methods on the fresh-keeping effect of honey peach[J].China Fruits,2017(3):38-40.
[12]张鹏,朱文月,李江阔,等.微环境气体调控在果蔬保鲜中的研究进展[J].包装工程,2020,41(1):1-10.
ZHANG P,ZHU W Y,LI J K,et al.Research progress of microenvironment gas regulation in preservation of fruits and vegetables[J].Packaging Engineering,2020,41(1):1-10.
[13]刘振通.箱式气调对葡萄、软枣猕猴桃冷藏品质调控效应的研究[D].沈阳:沈阳农业大学,2017.
LIU Z T.Study on the effect of box controlled atmosphere on the cold storage quality of grape,soft jujube and kiwi fruit[D].Shenyang:Shenyang Agricultural University,2017.
[14]FALAGÁN N,MICLO T ,TERRY L A.Graduated controlled atmosphere:A novel approach to increase"Duke" blueberry storage life[J].Frontiers in Plant Science,2020,11:221.
[15]PARK M H,SANGWANANGKUL P,CHOI J W.Reduced chilling injury and delayed fruit ripening in tomatoes with modified atmosphere and humidity packaging [J].Scientia Horticulturae,2018,231:66-72.
[16]CANTÍN C M,MINAS I S,GOULAS V,et al.Sulfur dioxide fumigation alone or in combination with CO2-enriched atmosphere extends the market life of highbush blueberry fruit[J].Postharvest Biology and Technology,2012,67:84-91.
[17]薛璐,刘小路,鲁晓翔,等.近红外漫反射无损检测蓝莓硬度的研究[J].浙江农业学报,2015,27(9):147-152.
XUE L,LIU X L,LU X X,et al.Non-destructive detection of blueberry hardness based on near-infrared diffused spectroscope [J].Acta Agriculturae Zhejiangensis,2015,27(9):147-152.
[18]韩双双.不同脱涩方法对磨盘柿货架品质及ADH 基因表达情况调查[D].沈阳:辽宁大学,2019.
HAN S S.Effects of different acerbity removal methods on shelf quality and ADH gene expression of Mopan persimmon[D].Shenyang:Liaoning University,2019.
[19]CHANG E H,LEE J S,KIM J G.Cell wall degrading enzymes activity is altered by high carbon dioxide treatment in postharvest ‘Mihong’ peach fruit[J].Scientia Horticulturae,2017,225:399-407.
[20]章宁瑛.臭氧处理及气调包装对蓝莓采后贮藏品质和生理代谢的影响[D].合肥:安徽农业大学,2017.
ZHANG N Y.Effects of ozone treatment and modified atmosphere packaging on postharvest storage quality and physiological metabolism of blueberries[D].Hefei:Anhui Agricultural University,2017.
[21]VICENTE A R,ORTUGNO C,POWELL A L T,et al.Temporal sequence of cell wall disassembly events in developing fruits.1.Analysis of raspberry(Rubus idaeus)[J].Journal of Agricultural and Food Chemistry,2007,55(10):4119-4124.
[22]赵云峰,林河通,林娇芬,等.果实软化的细胞壁降解酶及其调控研究进展[J].仲恺农业工程学院学报,2006,19(1):65-70.
ZHAO Y F,LIN H T,LIN J F,et al.A review of cell wall-degrading enzymes in fruit softening and their control[J].Journal of Zhongkai University of Agriculture and Technology,2006,19(1):65-70.
[23]WANG S Y,ZHOU Q,ZHOU X ,et al.The effect of ethylene absorbent treatment on the softening of blueberry fruit[J].Food Chemistry,2018,246(25):286-294.
[24]ANGELETTI P,CASTAGNASSO H,MICELI E,et al.Effect of preharvest calcium applications on postharvest quality,softening and cell wall degradation of two blueberry (Vaccinium corymbosum) varieties[J].Postharvest Biology&Technology,2010,58(2):98-103.
[25]WANG S Y,ZHOU Q,ZHOU X,et al.Ethylene plays an important role in the softening and sucrose metabolism of blueberries postharvest[J].Food Chemistry,2020,310(25):125965.
[26]CHEA S,YU D J,PARK J,et al.Fruit softening correlates with enzymatic and compositional changes in fruit cell wall during ripening in ‘Bluecrop’highbush blueberries [J].Scientia Horticulturae,2019,245:163-170.
[27]王秀.蓝莓果实采后软化与细胞壁代谢关系研究[D].南京:南京农业大学,2014.
WANG X.Study on the relationship between postharvest softening and cell wall metabolism of blueberry fruit[D].Nanjing:Nanjing Agricultural University,2014.
[28]张丙秀,王傲雪,李景富.番茄果实细胞壁水解酶研究进展 [J].东北农业大学学报,2009,40(1):128-132.
ZHANG B X,WANG A X,LI J F.Progress on cell wall hydrolase of tomato fruit [J].Journal of Northeast Agricultural University,2009,40 (1):128-132.
[29]宣继萍,王刚,贾展慧,等.李属植物果实成熟软化研究进展[J].中国农学通报,2015,31(31):104-118.
XUAN J P,WANG G,JIA Z H,et al.Research advances of ripening and softening in Prunus fruit[J].Chinese Agricultural Science Bulletin,2015,31(31):104-118.
[30]贾艳茹.鸭梨和京白梨果实质地变化及其细胞壁多糖降解特性研究[D].秦皇岛:河北科技师范学院,2012.
JAI Y R.Study on the changes of fruit parenchyma and the degradation characteristics of cell wall polysaccharides in Ya pear and Jingbai pear [D].Qinhuangdao:Hebei Normal University of Science&Technology,2012.
[31]田爱梅,刘金龙,曹家树.植物β-半乳糖苷酶[J].中国细胞生物学学报,2014(5):703-707.
TIAN A M,LIU J L,CAO J S.Beta galactosidase in plants[J].Chinese Journal of Cell Biology,2014(5):703-707.
[32]纪淑娟,卜凤雅,周倩,等.冷藏对蓝莓果实细胞壁组分及其降解酶活性的影响[J].食品与发酵工业,2014,40(6):199-204.
JI S J,BU F Y,ZHOU Q,et al.Effects of refrigeration on cell wall components and cell wall-degrading enzyme activities of blueberries[J].Food and Fermentation Industries,2014,40(6):199-204.
[33]CHEN H J,CAO S F,FANG X J,et al.Changes in fruit firmness,cell wall composition and cell wall degrading enzymes in postharvest blueberries during storage[J].Scientia Horticulturae,2015,188:44-48.