轻腌大黄鱼(Larimichthys crocea)因营养丰富极易受环境因素的影响而发生腐败,微生物生长繁殖是鱼肉品质下降的主要诱因。有部分微生物在特定条件下产生腐败代谢产物,成为水产品质变的优势菌群,主要原因是此类特定腐败菌(Special spoilage organism,SSOs)降解蛋白质产生生物胺、三甲胺等小分子具有刺激性气味的代谢物,导致水产品达到感官拒绝点[1]。普通变形杆菌和蜂房哈夫尼菌是常见的肠道致病菌,均属于革兰氏阴性杆菌,容易引起肠胃感染,出现腹泻、呕吐等症状,严重时可能引发脑膜炎、败血症等疾病[2-3]。两菌可引起高营养物腐败变质,降低食用价值,水产品、肉类产品质量恶化与之密切相关。微生物细菌间通讯交流机制是通过信号分子调控产生群体感应,引导生物被膜产生、胞外酶产物活性改变等群体行为[4]。生物被膜被一些富含多糖、多肽和磷脂的大分子包裹,使其不受外界侵害,附着于物体表面,具有黏附性,难以清除,污染性大[5]。腐败菌生物被膜的形成和泳动性受到群体感应系统的调控[6]。抑菌剂可对群体行为产生阻碍作用,通过抑制群体感应有效控制特定腐败菌的腐败能力。如使用天然抗菌剂、防腐剂、基因敲除等多种方法延长水产品的货架期并减少由特定腐败菌引起的食源性疾病的发生。二烯丙基二硫醚能够抑制蜂房哈夫尼菌的群体感应活性、生物被膜等,从而发挥防腐功效[7]。天然的香苦草提取物可调控普通变形杆菌群体感应系统,降低生物被膜、毒力因子等产生[8]。
抗菌剂壳聚糖、乳酸链球菌素具有不同的抑菌特征,已应用于食品添加剂和生物医用等众多领域。壳聚糖为天然多糖甲壳素脱除部分乙酰基的产物,具有生物降解性、无毒性、降脂、广谱抑菌性等多种生理功能,在酸性条件下带正电荷,可与细菌细胞膜上带负电荷的物质结合,发生吸附作用,破坏细胞膜以致胞内物质渗漏出来 ,使细菌形态、细胞内部均发生明显变化,从而杀死细菌达到抑菌效果[9]。研究表明其抗菌活性随脱乙酰化度的升高而增强,能进入大肠杆菌细胞内部使菌体凹陷变形并伴有自溶现象[10]。乳酸链球菌素是由乳酸菌发酵生产的多肽类天然生物抗菌剂,能够抑制或杀死其它细菌,通常乳酸链球菌素对革兰氏阳性菌(G+) 产生抑制作用,对革兰氏阴性菌(G-)不存在抑菌效应[11]。乳酸链球菌素对普通变形杆菌(G-)抑菌率极低,几乎没有明显作用[12]。然而,据报道乳酸链球菌素结合壳聚糖复合作用可对大多数鱼源腐败菌(G-)产生协同抑菌效果。He 等[13]研究发现:0.6% 乳酸链球菌素协同1%壳聚糖对细菌生长和生物被膜形成均具有显著的抑制作用。壳聚糖联合乳酸钠(SL)、乳酸链球菌素对鱼类腐败菌群均有协同抑制效应,对大黄鱼的保鲜具有一定的积极作用[14]。Schelegueda 等[15]证明壳聚糖、乳酸链球菌素和乳酸钠联合抑制鱼类腐败相关微生物时会产生协同作用,并对抗菌剂联合应用于鱼类保鲜的可能性进行评价。
为阐明壳聚糖、乳酸链球菌素对普通变形杆菌和蜂房哈夫尼菌群体感应的抑制作用,本文探究大黄鱼鱼汁在5 ℃冷藏条件下,壳聚糖和乳酸链球菌素对特定腐败菌生长的影响。基于壳聚糖的最小亚抑菌浓度,共制备4 种处理组的鱼汁,探究单一及复合抑菌剂对两菌生长特性及代谢产物的影响。此外,对胞外蛋白酶活性、生物被膜及生物胺等代谢产物定量检测,比对单一和复合抑菌剂对两菌的抑制效应,旨在评估乳酸链球菌素复合壳聚糖是否抑制两菌细胞生长或发生物理损伤,为轻腌大黄鱼靶向抑菌提供参考。
1 材料与方法
1.1 材料
原料鱼:冰鲜大黄鱼,宁德某水产有限公司。
菌种来源:普通变形杆菌(Proteus vulgaris,序列号:KY684257)、蜂房哈夫尼菌(Hafnia alvei,序列号:KY684258) 均分离于5 ℃贮藏的轻腌大黄鱼货架期终点。
1.2 试剂与仪器
氧化三甲胺,阿拉丁生化科技有限公司;壳聚糖,coolaber 公司;乳酸链球菌素,浙江新银象生物工程有限公司;色胺盐酸盐(纯度>99%)、组胺盐酸盐(纯度>99%)、腐胺盐酸盐(纯度>98%)、尸胺盐酸盐(纯度>98%)、乙酸铵、正己烷、丹黄酰氯,偶氮酪蛋白,Micklin 公司;三氯乙酸、正丁醇、三氯甲烷、丙酮、乙醚、谷氨酸钠、碳酸氢钠、氯化钠、氢氧化钠,国药集团;1 mol/L 盐酸,北京天恩泽基因科技有限公司。
SW-CJ-1FB 超净台,上海博迅实业有限公司;DDSJ-308A 电导率仪,上海仪电科学仪器股份有限公司;MIR-153 型高精密度低温培养箱,上海一恒科学仪器有限公司;Spark10M 多功能酶标仪,瑞士帝肯公司;PHS-3C pH 计,上海精密科学仪器有限公司;BIOSCREEN C 微生物生长测定仪,芬兰Oy growth curve 公司;Avanti J-301 高速冷冻离心机,美国贝克曼库尔特公司;NITROGEN EVAPORATOR 氮吹仪,上海安谱科学仪器有限公司;Agilent 1260 高效液相色谱,美国安捷伦科技公司;ZHWY-200H 恒温震荡培养器,上海智城分析仪器制造有限公司;紫外分光光度计,莱伯泰科有限公司;恒温培养振荡器,上海智城分析仪器制造有限公司;HY-4A 调速多用振荡器,常州峥嵘仪器有限公司。
1.3 试验方法
1.3.1 鱼汁制备 参照Dalgaard 等[16]的方法略作修改,将大黄鱼从真空包装袋中取出,取肉剪成细条,组织搅拌机打碎,鱼水比1∶2 煮沸15 min,过滤弃去鱼渣,滤液备用。将上述滤液于4 200 r/min,离心30 min 取上清液,再次过滤。向滤液中加入0.1 mol/L 的磷酸缓冲液,用NaOH/HCl 调节pH 值为6.6±0.1。向鱼汁中加入1.6 g/L 氧化三甲胺(TMAO)、40 mg/L 半胱氨酸和40 mg/L L-甲硫氨酸,分装至试管121 ℃灭菌15 min。
1.3.2 接种液制备
1.3.2.1 最小抑菌浓度(MIC)测定 将0.01 g 壳聚糖添加至装有20 mL 灭菌鱼汁的离心管中,混匀充分溶解后,取10 mL,采用二倍梯度稀释法稀释至质量浓度为500,250,125,62.5,31.25 μg/mL的接种液,以鱼汁和营养肉汤作阴性对照。参考文献[15],特定腐败菌5 ℃培养48 h,以OD600nm 增长不超过0.1 为生长和不生长界限。
1.3.2.2 复合抑菌剂制备 将已经梯度稀释好的10 mL 壳聚糖亚抑菌浓度灭菌鱼汁分别添加0.0025,0.005,0.01 g 乳酸链球菌素至最终复合质量浓度组F1:62.5 μg/mL 壳聚糖;F2:62.5 μg/mL壳聚糖+250 μg/mL 乳酸链球菌素;F3:62.5 μg/mL壳聚糖+500 μg/mL 乳酸链球菌素;F4:62.5 μg/mL 壳聚糖+1 000 μg/mL 乳酸链球菌素。
1.3.3 菌悬液接种
1.3.3.1 菌株活化 分别挑取一环普通变形杆菌和蜂房哈夫尼菌斜面接种至LB 肉汤培养基中,在30 ℃、150 r/min 摇床振荡培养18 h,平板划线法得到单菌落,挑取直径大约为3 mm 单菌落放大培养,25 ℃过夜培养达到109 CFU/mL,4 ℃存放备用,用时用生理盐水稀释。
1.3.3.2 菌悬液接种
1)最小抑菌浓度测定 检测最小抑菌浓度采用微孔板法,取180 μL 不同浓度接种液至微孔板,将20 μL 约108 CFU/mL 普通变形杆菌和蜂房哈夫尼菌菌悬液分别接种于微孔板使得最终浓度为107 CFU/mL,盖好孔板盖置于BIOSCREEN 中速震荡检测OD600nm 吸光度值。5 ℃恒温培养,每个试验组3 个平行。
2)代谢产物的检测 将100 μL 约108 CFU/mL 菌悬液接种至装有不同复合抑菌剂浓度的10 mL 鱼汁中,5 ℃恒温中速振荡贮藏6 d,适时检测生物被膜、胞外蛋白酶活性、生物胺等指标,以不添加保鲜剂为空白对照组,每个指标每个试验做2 个平行。
1.3.4 化学指标
1.3.4.1 pH 值和电导率 取适量鱼汁,分别用将pH 计和电导率仪探头置于样品液中测定,数值稳定为结果值。
1.3.4.2 胞外蛋白酶活力 参照文献[17]略作修改,将样品在10 000×g、10 min 条件下离心,取上清液与等体积(800 μL)偶氮酪蛋白(20 g/L)混合,在30 ℃下反应30 min;用800 μL 0.5 mol/L 三氯乙酸终止反应。在室温下静止30 min 后离心(10 000×g、10 min);取上清液与等体积1 mol/L NaOH 混合,用紫外分光光度计测定波长366 nm处的吸光度值,超纯水作阴性对照。
蛋白酶活性(U/mL)=(样品吸光度值-阴性对照的吸光度值)/0.01
1.3.4.3 生物被膜 参照文献[18]略作修改,分别取不同质量浓度抑菌剂处理组鱼汁180 μL 加入96 孔板中,每个菌株重复4 孔,5 ℃培养至合适时间后取出96 孔板,0.1 g/L 结晶紫染色15 min,弃去,超净水洗掉多余染料后烘干,加入33%冰乙酸,每孔200 μL,放置5 min,将孔壁上结晶紫洗脱。检测前用酶标仪高速振荡20 min 后,测量OD600nm。
1.3.4.4 生物胺 参考国标GB 5009.208-2016《食品安全国家标准 食品中生物胺的测定》 的方法,使用5%三氯乙酸提取2 次,净化2 次,正己烷除脂2 次,正丁醇/三氯甲烷(体积比1∶1)混合溶液萃取2 次,40 ℃水浴氮气吹干,1 mL 0.1 mol/L HCL 漩涡振荡溶解。加入1 mL 饱和碳酸氢钠溶液、100 μL 1 mol/L NaOH 溶液,1 mL 衍生试剂混匀后60 ℃恒温水浴衍生15 min 取出加入100 μL谷氨酸钠混匀,60 ℃恒温水浴15 min。取出,冷却至室温,加入1 mL 水,漩涡混合1 min,40 ℃水浴氮气吹去约1 mL 丙酮。加入0.5 g 氯化钠漩涡振荡至完全溶解后加入5 mL 乙醚,漩涡振荡2 min,静置分层,取上层有机相,萃取2 次,合并萃取液氮气吹干。加入1 mL 乙腈漩涡振荡使残留物完全溶解,0.22 μm 过滤。
色谱条件:C18 柱子,紫外检测波长254 nm,进样量20 μL,柱温35 ℃,流动相A 为90%乙腈/10%乙酸铵溶液,流动相B 为10%乙腈/90%乙酸铵溶液,流速0.8 mL/min 梯度洗脱。
1.3.5 微生物生长一级模型构建及拟合优度
1.3.5.1 一级模型构建 参考朱彦祺等[19]的方法利用修正Gompertz 模型拟合普通变形杆菌和蜂房哈夫尼菌生长情况,公式如(1)所示:
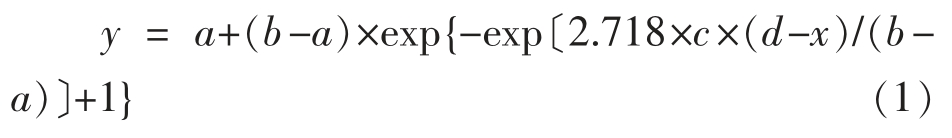
式中,y——t 时OD 值;x——时间,h;a——最小OD 值;b——最大OD 值;c——最大比生长速率,h-1;d——延滞期,h。
1.3.5.2 模型可靠性评价 通过判定系数R2,均方根误差(Root mean square error,RMSE),偏差因子(Bias factor,Bf),准确因子(Accuracy factor,Af)和残差平方和(Sum of squared residuals,RSS)来进行验证。其中R2、Af 和Bf 值越接近于1,RSS、RMSE 越接近于0,表明预测效果越好,评价方程如下。
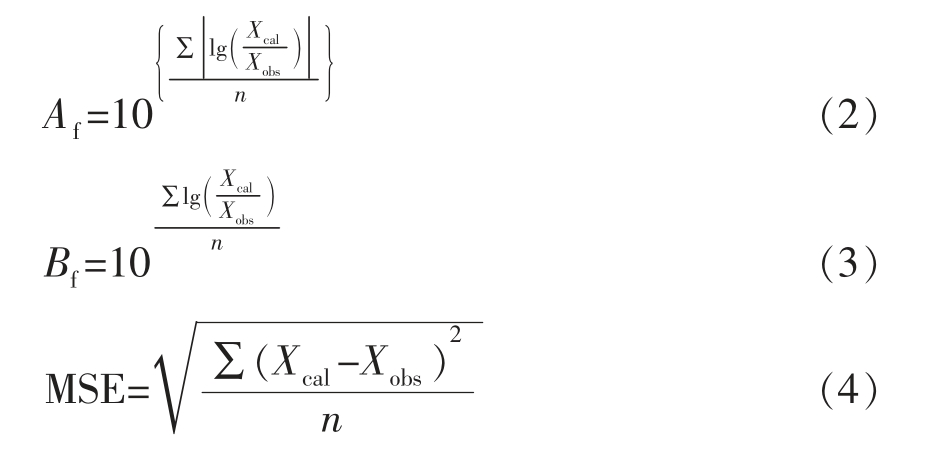
式中,Xcal——预测OD 值;Xobs——实测OD值;n——实测值个数。
1.4 数据分析
采用软件EXCEL 和SPSS 进行数据统计分析,SPSS 的ANOVA 进行方差分析。P<0.05 表示有统计学显著性,P<0.01 表示显著性极大;采用软件Oringin2018 拟合作图,试验取值为均值±标准偏差。
2 结果与分析
2.1 壳聚糖最小抑菌浓度
本研究在5 ℃条件下进行试验,腐败菌敏感度较低,培养48 h 后OD600nm 值变化不大于0.1 认为不生长,被判定为壳聚糖对细菌的最小抑菌浓度。由表1可知,壳聚糖质量浓度大于等于125 μg/mL 对两菌作用均为不生长。表明壳聚糖对普通变形杆菌和蜂房哈夫尼菌的最小抑菌浓度均为125 μg/mL。
表1 不同质量浓度壳聚糖对腐败菌生长的影响
Table 1 Effects of different mass concentrations of chitosan on the growth of putrefactive bacteria
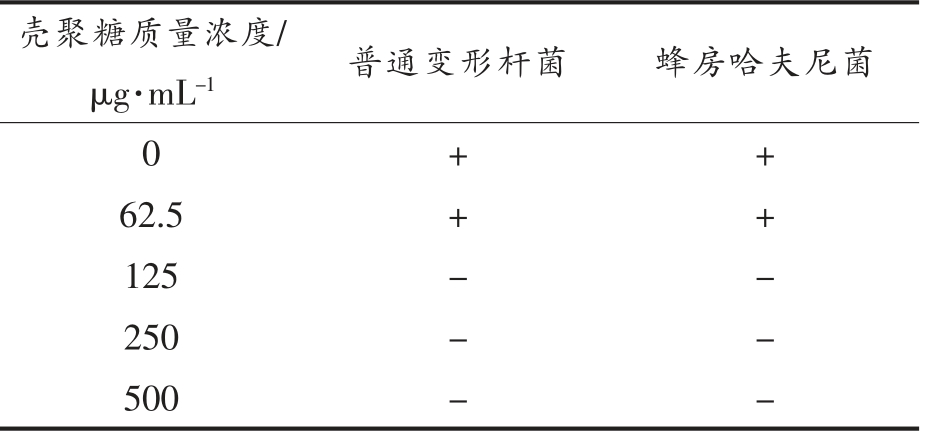
注:“+”代表生长;“-”代表不生长。
壳聚糖质量浓度/μg·mL-1 普通变形杆菌 蜂房哈夫尼菌0++62.5++125--250--500--
2.2 壳聚糖质量浓度对腐败菌生长情况和动力学参数影响
0.995,均>0.95,拟合优度良好。其生长动力学参数如表2所示,普通变形杆菌接种至空白鱼汁最大比生长速率为0.0089 h-1,肉汤为0.0065 h-1,鱼汁生长速率快,延滞期较肉汤短,更接近特定腐败菌生长所需营养条件;此外,随着壳聚糖质量浓度的升高,最大比生长速率先升高后降低,延滞期逐渐增加。壳聚糖质量浓度为125 μg/mL 时,最大生长比率虽较高,但其延滞期相对较长。
表2 不同质量浓度壳聚糖对两菌生长动力学参数的影响
Table 2 Effects of different mass concentrations of chitosan on the growth kinetic parameters of two bacteria
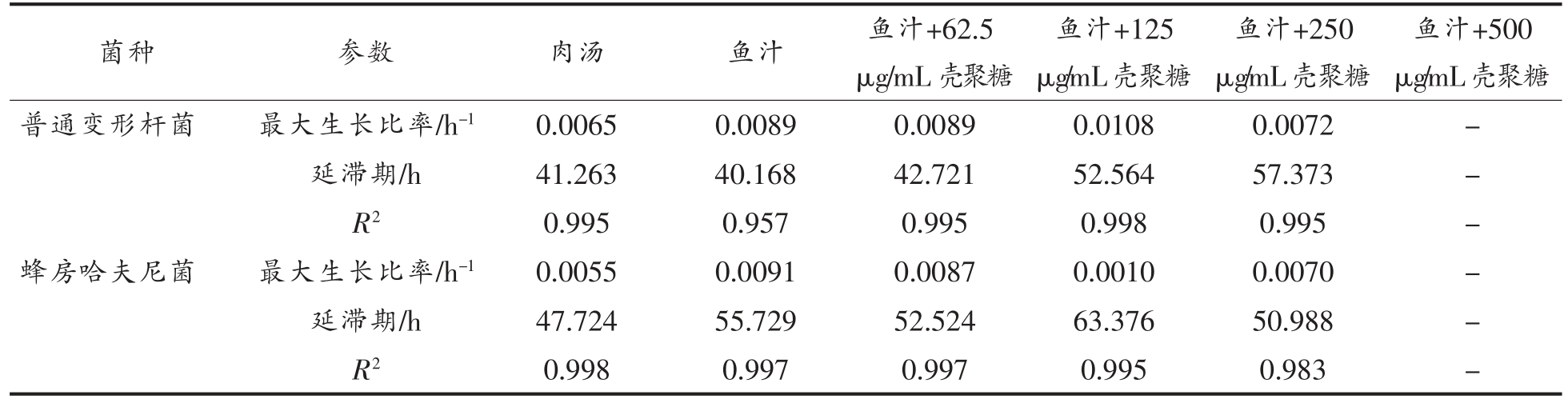
鱼汁+500 μg/mL 壳聚糖普通变形杆菌 最大生长比率/h-1 0.0065 0.0089 0.0089 0.0108 0.0072-延滞期/h 41.263 40.168 42.721 52.564 57.373-R2 0.995 0.957 0.995 0.998 0.995-蜂房哈夫尼菌 最大生长比率/h-1 0.0055 0.0091 0.0087 0.0010 0.0070-延滞期/h 47.724 55.729 52.524 63.376 50.988-R2 0.998 0.997 0.997 0.995 0.983-菌种 参数 肉汤 鱼汁 鱼汁+62.5 μg/mL 壳聚糖鱼汁+125 μg/mL 壳聚糖鱼汁+250 μg/mL 壳聚糖
接种在几种基质上的蜂房哈夫尼菌的判定系数R2 依次为0.998,0.997,0.997,0.995,0.983,均>0.98,拟合优度良好。蜂房哈夫尼菌接种至空白鱼汁最大比生长速率为0.0091 h-1,肉汤为0.0055 h-1,延滞期差异不显著,鱼汁生长速率快。此外,随着壳聚糖添加量增加,最大生长比率先减小后升高,延滞期差异不显著(P>0.5)。同普通变形杆菌相似,壳聚糖质量浓度为125 μg/mL,延滞期最长。
图1为添加不同质量浓度壳聚糖对普通变形杆菌和蜂房哈夫尼菌生长的影响,通过Gompertz模型拟合,得到各组数据预测生长曲线。普通变形杆菌分别接种于空白肉汤、空白鱼汁、添加壳聚糖质量浓度62.5,125,250 μg/mL 的鱼汁等几种基质中,判定系数R2 依次为0.995,0.957,0.995,0.998,
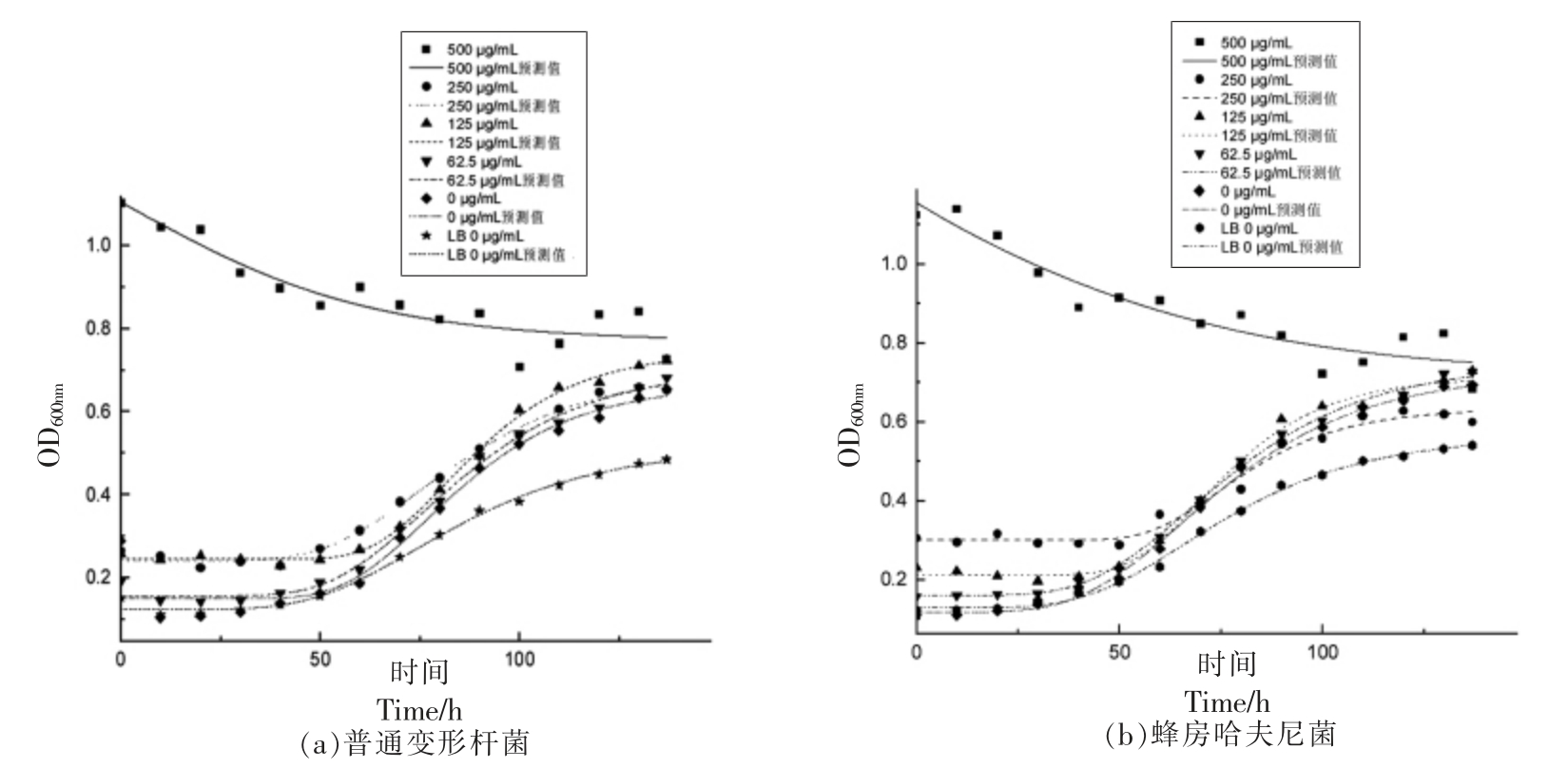
图1 不同壳聚糖质量浓度对普通变形杆菌和蜂房哈夫尼菌生长的影响
Fig.1 Effects of different mass concentrations of chitosan on the growth of Proteus vulgaris and Hafnia alvei
综上,普通变形杆菌和蜂房哈夫尼菌在各个底物条件下,鱼汁生长情况比肉汤好,壳聚糖质量浓度越高,生长越缓慢;相比蜂房哈夫尼菌而言,壳聚糖对普通变形杆菌的影响更大。相比肉汤培养基而言,鱼汁更适和两菌的生长,更还原两菌的实际生长环境。
2.3 复合抑菌剂对腐败菌生长情况及生长动力学的影响
壳聚糖质量浓度选择2.1 节中的亚抑菌浓度,加入不同质量浓度乳酸链球菌素,之后接种普通变形杆菌和蜂房哈夫尼菌。PF1-PF4 分别为F1-F4 组接种普通变形杆菌处理组,PC 为鱼汁接种普通变形杆菌的空白组;FF1-FF4 分别为F1-F4 组接种蜂房哈夫尼菌处理组,FC 为鱼汁接种蜂房哈夫尼菌的空白组。通过修正Gompertz 模型拟合不同抑菌条件下腐败菌的生长趋势。图2和图3分别为不同保鲜剂组合对普通变形杆菌和蜂房哈夫尼菌生长情况及生长动力学参数的影响。接种普通变形杆菌和蜂房哈夫尼菌处理组模型评价中R2 均大于0.998,普通变形杆菌Af 在0.999~1.000 之间,Bf 在1.013~1.024 之间,RMSE 在0.005~0.010 之间;蜂房哈夫尼菌菌Af 在0.999~1.000 之间,Bf 在1.014~1.025 之间,RMSE 在0.004~0.008之间,表明两菌利用该生长模型拟合优度良好。
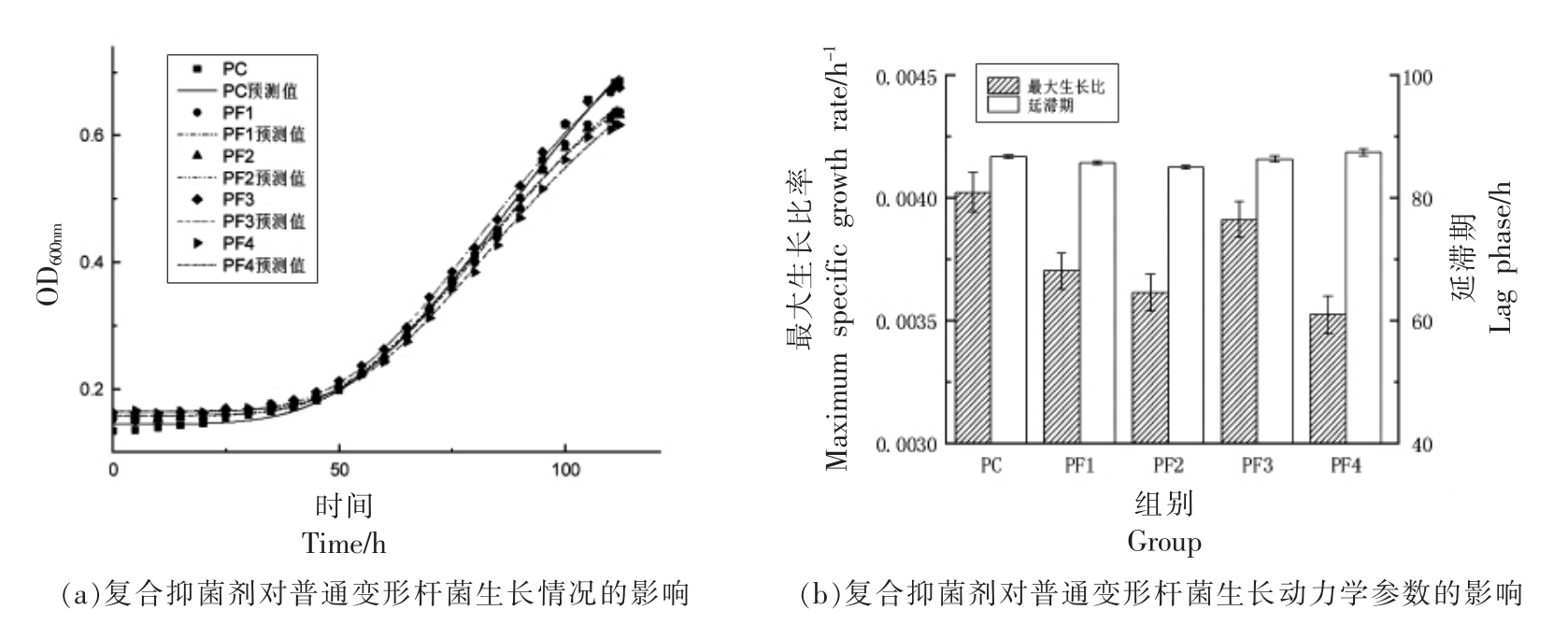
图2 复合抑菌剂对普通变形杆菌生长情况及生长动力学的影响
Fig.2 The effect of compound bacteriostatic agent on the growth and growth dynamics of Proteus vulgaris
由图2可知,添加壳聚糖及其复合乳酸链球菌素对普通变形杆菌的生长动力学参数最大生长比率(μmax)和延滞期(Lag)存在影响。得到如下规律,空白组μmax 最大,所有处理组Lag 没有显著差异,随着复合抑菌剂中乳酸链球菌素质量浓度的增大,Lag 变化不显著,μmax 逐渐减小,然而PF3 组μmax 较大,生长速度较单一接菌组快,没有明显的效果,其中抑制效果最好的是PF4 组。乳酸链球菌素本身对G-菌没有抑制效果,然而复合壳聚糖具有一定的抑菌性能。He 等[13]研究发现在0.6%乳酸链球菌素协同1%壳聚糖对大黄鱼特定腐败菌的生长有抑制作用。
由图3可知,添加壳聚糖及其复合乳酸链球菌素对蜂房哈夫尼菌的生长动力学参数μmax 和Lag 存在影响。得到如下规律,空白组μmax 最大,添加抑菌剂组合μmax 均有所下降,其中FF1 μmax 大于其余添加乳酸链球菌素复合抑菌组,复合抑菌组FF2 和FF3 最大生长比率(μmax)一样,FF2 延滞期(Lag)略高于FF3,显著性差异不大(P<0.05);FF4 Lag(52.03177 h)略大于FF3(51.80112 h),μmax(0.00776 h-1)略大于FF3(0.00766 h-1),复合抑菌组合μmax、Lag 均没有显著性差异(P<0.05)。
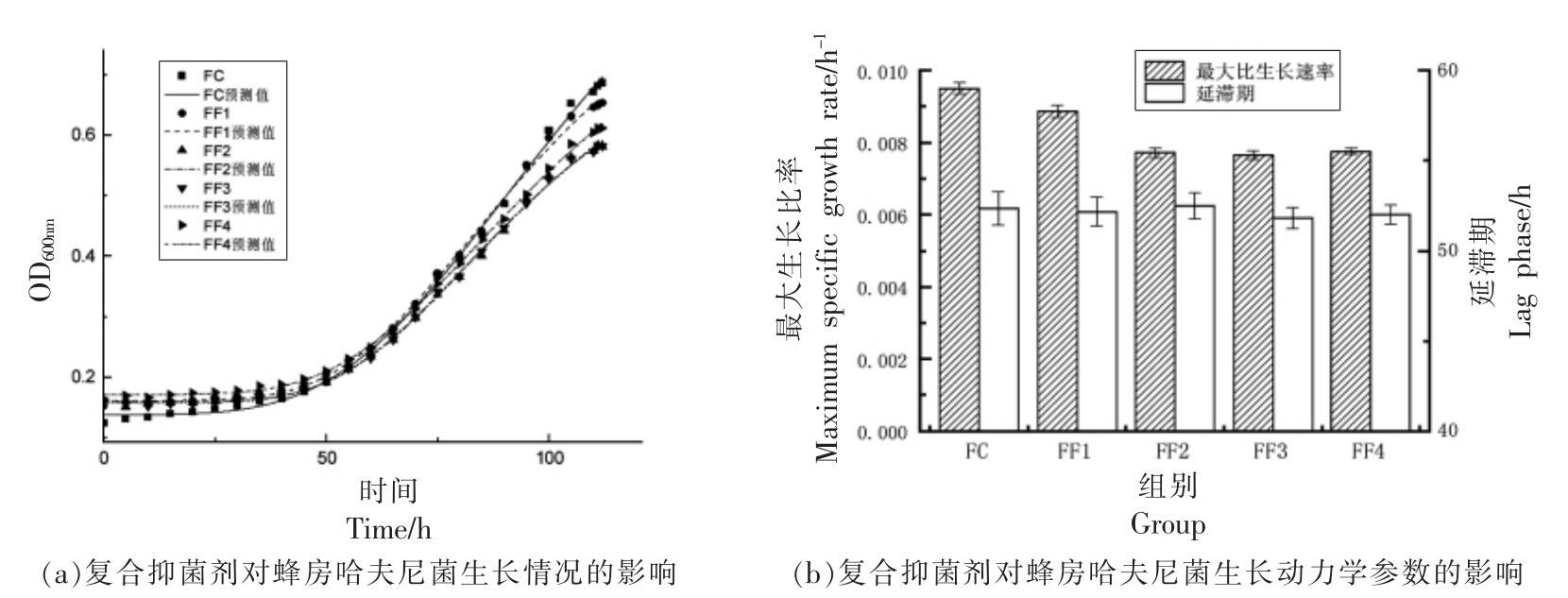
图3 不同抑菌组对蜂房哈夫尼菌生长情况及生长动力学的影响
Fig.3 The effect of compound bacteriostatic agent on the growth and growth dynamics of Hafnia alvei
综上,复合抑菌剂对普通变形杆菌较单一抑菌剂效果好且复合抑菌剂添加1 000 μg/mL 乳酸链球菌素抑菌效果最佳;复合抑菌剂对蜂房哈夫尼菌较单一抑菌剂效果好,乳酸链球菌素添加剂量对蜂房哈夫尼菌各组生长动力学参数无显著性差异(P<0.05)。
2.4 pH 值变化
不同抑菌组对普通变形杆菌和蜂房哈夫尼菌pH 值的影响如图4所示,随着时间延长,FF1、FF3组pH 值呈直接上升趋势,可能是由于微生物生长降解鱼汁营养生成胺类物质,导致溶液中pH值上升;PF1~PF4、FF2、FF4 组pH 值先下降,贮藏3 d 之后逐渐上升,可能的原因是初期pH 值下降的原因是鱼汁中营养成分发生糖降解产生乳酸等使得样品酸度下降,随后由于腐败菌进入对数期产生大量含氮代谢化合物,使其pH 值上升。壳聚糖是天然含氮有机化合物,溶解后生成阳离子影响pH 值[20],使其变化规律发生紊乱。综上,单一抑菌剂组和复合抑菌剂组对两菌pH 值的影响不显著(P<0.05),然而pH 值受微生物产生代谢产物影响。
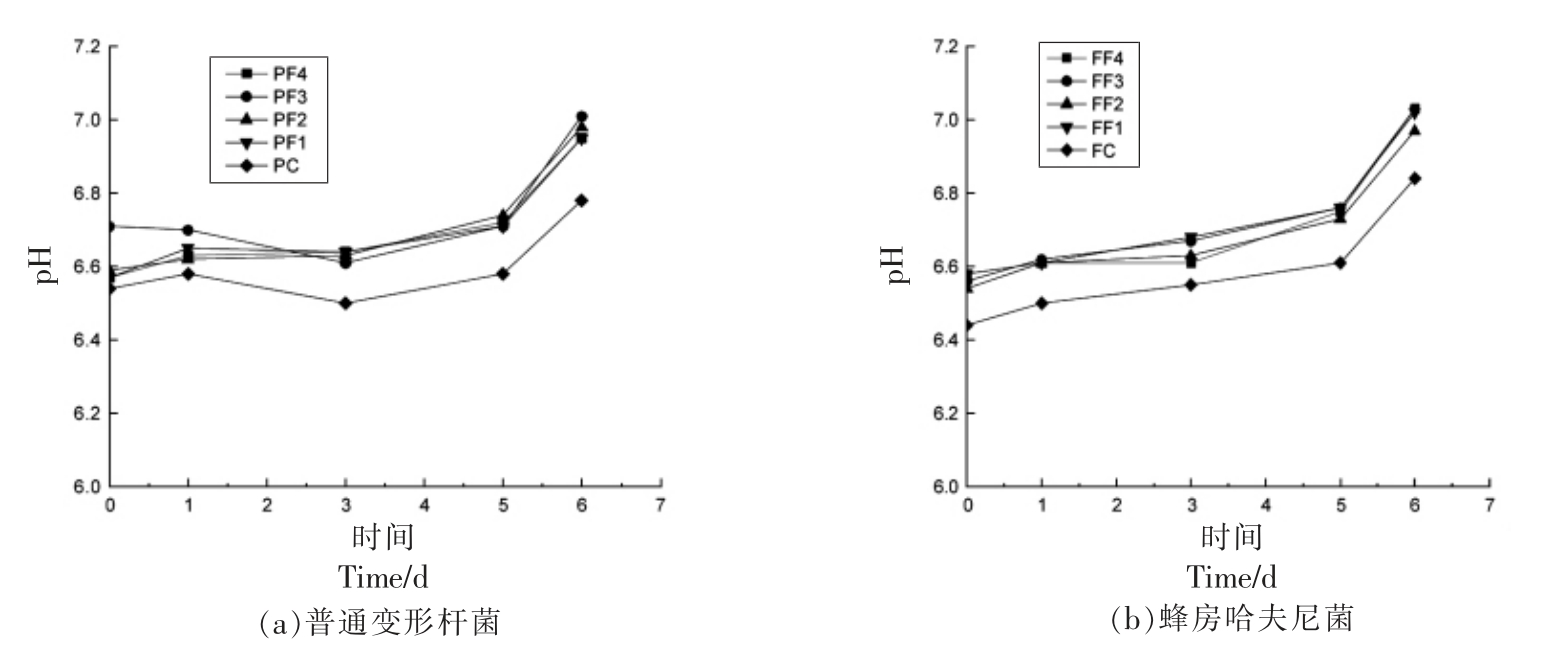
图4 不同抑菌组对普通变形杆菌和蜂房哈夫尼菌pH 值的影响
Fig.4 Effects of different antibacterial groups on pH value of Proteus vulgaris and Hafnia alvei
2.5 电导率变化
电导率表示细胞内物质成分透过细胞膜释放物质的多少,可表征抑菌剂对细菌细胞膜通透性和细胞活性变化的影响[23]。由图5可知,贮藏0 ~6 d 时,接种普通变形杆菌和蜂房哈夫尼菌组电导率在一定范围内稳定波动。处理组电导率初始值高,因为带正电荷壳聚糖分子影响[22]。1 d 时略微下降随后电导率呈上升趋势,说明内容物质开始向外渗透,复合抑菌剂处理组在第5~6 天稳定,PF1 组继续上升。接种普通变形杆菌所有组1~3 d电导率上升斜率从大到小依次为PF4、PF3 和PF2、PF1 (P<0.05),PF4、PF3 内容物渗出较多,抑制效果强;3~5 d 依次是PF1、PF3、PF2 和PF4(P<0.05),PF1、PF3 内容物渗出较多,抑制效果强;接种蜂房哈夫尼菌所有组1~3 d 电导率上升斜率从大到小依次为FF1、FF3、FF2、FF4 (P<0.05),FF1、FF3 抑制效果强;3~5 d 依次是FF1、FF2、FF3 和FF4,但差异不显著(P>0.05),由此说明添加壳聚糖和乳酸链球菌素可以破环细胞细胞膜,使得内容物溢出,导致溶液电解质增多,引起电导率改变。
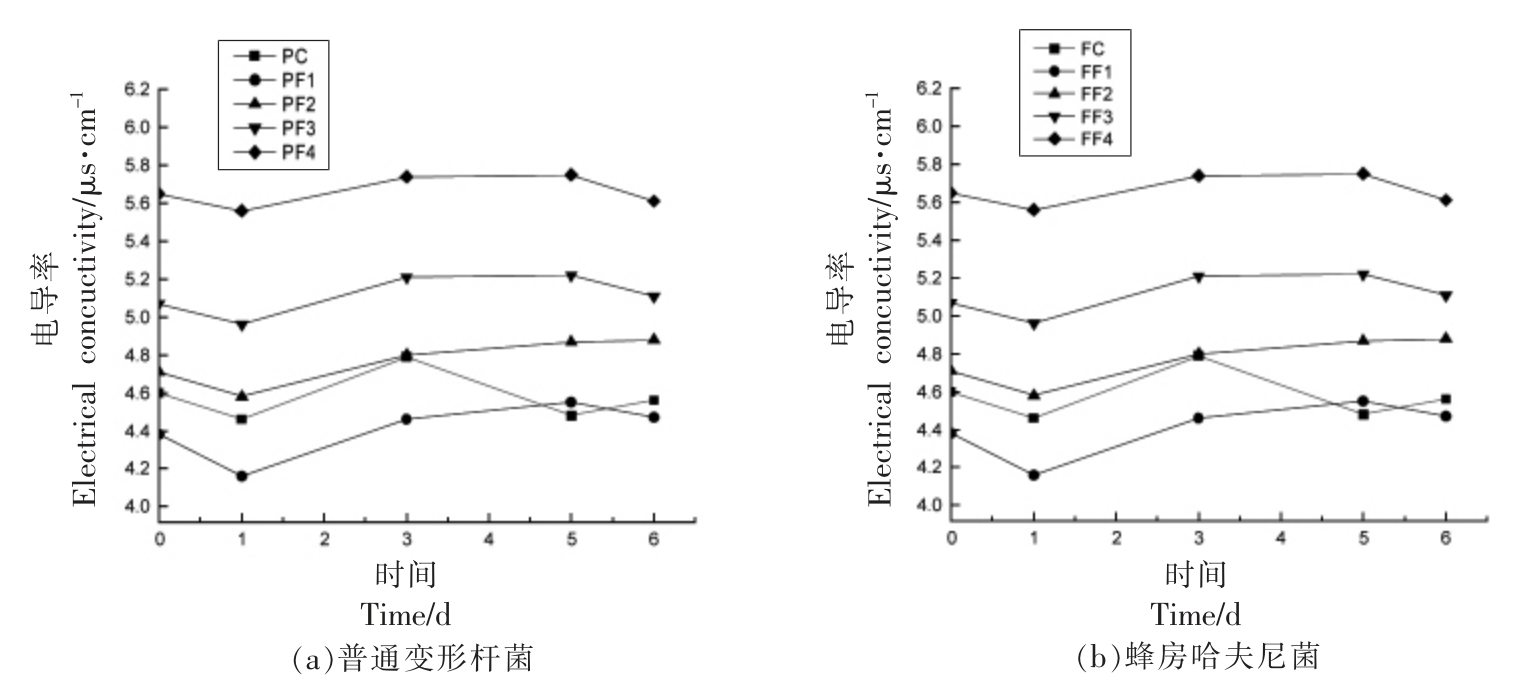
图5 不同抑菌组对普通变形杆菌和蜂房哈夫尼菌电导率的影响
Fig.5 Effects of different antibacterial groups on electrical conductivity of Proteus vulgaris and Hafnia alvei
2.6 胞外蛋白酶活性变化
腐败菌通过信号分子调控菌体间的群体感应行为,产生一些胞外产物,外界环境刺激细胞内物质的流出,影响蛋白酶活性。图6为不同抑菌组对普通变形杆菌和蜂房哈夫尼菌胞外蛋白酶的影响。由图可知,不同贮藏时间段蛋白酶活性具有显著差异(P<0.05),随着贮藏时间的延长,各处理组胞外蛋白酶活性均呈先增强后减弱的变化趋势,贮藏至第3 天胞外蛋白酶活性显著提高,可能由于腐败菌处于生长对数期,活性较高。贮藏至第6天时,胞外蛋白酶活略微降低,可能是微生物进入衰亡期,活性低。由图6a可知,贮藏至3 d 时,PF1组添加单一壳聚糖胞外蛋白酶活性最高,复合抑菌组均有所降低,其中PF2 和PF4 活性最低,推测是添加乳酸链球菌素后腐败菌生长受到一定的抑制作用,导致胞外蛋白酶活性降低。由图6b可知,贮藏至第3 天接种蜂房哈夫尼菌所有处理组胞外蛋白酶活性显著上升,其中FF1 组添加活性最强,FF2 组和FF3 组酶活受到抑制较强,活性低,FF4组也受到一定的抑制作用。综上,所有处理组在第3 天菌胞外蛋白酶活性处于最强,原因是腐败菌进入生长对数期,胞外产物较多,产酶量较高;复合抑菌组较单一抑菌组对胞外蛋白酶活性抑菌性强。
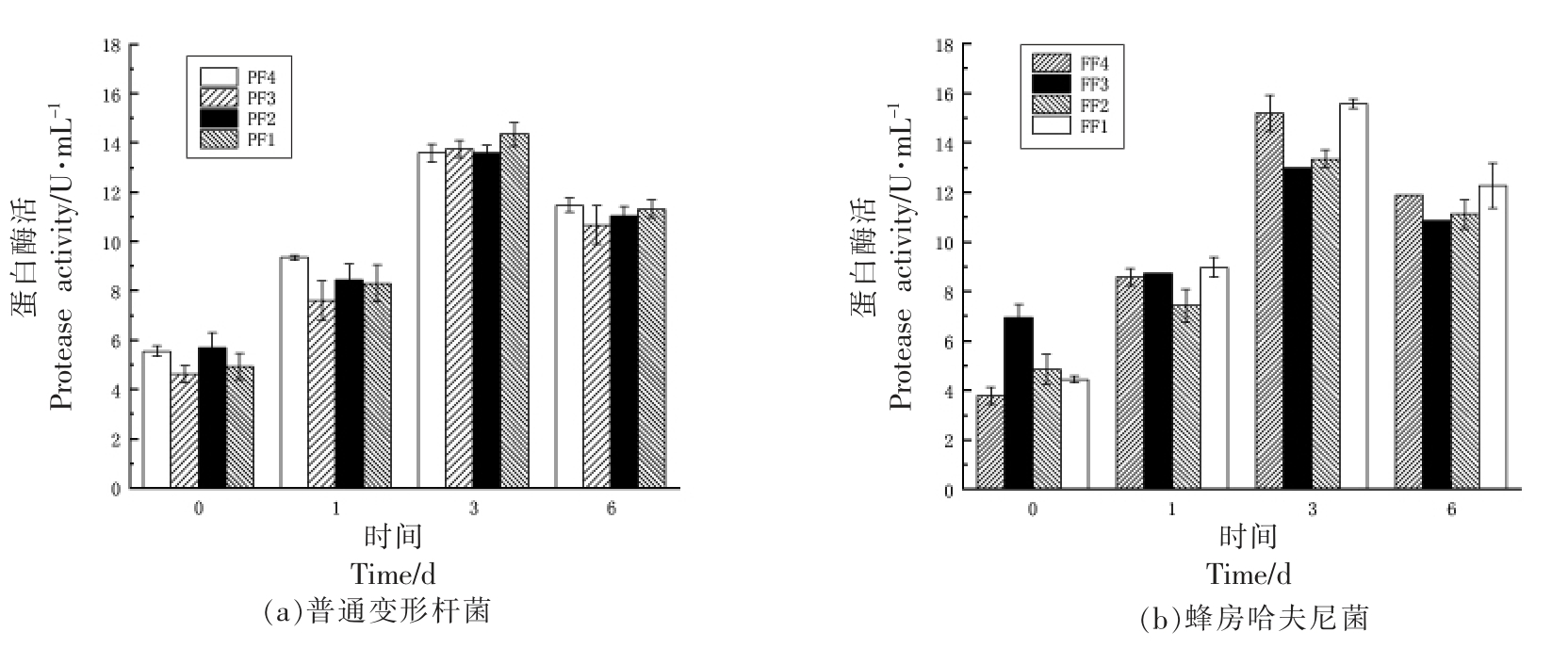
图6 不同抑菌组对普通变形杆菌和蜂房哈夫尼菌胞外蛋白酶的影响
Fig.6 Effects of different antibacterial groups on extracellular protease activity of Proteus vulgaris and Hafnia alvei
2.7 生物被膜变化
图7为接种普通变形杆菌和蜂房哈夫尼菌添加不同抑菌剂组合第3 天和第6 天生物被膜的生长变化情况。由图可知,所有处理组3 d 和6 d 时生物被膜生长量没有显著差异(P>0.05);贮藏至3 d 时,和单一抑菌剂处理组F1 对比,接种两菌的复合处理组F2、F3、F4 生物被膜均形成受到一定程度的抑制,且乳酸链球菌素含量越高,受到的抑制作用越强,两菌结果类似;贮藏至6 d 时,处理组F1、F2 生物被膜的形成量有显著上升趋势(P<0.05),F3、F4 组发生略微变化,和3 d 没有显著差异 (P>0.05),处理组FF3 和FF4 产量较FF1 和FF2 低,抑制效果更明显。普通变形杆菌比蜂房哈夫尼菌产生物被膜量多。结果表明两菌产膜能力受生长环境影响,添加抑菌剂抑制两菌形成生物被膜。蜂房哈夫尼菌生物被膜形成能力受环境因素的调节,生物被膜的黏附特性可能会导致其致病性[23]。酰基化高丝氨酸提取物(AHL-CCE)影响铜绿假单胞菌的生长和生物膜的形成[4]。防止生物被膜的产生具有很重要的意义,清除微生物生物被膜可改善食品卫生和安全性。
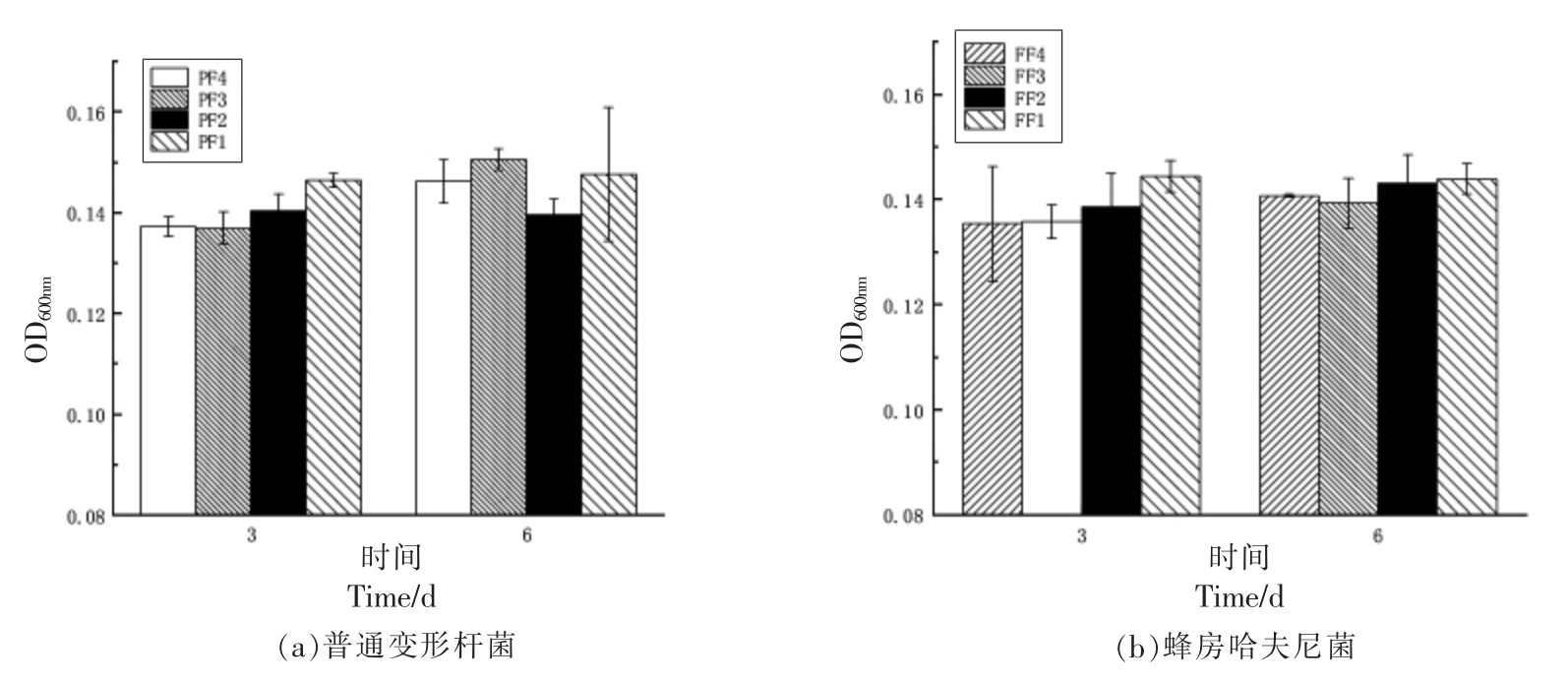
图7 不同抑菌组对普通变形杆菌和蜂房哈夫尼菌生物被膜的影响
Fig.7 Effects of different antibacterial groups on biofilm of Proteus vulgaris and Hafnia alvei
2.8 生物胺变化
生物胺是微生物生长代谢产生的一类具有生物活性的小分子含氮化合物,是由鱼体内游离氨基酸脱羧和转氨生成。生物胺可反映水产品的新鲜度,大部分水产品及肉禽等都含有生物胺,微生物在肉类组织中生长代谢产生尸胺、腐胺、组胺、色胺、酪胺等,其中腐胺和尸胺的产生极大的影响水产品品质,是水产品的优势生物胺,通常作为鱼类安全性和质量的指标。组胺具有较强的毒副性,当腐胺和尸胺与组胺共存能够增强组胺的毒性,因此要重视腐胺、尸胺和组胺等生物胺对水产品带来的危害。通过国标执行,得到腐胺标曲y=916.13x-367.14,判定系数R2=0.9695,尸胺标曲y=846.69x-328.62,判定系数R2=0.9681,色胺标曲y=71.276x+937.22,判定系数R2=0.9524;组胺y=249.36x-91.379,判定系数R2=0.9481。
图8为不同抑菌组对普通变形杆菌和蜂房哈夫尼菌生物胺(腐胺、尸胺、组胺)的影响,试验过程中几乎不产色胺(图中未展示)。由图可知,随着时间的延长,两菌接种腐胺和尸胺含量逐渐增加,尸胺比腐胺产量高,组胺含量变化没有显著差异且含量高。普通变形杆菌PF3、PF4 组第1 天和第3 天未检出腐胺,第3 天PF2、PF3、PF4 组尸胺含量小于PF1,PF4 组胺含量低;第6 天微生物处于衰亡生物胺含量不变或有所下降;几乎所有组组胺含量具有先上升后下降的波动趋势;蜂房哈夫尼菌第1 天只有FF1 组检出腐胺,第3 天尸胺含量从高到低依次是FF4、FF3、FF2、FF1,第6 天尸胺FF4 组含量最低,组胺第3 天FF1 组高于FF2、FF3、FF4 组,第6 天FF4 含量最低。综上,两菌尸胺产量高于腐胺产量,组胺变化没有显著性差异。普通变形杆菌复合保鲜剂抑菌性好于单一保鲜剂;蜂房哈夫尼菌单一和复合保鲜剂没有显著性差异,复合保鲜剂可抑制组胺产生。
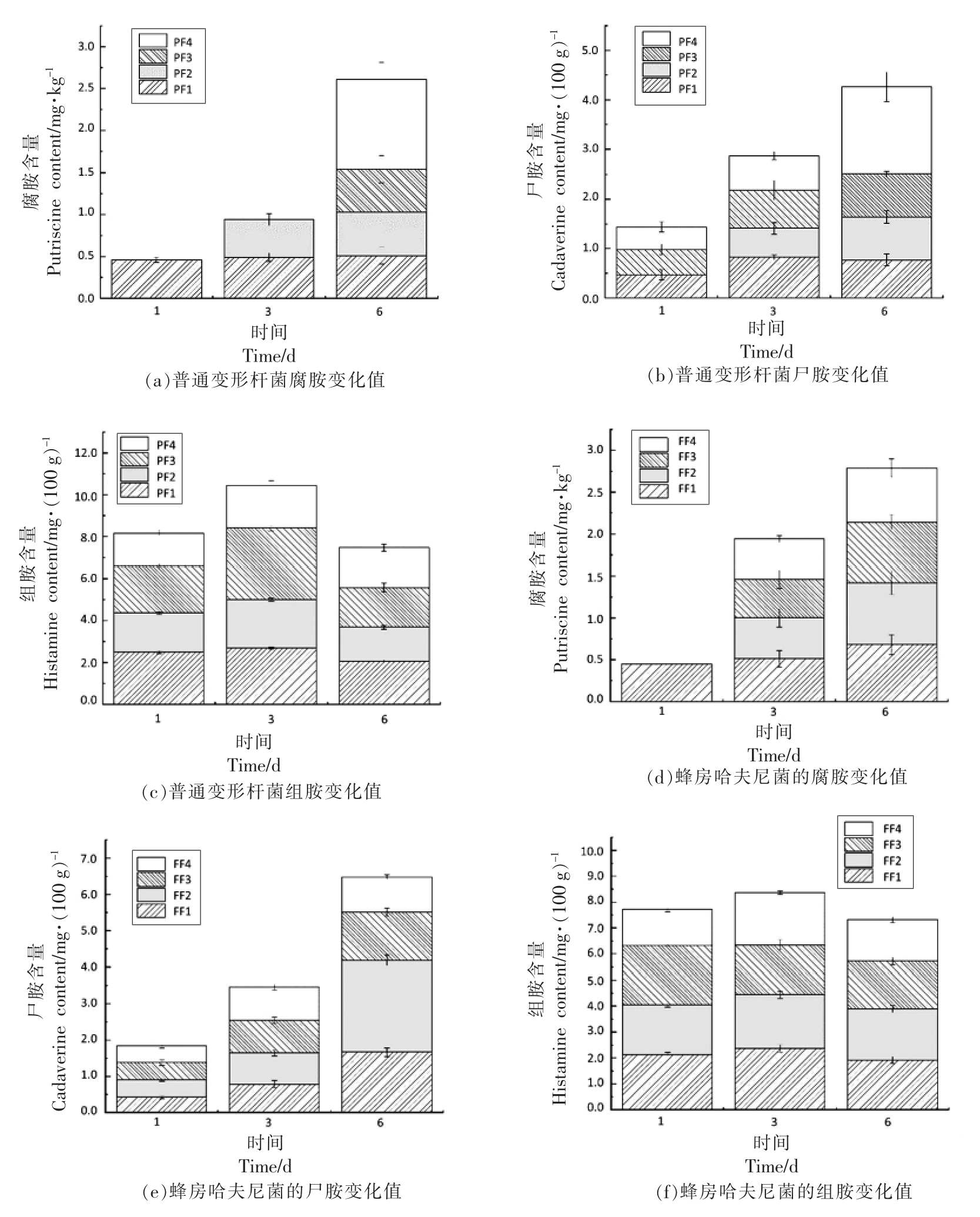
图8 不同抑菌组对普通变形杆菌和蜂房哈夫尼菌生物胺的影响
Fig.8 Effects of different antibacterial groups on bioamine contents of Proteus vulgaris and Hafnia alvei
2.9 菌落总数变化
菌落总数的变化反映了微生物的生长代谢快慢,与大黄鱼安全性和货架期直接相关,通过菌落总数的变化可以评价不同处理组对普通变形杆菌和蜂房哈夫尼菌生长代谢的影响。由图9可知,鱼汁在5 ℃贮藏过程中不同处理情况对普通变形杆菌和蜂房哈夫尼菌菌落总数变化的影响,随着时间的延长微生物菌落总数逐渐升高,当贮藏至第6 天时,所有组均达到9 lg(CFU/mL),是微生物生长稳定期。由图9a所示,贮藏至第6 天时,PF4 组菌落总数相对其它组较少;由图9b所示,贮藏至第3 天和第6 天时,FF4 组菌落总数较其它组少,表明PF4、FF4 组效果较好。综上,添加乳酸链球菌素含量越高,对细菌生长抑制作用越大。

图9 鱼汁在5 ℃贮藏过程中不同菌株菌落总数的变化
Fig.9 Changes of the total viable count in fish juice during storage at 5 ℃
3 结论
以源自轻腌大黄鱼特定腐败菌普通变形杆菌和蜂房哈夫尼菌为研究对象,评价壳聚糖协同乳酸链球菌素对两菌生长及细胞代谢的影响。结果表明,两菌在鱼汁中生长较肉汤好,壳聚糖对两菌最小抑菌浓度均为125 μg/mL,乳酸链球菌素没有抑制作用,单一壳聚糖对普通变形杆菌的影响更大;复合抑菌剂对普通变形杆菌较单一抑菌剂效果好,且随着乳酸链球菌素质量浓度的升高,抑制效果增强;单一抑菌和复合抑菌条件对蜂房哈夫尼菌生长速率的影响无显著性差异 (P>0.05);单一抑菌和复合抑菌条件对两菌pH 值的影响不显著(P<0.05),添加抑菌剂可破环细菌细胞膜,PF1、PF3、FF1、FF3 组电导率大,内容物渗出较多,抑制效果显著(P<0.01);所有组在第3 天(生长对数期)胞外蛋白酶活性最强,壳聚糖和乳酸链球菌素对两菌生物被膜的形成产生协同作用,且乳酸链球菌素含量越高,受到的抑制作用越强;壳聚糖和乳酸链球菌素复合虽对普通变形杆菌产生生物胺产生协同效果,对蜂房哈夫尼菌均无显著性差异(P>0.05),但复合保鲜剂可抑制两菌产组胺;PF4、FF4 组菌落总数最小,说明添加乳酸链球菌素含量最高,抑菌效果较好。综上,复合抑菌剂相对单一壳聚糖效果显著(P<0.05),壳聚糖和乳酸链球菌素复合发生协同抑菌效果。
[1]LONE G,PAW D.Fish spoilage bacteria-problems and solutions[J].Current Opinion in Biotechnology,2002,13(3):262-266.
[2]赵淑芳,曹卢园,唐子晴,等.棘胸蛙新型病菌蜂房哈夫尼菌的分离、鉴定与药敏试验[J].丽水学院学报,2019,41(5):29-33.
ZHAO S F,CAO L Y,TANG Z Q,et al.Isolation,identification and drug sensitivity tests of Hafnia alvei from Quasipaa spinosa[J].Journal of Lishui University,2019,41(5):29-33.
[3]柯文杰,孙斌斌,覃华斌,等.加州鲈源普通变形杆菌分离、鉴定及药敏分析[J].水产学杂志,2020,33(2):29-34.
KE W J,SUN B B,QIN H B,et al.Isolation,identification and drug sensitivity of Proteus vulgaris from diseased largemouth bass Micropterus salmoides[J].Chinese Journal of Fisheries,2020,33 (2):29-34.
[4]ZHANG Q Q,YE K P,WANG H H,et al.Inhibition of biofilm formation of Pseudomonas aeruginosa by an acylated homoserine lactones-containing culture extract[J].LWT-Food Science and Technology,2014,57(1):230-235.
[5]胡辰晨,刘红玲,史蓉蓉,等.细菌生物被膜耐药机制研究进展[J].检验医学与临床,2010,7(23):2659-2661.
HU C C,LIU H L,SHI R R,et al.Research progress on the mechanism of bacterial biofilm drug resistance[J].Laboratory Medicine and Clinic,2010,7(23):2659-2661.
[6]朱耀磊,侯红漫,张公亮,等.蜂房哈夫尼菌群体感应对其生物膜及泳动性的调控作用[J].食品科学,2020,41(14):169-174.
ZHU Y L,HOU H M,ZHANG G L,et al.Regulation of quorum sensing on biofilm formation and swimming motility in Hafnia alvei[J].Food Science,2020,41(14):169-174.
[7]王一芳,侯红漫,张公亮,等.二烯丙基二硫醚对蜂房哈夫尼菌群体感应的抑制作用[J].大连工业大学学报,2019,38(3):161-165.
WANG Y F,HOU H M,ZHANG G L,et al.The inhibitory effect of diallyl disulfide on quorum sensing of Hafnia alvei[J].Journal of Dalian Polytechnic University,2019,38(3):161-165.
[8]SALINI R,SINDHULAKSHMI M,POONGOTHAI T,et al.Inhibition of quorum sensing mediated biofilm development and virulence in uropathogens by Hyptis suaveolens[J].Antonie van Leeuwenhoek,2015,107(4):1095-1106.
[9]王继业,张明宇,霍倩,等.壳聚糖的性能及应用[J].纺织科学与工程学报,2020,37(3):110-116.
WANG J Y,ZHANG M Y,HUO Q,et al.Properties and applications of chitosan[J].Journal of Tex tile Science and Engineering,2020,37(3):110-116.
[10]杨冬芝,刘晓非,李治,等.壳聚糖抗菌活性的影响因素[J].应用化学,2000,17(6):598-602.
YANG D Z,LIU X F,LI Z,et al.On the factors influencing the antibacterial activity of chitosan[J].Chinese Journal of Applied Chemistry,2000,17(6):598-602.
[11]程琳丽.乳酸链球菌素的研究现状及在食品中的应用[J].食品安全质量检测学报,2020,11(11):3581-3585.
CHENG L L.Research status and application of nisin in food[J].Journal of Food Safety and Quality,2020,11(11):3581-3585.
[12]马含笑,李春,周晓宏.真空包装酱猪肝中污染微生物的分离鉴定和抑菌研究[J].食品研究与开发,2012,33(8):204-210.
MA H X,LI C,ZHOU X H.Isolation and identification of spoilage microorganisms in vacuum-packaged sauced pork liver and the antimicrobial study[J].Food Research and Development,2012,33(8):204-210.
[13]HE M,GUO Q Y,SONG W,et al.Inhibitory effects of chitosan combined with nisin on Shewanella spp.isolated from Pseudosciaena crocea[J].Food Control,2017,79(1):349-355.
[14]SCHELEGUEDA L I,GLIEMMO M F,CAMPOS C A.Antimicrobial synergic effect of chitosan with sodium lactate,nisin or potassium sorbate against the bacterial flora of fish[J].Journal of Food Research,2012,1(3):272-281.
[15]SCHELEGUEDA L,ZALAZAR A L,GLIEMMO M F,et al.Inhibitory effect and cell damage on bacterial flora of fish caused by chitosan,nisin and sodium lactate[J].International Journal of Biological Macromolecules,2015,83(1):396-402.
[16]DALGAARD P,MANFIO G P,GOODFELLOW M.Classification of photobacteria associated with spoilage of fish products by numerical taxonomy and pyrolysis mass spectrometry[J].Zentralblatt Für Bakteriologie International Journal of Medical Microbiology,1997,285(2):157-168.
[17]ZHU S Q,WU H H,ZHANG C L,et al.Spoilage of refrigerated Litopenaeus vannamei:Eavesdropping on Acinetobacter acyl-homoserine lactones promotes the spoilage potential of Shewanella baltica[J].Journal of Food Science and Technology,2018,55(5):1903-1912.
[18]ZHU J L,ZHAO A F,FENG L F,et al.Quorum sensing signals affect spoilage of refrigerated large yellow croaker (Pseudosciaena crocea) by Shewanella baltica[J].International Journal of Food Microbiology,2016,217(2):146-155.
[19]朱彦祺,郭全友,李保国,等.不同温度下腐败希瓦氏菌(Shewanela putrefaciens)生长动力学模型的比较与评价[J].食品科学,2016,37(13):147-152.
ZHU Y Q,GUO Q Y,LI B G,et al.Comparison and evaluation of models for the growth of Shewanella putrefaciens at different temperatures[J].Food Science,2016,37(13):147-152.
[20]胡军,孙杰,李吉刚,等.壳聚糖制膜的电导率研究[J].应用化工,2018,47(4):660-662,667.
HU J,SUN J,LI J G,et al.Research on conductivity of chitosan membrane[J].Applied Chemical Industry,2018,47(4):660-662,667.
[21]王悠.纳米材料对环境中微生物活性的影响研究[J].环境科学与管理,2015,40(10):63-66.
WANG Y.Effect of nanoparticles to microbe viability in environment [J].Environmental Science and Management,2015,40(10):63-66.
[22]王瑞秀,陈中卫,刘强,等.不同溶剂下低聚壳聚糖对3 种常见鸭源性致病菌的体外抑菌效果的影响[J].饲料工业,2020,41(16):25-30.
WANG R W,CHEN Z W,LIU Q,et al.Inhibition effect of chitoligosaccharide with different solvent on three species of duck pathogenic bacteria in vitro[J].Feed Industry,2020,41(16):25-30.
[23]VIVAS J,PADILLA D,REAL F,et al.Influence of environmental conditions on biofilm formation by Hafnia alvei strains [J].Veterinary Microbiology,2008,129(1/2):150-155.