植物内生菌,是指定殖于健康植物组织,在植物不同生长阶段与植物和谐共生的一类微生物[1]。研究显示,植物内生菌不仅对植物生长发育起到积极的调节作用,有些植物内生菌还能产生与宿主相同或相似活性的物质[2-3]。近年来,研究人员从不同植物内生菌次级代谢产物中发现了很多具有抗菌、抗氧化、抗肿瘤等生物活性的物质,植物内生菌作为一个亟待开发的重要资源,正在被越来越多的研究人员所关注[4]。
甘草(Glycyrrhiza uralensis Fisch.)为豆科甘草属多年生草本植物,具有“补脾益气,清热解毒,祛痰止咳,缓急止痛,调和诸药之功效”。作为最常用的大宗药材,甘草素有“十方九草”和“药之国老”的美誉[5]。现代药理学研究表明,甘草的有效成分以黄酮类和三萜皂苷成分为主[6-8],还包括香豆素类、生物碱类、多糖等化合物[9-11],具有抗溃疡、抗肿瘤、抗病毒、免疫调节、抗氧化和治疗心血管疾病等功效[10]。
从植物中分离筛选出具有生理活性的内生菌并获得其次生代谢产物,是药用植物资源替代的重要尝试,对于在一定程度上解决我国甘草野生资源的匮乏具有着重要的意义。研究显示[12-13],不同培养基对内生真菌的分离的种类会产生一定的影响,不同培养基分离所得内生真菌的多样性也明显不同。甘草主要分布于我国东北、西北及华北等地区,其中又以宁夏、甘肃、内蒙和新疆等地所产的道地药材品质最佳,是我国在种植和应用上最为广泛的植物资源[14]。本研究采用9 种分离培养基对甘肃本地野生甘草不同组织中内生真菌进行分离,并采用不同的方法评价其代谢产物的抗氧化和抑菌活性,以期增加甘草内生菌的丰度并筛选出活性良好的菌株,为甘草深层次应用提供技术资料。
1 材料与方法
1.1 材料与试剂
甘草为采集自甘肃省庆城县野生全株,经兰州理工大学生命科学与工程学院杨林副教授鉴定确系为该种药材。
标准供试菌使用两种革兰氏阴性菌绿脓杆菌(Pseudomonas aeruginosa)、大肠杆菌(Escherichia coli) 和3 种革兰氏阳性菌金黄色葡萄球菌(Staphylococcus aureus)、肺炎链球菌(Streptococcus pneumoniae)、地衣芽孢杆菌(Bacillus licheniformis),以上菌株均由兰州理工大学生命科学与工程学院实验中心提供。
二苯代苦味酰基自由基DPPH(96%)、抗坏血酸(VC,99%),购自阿拉丁生化科技股份有限公司;水杨酸,铁氰化钾,硫酸亚铁,三氯乙酸等,购自天津福晨化学试剂有限公司,且均为分析纯级。
1.2 仪器与设备
UV2102PC 型紫外-可见分光光度计,上海尤尼柯仪器有限公司);SPX-100B-Z 生化培养箱,上海博迅实业有限公司。
1.3 方法
1.3.1 甘草内生真菌的分离纯化 取新鲜甘草根、茎、叶清水冲净泥土,再依次用无菌水清洗、75%酒精消毒、2%次氯酸钠溶液消毒,最后用无菌水冲洗3 次并保存最后一次冲洗液作为空白对照[15]。采用Gary 等[16]报道的组织块法将表面消毒过的植物组织剪成10 mm 长的小段,分别接种在表1所示I~IX 共9 种固体培养基中28 ℃培养5~10 d,然后挑取初步分离得到的菌株转接至新的培养基上划线分离,连续转接4~5 次,直至得到单菌落然后对菌种进行编号和保藏。
表1 试验用培养基及成分
Table 1 Experimental medium and ingredients

?序号 培养基 成分I PDA 培养基 马铃薯200 g,加水煮沸30 min,蒸馏水定至1 000 mL,葡萄糖20 g,琼脂15 g,pH 值自然II 50 倍稀释PDA 培养基 50 倍稀释的培养基I III 100 倍稀释PDA 培养基 100 倍稀释的培养基I IV 山药培养基 山药200 g,加水煮沸30 min,蒸馏水定至1 000 mL,葡萄糖20 g,琼脂15 g,pH 值自然V 100 倍稀释山药培养基 100 倍稀释的培养基IV VI 胡萝卜培养基 胡萝卜200 g,加水煮沸30 min,蒸馏水定至1 000 mL,葡萄糖20 g,琼脂15 g,pH 值自然VII 100 倍稀释胡萝卜培养基 100 倍稀释的培养基VI VIII 百合培养基 百合粉10 g,蒸馏水定至1 000 mL,葡萄糖10 g,琼脂15 g,pH 值自然IX 100 倍稀释百合培养基 100 倍稀释的培养基VIII X 牛肉膏蛋白胨细菌培养基 牛肉膏3.0 g,蛋白胨10.0 g,NaCl 5.0 g,琼脂15.0 g,蒸馏水1 000 mL,pH 值自然
1.3.2 甘草内生真菌分子生物学鉴定 将已分离纯化的甘草内生真菌转接至相应固体培养基,28℃恒温培养观察记录菌株生长状况、菌落整体形态、质地,菌丝颜色、长短及基质颜色等,将部分形态特异的菌株送至西安一棵树生物科技公司进行18S rDNA 基因测序,将测序结果在GenBank 数据库中进行序列比对,获取菌种注册号,并用MEGA 7.0 软件绘制系统进化树。
1.3.3 甘草内生真菌的发酵及次级代谢产物的制备 菌株在相应液体培养基28 ℃发酵培养7 d。过滤分离发酵液和菌丝体,取滤液用等体积乙酸乙酯萃取3 次,合并有机相,55 ℃减压浓缩蒸干得发酵液供试样品;菌丝体用甲醇冷凝回流3 次,合并有机相减压浓缩蒸干得菌丝体供试样品。所得样品均置于冰箱4 ℃保藏备用。
1.3.4 甘草内生真菌次级代谢产物抗氧化活性的评价
1.3.4.1 清除DPPH 自由基活性的测定 清除DPPH 自由基活性的测定参照Du 等[17]报道中的方法。配制并移取待测样品溶液(50 μL 0.1 mg/mL),加入DPPH-乙醇溶液(50 μL 0.05 mg/mL),涡旋震荡室温避光30 min,用无水乙醇调零于517 nm处测定吸光度值Ai;用无水乙醇替换DPPH 溶液测得Aj;以无水乙醇代替待测样品溶液测得A0;以抗坏血酸(VC)作为阳性对照,依据公式计算得DPPH 清除率。
1.3.4.2 清除羟自由基活性的测定 清除羟自由基活性的测定参照Smirnoff 等[18]报道的方法。配制并移取待测样品溶液(50 μL 0.1 mg/mL),依次加入50 μL FeSO4(6.0 mmol/L)溶液、水杨酸-乙醇(6.0 mmol/L) 溶液、0.1% H2O2 溶液,37 ℃水浴反应30 min,用20%乙醇调零于波长510 nm 处测定吸光度值A1;以无水乙醇代替待测样品溶液测得A0,用蒸馏水替换0.1% H2O2 溶液测得A2;并以抗坏血酸(VC)作为阳性对照,依据公式计算得羟自由基清除率。
1.3.4.3 总还原力的测定 还原力的测定参照Wei 等[19]的方法。配制并移取磷酸盐缓冲液(500 μL 0.2 mol/L,pH=6.6),依次加入待测样品溶液(500 μL 0.1 mg/mL)和500 μL 1% K3[Fe(CN)6],50 ℃水浴后快速冷却至室温,加入500 μL 10%三氯乙酸溶液,混匀后5 000 r/min 离心,取上清液100 μL 依次加入80 μL 蒸馏水及20 μL 0.1%的三氯化铁溶液,充分反应15 min,于波长700 nm处测定其吸光度值,吸光度值越大表明其还原力越强,以500 μL 蒸馏水代替1% K3[Fe(CN)6]溶液作空白,用VC 的总还原力做标准曲线,每组样品平行3 次,求其均值。
1.3.5 甘草内生真菌次级代谢产物的抑菌活性评价 取经活化的5 种受试菌株菌液按1%的接种量接种于100 mL 牛肉膏-蛋白胨液体培养基并将菌液浓度稀释至0.5 麦氏浓度,作为受试菌悬液[20-21]。制备1.3.1 节所述牛肉膏-蛋白胨固体培养基(厚度2~3 mm)移取受试菌悬液200 μL,均匀涂布制成含菌平板。取待测样品溶液 (10 μL 10 mg/mL)滴于直径5 mm 已灭菌滤纸片并移至含菌平板上,以青霉素钾和硫酸链霉素(0.1 mg/mL)作阳性对照,每个待测样品溶液作两个平行。37 ℃恒温培养观察并测量抑菌圈直径大小,以抑菌圈直径作为评价样品抑菌效果的指标[2,22]。
2 结果
2.1 甘草内生真菌菌株分布
研究采用9 种培养基从甘草根、茎、叶中共分离出内生真菌128 株,其中根部95 株、茎部9 株、叶部24 株,分别为分离菌株总数的74.22%、7.03%、18.75%(见表2)。9 种培养基对甘草中内生真菌分离的出菌率如图1所示,以山药培养基和100 倍稀释的山药培养基的出菌率最高,分别为19.53%、13.28%。
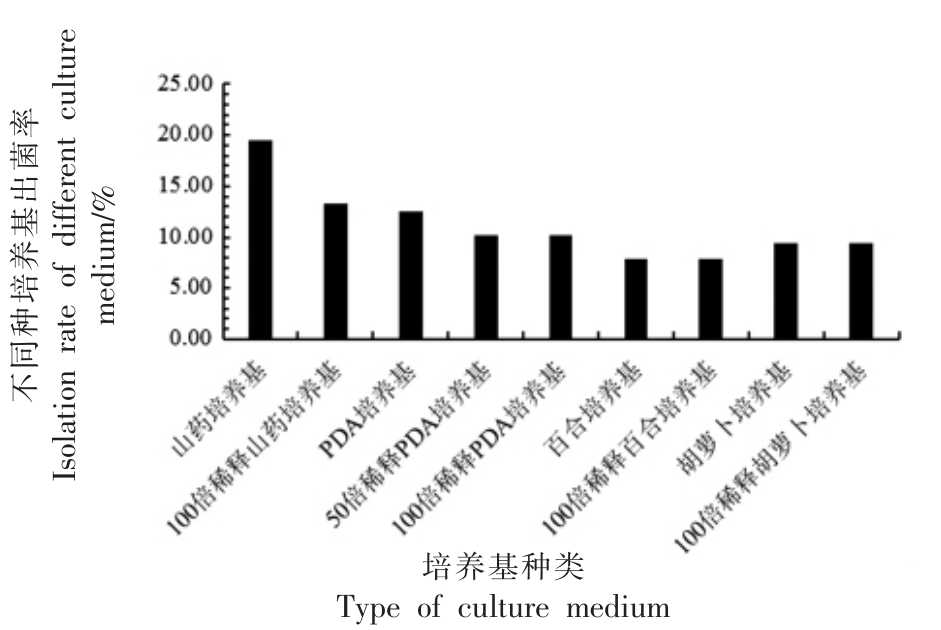
图1 甘草内生真菌在不同培养基分离下的出菌率图
Fig.1 Isolation rate of endophytic fungi from licorice
in different media
表2 甘草内生真菌菌株分布
Table 2 Distribution of isolates of endophytic fungi from licorice
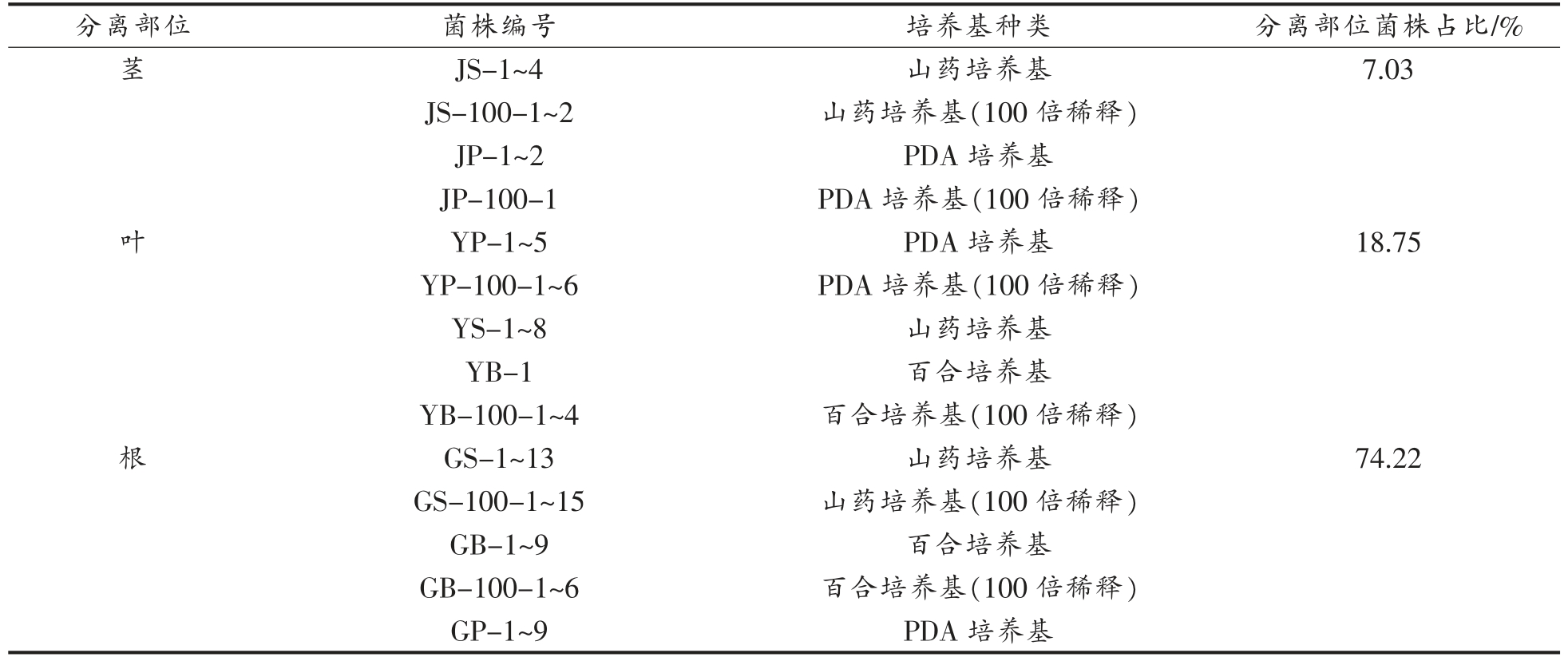
分离部位 菌株编号 培养基种类 分离部位菌株占比/%茎JS-1~4 山药培养基 7.03 JS-100-1~2 山药培养基(100 倍稀释)JP-1~2 PDA 培养基JP-100-1 PDA 培养基(100 倍稀释)叶YP-1~5 PDA 培养基 18.75 YP-100-1~6 PDA 培养基(100 倍稀释)YS-1~8 山药培养基YB-1 百合培养基YB-100-1~4 百合培养基(100 倍稀释)根GS-1~13 山药培养基 74.22?GS-100-1~15 山药培养基(100 倍稀释)GB-1~9 百合培养基GB-100-1~6 百合培养基(100 倍稀释)GP-1~9 PDA 培养基
(续表2)

分离部位 菌株编号 培养基种类 分离部位菌株占比/%GP-50-1~6 PDA 培养基(50 倍稀释)GP-100-1~13 PDA 培养基(100 倍稀释)G-HB-1~12 胡萝卜培养基G-HB-100-1~12 胡萝卜培养基(100 倍稀释)?
2.2 甘草内生真菌的分子生物学鉴定
从所分离出的菌中按照不同分离培养基各选取了部分形态特殊的菌株共计18 株,进行了18S rDNA 测序,提交NCBI 进行GeneBank 注册(见表3)。将上述菌株的测定序列在Genbank 数据库进行序列比对,构建系统进化树,结果如图2所示。真菌经分子生物学鉴定归属于4 目5 科5 属,包括曲霉属、镰刀菌属、毕赤酵母属、丛赤壳属、枝孢属,归属于4 个不同的目。其中分离出较多的菌属为镰刀菌属和毕赤酵母属。

图2 甘草内生真菌的系统进化树
Fig.2 Phylogenetic tree of endophytic fungi in licorice
表3 甘草内生真菌分子生物学鉴定
Table 3 Molecular biological identification of endophytic fungi in licorice
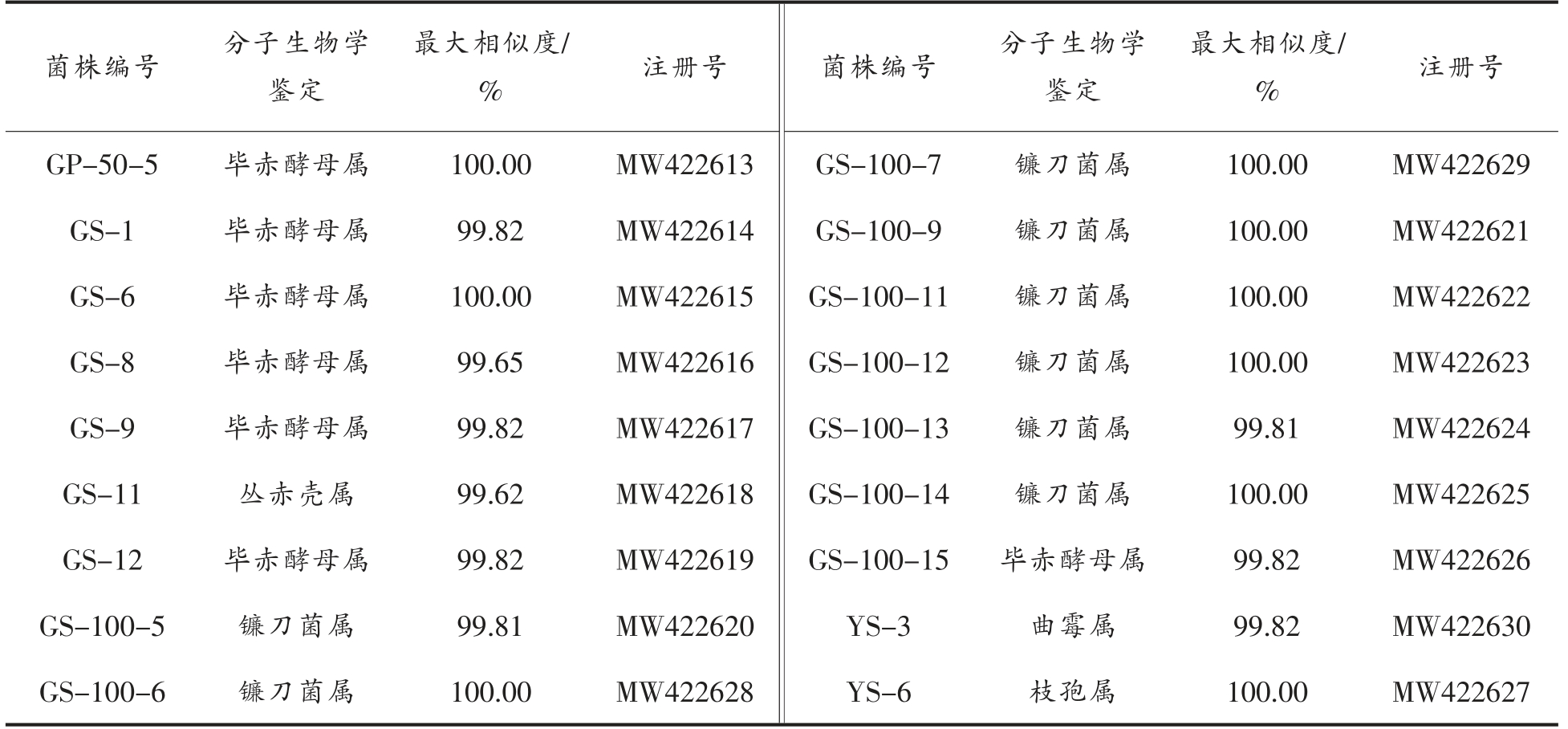
最大相似度/%GP-50-5 毕赤酵母属 100.00 GS-1 毕赤酵母属 99.82 GS-6 毕赤酵母属 100.00 GS-8 毕赤酵母属 99.65 GS-9 毕赤酵母属 99.82 GS-11 丛赤壳属 99.62 GS-12 毕赤酵母属 99.82 GS-100-5 镰刀菌属 99.81 GS-100-6 镰刀菌属 100.00菌株编号 分子生物学鉴定注册号MW422613 MW422614 MW422615 MW422616 MW422617 MW422618 MW422619 MW422620 MW422628菌株编号GS-100-7 GS-100-9 GS-100-11 GS-100-12 GS-100-13 GS-100-14 GS-100-15 YS-3 YS-6分子生物学鉴定镰刀菌属镰刀菌属镰刀菌属镰刀菌属镰刀菌属镰刀菌属毕赤酵母属曲霉属枝孢属最大相似度/%100.00 100.00 100.00 100.00 99.81 100.00 99.82 99.82 100.00注册号MW422629 MW422621 MW422622 MW422623 MW422624 MW422625 MW422626 MW422630 MW422627
2.3 甘草内生真菌次级代谢产物抗氧化活性的评价
2.3.1 次级代谢产物样品对DPPH 自由基的清除作用 从根、茎、叶3 个部位所分离的菌株中各选取了部分形态特殊的甘草内生真菌共18 株,制得36 个供试样品并测定了其对DPPH 自由基清除率,如表4所示。
表4 不同甘草内生真菌样品的DPPH 自由基清除率
Table 4 DPPH free radical scavenging rate of different licorice endophytic fungi samples
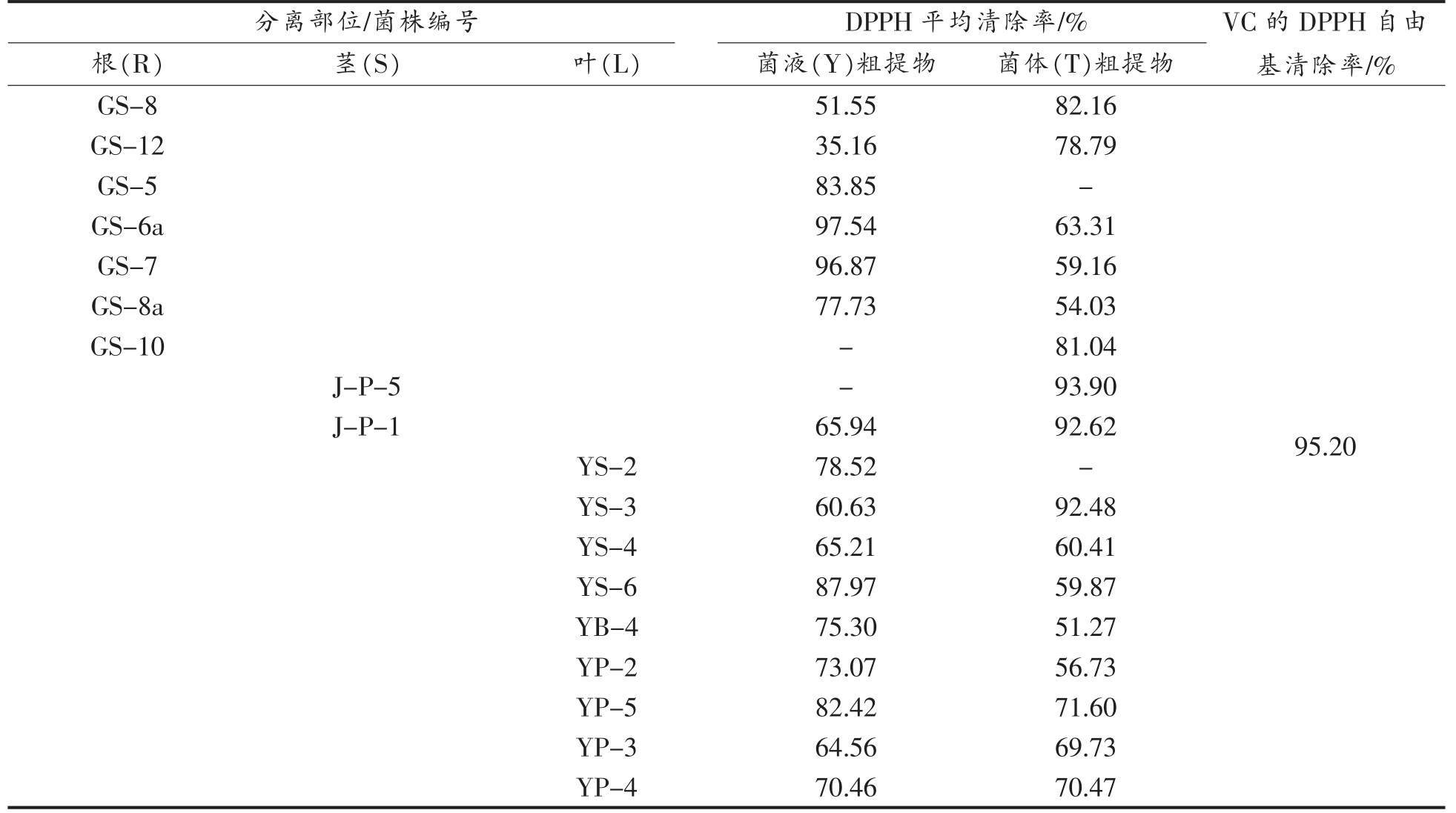
注:“-”指样品对DPPH 自由基的清除率<50%。
根(R) 茎(S) 叶(L) 菌液(Y)粗提物 菌体(T)粗提物分离部位/菌株编号 DPPH 平均清除率/% VC 的DPPH 自由基清除率/%GS-8 51.55 82.16 GS-12 35.16 78.79 GS-5 83.85-GS-6a 97.54 63.31 GS-7 96.87 59.16 GS-8a 77.73 54.03 GS-10-81.04 J-P-5-93.90 J-P-1 65.94 92.62 YS-2 78.52-YS-3 60.63 92.48 YS-4 65.21 60.41 YS-6 87.97 59.87 YB-4 75.30 51.27 YP-2 73.07 56.73 YP-5 82.42 71.60 YP-3 64.56 69.73 YP-4 70.46 70.47 95.20
试验结果显示阳性对照VC 的DPPH 自由基清除率为95.20%。对DPPH 自由基清除率超过60%的样品有25 个,占总样品的69.44%;清除率超过80%的样品有10 个,其中GS-6a、GS-7 菌液粗提物对DPPH 自由基的清除率分别达到了97.54%和96.87%与阳性对照效果相当,具有较强体外抗氧化能力。
2.3.2 次级代谢产物样品对羟自由基的清除作用 试验对所得36 个次级代谢产物样品又进行了羟自由基清除率的测定,测定结果如下表5所示。
表5 不同甘草内生真菌样品的羟自由基清除率
Table 5 Hydroxyl radical scavenging rate of different licorice endophytic fungi samples
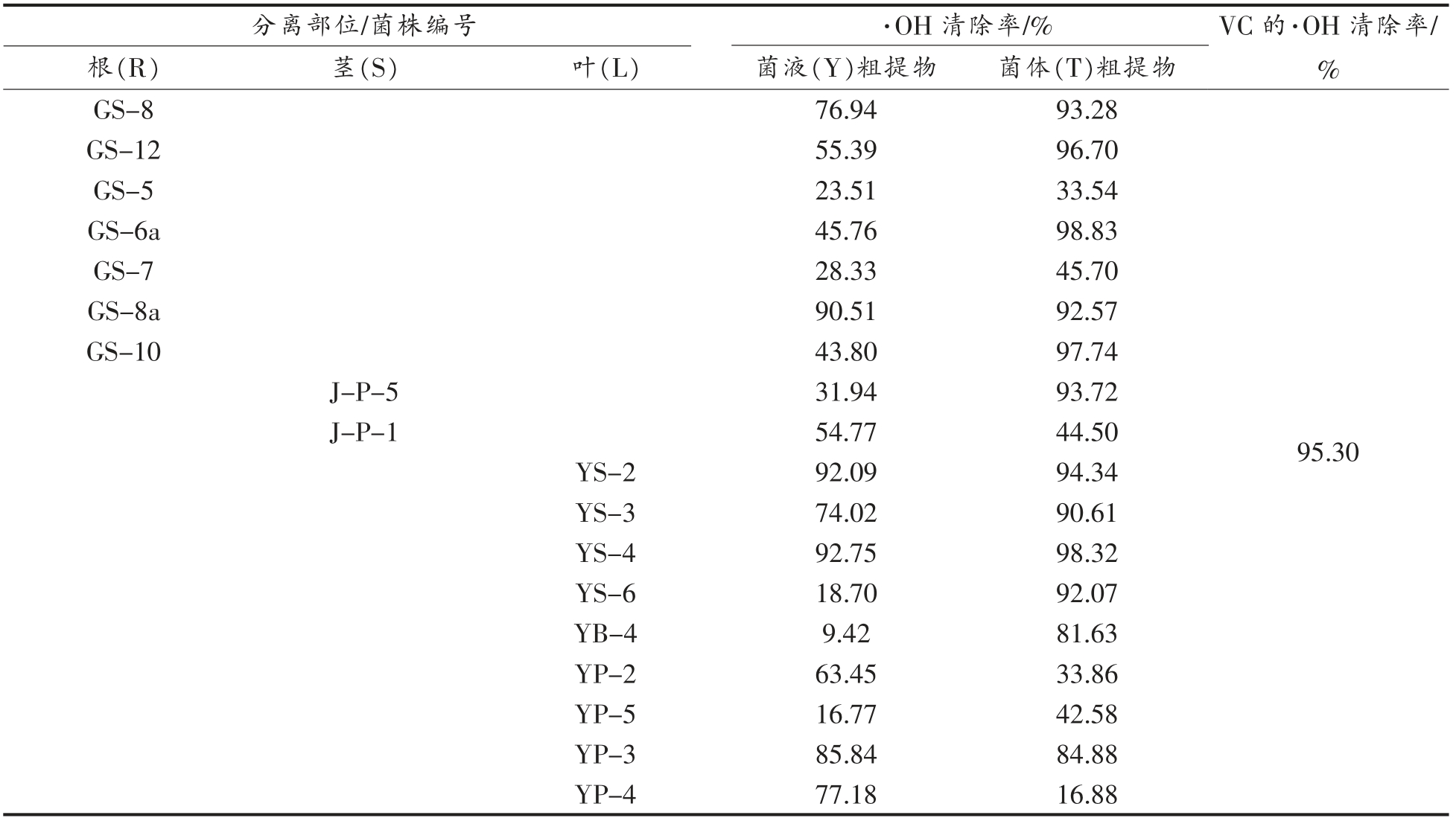
分离部位/菌株编号 ·OH 清除率/% VC 的·OH 清除率/%根(R) 茎(S) 叶(L) 菌液(Y)粗提物 菌体(T)粗提物GS-8 76.94 93.28 GS-12 55.39 96.70 GS-5 23.51 33.54 GS-6a 45.76 98.83 GS-7 28.33 45.70 GS-8a 90.51 92.57 GS-10 43.80 97.74 J-P-5 31.94 93.72 J-P-1 54.77 44.50 YS-2 92.09 94.34 YS-3 74.02 90.61 YS-4 92.75 98.32 YS-6 18.70 92.07 YB-4 9.42 81.63 YP-2 63.45 33.86 YP-5 16.77 42.58 YP-3 85.84 84.88 YP-4 77.18 16.88 95.30
试验结果显示阳性对照VC 的羟自由基清除率为95.30%。对羟自由基清除率超过60%的样品有20 个,占总样品的55.56%;清除率超过80%的供试样品有16 个,其中GS-6a、YS-4 菌株菌丝体供试样品具有强体外抗氧化能力,对羟自由基的清除率分别达到了98.83%和98.32%,与阳性对照效果相当,具有较强体外抗氧化能力。
2.3.3 次级代谢产物样品的总还原力 将阳性对照VC 配成不同质量浓度的标准溶液,以VC 标准溶液质量浓度为横坐标,以波长700 nm 处测定的不同质量浓度标准溶液吸光度值为纵坐标作VC标准曲线,如图3所示。VC 标准溶液在0.02~0.10 mg/mL 的质量浓度范围内,其吸光度值与质量浓度线性关系良好。将各供试样品溶液吸光度值代入线性回归方程 Y=7.445X+0.0587(R2=0.994),算出各样品的VC 当量如表6所示。
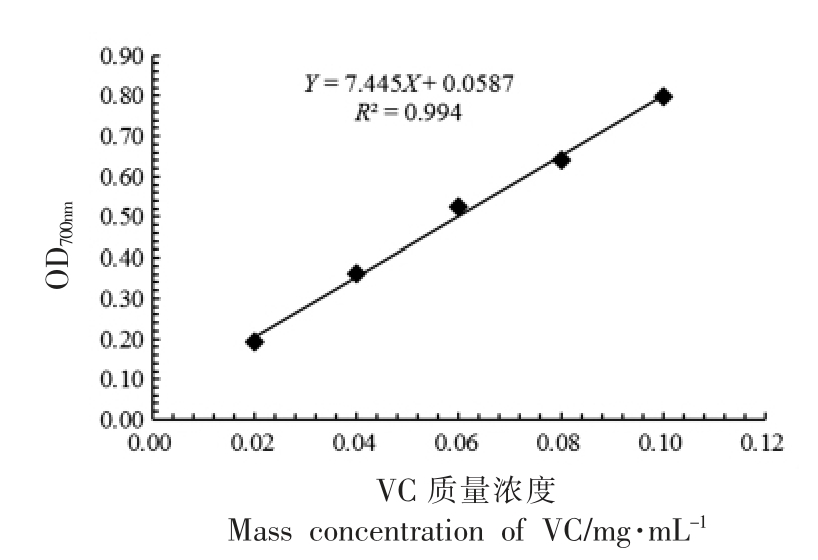
图3 VC 标准曲线
Fig.3 VC standard curve
表6 不同甘草内生真菌样品总还原力测定
Table 6 Determination of total reducing power of different licorice endophytic fungi samples
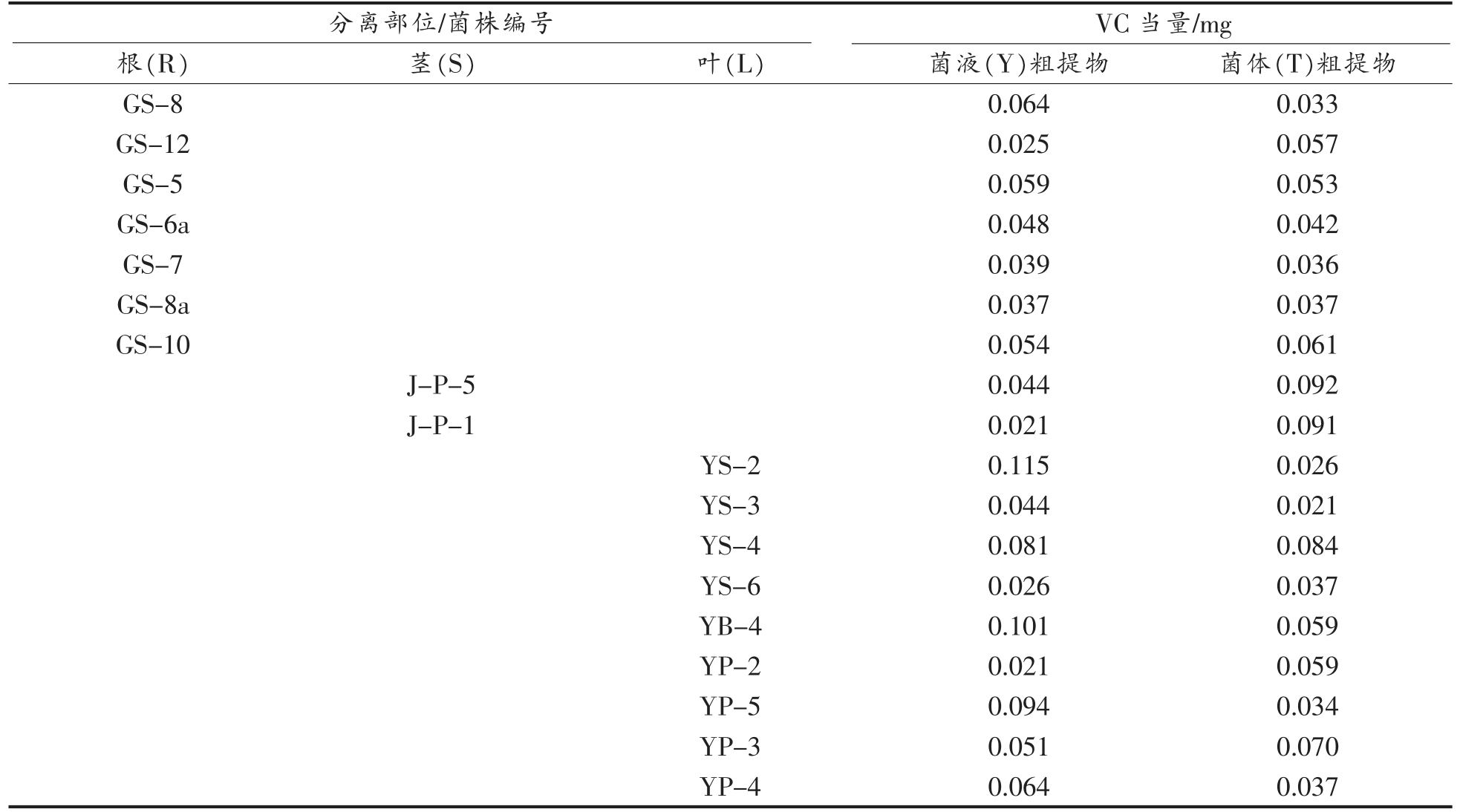
分离部位/菌株编号 VC 当量/mg根(R) 茎(S) 叶(L) 菌液(Y)粗提物 菌体(T)粗提物GS-8 0.064 0.033 GS-1 2 0.025 0.057 GS-5 0.059 0.053 GS-6a 0.048 0.042 GS-7 0.039 0.036 GS-8a 0.037 0.037 GS-10 0.054 0.061 J-P-5 0.044 0.092 J-P-1 0.021 0.091 YS-2 0.115 0.026 YS-3 0.044 0.021 YS-4 0.081 0.084 YS-6 0.026 0.037 YB-4 0.101 0.059 YP-2 0.021 0.059 YP-5 0.094 0.034 YP-3 0.051 0.070 YP-4 0.064 0.037
试验结果显示,总还原力超过0.060 mg VC当量还原力的待测样品共有11 个,占到了样品总数的30.6%;YS-2、YB-4 菌株发酵液样品的总还原力分别达到0.115 mg VC 当量和0.101 mg VC当量,与0.100 mg VC 当量的还原力相当,具有较强体外抗氧化能力。
2.3.4 甘草内生真菌次级代谢产物样品抑菌活性的评价 试验采用纸片扩散法[23-24]对36 份甘草内生真菌次级代谢产物样品进行抑菌活性测定,标准供试菌使用2 种革兰氏阴性菌绿脓杆菌、大肠杆菌和3 种革兰氏阳性菌金黄色葡萄球菌、肺炎链球菌、地衣芽孢杆菌,结果如表7所示。
表7 抑菌活性测定结果
Table 7 Test results of antibacterial activity
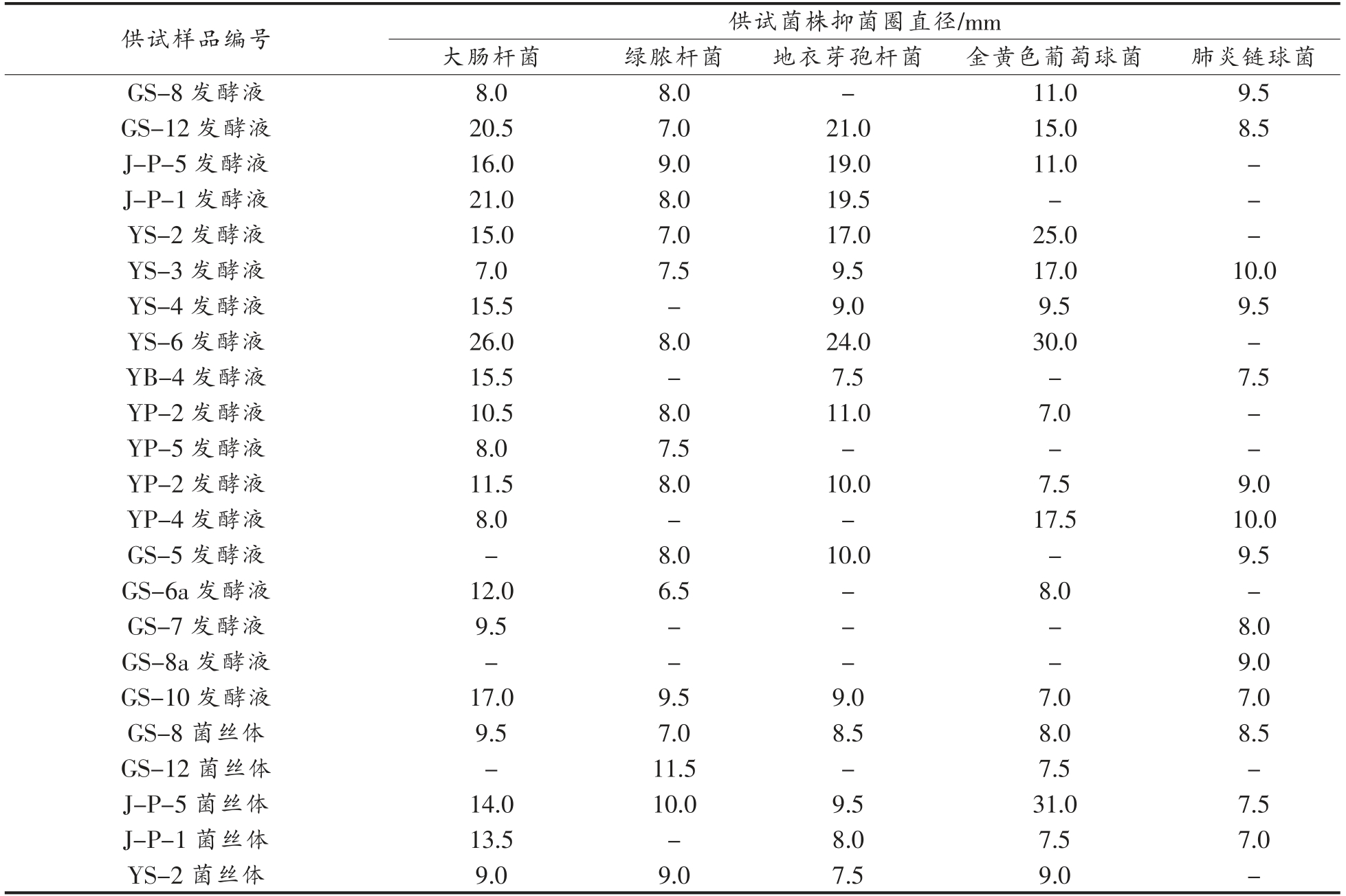
供试样品编号 供试菌株抑菌圈直径/mm?大肠杆菌 绿脓杆菌 地衣芽孢杆菌 金黄色葡萄球菌 肺炎链球菌GS-8 发酵液 8.0 8.0-11.0 9.5 GS-12 发酵液 20.5 7.0 21.0 15.0 8.5 J-P-5 发酵液 16.0 9.0 19.0 11.0-J-P-1 发酵液 21.0 8.0 19.5--YS-2 发酵液 15.0 7.0 17.0 25.0-YS-3 发酵液 7.0 7.5 9.5 17.0 10.0 YS-4 发酵液 15.5-9.0 9.5 9.5 YS-6 发酵液 26.0 8.0 24.0 30.0-YB-4 发酵液 15.5-7.5-7.5 YP-2 发酵液 10.5 8.0 11.0 7.0-YP-5 发酵液 8.0 7.5---YP-2 发酵液 11.5 8.0 10.0 7.5 9.0 YP-4 发酵液 8.0--17.5 10.0 GS-5 发酵液-8.0 10.0-9.5 GS-6a 发酵液 12.0 6.5-8.0-GS-7 发酵液 9.5---8.0 GS-8a 发酵液----9.0 GS-10 发酵液 17.0 9.5 9.0 7.0 7.0 GS-8 菌丝体 9.5 7.0 8.5 8.0 8.5 GS-12 菌丝体-11.5-7.5-J-P-5 菌丝体 14.0 10.0 9.5 31.0 7.5 J-P-1 菌丝体 13.5-8.0 7.5 7.0 YS-2 菌丝体 9.0 9.0 7.5 9.0-
(续表7)
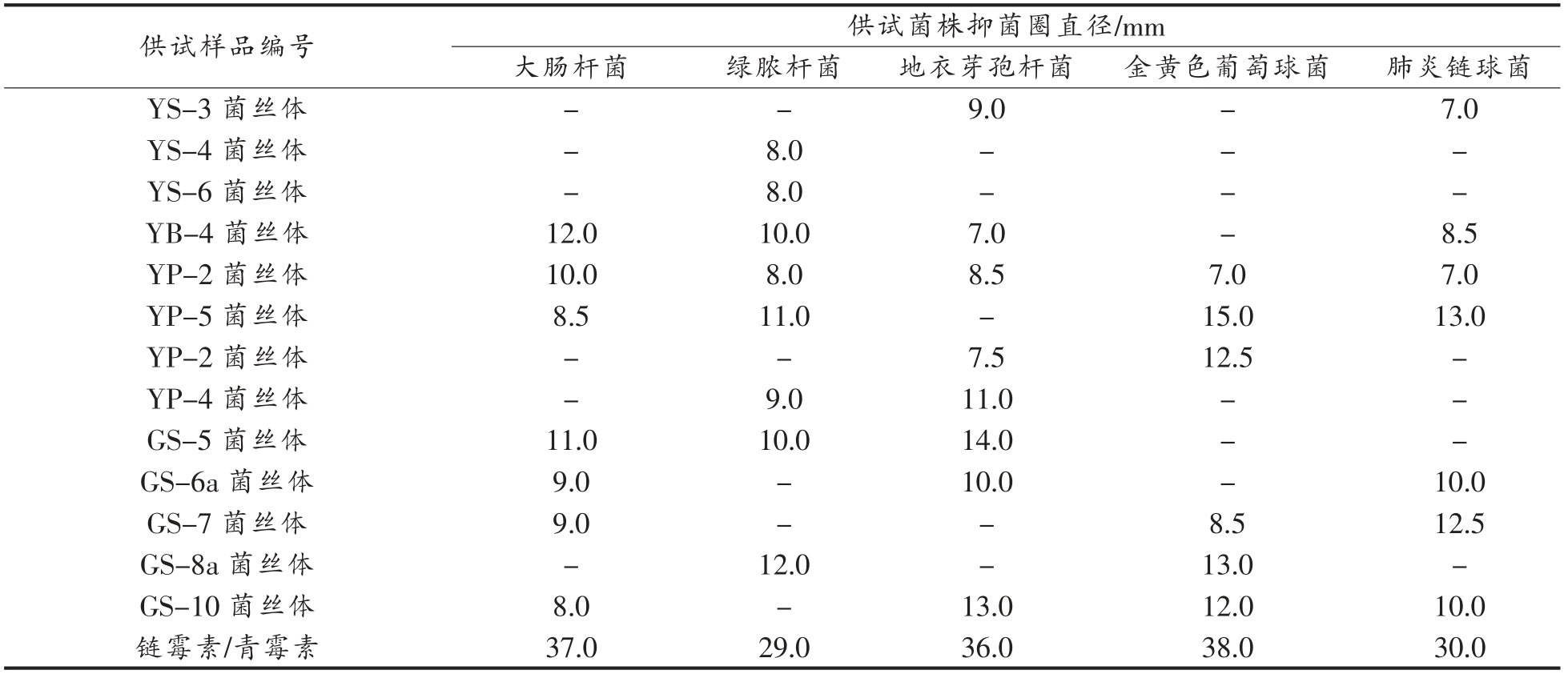
注:“-”指无抑菌圈。
供试样品编号 供试菌株抑菌圈直径/mm大肠杆菌 绿脓杆菌 地衣芽孢杆菌 金黄色葡萄球菌 肺炎链球菌YS-3 菌丝体--9.0-7.0 Y S-4 S-6 菌丝体-8.0---Y菌丝体-8.0---YB-4 菌丝体 12.0 10.0 7.0-8.5 YP-2 菌丝体 10.0 8.0 8.5 7.0 7.0 YP-5 菌丝体 8.5 11.0-15.0 13.0 YP-2 菌丝体--7.5 12.5-YP-4 菌丝体-9.0 11.0--GS-5 菌丝体 11.0 10.0 14.0--GS-6a 菌丝体 9.0-10.0-10.0 GS-7 菌丝体 9.0--8.5 12.5 GS-8a 菌丝体-12.0-13.0-GS-10 菌丝体 8.0-13.0 12.0 10.0链霉素/青霉素 37.0 29.0 36.0 38.0 30.0
大肠杆菌、绿脓杆菌阳性药-链霉素;地衣芽孢杆菌、金黄色葡萄球菌、肺炎链球菌阳性药-青霉素;对供试样品进行了抑菌活性的测定,部分结果如图4所示。图4分别为各细菌的典型抑菌结果。

图4 各供试细菌的典型抑菌结果
Fig.4 Typical antibacterial results of each tested bacteria
结果表明,菌株YS-6 发酵液对大肠杆菌的抑菌活性达到链霉素的70%,对地衣芽孢杆菌的抑菌活性达到青霉素的67%,对金黄色葡萄球菌的抑菌活性达到青霉素的79%,具有良好的抑菌活性;而GS-12 发酵液对以上3 种供试细菌也有着仅次于YS-6 的抑菌活性;所有待测样品对绿脓芽孢杆菌及肺炎双球菌的抑制作用不明显,表现出较弱的抑菌活性。由此可知,YS-6 发酵液供试样品和GS-6a 菌丝体供试样品在抑菌活性方面有较好的研究潜力。
3 讨论
植物内生真菌作为与植物共存一类微生物,通常与宿主植物具有相同或相似的次生代谢产物合成途径,其分布广泛种类多样,是一种亟待开发的重要微生物资源[2]。本研究通过不同培养基实现甘草根、茎、叶进行内生真菌的分离,结果证实甘草内生真菌在不同组织中都有分布且在不同组织中的分布不同,其中甘草根部组织微生物数量众多且种属各异,提示植物根部内生真菌的多样性最为丰富。
本研究通过9 种不同培养基进行内生真菌分离。为了尽可能模拟内生菌生长的自然环境,分离中除了采用经典微生物培养通常采用的常规培养基外,还设计了经50 倍和100 倍稀释的寡营养培养基[25]进行内生真菌的分离(见表1)。结果显示,常规培养基从甘草中能分离到内生真菌63 株,而寡营养培养基可分离出内生真菌65 株。以根部内生真菌最常采用的PDA 培养基分离为例,常规PDA 分离到9 株真菌,经50 倍和100 倍稀释的PDA 分别分离到6 株真菌和13 株真菌,该结果也提示经过稀释的培养基可以分离到常规方法难以获得的菌株,诠释了寡营养培养基也是一种良好的内生真菌分离手段。
为了尽力可能多地分离甘草内生真菌,本研究采用了马铃薯、山药、胡萝卜和百合作为培养基的成分进行培养基的改良,结果显示山药培养基共分离得到42 株内生真菌与常规真菌培养基PDA 分离到的内生真菌数量相当,均占总分离菌株数的32.81%,而通过百合培养基和胡萝卜培养基分离到的菌株数量只有以上两种的一半,分别占总菌株数的15.63%和18.75%,该结果也进一步说明了山药培养基中营养成分丰富,是一种可用于植物内生真菌分离的优质培养基。PDA 是植物内生真菌分离最常用的一种培养基,也有研究采用该培养基进行了甘草内生真菌的分离[26-28],与这些结果相比较,本研究不仅从甘草组织中分离得到了镰刀菌属、青霉属、曲霉属、链格孢属等已被报道过的甘草内生真菌,而且通过山药培养基和胡萝卜培养基也分离得到了如毕赤酵母属、枝孢属等鲜见报道的内生真菌,这显示出甘草内生真菌的数量众多且种属构成复杂,常规PDA 培养基能分离出的内生真菌只占植物中内生真菌总数的很少一部分,天然培养基和寡营养培养基的交叉使用对分离培养基种类的增加和菌株分离具有非常重要的意义。
本研究通过纸片扩散法[29]和3 种抗氧化活性测定方法评价了部分甘草内生真菌次级代谢产物的抗氧化和抑菌活性,从中筛选出了高活性菌株;GS-6a 菌株经分子生物学鉴定与季也蒙毕赤酵母有100%的同源性,初步鉴定为毕赤酵母属(Pichia.sp.),抗氧化活性测定结果显示其发酵液样品对DPPH 自由基清除率为97.54%,菌丝体样品对羟自由基清除率为98.83%,说明了季也蒙毕赤酵母次生代谢产物具有显著的抗氧化活性潜力[26-27]。此外,研究显示,季也蒙毕赤酵母也被用于聚乙烯等高分子材料的降解[28],在生物转化[30]和新型生物防菌剂[31]的制备方面也有较好的应用,具有着较高开发价值。具有较高抑菌活性的YS-6 菌株经分子生物学初步鉴定为枝孢霉菌属(Cladosporium sp.),其主要抗菌成分以异香豆素衍生物为主,显示了极大的开发潜力[32-33]。甘草作为一种应用广泛的中药,本研究通过其内生真菌较为系统的研究证实,甘草内生菌资源丰富,是活性化合物发现的良好资源,研究将为甘草的保护和深层次应用提供重要的技术资料。
[1]饶小莉,沈德龙,李俊,等.甘草内生细菌的分离及拮抗菌株鉴定[J].微生物学通报,2007,34(4):700-704.
RAO X L,SHEN D L,LI J,et al.Isolation of endophytic bacteria from glycyrrhiza and identifying of antagonistic bacteria[J].Microbiology,2007,34(4):700-704.
[2]赵妮,邓毅,刘靓,等.甘草内生菌20 株有效菌株发酵物与宿主水煎液、总黄酮、总皂苷体外抑菌活性对比研究[J].中医研究,2016,29(5):66-70.
ZHAO N,DENG Y,LIU L,et al.Comparative study on in vitro antibacterial activities of fermentation products of 20 effective strains of endophytic bacteria from Glycyrrhiza uralensis with host decoction,total flavonoids and total saponins[J].Traditional Chinese Medicinal Research,2016,29(5):66-70.
[3]曼琼,杨志军,邓毅,等.甘草内生菌的鉴定与药理作用和活性成分研究进展[J].中国临床药理学杂志,2018,34(9):1125-1128.
MAN Q,YANG Z J,DENG Y,et al.Research progress of identification,pharmacological action and active ingredients of endophytes isolated from Glycyrrhiza uralensis[J].The Chinese Journal of Clinical Pharmacology,2018,34(9):1125-1128.
[4]郭玉华,舒雪纯,张影波,等.基于超高效液相色谱-电喷雾-质谱、天然产物词典和活性筛选的艾纳香内生真菌次生代谢产物[J].微生物学通报,2020,47(2):552-561.
GUO Y H,SHU X C,ZHANG Y B,et al.Screening of bioactive secondary metabolites of endophytes associated with Blumea balsamifera (L.)DC.by UPLC-QTof-MS,DNP and bio-assay[J].Microbiology,2020,47(2):552-561.
[5]SOMAYEH N,MARYAM R,HOSSEIN H.Toxicological effects of Glycyrrhiza glabra (Licorice):A review[J].Phytotherapy Research:PTR,2017,31(11):1635-1650.
[6]李倩,高海荣,郭九峰.甘草主要化学成分及药效活性与环境关系研究进展[J].黑龙江农业科学,2019,9:150-154.
LI Q,GAO H R,GUO J F.Research progress on mainchemical composition and pharmacodynamic activity of Glycyrrhiza uralensis and relationship with environment[J].Heilongjiang Agricultural Sciences,2019,9:150-154.
[7]孙琛.甘草的化学成分研究进展[J].科技资讯,2020,18(2):64-65.
SUN C.Research progress on chemical constituents of Glycyrrhiza uralensis[J].Science&Technology Information,2020,18(2):64-65.
[8]吴林明,安琼,许衍东.甘草的化学成分及其药用价值[J].养生保健指南,2018,8:308.
WU L M,AN Q,XU Y D.Chemical constituents and medicinal value of Glycyrrhiza uralensis[J].Health Guide,2018,8:308.
[9]李薇,宋新波,张丽娟,等.甘草中化学成分研究进展[J].辽宁中医药大学学报,2012,14(7):40-44.
LI W,SONG X B,ZHANG L J,et al.Advances in research on chemical constituents of radix Glycyrrhizae[J].Journal of Liaoning University of Traditional Chinese Medicine,2012,14(7):40-44.
[10]田庆来,官月平,张波,等.甘草有效成分的药理作用研究进展[J].天然产物研究与开发,2006,2:343-347.
TIAN Q L,GUAN Y P,ZHANG B,et al.Research advances on pharmacological activities of components in licorice[J].Natural Product Research and Development,2006,2:343-347.
[11]张杰,李鸿钰,徐丽丽,等.甘草根和根茎的化学成分研究[J].中国药业,2017,26(12):15-19.
ZHANG J,LI H Y,XU L L,et al.Chemical constituents of the root and rhizome of glycyrrhiza uralensis fisch[J].China Pharmaceuticals,2017,26(12):15-19.
[12]吴晓菡.几种樟科和木兰科植物内生真菌多样性比较研究[D].上海:华东师范大学,2011.
WU X H.Comparative study of the diversity of endophytic fungi from several plants in Lauraceae and Magnoliaceae[D].Shanghai:East China Normal University,2011.
[13]ZHANG X G,GUO S J,WANG W N,et al.Diversity and bioactivity of endophytes from Angelica sinensis in China[J].Front Microbiol,2020,11:1489.
[14]李成义,马艳茹,魏学明,等.甘肃道地药材甘草的资源状况分析[J].西部中医药,2011,24(7):8-11.
LI C Y,MA Y R,WEI X M,et al.Analysis on resources of Gansu authentic ingredients licorice[J].Western Journal of Traditional Chinese Medicine,2011,24(7):8-11.
[15]李文军,郑素慧,毛培宏,等.新疆胀果甘草内生菌的分离及产甘草酸菌株的筛选[J].生物技术,2008,18(5):28-31.
LI W J,ZHENG S H,MAO P H,et al.Isolation of endophyte from Glycyrrhiza inflata Batalin of Xinjiang Uygur Autonomous Region and screening of glycyrrhizic acid-producing strain[J].Biotechnology,2008,18(5):28-31.
[16]GARY S,BRYN D.Bioprospecting for microbial endophytes and their natural products[J].Microbiology and Molecular Biology Reviews:MMBR,2003,67(4):491-502.
[17]DU X,MU H,ZHOU S,et al.Chemical analysis and antioxidant activity of polysaccharides extracted from Inonotus obliquus sclerotia [J].International Journal of Biological Macromolecules:Structure,Function and Interactions,2013,62:691-696.
[18]SMIRNOFF N,CUMBES Q J.Hydroxyl radical scavenging activity of compatible solutes[J].Phytochemistry,1989,28(4):1057-1060.
[19]WEI X,WANG Y,YANG Z.Antioxidant activities potential of tea polysaccharide fractions obtained by ultra filtration[J].International Journal of Biological Macromolecules:Structure,Function and Interactions,2012,50(3):558-564.
[20]张豪杰.复合抗菌剂的医用粘接剂抗菌性能及粘接强度的研究[D].天津:南开大学,2010.
ZHANG H J.Study of antibacterial property and adhesive strength about medical adhesive containing antibiotics[D].Tianjin:Nankai University,2010.
[21]HALSTEAD F D,RAUF M,MOIEMEN N S,et al.The antibacterial activity of acetic acid against biofilm-producing pathogens of relevance to burns patients[J].Plos One,2015,10(9):e0136190.
[22]李鹏杰,曼琼,邓毅,等.不同产地乌拉尔甘草及其内生细菌的抑菌活性比较[J].甘肃农业大学学报,2020,55(2):105-111.
LI P J,MAN Q,DENG Y,et al.Comparison of antibacterial acivity of Glyeyrrhiza uralensis and its endophytic bacteria in Gansu and Xinjiang[J].Journal of Gansu Agricultural University,2020,55(2):105-111.
[23]姜硕,许哲祥,王宇晴,等.基于甘草苷生物合成的甘草内生细菌的筛选及鉴定[J].中国新药杂志,2019,28(23):2872-2877.
JIANG S,XU Z X,WANG Y Q,et al.Biosynthesis of liquiritin in endophytic bacterium from Glycyrrhiza uralensis and its identification[J].Chinese Journal of New Drugs,2019,28(23):2872-2877.
[24]周世添,郭主声,邹美兰,等.纸片扩散法与微量肉汤稀释法检测念珠菌对氟康唑和伏立康唑药物敏感性的效果观察[J].心血管外科杂志 (电子版),2020,9(1):131-133.
ZHOU S T,GUO Z S,ZOU M L,et al.Observation on the effect of disk diffusion method and microbroth dilution method in detecting drug sensitivity of candida to fluconazole and voriconazole[J].Journal of Cardiovascular Surgery (Electronic Edition),2020,9(1):131-133.
[25]朱利平,黄惠莉.产壳聚糖酶海洋真菌鉴定、寡营养培养基优化及廉价培养基研究[J].食品与发酵工业,2011,37(5):39-43.
ZHU L P,HUANG H L.Identification of marine fungi producing chitosanase,optimization of oligotrophic medium and study on cheap medium[J].Food and Fermentation Industries,2011,37 (5):39-43.
[26]JOEL E L,BHIMBA B V.Evaluation of secondary metabolites from mangrove associated fungi Meyerozyma guilliermondii[J].Alexandria Journal of Medicine,2013,49(3):189-194.
[27]MOON Y S,NA C S,SEO S H,et al.Antioxidant and immunological activities of Sparassis crispa fermented with meyerozyma guilliermondii FM [J].Journal of the Korean Society of Food Science and Nutrition,2016,45(10):1398-1405.
[28]张杰,王天顺,刘雪,等.一种利用季也蒙毕赤酵母生物降解聚乙烯的方法:CN110317738A[P].2019-07-11[2021-01-19].
ZHANG J,WANG T S,LIU X,et al.A method for biodegradation of polyethylene by utilizing Meyerozyma guilliermondii:CN110317738A[P].2019-07-11[2021-01-19].
[29]时维静,路振香,李立顺.白头翁不同提取物及复方体外抑菌作用的实验研究[J].中国中医药科技,2006,13(3):166-168.
SHI W J,LU Z X,LI L S.Experimental study on antibacterial effect of different extracts and compound of Pulsatilla chinensis in vitro[J].Chinese Journal of Traditional Medical Science,2006,13(3):166-168.
[30]张丽媛,姚笛,王颖,等.季也蒙毕赤酵母发酵酒糟水解液生产木糖醇的方法:CN102994575A[P].2012-12-17[2021-01-19].
ZHANG L Y,YAO D,WANG Y,et al.The method of producing xylitol by fermentation of distiller's grains hydrolysate by Meyerozyma guilliermondii:CN102994575A[P].2012-12-17 [2021-01-19].
[31]孙卫红,周秋阳,杨慧慧,等.一种季也蒙毕赤酵母菌液体生防菌剂及其制备方法:CN109136117A[P].2018-08-27[2021-01-19].
SUN W H,ZHOU Q Y,YANG H H,et al.A liquid biocontrol agent for Meyerozyma guilliermondii and its preparation method:CN109136117A [P].2018-08-27[2021-01-19].
[32]JIANG Q,WEI N,HUO Y,et al.Secondary metabolites of the endophytic fungus Cladosporium sp.CYC38[J].Chemistry of Natural Compounds,2020,56(6):1166-1169.
[33]MURALI M,PRATHIBHA M,HEMA P,et al.Phytochemical analysis and antibacterial activity of endophytic fungi isolated from Basella rubra L.-A medicinal plant[J].Journal of Pure&Applied Microbiology,2015,9(4):2971-2978.