微囊藻毒素(Microcysin,MC)是一种天然小分子毒素[1],由蓝藻产生并释放到水体中[2],主要有MC-LR、MC-LA、MC-LY、MC-LW、MC-LF、MCYR、MC-WR、MC-RR 等8 种异构体[3],其中MCLR 毒性最强[4],普通水厂净化不能有效去除,严重威胁人畜饮用水安全。1996年,巴西一透析中心的透析液被MC-LR 污染,导致至少26 人死亡[5]。而在我国,2007年太湖蓝藻爆发导致整个无锡市的饮用水污染[6]。此外,在长江、黄河、松花江中下游等主要河流以及鄱阳湖、武汉东湖、上海淀山湖等几大淡水湖泊中,均检测到MC-LR。构建藻毒素的快速检测方法十分必要。
免疫分析方法是一种基于抗原与抗体特异性识别的检测技术[7],由于特异性强、灵敏度高等优点而被广泛应用于检测分析中[8-9]。近年来,免疫分析方法发展迅速,其中以酶联免疫分析法 (Enzyme-linked immunosorbent assay,ELISA) 应用最广泛[10]。对于免疫分析方法而言,制备高质量的抗体是其重点与难点所在[11]。与传统多克隆抗体和单克隆抗体相比,仅由重链可变区组成的纳米抗体(Nanobody,Nb)具有稳定性强、易表达、易于基因工程操作等特性[12-13],在免疫检测方面的应用优势越来越受到人们的关注。本研究基于实验室前期已构建好的噬菌体展示纳米抗体文库[14],采用固相亲和淘筛的方法,制备得到特异性识别MC-LR 的纳米抗体,建立MC-LR 的间接竞争酶联免疫分析方法,并将其应用于实际样品中MC-LR 的检测。
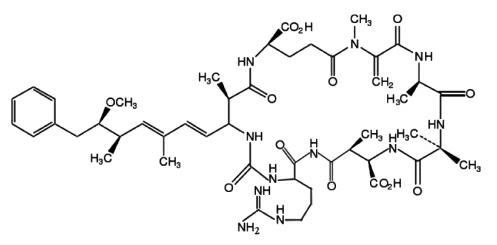
图1 微囊藻毒素-LR 结构式
Fig.1 The structure of MC-LR
1 材料与方法
1.1 材料与试剂
MCs 标准品,台湾Algal 公司;大肠杆菌BL21(DE3)菌株,全式金生物公司;大肠杆菌ER2738菌株,美国Lucigen 公司;TMB 显色液,北京索莱宝科技有限公司;兔抗VHH-HRP 多克隆抗体,南京金斯瑞科技有限公司;辅助噬菌体M13K07,NEB 生物科技有限公司;M13 噬菌体抗体,美国GE 公司;引物合成及测序由广州睿博公司完成。
1.2 仪器与设备
NanoDrop 2000C 分光光度计、SORVALL LYNX 4000 centrifuge 离心机、Multiskan MK3 酶标仪,美国Thermo 公司;蛋白电泳仪、Biologic LP蛋白纯化仪、GDS7500 凝胶成像仪,美国BIORAD公司。
1.3 方法
1.3.1 噬菌体展示纳米抗体文库的筛选与鉴定采用固相亲和淘筛方法,对已构建好的纳米抗体文库进行4 轮筛选,每轮包被不同质量浓度微囊藻毒素-鸡蛋白蛋白偶联物MC-LR-OVA(10,2.5,0.5,0.1 μg/mL),37 ℃包被过夜。用磷酸盐缓冲液(吐温)洗涤2 次,每轮选用不同封闭液封闭3 h。将100 μL 纳米抗体文库加入包被原孔,37 ℃振荡孵育1 h。第1~3 轮淘筛加入药物进行竞争洗脱,质量浓度依次为2,0.5,0.1 μg/mL,第4 轮为10 mg/mL 胰蛋白酶,37 ℃振荡1 h,重复洗脱1次,混合两次洗脱液即为各轮淘筛产物。取10 μL洗脱液计算滴度,其余进行扩增后用于下一轮的淘筛。从第4 轮的平板上随机挑取20 个单克隆进行深孔板表达,用ic-ELISA 方法检测其活性。根据测定结果,抑制率(Inhibition rate,I)计算公式如下:
式中,B0——MC-LR“0”质量浓度孔对应的吸光值;B——MC-LR 标准溶液孔对应的吸光值。
1.3.2 抗MC-LR 纳米抗体的表达纯化与性能分析 将含有抗 MC-LR 纳米抗体基因的pComb3XSS 质粒转化至表达宿主大肠杆菌BL21(DE3) 中,表达条件为:37 ℃、250 r/min、1%接种量、0.1 mmol/L 异丙基-β-D-硫代半乳糖苷,采用冻融法提取菌体周质腔,经镍柱亲和纯化获得纳米抗体。利用ic-ELISA 方法,研究其热稳定性及有机溶剂耐受性。
1.3.3 基于抗MC-LR 纳米抗体M110 的ic-ELISA 的方法建立 用包被液将包被抗原MCLR-OVA 稀释至1 000 ng/mL,100 μL/孔加入到酶标板,37 ℃包被过夜。次日,用1%鱼胶,37 ℃封闭3 h。向酶标板内加入50 μL/孔的纳米抗体及50 μL/孔不同质量浓度的MC-LR 标准品溶液,37 ℃孵育40 min。用PBST 洗涤5 次,加入100 μL/孔的兔抗VHH-HRP 抗体(0.1 μg/mL),37 ℃孵育40 min。用PBST 洗涤5 次后,加入100 μL/孔的TMB显色液,37 ℃孵育10 min,加入50 μL/孔10%的H2SO4 溶液终止后,测定A450nm 吸光值。
1.3.4 样品添加回收及方法准确性分析 取车陂涌华南农业大学段水样,参照国标GB/T 20466-2006《水中微囊藻毒素的测定》的检测方法,以建立的ic-ELISA 方法对样品进行检测,并与UPLCMS/MS 检测结果进行比对,评价方法的可靠性。
2 结果与分析
2.1 噬菌体展示纳米抗体文库的淘筛
以MC-LR 为免疫原,本课题组在试验前期已成功构建库容量为8.33×107 CFU/mL VHH 基因文库。经辅助噬菌体M13K07 救援后,获得滴度为1.0×1012 PFU/mL 噬菌体展示纳米抗体文库。
以MC-LR-OVA 为包被原,对噬菌体展示纳米抗体文库进行4 轮淘筛,从第4 轮筛选的洗脱产物测定平板上随机挑选20 个克隆,用ic-ELISA鉴定其活性,结果如图2所示。最终获得抗MCLR 纳米抗体2 株:M110 和M207,其序列信息如图3所示。采用ic-ELISA 检测抗体活性,选择抑特异性较好的M110 克隆(I=97.26%)用于后续研究。
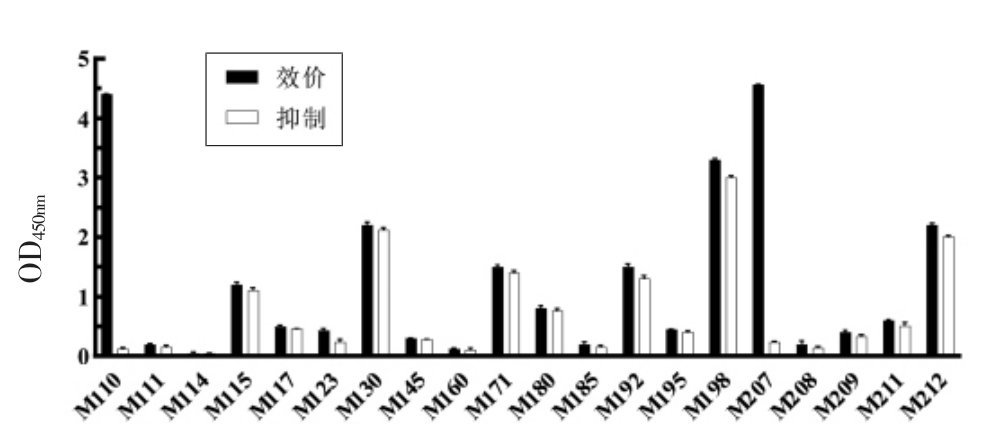
图2 ic-ELISA 鉴定特异性阳性克隆
Fig.2 Identification of specific positive clones by ic-ELISA
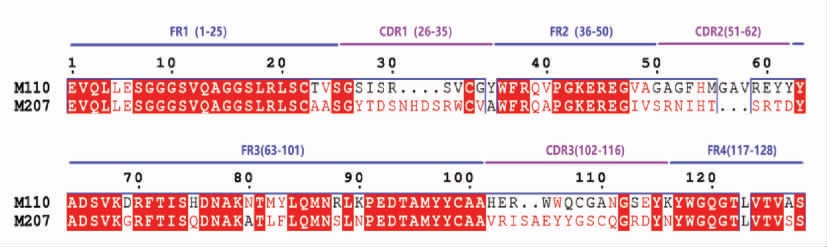
图3 M110、M207 序列比对
Fig.3 Sequence aligment of M110 and M207
2.2 纳米抗体M110 的表达纯化及性能分析
表达纯化后的纳米抗体经SDS-PAGE 和免疫印迹验证(图4),纯度可达90%以上,表达量为3.5 mg/L。稳定性分析结果表明(图5),纳米抗体M110 在90 ℃孵育1 h,仍具备超过60%的抗原结合活性,且在体积分数40%甲醇或乙腈中仍具有超过80%的活性,这显示该抗体具有较好的热稳定和有机溶剂耐受性。
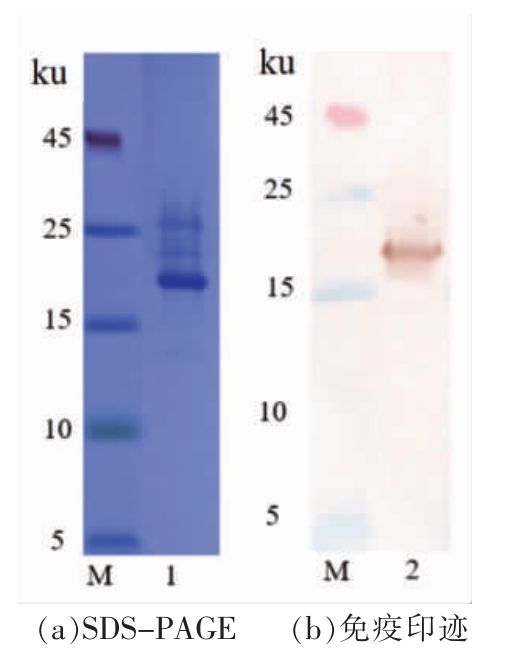
图4 SDS-PAGE(a)和免疫印迹(b)验证纯化后纳米抗体M110
Fig.4 Identification of the purified nanobody M110 by SDS-PAGE (a) and western blotting (b)
注:M 表示标准蛋白;泳道1 与泳道2 均为纯化后的M110。
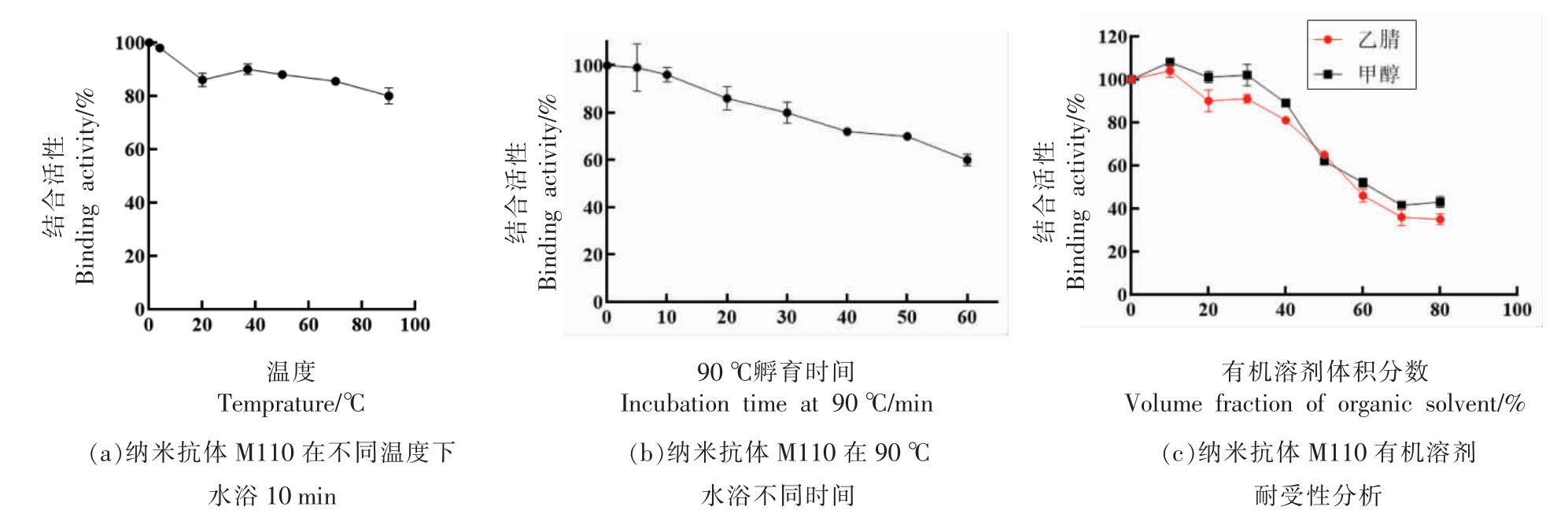
图5 纳米抗体M110 热稳定性和有机溶剂耐受性分析
Fig.5 Thermal stability and organic solvents tolerance of nanobody M110
2.3 基于纳米抗体M110 的ic-ELISA 方法建立及灵敏度和特异性评价
2.3.1 基于纳米抗体M110 的ic-ELISA 方法建立 建立基于纳米抗体M110 检测MC-LR 的ic-ELISA 方法,绘制竞争抑制标准曲线[14]。如图6所示,其IC50 为3.55 ng/mL,线性范围为1.28~9.88 ng/mL,检测限为0.652 ng/mL,其与所有藻毒素类毒素均有交叉(表1),可能的原因是藻毒素均有一个共同的结构域Adda,纳米抗体M110 能够识别的区域是Adda。
表1 纳米抗体M110 与藻毒素的交叉率(n=3)
Table 1 The crossover rate between nanobody M110 and algal toxin (n=3)
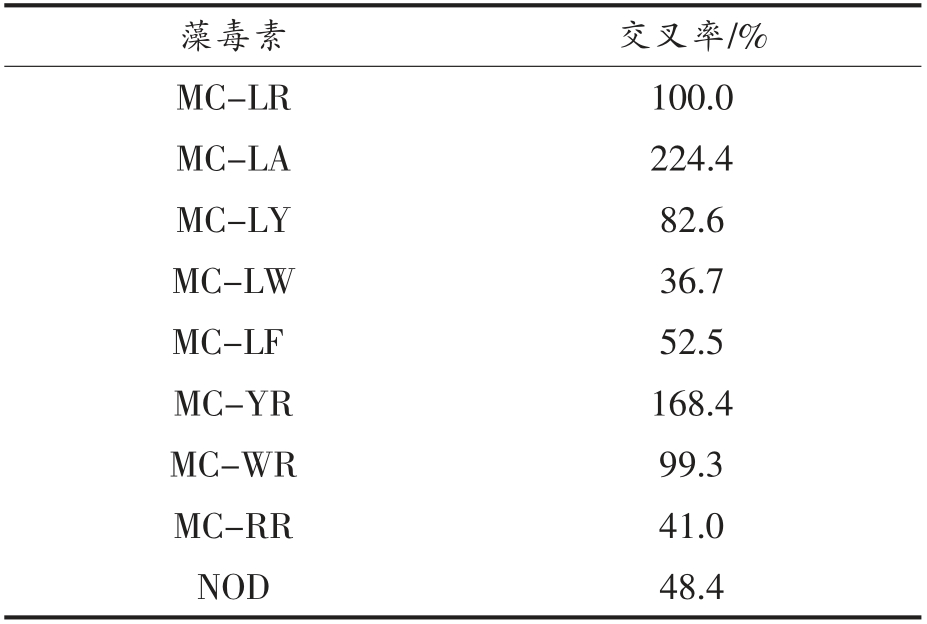
注:NOD.节球藻毒素。
藻毒素 交叉率/%MC-LR 100.0 MCLA LY 224.4 MC-82.6 MC-LW 36.7 MC-LF 52.5 MC-YR 168.4 MC-WR 99.3 MC-RR 41.0 NOD 48.4
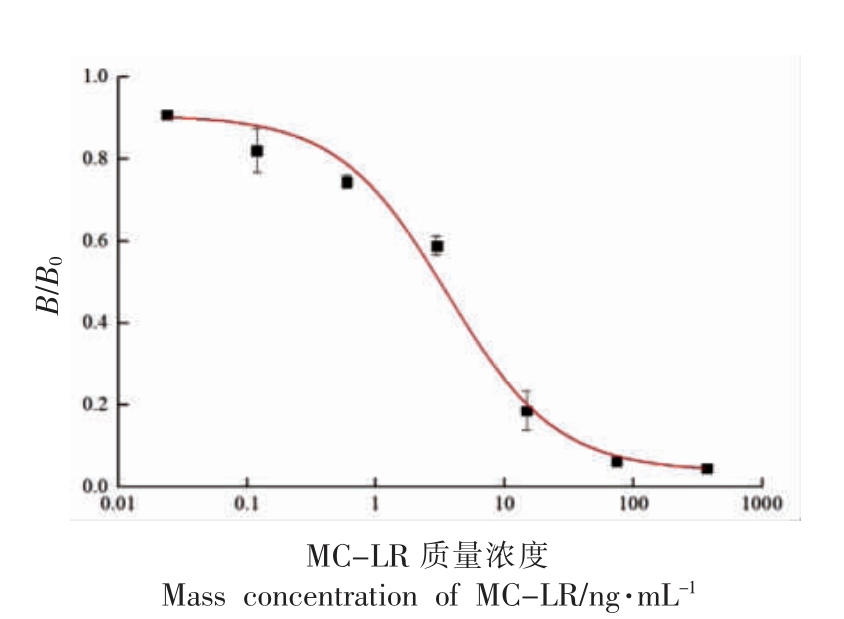
图6 基于纳米抗体M110 的ic-ELISA 方法检测MC-LR 的标准曲线(n=3)
Fig.6 The standard curve of ic-ELISA for detecting MC-LR based on nanobody M110 (n=3)
2.3.2 样品添加回收及方法准确性分析 分别对水样添加不同质量浓度MC-LR 标准品(0.5,1,2 ng/mL)进行添加回收试验,采用UPLC-MS/MS 方法对ic-ELISA 方法进行验证,其结果见表2,ic-ELISA 方法回收率为111.0%~119.3%,从图7中可以看出,两种方法的结果相关系数达0.999,结果表明ic-ELISA 方法检测准确性良好。
表2 基于M110 的ic-ELISA 方法检测水样中MC-LR 的回收率(n=3)
Table 2 Recovery of MC-LR in water samples detected by ic-ELISA based on M110 (n=3)

加标质量浓度/ng·mL-1 ic-ELISA UPLC-MS/MS检出值/ng·mL-1 回收率/% 检出值/ng·mL-1 回收率/%0 0----浓缩后质量浓度/ng·mL-1 0.5 20 23.5±0.9 117.7±3.6 21.1±0.4 105.4±1.9 1 40 44.4±2.6 111.0±5.8 42.9±0.8 107.2±1.9 2 80 95.5±0.9 119.3±2.0 93.1±1.4 116.4±1.5
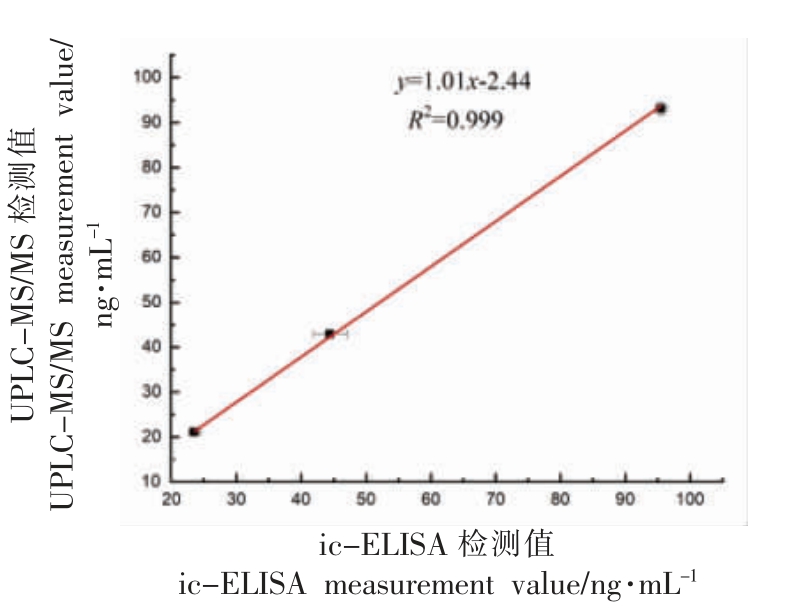
图7 ic-ELISA 和UPLC-MS/MS 方法检测水样中MC-LR 的结果比对(n=3)
Fig.7 Results comparison of MC-LR in water samples detected by ic-ELISA and UPLC-MS/MS (n=3)
3 结论
纳米抗体因其特性,被广泛应用于医疗方面,近年来也被广泛应用于小分子污染物检测中。本研究构建了针对MC-LR 的纳米抗体文库,库容量为8.33×107 CFU/mL。并通过亲和淘筛获得MCLR 纳米抗体M110,建立了MC-LR 的ic-ELISA方法,其IC50 为3.55 ng/mL。将该方法其应用于水样中MC-LR 的检测,并利用UPLC-MS/MS 方法进行仪器比对,该ic-ELISA 方法准确性好、灵敏度高,制备的纳米抗体M110 还具有较好的热稳定性与有机溶剂耐受性,可用于免疫快速检测试剂盒的开发研究。
[1]KELETI G,SYKORA J L.Production and properties of cyanobacterial endotoxins[J].Applied and Environmental Microbiology,1982,43(1):104-109.
[2]隋海霞,陈艳,严卫星,等.淡水湖泊中微囊藻毒素的污染[J].中国食品卫生杂志,2004 (2):112-114.
SUI H X,CHEN Y,YAN W X,et al.Pollution of microcystin in fresh water lakes[J].Chinese Journal of Food Hygiene,2004(2):112-114.
[3]XU C X,YANG Y,LIU L W,et al.Microcystin-LR nanobody screening from an alpaca phage display nanobody library and its expression and application [J].Ecotoxicology and Environmental Safety,2018,151:220-227.
[4]王莎飞,郭彩荣,徐向阳,等.环境水体藻毒素生物处理技术研究进展[J].应用生态学报 2016,27(5):1683-1692.
WANG S F,GUO C R,XU X Y,et al.Review on iological treatment of cyanobacterial toxin in natural waters[J].Journal of Applied Ecology,2016,27(5):1683-1692.
[5]POURIA S,DE ANDRADE A,BARBOSA J,et al.Fatal microcystin intoxication in haemodialysis unit in Caruaru,Brazil [J].The Lancet,1998,352(9121):21-26.
[6]于建伟,李宗来,曹楠,等.无锡市饮用水嗅味突发事件致嗅原因及潜在问题分析[J].环境科学学报,2007,27(11):1771-1777.
YU J W,LI Z L,CAO N,et al.Analyses on cause for odor and potential problems in water source during odor episode event in Wuxi[J].Journal of Environmental Sciences,2007,27 (11):1771-1777.
[7]HOU S L,MA J J,CHENG Y Q,et al.One-step rapid detection of fumonisin B-1,dexyonivalenol and zearalenone in grains [J].Food Control,2020,117:107107.
[8]SELVARAJ J N,WANG Y,ZHOU L,et al.Recent mycotoxin survey data and advanced mycotoxin detection techniques reported from China:A review[J].Food Additives&Contaminants:Part A,2015,32(4):440-452.
[9]ZHANG J R,WANG Y,DONG J X,et al.Development of a simple pretreatment immunoassay based on an organic solvent-tolerant nanobody for the detection of carbofuran in vegetable and fruit samples[J].Biomolecules,2019,9(10):576.
[10]XU C X,YANG Y,LIU L W,et al.Microcystin-LR nanobody screening from an alpaca phage display nanobody library and its expression and application [J].Ecotoxicology and Environmental Safety,2018,151:220-227.
[11]LU N,LING L,GUAN T,et al.Broad-specificity ELISA with a heterogeneous strategy for sensitive detection of microcystins and nodularin [J].Toxicon,2020,175:44-48.
[12]ZHANG Y Q,XU Z L,WANG F,et al.Isolation of bactrian camel single domain antibody for parathion and development of one-step dc-FEIA method using VHH-alkaline phosphatase fusion protein[J].Analytical Chemistry,2018,90 (21):12886-12892.
[13]蔡家麟,夏立亮,潘欣,等.重链抗体的结构特点及其应用前景分析 [J].生命科学 2013,25(9):853-857.
CAI J L,XIA L L,PAN X,et al.Structure properties of heavy chain antibody and its future application[J].Life Sciences,2013,25(9):853-857.
[14]ZHANG J R,WANG Y,DONG J X,et al.Development of a simple pretreatment immunoassay based on an organic solvent-tolerant nanobody for the detection of carbofuran in vegetable and fruit samples[J].Biomolecules,2019,9(10):576.
[15]张玉琪,张瑾如,王锋,等.对硫磷纳米抗体筛选及分子识别机制研究[J].分析化学 2019,47(9):1419-1428.
ZHANG Y Q,ZHANG J R,WANG F,et al.Selection of nanobody and recoanition mechanism between nanobody and parathion [J].Analytical Chemistry,2019,47(9):1419-1428.