单氰胺(Cyanamide)又名氨基氰,是一种良好的植物生长调节剂[1],可以促使蔬菜和水果提前萌芽、开花、结果、成熟、上市[2],在番茄、葡萄、樱桃等经济效益较高的蔬菜和水果产中有着广泛应用[3-4]。然而,单氰胺在水中易溶解[5],易通过农业生产排放到自然环境中,从而影响生态系统的稳定和平衡[6]。此外,单氰胺有剧毒,能够腐蚀人体皮肤组织,刺激呼吸道[7],能引起接触性皮炎[8]、头晕头痛和恶心、呕吐、腹泻等症状[9-12],食品中的单氰胺残留对人类健康有着潜在的危险。一方面,GB 2763-2019 《食品安全国家标准 食品中农药最大残留限量》中规定0.05 mg/kg(临时限量)为葡萄的单氰胺最大残留限量[13];另一方面,缺乏相应的行业标准及国家标准,有关单氰胺检测的方法也不多[14]。现有食品中单氰胺的分析方法主要有:比色法[15]、气相色谱-质谱联用法[16]、红外光谱法[17]、脉冲电化学检测法[18]、电位滴定法[19]等。这些方法虽准确、可靠,但灵敏度尚有不足。建立高灵敏食品中单氰胺残留量的检测方法,对于促进食品安全和保障人类健康具有着非常重要的意义。
单氰胺结构中含有活泼基团氨基,可通过柱前衍生化反应后用高效液相色谱-质谱法(HPLCMS)间接测定。衍生化反应可在其分子上增加发色基团,改变其色谱行为,提高其质谱雾化及离子化效率,大大提高其HPLC-MS 检测灵敏度[4]。测定单氰胺常用的衍生化试剂有邻苯二甲醛[20]、6-氨基喹啉基-N-羟基琥珀酰亚胺基氨基甲酸酯[21]、丹磺酰氯[22]、1,2-萘醌-4-磺酸钾[23]等。由于这些衍生试剂具有衍生产物不稳定、对光敏感、专一性不强、操作复杂等问题,因此合成一种新的衍生化试剂就显得非常必要。本研究合成了一种以罗丹明B 为母体结构,琥珀酰亚胺基为活性基团,对单氰胺高效、专一的新型化学衍生试剂——罗丹明BN-琥珀酰亚胺酯(RBS),对其结构和性质进行表征,并基于RBS 柱前衍生和HPLC-MS 技术建立一种高灵敏、高准确、高效率的单氰胺检测方法,用于检测葡萄和番茄中的单氰胺残留量。
1 材料与方法
1.1 试剂与仪器
葡萄和番茄,购于雅安市农贸市场。
罗丹明B (96%)(RB)、N-羟基琥珀酰亚胺(98%)、二环己基碳二亚胺(DCC)(98%)、单氰胺(98%),北京百灵威科技有限公司;乙腈(HPLC级)、甲醇(HPLC 级),成都市凌微科技有限公司;乙酸乙酯(HPLC 级)、无水乙醇(HPLC 级),成都市科隆化学品有限公司;甲酸(LC-MS Ultra 级),西格玛奥德里奇(上海)贸易有限公司。
Bruker AVIII 600 MHz 型核磁共振波谱仪,布鲁克科技有限公司;Agilent 6120 型质谱仪、Agilent 1260 型高效液相色谱仪,安捷伦科技有限公司;Thermo Scientific NicoletIS10 型傅里叶变换红外光谱仪,赛默飞世尔科技有限公司。
1.2 RBS 合成及结构表征
1.2.1 RBS 合成 RBS 合成路线如图1所示。罗丹明B 2.4 g 溶于100 mL 乙腈中,加热至约45 ℃加入N-羟基琥珀酰亚胺(HOSu)0.6 g 边搅拌边由恒压滴液漏斗滴加入含二环己基碳二亚胺(DCC)1.2 g 的乙腈溶液50 mL,维持45 ℃反应1 h 再室温搅拌反应20 h[24]。过滤除去反应生成的粉末,滤液蒸除乙腈,所得黏稠状固体用干燥乙醚洗涤多次,所得粗产品用乙腈/乙醚重结晶,得亮绿色晶体。

图1 RBS 的合成路线
Fig.1 Synthesis route of RBS
1.2.2 核磁共振氢谱表征 以CD3CN 为溶剂测定RBS 的核磁共振氢谱,600.13 MHz 为质子共振频率,四甲基硅烷为内标,298 K 为试验温度[25]。
1.2.3 傅里叶红外光谱表征 在用溴化钾为背景、仪器分辨率为4 cm-1、压力为15 kPa 的条件下,扫描次数32 次[26],使用压片法测定。
1.2.4 高效液相色谱-质谱鉴定 将罗丹明B 和合成的RBS 称取适量,用无水乙醇配置成一定浓度,过0.22 μm 有机相滤膜,用高效液相色谱-质谱联用仪进行上机测定。
1.3 样品前处理
样品前处理参考兰丰等[2]和Cheng 等[22]的方法并做了改进。分别准确称取5 g 葡萄样品和番茄样品于100 mL 烧杯中,加入25 mL 乙酸乙酯,超声15 min,加入30 g 无水硫酸钠,持续涡旋3 min,在4 ℃下以4 000 r/min 离心15 min,快速定性滤纸过滤,用15 mL 乙酸乙酯冲洗3 次,收集所有滤液至100 mL 烧杯中,用0.22 μm 有机相滤膜过滤于50 mL 具塞玻璃试管中,于40 ℃氮吹仪上吹干,用1 mL 无水乙醇复溶,再用0.22 μm 有机相滤膜过滤至进样品瓶中,备用。
1.4 标准溶液配制
准确称取一定量的单氰胺标准品于10 mL 容量瓶中,使用色谱级的无水乙醇定容,配制成0.1 mol/L 的储备液,再根据实际使用情况进行稀释,最好现配现用[25]。
1.5 单氰胺衍生化
准确称取一定量的RBS 使用色谱级的无水乙醇定容,配制成一定浓度的衍生试剂,将制得的衍生化试剂加入至一定量的单氰胺标准溶液和样品溶液中,60 ℃下水浴避光反应1 h[27],采用0.22 μm 有机滤膜过滤至进样瓶,上机测定。
1.6 HPLC-MS 条件
1.6.1 色谱条件 色谱柱:Agilent Zorbax SB-C18反相色谱柱(250 mm×4.6 mm,5 μm);流动相A:水+0.1%甲酸;流动相B:甲醇+0.1%甲酸;梯度洗脱:0~6 min,76%~95%B;进样量:10 μL;流速:1 mL/min;柱温:35 ℃;DAD 检测波长:260 nm。
1.6.2 质谱条件 雾化气体:氮气;干燥气的温度:350 ℃;驻留时间:290 ms;扫描的方式:电喷雾离子源(ESI)正离子扫描;干燥气的流速:12.0 L/min;相对驻留时间:100.0%;检测的模式:Scan 扫描、SIM 扫描;雾化器的压力:275.8 kPa;碰撞诱导解离能量:70 V;质荷比扫描范围:100~1 000 u。采用碎片离子和分子离子的质荷比进行定性分析,采用外标法质谱峰面积进行定量分析。
1.7 数据分析与处理
作图分析使用Origin 9.0 软件,结构式画图分析采用Chem Office 2016 软件,数据统计使用Excel 2010 软件。
2 结果与讨论
2.1 RBS 结构表征
与RB 进行对比,通过核磁共振氢谱对合成的RBS 进行结构分析,RBS 和RB 在氘代乙腈中的质子化学位移(δH)和位置归属在表1中列出。从表1可得,荧光探针RBS 在0.00268‰处出现了含4 个氢原子的峰,此为两个CH2,即琥珀酰亚胺基中的两个亚甲基[24],由这一特征值可表明RB分子上成功接枝了琥珀酰亚胺基基团,RBS 已合成。并且产物RBS 苯环中的氢原子与RB 中相应氢原子相比,向低场方向发生了较大化学位移变化,说明下部苯环上琥珀酰亚胺酯取代基对整个大共轭结构的电子云分布影响显著,使氢核外电子云密度降低。此外,从RBS 芳环区质子的化学位移还可以看到,RBS 与RB 一样,4 号质子的化学位移在2 号质子的高场区。这说明RBS 与RB一样为开环结构。由于苯环上琥珀酰亚胺酯结构的存在,使RBS 无法形成内酯型结构。据此推断,RBS 可能会较少受环境影响,在较宽的溶剂选择及pH 值范围内都具备紫外吸收及荧光发射特性。
表1 RBS、RB 的核磁共振氢谱
Table 1 Nuclear magnetic resonance spectroscopy of RBS and RB
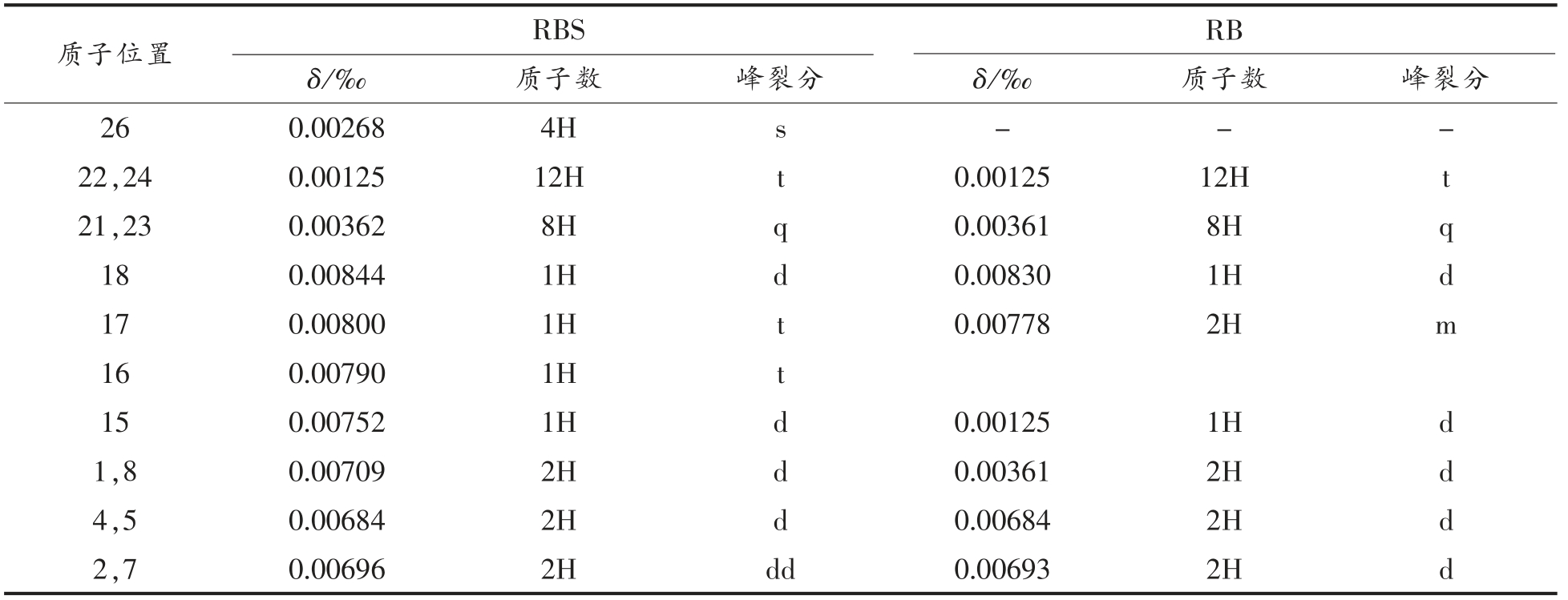
质子位置 RBS RB δ/‰ 质子数 峰裂分 δ/‰ 质子数 峰裂分26 0.00268 4H s---22,24 0.00125 12H t 0.00125 12H t 21,23 0.00362 8H q 0.00361 8H q 18 0.00844 1H d 0.00830 1H d 17 0.00800 1H t 0.00778 2H m 16 0.00790 1H t 15 0.00752 1H d 0.00125 1H d 1,8 0.00709 2H d 0.00361 2H d 4,5 0.00684 2H d 0.00684 2H d 2,7 0.00696 2H dd 0.00693 2H d
对RBS 还进行了FTIR 表征。如图2所示,波数为2 979.50,2 931.90 cm-1 的峰被指认为甲基CH3、亚甲基CH2 的伸缩振动峰,在1 771.57 cm-1处的峰被指认为酯基C=O 的伸缩振动峰,1 738.84 cm-1 处的峰被指认为琥珀酰亚胺C=O 的伸缩振动峰,在1 646.61,1 590.08 cm-1 处的峰被指认为芳环C=C 的伸缩振动峰,在1 468.10 cm-1 处的峰被指认为甲基CH3、亚甲基CH2 的弯曲振动峰,在1 182.48 cm-1 处的峰指认为C-O 的伸缩振动峰,在998.02,923.64,682.64 cm-1 处的峰指认为芳环=C-H 的伸缩振动峰。分析结果表明,衍生产物中出现琥珀酰亚胺的信号,说明罗丹明B-N-琥珀酰亚胺衍生成功[24],以上数据进一步证实了RBS的成功合成。
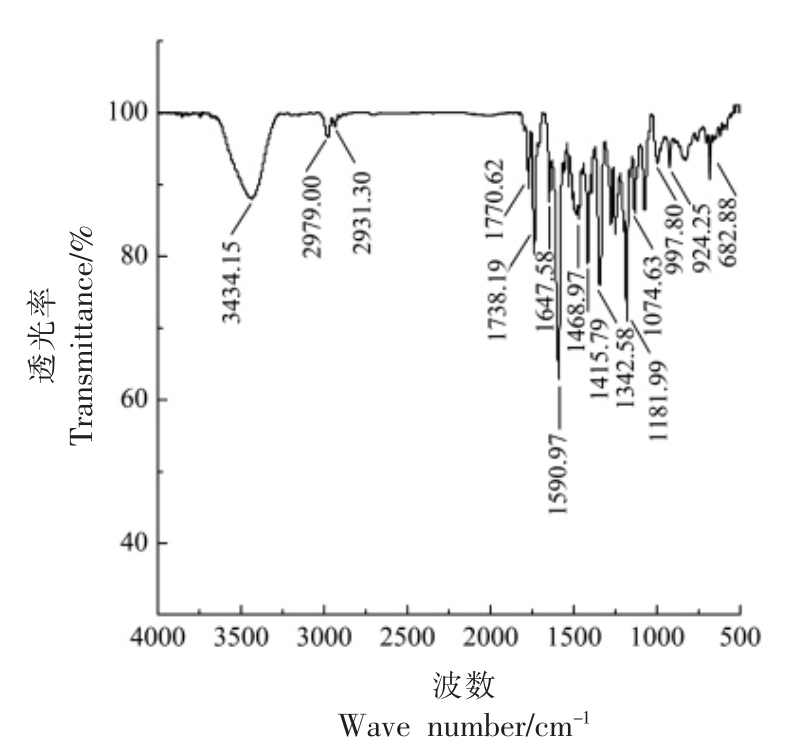
图2 RBS 的红外光谱图
Fig.2 Infrared spectrum of RBS
2.2 RBS 的HPLC-MS 鉴定
图3是RBS 的色谱图(图3a)、总离子流图(图3b)及质谱图(图3b 内插图)。如图3a所示,1.63 min 出峰的物质是合成的RBS,由于RBS 上的琥珀酰亚胺酯基团极易水解,1.86 min 出峰物质为RBS 在流动相中部分水解生成的RB,通过与RB 标准品的色谱图对照得以验证。色谱图基线平稳,无其它杂质,初步证明RBS 合成成功。如图3b所示,RBS 的质谱峰形良好,由内插图可见其质荷比为540.3,可归属为RBS 的准分子离子峰[M+](RBS 分子式:C32H34N3O5,M+计算值:540.25),以上结果可证明目标化合物RBS 成功合成。
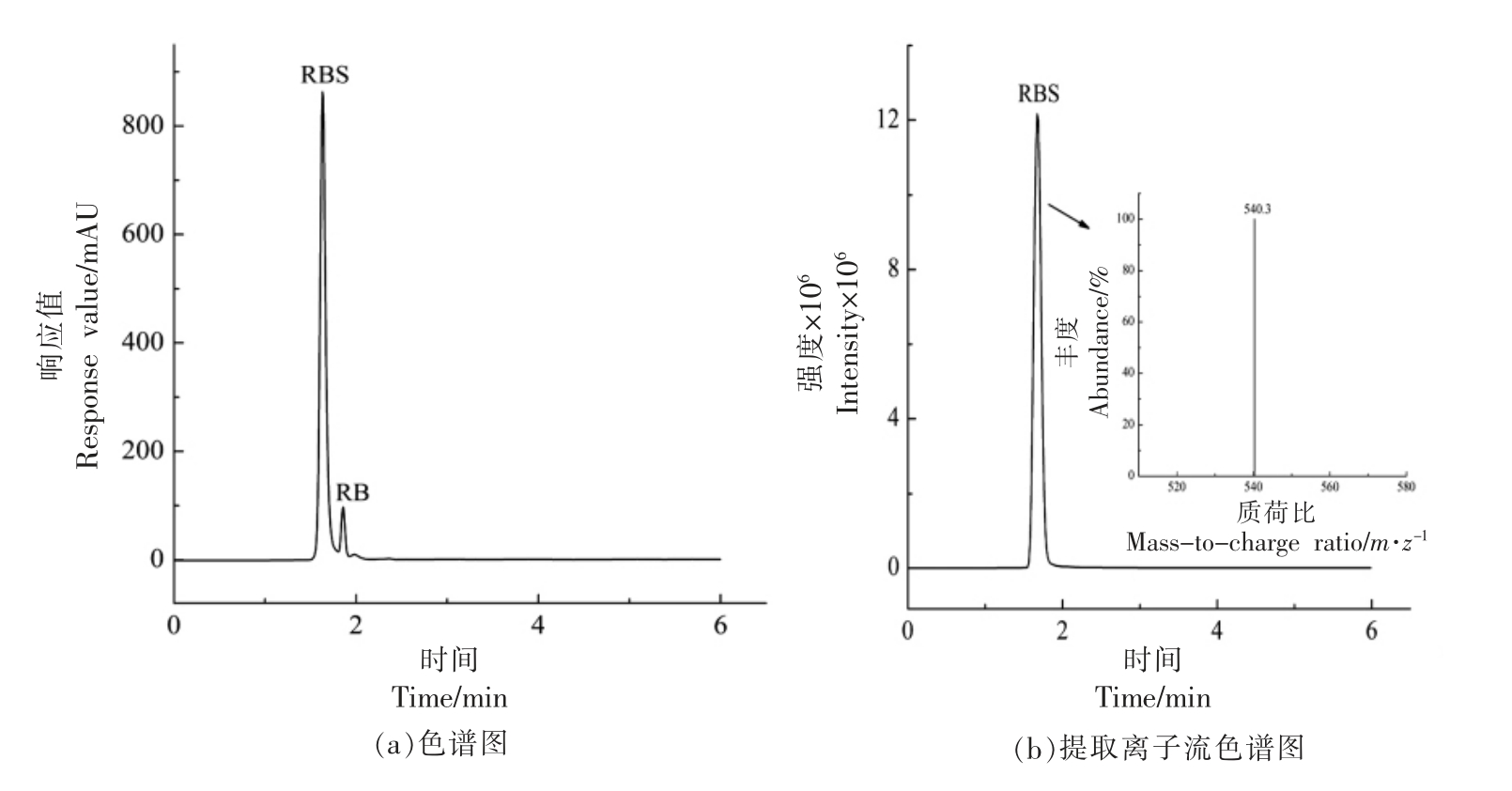
图3 RBS 的色谱图(a)、提取离子流色谱图(b)及质谱图(b 内插图)
Fig.3 Chromatogram (a),extracted ion current chromatogram (b) and mass spectrum(b-inset) of RBS
2.3 RBS 衍生化单氰胺
RBS 衍生化单氰胺的反应方程式如图4所示。单氰胺化学分子结构简单,分子质量小,极性大,没有生色基团和荧光基团,无法直接进行色谱分析[27]。然而单氰胺结构中含有氨基,经衍生化反应后可以增加发色基团,改变其色谱行为。RBS 中的琥珀酰亚胺基团(NHS)与氨基基团(-NH2)交联反应后生成的酰胺类物质,该物质结构本身就含有共轭结构,发生衍生化反应后,衍生产物会更稳定[28-29]。此反应灵敏且迅速,具有高选择性、高特异性、高专一性、反应效率高、副产物少等优点,被广泛地应用于氨基化合物的衍生[30]。
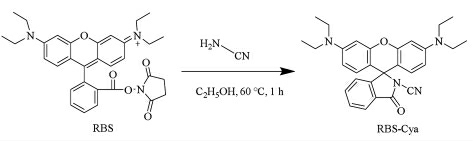
图4 RBS 衍生单氰胺的反应示意图
Fig.4 Schematic diagram of RBS-derived cyanamide reaction
2.4 单氰胺衍生产物的HPLC-MS 鉴定
对RBS 与单氰胺的物质的量比为2∶1 反应后的溶液进行HPLC-MS 分析。如图5a所示,HPLC 谱中1.67 min 和1.84 min 的色谱峰可分别归属为RBS 及其水解产物RB,保留时间5.42 min 的色谱峰归属为衍生产物RBS-Cya,该峰形尖锐、对称,可以初步判断RBS 对单氰胺的衍生化反应是成功的。所有物质在6 min 内可以完全分离,分析时间较短[31],能够满足定量分析的要求。图5b 是在正离子模式下,采用SIM 扫描模式得到RBS 衍生化单氰胺的提取离子流色谱图,由内插图可见,m/z=467.2 的质谱峰,可归属为RBSCya 的[M+H]+峰(RBS-Cya 分子式:C29H30N4O2,M+计算值:466.24),由此可判断RBS 对单氰胺的衍生化反应成功进行。
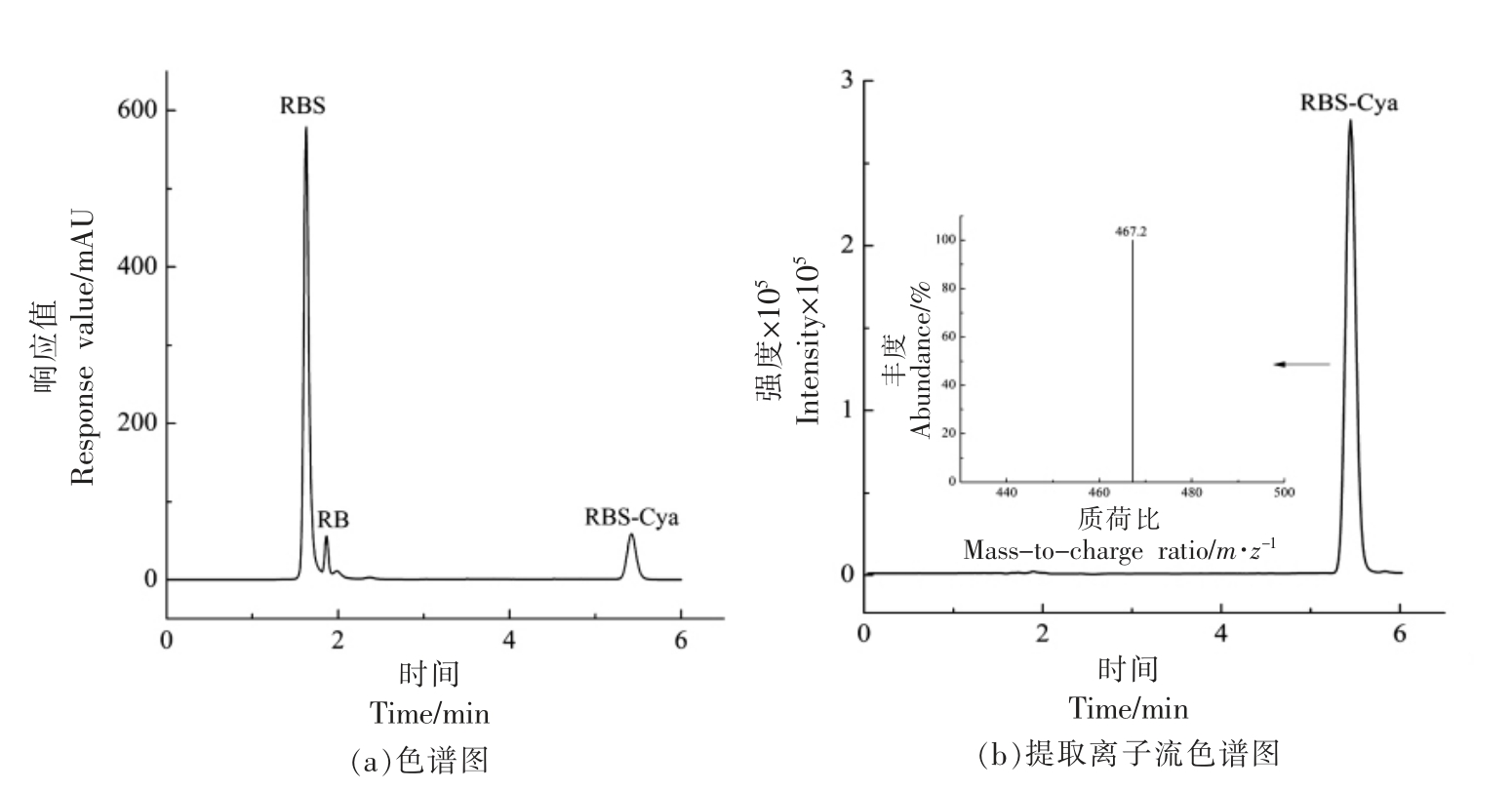
图5 RBS-Cya 的色谱图(a)、提取离子流色谱图(b)及质谱图(b 内插图)
Fig.5 Chromatogram(a),extracted ion chromatogram (b) and mass spectrum (b-inset) of RBS-Cya
2.5 衍生化条件的优化
试验优化的条件有衍生溶剂、衍生剂浓度、衍生温度、衍生时间。考察了不同反应溶剂对衍生化效率的影响,分别选用色谱级的乙腈、色谱级的无水乙醇、色谱级的甲醇作为反应溶剂进行优化[27],当以无水乙醇为反应溶剂时(图6a),峰面积达到最大,反应最为完全,反应效率最高,且无水乙醇毒性较低,价格低廉。此外,研究了衍生试剂RBS浓度为1,2,3,4,5,6,7,8 mmol/L 时的衍生效果,图6b 显示当RBS 浓度为4 mmol/L 时,衍生产物峰面积最大,信号最强,衍生化效果最好。对反应温度进行研究,分别在30,40,50,60,70,80,90 ℃密封避光水浴加热条件下使RBS 和单氰胺避光反应,图6c 表明在60 ℃水浴加热条件下,其反应时间短,转化率高,这与赵华锋等[27]研究的结果一致。60 ℃后反应效率随着温度的升高逐渐变低,这可能是因为在高温水浴条件下,部分水蒸气渗透入反应体系,使得RBS 易水解成RB,同时单氰胺在加热的情况下,很容易水解生成尿素,在较高温度时尿素直接生成二氧化碳和氨[32],使衍生化效率降低。最后,在2 h 内(0,30,60,90,120 min)研究了反应时间对衍生效率的影响(图6d),结果表明反应60 min 时反应效率最大且稳定,这与王旭群等[33]研究的结果一致,60 min 后反应效率随着时间的延长逐渐变低,可能是在长时间的水浴加热条件下,衍生化试剂RBS 的性质有所变化,导致副反应发生。综上,RBS 衍生化单氰胺的优化条件为:溶剂:无水乙醇;衍生试剂浓度:4 mmol/L;温度:60 ℃;时间:60 min。

图6 衍生条件的优化
Fig.6 Optimization of derivative conditions
2.6 质谱条件的优化
将RBS 与一定浓度的单氰胺标准溶液发生衍生化反应,通过质谱测定来进行参数优化[25]。因为衍生产物含有杂环原子,在电喷雾离子源(ESI)正离子模式下扫描可以得到H+形成准分子离子峰[M+H]+[25],所以选择电喷雾离子源(ESI)正离子模式进行测定。先采用全扫描模式进行扫描,选择母离子,再采用SIM 扫描模式,寻找出响应最高的两个碎片离子峰,最后选择定性离子(234.10 m/z和467.20 m/z)和定量离子(466.20 m/z)作为RBS衍生化单氰胺的质谱采集参数。
2.7 方法检出限 (LOD)、线性范围、定量限(LOQ)以及日内和日间精密度
本试验采用线性回归分析方法,横坐标为浓度、纵坐标为定量离子峰面积进行计算。通过加标回收法以最低测定浓度的信噪比S/N=3 来确定检出限,以最低测定浓度的信噪比S/N=10 来确定定量限。通过测定日内和日间精密度(n=3)来考察该方法的重现性和稳定性,对标准样品添加两个的不同浓度,加标浓度为0.1 mmol/L 和0.4 mmol/L,每种添加浓度平行测定3 次,以3 次平行结果的相对标准偏差进行评估分析。如表2所示,本方法在0.005~5 mmol/L 浓度范围内呈良好的线性关系,相关系数为0.9969,该方法的检出限为0.001 mmol/L,定量限为0.0025 mmol/L,日内精密度为1.97%~3.63%,日间精密度为2.21%~4.18%,本方法在灵敏度、重现性和稳定性方面具有明显优势。因此,RBS 柱前衍生结合HPLC-MS 法不仅能用于单氰胺高灵敏的定量检测,还可作为其它氨基化合物的一种分析检测方法,从理论及实践来说,高灵敏分析方法都具有很高的开发价值。
表2 方法线性范围、LOD、相关系数、LOQ、日内和日间精密度(n=3)[34]
Table 2 Linear range,LOD,correlation coefficient,LOQ,intra-day and inter-day precision of the method (n=3)[34]

单氰胺线性范围/mmol·L-1 R2 LOD/mmol·L-1 LOQ/mmol·L-1日内精密度/%日间精密度/%加标浓度0.1 mmol/L加标浓度0.4 mmol/L 0.005~5.000 0.9969 0.001 0.0025 1.97 3.63 2.21 4.18加标浓度0.4 mmol/L加标浓度0.1 mmol/L
2.8 样品精密度(RSD)和加标回收率
本试验采用加标回收对空白样品添加3 个不同的浓度,加标浓度为0.5,1,2 mmol/L,3 个加标浓度都平行测定3 次。该方法的精密度是通过3次平行结果的RSD 来分析的。由表3可知,82.10%~105.21%为葡萄样品的回收率,RSD 为1.63%~3.35%;测得番茄样品的回收率为77.56%~102.17%,RSD 为1.88%~4.04%。说明该方法的准确度和精密度都较好。
表3 葡萄样品和番茄样品3 个加标浓度下单氰胺的平均回收率和RSD(n=3)
Table 3 Average recovery rate and RSD of cyanamide at 3 spiked concentrations for grape samples and tomato samples (n=3)
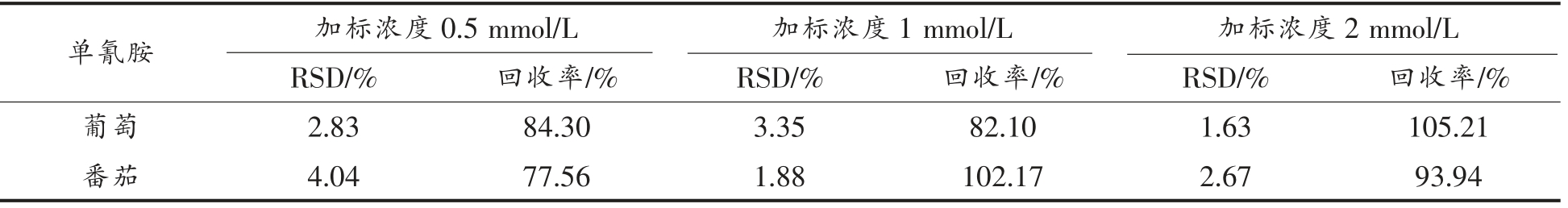
单氰胺 葡萄 加标浓度0.5 mmol/L 加标浓度1 mmol/L 加标浓度2 mmol/L RSD/% 回收率/% RSD/% 回收率/% RSD/% 回收率/%2.83 84.30 3.35 82.10 1.63 105.21番茄 4.04 77.56 1.88 102.17 2.67 93.94
2.9 实际样品中的单氰胺含量
按所研究的方法对雅安市农贸市场的葡萄、番茄中单氰胺残留量进行了测定,葡萄样品中的单氰胺的含量为0.016 mmol/L,番茄样品中的单氰胺含量为0.009 mmol/L。而GB 2763-2019《食品安全国家标准 食品中农药最大残留限量》中规定0.05 mg/kg(临时限量)为葡萄的单氰胺最大残留限量[13],与之相比,本试验测定的葡萄样品单氰胺含量超标。
表4 实际样品中的单氰胺含量
Table 4 The content of cyanamide in actual samples

?样品 单氰胺含量/mmol·L-1葡萄 0.016±0.03番茄 0.009±0.02
3 结论
本研究设计合成了新型琥珀酰亚胺酯类化学衍生试剂RBS,RBS 衍生化单氰胺选择性好,副产物少,衍生化反应较为快速及灵敏。高效液相色谱-质谱检测技术应用广泛,检测范围也较广,还可改善样品的分离度,灵敏度和准确度也得到提高,由此建立了RBS 柱前衍生高效液相色谱-质谱法,用于检测葡萄和番茄中的单氰胺残留量。试验结果表明,该方法具有选择性好、灵敏度高、衍生化时间短、检测限低等优点,可对番茄和葡萄中的单氰胺残留量进行批量检测。建立食品中单氰胺残留量的检测方法,具有不可或缺的意义,同时有着较为广阔的应用前景。
[1]张春涛,张玲,刘维娟,等.基质固相分散-高效液相色谱法检测葡萄和土壤中的单氰胺[C].长沙:第十一届全国色谱学术报告会与仪器展览会,2009:163-164.
ZHANG C T,ZHANG L,LIU W J,et al.Determination of monocyanamide in grape and soil by matrix solid phase dispersion-high performance liquid chromatography[C].Changsha:The 11th National Chromatography Symposium and Instrument Exhibition,2009:163-164.
[2]兰丰,刘传德.柱前衍生-液相色谱-串联质谱法测定葡萄和樱桃中单氰胺残留[J].色谱,2018,36(1):78-82.
LAN F,LIU C D.Determination of cyanamide residue in grapes and cherries by liquid chromatography-tandem mass spectrometry coupled with precolumn derivatization[J].Chinese Journal of Chromatography,2018,36(1):78-82.
[3]PRAMANIK S K,DUTTA S,BHATTACHARYYA A.Studies on the residue of hydrogen cyanamide in grape berries[J].Bulletin of Environmental Contamination and Toxicology,2009,82(5):644-646.
[4]姜蔚,刘传德,段小娜,等.单氰胺残留检测技术研究进展[J].食品工业,2018,39(4):285-287.
JIANG W,LIU C D,DUAN X N,et al.Research progress on analytical technology for cyanamide residues[J].The Food Industry,2018,39(4):285-287.
[5]李红,张薇,杨松,等.UPLC-MS/MS 法测定水体中的单氰胺[J].农药科学与管理,2018,39(12):45-48.
LI H,ZHANG W,YANG S,et al.Determination of cyanamide in water by UPLC-MS/MS[J].Pesticide Science and Administration,2018,39(12):45-48.
[6]杨小青,谢诚,叶琰.采用HILIC 模式超高效液相色谱法分析土壤中的单氰胺[J].广东化工,2020,47(11):209-210.
YANG X Q,XIE C,YE Y.Analysis of the monocyanamide in soil via an ultra high performance liquid chromatography under HILIC mode[J].Guangdong Chemical Industry,2020,47(11):209-210.
[7]NAGUMO Y,TANAKA K,TEWARI K,et al.Rapid quantification of cyanamide by ultra-highpressure liquid chromatography in fertilizer,soil or plant samples [J].Journal of Chromatography A,2009,1216(29):5614-5618.
[8]王敏华,黄玲,黄静,等.农药单氰胺致接触性皮炎12 例临床分析[J].临床皮肤科杂志,2015,44(10):642-643.
WANG M H,HUANG L,HUANG J,et al.Clinical analysis of 12 cases of contact dermatitis caused by pesticide monocyanamide[J].Journal of Clinical Dermatology,2015,44(10):642-643.
[9]刘芳,寇芯,聂萧,等.不同促萌处理对葡萄芽萌发和果实品质的影响[J].分子植物育种,2017,15(1):370-376.
LIU F,KOU X,NIE X,et al.The effect of different treatments of stimulating germination on grapes buds and fruit quality[J].Molecular Plant Breeding,2017,15(1):370-376.
[10]刘鑫铭,许鲁杰,陈婷,等.单氰胺处理对设施葡萄物候期及果实品质的影响[J].西北农业学报,2017,26(12):1838-1844.
LIU X M,XU L J,CHEN T,et al.Effect of cyanamide on phenophase and fruit quality of grape cultivated under greenhouse [J].Acta Agriculturae Boreali-occidentalis Sinica,2017,26(12):1838-1844.
[11]MOHAMED H B,VADEL A M,GEUNS J M C,et al.Effects of hydrogen cyanamide on antioxidant enzymes’ activity,proline and polyamine contents during bud dormancy release in superior seedless grapevine buds [J].Acta Physiologiae Plantarum,2012,34(2):429-437.
[12]SCHEP L,TEMPLE W,BEASLEY M.The adverse effects of hydrogen cyanamide on human health:An evaluation of inquiries to the New Zealand National Poisons Centre[J].Clinical Toxicology,2009,47(1):58-60.
[13]全国文献工作标准化委员会.食品安全国家标准 食品中农药最大残留限量:GB 2763-2019[S].北京:中国标准出版社,2019.
National Committee for Standardization of Documentation Work.National food safety standards,maximum residue limits of pesticides in foods:GB 2763-2019[S].Beijing:Standards Press of China,2019.
[14]占绣萍,陈秀,黄兰淇,等.柱前衍生-液质联用法快速测定葡萄中单氰胺残留[J].农药科学与管理,2020,41(3):42-47.
ZHAN X P,CHEN X,HUANG L Q,et al.Determination of cyanamide residue in grapes by high performance liquid chromatography-tandem mass spectrometry coupled with precolumn derivatization[J].Pesticide Science and Administration,2020,41(3):42-47.
[15]STELLER W A,FREDERICK I B,MORGAN P W.Defoliant residues,determination of cyanamide residues on ginned cottonseed[J].Journal of Agricultural and Food Chemistry,1965,13(4):329-330.
[16]HIRADATE S,KAMO T,NAKAJIMA E,et al.Direct quantitative determination of cyanamide by stable isotope dilution gas chromatography-mass spectrometry[J].Journal of Chromatography A,2005,1098(1/2):138-143.
[17]URBANYI T,WALTER A.IR determination of trace quantities of dicyandiamide and cyanamide in guanidine sulfate[J].Journal of Pharmaceutical Sciences,1971,60(11):1699-1701.
[18]NAIR J B.Determination of trace levels of cyanamide in a novel potassium channel activator bulk drug by pulsed electrochemical detection [J].Journal of Chromatography A,1994,671(1/2):367-374.
[19]TETSUTARO Y,MASAAKI K,KENTARO K.Potentiometric determination of cyanoguanidine and analysis of its unique titration curve[J].Journal of AOAC International,1995,78(6):1339-1345.
[20]李秀瑜,韩康,韩亚楠,等.液相色谱法同时检测胍基乙酸、氨基乙酸和单氰胺[J].分析试验室,2015,34(8):886-890.
LI X Y,HAN K,HAN Y N,et al.Simultaneous determination of guanidineacetic acid,glycine and aminonitrile by high performance liquid chromatography[J].Chinese Journal of Analysis Laboratory,2015,34(8):886-890.
[21]CAI X M,ZHAO H,WU M,et al.Determining hydrogen cyanamide in fruit by derivatization with 6-aminoquinolyl-N-hydroxysuccinimidyl carbamate and HPLC with fluorescence detection [J].Chromatographia,2012,75(17/18):1069-1074.
[22]CHENG C,DI S,ZHANG W,et al.Determination of cyanamide residue in 21 plant-derived foods by liquid chromatography-tandem mass spectrometry[J].Food Chemistry,2018,239:529-534.
[23]REDDY E G S,RAO T N,PRASAD B G.A new validated method for determination of hydrogen cyanamide residues in black grape juice[J].Der Pharmacia Lettre,2015,7(4):240-244.
[24]郁美娟,张海凤,赖奕坚,等.新型罗丹明类荧光标记探针的研究 (Ⅱ)—罗丹明B-N-羟基琥珀酰亚胺酯的合成与标记应用[J].染料与染色,2004,41(5):249-251.
YU M J,ZHANG H F,LAI Y J,et al.A study on novel fluorescent probe containing rhodamine skeleton (Ⅱ)——synthesis of rhodamine B succinimidyl ester and its application as a labeling reagent[J].Dyestuffs and Coloration,2004,41(5):249-251.
[25]彭雪,韩瑞,陈栎颖,等.罗丹明B 酰肼柱前衍生-高效液相色谱-质谱联用法测定蜂蜜中的苯甲醛残留量[J].食品与机械,2018,34(12):38-42,59.
PENG X,HAN R,CHEN L Y,et al.Determination of benzaldehyde residues contents in honey by HPLC-MS using rhodamine B hydrazide as the precolumn derivatization reagent[J].Food&Machinery,2018,34(12):38-42,59.
[26]冯泳兰,蒋伍玖,邝代治,等.3,5-二溴水杨醛罗丹明B 酰肼的合成及其在汞 (Ⅱ) 检测中的应用[J].冶金分析,2016(9):52-56.
FENG Y L,JIANG W J,KUANG D Z,et al.Synthesis of 3,5-dibromosalicylaldehyde rhodamine B hydrazide and its application in determination of mercury (Ⅱ)[J].Metallurgical Analysis,2016(9):52-56.
[27]赵华锋,王瑞莲,周嘉明,等.番茄酱中单氰胺检测衍生化条件的研究[J].中国调味品,2017,42(1):142-143,147.
ZHAO H F,WANG R L,ZHOU J M,et al.Study on derivatization condition of cyanamide detection in tomato sauce[J].China Condiment,2017,42(1):142-143,147.
[28]鲁鹏.四氮杂环双功能螯合剂的合成及在正电子金属核素标记中的应用研究[D].郑州:郑州大学,2013.
LU P.Synthesis of the tetraaza ring bifunctional chelating agent and applied research in the positive ion metal radionuclide[D].Zhengzhou:Zhengzhou University,2013.
[29]张奇,王彬,黎霞,等.基于点击化学反应的免疫荧光检测方法的建立和应用[J].高等学校化学学报,2011,32(2):281-285.
ZHANG Q,WANG B,LI X,et al.Establishment and application of immunofluorescence detection method based on click chemistry[J].Chemical Jour nal of Chinese Universities,2011,32(2):281-285.
[30]鲁苗.叶酸靶向性硅包覆量子点荧光探针的制备及生物应用[D].武汉:华中科技大学,2013.
LU M.Folate receptor-targeted,PEG-modified and silica-coated CdTe quantum dots fluorescent probes for bioimaging applications[D].Wuhan:Huazhong University of Science and Technology,2013.
[31]陈海燕,张辉,顾咸建,等.HILIC-HPLC 法检测氰胺基甲酸甲酯中单氰胺和双氰胺[J].农药,2017,56(8):587-589.
CHEN H Y,ZHANG H,GU X J,et al.Determination of cyanamide and dicyanodiamide in methyl cyanocarbamate by HILIC-HPLC[J].Agrochemicals,2017,56(8):587-589.
[32]李淑琼,汪晓军.单氰胺集装箱冒烟泄露事故分析及防范措施[J].广东化工,2012,39(14):153-154.
LI S Q,WANG X J.The analysis and preventing of cyanamide container leak and smoking accident[J].Guangdong Chemical Industry,2012,39(14):153-154.
[33]王旭群,赵华锋,周嘉明,等.柱前衍生化液相色谱串联质谱法测定葡萄中单氰胺的含量[J].中外食品工业,2014(4):61-62.
WANG X Q,ZHAO H F,ZHOU J M,et al.Determination of cyanamide in grapes by pre-column derivatization liquid chromatography-tandem mass spectrometry[J].Chinese and Foreign Food Industry,2014(4):61-62.
[34]宋占腾,樊霞,肖志明,等.超高效液相色谱-四极杆/静电场轨道阱高分辨率质谱法测定鸡肉中8 种喹噁啉类药物及其代谢产物[J].食品安全质量检测学报,2021,12(8):3023-3033.
SONG Z T,FAN X,XIAO Z M,et al.Determination of 8 kinds of quinoxalines and their metabolites in chicken meat by applying high performance liquid chromatography-quadrupole/lectrostatic field orbit trap high resolution mass spectrometry[J].Journal of Food Safety and Quality,2021,12(8):3023-3033.