藻类是地球生态重要的组成部分,它们为地球贡献50%~87%的氧气[1]。截至到本世纪初,地球上已知的藻类有3 万余种,其中微藻类约占70%。微藻的生长范围极其广泛,遍布热带、温带以及南北两极的寒带地区。自上世纪以来,藻类被认为是应对全球气候变化以及人口增长所带来的食物与蛋白质匮乏的最具潜力的对象[2]。同大型藻类相比,微藻光合效率及生长速率更高,其生产培养方式也更灵活。传统的陆生作物的种植在很大程度上依赖于环境和气候。例如,大豆只能在夏季炎热、平均温度20~30 ℃和生长条件适宜的地区种植。而微藻的生产可以采用工业化生产模式,不受自然环境的限制,可以全年收获。同传统作物相比,微藻生长速率更高,每亩年产量可达15 t 干粉,是粮食作物最高产量的10 倍以上;并且微藻可在没有淡水及气候、土壤等不适宜传统作物生长的环境(如沙漠和海岸)中培植,这有可能会缓解全球粮食与能源匮乏的状况。此外,微藻的固碳能力是陆生植物的4~5 倍,在全球生物圈固碳中占据半壁江山,对助力实现“碳中和”具有巨大的作用。
近年来,微藻巨大的经济与环保价值引起各行业的广泛关注。作为植物性营养素的天然来源,微藻在食品领域的应用也逐步被认可,越来越多的国家、食品企业开始从事微藻的生产研究。其实,微藻的食用历史源远流长。早在1 500年前,我国就有食用微藻的传统,并尝试将其作为中药来治疗疾病。在食物匮乏的年代,微藻更一度成为替代蛋白乃至替代粮食的优先选择[3]。微藻的商业化生产始于上世纪60年代的“小球藻”及70年代的“螺旋藻”培植。目前,世界上应用生物技术进行大量培养或生产的微藻约有200 种,主要包括硅藻(Bacillariophyceae)、绿藻(Chlorophyceae)、金藻(Chrysophyceae)及红藻(Rhodophyta)等真核藻类,以及原核类蓝藻(Cyanophyceae)[1,4]。而在世界范围内,已获得审批具有食品资质的微藻仅是少数,2004年,钝顶螺旋藻(Spirulina platensis)和极大螺旋藻(Spirulina maxima)被批准可作为普通食品食用,开启了中国微藻食品原料的先河。目前在我国共有9 类与微藻相关的食品原料获得审批(表1)。近期,莱茵衣藻(Chlamydomonas reinhardtii)申报新食品原料已通过专家评审委员会的技术审查。在欧美等地区金色奥杜藻(Odontellaaurita)、周氏扁藻(Tetraselmischui)等微藻亦具有作为食品原料的资质[1,5]。
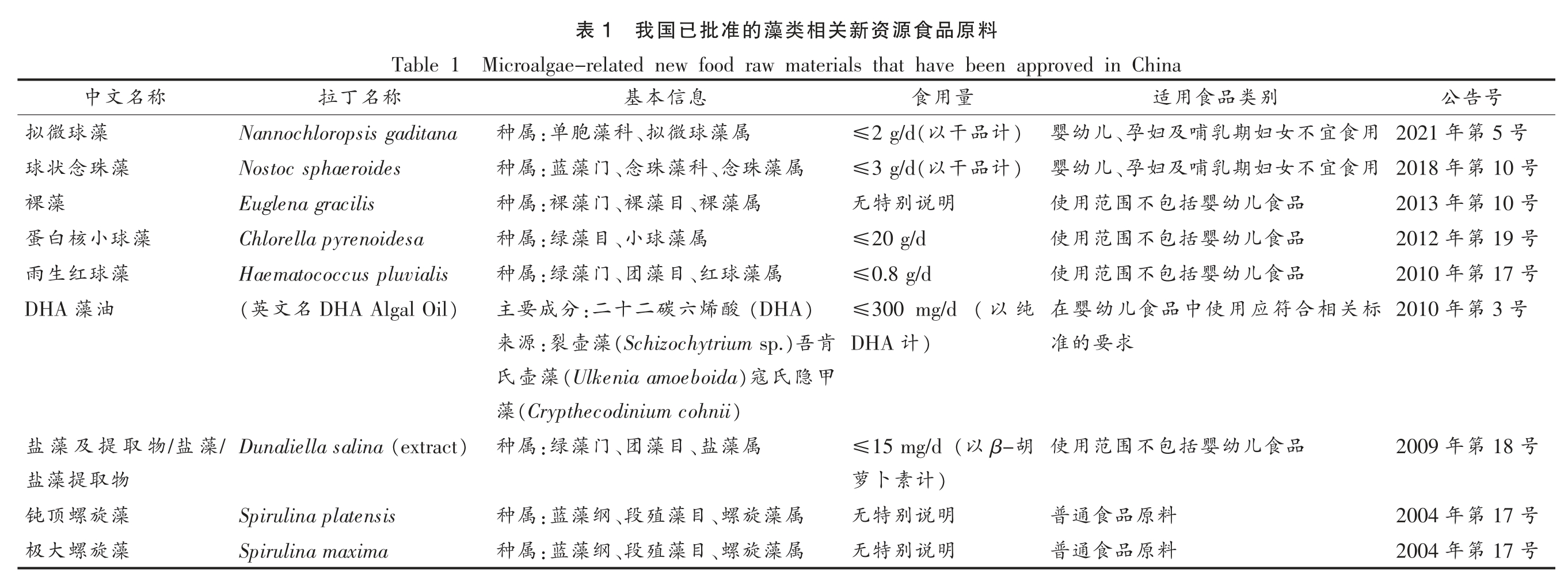
料原品食源资新关相类藻的准批已国我1表Microalgae-related new food raw materials that have been approved in China Table 1 号告公别类品食用适量用食息信本基称名丁拉5 号第用 2021年食宜不女妇期乳哺及妇、孕儿幼婴)计品干2 g/d(以≤属藻球微、拟科藻胞:单属种Nannochloropsis gaditana号10第年用 2018食宜不女妇期乳哺及妇、孕儿幼婴)计品干(以3 g/d≤属藻珠、念科藻珠、念门藻:蓝属种Nostoc sphaeroides号10第年2013品食儿幼婴括包不围范用使明说别特无属藻、裸目藻、裸门藻:裸属种Euglena gracilis号19第年2012品食儿幼婴括包不围范用使20 g/d≤属藻球、小目藻:绿属种Chlorella pyrenoidesa 17 号第2010年品食儿幼婴括包不围范用使0.8 g/d≤属藻球、红目藻、团门藻:绿属种Haematococcus pluvialis号3第年2010标关相合符应用使中品食儿幼婴在纯(以300 mg/d≤)(DHA酸烯六碳二十:二分成要主)DHA Algal Oil名文(英求要的准)计DHA肯)吾(Schizochytrium sp.藻壶:裂源来甲隐氏)寇(Ulkenia amoeboida藻壶氏)(Crypthecodinium cohnii藻号18第年2009品食儿幼婴括包不围范用使胡β-(以15 mg/d≤属藻、盐目藻、团门藻:绿属种)(extract Dunaliella salina/)计素卜萝号17第年2004料原品食通普明说别特无属藻旋、螺目藻殖、段纲藻:蓝属种Spirulina platensis 17 号第2004年料原品食通普明说别特无属藻旋、螺目藻殖、段纲藻:蓝属种Spirulina maxima称名文中藻球微拟藻珠念状球藻裸藻球小核白蛋藻球红生雨油藻DHA藻盐/物取提及藻盐物取提藻盐藻旋螺顶钝藻旋螺大极
微藻是迄今为止所发现的含有营养素最丰富的食物之一。微藻内含有大量的生物活性物质,如蛋白质、脂类、藻多糖、β-胡萝卜素、岩藻黄素与虾青素等[1]。目前,市场上主要将微藻作为膳食补充剂和生物工厂制备各类具有生理活性的物质成分,如DHA 藻油、虾青素等,其产品的应用出口相对较窄。藻油的开发占据微藻食品产业的主要市场。比起油脂含量,通常微藻中含有更多的蛋白质,而微藻蛋白在食品中的应用出口有待进一步开发。本文主要从可作为新资源食品及常见的微藻出发,阐述微藻蛋白的提取方法、营养与加工特性、生理活性及其在医药保健和食品中的应用和研究现状,提出未来发展中可能存在的问题,旨在为新资源食品的研究与开发提供参考。
1 微藻的营养成分
蛋白质是微藻的初级代谢产物,是微藻最主要的物质成分之一。微藻的蛋白质含量一般在40%以上,在微藻干基物质中占比最高。某些微藻(如裂壶藻、小球藻)在特定的生长阶段或生长环境中会累积更多的油脂。通常,微藻的总脂类含量占干物质的1%~70%,多数为直链型含偶数磷原子的甘油酸酯。微藻中的脂类含有丰富的不饱和脂肪酸(如DHA、EPA),多数的淡水型微藻含有大量的α-亚麻酸(ALA),是许多保健品及婴幼儿食品生产的重要原料。微藻中碳水化合物是微藻中另一个主要成分,其含量一般占干物质的10%~20%。藻类的碳水化合物主要以淀粉、纤维素、单糖和多糖的形式存在。纤维素与多糖类物质是微藻细胞壁的主要成分之一,还有一些微藻的叶绿体中存在与淀粉生产与储藏有关的淀粉核。微藻淀粉的消化率较低,可能在糖尿病、肠胃系统疾病及减肥辅助药物的研制中存在巨大的潜力。表2列出了一些常规农作物以及常见的与食品相关的微藻的蛋白、脂肪和碳水化合物的大致含量。同传统的农作物相比,微藻中含有更高的蛋白和脂类物质。不过,微藻中营养成分的含量受微藻生长阶段与培养条件的影响,如蛋白核小球藻在氮源充足的培养条件下,其蛋白质含量可达60%,而在氮源不足的情况下,在生长阶段其细胞内的脂类含量可达86%[4]。一般而言,工业化生产的螺旋藻在适宜的培养条件下,其蛋白质含量可达60%~70%,其色素蛋白(如藻蓝蛋白Phycocyanin)约占总蛋白含量的20%,是优质的蛋白质来源。
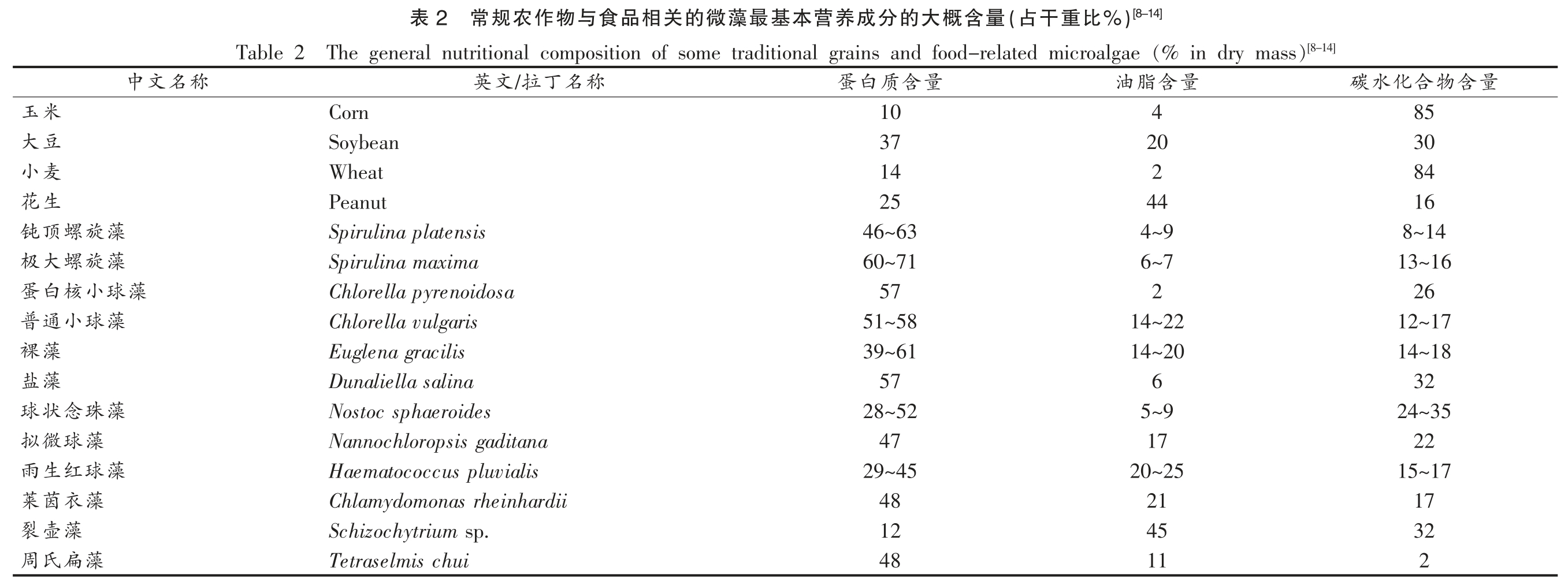
[8-14])%比重干(占量含概大的分成养营本基最藻微的关相品食与物作农规常2表[8-14]The general nutritional composition of some traditional grains and food-related microalgae(% in dry mass)Table 2 量含物合化水碳量含脂油量含质白蛋称名丁拉/文英85 4 10 Corn 30 20 37 Soybean 84 2 14 Wheat 16 44 25 Peanut 8~14 4~9 46~63 Spirulina platensis 13~16 6~7 60~71 Spirulina maxima 26 2 57 Chlorella pyrenoidosa 12~17 14~22 51~58 Chlorella vulgaris 14~18 14~20 39~61 Euglena gracilis 32 6 57 Dunaliella salina 24~35 5~9 28~52 Nostoc sphaeroides 22 17 47 Nannochloropsis gaditana 15~17 20~25 29~45 Haematococcus pluvialis 17 21 48 Chlamydomonas rheinhardii 32 45 12 Schizochytrium sp.2 11 48 Tetraselmis chui称名文中米玉豆大麦小生花藻旋螺顶钝藻旋螺大极藻球小核白蛋藻球小通普藻裸藻盐藻珠念状球藻球微拟藻球红生雨藻衣茵莱藻壶裂藻扁氏周
除了最基本的营养成分(即蛋白、脂肪和碳水化合物)外,微藻细胞中含有十分丰富的与人体生长发育直接相关的维生素与矿物元素。据报道,微藻中维生素含量超过所有其它天然食品,其钾、磷、钙、镁、锌和锰等矿物元素含量超过牛奶中同类元素的含量[6]。此外,微藻中含有许多种天然的可食用色素,主要包括:叶绿素、叶黄素、胡萝卜素和藻胆素,微藻的亲脂色素(如叶绿素、类胡萝卜素)约占微藻干量的5%[7],而雨生红球藻中虾青素含量特别多,可占其干物质重量的10%以上。除上述营养素外,微藻中还含有许多种生物活性成分,如硫氨素、吡多醇、肌醇、叶酸、泛酸钙和烟酸等,可以说微藻是人类迄今为止所发现的含有营养素最丰富的食物之一。
2 微藻的生物质培养与生产策略
微藻的培养方式灵活多样,根据微藻的种类与特性可选择自养、异养或混养的模式来培养获取微藻生物质。其中,光自养是微藻产业中最为常见的养殖方式,微藻通过光合作用,利用光能将无机碳源(如二氧化碳、碳酸盐等)转化成有机物,这是一种经济、环境友好型的养殖方式。由于没有向培养基中添加有机碳源,因此污染风险较小。光自养养殖的微藻细胞密度与生长速率往往较低,导致微藻生产力和能源利用效率不高。异养培植是指利用有机碳源(如葡萄糖、蔗糖等)作为能源,在没有光照的情况下对微藻进行培养。异养培植可在传统的发酵罐中进行,发酵罐的搭建和操作成本相对较低,通常可以产生相当高的生物量密度。据报道,蛋白核小球藻采用异养的培植方式,其生物量密度可以高达100 g/L 以上,比光自养养殖的密度高80 倍[15-16],而且异养培植的实验室产量通常可在工业规模上进行复制。异养培植在大规模培养食用微藻中具有突出的优势,其主要优点是生物量高,生产参数控制准确简单,并且微藻大规模发酵生产可以借鉴传统微生物发酵积累的经验,其生产的技术壁垒相对较低[5]。目前一些生物技术公司(如Solazyme、Roquette Frères)可以成功地异养生产多种商业用途的微藻。混养是通过补充无机碳源和有机碳源,将光自养和异养结合起来的培养模式。有研究表明,微藻在混合营养模式下培养的生物量比单纯的采用光自养或异养方式养殖更高[17]。在混养条件下,微藻有氧呼吸产生的二氧化碳可能会在细胞内直接被光合作用所利用,提高了其生长效率[18]。混养条件下微藻的代谢过程非常复杂,在混养培植过程中,随着微藻细胞密度的逐步升高,光能在细胞间会被逐渐稀释,微藻的光自养水平会逐渐降低。对混养模式而言,维持微藻光合作用和呼吸作用之间的平衡是一个艰难的挑战。
微藻培植的另一个特点是通过调整培养条件刺激特定代谢产物(如蛋白质、碳水化合物或脂质)的积累。微藻中的蛋白质等成分的含量可以根据其应用特点进行调整,这为微藻在食品中的应用提供了更大的灵活性。微藻中的蛋白质产量与培养基中的氮源(如硝酸盐、铵盐、尿素和蛋白胨)的含量、种类与利用程度密切相关。据Guccione等[19]报道,小球藻(Chlorella sp.)的蛋白质含量在富含氮源的培养条件下比缺氮培养高1 倍左右。此外,培养条件(如pH 值、温度)以及磷元素的含量也是影响微藻中蛋白质累积程度的重要因素[20]。针对不同的微藻制定合适的培养方案以累积特定的营养素,一直是微藻研究领域的热点。
3 微藻蛋白及其分离方法
微藻中的蛋白主要是以酶类蛋白为主,分布于微藻细胞的各个部分,即细胞壁、细胞质、细胞器和细胞核中[21]。文献中报道的关于微藻中蛋白质含量的数据,大多数是基于对粗蛋白估计,是通过微藻生物质水解后的总氮含量估算得到的。除蛋白质外,微藻的其它成分,如核酸、葡糖酰胺和细胞壁也含有氮,这会导致高估真实的蛋白质含量。例如,斜生栅藻、螺旋藻和杜氏藻中的非蛋白氮含量大约分别为12%,11.5%和6%[8]。据报道,利用凯氏定氮法与杜马斯燃烧法测定微藻蛋白含量的蛋白质系数分别为5.95 和4.44[22]。
有些微藻具有较厚的细胞壁,为了充分释放微藻细胞中的蛋白,提高蛋白的提取效率,通常需对微藻进行破壁和细胞粉碎处理。目前,常用的细胞粉碎方法有机械处理与非机械处理,机械处理包括研磨、高压、均质、超声处理等手段,非机械处理包括物理手段(如负压、冻融、微波处理等)、化学手段(如裂解液、酸碱处理等)与酶处理。近期Amorim 等[23]综述了微藻细胞的破碎方法及其蛋白的分离鉴定方法,微藻蛋白分离一般包括细胞破碎、蛋白溶解、分离、浓缩、絮凝、纯化等程序。Safi等[24]对比评估了冻融、高压均质、超声、手工研磨和化学处理等各种预处理手段对微藻蛋白质提取的影响。他们采用不同的预处理对质量分数为2%的微藻悬浊液(分别为紫球藻、钝顶节螺旋体、普通小球藻、拟球藻和雨生红球藻)进行破壁处理,然后用2 mol/L、NaOH 将pH 值提高到12,分析上清液中的氨基酸组成、总氮及总蛋白含量,结果发现机械处理能够更有效地破坏微藻的细胞壁和蛋白质聚集,使微藻蛋白更有效地溶出;而高压均质是所有评估方法中提取微藻蛋白的最有效方式,高压均质释放了微藻细胞壁中近一半的蛋白质。不同的细胞破壁技术对微藻蛋白及其它活性成分可能存在不同程度的破坏作用,分离具有特殊功能活性的微藻蛋白或组分,可能对处理技术有特殊的要求。近年来,随着科技的进步以及微藻研究领域的发展,微藻破壁与蛋白分离的技术也在不断革新,超临界提取、离子渗透压震扰、离子液、高压脉冲电场等也被用于微藻破壁处理以及辅助微藻蛋白及其它成分的提取[25-27]。针对不同的藻种特性,结合几种不同的处理技术,选择合适的萃取剂及蛋白沉降方式是提高蛋白分离效率的关键。
4 微藻蛋白的物化特性
蛋白质的溶解性、凝胶性、乳化性、发泡性等物理化学性质不仅在食品生产加工中至关重要,还会影响产品的储藏和消费。通常情况下,蛋白质溶解度与其凝胶化、乳化和起泡性呈正相关[28]。蛋白质凝胶化是食品生产中常用的一种性质,它能将各类食品成分结合在一起,不仅形成固态凝结,还能起到增稠的作用。蛋白的乳化性能是蛋白质食品加工中另一重要的功能性质,通常以蛋白的乳化力(Emulsifying Capacity) 和乳化稳定性(Emulsion Stability)为衡量指标。而发泡性是气体分散在液体或固体材料中的结果,对食品质地、感官能够产生重大影响。
2019年,Grossmann 等[29]综述了有关微藻蛋白的研究,总结出微藻蛋白的乳化、起泡性等物化性质与乳清蛋白和大豆蛋白相当。微藻蛋白比许多其它来源的蛋白质具有更好的溶解性。例如,大豆中主要的贮藏蛋白——豆球蛋白在pH 4.5~6.0时的溶解度低于20%,而小球藻(Chlorella protothecoides) 的蛋白提取物在pH 2~12 范围的溶解度高于84.3%[30-31]。研究表明,在不同条件下,钝顶螺旋藻、扁藻(Tetraselmis suecica) 和小球藻(Chlorella sorokiniana) 的蛋白提取物都能够成功凝胶化[28]。先前,Ursu 等[32]报道了从普通小球藻中获得的蛋白质的乳化力为(3 740±20)mL 油/g 蛋白质,乳化稳定性为(72±1)%,这比一些商业乳化蛋白质,如酪蛋白酸钠(3 250 mL 油/g 蛋白质±40 mL 油/g 蛋白质,62%±1%)和大豆分离蛋白(1 780 油/g 蛋白质±30 mL 油/g 蛋白质,61%±1%)更高。近期,Böcker 等[33]使用界面剪切流变技术评估钝顶螺旋藻的蛋白提取物的乳化潜力。研究发现,螺旋藻的粗蛋白和水溶性蛋白提取物均可以有效乳化,而纯化后的螺旋藻蛋白质可在油-水界面产生更小的乳化液滴和更强的黏弹性网络。在发泡性能方面,微藻的蛋白质提取物可以产生稳定的泡沫,而不同微藻种类之间的蛋白起泡性差异很大。例如,Schwenzfeier等[34]观测到在pH 5~7 的条件下,来自扁藻(Tetraselmis sp.) 的可溶性蛋白比乳清蛋白制备的样品具有更好的泡沫稳定性。钝顶螺旋藻蛋白在pH=10 时的泡沫容量较高(>250%),而其泡沫稳定性非常低[35]。蛋白核小球藻的蛋白质表现出较高的泡沫稳定性(180 min 后为97%),而其泡沫容量(95%)远低于大豆蛋白质(235%)[36]。目前,与传统类作物蛋白相比,微藻蛋白的研究信息相对较少,关于微藻蛋白的物化加工特性的研究报道也比较零散。由于微藻及其蛋白种类的多样性,微藻蛋白理化性质也是丰富多样的,适当地调整其配方与配比,能够满足其在食品生产加工中的广泛应用,微藻蛋白在未来食品工业中的应用具有极大的开发潜力。
5 微藻蛋白的营养特性
蛋白质的营养价值基本上取决于其氨基酸的含量比例和生物利用度。其中必需氨基酸含量是鉴定蛋白质营养品质的重要指标。表3列出几种微藻的必需氨基酸含量,并与一些常规食品和世卫/粮农组织(WHO/FAO)推荐的8 种必需氨基酸模式标准进行比较。除鸡蛋与酪蛋白外,由于几乎所有食品都存在一种或几种必需氨基酸含量不足的情况,因此在饮食或产品配方开发上通常需要几类食物的平衡搭配。同许多常规的食品相比,微藻类的氨基酸含量以WHO/FAO 的参考标准相比是更合理的。普通小球藻中有7 种必需氨基酸的丰富度高于WHO/FAO 的参考值,仅甲硫氨酸和半胱氨酸含量略低。以WHO/FAO 的标准来看,小球藻和钝顶节螺旋体的必需氨基酸指数(EAAI)高于小麦、玉米等作物蛋白,与肉类及大豆相当[23,37]。此外,因不同微藻的必需氨基酸含量差异很大,故平衡多种微藻的营养价值也是一个值得探索的研究领域。
表3 几种微藻的必需氨基酸含量(g/100 g 蛋白)同常规食品与WHO/FAO 推荐标准比较[5,23]
Table 3 Essential amino acid(EAA) profile of different microalgae and conventional protein sources as compared with the WHO/FAO(1973) reference pattern(g/100 g of protein)
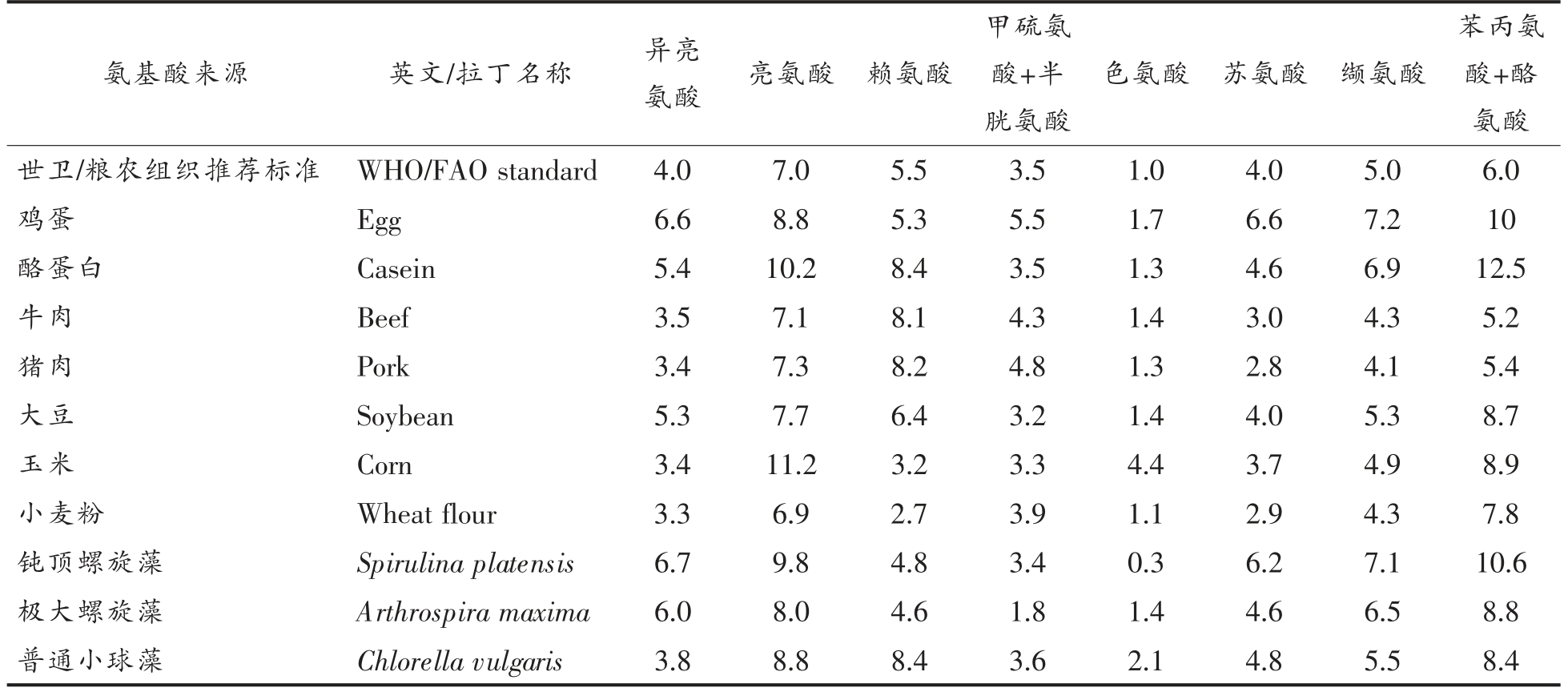
苯丙氨酸+酪氨酸世卫/粮农组织推荐标准 WHO/FAO standard 4.0 7.0 5.5 3.5 1.0 4.0 5.0 6.0鸡蛋 Egg 6.6 8.8 5.3 5.5 1.7 6.6 7.2 10酪蛋白 Casein 5.4 10.2 8.4 3.5 1.3 4.6 6.9 12.5牛肉 Beef 3.5 7.1 8.1 4.3 1.4 3.0 4.3 5.2猪肉 Pork 3.4 7.3 8.2 4.8 1.3 2.8 4.1 5.4大豆 Soybean 5.3 7.7 6.4 3.2 1.4 4.0 5.3 8.7玉米 Corn 3.4 11.2 3.2 3.3 4.4 3.7 4.9 8.9小麦粉 Wheat flour 3.3 6.9 2.7 3.9 1.1 2.9 4.3 7.8钝顶螺旋藻 Spirulina platensis 6.7 9.8 4.8 3.4 0.3 6.2 7.1 10.6极大螺旋藻 Arthrospira maxima 6.0 8.0 4.6 1.8 1.4 4.6 6.5 8.8普通小球藻 Chlorella vulgaris 3.8 8.8 8.4 3.6 2.1 4.8 5.5 8.4氨基酸来源 英文/拉丁名称 异亮氨酸 亮氨酸 赖氨酸甲硫氨酸+半胱氨酸色氨酸 苏氨酸 缬氨酸
另外,植物源蛋白通常含有消化酶抑制剂、凝集素等抗营养因子,限制了人体对蛋白质的吸收。通常会用生物利用度作为一种营养指标来反映蛋白质的质量,评估人体对蛋白质的消化率和吸收率。据报道,小球藻和螺旋藻蛋白的生物值(BV)约为51~82,生物利用度(以蛋白质效率PER、净利用率NPU 及消化系数DC 反映) 约为酪蛋白的80%,总体低于鸡蛋、肉类等动物蛋白,而与大豆蛋白相当,优于小麦蛋白。整体而言,微藻仍是优质的蛋白来源。
6 微藻蛋白及相关成分的生物功能活性
微藻中的蛋白大多数是酶蛋白,此外,还有一些与蛋白相关的物质成分,如蛋白复合物、多肽及多肽类复合物等,通常这些蛋白成分具有独特的生物功能活性。有些活性蛋白对人体有益,具有预防或治疗多种疾病的潜力,可作为细胞毒性和酶抑制剂,具有抗病毒、抗菌、抗肿瘤以及诱导生物调节(如免疫抑制和抗炎性疾病)等作用。这些微藻蛋白成分在食品加工、保鲜、保健品及特殊健康辅助食品等产业中具有重要的开发价值。
6.1 蛋白酶与蛋白酶抑制剂
人类许多疾病(如心血管疾病、癌症、炎症或神经退行性疾病等) 的病因是由自身体内的蛋白酶活性异常所致。蛋白酶和蛋白酶的抑制剂都被用于许多药物的研发与疾病的治疗[38]。蛋白酶参与生物体的许多重要生理反应,是一类蛋白水解酶和信号分子。蛋白酶是全球酶市场上的主要产品(>60%),被广泛应用于食品加工、生物修复、洗涤剂生产和制药等产业。而蛋白酶抑制剂一般是一类小分子多肽类物质,具有蛋白酶底物的类似结构,通过与蛋白酶结合来抑制其活性。微藻可产生多种蛋白酶抑制剂,其中有几类微藻的代谢产物可以对哺乳动物蛋白酶的活性起作用。例如:铜绿菌素(Aeruginosins)是一类直链四肽化合物,最初是从微囊藻中分离得到的,与丝氨酸蛋白酶具有很强的亲和力。丝氨酸蛋白酶是参与血液凝固过程的酶,由其活性紊乱导致的血栓栓塞性疾病是最常见的死亡原因之一。以铜绿菌素为基础合成的化合物可用于治疗和预防血栓形成[39-40]。由泡沫节球藻(Nodularia spumigena) 和鱼腥藻(Anabaena compacta) 产生的一类直链四肽化合物Spumigins,对胰蛋白酶样丝氨酸蛋白酶具有很强的抑制能力[41-42]。此外,微藻内合成的丝氨酸蛋白酶抑制剂大多数是环缩肽类化合物,此类化合物对胰蛋白酶、糜蛋白酶、凝血酶、弹性蛋白酶和纤溶酶等具有抑制作用[43]。从微藻中分离出的微虹膜蛋白(Microviridins)是很强的弹性蛋白酶抑制剂,对治疗和预防肺气肿有一定效果[44]。另外,某些微藻源的脂肽(Lipopeptides) 和微肽素(Microginins)能够抑制各种外肽酶,包括在低微摩尔水平上抑制血管紧张素转换酶(ACE-I)和亮氨酸氨基肽酶(LAP)[45-46],可用于治疗和预防心血管疾病的新药与保健食品研制。
6.2 抗菌活性
目前细菌对抗生素的耐药性在不断增加,全球范围内迫切需要新的抗菌药物。关于海洋浮游植物抗菌特性的首次报道,可以追溯到1959年Sieburth[47]报道的以球形藻(Phaeocytsis sp.)为主的水样抑制细菌生长的研究。从此,从海洋蓝藻、硅藻、绿藻、甲藻、裸藻等微藻中提取的各类粗提物、细胞裂解物、脂肪酸、萜类、酚类、甾醇、肽、生物碱和色素等被证实具有抑菌和杀菌活性[48]。以微藻为平台,表达生产的抗菌肽及内溶素(endolysins) 对许多种革兰氏阴性菌具有抑制作用。例如,Stoffels[49]采用莱茵衣藻(Chlamydomonas reinhardtii)和聚囊藻(Synechocystis sp.)为生物反应器,表达生产了具有人类病原体肺炎链球菌和金黄色葡萄球菌特异性的内溶素。由于对抗菌肽和内溶素产生耐药性的情况很少见,因此内溶素有望作为新型抗生素应用于食品及药品中。从微藻中获得新的抗菌化合物是被公认的新蓝海。
6.3 抗氧化、抗炎与抗癌活性
微藻等微生物细胞缺乏外部防御机制,其自身会采取化学防御策略,通过产生一些次级代谢产物来应对环境压力的变化。某些次级代谢产生的化合物的功能活性可能就是为了增加其细胞生存机会或使其在特殊条件下保持一定的生长速度[48]。细胞癌变在一定程度上被视为是对环境压力的反应,因此微藻中参与防御机制的生物活性化合物引起许多研究者的兴趣。目前,微藻中许多化合物(包括蛋白类化合物)被证实具有抗氧化、抗炎以及抑制癌细胞生长、转移的能力。据报道,藻蓝蛋白能够清理超氧化物和氢过氧化物等自由基,在抗氧化应激、抗疲劳或抗失眠中具有很好的作用。此外,藻蓝蛋白还可以提高淋巴细胞活性,能够调节人体免疫系统,提高人体对疾病的抵抗力[50]。Baudelet 等[51]研究发现从蓝藻中分离的C-藻蓝蛋白和别藻蓝蛋白的8 个组分中,有两种组分能抑制90%以上的黑色素瘤细胞生长,其中一种组分能有效抑制恶性黑色素瘤、乳腺癌和肺腺癌3 种癌细胞生长。这类微藻特有的捕光色素蛋白既可以作为天然色素用于食品等工业,也可制成荧光试剂,用于临床医学诊断和免疫化学及生物工程等研究领域,在食品和医疗保健上具有很高的开发、利用价值。
7 微藻蛋白的食用安全性与过敏成分
食品原料的安全性是食品加工最重要的考量因素。在宣布一种新型食品,尤其是非常规的蛋白食品是安全可食用之前,必须经过一系列详细而严格的毒理学测试。目前,普遍认为钝顶螺旋藻(Spirulina platensis)、蛋白核小球藻(Chlorella pyrenoidesa)、普通小球藻(Chlorella vulgaris)、杜氏盐藻(Dunaliella Salina)、裸藻(Euglena gracilis)、雨生红球藻(Haematococcus pluvialis)、莱茵衣藻(Chlamydomonas reinhardtii)、周氏扁藻(Tetraselmis chui)的干燥生物质是通株可食的[1,6]。据目前可查信息,所有的动物短期或长期喂养试验以及急性或慢性毒性研究,包括人体研究,均未发现食用这些藻类产生负面影响的证据。
随着时间的推移,越来越多微藻种属被发现,许多微藻具有作为食品配料的巨大潜力。微藻中常见的食品安全问题,如生物和化学污染,可以通过加强管控栽培环境来缓解、控制。更大潜在的安全风险可能是一些微藻物种会产生毒素(如甲藻、硅藻和蓝藻)[52],因此,在应用到食品之前,需要仔细研究其生物毒性。
对食品工业生产而言,过敏性是需要考虑的另一个重要因素。牛奶、花生、大豆和小麦是最常见的一些食物过敏原,与之不同的是,微藻蛋白的过敏反应具有物种特异性。据报道,有些人服用螺旋藻(A.platensis)片会产生过敏反应,而对小球藻(C.protothecoides)源蛋白质过敏的人群很少或没有[53-54]。值得注意的是,大多数对螺旋藻片剂过敏的患者也容易对广泛的过敏原产生过敏反应。目前,关于微藻潜在致敏性的研究数据仍非常有限,根据现有研究数据来看,微藻蛋白不是强致敏原。
8 微藻蛋白在食品中应用的发展潜力与挑战
自上世纪以来,因人口增长与粮食危机加剧,故人类在不断寻找新的食物来源。微生物因蛋白含量高,生长繁殖快的特点而日益为人们所重视。作为单细胞蛋白(Single Cell Protein,SCP)的重要来源之一,微藻所含的核黄素、吡多醇、叶酸、烟酸、肌醇和多种维生素等增加了其营养价值,而且同其它SCP 来源(如细菌和酵母)相比,微藻核酸含量较低[7]。目前,微藻及其提取物主要以粉末、片剂、胶囊等形式被作为膳食补充剂应用于保健食品领域。从螺旋藻等微藻中提取的藻蓝蛋白在保健食品及医药等领域具有重要的应用价值。作为天然的食用色素,藻蓝蛋白如今广泛应用于饮料等食品领域[55]。目前国内已有生产藻蓝色素的上游厂商。随着藻蓝蛋白稳定性与加工技术的改善,以及原料成本的控制,藻蓝蛋白的食品应用市场有望进一步扩大。
近年来,微藻及其粗蛋白在传统食物领域的应用也显示出良好的发展势头。目前,市场上有将螺旋藻和小球藻藻粉应用于面包、面条、零食、调味品及饮料等领域,以改善其产品的营养价值、颜色和质地的稳定性[54-57]。例如,添加螺旋藻藻粉(其粗蛋白含量可达70%以上) 的乌冬面或意大利面等产品,具有较高的蛋白和维生素含量,其口感、韧性及色泽也更受消费者喜爱。不过螺旋藻等微藻的色素问题,也给其蛋白在食品领域的应用带来一些限制。据报道,在混养和异养模式下培养的微藻叶绿素的积累较少[58]。最近的研究表明,异养小球藻等微藻蛋白提取物具有良好的感官特性,这是可将其广泛应用到食品的先决条件[59]。此外,通常植物蛋白的技术加工性比较差,如豌豆、土豆或大米蛋白,在低pH 值下蛋白质分散性差、口感不好,阻碍了它们在配方饮料中的使用,而微藻蛋白在较宽的pH 值范围内具有高发泡、乳化和稳定能力[30-31],可以很好地弥补此类空白。
近期的研究表明,微藻及其蛋白在肉制品和植物肉领域中也具有很好的开发应用潜力[60-61]。近年来,植物肉相关领域的研究受到越来越多的关注。植物肉产业的发展对于缓解因人口增长带来的动物蛋白短缺,减少环境污染等具有重要意义。同传统肉类蛋白相比,植物基蛋白具有低脂肪、高纤维、无胆固醇等特点,更符合当前人们对健康食品的要求。而传统的作物蛋白的生产依赖于耕地,且同动物蛋白的风味、理化性质差异较大,存在营养与生物利用率偏低、致敏率较高等问题,制约了植物肉产业的发展。微藻蛋白富含各类人体必需氨基酸,且生物利用率高、致敏性低,是良好的可持续性未来食品蛋白质来源,其独特的鲜味多肽与风味物质,在替代肉产品及海产品中具有巨大的开发潜力。
目前,微藻蛋白在食品中的应用还处在探索与发展阶段。在我国,大规模工业化生产的微藻主要是螺旋藻与小球藻,螺旋藻约占整个微藻类市场的三分之二。这两种藻的生产对生产设备与技术要求相对较低,其养殖方式主要以传统的开放式的跑道池系统为主。该类系统易于构建和操作,可扩展性高,生产成本低,然而容易受到生物和化学污染。不过,螺旋藻是一种嗜碱性蓝藻,培养基中的过高pH 值不适合大部分生物污染物的生长;而小球藻主要是依靠快速的生长速度战胜潜在的污染物。现阶段制约微藻蛋白在食品领域中应用的关键主要还是技术与成本的问题。微藻的培植与传统的作物种植方式有着很大的不同,现阶段成熟而系统的作物种植与收割技术无法整套转用于微藻的培植。较传统的农作物种植,微藻的生产成本偏高。
为了扩大微藻产业规模,需要解决生物量生产的能效问题。目前,微藻的工业生产主要在开放式的跑道池或封闭的管道中进行,污染的防治与低密度的生物量增加了微藻的生产与收获成本。而微藻高密度异养发酵是解决目前产业难题的关键,其生产效率高于光合培养,不受天气、土地和污染问题的限制。此外,微藻的破壁与蛋白回收效率较低,蛋白纯化工艺复杂,普遍存在的腥味与色素问题也是限制微藻蛋白在食品领域应用的关键。工业上为降低成本达到效益最大化,可以采用原料分流提取,以充分回收利用微藻的不同生物组分。例如,提取完藻油剩余的组分可用来提取微藻蛋白与多糖,最后剩余的残渣也可以用作饲料、堆肥等原料。开展绿色、高效、经济、环保的微藻培植与蛋白等组分分离技术的研究,仍是当下微藻研究领域的热点。
9 结语
微藻作为新资源食品具有丰富的蛋白质、藻多糖、脂质和类胡萝卜素等活性物质。通常而言,微藻的蛋白质含量比传统的农作物都高,而且微藻蛋白的氨基酸组成齐全,含有人体必需的8 种氨基酸,消化利用率相对较高。微藻及其蛋白质种类丰富多样,是潜力巨大的生物与未来食品资源宝库。微藻蛋白良好的物化加工特性,可以满足在未来食品加工生产中的多种应用。某些微藻蛋白类物质还具有特定的生物活性,如抗菌、抗癌活性,在功能食品及医疗保健品中具有巨大的开发价值。然而,目前国内外对微藻蛋白的生产与开发利用的研究仍十分有限,微藻在大规模生产与高品质蛋白分离技术方面还有着很大的进步空间。微藻粗蛋白在未来食品中的应用出口,有待进一步扩大。随着更多自动化、环保、高效、低能耗的技术应用,微藻蛋白正在逐步走向普通食品市场,走向老百姓的餐桌。
[1]ENZING C,PLOEG M,BARBOSA M,et al.Microalgae-based products for the food and feed sector:an outlook for Europe.Scientific and Policy Reports[M].Spain:Joint Research Centre,2014.
[2]ULLMANN J,GRIMM D.Algae and their potential for a future bioeconomy,landless food production,and the socio-economic impact of an algae industry[J].Organic Agriculture,2021,11(2):261-267.
[3]高风正,葛保胜,向文洲,等.生物技术研究引领中国微藻产业发展的六十年:回顾与展望[J].中国科学:生命科学,2021,51(1):26-39.
GAO F Z,GE B S,XIANG W Z,et al.Development of microalgal industries in the past 60 years due to biotechnological research in China:a review(in Chinese)[J].Sci Sin Vitae,2021,51(1):26-39.
[4]陈峰,姜悦.微藻生物技术[M].北京:中国轻工业出版社,1999:56.
CHEN F,JIANG Y.Microalgae biotechnology[M].Beijing:China Light Industry Press,1999:56.
[5]FU Y,CHEN T,CHEN S H Y,et al.The potentials and challenges of using microalgae as an in gredient to produce meat analogues[J].Trends in Food Science & Technology,2021,112:188-200.
[6]张继红,任丹丹,姜玉声,等.微藻营养价值及其在水产生物营养强化中的应用[J].食品工业科技,2016,37(20):371-376.
ZHANG J H,REN D D,JIANG Y S,et al.Microalgae in aquaculture:a review to nutritional value and rotifers enrichment[J].Science and Technology of Food Industry,2016,37(20):371-376.
[7]曹健,漆丹华,高孔荣.微藻的营养价值及生产和应用开发[J].粮食与饲料工业,1997(5):28-31.
CAO J,QI D H,GAO K R.Nutritive value,production,application and development of microalgae[J].Cereal & Feed Industry,1997(5):28-31.
[8]BECKER E W.Micro-algae as a source of protein[J].Biotechnology Advances,2007,25(2):207-210.
[9]邓中洋,阎春兰,胡强,等.葛仙米研究进展[J].水生生物学报,2008,32(3):393-399.
DENG Z Y,YAN C L,HU Q,et al.The research advance of Nostoc sphaeroides[J].Acta Hydrobiologica Sinica,2008,32(3):393-399.
[10]OSLAN S,TAN J S,OSLAN S N,et al.Haematococcus pluvialis as a potential source of astaxanthin with diverse applications in industrial sectors:Current research and future directions[J].Molecules(Basel,Switzerland),2021,26(21):6470.
[11]HADLEY K B,BAUER J,MILGRAM N W.The oil-rich alga Schizochytrium sp.as a dietary source of docosahexaenoic acid improves shape discrimination learning associated with visual processing in a canine model of senescence[J].Prostaglandins Leukotrienes & Essential Fatty Acids,2017,118:10-18.
[12]NUNES M C,FERNANDES I,VASCO I,et al.Tetraselmis chuii as a sustainable and healthy ingredient to produce gluten -free bread:Impact on structure,colour and bioactivity[J].Foods,2020,9(5):579.
[13]ZANELLA L,VIANELLO F.Microalgae of the genus Nannochloropsis:Chemical composition and functional implications for human nutrition[J].Journal of Functional Foods,2020,68:103919.
[14]LI D,XING W,LI G,et al.Cytochemical changes in the developmental process of Nostoc sphaeroides(cyanobacterium)[J].Journal of Applied Phycology,2009,21(1):119-125.
[15]WU Z,SHI X.Optimization for high-density cultivation of heterotrophic Chlorella based on a hybrid neural network model[J].Letters in Applied Microbiology,2010,44(1):13-18.
[16]HAN F,HUANG J,LI Y,et al.Enhanced lipid productivity of Chlorella pyrenoidosa through the culture strategy of semi-continuous cultivation with nitrogen limitation and pH control by CO2[J].Bioresource Technology,2013,136:418-424.
[17]ZHANG Z,SUN D,WU T,et al.The synergistic energy and carbon metabolism under mixotrophic cultivation reveals the coordination between photosynthesis and aerobic respiration in Chlorella zofingiensis[J].Algal Research,2017,25:109-116.
[18]WANG J,YANG H,WANG F,et al.Mixotrophic cultivation of microalgae for biodiesel production:Status and prospects [J].Applied Biochemistry &Biotechnology,2014,172(7):3307-3329.
[19]GUCCIONE A,BIONDI N,SAMPIETRO G,et al.Chlorella for protein and biofuels:from strain selection to outdoor cultivation in a Green Wall Panel photobioreactor[J].Biotechnology for Biofuels,2014,7(1):84.
[20]MARKOU G.Alteration of the biomass composition of Arthrospira(Spirulina) platensis under various amounts of limited phosphorus[J].Bioresour Technol,2012,116:533-535.
[21]SAFI C,FRANCES C,URSU A V,et al.Understanding the effect of cell disruption methods on the diffusion of Chlorella vulgaris proteins and pigments in the aqueous phase[J].Algal Research,2015,8:61-68.
[22]LÓPEZ C V G,GARCÍA M D C C,FERNÁNDEZ F G A,et al.Protein measurements of microalgal and cyanobacterial biomass[J].Bioresource Technology,2010,101(19):7587-7591.
[23]AMORIM M L,SOARES J,COIMBRA J S D R,et al.Microalgae proteins:Production,separation,isolation,quantification,and application in food and feed[J].Critical Reviews in Food Science and Nutrition,2021,61(12):1976-2002.
[24]SAFI C,CHARTON M,URSU A V,et al.Release of hydro-soluble microalgal proteins using mechanical and chemical treatments [J].Algal Research,2014,3(1):55-60.
[25]CARULLO D,ABERA B D,CASAZZA A A,et al.Effect of pulsed electric fields and high pressure homogenization on the aqueous extraction of intracellular compounds from the microalgae Chlorella vulgaris[J].Algal Research,2018,31:60-69.
[26]LIU Z W,YUE Z,ZENG X A,et al.Ionic liquid as an effective solvent for cell wall deconstructing through astaxanthin extraction from Haematococcus pluvialis[J].International Journal of Food Science &Technology,2019,54(2):583-590.
[27]LEE S Y,CHO J M,CHANG Y K,et al.Cell disruption and lipid extraction for microalgal biorefineries:A review[J].Bioresource Technology,2017,244:1317-1328.
[28]KINSELLA J E.Functional properties of soy proteins[J].Journal of the American Oil Chemists' Society,1979,56:242-258.
[29]GROSSMANN L,HINRICHS J,WEISS J.Cultivation and downstream processing of microalgae and cyanobacteria to generate protein-based technofunctional food ingredients[J].Critical Reviews in Food Science & Nutrition,2020,60(17):2961-2989.
[30]GROSSMANN L,HINRICHS J,WEISS J.Solubility and aggregation behavior of protein fractions from the heterotrophically cultivated microalga Chlorella protothecoides[J].Food Research International,2018,116:283-290.
[31]LAKEMOND C,JONGH H D,HESSING M,et al.Soy glycinin:influence of pH and ionic strength on solubility and molecular structure at ambient temperatures[J].J Agric Food Chem,2000,48(6):1985-1990.
[32]URSU A V,MARCATI A,SAYD T,et al.Extraction,fractionation and functional properties of pro teins from the microalgae Chlorella vulgaris[J].Bioresource Technology,2014,157:134-139.
[33]BÖCKER L,BERTSCH P,WENNER D,et al.Effect of Arthrospira platensis microalgae protein purification on emulsification mechanism and efficiency[J].Journal of Colloid and Interface Science,2021,584:344-353.
[34]SCHWENZFEIER A,LECH F,WIERENGA P A,et al.Foam properties of algae soluble protein isolate:Effect of pH and ionic strength[J].Food Hydrocolloids,2013,33(1):111-117.
[35]BENELHADJ S,GHARSALLAOUI A,DEGRAEVE P,et al.Effect of pH on the functional properties of Arthrospira(Spirulina) platensis protein isolate[J].Food Chemistry,2016,194:1056-1063.
[36]WAGHMARE A G,SALVE M K,LEBLANC J G,et al.Concentration and characterization of microalgae proteins from Chlorella pyrenoidosa [J].Bioresources and Bioprocessing,2016,3(1):16.
[37]KENT M,WELLADSEN H M,MANGOTT A,et al.Nutritional evaluation of Australian microalgae as potential human health supplements[J].Plos One,2015,10(2):e0118985.
[38]DRAG M,SALVESEN G S.Emerging principles in protease-based drug discovery[J].Nature Reviews Drug Discovery,2010,9(9):690-701.
[39]WANG G,GOYAL N,HOPKINSON B.Preparation of L-proline based aeruginosin 298-A analogs:optimization of the P1-moiety[J].Bioorganic & Medicinal Chemistry Letters,2009,19(14):3798-3803.
[40]ERSMARK K,DEL VALLE J,HANESSIAN S.Chemistry and biology of the aeruginosin family of serine protease inhibitors[J].Angewandte Chemie International Edition,2010,47(7):1202-1223.
[41]MAZUR -MARZEC H,KACZKOWSKA M,BLASZCZYK A,et al.Diversity of peptides produced by Nodularia spumigena from various geographical regions[J].Marine Drugs,2013,11(1):1-19.
[42]ANAS A R,KISINGI T,UMEZAWA T,et al.Thrombin inhibitors from the fresh water cyanobacterium Anabaena compacta[J].J Nat Prod,2012,75(9):1546-1552.
[43]NAMIKOSHI M,RINEHART K L.Bioactive compounds produced by cyanobacteria[J].Journal of Industrial Microbiology,1996,17(5):373-384.
[44]MURAKAMI M,QI S,ISHIDA K,et al.Microviridins,elastase inhibitors from the cyanobacterium Nostoc minutum(NIES-26)[J].Phytochemistry,1997,45(6):1197-1202.
[45]KRAFT M,SCHLEBERGER C,WECKESSER J,et al.Binding structure of the leucine aminopeptidase inhibitor microginin FR1[J].FEBS Letters,2007,580(30):6943-6947.
[46]BAGCHI S N,SONDHIA S,AGRAWAL M K,et al.An angiotensin -converting enzyme -inhibitory metabolite with partial structure of microginin in a cyanobacterium Anabaena fertilissima CCC597,producing fibrinolytic protease[J].Journal of Applied Phycology,2015,28(1):177-180.
[47]SIEBURTH J M.Antibacterial activity of antarctic marine phytoplankton1[J].Limnology & Oceanography,1959,4(4):419-424.
[48]HAYES M,SKOMEDAL H,SKJÅNES K,et al.Microalgal proteins for feed,food and health[M]//Microalgae -based biofuels and bioproducts.UK:Woodhead Publishing,2017:347-368.
[49]STOFFELS L.Microalgae as a novel production platform for antibacterial proteins[D].London:University College London,2015.
[50]ABD EL-BAKY H H,EL-BAROTY G S.Characterization and bioactivity of phycocyanin isolated from Spirulina maxima grown under salt stress[J].Food & Function,2012,3(4):381-388.
[51]BAUDELET P,GAGEZ A,BÉRARD J,et al.Antiproliferative activity of Cyanophora paradoxa pigments in melanoma,breast and lung cancer cells[J].Marine Drugs,2013,11(11):4390-4406.
[52]SANTI DELIA A,CARUSO G,MELCARNE L,et al.Biological toxins from marine and freshwater microalgae [M]//Microbial toxins and related contamination in the food industry.Switzerland:Springer,Cham,2015:13-55.
[53]LE T M,KNULST A C,RÖCKMANN H.Anaphylaxis to Spirulina confirmed by skin prick test with ingredients of Spirulina tablets[J].Food and Chemical Toxicology,2014,74:309-310.
[54]SZABO N J,MATULKA R A,CHAN T.Safety evaluation of Whole Algalin Protein(WAP) from Chlorella protothecoides [J].Food & Chemical Toxi cology,2013,59:34-45.
[55]冯玉杰.螺旋藻中藻蓝蛋白的提取与纯化[D].南昌:南昌大学,2019.
FENG Y J.Extraction and purification of phycocyanins from Spirulina[D].Nanchang:Nanchang University,2019.
[56]URIBE -WANDURRAGA Z N,IGUAL M,P GARCÍA-SEGOVIA,et al.Effect of microalgae addition on mineral content,colour and mechanical properties of breadsticks[J].Food & Function,2019,10(8):4685-4692.
[57]FRADINHO P,NICCOLAI A,SOARES R,et al.Effect of Arthrospira platensis(spirulina) incorporation on the rheological and bioactive properties of gluten-free fresh pasta[J].Algal Research,2020,45:101743.
[58]CAPORGNO M P,HABERKORN I,BCKER L,et al.Cultivation of Chlorella protothecoides under different growth modes and its utilisation in oil/water emulsions[J].Bioresource Technology,2019,288:121476.
[59]GROSSMANN L,V WRNER,HINRICHS J,et al.Sensory properties of aqueous dispersions of protein-rich extracts from Chlorella protothecoides at neutral and acidic pH[J].Journal of the Science of Food and Agriculture,2020,100(3):1344-1349.
[60]ŽUGCˇIC,TIHANA,ABDELKEBIR R,et al.Effects of pulses and microalgal proteins on quality traits of beef patties[J].Journal of Food Science and Technology,2018,55(11):4544-4553.
[61]PALANISAMY M,S TÖPFL,BERGER R G,et al.Physico-chemical and nutritional properties of meat analogues based on Spirulina/lupin protein mixtures[J].European Food Research and Technology,2019,245(9):1889-1898.