乳酸菌是一类在自然界中广泛存在的革兰氏阳性菌,能够在生物氧化的过程中获得能量并生长繁殖。植物乳杆菌(Lactobacillus plantarum)属于乳杆菌科中的乳杆菌属,最适生长温度在30~35 ℃,最适pH 值为6.5 左右,是一类兼性异养,兼性厌氧的同型发酵乳酸菌[1]。植物乳杆菌作为安全的食品发酵剂,在改善食品风味和发酵特性等方面被广泛应用[2]。其在葡萄酒酿造业中也发挥着重要作用。植物乳杆菌是葡萄酒进行苹果酸乳酸发酵常见的乳酸菌之一[3],可在葡萄酒高酒精、低、高温等苛刻条件下生长[4],并且其产生的β-葡萄糖苷酶对葡萄酒的风味有着非常重要的影响[5],对于葡萄酒的增香具有广阔的应用前景[6]。
β-葡萄糖苷酶(β-Glucosidase,EC3.2.1.21),是一种能够水解糖苷键,从而产生挥发性香气物质和葡萄糖的糖苷水解酶(glycohydrolase enzyme,GH enzyme)[7],又称β-D-葡萄糖苷葡萄糖水解酶,它能水解结合于非还原性末端的β-D-葡萄糖苷键,同时释放出β-D 葡萄糖和相应的配基,是纤维素分解酶系中的重要组成成分[8]。另外,还有一类6-磷酸-β-葡萄糖苷酶(6-phospho-β-glucosidase,EC 3.2.1.86)[9]在微生物中基本以胞内酶的形式存在,可催化6-磷酸-纤维二糖、6-磷酸-纤维素寡糖等6-磷酸-β-葡萄糖苷类化合物产生葡萄糖-6-磷酸,使纤维素得以分解[10-11]。
6-磷酸-β-葡萄糖苷酶有两类,分别分布于GH1 和GH4 中。GH1 家族作用残基多为两个谷氨酸残基,靠近N 端的谷氨酸起酸/碱作用,另一谷氨酸起亲核试剂的作用[12]。这两类酶的主要区别是GH4 的6-磷酸-β-葡萄糖苷酶催化底物分解时需要金属离子(Mn2+,Ni2+,Co2+或Fe2+)和NAD+的辅助,而GH1 的6-磷酸-β-葡萄糖苷酶则可独立完成催化作用[11,13]。目前关于β-葡萄糖苷酶的研究很多,而有关6-磷酸-β-葡萄糖苷酶的报道很少,鲜见有关植物乳杆菌来源的6-磷酸-β-葡萄糖苷酶,原因之一可能是其在异源表达时容易形成包涵体或需要磷酸化底物[14]。牛瑜[15]、尹捷等[16]和刘晴等[17]以pNPβG6P(p-Nitrophenyl-β-D-Glucuronide-6-phospho,对硝基苯基-β-D-吡喃葡萄糖苷-6-磷酸)为底物,测定6-磷酸-β-葡萄糖苷酶酶活。
根据NCBI 数据库中的比对信息得到植物乳杆菌WU14 中有8 个6-磷酸-β-葡萄糖苷酶基因。本研究 对8 个基 因BglAW14、BglBW14、BglCW14、BglDW14、BglEW14、BglFW14、BglGW14和BglHW14 进行基因克隆和异源表达,并对其对应的编码蛋白进行生物信息学分析。
1 材料与方法
1.1 菌株和质粒
植物乳杆菌(L.plantarum)WU14 筛自腌菜,大肠杆菌(Escherichia coli) DH5α 克隆菌株、E.coli BL21(DE3)表达菌株购自博迈德生物公司,表达载体pET30a(+)为本实验室保存。
1.2 工具酶和试剂
限制性内切酶Hind III、Nde I,Thermo Scientific 公司;Exnase Ⅱ连接酶,Vazyme 公司;KOD Plus Neo 高保真酶,株式会社东洋纺公司;DNA 凝胶回收试剂盒、质粒小提试剂盒和清洁回收试剂盒,康宁生命科学有限公司;细菌基因组DNA 提取试剂盒,Solarbio 公司;普通琼脂糖凝胶DNA 回收试剂盒,TIANGEN 公司;镍柱填料,QIAGEN 公司;TGA Stain-Free Fast Cast Acrylamide Kit 12%,BIO-RAD 公司;其它试剂均为国产分析纯,购自北京化学试剂公司。
1.3 试验仪器
DK-8D 三孔电热恒温水槽,上海齐欣科学仪器有限公司;PCR 仪,Bio-rad 公司;紫外分光光度计,菲勒仪器有限公司;超声波细胞破碎仪,贝普斯科技有限公司;台式高速离心机,湖南赫西仪器装备有限公司;pH 计,METTLER TOLEDO 公司;电子天平,上海天美天平仪器有限公司;胶片观察灯,北京六一仪器厂;电泳仪,北京东方瑞利电泳设备有限公司;磁力搅拌器,Kylin-bell 实验仪器公司;恒温振荡培养箱,上海旻泉仪器有限公司;脱色摇床,Kylin-bell 实验仪器公司;洁净工作台,北京东联哈尔仪器制造有限公司。
1.4 培养基和相关溶液
1)LB 培养基 5 g/L 酵母提取物,10 g/L 胰蛋白胨,10 g/L NaCl,(固体培养基含20 g/L 琼脂),121 ℃灭菌20 min。
2)MRS 液体培养基 蛋白胨10.0 g,牛肉膏10.0 g,酵母膏5.0 g,K2HPO4 2.0 g,柠檬酸铵2.0 g,无水乙酸钠5.0 g,葡萄糖20.0 g,吐温-80 1.0 mL,MgSO4·7H2O 0.50 g,MnSO4·2H2O 0.25 g,调节pH 值为7.0,加入蒸馏水补至1 L。
3)10×SDS-PAGE 缓冲液 188 g 甘氨酸,10 g SDS,30.3 g Tris 碱,蒸馏水900 mL 25 ℃水浴搅拌溶解,定容至1 L,室温保存备用。
4)考马斯亮蓝R250 染色液 0.1%(质量分数) 考马斯亮蓝R250,10%(质量分数) 冰醋酸,25%(质量分数)异丙醇,蒸馏水定容1 L,过滤去除杂质,室温避光保存备用。
5)卡那霉素 配制母液50 mg/mL,滤器过滤除菌,-20 ℃保存备用。
6)NTA 缓冲液 20 mol/L Tris-Hcl 缓冲液,0.5 mol/L NaCl,20~300 mmol/L 咪唑,每个梯度调pH 7.4。
7)IPTG 配制母液24 mg/mL,滤器过滤除菌,-20 ℃保存备用。
8)50×TAE Buffer Tris 242 g,Na2EDTA·2H2O 37.2 g,冰乙酸57.1 mL,蒸馏水定容至1 L,调pH 8.5,室温保存备用。
1.5 方法
1.5.1 菌种活化 从-80 ℃冰箱中取出保藏菌株植物乳杆菌WU14 在MRS 固体平板上划线,挑取单菌落接种到4 mL MRS 液体培养基中,37 ℃静置培养12 h,后按1%接种量接种至100 mL MRS液体培养基中37 ℃静置培养12 h。
1.5.2 基因组DNA 提取及浓度纯度检测 使用购自Solarbio 公司的细菌基因组DNA 提取试剂盒,提取植物乳杆菌WU14 总基因组,操作步骤按照试剂盒说明书进行,提取的基因组DNA 用超微量蛋白核酸分析仪检测,确定提取的DNA 的浓度和纯度是否合格,将合格的基因组DNA 置于-20 ℃冰箱保存。
1.5.3 目的基因的PCR 扩增 引物是由华大基因公司合成,PCR 扩增特异引物序列依次为:
表1 基因扩增引物
Table 1 The primers used for gene cloning
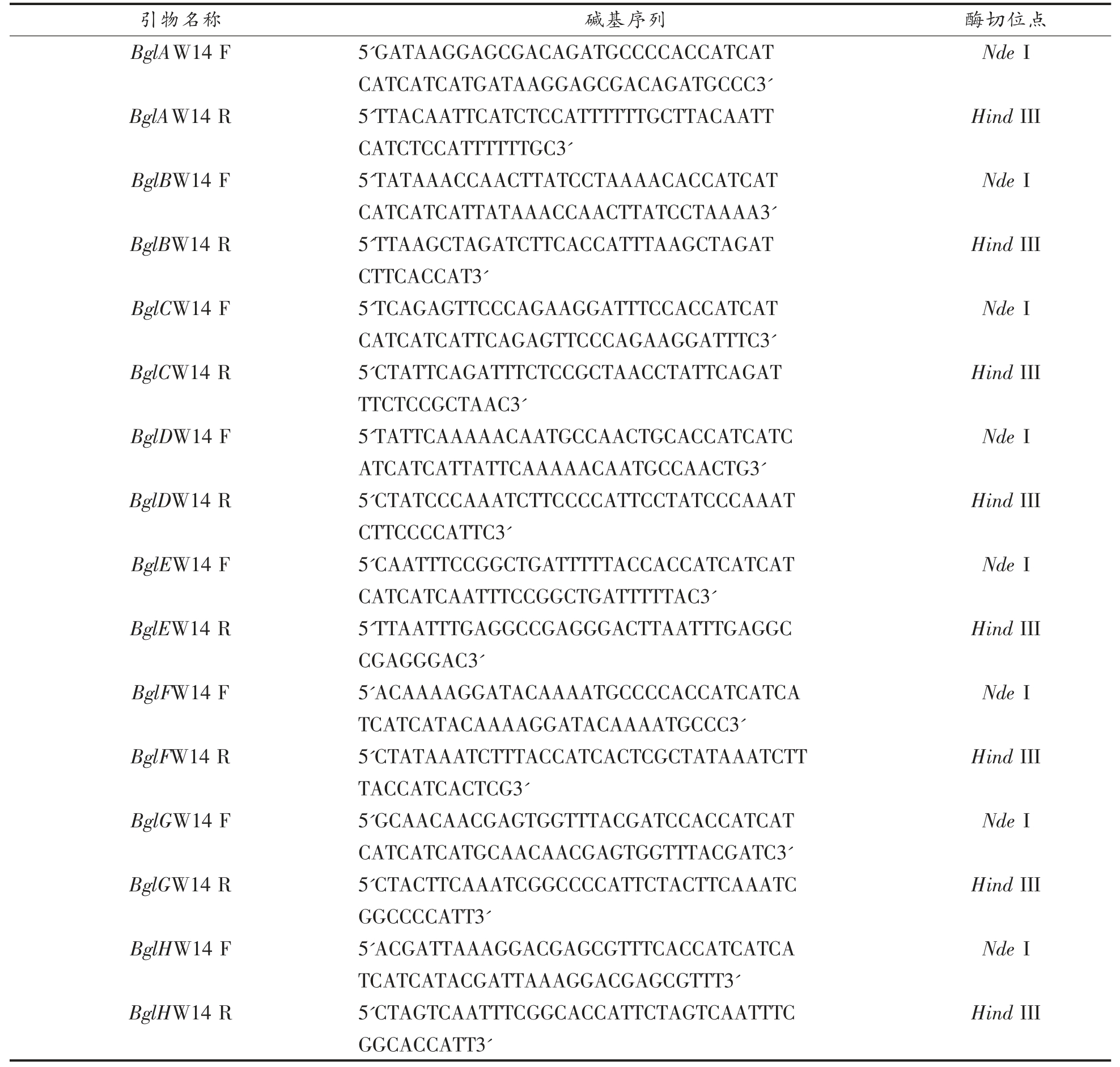
引物名称 碱基序列 酶切位点BglAW14 F 5'GATAAGGAGCGACAGATGCCCCACCATCAT Nde I CATCATCATGATAAGGAGCGACAGATGCCC3'BglAW14 R 5'TTACAATTCATCTCCATTTTTTGCTTACAATT Hind III CATCTCCATTTTTTGC3'BglBW14 F 5'TATAAACCAACTTATCCTAAAACACCATCAT Nde I CATCATCATTATAAACCAACTTATCCTAAAA3'BglBW14 R 5'TTAAGCTAGATCTTCACCATTTAAGCTAGAT Hind III CTTC ACCAT3'BglCW14 F 5'TCAGAGTTCCCAGAAGGATTTCCACCATCAT Nde I CATCATCATTCAGAGTTCCCAGAAGGATTTC3'BglCW14 R 5'CTATTCAGATTTCTCCGCTAACCTATTCAGAT Hind III TTCTCCGCTAAC3'BglDW14 F 5'TATTCAAAAACAATGCCAACTGCACCATCATC Nde I ATCATCATTATTCAAAAACAATGCCAACTG3'BglDW14 R 5'CTATCCCAAATCTTCCCCATTCCTATCCCAAAT Hind III CTTCCCCATTC3'BglEW14 F 5'CAATTTCCGGCTGATTTTTACCACCATCATCAT Nde I CATCATCAATTTCCGGCTGATTTTTAC3'BglEW14 R 5'TTAATTTGAGGCCGAGGGACTTAATTTGAGGC Hind III CGAGGGAC3'BglFW14 F 5'ACAAAAGGATACAAAATGCCCCACCATCATCA Nde I TCATCATACAAAAGGATACAAAATGCCC3'BglFW14 R 5'CTATAAATCTTTACCATCACTCGCTATAAATCTT Hind III TACCATCACTCG3'BglGW14 F 5'GCAACAACGAGTGGTTTACGATCCACCATCAT Nde I CATCATCATGCAACAACGAGTGGTTTACGATC3'BglGW14 R 5'CTACTTCAAATCGGCCCCATTCTACTTCAAATC Hind III GGCCCCATT3'BglHW14 F 5'ACGATTAAAGGACGAGCGTTTCACCATCATCA Nde I TCATCATACGATTAAAGGACGAGCGTTT3'BglHW14 R 5'CTAGTCAATTTCGGCACCATTCTAGTCAATTTC Hind III GGCACCATT3'
PCR 反应体系(50 μL):KOD buffer 5 μL、dNTP 5 μL、MgSO4 3 μL、WU14 基因组1 μL、引物各1.5 μL、KOD 酶1 μL,加ddH2O 至50 μL。
PCR 扩增程序:94 ℃预变性2 min、98 ℃变性10 s,55 ℃退火30 s,68 ℃延伸1 min 30 s,35 个循环,最后4 ℃保存。
用1%琼脂糖凝胶电泳验证PCR 扩增产物,电泳结束后用凝胶成像系统留图分析。
1.5.4 pET30a(+)空载体双酶切 使用下列快切酶体系(50 μL)对pET30a(+)空载体进行双酶切37 ℃金属浴4 h,并使用PCR 清洁试剂盒回收酶切产物,测好浓度,保存在-20 ℃冰箱中备用。
酶切体系:
pET30a(+) 20 μL
Hind III 限制性内切酶 1.5 μL
NdeⅠ限制性内切酶 1.5 μL
FD buffer 5 μL
ddH2O 22 μL
总体积 50 μL
1.5.5 无缝连接目的片段与酶切载体 使用购自康宁生命科学有限公司的DNA 凝胶回收试剂盒回收目的基因,然后使用pET30a(+)载体系统,按照下列无缝连接体系(10 μL),37 ℃连接45 min。质粒的转化参照大肠杆菌DH5α 感受态的转化方法进行。
Exnase Ⅱ连接酶 1 μL
pET30a(+) 1 μL
目的基因回收片段 1 μL
ddH2O 5 μL
buffer 2 μL
总体积 10 μL
1.5.6 重组质粒的提取及转化 用含有Kana(K+) 抗生素的LB 培养基活化已验证正确的含有重组克隆载体的大肠杆菌DH5α 感受态菌株,37 ℃振荡培养6~8 h,取1~4 mL 的菌液用于提取重组质粒,质粒的提取参照康宁生命科学有限公司的质粒小提试剂盒的提取方法。重组质粒的转化参照大肠杆菌BL21 感受态的转化方法进行。
1.5.7 重组蛋白的诱导表达、纯化和检测 将过夜培养的重组质粒种子液按1%接种于200 mL LB(K+)液体培养基中,37 ℃摇床培养至OD600 为0.4~0.8,加入终浓度为0.6 mmol/L 的IPTG 37 ℃振荡培养4 h。收集诱导完成的发酵液菌体,利用超声破碎仪将细胞破碎,收集破碎上清液和破碎沉淀,用镍柱纯化蛋白,并用不同浓度的咪唑洗脱纯化蛋白,然后用SDS-PAGE 分析蛋白表达情况。
1.5.8 测序及生物信息学分析 将1%琼脂糖凝胶电泳验证正确的菌液送至华大基因公司测序。测序完成后,将得到的碱基序列翻译为氨基酸序列,随后进行生物信息学分析。
2 结果与分析
2.1 植物乳杆菌WU14 全基因组的提取
利用细菌基因组DNA 提取试剂盒提取植物乳杆菌 WU14 全基因组DNA,提取的基因组DNA 用超微量蛋白核酸分析仪检测,其质量浓度在40 ng/μL,可用于后续试验,同时用1%琼脂糖凝胶电泳验证,提取结果如图1所示。
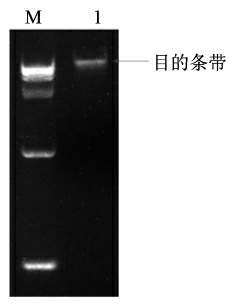
图1 植物乳杆菌WU14 基因组的琼脂糖凝胶电泳
Fig.1 Gel electrophoresis of L.plantarum WU14 genome
注:M:Marker 15 000;泳道1:WU14 全基因组DNA。
2.2 克隆8 个β-葡萄糖苷酶编码基因
通过基因组测序结果分析,经CAZy 数据库(http://www.cazy.org/)注释分析发现基因组上具有8 个GH1 家族6-磷酸-β-葡萄糖苷酶基因。利用植物乳杆菌WU14 基因组为模板,以目的基因的特异性引物为扩增引物进行PCR 扩增,然后用1%琼脂糖凝胶电泳验证,结果如图2所示,目的条带大小为1 500 bp 左右,结果显示扩增条带大小正确,条带单一浓度较高,可用于后续试验。

图2 BglAW14、BglBW14、BglCW14、BglDW14、BglEW14、BglFW14、BglGW14 和BglHW14 基因PCR 扩增凝胶电泳图
Fig.2 Gel electrophoresis of BglAW14、BglBW14、BglCW14、BglDW14、BglEW14、BglFW14、BglGW14、BglHW14 gene PCR amplification
注:M:DNA 标准Marker 2 000;泳道1:BglAW14 基因、泳道2:BglBW14、泳 道3:BglCW14、泳 道4:BglDW14、泳 道5:BglEW14、泳 道6:BglFW14、泳 道7:BglGW14、泳 道8:BglHW14。
2.3 SDS-PAGE 分析重组蛋白
利用生物信息学软件SnapGene 分析目的基因序列,8 个基因的理论蛋白大小均为55 ku 左右。8 个蛋白结果如图3到图6所示,以未加IPTG 诱导的菌液作为对照组,可以看出8 个蛋白都诱导表达成功,蛋白BglAW14、BglCW14 和BglFW14 的破碎上清液表达条带明显且与诱导成功的条带一致,都在55 ku 左右,其余的5 个蛋白的菌体破碎上清未检测到表达蛋白,而菌体破碎沉淀都有大量表达,故5 个蛋白都为包涵体表达。蛋白BglAW14、BglCW14 和BglFW14 为部分可溶性表达。
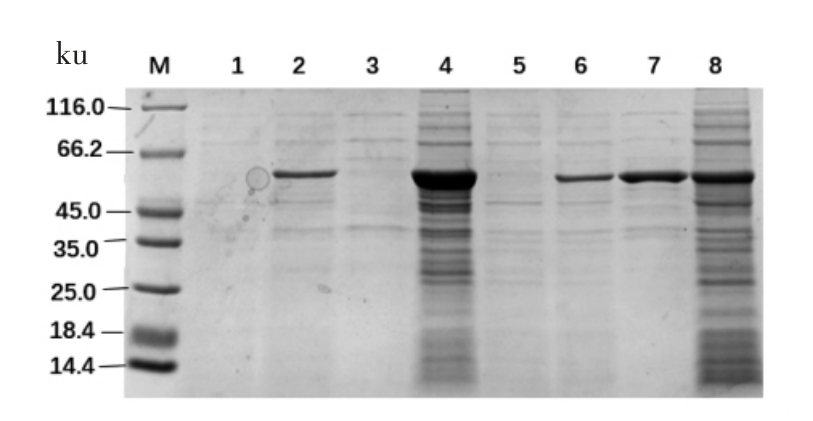
图3 SDS-PAGE 分析Fnr 蛋白
Fig.3 SDS-PAGE analysis of Fnr protein
注:M:蛋白Maker;泳道1:-IPTG BglBW14;泳道2:+IPTG BglBW14;泳道3:BglBW14 破碎上清;泳道4:BglBW14 破碎沉淀;泳道5:-IPTG BglCW14;泳道6:+IPTG BglCW14;泳道7:BglCW14 破碎上清;泳道8:BglCW14 破碎沉淀。

图4 SDS-PAGE 分析BglDW14 和BglEW14 蛋白
Fig.4 SDS-PAGE analysis of BglDW14 and BglEW14 protein
注:M:蛋白Maker;泳道1:-IPTG BglDW14;泳道2:+IPTG BglDW14;泳道3:BglDW14 破碎上清;泳道4:BglDW14 破碎沉淀;泳道5:-IPTG BglEW14;泳道6:+IPTG BglEW14;泳道7:BglEW14 破碎上清;泳道8:BglEW14 破碎沉淀。
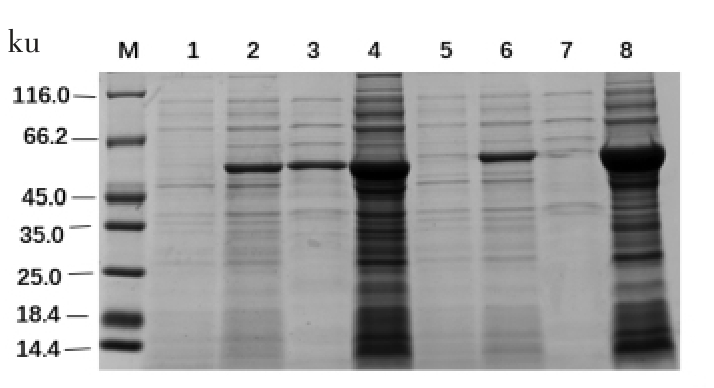
图5 SDS-PAGE 分析BglDW14 和BglEW14 蛋白
Fig.5 SDS-PAGE analysis of BglFW14 and BglGW14 protein
注:M:蛋白Maker;泳道1:-IPTG BglFW14;泳道2:+IPTG BglFW14;泳道3:BglFW14 破碎上清;泳道4:BglFW14 破碎沉淀;泳道5:-IPTG BglGW14;泳道6:+IPTG BglGW14;泳道7:BglGW14 破碎上清;泳道8:BglGW14 破碎沉淀。

图6 SDS-PAGE 分析BglHW14 和BglAW14 蛋白
Fig.6 SDS-PAGE analysis of BglHW14 and BglAW14 protein
注:M:蛋白Maker;泳道1:-IPTG BglHW14;泳道2:+IPTG BglHW14;泳道3:BglHW14 破碎上清;泳道4:BglHW14 破碎沉淀;泳道5:-IPTG BglAW14;泳道6:+IPTG BglAW14;泳道7:BglAW14 破碎上清;泳道8:BglAW14 破碎沉淀。
纯化蛋白BglAW14、BglCW14 和BglFW14 的SDS-PAGE 结果如图7所示,3 个蛋白用不同浓度的咪唑溶液洗脱后,得到的纯化蛋白的条带与对应的已诱导的菌体破碎液上清条带一致,表达量高且条带单一,用pNPG 法处理样品10 min 没有检测到β-葡萄糖苷酶酶活。刘晴等[16]研究的6-磷酸-β-葡萄糖苷酶TteBg1B 具有较强的底物特异性,对β-D-葡萄糖苷键和β-D-半乳糖苷键仅有微弱的水解作用。尹捷等[15]研究的6-磷酸-β-葡萄糖苷酶PbgL 具有底物专一性,对pNP 衍生物中的α-半乳糖苷键,6-磷酸-α-葡萄糖苷键,6-磷酸-α-半乳糖苷键及6-磷酸-α-甘露糖苷键均无水解作用,本研究中的这3 个纯化酶与已报道的6-磷酸-β-葡萄糖苷酶具有特异降解6-磷酸底物,而不能水解pNPG 的酶学特性相一致。
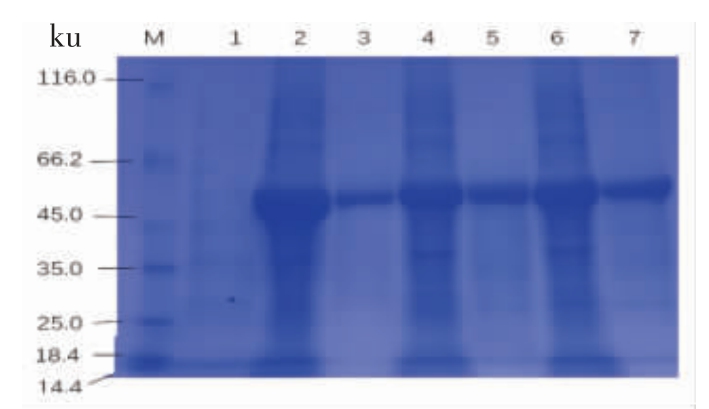
图7 SDS-PAGE 分析BglAW14、BglCW14和BglFW14 纯化蛋白
Fig.7 SDS-PAGE analysis of BglAW14,BglCW14 and BglFW14 purified protein
注:M:蛋白Maker;泳道1:pet-30a 空载体;泳道2:BglAW14 破碎上清;泳道3:BglAW14 纯化蛋白;泳道4:BglCW14 破碎上清;泳道5:BglCW14 纯化蛋白;泳道6:BglFW14 破碎上清;泳道7:BglFW14 纯化蛋白。
2.4 目的基因BglAW14、BglBW14、BglCW14、BglDW14、BglEW14、BglFW14、BglGW14 和Bgl-HW14 的生物信息学分析
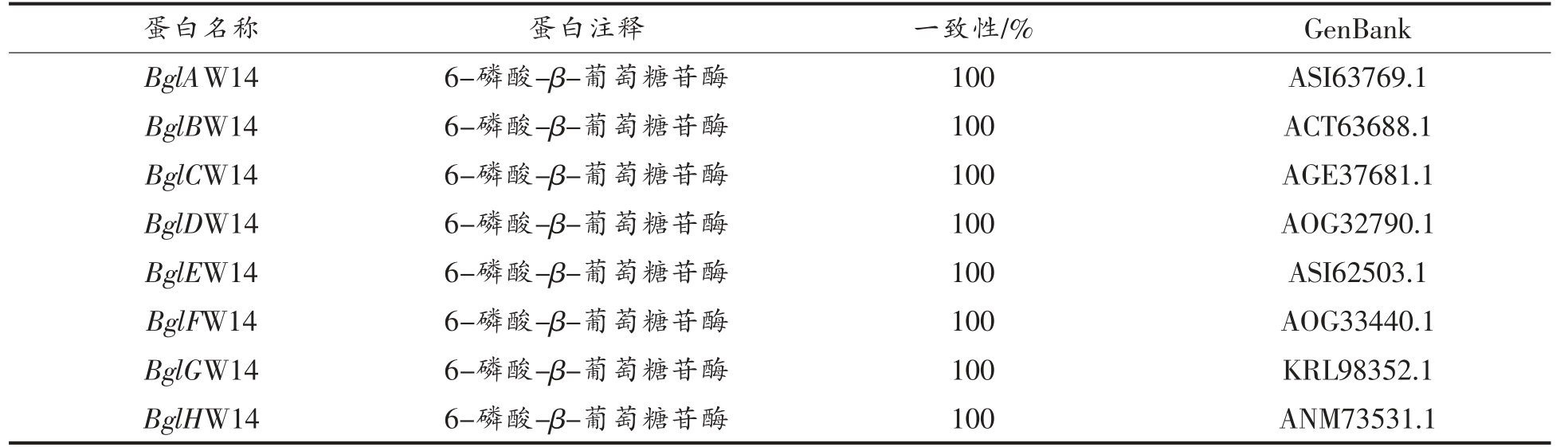
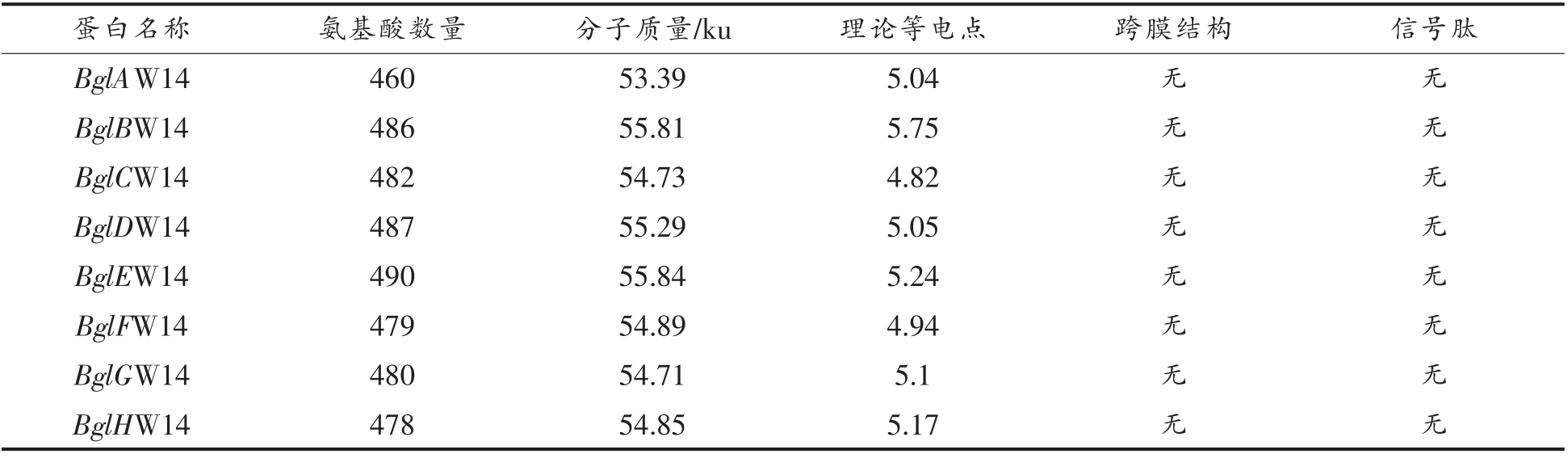
2.4.1 氨基酸序列分析、跨膜结构和信号肽预测用NCBI 比对氨基酸序列,结果如表2所示,8 个基因与对应的蛋白注释的一致性在100%。在线(http://web.expasy.org/protparam/)预测8 个基因编码蛋白的氨基酸长度、分子质量和等电点如下表3所示。蛋白质的跨膜结构能分析蛋白质的定位,为后续的表达、纯化有着重要影响,利用TMHMM 2.0 对8 个基因进行跨膜结构预测,结果如下表2所示,8 个蛋白均没有跨膜结构,预测结果均为可溶性蛋白。信号肽能够引导新合成的蛋白向分泌通路转移,预测蛋白类型,利用SignalP4.0 对8 个基因进行信号肽预测,预测结果如下表2所示,8 个蛋白均没有信号肽,预测结果均为非分泌蛋白。
表2 植物乳杆菌的GH1 家族葡萄糖苷酶的基因注释和一致性分析
Table 2 Gene annotation and consistency analysis of GH1 family glucosidase from L.plantarum
?
表3 氨基酸序列分析、跨膜结构和信号肽预测
Table 3 Amino acid sequence analysis,transmembrane structure and signal peptide prediction
?
2.4.2 氨基酸序列比对分析及系统发育树分析将8 个蛋白的氨基酸序列进行序列比对,结果如图8所示,8 个序列都具有GH1 家族葡萄糖苷酶的两个典型的谷氨酸(E)催化位点。N 端序列差异明显,C 端序列具有较高的一致性。同时对8 个蛋白序列用MEGA 5 软件的NJ 法构建系统发育树,结果如图9所示,8 个蛋白序列的一致性在32%~74%之间。从进化树分析结果发现,8 个蛋白形成3 个进化簇,其中BglBW14 和BglDW14 氨基酸一致性最高为74%,其次BglFW14、BglHW14和BglGW14 相互之间的一致性在66%以上。其它蛋白氨基酸一致性均在60%以下,尤其BglAW14与其它7 个蛋白氨基酸一致性在40%以下。

图8 氨基酸序列比对结果
Fig.8 Amino acid sequence alignment results

图9 系统发育树
Fig.9 Phylogenetic tree
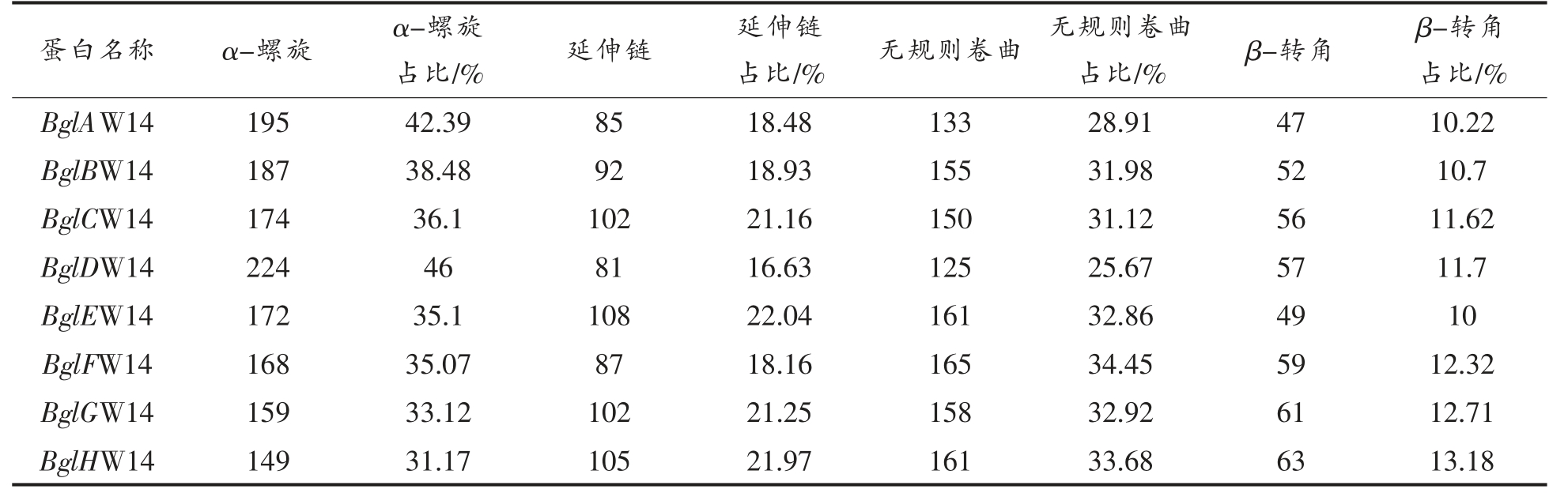
2.4.3 蛋白二级结构预测 蛋白质的二级结构是蛋白质的多肽链中有规则重复的构象,主要包括α-螺旋、β-折叠和β-转角,在线(https://npsaprabi.ibcp.fr/cgi-bin/secpred_sopm.pl)预测BglAW14、BglBW14、BglCW14、BglDW14、BglEW14、BglFW14、BglGW14 和BglHW14 的二级结构,结果如下表4所示,8 个蛋白均有最大占比的α-螺旋,中等占比的延伸链,大占比的无规则卷曲以及小占比的β-转角。
表4 蛋白二级结构预测
Table 4 Protein secondary structure prediction
蛋白名称 α-螺旋 α-螺旋占比/% 延伸链 延伸链占比/% 无规则卷曲 无规则卷曲
2.4.4 亚细胞定位 亚细胞定位能预测蛋白在细胞内的位置,对于研究蛋白具有重要意义,在线(http://www.softberry.com/berry.phtml?topic=bprom&group=programs&subgroup=gfindb) 预测BglAW14、BglBW14、BglCW14、BglDW14、BglEW14、BglFW14、BglGW14 和BglHW14 编码蛋白在细胞内的位置如下表5所示,BglAW14、BglBW14、BglCW14、BglDW14、BglFW14 和BglGW14 的预测结果显示其位于细胞质内,BglEW14 的预测结果显示其位于分泌内,BglHW14 的预测结果显示其位于细胞膜。其中BglCW14 和BglFW14 在周质空间内有较多的占比,BglCW14 和BglFW14 具有部分可溶性可能与此相关。
表5 亚细胞定位
Table 5 Subcellular localization

蛋白名称 细胞质 跨膜 分泌 周质空间BglAW14 7.64 2.36 0 0 B glB W14 7.97 1.43 0.6 0 BglCW14 4.91 2.93 0.4 1.76 BglDW14 4.59 2.91 1.86 0.65 BglEW14 0.58 3.15 6.01 0.27 BglFW14 4.31 2.75 0.65 2.29 BglGW14 7.15 0.87 0.31 1.67 BglHW14 3.2 6.6 0 0.2
3 结论
1)本研究成功克隆到8 个来自植物乳杆菌WU14 的6-磷酸-β-葡萄糖苷酶编码基因。经SDS-PAGE 验证可知8 个酶蛋白在大肠杆菌中异源表达成功,但只有3 个蛋白BglAW14、BglCW14和BglFW14 为部分可溶性表达,其余5 个酶蛋白为包涵体。
2)对8 个基因的编码蛋白进行生物信息学分析,结果显示:8 个基因都属于GH1 家族,编码6-磷酸-β-葡萄糖苷酶。编码氨基酸具有GH1 家族6-磷酸-β-葡萄糖苷酶保守的两个催化区域(NEP 和ENG)。编码蛋白都无信号肽和跨膜结构、疏水性较强。亚细胞结构预测可知,除了BglEW14 主要存在于分泌结构内和BglHW14 主要存在于细胞膜,其余的6 个基因都存在于细胞质内。
3)研究表明BglAW14、BglCW14 和BglFW14在大肠杆菌中异源表达为可溶性蛋白,并纯化获得了单一目的条带,但上述3 个可溶性蛋白以pNPG 为底物未检测到β-葡萄糖苷酶活性,这与6-磷酸-β-葡萄糖苷酶具有特异降解6-磷酸底物,而不能高效水解pNPG 的酶学特性相一致。
[1]张哲.植物乳杆菌β-D-葡萄糖苷酶的胞内定位及性质研究[D].杨凌:西北农林科技大学,2014.
ZHANG Z.Intracellular localization and properties of Lactobacillus plantarum β-D-glucosidase[D].Yangling:Northwest A&F University,2014.
[2]卜潇.葡萄酒中植物乳杆菌β-葡萄糖苷酶及其苹果酸-乳酸发酵潜力研究[D].杨凌:西北农林科技大学,2016.
BU X.Study on Lactobacillus plantarum β-glucosidase and its malic acid-lactic fermentation potential in wine[D].Yangling:Northwest A&F University,2016.
[3]GAGNÉ S,LUCAS P M,PERELLO M C,et al.Variety and variability of glycosidase activities in an Oenococcus oeni strain collection tested with synthetic and natural substrates[J].Journal of Applied Microbiology,2010,110(1):218-228.
[4]MARET,DU,TOIT,et al.Lactobacillus:the next generation of malolactic fermentation starter culturesan overview[J].Food and Bioprocess Technology,2010,4(6):876-906.
[5]MILLA ALVES BAFFI,NATÁLIA MARTIN,THAISE MARIÁ TOBAL,et al.Purification and Characterization of an Ethanol-Tolerant β-Glucosidase from Sporidiobolus pararoseus and Its Potential for Hydrolysis of Wine Aroma Precursors[J].Applied Biochemistry and Biotechnology,2013,171(7):1681-1691.
[6]LERM E,ENGELBRECHT L,DU TOIT M.Selection and characterisation of Oenococcus oeni and Lactobacillus plantarum south African wine isolates for use as malolactic fermentation starter cultures[J].South African Journal of Enology & Viticulture,2011,32(2):280-295.
[7]BARBOSA A M,GIESE E C,DEKKER R F H,et al.Extracellular beta-glucosidase production by the yeast Debaryomyces pseudopolymorphus UCLMNS7A:optimization using response surface methodology[J].New Biotechnology,2010,27(4):374-381.
[8]曹慧方.来源于Alicyclobacillus sp.A4 的GH1 家族β-葡萄糖苷酶的克隆表达及葡萄糖耐受性分子改造[D].北京:中国农业科学院研究生院,2017.
CAO H F.Cloning and expression of GH1 family β -glucosidase from Alicyclobacillus sp.A4 and molecular modification of glucose tolerance[D].Beijing:Graduate School of Chinese Academy of Agricultural Sciences,2017.
[9]WITT E,FRANK R,HENGSTENBERG W.6 -Phospho-β-galactosidases of Gram-positive and 6-phospho-β-glucosidase B of Gram-negative bacteria:comparison of structure and function by kinetic and immunological methods and mutagenesis of the lacG gene of staphylococcus aureus[J].Protein Engineering,Design and Selection,1993,6(8):913-920.
[10]DESAI S K,NANDIMATH K,MAHADEVAN S.Diverse pathways for salicin utilization in Shigella sonnei and Escherichia coli carrying an impaired bgl operon [J].Archives of Microbiology,2010,192(10):821-833.
[11]THOMPSON J,RUVINOV S B,FREEDBERG D I,et al.Cellobiose-6-phosphate hydrolase(CelF) of Escherichia coli:Characterization and assignment to the unusual family 4 of glycosylhydrolases[J].Journal of Bacteriology,1999,181(23):7339-7345.
[12]MCINTOSH L P,HAND G,JOHNSON P E,et al.The pKa of the general acid/base carboxyl group of a glycosidase cycles during catalysis:A 13 C-NMR study of Bacillus circulans Xylanase[J].Biochemistry,1996,35(31):9958-9966.
[13]THOMPSON J,ROBRISH S A,BOUMA C L,et al.Phospho -beta -glucosidase from Fusobacterium mortiferum:Purification,cloning,and inactivation by 6-phosphoglucono-delta-lactone[J].Journal of Bacteriology,1997,179(5):1636-1645.
[14]THOMPSON J,LICHTENTHALER F W,PETERS S,et al.Beta-glucoside kinase(BglK) from Klebsiella pneumoniae.Purification,properties,and preparative synthesis of 6-phospho-beta-D-glucosides[J].Journal of Biological Chemistry,2002,277(37):34310-34321.
[15]牛瑜.6-磷酸-β-葡萄糖苷酶Pbgl25-217 的克隆、表达与酶学性质研究[D].济南:山东大学,2011.
NIU Y.Cloning,expression and enzymatic properties of 6-phosphate-β-glucosidase Pbgl25-217[D].Jinan:Shandong University,2011.
[16]尹捷,刘一苇,李洁,等.腾冲嗜热厌氧杆菌6-磷酸-β-葡萄糖苷酶的表达与结晶及其功能鉴定[J].中国生物化学与分子生物学报,2008(10):916-924.
YIN J,LIU Y W,LI J,et al.Expression,crystallization and functional identification of 6-phosphateβ -glucosidase from Thermoanaerobacterium Tengchong[J].Chinese Journal of Biochemistry and Molecular Biology,2008(10):916-924.
[17]刘晴,张宇微,张宇宏,等.热稳定6-磷酸-β-葡萄糖苷酶TteBglB 异源表达、分离纯化及酶学性质分析[J].中国农业科技导报,2014,16(6):52-58.
LIU Q,ZHANG Y W,ZHANG Y H,et al.Heterologous expression,purification and enzymatic properties of thermostable 6-phosphate-β-glucosidase TteBglB[J].China Agricultural Science and Technology Review,2014,16(6):52-58.