炎症反应(Inflammatory response)是由病原体入侵、细胞损伤或者有毒化合物引起免疫系统产生的一种防御性反应。过度或慢性的炎症反应可能导致机体心脏、肝脏、脑、肠道等组织损失或疾病,如感染性心内膜炎、类风湿性关节炎、炎症性肠病(克罗恩病和溃疡性结肠炎)[1]。炎症影响多种疾病的发病机制涉及常见的炎症介质和调节通路。微生物产物和细胞因子,例如白细胞介素-1β(Interleukin-1β,IL-1β)、白细胞介素-6(Interleukin-6,IL-6)和肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α),与机体TLRs 受体、TNF 受体相互作用介导炎症;受体激活触发重要的细胞内信号通路,包括丝裂原活化蛋白激酶(mitogenactivated protein kinase,MAPK)、核因子-κB(Nuclear factor kappa-B,NF-κB)和Janus 激酶(Janus kinase,JAK)-信号转导和转录激活因子(activator of transcription,STAT)通路[1-2]。脂多糖(Lipopolysaccharide,LPS) 是典型的炎症刺激剂,是革兰氏阴性菌细胞壁的主要成分及Toll 样受体4(Toll-like receptor 4,TLR4)的配体,能够无限度地启动天然免疫反应,导致器官衰竭甚至死亡[3]。在LPS 诱导的细胞炎症反应模型中,巨噬细胞通过其细胞膜表面表达的TLR4 等模式识别细菌LPS 等病原,引起刺激性信号传导,激活MAPK 等信号通路,进而引发炎症性疾病[4-5]。近年来,在膳食预防和辅助治疗炎症反应的研究方面,壳寡糖、褐藻胶寡糖、岩藻聚糖寡糖等海洋活性寡糖在抗炎方面有着很好的发展潜力。
我国的海藻资源丰富,2019年我国海藻产量255.6 万t,其中福建省海藻产量为118.9 万t,占比达46.51%,居全国首位(数据来源:中国统计年鉴)[6]。多糖(如卡拉胶、琼胶、岩藻聚糖等)是海藻的主要结构物质和膳食营养元素之一,经降解后低分子质量多糖或寡糖会保留原有的活性或产生新的活性,同时更易于被机体吸收,提高生物利用度[7]。琼胶是由海洋红藻中提取的多糖,是目前世界上用途较广泛的海藻胶之一。琼胶寡糖是由琼胶降解得到的一种低聚合度寡糖分子。目前,关于琼胶寡糖的生物活性研究集中于其益生元效应和调控肠道菌群[8-10]、调节血糖[11]、抗氧化[12-13]等作用,而关于琼胶寡糖的抗炎作用及机制[14-15]鲜有报道。本研究采用LPS 诱导小鼠单核巨噬细胞RAW264.7 建立炎症反应模型,探讨琼胶寡糖对LPS 诱导小鼠单核巨噬细胞RAW264.7 炎症反应的影响,为琼脂寡糖作为功能性食品的开发及其在生物医药领域的应用提供理论参考。
1 材料与方法
1.1 材料与试剂
酸法制备的琼胶寡糖(平均分子质量1~3 ku) 青岛博智汇力生物科技有限公司;小鼠巨噬细胞RAW264.7,中国科学院细胞库(National Collection of Authenticated Cell cultures);胎牛血清,美国Gibco 公司;双抗(链、青霉素),西格玛奥德里奇(上海)有限公司;高糖DMEM 培养基,美国Hyclone 公司;四甲基偶氮唑盐(methylthiazolyldiphenyl-tetrazolium bromide,MTT),上海阿拉丁生化科技股份有限公司;磺胺酸、N-1-(萘基)乙二胺二盐酸盐、冰醋酸,国药集团化学试剂有限公司;capture antibody(MM350C)、conjugater antibody(MM350DB),美国Thermo Fisher Scientific 公司;细胞裂解液和BCA 试剂盒,北京索莱宝科技有限公司;SDS-PAGE 凝胶配制试剂盒,碧云天生物科技公司。
1.2 设备与仪器
HERAcell VIOS 160I CO2 细胞培养箱,赛默飞世尔科技公司;Avanti J26XP 高速冷冻离心机,德国贝克曼公司;BioTek Cytation-5 酶标仪,美国伯腾仪器有限公司;Nikon TS100 倒置显微镜、Nikon 50i 荧光显微镜,日本尼康(Nikon)公司;AI600 凝胶成像仪,美国通用电气公司(General Electric)。
1.3 方法
1.3.1 红外光谱测试 将琼胶寡糖粉末烘干,取5 mg 琼胶寡糖样品与溴化钾按1∶100 比例混合均匀,充分研磨后压片,后采用is50 FT-IR 型红外光谱仪检测样品的化学结构,扫描的波数范围为4 000~400 cm-1,分辨率为4 cm-1。
1.3.2 核磁共振测试 按照陈岩君[16]报道的方法进行优化,称取冻干的样品10 mg,溶于1 mL D2O中,冻干并重复3 次使样品中的氢完全被氘置换;最后用500 μL D2O 溶解,转移至核磁管中进行检测。磁场频率为500 MHz。
1.3.3 琼胶寡糖分子质量的测定 精确称取琼胶寡糖5 mg,溶于1 mL 超纯水中,充分混匀后,使用0.22 μm 滤膜过滤,再利用配备有TSK gel G2500 PWXL 柱(7.8 mm I.D.×30 cm)和ELSD-LT Ⅱ蒸发光散射检测器的高效液相色谱系统来测定寡糖的分子质量[17]。以葡萄糖(Mw:180.16)、昆布二糖(laminaribiose,Mw:342.3)、昆布四糖(laminaritetraose,Mw:666.58)、昆布五糖(laminaripentaose,Mw:828.72)、葡聚糖1.0×103 u 和5.0×103 u 作为标准品。
1.3.4 细胞培养和细胞活力分析 小鼠巨噬细胞RAW264.7 采用含有10% FBS、100 U/mL 青霉素和100 U/mL 链霉素的高糖DMEM 培养基,于37℃、5% CO2 的细胞培养箱中培养。细胞生长至75%左右时,移除旧培养基,用1×PBS 清洗2 次后加入新培养基,并用刮刀将贴壁细胞刮下,吹打均匀,按1∶2 比例进行传代培养。
采用MTT 法来测定琼胶寡糖对RAW264.7细胞毒性的影响[17]。将处于生长对数期的RAW264.7 细胞以3×104 细胞/孔的浓度接种于96孔细胞培养板,置于培养箱中孵育,细胞贴壁生长至85%后,用100 μL 含有不同浓度的琼胶寡糖的培养基(0,7.8125,15.625,31.25,62.5,125 和250 μg/mL)处理细胞24 h。孵育结束后除去上清,每孔加入50 μL 的MTT 溶液,继续孵育30 min。移除上清,每孔用1×PBS 清洗2 次 后加 入100 μL DMSO,振荡20 min 至甲瓒完全溶解,用CytationTM 5 细胞成像多功能检测系统检测570 nm 处吸光值(OD570)。为探究琼胶寡糖对LPS 诱导的RAW264.7 细胞损伤的抑制作用,以不同浓度的LPS 处理RAW264.7 细胞构建炎症模型,最终确定以10 ng/mL LPS 作为诱导条件。试验在使用LPS(终质量浓度为10 ng/mL)诱导RAW264.7 细胞前,用含有琼胶寡糖的培养基预处理细胞24 h(试验组)。以只用生长培养基处理的细胞为空白组(Blank);对照组为用生长培养基预处理,再用LPS 进行诱导12 h 的细胞。采用相同的方法进行细胞活力测定,并根据公式1 计算细胞活力。
式中:A1——试验组或对照组在570 nm 处的吸光值;A2——空白组在570 nm 处的吸光值;T1——同体积DMSO 在570 nm 处的吸光值。
1.3.5 RAW264.7 细胞内一氧化氮(Nitric oxide,NO)的产生测定 采用Griess 法[17]测定RAW264.7细胞释放NO。参照1.3.4 节方法将细胞接种于细胞培养板中。经过夜培养后,分别向贴壁的RAW264.7 细胞中加入100 μL 含琼胶寡糖(终质量浓度分别为7.8125,15.625,31.25,62.5,125 和250 μg/mL)的生长培养基,空白组和对照组加入100 μL 生长培养基,于培养箱中培养24 h,移除培养基,再向寡糖处理组和对照组加入LPS 处理12 h。每孔取出50 μL 培养上清液置于新的96 孔细胞培养板中,之后向上清液中加入100 μL 的Griess 试剂(含3 mol/L 磺胺酸,30 mg/L N-1-(萘基)乙二胺二盐酸盐,质量分数为25%冰醋酸),室温避光孵育20 min,检测540 nm 下的吸光值(OD540)。同时,用不同浓度的NaNO2 标准溶液绘制标准曲线,计算培养上清液中NO 浓度。
1.3.6 RAW264.7 细胞内肿瘤坏死因子(tumor
necrosis factor-α,TNF-α) 的含量测定 采用ELISA 法测定RAW264.7 细胞分泌的TNF-α。一抗capture antibody(MM350C)稀释1 000 倍,按照100 μL/孔将其加入ELISA 板,置于4 ℃冰箱反应12 h 后洗板5 次。继续加入4%牛血清蛋白的PBS进行蛋白包被,室温反应2 h 后振荡洗板5 次。然后将样品稀释50 倍,按100 μL/孔加入ELISA 板中,室温反应2 h,振荡洗板5 次。之后加入相同体积稀释1 000 倍后的二抗conjugater antibody(MM350DB),室温反应2 h,振荡洗板5 次。接着加入100 μL 稀释1 000 倍的三抗avidin-HRP,室温反应30 min 后洗板,加入100 μL 显色剂反应30 min。最后加入终止液终止反应,在波长450 nm 处测定吸光值。
1.3.7 RAW264.7 细胞内活性氧(Reactive oxygen species,ROS)的产生测定 通过二氯荧光乙酰乙酸盐(DCFH-DA)荧光探针测定RAW264.7 细胞内产生的ROS 含量[18]。参照1.3.4 节方法将细胞接种于细胞培养板中,按1.3.5 节中的方法处理细胞后,移除各孔中的培养基,加入100 μL 含有10 μmol/L DCFH-DA 的生长培养基,于37 ℃、5%CO2 培养箱中孵育20 min。孵育结束后,移去各孔中的培养基,用1×PBS 洗涤3 次,以去除未进入细胞内的DCFH-DA 探针,然后加入100 μL 生长培养基,在激发波长为485 nm,发射波长为525 nm 的条件下用细胞成像多模式检测仪检测各孔的荧光强度,根据公式2 计算相对ROS 水平,并用Nikon 50i 荧光显微镜进行拍照。
式中:B1——试验组或对照组的荧光强度;B2——空白组的荧光强度。
1.3.8 Western blotting 分析MAPK 信号通路中的目的蛋白[19] 将处于对数生长期的RAW264.7细胞按照4×106 cell/mL 的浓度接种到内径为3.5 cm 的培养皿中,每个培养皿加入2 mL 细胞悬液。按1.3.5 节中的方法处理各组细胞,孵育结束后按照试剂盒说明书方法步骤提取胞浆蛋白,置于-20℃保存备用。采用BCA Protein Assay Kit 测定蛋白质含量,牛血清蛋白BSA 为标准品。按照试剂盒说明书方法步骤测定所提取的胞浆蛋白溶液的蛋白浓度。
SDS-PAGE 电泳:配制厚度为1 mm 的10%凝胶。样品细胞裂解液稀释至同一蛋白浓度后按照4∶1 的比例与Loading Buffer 充分混匀。沸水浴5 min 后,冷却至室温,按照每孔28 μg 蛋白加样。加样结束后,先将电压调至80 V 进行电泳。当样品电泳至分离胶与浓缩胶交界处,将电压调节为120 V 至电泳结束。转膜:将胶从电泳槽中取出,裁剪与胶大小相同的PVDF 膜,按照正确的顺序将胶和膜放置转膜器中,定电流250 mA,转膜150 min。免疫印迹:转膜结束后取出PVDF 膜,置于封闭液中封闭1 h,封闭结束后,用TBST 振荡清洗3 次,每次10 min。孵育一抗(p44/42 p-p44/42 MAPK Rabbit mAb、p-p38 p38 MAPK Rabbit mAb 和JNK p-JNK MAPK Rabbit mAb) 放置4℃缓慢摇动过夜。孵育结束后清洗3 次,再于室温孵育二抗Anti-rabbit IgG(HRP-linked Antibody)1 h。显影:二抗孵育结束后,清洗3 次。将配置好的显影液均匀地涂抹在PVDF 膜上,室温避光孵育2 min,放置于凝胶成像仪中进行目的蛋白显影。
1.4 数据统计与分析
设置3 个平行试验,试验结果表示为平均值±标准偏差(SD)。试验数据利用Graphpad prism 5软件分析处理后绘图,利用SPSS 19.0 软件单因素方差分析检验数据差异显著性,P<0.05 表示差异显著,P<0.01 表示差异极显著。
2 结果与分析
2.1 琼胶寡糖的分子结构鉴定
图1为琼胶寡糖的红外光谱图。与现有报道类似,琼胶的分子结构特征主要由(l→3)-β-D-半乳糖和(1→4)-3,6-内醚-α-L-半乳糖交替连接构成,由琼胶降解制备的寡糖样品在3 416,2 916,2 900,1 639,1 376,1 154,1 074,933 cm-1波长处出现典型的特征吸收峰[20]。3 416 cm-1 处的吸收宽峰为琼胶寡糖-OH 的伸缩振动峰,2 916 和2 900 cm-1 为糖环的-CH2 的伸缩振动峰。1 639 cm-1 处的振动峰由糖环的-C-C-的伸缩振动引起,933 cm-1 和1 074 cm-1 处吸收峰则为C-O 键的伸缩振动峰,表明琼胶寡糖含有3,6-内醚半乳糖糖环结构。

图1 琼胶寡糖的红外光谱图
Fig.1 FT-IR spectra of agaro-oligosaccharide
图2为琼脂寡糖的核磁共振氢谱,1H NMR(500 MHz,D2O) δ 5.04(s,1H),4.90(d,J=6.3 Hz,1H),4.50(d,J=47.4 Hz,5H),4.29(s,1H),4.13(d,J=10.3 Hz,1H),4.03(s,2H),3.92(d,J=10.6 Hz,1H),3.82(s,1H),3.66(ddd,J=11.4,7.2,3.0 Hz,6H),3.56~3.46(m,3H),3.38(d,J=9.4 Hz,1H),3.31(s,1H)。图3为琼胶寡糖的核磁共振碳谱,13C NMR(126 MHz,D2O) δ 101.98(d,J=30.6 Hz),97.96(s),89.83(s),81.69(s),79.56(s),76.87(s),75.44~74.71(m),73.02(s),72.58(s),70.46(s),69.71(s),69.23(s),68.89(s),68.57(s),68.24(s),60.92(s)。氢谱中δ 5.04(s,1H)与4.50(d,J=47.4 Hz,5H)表明琼胶寡糖含有端基3,6 内醚-α-L-半乳糖的H1 与端基β-D-半乳糖的分子结构,以及碳谱中δ 97.00 出现信号位移而δ 93.00 和δ 90.72没有出现信号峰,表明所制备的琼胶寡糖具有β构型半乳糖残基而无α构型半乳糖残基。因此,推测该琼胶寡糖主要由β-D-半乳糖和3,6 内醚-α-L-半乳糖残基构成,符合酸法降解产生的寡糖产物的特征结构[20-22]。
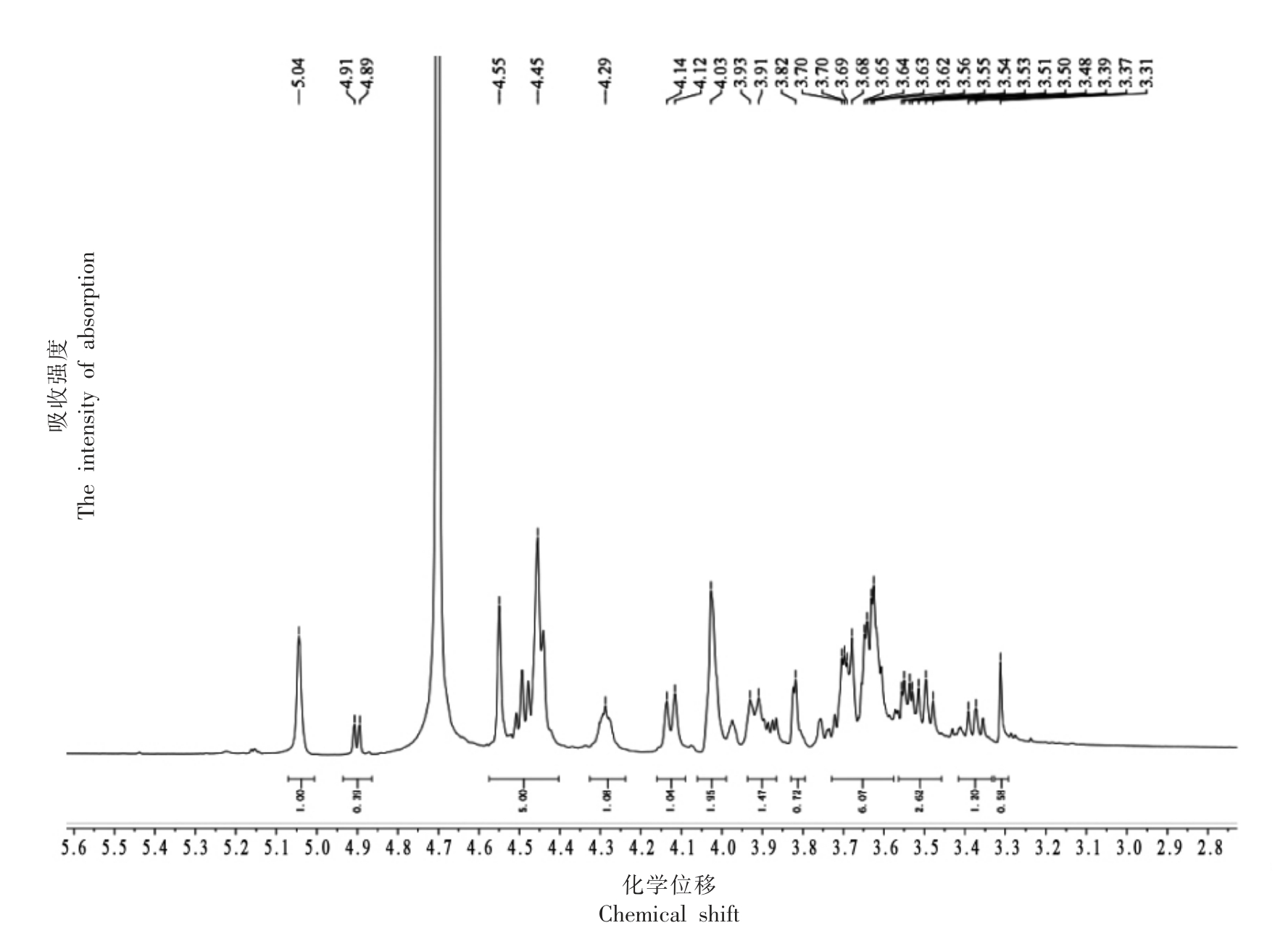
图2 琼胶寡糖的核磁共振氢谱图
Fig.2 1H NMR spectrum of agaro-oligosaccharide
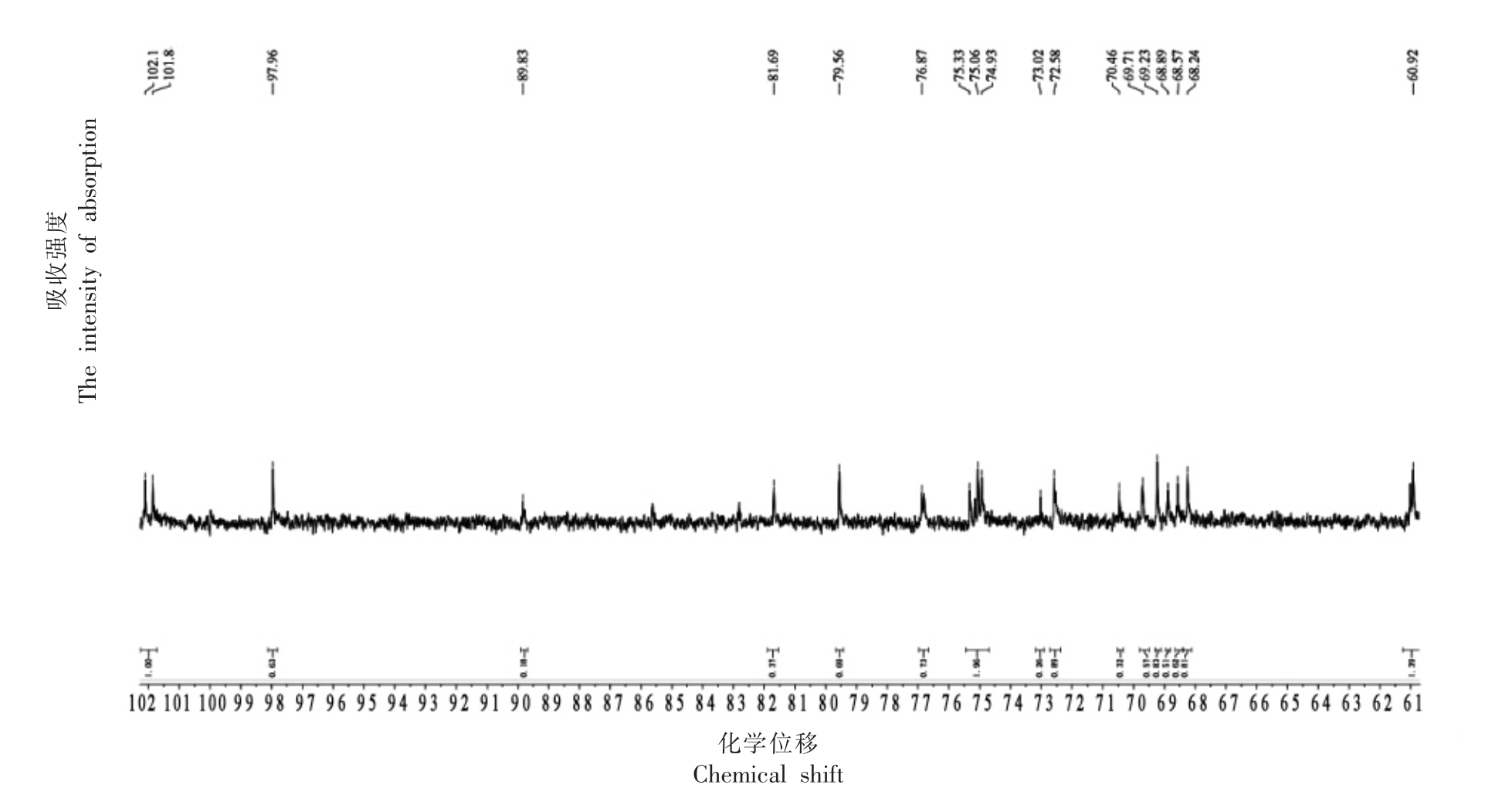
图3 琼胶寡糖的核磁共振碳谱图
Fig.3 Nuclear magnetic resonance carbon spectrum of agar-oligosaccharides
图4为琼胶寡糖的高效液相色谱图,本试验利用配备有TSK gel G2500 PWXL 柱(7.8 mm I.D.×30 cm) 和ELSD-LT Ⅱ蒸发光散射检测器的高效液相色谱来测定寡糖的分子质量,以葡萄糖(Mw:180.16)、昆布二糖(Mw:342.3)、昆布四糖(Mw:666.58)、昆布五糖(Mw:828.72)、葡聚糖1.0×103 u 和5.0×103 u 作为标准品,以保留时间(t)为横坐标,分子质量(Mw)为纵坐标绘制分子质量分布标准曲线,根据标曲计算样品分子质量分布情况,结果表明琼胶寡糖的分子质量范围为1 065.5~1 308.2 u,根据上述结果推测其含有两种聚合度的寡糖,为四糖和五糖。
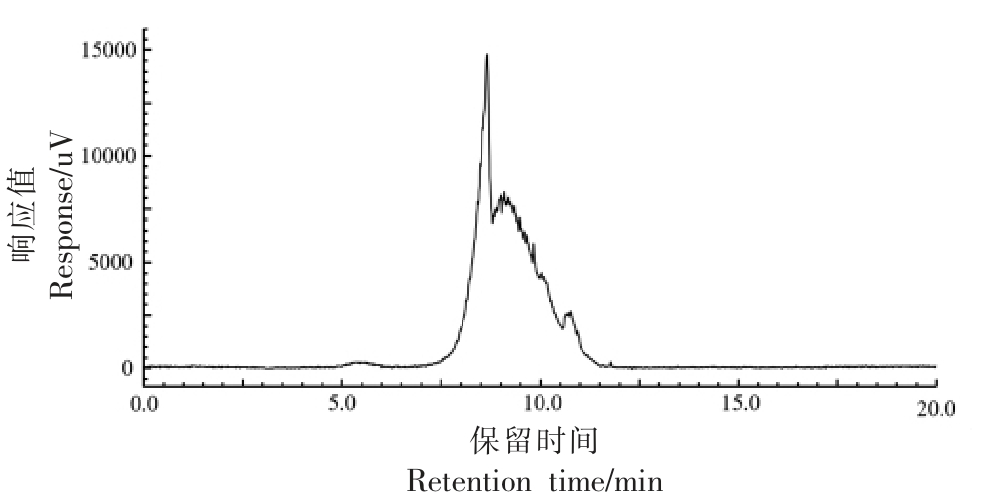
图4 琼胶寡糖的高效液相色谱图
Fig.4 HPLC of agar-oligosaccharides
2.2 琼胶寡糖对RAW264.7 细胞活力的影响
采用MTT 法分析琼胶寡糖对RAW264.7 细胞活力的影响,结果如图5a 所示。在琼胶寡糖质量浓度为0~250 μg/mL 范围内,各组RAW264.7细胞活力均高于90%,与对照组(0 μg/mL 琼胶寡糖)相比,无显著性差异(P>0.05)。结果表明,琼胶寡糖在测试质量浓度(0~250 μg/mL) 范围内对RAW264.7 的细胞活力无显著影响。进一步构建细胞炎症模型如图5b,使用不同浓度的LPS 诱导细胞,当LPS 质量浓度为2 ng/mL 时细胞活力开始显著降低,随着浓度的增加而降低;LPS 质量浓度为50 ng/mL 和250 ng/mL 时细胞半数死亡且两者两者之间没有显著性差异,故试验选取10 ng/mL 作为诱导条件建立模型。为研究琼胶寡糖对LPS 诱导RAW264.7 细胞炎症反应的抑制作用,本文在LPS 刺激细胞前使用不同剂量琼胶寡糖进行干预。结果如图5c 所示,与空白组相比,对照组LPS 刺激后RAW264.7 细胞活力显著降低,这是因为LPS 对RAW264.7 细胞增殖具有抑制作用,其细胞周期被阻滞在S 期,随后发生凋亡[23]。添加琼胶寡糖干预处理后,LPS 刺激后RAW264.7 的细胞活力明显高于对照组(P<0.05),并且与空白组细胞活力相当。Wang 等[24]发现LPS 处理引起RAW264.7 细胞活力降低,添加硫酸多糖能够提高LPS 刺激的RAW264.7 细胞的活力和降低NO的产生,具有抗炎作用。与该研究一致,本研究表明琼胶寡糖对LPS 刺激引起RAW264.7 细胞活力降低的现象具有改善作用,具有潜在的炎症调节作用。
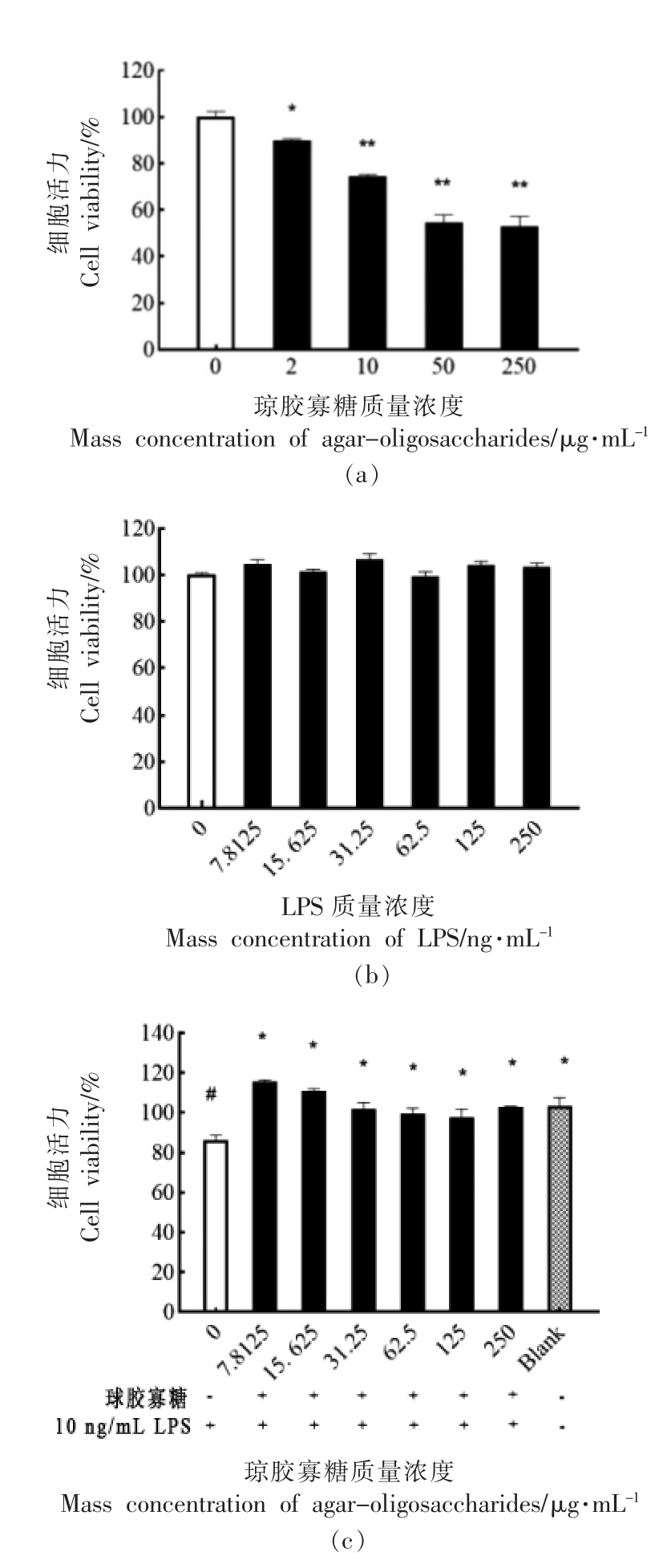
图5 琼胶寡糖对RAW264.7(a)和LPS 刺激RAW264.7(b)以及琼胶寡糖干预(c)对细胞活力的影响
Fig.5 Effect of agar-oligosaccharides on cell viability of RAW264.7(a) and LPS-treated RAW264.7(b)and agar-oligosaccharides intervention(c) respetively
注:与空白组(Blank)相比,# P<0.05;与对照组(图中琼胶寡糖添加量为0 μg/mL,LPS 诱导细胞炎症组)相比,*P<0.05,**P<0.01,下同。
2.3 琼胶寡糖对LPS 诱导RAW264.7 细胞产生NO 水平的影响
一氧化氮(NO)是LPS 诱导细胞炎症反应的过程中重要的炎症介质,随着炎症反应的增强,细胞产生的NO 量不断增加[25]。试验采用Griess 法检测细胞内产生的NO 水平,如图6所示,与空白组相比,10 ng/mL LPS 刺激后RAW264.7 细胞内NO水平显著增加(P<0.05),表明10 ng/mL LPS 能够诱导RAW264.7 细胞产生炎症反应;琼胶寡糖(7.8125~250 μg/mL) 干预处理组细胞内NO 水平明显低于对照组,且细胞内NO 产生量随着琼胶寡糖样品浓度的增加而呈下降趋势(P<0.05)。结果表明,琼胶寡糖对LPS 诱导细胞炎症反应过程中NO 的产生具有明显的抑制作用且呈浓度依赖,并且结合琼胶寡糖能够提高LPS 刺激RAW264.7 细胞活力的结果,表明其对NO 的抑制作用并非由对细胞的毒性作用而产生,而是来源于自身的活性作用,具有抑制细胞炎症的作用。研究报道,新琼脂糖寡糖单体,特别是新琼脂糖四糖可以显著降低LPS 诱导的巨噬细胞中NO 的产生和释放[15]。该新琼脂四糖表现出高抗炎活性IC50值为250 μg/mL,显著抑制了LPS 诱导巨噬细胞中TNF-α、IL-1β 和IL-6 促炎细胞因子的产生和释放,通过抑制MAPK 和NF-κB 通路抑制LPS 诱导巨噬细胞的炎症反应。而Zou 等[5]报道琼胶寡糖混合物[包括寡糖单体347.0953 m/z(C12H20NaO10;324 u+23 u;AO2+Na)、653.1910 m/z(C24H38NaO19;630 u+23 u;AO4+Na) 以及959.2848 m/z(C36H56NaO28;936 u+23 u;AO6+Na)]相比于寡糖单体具有更高的抗炎作用,其对LPS 诱导的RAW 264.7 细胞NO 产生抑制的IC50 值为12.5 μg/mL。而本研究中采用的分子质量分布为1 065.5~1 308.2 u 琼胶寡糖对LPS 诱导的RAW 264.7 细胞产生NO 的抑制IC50 值则为125 μg/mL。由此可见,琼胶寡糖对细胞炎症的作用受到结构、组分等多种因素的影响。
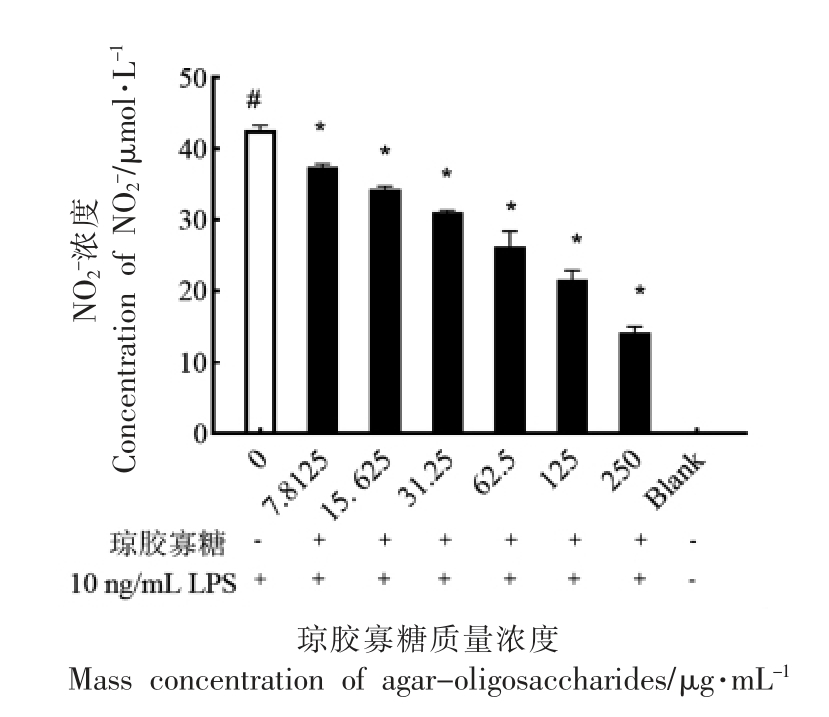
图6 琼胶寡糖对LPS 诱导RAW264.7 细胞内NO 产生的影响
Fig.6 Effect of agar-oligosaccharide on LPS-induced NO production in RAW264.7 cells
2.4 琼胶寡糖对LPS 诱导的RAW264.7 细胞内TNF-α 含量的影响
肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α),能够以自分泌的方式作用于单核细胞和巨噬细胞,与机体TLRs 受体、TNF 受体相互作用介导炎症。图7表明与空白组相比,10 ng/mL LPS诱导后RAW264.7 细胞内TNF-α 水平显著增加(P<0.05);琼胶寡糖(7.8125~250 μg/mL)干预处理组细胞内TNF-α 水平明显低于对照组,且随着琼胶寡糖样品浓度的增加而呈下降趋势(P<0.05)。结果表明,琼胶寡糖对炎症因子TNF-α 具有抑制作用,表现出潜在的抗炎作用。
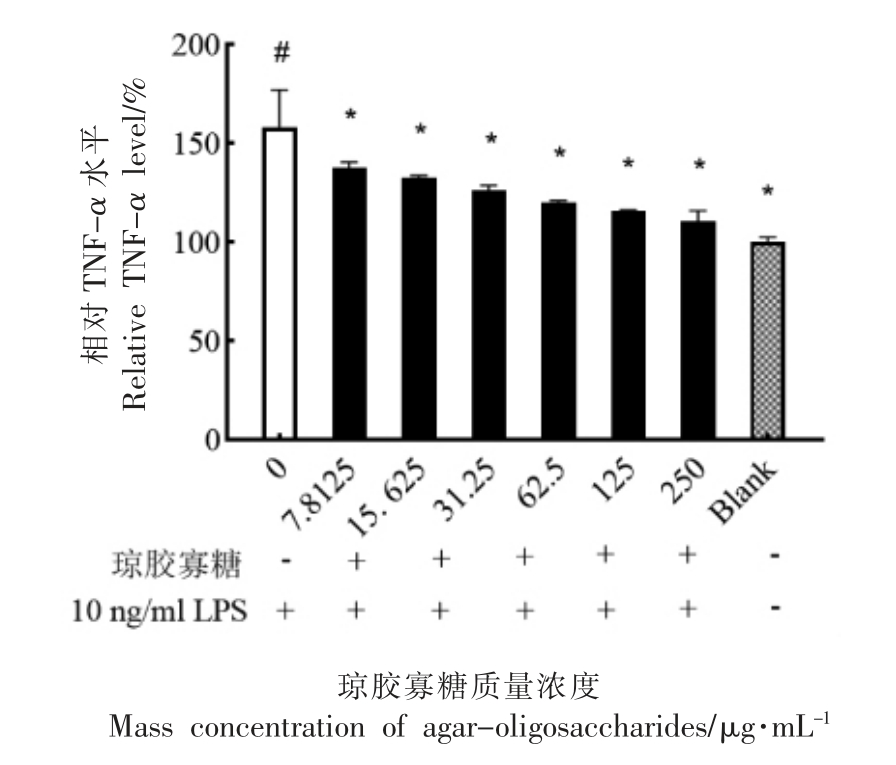
图7 琼胶寡糖对LPS 诱导RAW264.7 细胞内TNF-α 含量的影响
Fig.7 Effect of agar-oligosaccharide on LPS-induced TNF-α production in RAW264.7 cells
2.5 琼胶寡糖对LPS 诱导的RAW264.7 细胞内ROS 含量的影响
细胞内ROS 过量产生与炎症等病理状态密切相关,通过诱导细胞内促炎信号如MAPKs 起作用 [26-27]。本文利用二氯荧光乙酰乙酸盐(DCFHDA)探针通过细胞荧光强弱测定细胞内ROS 水平的高低。琼胶寡糖对RAW264.7 细胞内ROS 水平的影响如图8a 所示。RAW264.7 细胞的荧光强度随着琼胶寡糖的浓度升高而减弱,当寡糖浓度达到250 μg/mL 时RAW264.7 细胞内ROS 水平达到最低,荧光强度相当于空白组水平。基于荧光强弱换算各组的ROS 水平,如图8b 所示,与空白组相比,LPS 处理能够诱导RAW264.7 细胞内ROS 水平升高(P<0.05),而经不同浓度琼胶寡糖预处理后,LPS 诱导RAW264.7 细胞内ROS 的产生被显著抑制,并随着寡糖浓度升高而降低(P<0.05)。Zhou 等[28]研究发现GOS-OD(古罗糖醛酸寡糖)在0.1~2 mg/mL 的质量浓度下可显著抑制LPS 诱导细胞炎症反应过程中ROS 的过量产生,从而减缓细胞炎症反应。与上述研究一致,结果表明,琼胶寡糖能够有效降低LPS 诱导细胞炎症反应过程中ROS 的过量产生,从而减缓细胞炎症反应。

图8 琼胶寡糖对LPS 诱导RAW264.7 细胞内ROS 产生的影响
Fig.8 Effect of agar-oligosaccharides on LPS-induced intracellular ROS production in RAW264.7 cells
2.6 琼胶寡糖通过激活MAPKs 信号通路抑制LPS 诱导炎症发生
MAPKs 是生物体内重要的信号转导系统之一,主要包括ERK/JNK/SAPK、p38/RK 以及ERK/5BMK1 4 个MAPKs 亚族,其中通过ERK、JNK 和p38 介导的MAPKs 信号激活被认为与炎症介质释放、炎症的发生与发展密切相关[29-31]。本试验利用琼胶寡糖(250 μg/mL) 预处理巨噬细胞系RAW264.7,再加入LPS 刺激细胞,提取全蛋白采用Western Blot 检测琼胶寡糖对LPS 诱导的MAPKs 信号通路活化的影响。结果如图9所示,LPS 刺激后巨噬细胞RAW264.7 内JNK、ERK 与p38 磷酸化水平明显升高,提示LPS 通过巨噬细胞系RAW264.7 中MAPKs 家族激酶活化引起细胞炎症反应,这与前人的研究一致[29-31]。采用琼胶寡糖预处理后,LPS 诱导的MAKP 家族激酶JNK、ERK 以及p38 的磷酸化水平均显著降低。研究认为,ERK、p38 与JNK 激活参与了LPS 诱导的巨噬细胞促炎细胞因子的增加、TNF-α 基因的表达,阻断这3 条MAPK 通路中的任何一条都足以抑制LPS 诱导的炎症介质和细胞因子,从而减轻细胞炎症反应[32]。大多数文献报道显示,多糖或寡糖对LPS 诱导巨噬细胞的抗炎作用与MAPK 信号通路转导的阻断密切相关。Lu 等[32]从茯苓多糖根茎中分离纯化出SGP-1 和SGP-2 两个组分,探讨其是否通过MAPK 途径抑制LPS 诱导RAW264.7 的炎症,结果表明,SGP-1 和SGP-2 对促炎介质的抑制作用是通过ERK 和JNK 途径实现的。Ma 等[33]研究发现壳寡糖抑制了LPS 诱导的巨噬细胞中p38、ERK、JNK 磷酸化,可能是壳寡糖抑制LPS 诱导巨噬细胞中促炎细胞因子IL-6 和TNF-α 过度产生的原因。与此类似,由本文上述的研究结果可知,琼胶寡糖能够降低LPS 诱导的JNK、ERK 以及p38/MAKP 家族激酶的磷酸化水平,其对这3条MAPK 信号通路转导的阻断作用可能是上述炎症反应减缓的原因所在。
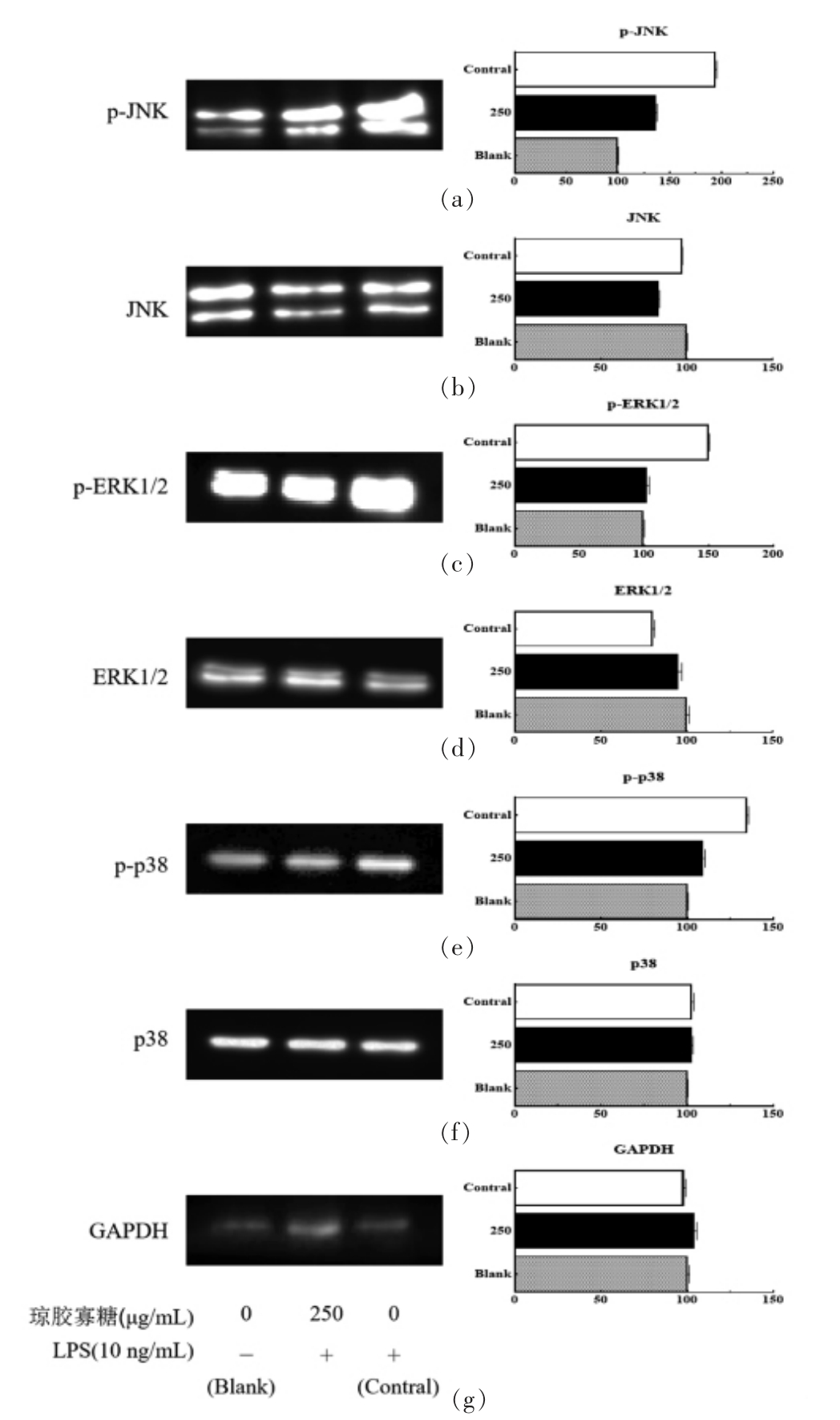
图9 琼胶寡糖对LPS 诱导RAW264.7 细胞中MAPKs 活化的影响
Fig.9 Activation of MAPKs in LPS - simulated RAW264.7 via agar-oligosaccharides
3 结论
本文研究琼胶寡糖对脂多糖诱导小鼠单核巨噬细胞RAW264.7 的炎症反应的抑制作用及机制。结果表明,琼胶寡糖在测定质量浓度范围内(0~250 μg/mL) 对RAW264.7 细胞活力无显著影响,能够提高LPS 刺激后RAW264.7 细胞活力,剂量依赖性地抑制LPS 诱导的RAW264.7 细胞中NO、TNF-α 和ROS 的生成,减轻炎症反应,从而证实了其在预防治疗炎症性疾病中的可能性。同时,LPS 诱导RAW264.7 细胞的炎症反应主要通过MAPK 信号转导,引起JNK、ERK、p38 等MAPK 家族激酶的磷酸化水平显著升高。采用琼胶寡糖预处理后,LPS 诱导的JNK、ERK、p38 等MAPK 家族激酶的磷酸化水平被明显抑制,提示琼胶寡糖可通过抑制LPS 介导的MAPKs 信号通路的激活发挥抗炎作用。本研究的结果可为丰富琼胶寡糖的食品营养学理论基础,为开发预防和辅助降低炎症反应的健康食品提供科学依据。未来仍需进一步研究琼胶寡糖发挥抗炎作用的特征结构及其细胞膜识别受体,定向设计与开发具有高活性抗炎作用的琼胶寡糖产物。
[1]CHEN L,DENG H,CUI H,et al.Inflammatory responses and inflammation -associated diseases in organs[J].Oncotarget,2015,9(6):7204-7218.
[2]HENDRAYANI S F,AL-HARBI B,AL-ANSARI M M,et al.The inflammatory/cancer-related IL-6/STAT3/NF-κB positive feedback loop includes AUF1 and maintains the active state of breast myofibroblasts[J].Oncotarget,2016,7(27):41974-41985.
[3]HANKITTICHAI P,BUACHEEN P,PITCHAKARN P,et al.Artocarpus lakoocha extract inhibits LPSinduced inflammatory response in RAW 264.7 macrophage cells[J].International Journal of Molecular Sciences,2020,21(4):1355.
[4]王晶,徐颖,张庆.青蒿乙素对脂多糖诱导小鼠单核巨噬细胞RAW264.7 炎症反应的抑制及机制[J].华西药学杂志,2021,36(1):39-43.
WANG J,XU Y,ZHANG Q.Anti-inflammatory effect and mechanism of arteannuin B on LPS-stimulated RAW264.7 macrophages[J].West China Journal of Pharmaceutical Sciences,2021,36(1):39-43.
[5]ZOU Y,FU X,LIU N,et al.The synergistic antiinflammatory activities of agaro-oligosaccharides with different degrees of polymerization[J].Journal of Applied Phycology,2019,31(4):2547-2558.
[6]国家统计局.中国统计年鉴2020[M].北京:中国统计出版社,2020.
National Bureau of Statistics.China Statistical Yearbook 2020[M].Beijing:China Statistics Press,2020.
[7]张真庆,江晓路,管华诗.寡糖的生物活性及海洋性寡糖的潜在应用价值[J].中国海洋药物,2003,22(3):51-56.
ZHANG Z Q,JIANG X L,GUAN H S.Bioactivities of oligosaccharides and the potential application of marine oligosaccharides[J].Chinese Journal of Marine Drugs,2003,22(3):51-56.
[8]HIGASHIMURA Y,NAITO Y,TAKAGI T,et al.Protective effect of agaro -oligosaccharides on gut dysbiosis and colon tumorigenesis in high-fat dietfed mice[J].American Journal of Physiology.Gastrointestinal and Liver Physiology,2016,310(6):367-375.
[9]WANG X,YANG Z,XU X,et al.Odd-numbered agaro-oligosaccharides alleviate type 2 diabetes mellitus and related colonic microbiota dysbiosis in mice[J].Carbohydrate Polymers,2020,240(7):1-15.
[10]ZHANG X,AWEYA J J,HUANG Z,et al.In vitro fermentation of Gracilaria lemaneiformis sulfated polysaccharides and its agaro -oligosaccharides by human fecal inocula and its impact on microbiota[J].Carbohydrate Polymers,2020,234(4):1-9.
[11]LIN F,YANG D,HUANG Y,et al.The potential of neoagaro-oligosaccharides as a treatment of type II diabetes in mice[J].Marine Drugs,2019,17(10):541.
[12]陈海敏,严小军.琼脂寡糖对糖尿病小鼠血糖和氧化-抗氧化态的效应[J].营养学报,2006,28(2):152-155.
CHEN H M,YAN X J.Effect of agar-oligosaccharides on blood glucose level and oxidation-antioxidation status of diabetic mice[J].Acta Nutrimenta Sinica,2006,28(2):152-155.
[13]KANG O L,GHANI M,HASSAN O,et al.Novel agaro-oligosaccharide production through enzymatic hydrolysis:Physicochemical properties and antioxidant activities[J].Food Hydrocolloids,2014,42(2):304-308.
[14]HIGASHIMURA Y,NAITO Y,TAKAGI T,et al.Oligosaccharides from agar inhibit murine intestinal inflammation through the induction of heme oxygenase-1 expression[J].Journal of Gastroenterology,2013,48(8):897-909.
[15]WANG W,LIU P,HAO C,et al.Neoagaro -oligosaccharide monomers inhibit inflammation in LPS-stimulated macrophages through suppression of MAPK and NF-κB pathways[J].Scientific Reports,2017,7(3):1-11.
[16]陈岩君.低聚合度褐藻寡糖的分离制备及其脂蛋白代谢影响初步研究[D].无锡:江南大学,2018.
CHEN Y J.Preparation and regulation in lipoprotein metabolism of alginate oligosaccharides[D].Wuxi:Jiangnan University,2018.
[17]JIANG Z,YU G,BAO Q Y,et al.Macrophagestimulating activities of a novel low molecular weight saccharide fragment prepared from ascophyllan with alginate lyase[J].Journal of Functional Foods,2020,67(4):1-12.
[18]IWONA Z.The effect of selenium,as selenite,on vanadate-induced ROS generation in CHO-K1 cells measured using dichloro-dihydro-fluorescein diacetate(DCFH-DA) assay[J].Trace Elements and Electrolytes,2018,35(3):136-141.
[19]LEE J H,AHN D U,PAIK H D.In Vitro immune-enhancing activity of ovotransferrin from egg white via MAPK signaling pathways in RAW 264.7 macrophages[J].Korean Journal for Food Science of Animal Resources,2018,38(6):1226-1236.
[20]LIN F,YE J,HUANG Y,et al.Simple preparation of diverse neoagaro-oligosaccharides[J].Processes,2019,7(5):267.
[21]张伟宾,刘丹,许竞男,等.琼胶寡糖鉴定方法的研究进展[J].中国海洋药物,2017,36(6):96-102.
ZHANG W B,LIU D,XU J N,et al.An review on the identiffication methods for types of agaroligosaccharides[J].Chinese Journal of Marine Drugs,2017,36(6):96-102.
[22]MEI J,SHAO J,WANG Q,et al.Separation and quantification of neoagaro-oligosaccharides[J].Journal of Food Science & Technology,2013,50(6):1217-1221.
[23]周静,王轶楠,柳忠辉,等.脂多糖诱导小鼠巨噬细胞系RAW264.7 细胞的活化凋亡作用[J].中国生物制品学杂志,2009,22(2):136-138.
ZHOU J,WANG Y N,LIU Z H,et al.Activation-induced apoptosis of mouse macrophage RAW264.7 by lipopolysaccharide[J].Chinese Journal of Biologicals,2009,22(2):136-138.
[24]WANG L,OH J Y,JAYAWARDENA T U,et al.Anti-inflammatory and anti-melanogenesis activities of sulfated polysaccharides isolated from Hizikia fusiforme:Short communication[J].International Journal of Biological Macromolecules,2020,142(1):545-550.
[25]WANG Y,JIANG Z,KIM D,et al.Stimulatory effect of the sulfated polysaccharide ascophyllan on the respiratory burst in RAW264.7 macrophages[J].International Journal of Biological Macromolecules,2013,52(1):164-169.
[26]BRÜNE B,DEHNE N,GROSSMANN N,et al.Redox control of inflammation in macrophages[J].Antioxidants & Redox Signaling,2013,19(6):595-637.
[27]YONG S,YONG KWAN C,NAM HO K,et al.Mitogen-activated protein kinases and reactive oxygen species:How can ROS activate MAPK pathways?[J].Journal of Signal Transduction,2011(2):1-6.
[28]ZHOU R,SHI X,GAO Y,et al.Anti-inflammatory activity of guluronate oligosaccharides obtained by oxidative degradation from alginate in lipopolysaccharide -activated murine macrophage RAW 264.7 cells[J].Journal of Agricultural and Food Chemistry,2015,63(1):160-168.
[29]姜勇,龚小卫.MAPK 信号转导通路对炎症反应的调控[J].生理学报,2000,52(4):267-280.
JIANG Y,GONG X W.Regulation of inflammatory responses by MAPK signal transduction pathways[J].Acta Physiologica Sinica,2000,52(4):267-280.
[30]GUO W,SUN J,JIANG L,et al.Imperatorin attenuates LPS-induced inflammation by suppressing NF -κB and MAPKs activation in RAW 264.7 macrophages[J].Inflammation,2012,35(6):1764-1772.
[31]PARK Y J,CHEON S Y,LEE D S,et al.Antiinflammatory and antioxidant effects of Carpesium cernuum L.methanolic extract in LPS -stimulated RAW 264.7 macrophages [J].Mediators of Inflamma tion,2020(8):1-14.
[32]LU C,ZHU W,WANG M,et al.Polysaccharides from Smilax glabra inhibit the pro-inflammatory mediators via ERK1/2 and JNK pathways in LPS-induced RAW264.7 cells[J].Carbohydrate Polymers,2015,122(5):428-436.
[33]MA P,LIU H T,WEI P,et al.Chitosan oligosaccharides inhibit LPS-induced over-expression of IL-6 and TNF -α in RAW264.7 macrophage cells through blockade of mitogen-activated protein kinase(MAPK) and PI3K/Akt signaling pathways[J].Carbohydrate Polymers,2011,84(4):1391-1398.