黄酒,作为中华民族特有的酒种,是经加曲和部分酶制剂、酵母等糖化发酵剂酿制成的发酵酒[1]。醇、醛、酯、酸等物质丰富了黄酒酒体的醇厚性和典型性。β-苯乙醇,作为芳香醇的一种,是黄酒酿造过程中酿酒酵母代谢产生的主要副产物之一,在黄酒中含量为40~180 mg/L[2-3],可赋予黄酒特有的醇香风味,其含量较高时会产生致醉性[4]。在以黄酒为主要原料的料酒等调味品中,β-苯乙醇具有提升食物香味的作用[5],说明β-苯乙醇在食品工业中具有十分重要的作用。
酿酒酵母合成β-苯乙醇是通过莽草酸途径和艾利希途径的一系列酶催化[6]。艾利希途径中,酿酒酵母可将底物L-苯丙氨酸,通过转氨酶的作用将其氨基转移形成苯丙酮酸,然后通过脱羧酶的脱羧作用形成苯乙醛,最后再由脱氢酶催化还原成β-苯乙醇[7],而另一条莽草酸代谢途径中,由于反应途径复杂,存在多种抑制作用,导致β-苯乙醇产量很低[8]。近几年来关于β-苯乙醇合成途径中关键基因的作用研究较多[9-11]。福田等[12-14]比较了清酒酵母突变菌株和亲本在β-苯乙醇合成途径中的一系列酶的酶活变化,确定了突变菌种中引起β-苯乙醇产量提高的关键酶,进一步研究了关键酶的相关基因,其中包括能够引起β-苯乙醇高产的突变基因。也有研究 [15] 发现黄酒酵母HJ01 预苯酸脱水酶PDT 的3 个碱基突变使其表现出较高的底物亲和力、催化效率等。醇脱氢酶作为两条途径中关键酶,在同型酒精发酵过程中催化产乙醇[16],在艾利希途径中的最后催化杂醇醛(苯乙醛)脱羧形成β-苯乙醇[17-18],在β-苯乙醇合成调控过程中起到至关重要的作用[19]。目前对于黄酒中β-苯乙醇的合成调控机理以及合成途径中关键基因的研究较少[20]。
醇脱氢酶是黄酒酵母的β-苯乙醇合成调控的关键酶,探究黄酒酵母与酿酒酵母模式菌产的醇脱氢酶的差异性是必要的。本研究以工业生产菌株黄酒酵母(Saccharomyces cerevisiae)HJ 和模式菌株酿酒酵母(S.cerevisiae)S288C 的醇脱氢酶I(Alcohol dehydrogenase I,Adh1p)为研究对象,基于同源建模分析其三维结构的差异,通过分子生物学手段对比研究其酶学性质,以期为黄酒酵母关键酶的结构以及酶学性质分析提供方法和理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与质粒 酿酒酵母(Saccharomyces cerevisiae)S288C、黄酒酵母(Saccharomyces cerevisiae) HJ、大肠杆菌(Escherichia coli)BL21(DE3)、质粒pESI-T 和pET-28a(+),均为本实验室保存。已获得不含外源抗性基因且不能发生接合型转变的黄酒酵母HJ 单倍体菌株[21]。
1.1.2 试剂 T4 DNA 连接酶、DNA 聚合酶、Nde I 内切酶、BamH I 内切酶,美国ThermoFisher Scientific 公司;DNA 凝胶电泳回收试剂盒(纯化回收DNA 片段)、质粒小量提取试剂盒,天根生化科技(北京)有限公司;酵母膏、蛋白胨、酸洗玻璃珠,西格玛奥德里奇(上海)贸易有限公司;氯化钠,国药集团化学试剂有限公司;苯乙醛、焦磷酸硫胺素、β-NADH、乙醇脱氢酶、咪唑、IPTG,上海阿拉丁生化科技股份有限公司;其它试剂均为分析纯生化试剂。
1.2 仪器与设备
AKTA pure 蛋白纯化系统、His TrapTM HP(1 mL)色谱柱,美国GE 公司;三头梯度PCR 仪,江苏舜天国际集团机械进口股份有限公司;Amicon-Ultra-15 超滤管(15 mL,30 ku),美国Milipore 公司;超声波破碎仪,美国SONICS&MATERIALS 公司;凝胶成像仪,美国Bio-Rad 公司。
1.3 方法
1.3.1 酵母基因组提取 酿酒酵母(Saccharomyces cerevisiae)S288C 和黄酒酵母(Saccharomyces cerevisiae) HJ 菌株在活化后,接种至酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD) 培养基中28 ℃、180 r/min 条件下培养过夜。在OD600nm 达到2.0~3.0 时,离心收集菌体,参照赵宏宇等[22]用珠磨法提取酵母基因组。
1.3.2 醇脱氢酶Adh1p 氨基酸序列与三维结构分析 使用蛋白质同源建模在线服务器SWISSMODEL(https://swissmodel.expasy.org/)构建醇脱氢酶Adh1p 的三维结构模型,获取同源建模数据。使用DNAMAN 工具进行氨基酸序列比对分析和引物设计。使用PyMOL 软件进行蛋白结构分析,使用SnapGene 工具进行质粒图谱分析。
1.3.3 重组质粒构建 根据酿酒酵母 S288C 基因序列(NCBI Gene ID:854068)和黄酒酵母HJ的相应醇脱氢酶基因ADH1 编码区序列设计引物,该序列全长为1 047 bp。上游引物序列:5’-GGGAATTCCATATGATGTCTATCCCAGAAACTCA-3’;下游引物序列:5’-GGATCCTTATTTAGAAGTGTCAACAA -3’。下划线序列分别为NdeI和BamHI 的酶切位点,引物由生工生物工程(上海)股份有限公司合成。
利用NdeI 和BamHI 限制性内切酶对pESIT-S288C-ADH1 和pESI-T-HJ-ADH1 质粒进行双酶切并回收目的基因产物。T4 连接酶将目的基因产物与pET-28a(+)空质粒连接构建pET-28a(+)-S288C-ADH1 和pET-28a(+)-HJ-ADH1 重组质粒,质粒提取后做双酶切验证。将重组质粒转入大肠杆菌BL21(DE3)感受态细胞[23]。选取阳性单克隆菌,在含有50 μg/mL 卡那霉素的LB 液体培养基中过夜培养,将菌液送去苏州金唯智生物科技公司测序鉴定,扩培,于-80 ℃甘油管冷藏。
1.3.4 重组工程菌的诱导表达和粗酶液的获取将保藏的阳性克隆菌,分别接种到含终质量浓度为50 μg/mL 卡那霉素的LB 液体培养基中(接种量1%),37 ℃170 r/min 振荡培养12 h。将活化好的种子液取出,转接于50 mL 含终质量浓度为50 μg/mL 卡那霉素的TB 液体培养基中(接种量5%),37 ℃170 r/min 振荡培养3 h,加入诱导剂IPTG 至终浓度为0.5 mmol/L,降温至25 ℃诱导12 h。
取菌液至无菌离心管中,4 ℃12 000 r/min 离心10 min 去上清,收集沉淀菌体,用0.2 mol/L 磷酸缓冲盐溶液(phosphate buffer saline,PBS)(pH 7.5)洗涤2 次,吹打重悬菌体,冰浴条件下超声波破碎(超声条件:400 W,工作1 s,间隔2 s,总破碎时间30 min),破碎至菌液澄清透光。4 ℃12 000 r/min 离心20 min 收集上清,即粗酶液,留样进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(Sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)分析[24]。
1.3.5 蛋白亲和层析纯化 采用AKTA pure 仪器分离纯化目的蛋白,流速为1 mL/min。结合缓冲液对镍柱进行平衡,上样5 mL 的过膜粗酶液,10倍柱体积的洗脱缓冲液进行线性洗脱,最后用结合缓冲液对镍柱再次平衡。分别收集出峰处的蛋白,用SDS-PAGE 检测洗脱蛋白的分子质量大小和纯度。将收集的洗脱液置于超滤管中4 ℃,4 000 r/min 离心30 min 脱盐浓缩。蛋白含量检测采用Bradford 法[25]。
1.4 醇脱氢酶Adh1p 的酶学性质分析
1.4.1 醇脱氢酶Adh1p 酶活测定与计算 用分光光度计测定辅酶NADH 在340 nm 处的吸光值变化值OD340nm[26]。反应体系包括终浓度为20 mmol/L Na2HPO4-NaH2PO4 缓冲液(pH 7.5),0.35 mmol/L NADH,2 mmol/L 的底物和纯酶。将无酶反应体系在37 ℃孵育5 min,然后置于分光光度计中,读数稳定后立即加入纯酶,开始计数,反应15 min,得到OD340nm,计算公式如下:
式中:V——反应体系体积(mL);OD340nm——吸光度差值;t——反应时间(min);ε——NADH的摩尔消光系数【6.22×103 L/(mol·min)】;b——光程(cm)。
1 个酶活力单位(U) 定义为1 min 减少1 μmol 的辅酶NADH 所需的酶量。比酶活(U/g)定义为每克酶所具有的酶活力单位。
1.4.2 pH 值对醇脱氢酶Adh1p 酶活的影响及其稳定性 配制不同pH 值的缓冲液:20 mmol/L Na2CO3-NaHCO3 缓冲液(pH 9.0~10.0)、20 mmol/L Tris-HC1 缓冲液(pH 8.0~9.0)、20 mmol/L Na2HPO4-柠檬酸缓冲液(pH 3.0~8.0)。为研究pH值对醇脱氢酶Adh1p 酶活的影响,将底物苯乙醛置于不同pH 值的缓冲液反应体系中,孵育5 min后立即加入40 μL(蛋白浓度调整至50 μg/mL)的纯酶。Adh1pS288C 最高的酶活力定义为100%,其对应的pH 值为最适反应pH 值。为研究醇脱氢酶Adh1p 的pH 值稳定性,将纯酶液孵育在不同pH值的缓冲液中1 h,测定相对酶活。Adh1pS288C 最高的酶活力定义为100%,其对应的pH 值为最稳定pH 值。绘制重组醇脱氢酶Adh1p 的pH-相对酶活图。
1.4.3 温度对醇脱氢酶Adh1p 酶活的影响及其稳定性 将含有底物苯乙醛的反应体系在最适pH值下孵育5 min 后,在不同温度(15,20,25,30,35,40,50,60,70 ℃) 条件下测定醇脱氢酶Adh1p的酶活。Adh1pS288C 最高的酶活定义为100%,其对应的温度为最适反应温度。将重组醇脱氢酶Adh1p 酶液分别在不同的温度(20,30,35,40,50,60,70 ℃)中孵育1 h,在最适反应pH 值和温度条件下测定残余的相对酶活。Adh1pS288C 最高的酶活定义为100%,其对应的温度为最稳定温度。绘制重组醇脱氢酶Adh1p 的温度-相对酶活图[27]。
1.4.4 醇脱氢酶Adh1p 的动力学参数 以0~5 mmol 的苯乙醛和乙醛为底物进行酶学动力学研究。使用Origin 软件对所获数据进行非线性拟合回归[28],利用双倒数作图法(Lineweaver-Burk)计算得Km,Vmax 和kcat/Km。
1.4.5 外源添加末端产物对酶活的影响 以苯乙醛和乙醛为底物,分别在酶测体系中加入不同体积分数的乙醇(0~20%)和苯乙醇(0~300 mg/L),测定酶活。未添加末端产物乙醇和苯乙醇的Adh1pS288C 的酶活分别定义为100%。绘制重组醇脱氢酶Adh1p 的外源物质-相对酶活图。
1.5 数据分析处理
采用凝胶成像仪对电泳图进行分析。使用Origin 2019 软件对数据进行统计分析,GraphPad Prism 8.0.2 进行显著性差异分析。
2 结果与分析
2.1 醇脱氢酶Adh1p 的氨基酸序列与同源建模结构分析
将ADH1HJ 的氨基酸序列导入SWISS-MODEL 在线服务器,同源建模结果发现,ADH1HJ 与酿酒酵母醇脱氢酶I(PDB:4W6Z) 的相似度达98.85%,与巴斯德毕赤酵母(Komagataella phaffii)GS115 的线粒体醇脱氢酶同工酶III(PDB:5YAT)的相似度达72.91%。Raj 等[29]研究显示酵母醇脱氢酶I(PDB:4W6Z)是由347 个氨基酸残基组成的具有4 个背靠背亚基的同源四聚体。不对称单位包含4 个不同的亚基,排列成相似的二聚体。如图2a 所示,晶胞中含有两种由"背靠背"二聚体组成的四聚体,四聚体二聚体亚基的不对称性提供2 个似乎与催化机制相关的结构。结构中包括8个锌离子,如图1所示,即催化锌结合残基结合的活性位点残基(Cys-43、Cys-153、His-66 和Glu-67),结构锌结合残基(Cys-97、Cys-100、Cys-103和Cys-111)。2,2,2-三氟乙醇的氧以经典的四面体与Cys-43,Cys-153 和His-66 配位连接到催化锌上。相反,具有开放的构象的亚基,没有结合辅酶,催化锌与Cys-43、Cys-153、His-66 和Glu-67的羧酸盐具有交替的反向配位。通过调节 Glu-67 与锌的相互作用将会促进水、醇和醛的配体交换。如图2b 所示,棍状结构表示的Gly-177~Gly-183 和Val-268~Gly-Met-270 为辅酶NAD,Asn-31~Ala-136 为酵母醇脱氢酶I 结构N 端,Gly-181~Ala-309 为酵母醇脱氢酶I 结构C 端。底物结合位点如图2c 所示。几个大的疏水残基Trp-55、Trp-93、Met-271 和Tyr-295 产生1 个空腔可容纳底物,预测可能为黄酒酵母醇脱氢酶Adh1pHJ的底物的结合区域。将氨基酸序列输入DNAMAN中进行同源序列对比发现,ADH1HJ 和4W6Z(ADH1S288C)氨基酸序列在位点58(V-T),127(QE),147(Q-E),151(I-V)处共有4 个氨基酸有差异。醇脱氢酶的每个亚基都由两个结构域组成,辅酶结合结构域(又称生物有机催化结构域)和催化活性结构域(又称生物无机催化结构域),辅酶结合结构域具有Rossnman 折叠,能通过氨基酸残基上的官能团与辅酶相互作用而使辅酶(NAD+/NADH)结合在醇脱氢酶上。催化活性结构域结合的催化活性Zn2+能与许多底物相结合,这两个结构域大小不等,催化活性结构域的氨基酸数占整个肽链的60%,辅酶结合结构域占40%[30]。Mlejnek等[31]发现氨基酸残基序列的143~283 为辅酶结合区域,氨基酸残基序列的1~142 和284~336 为催化活性区域。结合Zhang 等[32]对巴斯德毕赤酵母GS115 的线粒体醇脱氢酶同工酶III KpADH3(PDB:5YAT)研究,预测差异氨基酸可能位于催化活性区域,这可能会导致醇脱氢酶Adh1p 的酶学性质发生改变。
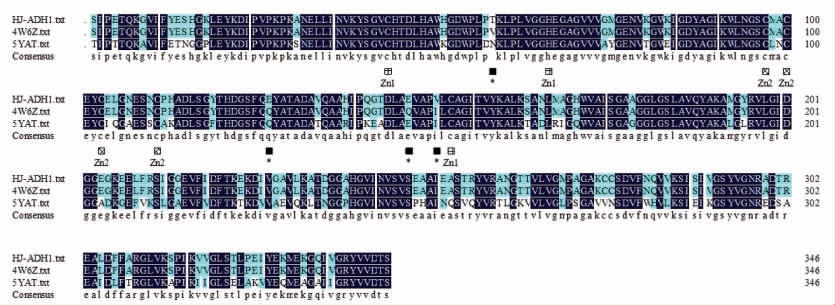
图1 氨基酸序列对比图
Fig.1 Comparison of amino acid sequences
注:*:差异氨基酸位点;Zn1:催化锌结合残基结合的活性位点残基;Zn2:结构锌结合残基结合的活性位点残基。

图2 三维结构模拟图
Fig.2 3D structure simulation
2.2 重组质粒载体的构建
以黄酒酵母HJ 和酿酒酵母S288C 的cDNA为模板,设置引物后扩增目的基因片段,并在该基因的5’端和3’端分别引入酶切位点BamH I 和Nde I。经TA 克隆后,命名为pESI-ADH1HJ 和pESI-ADH1S288C。经菌落PCR 筛选出阳性转化子,电泳结果见图3a。通过对pESI-ADH1HJ 和pESIADH1S288C 与pET28a 空载质粒酶切和胶回收,连接和转化等步骤获得重组质粒,将其导入大肠杆菌BL21(DE3)后,此基因工程菌命名为pET-28a(+)-ADH1HJ 和pET-28a(+)-ADH1S288C。构建过程中酶切验证的电泳鉴定结果如图3b 所示,重组表达载体经双酶切后在5 000 bp 和1 000 bp 附近均出现单一条带,其中5 000 bp 附近为载体pET-28a 条带,1 000 bp 附近为目的基因条带,经苏州金唯智生物科技公司测序鉴定为目的基因,表明该重组表达载体构建成功,符合预期。pET-28a(+)-ADH1HJ 质粒图谱见图4,目的基因ADH1 两段为酶切位点BamH I 和Nde I,pET-28a(+)-ADH1HJ 全长为6 383 bp。

图3 重组质粒电泳验证图
Fig.3 Electrophoretic verification map of recombinant plasmid
注:(a):M:DNA Marker;泳道1、2:pESI-ADH1HJ 和pESI-ADH1S288CPCR 扩增产物电泳图。(b):M.DNA Marker;泳道1:空质粒pET-28a 单酶切;2:pET-28a-ADH1HJ 单酶切;3:pET-28a-ADH1S288C 单酶切;4:pET-28a-ADH1HJBamH I + Nde I 双酶切验证;5:pET-28a-ADH1S288CBamH I + Nde I 双酶切验证。
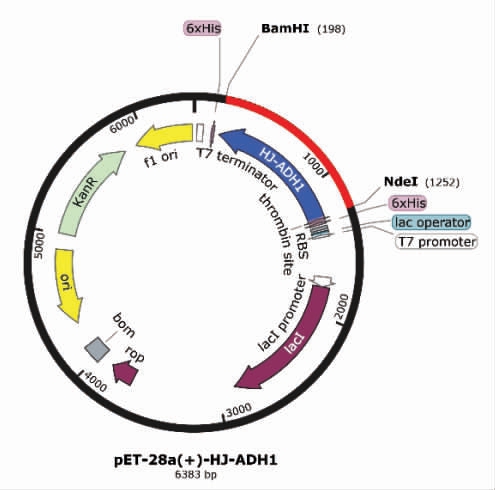
图4 pET-28a(+)-ADH1HJ 质粒图谱
Fig.4 Plasmid map of pET-28a(+)-ADH1HJ
2.3 重组菌的诱导表达与分离纯化
重组菌株的ADH1 基因编码341 个氨基酸,醇脱氢酶Adh1p 的分子质量约36.8 ku,重组表达载体实际表达为42.6 ku。粗酶液SDS-PAGE 结果如图5所示,在43 ku 处有特征条带出现,与预期设计蛋白分子质量一致,而对照无此条带,说明重组工程菌表达醇脱氢酶Adh1p 成功。
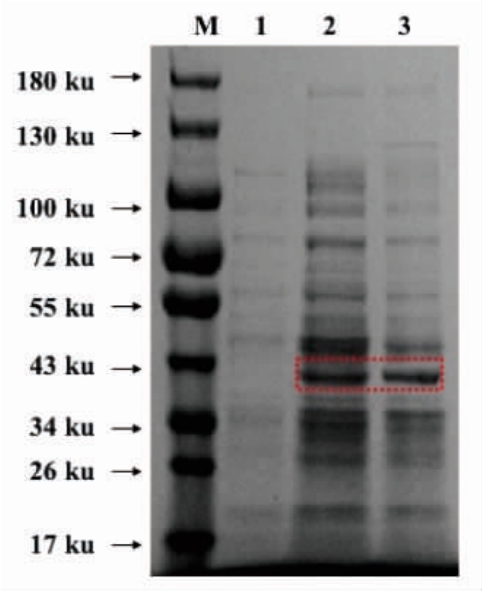
图5 粗酶液蛋白电泳图
Fig.5 Protein electrophoresis of crude enzyme solution
注:M:Protein Marker;泳 道1:空 质 粒pET-28a;泳 道2:Adh1pHJ 粗酶液;泳道3:Adh1pS288C 粗酶液。
预处理后通过亲和层析镍柱分离纯化目的蛋白,得到纯化色谱峰图6a,记录AKTA Pure 仪器上出峰位置所在的收集管,结果显示线性洗脱在约20%处,即100 mmol/L 咪唑的磷酸盐缓冲液开始出现单一色谱峰,进一步对纯化后的酶液进行超滤,离心浓缩溶于水中,调整蛋白浓度后SDSPAGE 结果显示Adh1pS288C 和Adh1pHJ 纯酶液在42.6 ku 处有单一条带,确认为目的条带。
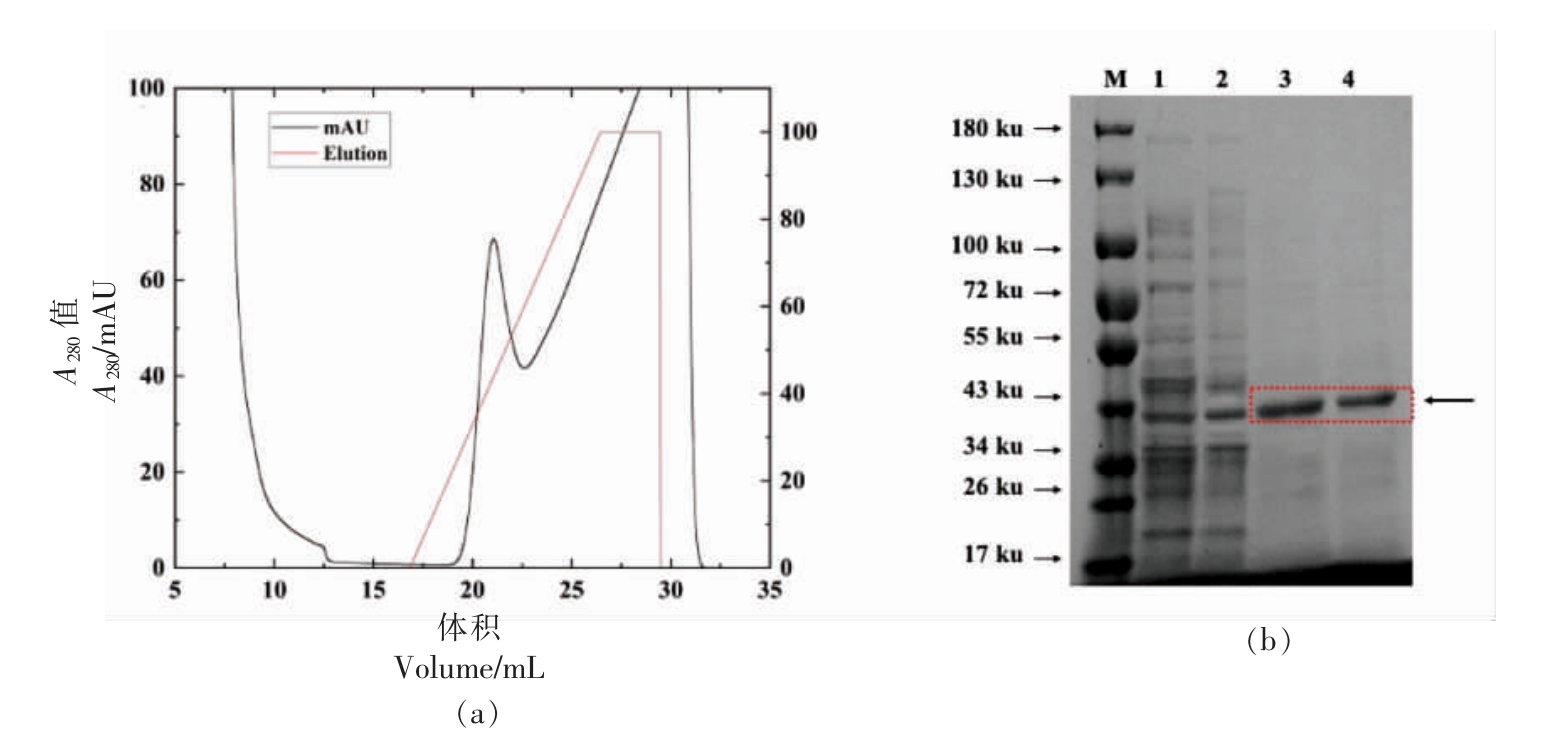
图6 酶液纯化过程图
Fig.6 Purification process of enzyme solution
注:(a)纯化色谱峰图;(b)M.Protein Marker;泳道1:Adh1pS288C 粗酶液;泳道2:Adh1pHJ 粗酶液;泳道3:Adh1pS288C 纯酶液;泳道4:Adh1pHJ 纯酶液。
2.4 醇脱氢酶Adh1p 酶学性质
2.4.1 醇脱氢酶Adh1p 的最适反应pH 值和稳定性 试验结果表明,Adh1p 的最适反应pH 值为7.5,结果如图7a 所示,在pH 3.0~7.5 范围,酶活随着pH 值的升高而提高,当pH 值大于7.5,酶活逐渐减弱。Adh1p 的最稳定pH 值为7.5。图7b 表明醇脱氢酶Adh1p 在pH 7.5~8.0 范围孵育1 h后,仍剩余80%以上的酶活,且Adh1pHJ 酶活相对略高于Adh1pS288C;在pH 3.0~5.0 的缓冲液中孵育2 h 后,剩余酶活不足40%,说明醇脱氢酶Adh1p在中性pH 值的条件下比较稳定。

图7 醇脱氢酶的最适pH 值和pH 值稳定性
Fig.7 Optimum pH and pH stability of alcohol dehydrogenase
2.4.2 醇脱氢酶Adh1p 的最适反应温度和稳定性 试验结果表明,Adh1p 的最适反应温度为40 ℃,Adh1pHJ 的酶活(231.51 U/g)比Adh1pS288C(203.48 U/g)高13.79%。结果如图8a 所示,15~40 ℃范围,酶活随温度的升高而提高,当温度高于40 ℃,酶活下降较快。Adh1p 的最稳定温度为30 ℃。图8b表明醇脱氢酶Adh1p 在20~35 ℃条件下孵育1 h后,仍剩余80%以上的酶活,当温度高于35 ℃时,酶活下降迅速;当温度高于60 ℃时,剩余酶活不足30%。
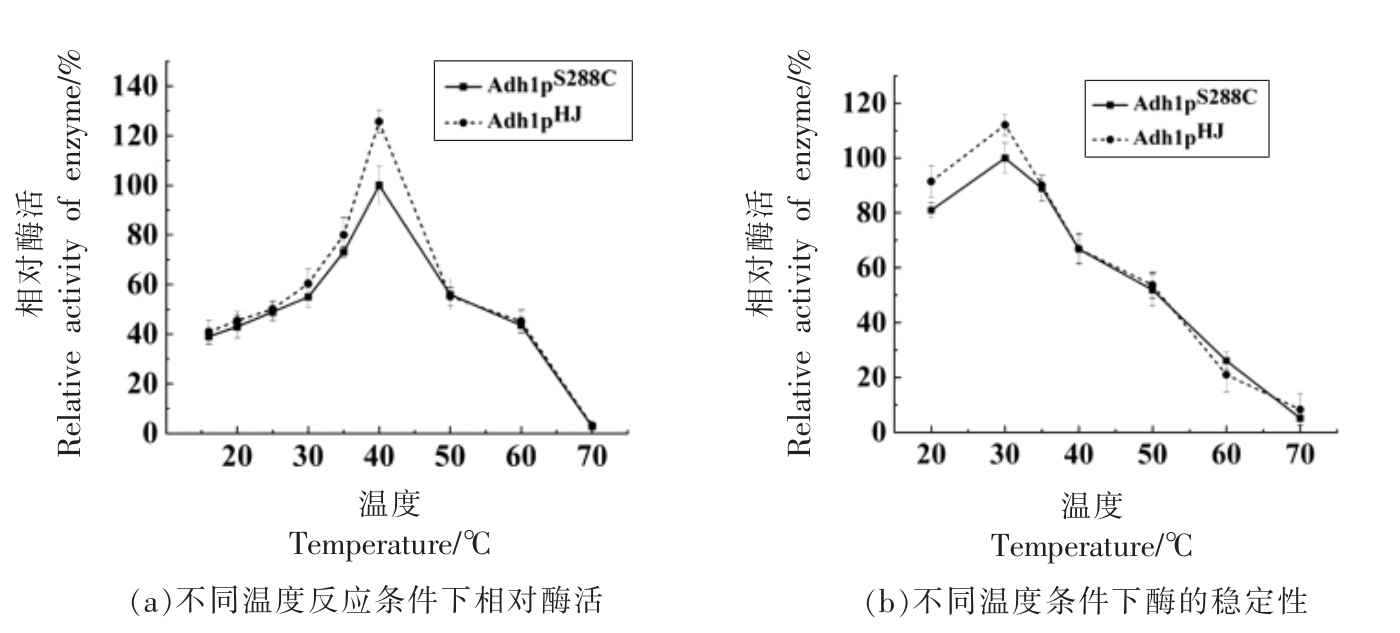
图8 不同温度下Adh1p 酶活以及稳定性分析图
Fig.8 Activity and stability of Adh1p at different temperatures
2.5 醇脱氢酶Adh1p 的酶学动力学分析
分别以0~5 mmol/L 的苯乙醛和乙醛为底物,测定酶反应的初速度,以底物浓度[S]为X 轴,速度v 为Y 轴进行曲线拟合,结果如图9所示。随着底物浓度的增加,醇脱氢酶Adh1p 被饱和。进而对Adh1pHJ 和Adh1pS288C 的酶促动力学结果进行分析,结果如图10所示。根据试验数据获得米氏方程,最终获得Km、Vmax 和kcat/Km 值。如表1所示:以苯乙醛为底物时,Adh1pS288C 的特征性常数Km 值(0.759 μmol/L)比Adh1pHJ 的Km 值(0.524 μmol/L)大,说明Adh1pHJ 与底物苯乙醛的亲和力相对于Adh1pS288C 较大。Adh1pHJ 的Vmax 值【299.40 μmol/(min·g)】 比Adh1pS288C 的Vmax 值 【289.86 μmol/(min·g)】略高,且Adh1pHJ 的kcat/Km 值【0.406 L/(μmol·min)】表现为较大,说明在同一底物苯乙醛的条件下,Adh1pHJ 的催化效率比Adh1pS288C 高。而以乙醛为底物时,Adh1pS288C 的Km 值(0.741 μmol/L),比Adh1pHJ 的Km 值(0.895 μmol/L)小,说明Adh1pS288C 与底物乙醛的亲和力比Adh1pHJ大。Adh1pHJ 的Vmax 值 【363.64 μmol/(min·g)】和kcat/Km 值【0.289 L/(μmol·min)】略比Adh1pS288C 的Vmax 值低,说明在同一底物乙醛的条件下,Adh1pHJ的催化效率低于Adh1pS288C。
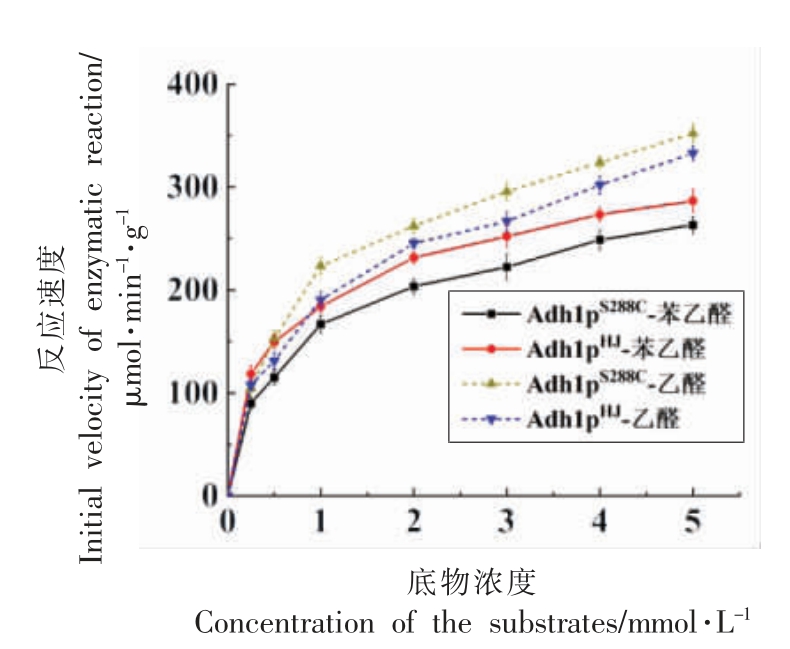
图9 底物与醇脱氢酶Adh1p 反应速度的非线性拟合回归图
Fig.9 Non-linear regression of substrate and reaction rate of Adh1p

图10 酵母模式菌株和黄酒酵母菌株中Adh1p 1/[S]-1/v 关系图
Fig.10 Relationship between Adh1p 1/[S]-1/v
表1 Adh1p 酶学参数分析
Table 1 Analysis of Adh1p enzymatic parameters

Adh1pS288C-苯乙醛 Adh1pHJ-苯乙醛 Adh1pS288C-乙醛 Adh1pHJ-乙醛Vmax/μmol·(min·g)-1 289.86 ± 3.51 299.40 ± 5.82 380.23 ± 8.34 363.64 ± 9.33 Km/μmol·L-1 0.76 ± 0.15 0.52 ± 0.19 0.74 ± 0.13 0.90 ± 0.11 kcat/Km/L·(μmol·min)-1 0.27 ± 0.06 0.41 ± 0.08 0.36 ± 0.05 0.29 ± 0.06
2.6 外源添加末端产物乙醇和β-苯乙醇对醇脱氢酶Adh1p 的酶活的影响
试验结果如图11a 所示,通过外源添加0~300 mg/L β-苯乙醇,醇脱氢酶Adh1p 对底物乙醛的脱羧反应仍保持高催化活性,且其在0~200 mg/L 质量浓度范围随β-苯乙醇的添加量而增加,Adh1pHJ 的相对酶活比Adh1pS288C 的相对酶活显著高,相比之下,黄酒酵母菌株的Adh1pHJ 耐受β-苯乙醇的能力相对来说高于酵母模式Adh1pS288C。而外源添加体积分数0~20%的乙醇,随体积分数的上升,醇脱氢酶对底物苯乙醛的脱羧反应的催化活性下降,在添加20%乙醇条件下,Adh1pS288C 的相对酶活剩余57.99%,Adh1pHJ 的相对酶活虽有所下降,但仍剩余82.21%。相比之下,黄酒酵母菌株的Adh1pHJ 耐受乙醇的能力相对高于酿酒酵母Adh1pS288C。
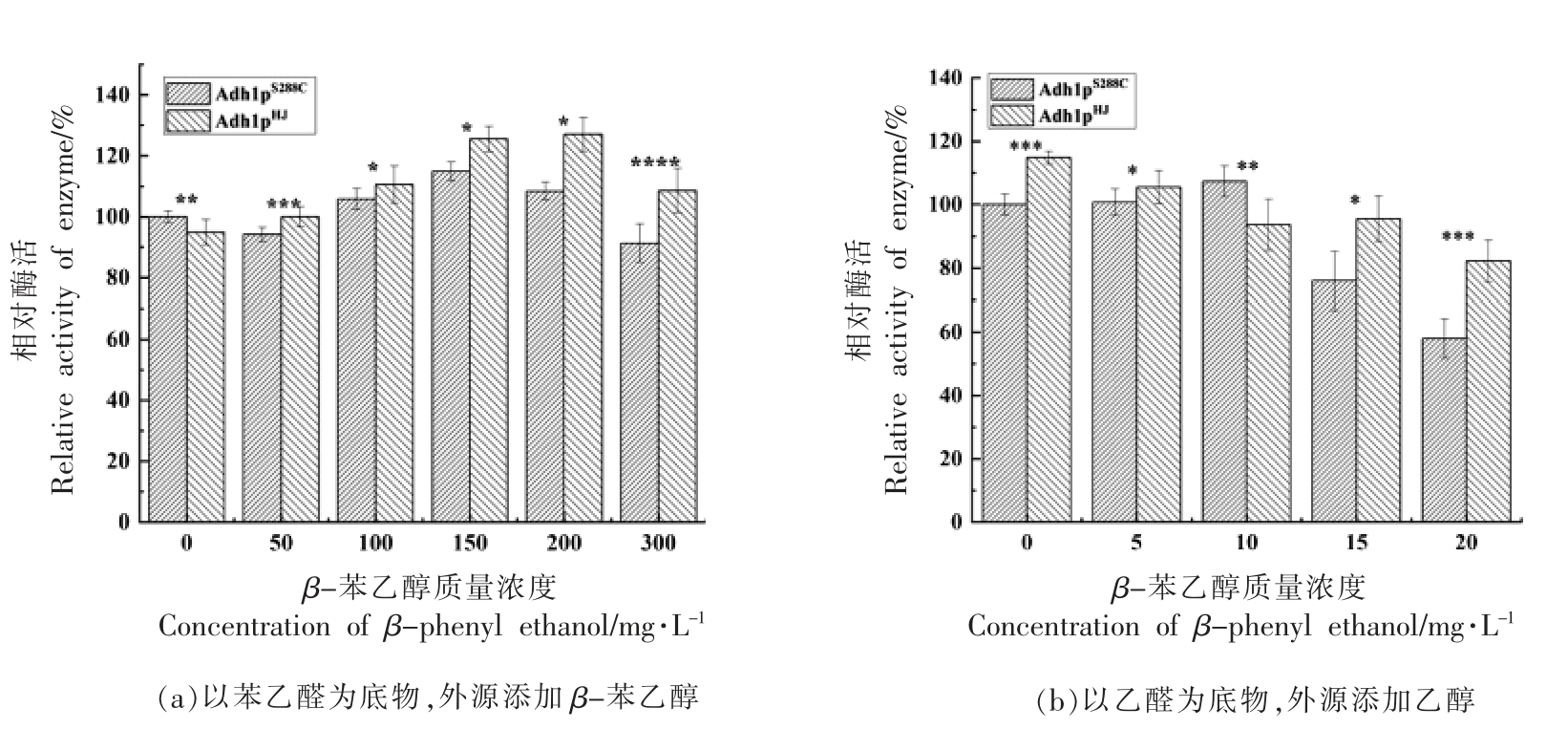
图11 外源添加末端产物对醇脱氢酶Adh1p 酶活的影响
Fig.11 Effect of exogenous end products on enzyme activity of Adh1p
注:* 表示P<0.05;** 表示P<0.01;*** 表示P<0.001;**** 表示P<0.0001。
3 结论
醇脱氢酶Adh1p 作为酵母合成β-苯乙醇的艾利希途径的最后一步的酶,催化杂醇醛还原成杂醇,是生物体内不可缺少的关键酶[33]。本研究发现工业菌株黄酒酵母HJ 和酿酒酵母S288C 的醇脱氢酶Adh1p 在催化活性区域具有4 位氨基酸差异,因此研究其酶学性质是必要的。通过构建重组表达载体,利用IPTG 诱导,大量表达目的蛋白[34-35]。通过亲和柱层析手段对目的蛋白进行分离纯化,得到高纯度的Adh1p。对纯化后的酿酒酵母模式菌株S288C 的Adh1pS288C 和黄酒酵母菌株HJ 的Adh1pHJ 的稳定性、动力学参数以及末端代谢产物对酶活的影响进行分析,结果表明:醇脱氢酶Adh1p 的最适反应pH 7.5,最适反应温度40 ℃。在最适条件下,Adh1pHJ 的酶活(231.51 U/g)比Adh1pS288C(203.48 U/g)高约13.79%。动力学分析结果表明,以苯乙醛为底物时,Adh1pHJ 与底物苯乙醛的亲和力大于Adh1pS288C,且Adh1pHJ 的催化效率也较大。而以乙醛为底物时,Adh1pS288C 与底物乙醛的亲和力和催化效率较小。外源添加0~300 mg/L β-苯乙醇的情况下,醇脱氢酶对底物乙醛的脱羧反应仍保持高催化活性,且黄酒酵母菌株的Adh1pHJ 耐受β-苯乙醇的能力相对来说高于酵母模式Adh1pS288C,而对底物苯乙醛的脱羧反应,乙醇抑制一定的酶活,其中黄酒酵母菌株Adh1pHJ 耐受乙醇的能力相对高于酵母模式Adh1pS288C。这些差异很可能是黄酒酵母醇脱氢酶Adh1pHJ 的氨基酸差异导致酶催化能力的改变,进而影响黄酒酵母中β-苯乙醇的合成。酵母细胞内的Ehrlich 途径的前两步L-苯丙氨酸通过脱氨基作用形成苯丙酮酸,进而脱羧生成相应苯乙醛,然后经还原反应形成β-苯乙醇。该途径的前两步反应的机制已基本清楚[8,36]。本文研究醇脱氢酶Adh1p 相关酶学性质,为探究黄酒酵母的β-苯乙醇的合成途径关键酶和编码基因以及合成调控机制提供靶点。
[1]JIAO A,XU X,JIN Z.Research progress on the brewing techniques of new-type rice wine[J].Food Chem,2017,215:508-515.
[2]荣绍丰,伍进,管世敏,等.生物合成天然2-苯乙醇细菌的筛选及合成途径分析[J].食品科学,2021,42(16):69-75.
RONG S F,WU J,GUAN S M,et al.Isolation of 2-phenylethanol-synthesizing bacteria and synthetic pathway analysis[J].Food Science,2021,42(16):69-75.
[3]陈双,罗涛,徐岩,等.我国黄酒酵母和酿酒原料对黄酒中β-苯乙醇含量的影响[J].中国酿造,2009(4):23-26.
CHEN S,LUO T,XU Y,et al.Effects of yeast strains and raw materials on β-phenylethanol production in Chinese rice wines[J].China Brewing,2009(4):23-26.
[4]周佳冰,张雅卿,刘双平,等.黄酒酵母在黄酒发酵过程中产芳香醇差异分析[J].酿酒科技,2020(10):30-37.
ZHOU J B,ZHANG Y Q,LIU S P,et al.Differential analysis of aromatic alcohol production performance of Huangjiuyeasts during fermentation[J].Liquor-Making Science & Technology,2020(10):30-37.
[5]李茜云.新型食用菌料酒的制备及功能性成分的研究[D].杭州:浙江农林大学,2018.
LI Q Y.Preparation of new edible fungus wine and study onfunctional components[D].Hangzhou:Zhejiang A&F University,2018.
[6]ETSCHMANN M M,BLUEMKE W,SELL D,et al.Biotechnological production of 2-phenylethanol[J].Appl MicrobiolBiotechnol,2002,59(1):1-8.
[7]LI S,YUYA N,FUMIO M,et al.Overexpressing enzymes of the Ehrlich pathway and deleting genes of the competing pathway in Saccharomyces cerevisiae for increasing 2 -phenylethanol production from glucose[J].J BiosciBioeng,2016,122(1):34-39.
[8]杨霄,崔志峰.酵母生物转化生产2-苯乙醇的研究进展[J].应用与环境生物学报,2006,12(1):140-144.
YANG X,CUI Z F.Progress in 2-phenylethanol production by biotransformation with yeast[J].Chinese Journal of Applied & Environmental Biology,2006,12(1):140-144.
[9]WANG Y,ZHANG Z,LU X,et al.Genetic engineering of an industrial yeast Candida glycerinogenes for efficient production of 2-phenylethanol[J].Appl Microbiol Biotechnol,2020,104(24):10481-10491.
[10]MARTÍNEZ-AVILA O,SÁNCHEZ A,FONT X,et al.2-phenylethanol(rose aroma) production potential of an isolated pichiakudriavzevii through solidstate fermentation[J].Process Biochemistry,2020,93:94-103.
[11]GUO D,ZHANG L,KONG S,et al.Metabolic engineering of escherichia coli for production of 2-phenylethanol and 2-phenylethyl acetate from glucose[J].J Agric Food Chem,2018,66(23):5886-5891.
[12]FUKUDA K,WATANABE M,ASANO K.Altered regulation of aromatic amino acid biosynthesis in βphenylethyl-alcohol-overproducing mutants of sake yeast Saccharomyces cerevisiae[J].Agricultural and Biological Chemistry,1990,54(12):3151-3156.
[13]FUKUDA K,WATANABE M,ASANO K,et al.A mutated ARO4 gene for feedback-resistant DAHP synthase which causes both o-fluoro-DL-phenylalanine resistance and beta-phenethyl-alcohol overproduction in Saccharomyces cerevisiae[J].Curr Genet,1991,20(6):453-456.
[14]FUKUDAK,WATANABE M,ASANOK,et al.Molecular breeding of a sake yeast with a mutated ARO4 gene which causes both resistance to o-fluoro-dl-phenylalanine and increased production of βphenethyl alcohol[J].Journal of Fermentation and Bioengineering,1992,73(5):366-369.
[15]LIU S,YANG Q,MAO J,et al.Feedback inhibition of the prephenate dehydratase from Saccharomyces cerevisiae and its mutation in huangjiu(Chinese rice wine) yeast[J].LWT,2020,133:110040.
[16]徐国强,吴满珍,吴瑶,等.利用功能基因组学方法研究酿酒酵母乙醇生物合成的调控机理[J].微生物学杂志,2013,33(6):19-25.
XU G Q,WU M Z,WU Y,et al.Study on the regulation mechanism of ethanol biosynthesis in Saccharomyces cerevisiae by functional genomics[J].Journal of Microbiology,2013,33(6):19-25.
[17]HAZELWOOD L A,DARAN J M,VAN MARIS A J,et al.The Ehrlich pathway for fusel alcohol production:a century of research on Saccharomyces cerevisiae metabolism[J].Applied and Environmental Microbiology,2008,74(8):2259-2266.
[18]PAQUIN C E,WILLIAMSON V M.Ty insertions at two loci account for most of the spontaneous antimycin A resistance mutations during growth at 15 degrees C of Saccharomyces cerevisiae strains lacking ADH1[J].Mol Cell Biol,1986,6(1):70-79.
[19]GU Y,MA J,ZHU Y,et al.Refactoring ehrlich pathway for high-yield 2-phenylethanol production in Yarrowialipolytica[J].ACS Synthetic Biology,2020,9(3):623-633.
[20]王成涛,梁婧如,尹胜,等.溶氧量对酿酒酵母及其工程菌的β-苯乙醇合成代谢的影响及调控效应[J].中国食品学报,2016,16(8):78-86.
WANG C T,LIANG J R,YIN S,et al.Effects and biosynthetic metabolism regulation of dissolved oxygen on β -phenethylalcohol in Saccharomyces cerevisiae and its engineering strains[J].Journal of Chinese Institute of Food Science and Technology,2016,16(8):78-86.
[21]白梅,刘双平,毛健,等.黄酒酵母HO 基因的敲除及其对黄酒发酵的影响[J].食品科学,2018,39(18):61-66.
BAI M,LIU S P,MAO J,et al.Influence of knocking out the HO gene of Sacchromyces cerevisiae on Chinese rice wine fermentation[J].Food Science,2018,39(18):61-66.
[22]赵宏宇,李珺,赵玥,等.4 种酵母基因组提取方法的比较[J].食品科学,2011,32(9):170-173.
ZHAO H Y,LI J,ZHAO Y,et al.Comparison of four methods for genomic DNA extraction from yeasts[J].Food Science,2011,32(9):170-173.
[23]罗艳.Gluconobacter thailandicus D-阿拉伯糖醇脱氢酶和木糖醇脱氢酶基因的克隆及协同表达[D].镇江:江苏大学,2016.
LUO Y.Cloning and co-expression of D-arabitoldehydrogenase and xylitol dehydrogenase genes from Gluconobacterthailandicus[D].Zhenjiang:Jiangsu University,2016.
[24]LAEMMLI UK.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature,1970,227(5259):680-685.
[25]BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Anal Biochem,1976,72:248-254.
[26]于凤川.奇异变形杆菌醇脱氢酶的克隆表达及酶学性质研究[D].无锡:江南大学,2019.
YU F C.Gene cloning,expression and biochemicalcharacteristics of alcoholdehydrogenase from Proteus mirabilis JN458[D].Wuxi:Jiangnan University,2019.
[27]PENNACCHIO A,PUCCI B,SECUNDO F,et al.Purification and characterization of a novel recombinant highly enantioselective short-chain NAD(H)-dependent alcohol dehydrogenase from Thermus thermophilus[J].Appl Environ Microbiol,2008,74(13):3949-3958.
[28]舒梅.酿酒酵母乙醇脱氢酶2 和乙醛脱氢酶以及两种水生动物抗菌肽的表达和酶活分析[D].南昌:南昌大学,2011.
SHU M.Expression and characterization ADH2 and ALDH of Saccharomyces cerevisiae and expression and activity analysis oftwo anti-microbial peptides[D].Nanchang:Nanchang University,2011.
[29]RAJ S B,RAMASWAMY S,PLAPP B V.Yeast alcohol dehydrogenase structure and catalysis[J].Biochemistry,2014,53(36):5791-5803.
[30]许松伟,姜忠义,吴洪.醇脱氢酶结构和作用机理研究进展[J].有机化学,2005,25(6):629-633,607.
XU S W,JIANG Z Y,WU H.Progress in structure and kinetic mechanism of alcohol dehydrogenase[J].Organic Chemistry,2005,25(6):629-633,607.
[31]MLEJNEK K,SEIFFERT B,DEMBERG T,et al.Temperature optima of enzyme-catalysed reactions in microemulsion systems[J].Appl MicrobiolBiotechnol,2004,64(4):473-480.
[32]ZHANG H,LI Q,WANG L,et al.Investigation of structure and function of mitochondrial alcohol dehydrogenase isozyme III from Komagataellaphaffii GS115[J].Biochim Biophys Acta Gen Subj,2018,1862(5):1199-1208.
[33]DICKINSON J R,SALGADO L E,HEWLINS M J.The catabolism of amino acids to long chain and complex alcohols in Saccharomyces cerevisiae[J].J Biol Chem,2003,278(10):8028-8034.
[34]祁浩,刘新利.大肠杆菌表达系统和酵母表达系统的研究进展[J].安徽农业科学,2016,44(17):4-6,52.
QI H,LIU X L.Research progress of expression systems of Escherichia coli and yeast[J].Journal of Anhui Agricultural Sciences,2016,44(17):4-6,52.
[35]李赤霞,陈滢,张萌,等.白假丝酵母环核苷酸磷酸二酯酶2 的异源表达、纯化与酶学特性分析[J].食品科学,2020,41(22):82-87.
LI C X,CHEN Y,ZHANG M,et al.Heterologous expression,purification and enzymatic analysis of Candida albicanscyclic nucleotide phosphodiesterase 2[J].Food Science,2020,41(22):82-87.
[36]张晓瑜.黄酒酿酒酵母芳香醇脱氢酶的定点突变与催化位点鉴定[D].杭州:浙江农林大学,2017.
ZHANG X Y.Site-specific mutagenesis and catalytic site identification ofyeast aryl alcohol dehydrogenase in Chinese rice wine[D].Hangzhou:Zhejiang A&F University,2017.