异戊醇是葡萄酒中高级醇的主体成分,其含量占葡萄酒中高级醇总量的40%以上,阈值为30 mg/L,在葡萄酒中呈现杂醇味、涩味及苦杏仁味[1-4]。葡萄酒中适量的异戊醇不仅使酒体丰满、口感醇厚,还对葡萄酒香气的复杂性有积极的贡献[5-6];然而,异戊醇含量过高会给葡萄酒带来溶剂味、指甲油等令人不愉悦的气味,不仅会损害葡萄酒的风味平衡,还会造成饮用者头痛、恶心等症状[7-8]。在葡萄酒酿造过程中应对异戊醇的生成量进行适当控制。
酿酒酵母的异戊醇代谢途径包括合成代谢途径(Harris)和埃里希途径(Ehrlich)。若异戊醇形成的前体物质α-酮异己酸来源于碳水化合物代谢,则称为Harris 途径[9];若α-酮异己酸是由亮氨酸的转氨作用形成,之后经酮酸脱羧酶催化,由α-酮异己酸脱羧形成异戊醛,再还原形成异戊醇,则称为Ehrlich 途径。人们通常认为酿酒酵母发酵产生的高级醇,75%来自Harris 途径,只有25%来自Ehrlich 途径,且后者对前者具有补充和抑制双重效果[10-11]。也有研究者认为,大量的支链高级醇主要通过Ehrlich 途径合成,少量的直链高级醇是经Harris 途径合成的[12]。葡萄酒中异戊醇的产生与发酵基质中可同化氮含量和种类、糖含量和补加方式、发酵温度、溶氧量等多种发酵工艺条件有关[13-16]。近年来的研究表明:通过过表达/敲除途径特异性基因[17],删除/增强竞争途径[18-19],改善辅因子[20],在线粒体或细胞质重构代谢途径[21-24]等,可在一定程度上控制酵母的异戊醇产量;对具有不同遗传背景的酵母菌株而言,其异戊醇产量可能具有显著差异,并且在发酵过程中的不同阶段,酿酒酵母的异戊醇产率也有差异。有研究表明发酵对数期是异戊醇等高级醇的快速合成时期 [25],而发酵对数期内异戊醇合成的具体调控机制尚不清楚。
以本课题组筛选的具有优良葡萄酒酿造特性的本土酿酒酵母LFE1225 为研究对象,利用生化分析和转录组测序(RNA-Seq)技术,分析酿酒酵母LFE1225 在不同发酵时期的碳氮源、醇类、有机酸代谢以及转录组,揭示本土酿酒酵母LFE1225 在发酵进程中的异戊醇代谢规律和调控机制,为低产/高产异戊醇菌株的定向育种提供依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株 酿酒酵母LFE1225,西北农林科技大学葡萄酒学院保藏。
1.1.2 培养基 YPD 培养基(1 L):蛋白胨20 g,葡萄糖20 g,酵母粉10 g(若配置固体培养基,再添加20 g/L 的琼脂)加蒸馏水定容至1 L,高压蒸汽灭菌(121 ℃,灭菌20 min)。
Triple M 模拟葡萄汁[26](1 L):储液Ⅰ:100 g葡萄糖、100 g 果糖和4 mL ergo stock,蒸馏水定容至500 mL;储液Ⅱ:6 g 酒石酸、3 g 苹果酸和0.5 g 柠檬酸,蒸馏水定容至250 mL;储液Ⅲ:1.7 g YNB(酵母基础氮源)、2 g 水解酪蛋白、6 mg 肌醇、0.2 g 无水氯化钙、0.8 g L-精氨酸、1 g L-脯氨酸、0.1 g 色氨酸和1 g 磷酸铵,蒸馏水定容至250 mL。混匀储液Ⅰ、Ⅱ、Ⅲ,用KOH(4 mol/L)调pH值为3.25,0.22 μm 滤膜过滤除菌。ergo stock(50 mL):12.5 mL 吐温80、37.5 mL 95%乙醇和0.125 g 麦角固醇。
1.2 方法
1.2.1 模拟葡萄汁发酵 种子液的制备:将经过划平板纯化、镜检后的菌株接入装有50 mL 无菌Triple M 模拟汁的100 mL 锥形瓶中,以无菌过滤透气封口膜封口,于28 ℃,150 r/min 条件下培养24 h。
发酵:取已培养24 h 的种子液,离心收集菌体并悬浮于0.9%的生理盐水中,在显微镜下计数后以5×105 CFU/mL 接入装有300 mL 无菌Triple M 模拟汁的500 mL 锥形瓶中,以无菌过滤透气封口膜封口,于25 ℃条件下静置发酵。发酵过程中每24 h 监测CO2 质量损失并做CO2 失重曲线,当CO2 质量损失连续3 d 基本不变时视为发酵结束。设置3 个生物学平行。根据CO2 失重曲线取发酵过程中对数初期(24 h)、对数中期(72 h)、对数末期(240 h)及发酵结束后(504 h)的发酵液测定残糖(DNS 法)[27]、氨态氮(AMMONIA)、伯胺氮(PAN)、酵母可同化氮(YAN)和亮氨酸、异戊醇及其它代谢物的产量。
1.2.2 异戊醇等高级醇及其它代谢产物的检测异戊醇等高级醇的检测采用顶空固相微萃取-气相色谱-质谱联用法。使用DVB/CAR/PDMS 萃取纤维(50/30 μm 涂层厚度,2 cm 可伸缩长度)及SPME57330-U 联用手柄(Supelco,Bellefonte PA,USA)。在20 mL 顶空瓶中加入8 mL 酒样、2.0 g NaCl 和20 μL 2-辛醇(0.016 g/L)以及磁力搅拌子,在40 ℃,600 r/min 条件下平衡15 min后,再用萃取纤维在40 ℃,600 r/min 条件下搅拌吸附30 min 后取出,立即进行手动进样,在230℃进样口解析5 min,每个样品重复2 次。GC-MS所用气相色谱柱为DB-WAX 极性柱(60 m×0.25 mm×0.25 mm)(Alilent JandW,USA)。不分流进样,离子源温度为200 ℃,连接杆温度220 ℃,进样口230 ℃,载气为高纯度氦气(≥99.999%),载气流速为1.5 mL/min。升温程序为,40 ℃保持5 min,然后以3 ℃/min 上升至130 ℃,接着4 ℃/min 上升至250 ℃,在250 ℃保持5 min,总运行时间为60 min。离子源为EI 源,离子源电压为70 eV,质谱扫描范围25~350 amu,扫描频率为50 Hz。定性和定量分析参照陶永胜[3]的方法。
采用试剂盒法(北京索莱宝)通过Y15 全自动葡萄酒分析仪检测甘油,检测限为0.24~20 g/L。
乙醇的测定参照GB/T 15038-2006《葡萄酒、果酒通用分析方法》中的酒精计法。
有机酸的检测使用Aminex HPX-87H 有机酸分析柱(300 mm×7.8 mm;Bio-Rad;Hercules)。流动相:0.005 mol/L H2SO4,流速0.6 mL/min,进样量5 μL,55 ℃柱温,检测波长为210 nm。配置质量浓度为0.2,0.4,0.6,0.8,1,1.2 g/L 的标准品,经过0.22 μm 有机膜过滤后进样,测定得到相应的峰面积与出峰时间,以质量浓度为横坐标,峰面积为纵坐标绘制标准曲线。将发酵液稀释过滤后进行测定并计算。
1.2.3 AMMONIA、PAN、YAN 及亮氨酸的检测采用试剂盒法(北京 索莱宝)通过Y15 全自动葡萄酒分析仪检测AMMONIA 和PAN,AMMONIA的检测限为3~200 mg/L,PAN 的检测限为1~400 mg/L。YAN 质量浓度按照试剂盒方法采用公式(1)进行计算。
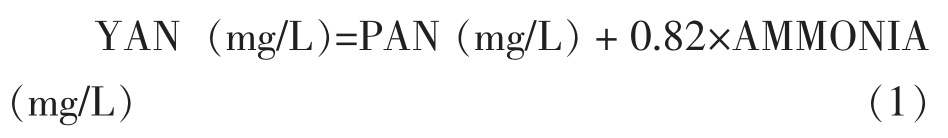
使用Venusil AA 氨基酸分析方法包按照说明书检测亮氨酸。
1.2.4 转录组测序样品制备 根据CO2 失重曲线,分别在发酵的对数初期(A 时期)、对数中期(B时期)和对数末期(C 时期)取发酵液并离心收集菌体,加入PBS 缓冲液洗涤后,再次离心弃上清,并置于液氮中迅速冷冻。样品由广州基迪奥生物科技有限公司进行转录组(RNA-seq) 检测及分析。
1.2.5 转录组测序数据分析 使用Deseq2 软件对reads count 进行标准化,根据模型计算假设检验概率(P 值)再进行多重假设检验矫正得到错误发现率(FDR 值)。将FDR<0.05 且不同发酵时期之间相比|log2FC|>1 的基因筛选为显著性差异表达基因。KEGG(kyoto encyclopedia of genes and genomes)富集分析以P 值小于0.05 为阈值。趋势分析参照STEM 软件,使用log2 标准化对数据预处理,将目标基因的变化趋势按照最具代表性的20 个模块进行归类分析。
2 结果与分析
2.1 酿酒酵母LFE1225 的发酵特征
如图1所示,从发酵开始后的第24 小时开始,LFE1225 的CO2 失重速率显著增加,发酵进入对数初期,此时发酵液残糖为(151.5±3.00)g/L。CO2 失重速率在发酵开始后的第72 小时达到最大值,此时发酵进入对数中期,发酵液残糖为(104.11±5.29)g/L,此后CO2 失重速率开始下降,从第240 小时开始逐渐稳定,到达发酵的对数末期,此时的残糖为(11.89±1.99)g/L。发酵结束后的残糖为(1.73±0.49)g/L。
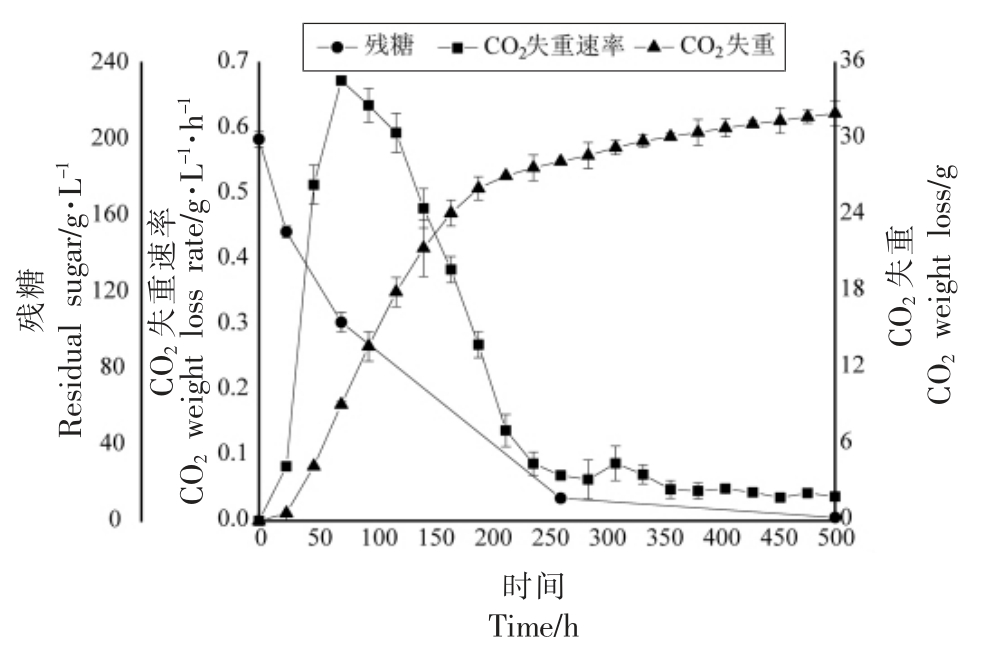
图1 酿酒酵母LFE1225 的发酵曲线
Fig.1 Fermentation curve of S.cerevisiae LFE1225
2.2 酿酒酵母LEF1225 异戊醇和其它代谢产物的分析
如图2所示,随着发酵的进行,发酵液中的异戊醇不断积累,发酵结束后的异戊醇产量达到了(336.62±4.66)mg/L。异戊醇的合成速率随发酵的进行呈现显著的下降趋势,近65%的异戊醇是在发酵的对数期生成的,其中,从对数中期到对数末期是LFE1225 生成异戊醇的主要时期,此阶段生成的异戊醇占发酵结束后异戊醇总量的44%。
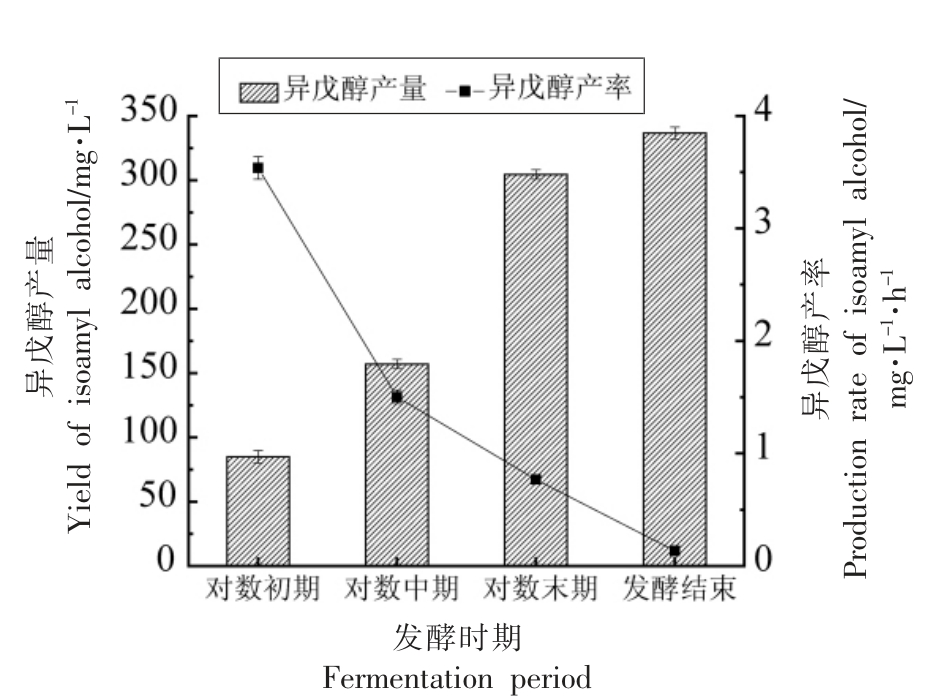
图2 酿酒酵母LEF1225 不同发酵阶段的异戊醇产量及合成速率
Fig.2 The content and synthesis rate of isoamyl alcohol in different fermentation stages of S.cerevisiae LEF1225
酿酒酵母LFE1225 在不同发酵时期的醇类物质的生成量和合成速率如表1所示,随着发酵的进行乙醇、甘油和高级醇在不断积累,发酵结束后,乙醇体积分数为(11.23±0.29)%(V/V),甘油质量浓度为(4.33±0.31)g/L,发酵液中的高级醇产量为(486.60±8.90)mg/L,以上醇类物质的合成速率均随着发酵的进行呈现显著的下降趋势。以异戊醇合成速率为横坐标,对乙醇合成速率、甘油合成速率、高级醇合成速率以及糖消耗速率作图(图3),发现异戊醇合成速率与乙醇合成速率、高级醇合成速率以及糖消耗速率具有极高的相关性,而与甘油合成速率相关性不高。
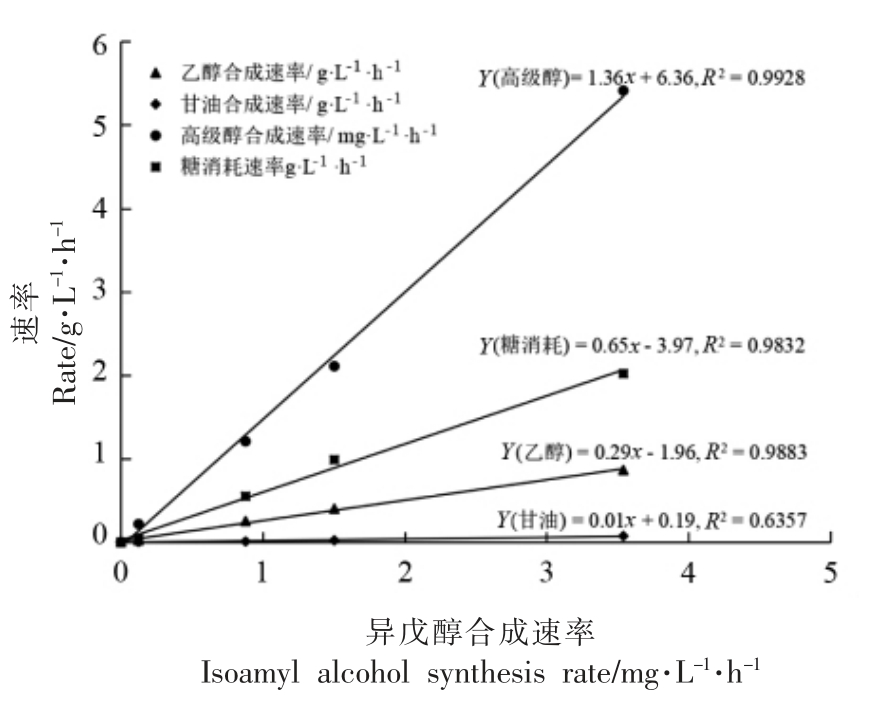
图3 相关性分析
Fig.3 Correlation analysis
表1 酿酒酵母LEF1225 不同发酵阶段的醇类物质产量
Table 1 Alcohols content in different fermentation stages of S.cerevisiae LEF1225
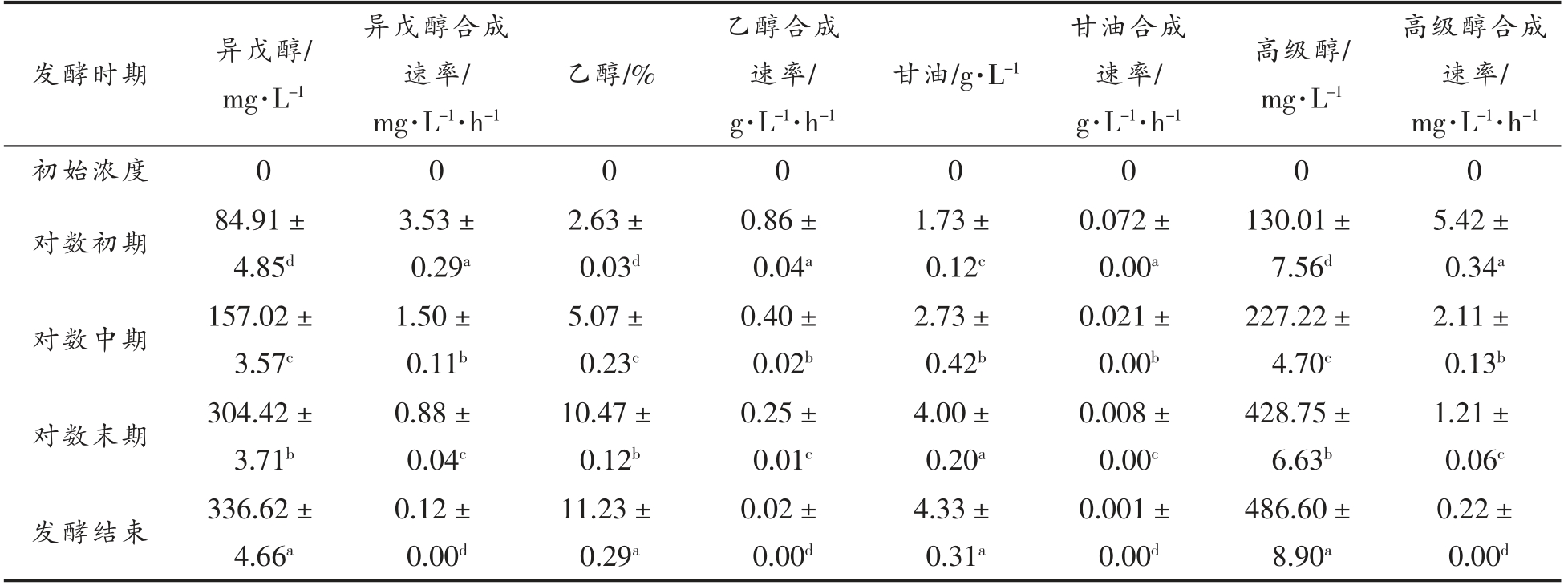
注:同列不同角标字母表示不同时期该物质的产量/合成速率之间存在显著性差异(P<0.05)。
高级醇合成速率/mg·L-1·h-1初始浓度 0 0 0 0 0 0 0 0对数初期 84.91±4.85d发酵时期 异戊醇/mg·L-1异戊醇合成速率/mg·L-1·h-1乙醇/%乙醇合成速率/g·L-1·h-1甘油/g·L-1甘油合成速率/g·L-1·h-1高级醇/mg·L-1 5.42±0.34a对数中期 157.02±3.57c 3.53±0.29a 2.63±0.03d 0.86±0.04a 1.73±0.12c 0.072±0.00a 130.01±7.56d 2.11±0.13b对数末期 304.42±3.71b 1.50±0.11b 5.07±0.23c 0.40±0.02b 2.73±0.42b 0.021±0.00b 227.22±4.70c 1.21±0.06c发酵结束 336.62±4.66a 0.88±0.04c 10.47±0.12b 0.25±0.01c 4.00±0.20a 0.008±0.00c 428.75±6.63b 0.12±0.00d 11.23±0.29a 0.02±0.00d 4.33±0.31a 0.001±0.00d 486.60±8.90a 0.22±0.00d
酿酒酵母LFE1225 发酵过程中的各种有机酸的合成与异戊醇的合成之间没有明显相关性。有机酸总量随着发酵的进行呈现先上升后下降的期开始出现,其中琥珀酸和乳酸随时间呈先上升后下降的趋势。趋势,在对数初期最高。柠檬酸与苹果酸质量浓度变化趋势一致先增加后降低,酒石酸则在发酵初期迅速下降,随后在对数末期缓慢回升。丙酮酸、琥珀酸、乳酸及乙酸则为发酵过程中形成的酸类,丙酮酸在发酵初期即产生,在对数中期质量浓度达到最高,琥珀酸、乳酸和乙酸则在发酵对数中后
2.3 酿酒酵母LFE1225 不同发酵阶段的氮源代谢
YAN 包括氨态氮、游离α-氨基氮化合物(脯氨酸除外)和一些小分子多肽,是酿酒酵母正常生长所必须的营养物质[28],研究表明葡萄汁中YAN含量过高或者不足均会导致发酵结束后的葡萄酒中高级醇含量增加[29]。试验所用Triple M 模拟汁的初始YAN 质量浓度为(446.28±14.25)mg/L,其在不同发酵时期的质量浓度如图4a 所示。在发酵起始阶段,氮源充足,酿酒酵母大量利用YAN,对数初期的YAN 质量浓度较初始下降近20%,约100 mg/L,此阶段异戊醇合成速率最高,可能与YAN 的消耗有关。在对数中期,YAN 质量浓度小幅上升,之后趋于稳定。对数中期YAN 质量浓度上升的原因可能为发酵初始阶段YAN 被大量利用导致发酵基质中氮源相较缺乏,因此酿酒酵母开始合成氨基酸以补充氮源。
表2 酿酒酵母LEF1225 不同发酵阶段的有机酸含量(g/L)
Table 2 The content of organic acids in different fermentation stages of S.cerevisiae LEF1225(g/L)

注:同列不同角标字母表示不同时期该物质含量之间存在显著性差异(P<0.05)。“-”表示未检测到相应物质。
?
Triple M 模拟汁的初始亮氨酸质量浓度为(287.74±16.07)mg/L(图4b),进入对数初期显著增加,为(390.06±35.46)mg/L,此后发酵液中的亮氨酸质量浓度呈现明显的下降趋势。与对数初期相比,对数中期的亮氨酸质量浓度减少了近63%。发酵结束后的亮氨酸质量浓度为(2.30±0.13)mg/L。发酵初始阶段亮氨酸质量浓度最高的时候异戊醇的合成速率最大,由此推测该阶段只有少量的异戊醇是通过Ehrlich 途径合成的。
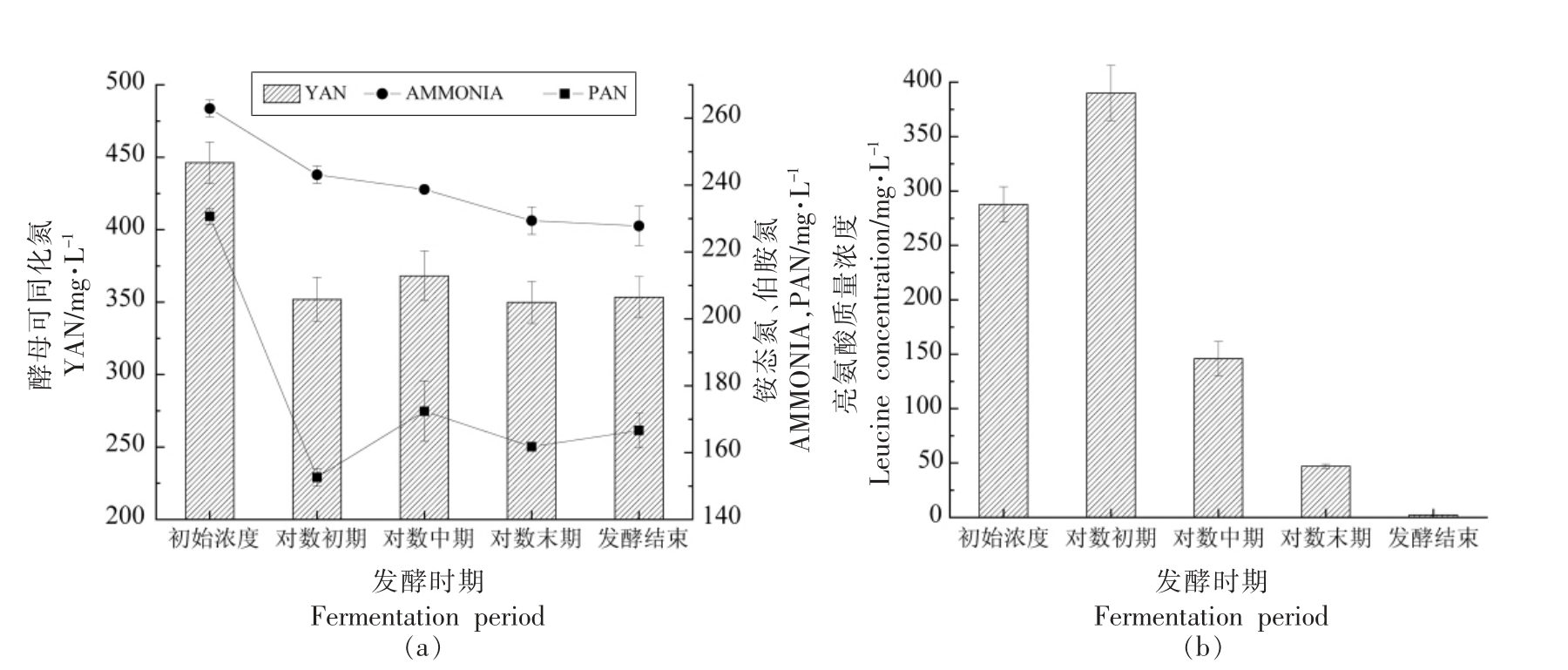
图4 酿酒酵母LEF1225 不同发酵阶段的氮源消耗情况
Fig.4 Consumption of nitrogen in different fermentation stages of S.cerevisiae LEF1225
2.4 不同发酵阶段的酿酒酵母LEF1225 转录组测序与分析
利用RNA-seq 对酿酒酵母LEF1225 的3 个发酵时期(对数初期A、对数中期B、对数末期C)进行转录组学测序与分析。测序平均产生21 071 058 条原始reads,通过质控过滤得到clean reads 总计185 388 216,平均数目为20 598 691,整体质控良好。将过滤后的reads 与rRNA 比对,将保留后的Unmapped_Reads 与参考基因组进行比对分析,可以定位到基因组上的有效reads 占比在94.91%~96.52%。
与发酵对数初期A 相比较,对数中期B 有1 469 个基因显著上调,284 个基因显著下调,其中与异戊醇合成相关基因MPC1/2/3、LEU2、BAT1/2、ALD6 的表达水平显著下调,而SFA1 显著上调(图5a)。SFA1 编码的Sfa1p 属于III 类醇脱氢酶(EC:1.1.1.284),同时具有醇脱氢酶和谷胱甘肽依赖性甲醛脱氢酶活性,参与高级醇的合成[30]。Zhu等[31]发现过量表达SFA1 可以促进酿酒酵母乙醇的合成,但是否可以有效促进酿酒酵母异戊醇的合成还有待进一步验证。LEU2 基因编码3-异丙基苹果酸脱氢酶,佐一含等[32]和李童等[33]都发现敲除LEU2 基因会导致酿酒酵母的异戊醇产量显著降低。本研究发现与发酵对数初期相比,对数中期LEU2 基因的表达量显著下降,与该阶段异戊醇合成速率的变化趋势一致。BAT1 基因编码的支链氨基酸转氨酶位于线粒体,倾向于催化α-酮酸合成氨基酸,而BAT2 基因编码的支链氨基酸转氨酶位于细胞质,倾向于催化氨基酸生成α-酮酸,进而合成高级醇[34-35]。BAT1 基因在整个对数期表达量的变化趋势为持续下降,与发酵液中亮氨酸质量浓度的变化趋势一致,其在对数初期的高表达量同样与该时期较高的亮氨酸质量浓度相符合,表明在发酵初始阶段,酿酒酵母LFE1225 已开始合成亮氨酸,且亮氨酸的合成作用随发酵的进行减弱。对数期BAT2 基因的表达量变化趋势为先下降后平稳,表明亮氨酸的转氨降解作用也是随发酵的进行减弱,且对数初期之前亮氨酸的合成作用大于降解作用,对数初期之后正好相反。
与发酵对数中期B 相比,对数末期C 有361个基因显著上调、1 378 个基因显著下调,其中ILV5、LEU9、PDC6、THI3、ADH6、ALD2/3/5 的表达水平显著下调,而ADH1 和ADH2 显著上调(图5a)。在发酵的对数末期,ILV5、LEU9、PDC6、THI3和ADH6 的显著下调可能与该发酵阶段异戊醇合成速率降低有关。ILV5 基因编码乙酰羟酸还原酶,其表达量在整个对数期表现出先平稳后下降的趋势,推测线粒体内由上述酶催化的从丙酮酸到α-酮异戊酸的过程主要发生在对数期的前期。LEU9 基因编码α-异丙基苹果酸合酶,其在对数期表达量的变化趋势同样为先平稳后下降,可能与其对应酶的催化作用主要发生在对数期前期有关。出现以上现象的原因可能为酿酒酵母LFE1225 在发酵初始阶段大量利用YAN 导致发酵基质中YAN 含量相较缺乏,因此酿酒酵母开始通过Harris 途径合成亮氨酸等氨基酸,同时产生异戊醇,并且随发酵的进行以及酿酒酵母自身合成氨基酸的积累,该途径的作用慢慢减弱。与发酵对数中期相比,对数末期酮酸脱羧酶编码基因PDC6 的表达量显著下降,与该时期异戊醇合成速率变化趋势一致,THI3 基因也表现出类似的趋势。THI3 编码类丙酮酸脱羧酶,亮氨酸的降解主要由该酶催化,同时其也可催化异亮氨酸的降解,并且在丙酮酸脱羧酶存在的条件下可催化芳香族氨基酸的脱羧反应[36]。杨青[37]研究发现敲除THI3基因的菌株S2 发酵后蒸馏酒中的相对异戊醇含量比出发菌株S1 降低了28.3%。
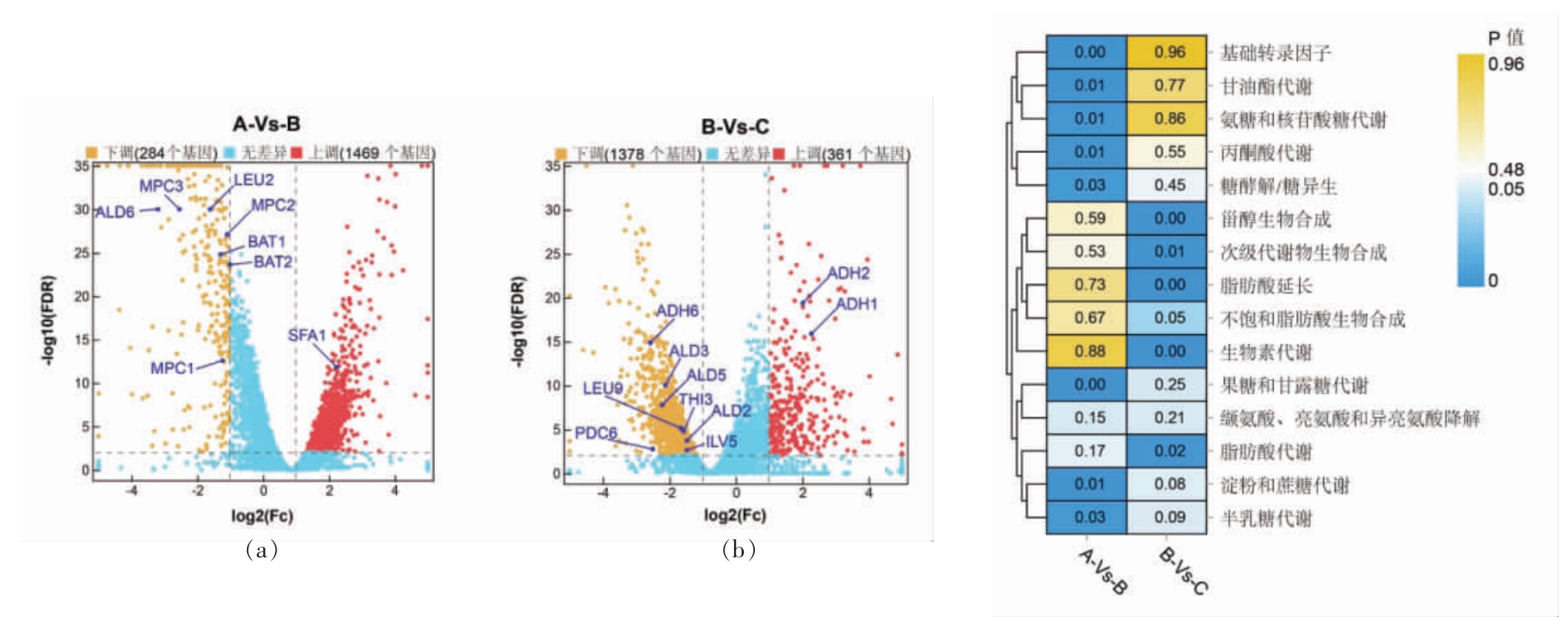
图5 基因转录差异比较(a)和差异表达基因Pathway 富集分析(b)
Fig.5 Comparison of gene transcription differences(a) and pathway enrichment analysis of differentially expressed genes(b)
将A-Vs-B 时期B-Vs-C 时期的显著差异基因进行KEGG 代谢通路富集,以P 值小于0.05 作为显著性富集标准。如图5b 所示,A-Vs-B 时期的差异表达基因主要富集在糖和甘露糖代谢(Fructose and mannose metabolism)、糖酵解/糖异生(Glycolysis / Gluconeogenesis)、丙酮酸代谢(Pyruvate metabolism)等糖代谢通路,而B-Vs-C时期的差异表达基因主要富集在与细胞膜代谢相关的途径如类固醇生物合成(Steroid biosynthesis)、脂肪酸延伸及代谢(Fatty acid elongation,Fatty acid metabolism)等,以及次级代谢物生物合成(Biosynthesis of secondary metabolites)等代谢通路。差异基因在缬氨酸、亮氨酸和异亮氨酸降解(Valine,leucine and isoleucine degradation)途径没有显著富集。
2.5 酿酒酵母转录因子与异戊醇代谢途径编码基因
目前,针对酿酒酵母异戊醇代谢的转录调控研究较少,仅报道了Leu3p 作为转录调控因子参与了支链氨基酸和高级醇的代谢调控[38-39]。现有研究已发现Leu3p 可调控异戊醇合成途径中的ILV2、ILV5、LEU1、LEU2、LEU4 和BAT1 等基因[40]。为了探讨转录因子在酿酒酵母生理代谢过程中与异戊醇合成的关系,将酿酒酵母现报道的124 个转录因子(www.yeastract.com)和异戊醇代谢相关的33 个编码基因进行表达趋势分析(图6)。如图所示,结果分为8 种趋势,仅Profile6 和Profile7 具有显著性(P<0.05)。在Profile6 中,没有异戊醇代谢相关基因,却有转录因子Leu3p 的编码基因LEU3。在Profile7 中,异戊醇代谢相关的BAP2、ILV2、PDC1 和SFA1 等4 个基因与GCN4 等20个转录因子具有相同的表达趋势。利用YEASTRACT 数据库(www.yeastract.com) 分析发现,GAT1、ADR1、UPC2、GCN4、RPN4、RFX1、CUP2、RIM101、RLM1、SUM1、TYE7、GAL4、RME1 和USV1 等14 个转录因子与异戊醇代谢途径BAP2、ILV2、PDC1 和SFA1 等4 个基因中的一个或两个基因具有相互作用(图7)[41]。

图6 酿酒酵母转录因子和异戊醇代谢相关基因的表达趋势分析
Fig.6 Analysis of expression trends of transcription factors and isoamyl alcohol metabolism-related genes in S.cerevisiae
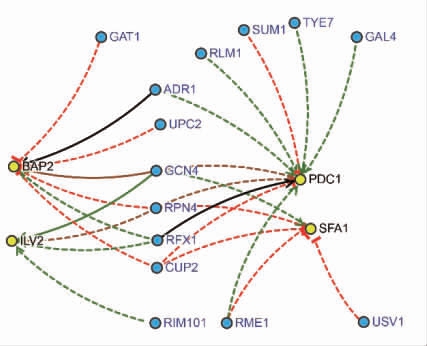
图7 Profile 7 中差异表达转录因子与异戊醇代谢相关基因的相互关系
Fig.7 The relationship between differentially expressed transcription factors and genes related to isoamyl alcohol metabolism in Profile 7
注:虚线代表数据来源于组学数据分析,实线代表数据来源于试验验证;红色代表抑制,其它颜色代表激活。
3 结论
通过分析本土酿酒酵母LFE1225 发酵进程中异戊醇合成、碳氮源代谢以及转录组学等,解析酿酒酵母LFE1225 的异戊醇合成机制。酿酒酵母LFE1225 在整个发酵阶段可以合成(336.62±4.66)mg/L 异戊醇,其中65%在对数期合成,随着发酵的进行,异戊醇合成速率逐渐降低,且异戊醇合成速率与乙醇合成速率、高级醇合成速率、糖消耗速率具有显著的正相关。酿酒酵母LFE1225 在发酵进入对数期前快速利用YAN,并合成一定量的亮氨酸,此阶段异戊醇合成速率最高,进入对数期后,亮氨酸才开始被快速利用,反而YAN 含量变化不显著。据此推测在发酵初始阶段,异戊醇合成速率最高的时候只有少量的异戊醇是通过Ehrlich途径合成的。
通过分析不同发酵时期酿酒酵母LFE1225的转录组,发现发酵对数期内LEU2、BAT1/2、ILV5、LEU9、PDC6、THI3、ADH6 等异戊醇代谢相关基因的表达量呈下降趋势,与此阶段异戊醇合成速率的变化趋势一致,这些基因表达量的变化可能是异戊醇产率逐渐降低的原因。尽管现有文献报道认为转录因子LEU3 在调控酵母异戊醇代谢中具有重要作用,但是本研究中并没有发现其在表达水平上有显著变化,但通过分析酿酒酵母转录因子与异戊醇代谢相关基因的表达趋势发现,14 个转录因子GAT1、ADR1、UPC2、GCN4、RPN4、RFX1、CUP2、RIM101、RLM1、SUM1、TYE7、GAL4、RME1 和USV1 等可能参与了酿酒酵母LFE1225 异戊醇代谢的调控。这些转录因子在异戊醇代谢中的作用还需要进一步试验验证。
[1]王春晓,唐佳代,吴鑫颖,等.酿酒小曲中功能微生物的研究进展[J].食品科学,2019,40(17):309-316.
WANG C X,TANG J D,WU X Y,et al.Progress in research of functional microbes in Xiaoqu,a Chinese traditional fermentation starter for liquor and rice wine[J].Food Science,2019,40(17):309-316.
[2]孙中贯,刘琳,王亚平,等.酿酒酵母高级醇代谢研究进展[J].生物工程学报,2021,37(1):1-20.
SUN Z G,LIU L,WANG Y P,et al.Higher alcohols metabolism by Saccharomyces cerevisiae:a mini review[J].Chinese Journal of Biotechnology,2021,37(1):1-20.
[3]陶永胜.贺兰山东麓霞多丽葡萄酒的香气成分活性及其指纹特征研究[J].宁夏林业,2019(3):55-61.
TAO Y S.Research on the aroma ingredient activity and fingerprint characteristics of Chardoli wine from the Helan Mountain[J].Ningxia Forestry,2019(3):55-61.
[4]苗丽平,赵新节,董书甲,等.商业酵母对马瑟兰干红葡萄酒香气成分的影响[J].中国酿造,2016,35(10):56-61.
MIAO L P,ZHAO X J,DONG S J,et al.Effects of commercial yeasts starter on aroma components of Marselan dry red wine[J].China Brewing,2016,35(10):56-61.
[5]罗杰,敖宗华,王松涛,等.浓香型白酒不同类别基酒中杂醇油相关性研究[J].酿酒科技,2015(1):43-44,47.
LUO J,AO Z H,WANG S T,et al.The correlations of fusel oil in different varieties of base Nongxiang Baijiu(Liquor)[J].Liquor-Making Science& Technology,2015(1):43-44,47.
[6]任津莹,马艳蕊,刘港,等.一种新型产乙酸乙酯酿酒酵母菌株的构建[J].中国酿造,2020,39(8):162-169.
REN J Y,MA Y R,LIU G,et al.Construction of a novel ethyl acetate-producing Saccharomyces cerevisiae[J].China Brewing,2020,39(8):162-169.
[7]格绒泽仁,皇甫洁,韩兴林,等.浓香型白酒饮后不适感关键高级醇类物质关联性判定新方法[J].食品与发酵工业,2019,45(14):191-195.
GERONG Z R,HUANG F J,HAN X L,et al.A method for determining associations between drinking discomforts and key higher alcohols in strong-aroma Baijiu[J].Food and Fermentation Industries,2019,45(14):191-195.
[8]孙中贯,王孟祺,王亚平,等.GAP1 基因缺失对上面发酵酵母高级醇代谢能力的影响[J].天津科技大学学报,2020,35(1):10-17.
SUN Z G,WANG M Q,WANG Y P,et al.Effect of GAP1 gene deletion on higher alcohols production in top-fermenting yeast[J].Journal of Tianjin Univer sity of Science & Technology,2020,35(1):10-17.
[9]KlOSOWSKI G,MIKULSKI D,MACKO D,et al.Influence of various yeast strains and selected starchy raw materials on production of higher alcohols during the alcoholic fermentation process [J].European Food Research and Technology,2015,240(1):233-242.
[10]GUYMON J F,INGRAHAM J L,CROWELL E A.The formation of n-propyl alcohol by Saccharomyces cerevisiae[J].Archives of Biochemistry and Biophysics,1961,95:163-168.
[11]BAI W,GENG W,WANG S,et al.Biosynthesis,regulation,and engineering of microbially produced branched biofuels[J].Biotechnol for Biofuels,2019,12(84):1-12.
[12]祝霞,刘琦,赵丹丹,等.酿造条件对酿酒酵母发酵香气的影响[J].食品科学,2019,40(16):115-123.
ZHU X,LIU Q,ZHAO D D,et al.Effect of different winemaking conditions on fermentation aroma production by Saccharomyces cerevisiae[J].Food Science,2019,40(16):115-123.
[13]RUIZ J,KIENE F,BELDA I,et al.Effects on varietal aromas during wine making:a review of the impact of varietal aromas on the flavor of wine[J].Applied Microbiology and Biotechnology,2019,103(18):7425-7450.
[14]孙时光,左勇,徐佳,等.外源添加物对桑椹果酒高级醇的影响[J].食品与发酵工业,2019,45(19):180-187.
SUN S G,ZUO Y,XU J,et al.Effect of exogenous additives on the higher alcohols of mulberry wine and its optimization[J].Food and Fermentation Industries,2019,45(19):180-187.
[15]王亚钦,刘沛通,吴广枫,等.可同化氮对葡萄酒发酵香气物质积累及代谢调控的影响[J].中国食品学报,2017,17(12):164-171.
WANG Y Q,LIU P T,WU G F,et al.Effect of the assimilable nitrogen on the aroma compounds production and the regulation of their biosynthesis during alcoholic fermentation[J].Journal of Chinese Institute of Food Science and Technology,2017,17(12):164-171.
[16]靳国杰,李爱华,刘浩,等.发酵温度对霞多丽干白葡萄酒香气质量的影响[J].中国食品学报,2017,17(10):134-144.
JIN G J,LI A H,LIU H,et al.Influence of fermentation temperature on aroma quality of dry Chardonnay wine[J].Journal of Chinese Institute of Food Science and Technology,2017,17(10):134-144.
[17]MA L,HUANG S,DU L,et al.Reduced production of higher alcohols by Saccharomyces cerevisiae in red wine fermentation by simultaneously overexpressing BAT1 and deleting BAT2[J].Journal of Agricultural and Food Chemistry,2017,65(32):6936-6942.
[18]WESS J,BRINEK M,BOLES E.Improving isobutanol production with the yeast Saccharomyces cerevisiae by successively blocking competing metabolic pathways as well as ethanol and glycerol formation[J].Biotechnol for Biofuels,2019,12(172):1-15.
[19]LEE K M,KIM S K,LEE Y G,et al.Elimination of biosynthetic pathways for L -valine and L -isoleucine in mitochondria enhances isobutanol production in engineered Saccharomyces cerevisiae[J].Bioresource Technology,2018,268:271-277.
[20]MORITA K,NOMURA Y,ISHII J,et al.Heterologous expression of bacterial phosphoenol pyruvate carboxylase and Entner-Doudoroff pathway in Saccharomyces cerevisiae for improvement of isobutanol production[J].Journal of Bioscience and Bioengineering,2017,124(3):263-270.
[21]HAMMER S K,ZHANG Y,AVALOS J L.Mitochondrial compartmentalization confers specificity to the 2 -Ketoacid recursive pathway:increasing isopentanol production in Saccharomyces cerevisiae[J].ACS Synthetic Biology,2020,9(3):546-555.
[22]MORITA K,MATSUDA F,OKAMOTO K,et al.Repression of mitochondrial metabolism for cytosolic pyruvate -derived chemical production in Saccharomyces cerevisiae[J].Microbial Cell Factories,2019,18(177):1-11.
[23]YUAN J F,MISHRA P,CHING C B.Engineering the leucine biosynthetic pathway for isoamyl alcohol overproduction in Saccharomyces cerevisiae[J].Journal of Industrial Microbiology & Biotechnology,2017,44(1):107-117.
[24]YUAN J,CHEN X,MISHRA P,et al.Metabolically engineered Saccharomyces cerevisiae for enhanced isoamyl alcohol production [J].Applied Micro biology and Biotechnology,2017,101(1):465-474.
[25]程军,秦伟帅,赵新节.葡萄酒酿造中高级醇的形成机制与调节[J].中国酿造,2011(12):9-11.
CHENG J,QIN W S,ZHAO X J.Formation and regulation of higher alcohols in wine fermentation[J].China Brewing,2011(12):9-11.
[26]SPIROPOULOS A,TANAKA J,FLERIANOS I,et al.Characterization of hydrogen sulfide formation in commercial and natural wine isolates of Saccharomyces[J].American Journal of Enology & Viticulture,2000,51(3):233-248.
[27]王春晓,江璐,刘延琳.DNS 法监控葡萄酒发酵进程的应用研究[J].中国酿造,2012,31(9):24-27.
WANG C X,JIANG L,LIU Y L.Application study on monitoring wine fermentation process by DNS method[J].China Brewing,2012,31(9):24-27.
[28]UGLIANO M,HENSCHKE P A,HERDERICH M J,et al.Nitrogen management is critical for wine flavour and style[J].Wine Industry Journal,2007,22(6):24-30.
[29]董书甲.氮源对酿酒酵母代谢产物的影响[D].济南:齐鲁工业大学,2018.
DONG S J.Effects of nitrogen sources on the metabolites of Saccharomyces cerevisiae[D].Jinan:Qilu University of Technology,2018.
[30]DICKINSON J R,SALGADO LE,HEWLINS M J.The catabolism of amino acids to long chain and complex alcohols in Saccharomyces cerevisiae[J].Journal of Biological Chemistry,2003,278(10):8028-8034.
[31]ZHU L,LI P,SUN T,KONG M,et al.Overexpression of SFA1 in engineered Saccharomyces cerevisiae to increase xylose utilization and ethanol production from different lignocellulose hydrolysates[J].Bioresource Technology,2020,313:1-5.
[32]佐一含,朱旭东,陈叶福,等.LEU2 基因敲除对工业啤酒酵母高级醇生成量的影响[J].中国酿造,2011(3):27-30.
ZUO Y H,ZHU X D,CHEN Y F,et al.Effect of LEU2 gene knockout on higher alcohols production in industrial Saccharomyces cerevisiae [J].China Brewing,2011(3):27-30.
[33]李童,孙军勇,吴殿辉,等.YDL080C 和LEU2 基因敲除对工业黄酒酵母异戊醇生成量的影响[J].食品工业科技,2015,36(15):189-193.
LI T,SUN J Y,WU D H,et al.Effect of YDL080C and LEU2 gene knockout on isoamyl alcohol production in industrial yellow rice wine yeast[J].Science and Technology of Food Industry,2015,36(15):189-193.
[34]COLÓN M,HERNÁNDEZ F,LÓPEZ K,et al.Saccharomyces cerevisiae Bat1 and Bat2 aminotransferases have functionally diverged from the ancestral-like Kluyveromyces lactis orthologous enzyme[J].Plos One,2011,6(1):e16099.
[35]ZHANG C Y,QI Y N,MA H X,et al.Decreased production of higher alcohols by Saccharomyces cerevisiae,for Chinese rice wine fermentation by deletion of Bat aminotransferases[J].Journal of Industrial Microbiology & Biotechnology,2015,42(4):617-625.
[36]VURALHAN Z,MORAIS M A,TAI S L,et al.Identification and characterization of phenylpyruvate decarboxylase genes in Saccharomyces cerevisiae[J].Applied and Environmental Microbiology,2003,69(8):4534-4541.
[37]杨青.构建基因THI3 和LEU2 缺失的低异戊醇工程程酵母及其应用研究[D].广州:华南理工大学,2017:10-15.
YANG Q.Constructing low isopentanol Saccharomyces cerevisiae with knockout gene THI3 and LEU2 and its application[D].Guangzhou:South China University of Technology,2017:10-15.
[38]FRIDEN P,SCHIMMEL P.LEU3 of Saccharomyces cerevisiae activates multiple genes for branched -chain amino acid biosynthesis by binding to a common decanucleotide core sequence[J].Molecular and Cellular Biology,1988,8(7):2690-2697.
[39]GONZALEZ J,LOPEZ G,ARGUETA S,et al.Diversification of transcriptional regulation determines subfunctionalization of paralogous branched chain aminotransferases in the yeast Saccharomyces cerevisiae[J].Genetics,2017,207(3):975-991.
[40]LIU X,LEE C K,GRANEK J A,et al.Wholegenome comparison of Leu3 binding in vitro and in vivo reveals the importance of nucleosome occupancy in target site selection[J].Genome Research,2006,16(12):1517-1528.
[41]MONTEIRO P T,OLIVEIRA J,PAIS P,et al.YEASTRACT+:a portal for cross-species comparative genomics of transcription regulation in yeasts[J].Nucleic Acids Research,2020,48(D1):D642-D649.