薏米又名薏苡仁、六谷米等,为一年生或多年生禾本科植物,在包括我国在内的许多亚洲国家都有悠久的种植历史[1]。薏米富含蛋白质、脂肪、矿物质以及富有生理活性的植物甾醇、薏苡仁内酯、多酚等化合物[2],是一种典型的药食两用资源。现代医学研究证实薏米具有抗炎[3]、抗肿瘤[4],提高机体免疫[5]等功能。薏米在精加工过程中产生大量的薏米麸皮,薏米麸皮作为薏米加工的副产物目前利用率仍较低,大部分被直接丢弃或少部分用作饲料、薏米油提取[6]。薏米麸皮较薏米籽粒其它部位具有更高含量的多酚类物质,具有较高的利用价值[7]。多酚是一种广泛存在于植物体皮、根、叶和果实中的重要次生代谢物,可由一个或多个芳香环组成,且在芳香环上至少存在一个羟基取代基。根据多酚芳香环的数量及附着在芳香环上的结构部分,可将其分为酚酸、黄酮、鞣质和木脂素等[8]。目前,多酚被证实具有良好的抗氧化[6]、抗肿瘤[9]和治疗高尿酸血症[7]等功能。然而,多酚因特殊的酚羟基结构,存在水溶性差、分子稳定性低等问题,故限制了其实际应用[10]。矫馨瑶等[11]研究发现外界加工条件,如pH 值、温度、光照、防腐剂、糖浓度和氧化剂都对蓝莓多酚的稳定性和抗氧化活性有较大影响。Fang 等[12]研究发现贮藏温度、水分活度可显著影响杨梅多酚的稳定性。通过有效的技术手段提高多酚在加工和贮存过程中的稳定性具有重要意义。
环糊精是由D-(+)-吡喃葡萄糖单元通过α-1,4-葡萄糖苷键连接而成的环状低聚糖,因特殊的中空圆锥形结构而使其具有疏水空腔和亲水外表面[13]。β-CD 是目前应用最广泛的环糊精,由7个葡萄糖单元组成。疏水空腔的内部结构使得环糊精能在不改变客体化学结构的情况下完全或部分包封多种客体分子,主客体分子之间主要通过范德华力、疏水相互作用、氢键等作用力形成包合物。研究发现在与环糊精形成包合物后,客体分子的许多物理和化学性质都会得到明显改善[10]。王轶博等[14]制备了杨梅素与葡萄糖基-β-CD 包合物,发现杨梅素通过包合,水中溶解度提高了70.24 倍,同时其自由基清除能力明显提高。Rodrigues 等[15]通过共蒸发法制备罗勒精油与β-CD的包合物,发现罗勒精油的热稳定性和抗炎活性显著提高。薏米中的多酚化合物在受热条件下很容易发生降解[16],然而,目前有关提高其稳定性的研究鲜有报道。
本文以薏米加工副产物脱脂薏米麸皮为原料制备ABP,将其与β-CD 进行复合处理得到ABP/β-CD 包合物,研究该包合物的理化特性,以期提高ABP 的利用率,为其相关产品开发提供理论依据。
1 材料与方法
1.1 材料与试剂
ABP:本实验室自制,新鲜薏米麸皮由福建省浦城县官路神农薏米专业合作社提供,麸皮经正己烷脱脂后先进行孵育处理以充分释放麸皮中的酚类物质[17],接着用80%乙醇提取酚类物质,然后将粗提液用AB-8 大孔树脂分离纯化,洗脱液经减压浓缩后冷冻干燥,粉碎过筛后-80 ℃保存备用。
β-CD,国药集团化学试剂有限公司;2,4,6-三(2-吡啶基)三嗪(TPTZ)、6-羟基-2,5,7,8-四甲基苯并二氢吡喃-2-羧酸(Trolox)、2,2'-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS),美国Sigma 公司。
1.2 仪器与设备
FD-2C 冷冻干燥机,北京博医康实验仪器有限公司;Nicolet iS50 傅里叶变换红外光谱仪(fourier transform infrared spectroscopy,FTIR),美国赛默飞世尔科技有限公司;SmartLab 9kw X 射线衍射仪(X-ray Diffraction,XRD),日本Rigaku公司;STA449 F3 热重-差示扫描量热仪(thermogravimetry-differential scanning calorimetry,TGDSC),德国Netzsch 公司;SEU8010 扫描电子显微镜(scanning electron microscope,SEM),日本Hitachi 公司。
1.3 方法
1.3.1 ABP/β-环糊精包合物的制备 采用冷冻干燥法制备包合物[18],先将3.78 g β-CD 完全溶解于100 mL 去离子水中,再加入0.63 g ABP,40 ℃保温搅拌2 h,冷冻干燥后得到ABP/β-CD 包合物。将ABP 与β-CD 按质量比1∶6 在研钵中充分研磨混合即得到物理混合物。
1.3.2 紫外光谱分析 准确称取ABP(1 mg)、β-CD(6 mg)、ABP/β-CD 包合物(7 mg),分别溶解于10 mL 去离子水中,测定其在220~400 nm 波长范围内的紫外吸收光谱,扫描间隔为1 nm。
1.3.3 红外光谱分析 采用溴化钾压片法对ABP、β-CD、ABP/β-CD 包合物及物理混合物进行红外光谱分析,按照质量比1∶100 分别称取样品与溴化钾,于研钵中充分研磨混匀后压片,然后采用FTIR 以4 cm-1 的分辨率在4 000~400 cm-1 的范围内扫描样品,扫描次数为32 次。
1.3.4 XRD 分析 对ABP、β-CD、ABP/β-CD 包合物及物理混合物进行XRD 分析,测试时采用Cu 靶Kα 射线,波长为0.154 nm,扫描范围2θ 为5°~45°,扫描速率为10°/min。
1.3.5 热特性分析 对ABP、β-CD、ABP/β-CD 包合物及物理混合物进行热特性分析,称取适量样品均匀分散在Al2O3 坩埚中,使用TG-DSC 测量样品的热特性,以10 ℃/min 的升温速率将样品从30 ℃加热到600 ℃,测试过程中控制氮气流速为70 mL/min。
1.3.6 SEM 分析 对ABP、β-CD、ABP/β-CD 包合物及物理混合物进行SEM 分析,取适量样品用双面胶带固定于铜短管上,然后真空喷金以增强导电性,在5 kV 的加速电压下进行样品形貌观察。
1.3.7 抗氧化活性分析 准确称取ABP(5 mg)和ABP/β-CD 包合物(35 mg),分别溶解于100 mL去离子水中,采用ABTS 和FRAP 法测定溶液的抗氧化活性,结果以Trolox 当量表示,单位为mmol TE/L。ABTS 阳离子自由基清除能力的测定参考Xu 等[17]的方法,准确移取100 μL 样品溶液和3.9 mL ABTS 阳离子自由基工作液于10 mL 离心管中,充分混匀,室温避光反应15 min 后于734 nm 处测定吸光值。FRAP 的测定参考Katalinic等[19]的方法,准确移取90 μL 样品溶液和270 μL去离子水于10 mL 离心管中,然后加入2.7 mL FRAP 试剂,充分混匀后室温避光反应30 min 后于593 nm 处测定吸光值。
1.3.8 溶液光照稳定性分析 参照Liu 等[20]的方法对ABP 和ABP/β-CD 包合物进行水溶液光照稳定性分析。准确称取ABP(1 mg)和ABP/β-CD包合物(7 mg),分别溶解于10 mL 去离子水中,于室温条件下白炽灯光照48 h,每隔一段时间取样。采用Folin-Ciocalteu 法[7]测定溶液中总酚含量,并计算总酚保留率。
1.4 数据统计与分析
每组试验均重复测定3 次,试验结果采用SPSS 20.0 软件进行分析,P<0.05 有显著性差异,使用Origin Pro 2021 软件作图。
2 结果与分析
2.1 紫外光谱分析
ABP、β-CD、及其包合物的紫外光谱图如图1所示。β-CD 没有不饱和结构,因而其在220~400 nm 范围内几乎没有任何吸收,而ABP 具有苯环、羰基等不饱和结构,其在284 nm 有特征吸收峰[21]。在ABP 和β-CD 形成包合物后,特征吸收峰位置未发生明显变化,其强度明显增加。冯光炷等[22]研究了β-CD 对β-胡萝卜素紫外吸收光谱的影响,研究发现随着β-CD 的浓度增加β-胡萝卜素的吸光度增加而吸收波长未发生变化,这与本文的研究结果一致。当与客体分子形成复合物后,β-CD 疏水空腔内较高的电子云密度可引发客体分子电子云的微拢或流动,从而引起客体分子紫外光谱峰位移或增强。

图1 ABP(a)、β-CD(b)和ABP/β-CD 包合物(c)紫外光谱图
Fig.1 UV scanning results of adlay bran polyphenols(a),β-CD(b),and adlay bran polyphenols/β-CD inclusion complex(c)
2.2 红外光谱分析
红外光谱是一种研究分子运动吸收光谱的技术,可分析短程范围内分子结构变化[23]。ABP、β-CD 及其混合物和包合物在4 000~400 cm-1 范围内的红外谱图如图2所示。ABP 在3 388 cm-1 处出现O-H 的特征峰,1 689 cm-1 处出现C=O 的特征吸收峰,1 602,1 515 和1 449 cm-1 处出现苯环骨架振动产生的峰,而β-CD 在3 377 cm-1 处出现O-H 的特征峰,2 925 cm-1 处出现亚甲基的特征峰,1 030 cm-1 处出现糖苷键的特征峰,1 156,1 079和1 030 cm-1 处出现C-H、C-O 的伸缩振动峰[24]。在ABP 与β-CD 物理混合物的红外光谱基中,既包含了O-H、亚甲基的吸收峰,也包含了C=O、苯环骨架的振动峰,基本上为二者红外光谱的简单叠加,表明ABP 与β-CD 保留了各自的基本化学结构。而其包合物的图谱整体上更接近于β-CD,ABP 在1 200~1 700 cm-1 之间的大部分特征吸收峰明显减弱,该结果表明ABP 的芳香环已进入β-CD 疏水腔体内成功形成包合物[25]。

图2 ABP(a)、β-CD(b)、ABP 与β-CD 物理混合物(c)和ABP/β-CD 包合物(d)红外光谱图
Fig.2 FTIR spectra of adlay bran polyphenols(a),β-CD(b),physical mixture of adlay bran polyphenols and β-CD(c),and adlay bran polyphenols/β-CD inclusion complex(d)
2.3 XRD 分析
XRD 已被证实是一种表征环糊精包合物中主客体相互作用的有效方法[26]。ABP、β-CD 及其混合物和包合物的XRD 结果如图3所示。ABP 和β-CD 呈现明显的晶型结构,拥有众多强烈而尖锐的衍射峰。在ABP 与β-CD 物理混合物的XRD 图中,均能观察到ABP 和β-CD 尖锐的结晶衍射峰,而在二者的包合物图谱中尖锐的结晶衍射峰消失,仅在2θ 为12.4°和17.6°附近有两个宽大的吸收峰。此表明在ABP 和β-CD 物理混合物中只是简单的主客体混合,而在包合物中主客体之间发生了明显的化学作用[14]。当ABP 与β-CD 形成包合物时,客体ABP 进入主体分子空腔内与β-CD发生相互作用,可使ABP 与β-CD 的结晶度降低或消失。Shao 等[25]在绿原酸/环糊精包合物的研究中也报道了类似的现象。
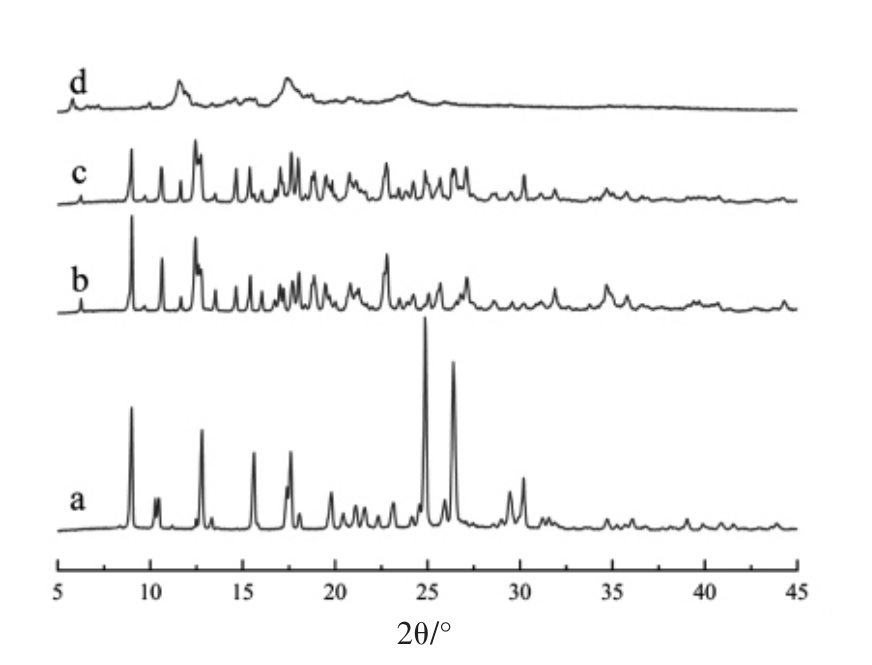
图3 ABP(a)、β-CD(b)、ABP 与β-CD 物理混合物(c)和ABP/β-CD 包合物(d)XRD 图
Fig.3 XRD patterns of adlay bran polyphenols(a),β-CD(b),physical mixture of adlay bran polyphenols and β-CD(c),and adlay bran polyphenols/β-CD inclusion complex(d)
2.4 热特性分析
主客体分子发生包合作用时可引发其吸、放热峰的消失或移动,导致晶体熔点、沸点、焓值等的变化[27]。ABP、β-CD 及其物理混合物和包合物的DSC 图谱如图4所示。由图可知,ABP 在158.4 和236.4 ℃处有两个吸热峰,而β-CD 则分别在94.5和321.7 ℃处有两个吸热峰。当ABP 和β-CD 物理混合后,在89.8 和329.6 ℃处出现两个大的吸热峰,此外在158.4 ℃处仍可以明显分辨出属于ABP 的特征吸热峰。当二者形成包合物时仅在75.1 和321.1 ℃处出现两个大的吸热峰,而158.4 ℃处的ABP 特征吸热峰已无法分辨出。同时,ABP/β-CD 包合物在321.1 ℃处吸热峰的焓值(102.3 J/g)要显著低于二者物理混合物在329.6 ℃处吸热峰的焓值(150.7 J/g)。
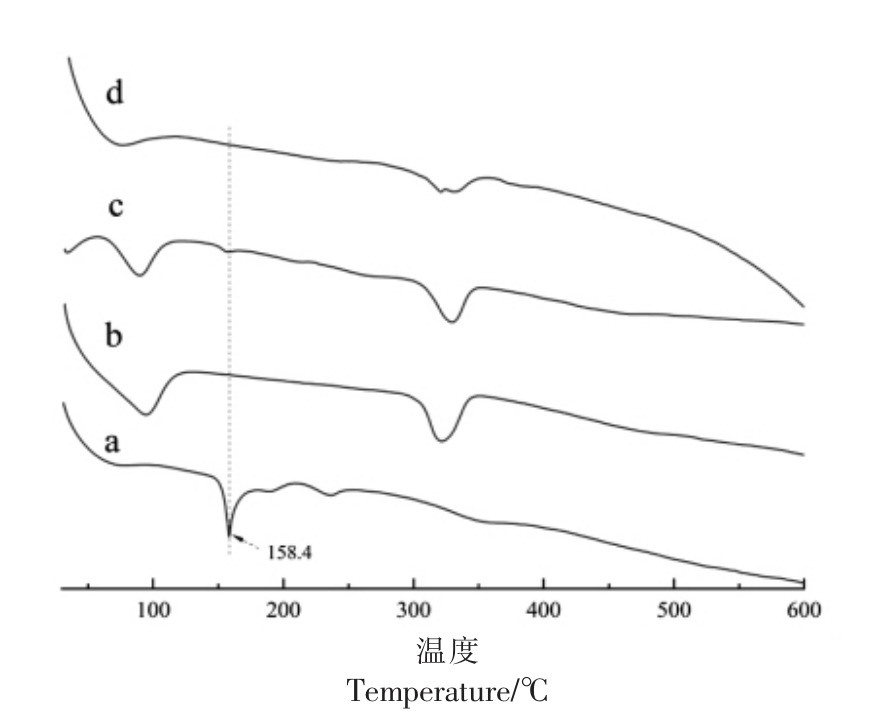
图4 ABP(a)、β-CD(b)、ABP 与β-CD 物理混合物(c)和ABP/β-CD 包合物(d)DSC 图
Fig.4 DSC curves of adlay bran polyphenols(a),β-CD(b),physical mixture of adlay bran polyphenols and β-CD(c),and adlay bran polyphenols/β-CD inclusion complex(d)
ABP、β-CD 及其物理混合物和包合物的TG图谱如图5所示。从图1中可以看出,β-CD 的热解过程分为两个阶段,其峰值分别出现在90.3 和321.5 ℃处。第一阶段失重率为10.5%,为结晶失水过程;第二阶段失重率为62.9%,为β-CD 的热分解过程。对于ABP,TG 曲线显示其在190.0 ℃前几乎没有质量损失,而后随着温度的升高ABP 逐渐发生分解,在190.0~383.7 ℃温度范围内,ABP的失重率为87.2%。ABP/β-CD 的包合物和物理混合物在温度升至70.0 ℃时质量均持续下降,但物理混合物的热重损失速率显著高于包合物,包合物的最终残留质量(8.0%) 显著高于物理混合物(4.3%)。上述结果表明通过与β-CD 的包合,ABP的热稳定性得到了提高。

图5 ABP(a)、β-CD(b)、ABP 与β-CD 物理混合物(c)和ABP/β-CD 包合物(d)TG 图
Fig.5 TG diagrams of adlay bran polyphenols(a),β-CD(b),physical mixture of adlay bran polyphenols and β-CD(c),and adlay bran polyphenols/β-CD inclusion complex(d)
2.5 SEM 分析
ABP、β-CD 及其混合物和包合物的表面形貌观察结果如图6所示。ABP 为大小规则的针状晶体结构,表面光滑,而β-CD 则呈体积较大的不规则碎片状。在二者的物理混合物中,两种形态的颗粒结构均能被观察到,且分离明显。而ABP/β-CD包合物则呈致密、均匀的片状结构,与ABP 和β-CD 在大小和形状方面具有较大差异,这些结果进一步表明包合物的形成[21]。当ABP 与β-CD 形成包合物时,主、客体分子之间的相互作用导致其晶体结构发生变化,进而引发包合物形貌发生了很大变化。Shao 等[25]在绿原酸和β-CD 形成复合物过程中也报道了显著的形态结构变化。

图6 ABP(a)、β-CD(b)、ABP 与β-CD 物理混合物(c)和ABP/β-CD 包合物(d)SEM 图
Fig.6 SEM photos of adlay bran polyphenols(a),β-CD(b),physical mixture of adlay bran polyphenols and β-CD(c),and adlay bran polyphenols/β-CD inclusion complex(d)
2.6 抗氧化活性
多酚是植物体中的一大类重要次级代谢产物,可清除自由基、鳌合金属离子、淬灭单线态氧,具有较强的抗氧化活性[28]。为了探讨包合作用对ABP 抗氧化活性的影响,分别采用ABTS 和FRAP法比较了同一浓度下游离和络合ABP 的抗氧化活性。其中,ABTS 法测量的是样品对自由基的清除作用,而FRAP 法考察的是样品的铁离子还原能力[19]。如图7所示,ABP 的ABTS 阳离子自由基清除能力和FRAP 分别为0.450 和0.303 mmol TE/L,而ABP/β-CD 包合物的ABTS 阳离子自由基清除能力和FRAP 分别为0.475 和0.330 mmol TE/L,分别较ABP 提高了5.6%和8.9%(P<0.05)。β-CD 本身没有任何抗氧化活性[14],然而当ABP 与β-CD 形成包合物时,β-CD 的仲羟基与ABP 芳香环上羟基之间形成的分子间氢键作用可能在一定程度上促进了包合物抗氧化活性的提高[29-30]。与本研究类似,Chao 等[31]和Shao 等[25]的研究结果也表明与环糊精形成包合物后客体分子的抗氧化活性提高。
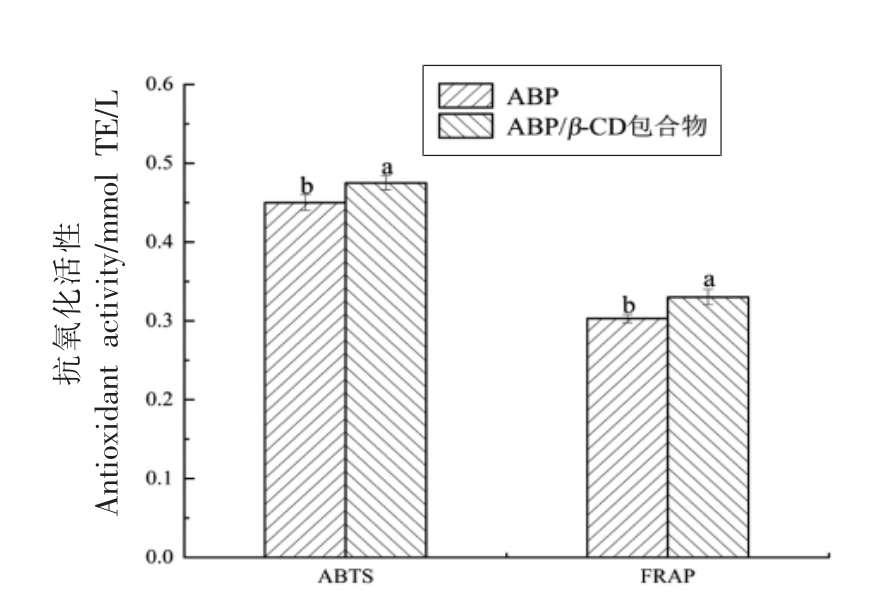
图7 ABP 和ABP/β-CD 包合物抗氧化活性比较
Fig.7 Comparison of the antioxidant activity between adlay bran polyphenols and adlay bran polyphenols/β-CD inclusion complex
注:同一指标不同小写字母表示差异显著(P<0.05)。
2.7 水溶液光照稳定性
酚类物质通常对外界环境条件敏感,尤其是在水溶液体系中,温度、光照、pH 值等都会影响其稳定性,因此在加工和储存过程中容易发生降解[12]。Liu 等[20]研究表明儿茶素和表儿茶素溶液在pH 8.0 条件下储藏48 h 损失率可分别达到21.2%和40.0%,而Zheng 等[32]研究发现杨梅多酚粉末在37 ℃,75%湿度条件下加速储藏6 周后总酚损失率可达到88.61%。目前,包括微胶囊在内的多种技术已被应用于酚类物质稳定性的提高[33]。光照条件下ABP 和ABP/β-CD 包合物水溶液总酚保留率的动态变化如图8所示。光照对ABP 的稳定性有很大的影响,随着光照时间的延长ABP 逐渐降解,48 h 后,在客体ABP 中总酚保留率仅为79.0%,而在ABP/β-CD 包合物中总酚保留率达到了95.0%,是客体ABP 的1.20 倍(P<0.05)。结果表明,β-CD 包合处理可显著提高ABP 的光稳定性。这主要是由于β-CD 具有梯状空心椎体结构,可通过非共价键与包括香料、精油和抗氧化剂在内的多种物质形成包合物,进而为客体物质提供保护作用[34]。类似地,Li 等[18]也报告了用β-CD 包合处理后桑椹多酚的光稳定性有所提高。
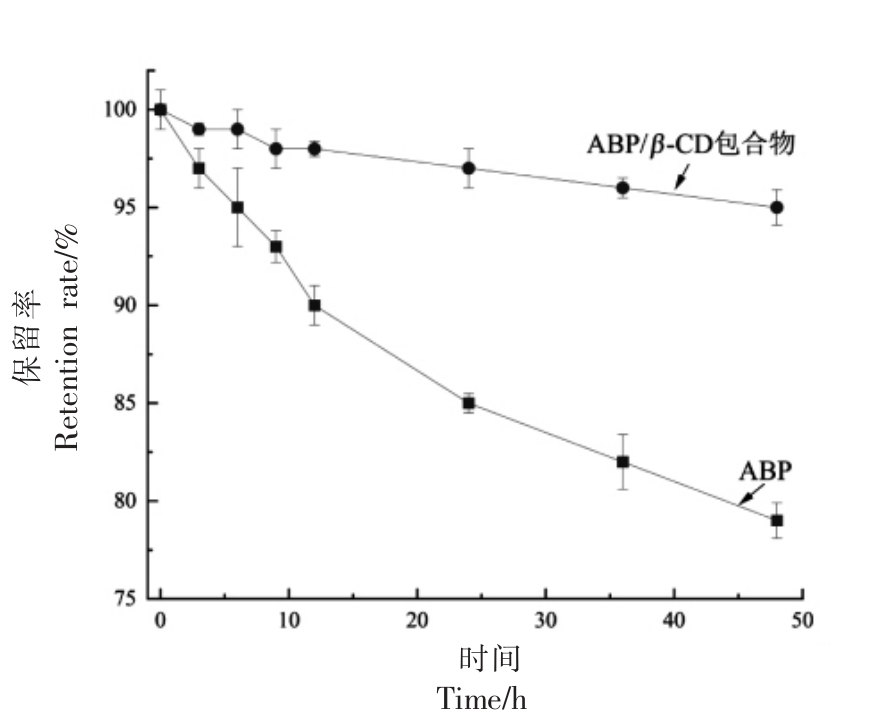
图8 ABP 和ABP/β-CD 包合物光照稳定性比较
Fig.8 Comparison of the light stability between adlay bran polyphenols and adlay bran polyphenols/β-CD inclusion complex
3 结论
采用冷冻干燥法制备ABP/β-CD 包合物。利用XRD、FTIR、TG-DSC、SEM 等分析方法对ABP/β-CD 包合物的结构进行了表征。与未包合前的ABP 相比,ABP/β-CD 包合物的ABTS 阳离子自由基清除能力提高了5.6%(P<0.05),FRAP 增大了8.9%(P<0.05)。水溶液光照稳定性试验表明:随着光照时间的延长,ABP 会逐渐发生降解,48 h 后,ABP/β-CD 包合物的总酚保留率是客体ABP 的1.20 倍(P<0.05)。ABP/β-CD 包合物具有良好的热稳定性、抗氧化活性和水溶液光照稳定性,可作为功能性食品的原料。
[1]李长凤,陈光静,谢佩言,等.薏米粒径和谷朊粉添加量对薏米挂面品质的影响[J].食品与发酵工业,2018,44(10):196-203.
LI C F,CHEN G J,XIE P Y,et al.Effects of particle size and wheat gluten content on the quality of pearl barley noodle[J].Food and Fermentation Industries,2018,44(10):196-203.
[2]ZHU F.Coix:Chemical composition and health effects[J].Trends in Food Science & Technology,2017,61:160-175.
[3]CHOI G,HAN A R,LEE J H,et al.A comparative study on hulled adlay and unhulled adlay through evaluation of their LPS-induced anti-inflammatory effects,and isolation of pure compounds[J].Chemistry & Biodiversity,2015,12(3):380-387.
[4]CHEN H J,LO Y C,CHIANG W C.Inhibitory effects of adlay bran(Coix lachryma-jobi L.var.ma-yuen Stapf) on chemical mediator release and cytokine production in rat basophilic leukemia cells[J].Journal of Ethnopharmacology,2012,141(1):119-127.
[5]YAO Y,ZHU Y Y,GAO Y,et al.Effect of ultrasonic treatment on immunological activities of polysaccharides from adlay[J].International Journal of Biological Macromolecules,2015,80:246-252.
[6]WANG L F,CHEN C,SU A X,et al.Structural characterization of phenolic compounds and antioxidant activity of the phenolic-rich fraction from defatted adlay(Coix lachryma-jobi L.var.ma-yuen Stapf) seed meal[J].Food Chemistry,2016,196:509-517.
[7]ZHAO M M,ZHU D S,SUN-WATERHOUSE D X,et al.In vitro and in vivo studies on adlay-derived seed extracts:phenolic profiles,antioxidant activities,serum uric acid suppression,and xanthine oxidase inhibitory effects[J].Journal of Agri cultural and Food Chemistry,2014,62(31):7771-7778.
[8]NACZK M,SHAHIDI F.Phenolics in cereals,fruits and vegetables:Occurrence,extraction and analysis[J].Journal of Pharmaceutical and Biomedical Analysis,2006,41(5):1523-1542.
[9]CHEN C,ZHANG Y Y,GAO Y L,et al.Identification and anti-tumour activities of phenolic compounds isolated from defatted adlay(Coix lachrymajobi L.var.ma-yuen Stapf) seed meal[J].Journal of Functional Foods,2016,26:394-405.
[10]XIONG X Y,ZHAO X F,SONG Z H.Exploring host-guest interactions of sulfobutylether-β-cyclodextrin and phenolic acids by chemiluminescence and site-directed molecular docking[J].Analytical biochemistry,2014,460:54-60.
[11]矫馨瑶,李恩惠,王月华,等.蓝莓多酚稳定性及热降解动力学研究[J].中国食品学报,2018,18(1):81-87.
JIAO X Y,LI E H,WANG Y H,et al.Studies on the stability and thermal degradation kinetics of blueberry polyphenols[J].Journal of Chinese Institute of Food Science and Technology,2018,18(1):81-87.
[12]FANG Z X,BHANDARI B.Effect of spray drying and storage on the stability of bayberry polyphenols[J].Food Chemistry,2011,129(3):1139-1147.
[13]GUO C J,XIAO Y.Negatively charged cyclodextrins:Synthesis and applications in chiral analysis-A review[J].Carbohydrate Polymers,2020,256:117517.
[14]王轶博,符晓芳,袁丽,等.杨梅素与G-β-CD 的包合作用及抗氧化性分析[J].食品科学,2020,41(4):1-6.
WANG Y B,FU X F,YUAN L,et al.Preparation and antioxidant properties of inclusion complex of myricetin with glucose-β-cyclodextrin[J].Food Science,2020,41(4):1-6.
[15]RODRIGUES L B,MARTINS A O B P B,RIBEIRO-FILHO J,et al.Anti-inflammatory activity of the essential oil obtained from Ocimum basilicum complexed with β-cyclodextrin(β-CD) in mice[J].Food and Chemical Toxicology,2017,109:836-846.
[16]XU B J,CHEN X.Comparative studies on free radical scavenging capacities and total phenolic contents of whole and dehulled adlay(Coix lacrymajobi var.ma-yuen) as affected by thermal processing methods[J].Journal of Food Processing and Preservation,2013,37(5):630-636.
[17]XU L,GAO S,XU H,et al.Impact of incubation on nutritional and antioxidant properties of defatted adlay(Coix lachryma-jobi L.) bran[J].LWT - Food Science and Technology,2021,137:110463.
[18]LI D L,ZHU M J,LIU X M,et al.Insight into the effect of microcapsule technology on the processing stability of mulberry polyphenols[J].LWT -Food Science and Technology,2020,126:109144.
[19]KATALINIC V,MODUN D,MUSIC I,et al.Gender differences in antioxidant capacity of rat tissues determined by 2,2′-azinobis(3-ethylbenzothiazoline 6-sulfonate;ABTS) and ferric reducing antioxidant power(FRAP) assays[J].Comparative Biochemistry And Physiology Part C:Toxicology & Pharmacology,2005,140(1):47-52.
[20]LIU M,ZHENG Y,WANG C M,et al.Improved stability of(+)-catechin and(-)-epicatechin by complexing with hydroxypropyl-β-cyclodextrin:Effect of pH,temperature and configuration [J].Food Chemistry,2016,196:148-154.
[21]ZHANG D X,ZHU J F,YE F Y,et al.Non-covalent interaction between ferulic acid and arabinanrich pectic polysaccharide from rapeseed meal[J].International Journal of Biological Macromolecules,2017,103:307-315.
[22]冯光炷,卢奎,李和平.紫外-可见光谱研究β-环糊精与β-胡萝卜素的包结作用[J].光谱学与光谱分析,2004,24(9):1099-1102.
FENG G Z,LU K,LI H P.Study on the inclusion complexation interaction of β-cyclodextrin and βcarotene by UV-Vis spectra[J].Spectroscopy and Spectral Analysis,2004,24(9):1099-1102.
[23]XU L,CHEN L,ALI B,et al.Impact of germination on nutritional and physicochemical properties of adlay seed(Coixlachryma-jobi L.)[J].Food Chemistry,2017,229:312-318.
[24]OLGA G,STYLIANI C,IOANNIS R G.Coencapsulation of ferulic and gallic acid in hp-b-cyclodextrin[J].Food Chemistry,2015,185:33-40.
[25]SHAO P,ZHANG J F,FANG Z X,et al.Complexing of chlorogenic acid with β -cyclodextrins:Inclusion effects,antioxidative properties and potential application in grape juice[J].Food Hydrocolloids,2014,41:132-139.
[26]YANG R,CHEN J B,DAI X Y,et al.Inclusion complex of GA-13315 with cyclodextrins:Preparation,characterization,inclusion mode and properties[J].Carbohydrate Polymers,2012,89(1):89-97.
[27]HORVATH G,PREMKUMAR T,BOZTAS A,et al.Supramolecular nanoencapsulation as a tool:Solubilization of the anticancer drug trans -dichloro(dipyridine) platinum(II) by complexation with βcyclodextrin [J].Journal of Agricultural and Food Chemistry,2008,5(2):358-363.
[28]JIANG Y Q,FANG Z X,LEONARD W,et al.Phenolic compounds in Lycium berry:Composition,health benefits and industrial applications[J].Journal of Functional Foods,2021,77:104340.
[29]STRAŽIŠAR M,ANDRENŠEK S,ŠMIDOVNIK A.Effect of β-cyclodextrin on antioxidant activity of coumaric acids[J].Food Chemistry,2008,110(3):636-642.
[30]NATELLA F,NARDINI M,FELICE M D,et al.Benzoic and cinnamic acid derivatives as antioxidants:Structure-activity relation [J].Journal of Agri cultural and Food Chemistry,1999,47(4):1453-1459.
[31]CHAO J B,WANG H F,ZHAO W,et al.Investigation of the inclusion behavior of chlorogenic acid with hydroxypropyl-β-cyclodextrin[J].International Journal of Biological Macromolecules,2012,50(1):277-282.
[32]ZHENG L Q,DING Z S,ZHANG M,et al.Microencapsulation of bayberry polyphenols by ethyl cellulose:Preparation and characterization[J].Journal of Food Engineering,2011,104(1):89-95.
[33]XU L,CHENG J R,LIU X M,et al.Effect of microencapsulated process on stability of mulberry polyphenol and oxidation property of dried minced pork slices during heat processing and storage[J].LWT - Food Science and Technology,2019,100:62-68.
[34]KAYACI F,SEN H S,DURGUN E,et al.Functional electrospun polymeric nanofibers incorporating geraniol-cyclodextrin inclusion complexes:High thermal stability and enhanced durability of geraniol[J].Food Research International,2014,62:424-431.