食品中含有大量的两性化合物成分,如多糖、蛋白质、油脂等,这些成分在食品加工过程中容易发生自组装形成微纳米级别的胶体颗粒[1]。这种胶体颗粒广泛存在于多种食品中,如茶[2]、猪骨汤[3-4]、醋[5]、酱油[6]、河蚬汤[7]等。甚至在中药汤剂中也多有发现,如在麻杏石甘汤中发现了装载麻黄碱与伪麻黄碱的纳米颗粒[8]。众所周知,物质的纳米尺寸化会带来新的物理化学特性和生理效应。作为一种大量、长期且反复被人体摄入的纳米物质,这类纳米颗粒对人体产生的影响必然有别于游离的食品成分,值得引起关注。这类纳米颗粒可以直接与肠道黏膜层相关细胞发生作用[9],如猪骨汤来源的纳米颗粒能与巨噬细胞直接作用,调节细胞的氧化应激状态和免疫功能[3-4],显示了与游离的猪骨汤成分完全不同的生理功能。
河蚬(Corbicula fluminea),又称金蚶,黄金蚬,是一种小型的双壳类动物,富含多糖、蛋白质、脂质和氨基酸等物质。河蚬烹制的汤不仅味道鲜美,而且有降脂保肝等保健作用[10-13]。有研究表明,河蚬汤可以通过降低丝裂原活化蛋白激酶和核因子NF-kappa B 的活化,抑制脂多糖活化巨噬细胞的炎症反应,显著增加巨噬细胞的内吞活性,具有调节机体免疫功能和修复肝损伤的作用[14]。河蚬汤中存在大量纳米颗粒,装载了汤中大部分活性护肝成分,如植物甾醇、鸟氨酸、牛磺酸等[7,15]。
本研究将河蚬汤纳米颗粒作为研究对象,以大鼠口腔巨噬细胞为模型,跟踪河蚬汤纳米颗粒进入巨噬细胞的过程及其在胞内的分布,探究纳米颗粒对氧化应激状态下的巨噬细胞的膜电位与线粒体自由基水平与代谢的影响。
1 材料与方法
1.1 试验材料
河蚬,由中国台湾花莲立川水产场养殖并惠赠。
细胞培养基、0.25% EDTA-胰酶、双抗(青霉素、链霉素)、PBS/HBSS 缓冲液和谷氨酰胺等,GIBCO 公司;胎牛血清,以色列Biological Industries 公司;DCFH-DA、AAPH、蛋白酶、HistopaqueR-1077 密度梯度液、Hoechst 33342 染料、DiBAC4(3)与Nile red 染料,美国Sigma 公司;96/48/12/6孔板(黑色透底和普通透底)与T-75 细胞培养板,美国Corning 公司;24 孔激光共聚焦培养板,美国Cellvis 公司;超滤管(Mw=100 ku),美国Millipore公司;多聚甲醛,德国Merck KgaA 公司;尼龙细胞过滤网(100 μm),美国Falcon 公司;其它试剂购于国药集团化学试剂有限公司。
SD 大鼠(SPF 级)购于浙江省动物科学研究所,涉及的动物实验已获浙江省医学科学院动物保护和福利委员会审查批准(编号:2016R10031)。
1.2 主要仪器与设备
细胞培养箱NU-8500,美国NUAIRE 公司;FlexStation 3 多功能钙流工作站,美国Molecular Devides 公司;生物安全柜1300Series II,美国Thermo Forma 公司;手持式细胞计数器ScepterTM2.0,美国Molecular Devices 公司;激光共聚焦显微镜Zeiss LSM780,德国Carl Zeiss SAS 公司;荧光倒置显微镜DMI3000 B,美国Leica 公司;高速离心机T15A36 型,日本Hitachi Koki 公司;-80 ℃超低温冰箱,美国Thermo Forma公司;电子分析天平(微量)XS105DU,Mettler Toledo 仪器有限公司;分析天平ME,METTLER TOLEDO。
1.3 试验分析方法
1.3.1 河蚬汤及其纳米颗粒制备及性质表征 参照前期研究进行制备[15],将河蚬浸泡除沙2~3 h,洗净后按1 000 g/L 比例与水混合,沸水煮60 min,收集汤液,冷却到室温,于5 000 g 离心15 min,除沉淀,所得上清液即为河蚬汤(Freshwater clam soup,FCS)。用Uno-Q 阴离子交换色谱连接多角度激光光散射(multiangle laser light scattering,MALLS) 对河蚬汤中纳米颗粒进行分离纯化,纯化得到两个纳米颗粒组分,收集并分别标记为IEC-P1 和IEC-P2。将FCS、IEC-P1 和IEC-P2进行冻干保藏,供后续试验用。
FCS、IEC-P1 和IEC-P2 的平均水合粒径(Dh)和zeta 电位采用动态光散射仪进行测定,每组数值进行3 次重复,汤的黏度、折射率和吸收值采用Malvern 软件提供的水的黏度μ=0.8872 cP,折射率RI=0.135 进行换算。
1.3.2 SD 大鼠口腔巨噬细胞的制备 SD 大鼠经脱颈处死,于75%的乙醇溶液中浸泡5 min 进行灭菌处理。取出置于无菌操作台中,用无菌剪刀和镊子将大鼠的面颊皮层剪开,小心剖出其面颊肌肉和上软腭,放入PBS(预先经4 ℃冷却且已加入体积分数1%的双抗)溶液中,洗掉当中的少许血块,并除去面颊肌肉上的筋条,此过程重复4 次。启用另外一套无菌剪刀和镊子,将肌肉和软腭切成1 mm3 左右的小块,放入经37 ℃预热的消化液(不含FBS 的DMEM 培养液,0.075% I 型 胶原酶,0.075% II 型胶原酶)中,置于37 ℃环境下消化2 h,期间每5 min 摇匀一次。用100 μm 的尼龙过滤网过滤消化液并收集滤过液,将其于25 ℃下进行400 g,5 min 的离心,留沉淀,用DMEM 维持液重悬,再离心,而后制成重悬液,按体积比1 ∶1比例,小心地将细胞悬液加在HistopaqueR-1077巨噬细胞密度梯度液上,于20 ℃下400 g 离心20 min。离心后,离心管的溶液分为3 层,中间薄薄的一层即为目标细胞群,小心取出该层细胞,用DMEM 维持液重悬,于400 g 离心5 min 除去残余的密度梯度液。最后用含有15% FBS、1%双抗的DMEM 培养基制备细胞悬液,调节细胞浓度为1×106 cells/mL,并培养于T-75 细胞培养瓶中,置于37 ℃,5% CO2 培养箱中2 h,取出,小心移除未贴壁的细胞,即为消化纯化后的口腔巨噬细胞,在其中加入新的DMEM 培养基,培养过夜,待用。
1.3.3 河蚬纳米颗粒进入口腔巨噬细胞的观察河蚬纳米颗粒采用尼罗红标记染色。用DMSO 配制1%的尼罗红母液,向FCS、IEC-P1 和IEC-P2纳米颗粒悬液中加入尼罗红溶液(终质量浓度为1 μg/mL),常温下避光染色1 h,染色结束后,利用超滤离心管(100 ku)于5 000 g 离心力下离心10 min,截留组分利用HBSS 重悬,超滤,多次进行直至滤液中未观察到尼罗红染液荧光,最后用DMEM 等体积重悬截留组分,待用。
将1 000 μg/mL 的标记后的纳米颗粒悬液与口腔巨噬细胞(2×104 cells/mL)在37 ℃,5% CO2的培养箱中孵育2 h,取出并去除板内培养基,加入0.6 mL 的含1 μmol/L Hoechst 33342 的HBSS染液,孵育5 min,利用HBSS 清洗细胞两次。于激光共聚焦荧光显微镜下观察口腔巨噬细胞与纳米颗粒的作用情况。激光共聚焦选用双通道设置。1)尼罗红:激发/发射波长=(549/628)nm;2)Hoechst 33342:激发/发射波长=(346/460)nm。
1.3.4 河蚬汤及其纳米颗粒对大鼠口腔巨噬细胞细胞膜电位和线粒体自由基含量的影响 检测FCS、IEC-P1 和IEC-P2 分别在1 000,250 和62.5 μg/mL 3 个质量浓度下对口腔巨噬细胞膜电位及线粒体自由基含量的影响。于96 孔培养板中接2×104 cells/孔的口腔巨噬细胞悬液200 μL,置于37 ℃,5% CO2 培养箱里过夜培养。取出并去除残余的培养基,用HBSS 清洗细胞2 遍,加入3 μmol/L 的线粒体超氧化物红色荧光探针(MitoSOX Red 溶液)200 μL/孔,于培养箱孵育10 min,小心吸取上清液,用HBSS 清洗2 遍,加入100 μL 2.5 μmol/L 的DiBAC4(3)溶液,于培养箱孵育15 min 后,往孔内加入50 μL AAPH(终质量浓度6.4 μmol/L)或50 μL HBSS,同时继续加入50 μL 样品(终质量浓度为1 000,250 和62.5 μg/mL),试验同时设立空白组、阳性对照组(AAPH)。完成加样后,选用双通道测定。(a)MitoSOX Red染料:激发/发射波长=(510/580)nm;(b)DiBAC4(3)染料:激发/发射波长=(493/516)nm。检测时长为120 min,每10 min 测定一次荧光值。
2 结果与讨论
2.1 河蚬汤中纳米颗粒的理化性质表征
河蚬汤中纳米颗粒的平均水合粒径和zeta电位分别为(76±0.5)nm 和-11.2 mV。按照前期研究中建立的方法分离制备河蚬汤中纳米颗粒[15],得到IEC-P1 和IEC-P2 两种纳米颗粒组分,其平均水合粒径和zeta 电位分别为(50±0.2)nm 和-28 mV、(67±0.4)nm 和-10.0 mV。FCS、IEC-P1 和IEC-P2 各组分中都含有为多糖、脂质、蛋白质和植物甾醇。
尼罗红作为脂质染料,可呈现红色荧光,常用来示踪脂质成分在细胞内或者体内的代谢状况[16]。如图1所示,激光共聚焦显微镜下,经尼罗红标记后的河蚬纳米颗粒呈红色小点。比较染色前后纳米颗粒的粒径大小和zeta 电位的变化,发现它们未发生明显的变化(数据未显示),说明河蚬汤纳米颗粒具有很好的稳定性。

图1 河蚬汤及其两颗粒组分Nile red 染色后荧光显微图
Fig.1 Fluorescence micrograph of freshwater clam soup and the two isolated nanoparticle fractions with Nile red staining
2.2 河蚬汤纳米颗粒和大鼠口腔巨噬细胞的直接作用
2.2.1 河蚬汤纳米颗粒进入口腔巨噬细胞的观察 经尼罗红染色的河蚬汤(FCS) 及纳米颗粒(IEC-P1 和IEC-P2) 作用于大鼠口腔巨噬细胞,结果如图2所示。巨噬细胞分别和FCS、IEC-P1与IEC-P2 作用2 h 后,在胞浆和细胞核中均可以观察到红色荧光颗粒(如图片箭头所示)。二者相互作用后在巨噬细胞胞内观察到的红色荧光颗粒与河蚬汤纳米颗粒在形态和大小上并无明显不同,表明河蚬汤纳米颗粒能以颗粒的完整形态进入胞内与巨噬细胞发生作用,部分颗粒还能进入细胞核内。河蚬汤纳米颗粒进入细胞胞内的行为可能同时与纳米颗粒理化性质和巨噬细胞的吞噬行为有关,即主动跨越生物膜和被动为巨噬细胞吞噬,其机制尚不完全明确。另一方面,巨噬细胞吞噬河蚬汤纳米颗粒后,激光共聚焦显微镜下并未观察细胞形态发生改变,表明河蚬汤纳米颗粒对巨噬细胞没有明显或急性的毒性作用。
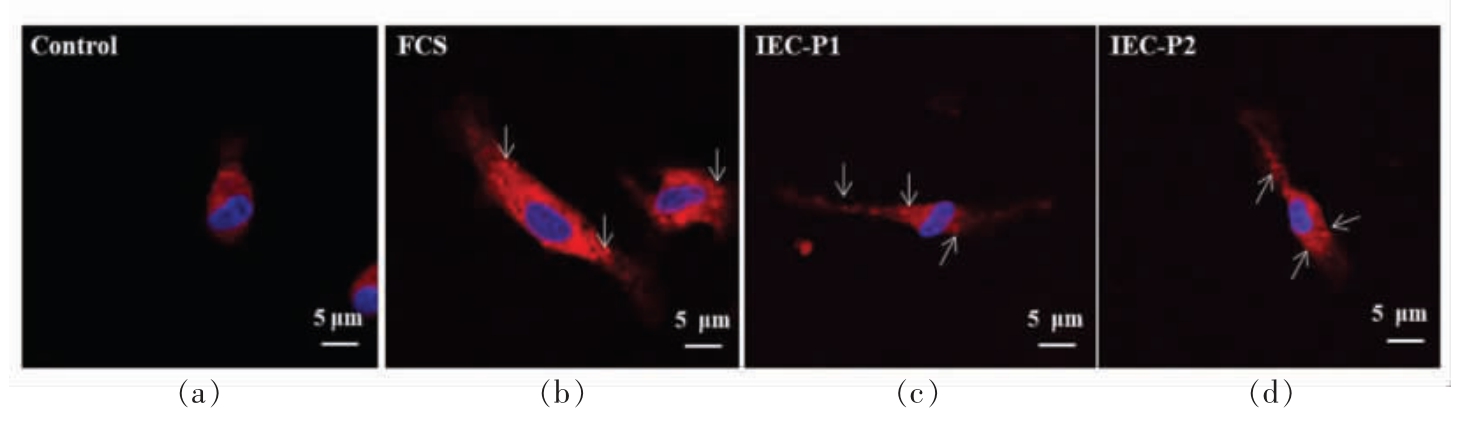
图2 大鼠口腔巨噬细胞对河蚬汤纳米颗粒的吞噬作用
Fig.2 Uptake of nanoparticles derived from freshwater clam soup(Nile red staining) by rat oral mucosal macrophages
注:Control:单纯尼罗红染色的巨噬细胞;FCS,IEC-P1,IEC-P2:经尼罗红染色的FCS,IEC-P1,IEC-P2 纳米颗粒被巨噬细胞吞噬;蓝色:由Hoechst 33342 染色的细胞核,激发波长/发射波长(346/460)nm;红色:由Nile-red 染色的河蚬汤纳米颗粒,激发波长/发射波长(549/628)nm;比例尺=5 μm。
2.2.2 河蚬汤纳米颗粒对口腔巨噬细胞膜电位的影响 FCS、IEC-P1 与IEC-P2 分别在1 000,250和62.5 μg/mL 3 个浓度下与巨噬细胞作用后,细胞膜电位发生变化的结果如图3所示。在与FCS、IEC-P1 和IEC-P2 前后,巨噬细胞膜电位探针DiBAC4(3)绿色荧光强度前后基本不变,显示这3种样品对正常状态下的口腔巨噬细胞膜电位(Vmem)没有明显影响。
水溶性偶氮化合物AAPH 可诱导脂质过氧化作用,被广泛应用于触发细胞中的氧化应激[17]。AAPH 可诱导巨噬细胞处于氧化应激状态,不同浓度下的FCS、IEC-P1 与IEC-P2 均能明显改变氧化应激状态下的巨噬细胞膜电位,表现为DiBAC4(3)发出的绿色荧光强度有明显变化。在AAPH 与巨噬细胞作用后的120 min 内(见图3),DiBAC4(3)的绿色荧光强度呈现了一个持续减弱的过程,说明在120 min 内AAPH 诱导细胞产生大量的过氧自由基,使得细胞Vmem 下降,细胞膜电位发生超极化现象。
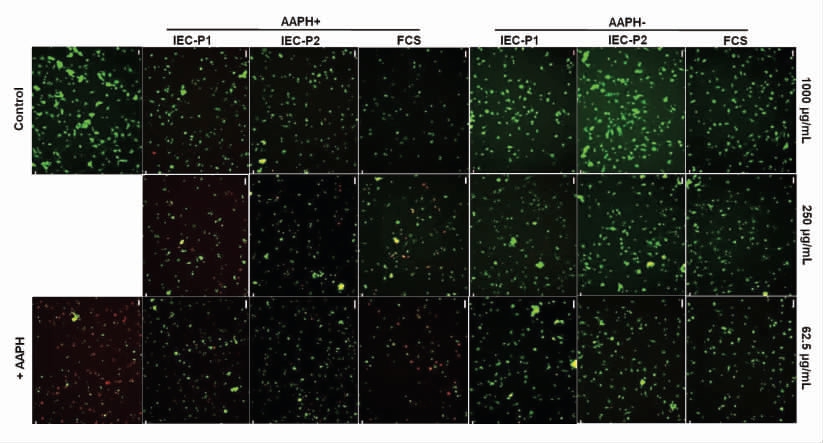
图3 河蚬汤纳米颗粒对大鼠口腔巨噬细胞膜电位(绿色荧光)和线粒体超氧自由基(红色荧光)的作用荧光显微图片
Fig.3 Fluorescence micrographs of the effects of nanoparticles derived from freshwater clam soup on cell membrane potential(green fluorescence) and mitochondrial superoxide radicals(red fluorescence) in rat oral mucosal macrophages
在AAPH 作用的同时加入不同浓度的FCS、IEC-P1 与IEC-P2,DiBAC4(3)的绿色荧光强度均比AAPH 组高,说明3 种河蚬汤纳米颗粒样品均可以减弱口腔巨噬细胞Vmem 下降的现象。
3 种河蚬纳米颗粒样品对氧化应激下的巨噬细胞膜电位的调节作用均具有浓度依赖性,以最高质量浓度1 000 μg/mL 下对膜电位的调节效果最为明显,随浓度降低其调节效果也随之减弱。3种河蚬纳米颗粒样品对巨噬细胞膜电位调节能力具有差异:在测试的3 个浓度范围内,和FCS 作用的巨噬细胞胞内绿色荧光强度均高于AAPH 组,即使FCS 最低质量浓度为62.5 μg/mL 时,胞内荧光强度还比AAPH 组的高约40%,而IEC-P1 和IEC-P2 纳米颗粒只在1 000 μg/mL 和250 μg/mL质量浓度时,作用的巨噬细胞胞内荧光强度明显强于AAPH 组,但质量浓度为62.5 μg/mL 时与AAPH 组差异不明显。在1 000 μg/mL 质量浓度下,FCS 样品表现出对膜电位的调节作用最为明显,IEC-P2 其次,IEC-P1 的调节作用为最弱。

图4 河蚬汤纳米颗粒对大鼠口腔巨噬细胞膜电位的影响
Fig.4 Effect of nanoparticles derived from freshwater clam soup on cell membrane potential of rat oral mucosal macrophage
2.2.3 河蚬汤纳米颗粒对口腔巨噬细胞线粒体超氧自由基的影响 试验同时检测了FCS、IEC-P1和IEC-P2 纳米颗粒分别在1 000,250 和62.5 μg/mL 3 个质量浓度下对巨噬细胞线粒体超氧自由基的影响,结果见图5。从胞内MitoSOX Red 荧光探针(也称Mito-HE)所发的红色荧光强度上看,3种河蚬纳米颗粒样品对正常状态下的巨噬细胞线粒体超氧自由基均没有明显影响。相反,不同浓度的3 种河蚬纳米颗粒样品均对AAPH 造成的氧化应激状态下的巨噬细胞线粒体超氧自由基有明显影响作用。
AAPH 造成巨噬细胞氧化应激后,激活了巨噬细胞线粒体的解偶联蛋白[18],导致线粒体呼吸代谢速率下降[19],反而会导致线粒体内超氧自由基水平降低[20]。如图5所示,巨噬细胞经AAPH 作用后,其线粒体自由基水平降低,表现为Mito-HE探针发出的红色荧光强度显著性减弱(P<0.01)。
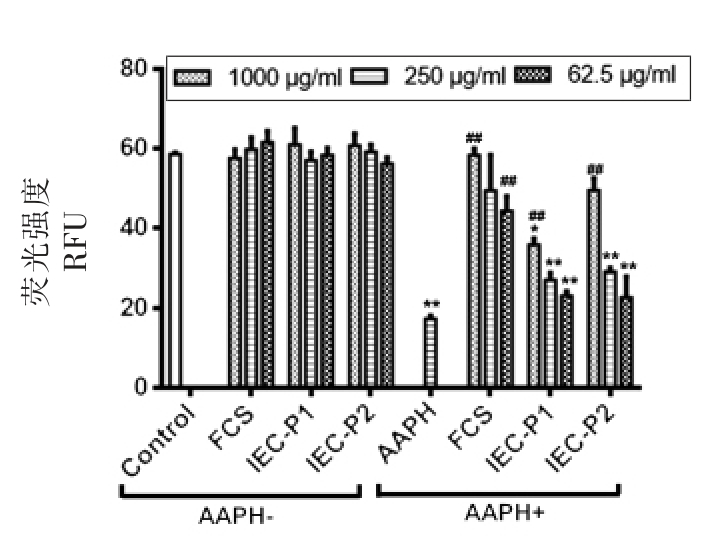
图5 河蚬汤纳米颗粒对大鼠口腔巨噬细胞线粒体超氧自由基的作用
Fig.5 Effects of nanoparticles derived from freshwater clam soup on mitochondrial superoxide radicals in rat oral mucosal macrophages
注:**:P<0.01 v.s.Control;##:P<0.01 v.s.AAPH;数据结果均为 ±s;P 值用t-test 测得(n=3)。
±s;P 值用t-test 测得(n=3)。
在AAPH 作用的同时,加入不同浓度的FCS、IEC-P1 和IEC-P2 纳米颗粒,巨噬细胞胞内线粒体氧呼吸代谢下降的现象得到不同程度的改善。3种河蚬汤纳米颗粒样品间也表现出对线粒体超氧自由基调节能力的不同:在1 000 μg/mL 质量浓度下,FCS 能使线粒体内Mito-SOX 荧光强度基本恢复到正常水平,改善幅度极为显著(P<0.01);IECP1 和IEC-P2 纳米颗粒虽不及河蚬汤颗粒,但也能使Mito-SOX 荧光强度恢复至正常水平的80%左右。同时,3 种河蚬汤纳米颗粒样品对细胞线粒体超氧自由基的调节作用均存在浓度依赖性,都以最高质量浓度1 000 μg/mL 下对线粒体超氧自由基的调节效果最为明显,随浓度降低其调节效果也随之减弱。
3 讨论
巨噬细胞是消化道黏膜免疫系统中的重要部分,具有识别食物中异物、吞噬颗粒的作用,在维持消化道黏膜免疫稳态、病原体先天防御、组织修复和代谢等方面发挥重要作用[21]。
从摄入口腔开始,食物中的纳米颗粒就不可避免地与黏膜巨噬细胞发生作用,调查二者之间的相互作用非常有必要。已有报道显示不同类型的无机纳米颗粒,如Ag 纳米颗粒[22]、ZnO 纳米颗粒[23-24]、SiO2 纳米颗粒[25]、TiO2 纳米颗粒[26]等,均能对巨噬细胞产生影响,造成细胞的氧化应激并带来毒性。本研究结果显示河蚬汤纳米颗粒可以直接对大鼠口腔黏膜来源的原代培养巨噬细胞产生影响,表明河蚬汤纳米颗粒从摄入口腔开始就具有影响消化道黏膜免疫的能力。与合成的无机纳米颗粒不同,河蚬汤纳米颗粒并不会造成正常巨噬细胞氧化应激,也未表现出细胞毒性。
消化道黏膜是食物摄入后消化和转运的主要交换界面,它的氧化还原平衡状态与黏膜免疫稳态密切相关。本研究中使用了偶氮化合物AAPH来诱导产生过氧自由基,以模拟食物在摄入过程中巨噬细胞在消化道微环境中可能遇到的ROS应激。AAPH 诱导会致使巨噬细胞胞内自由基上升,同时通过钙离子依赖的钾离子通道来增加胞内钙离子浓度,造成细胞膜电位超极化[27],并降低线粒体的呼吸代谢速率[19],从而减弱线粒体自由基的产生[20]。河蚬汤纳米颗粒表现出对氧化应激对巨噬细胞造成损害的修复能力,对细胞膜电位及细胞线粒体呼吸代谢速率损伤具有保护作用。其保护机制可能与巨噬细胞细胞膜上的Na+/K+通道作用有关。有研究表明,纳米颗粒可以与细胞膜的Na+/K+通道结合,从而造成膜电位发生改变[28];此外,纳米颗粒zeta 电位对细胞膜的膜电位具有影响,不同表面zeta 电位的纳米颗粒对细胞的膜电位改变具有不同的作用[29]。河蚬汤纳米颗粒对氧化应激状态下巨噬细胞具有保护作用,表明了食品中微纳米颗粒与消化道黏膜直接作用的可能,提示了一种食品与人体相互作用的新模式。
4 结论
本试验采用大鼠口腔黏膜来源的巨噬细胞为模型,对3 种不同河蚬汤纳米颗粒的活性进行调查,试验结果显示:FCS、IEC-P1 和IEC-P2 纳米颗粒可以纳米颗粒的完全形态进入巨噬细胞胞内和线粒体中发生作用。3 种河蚬汤纳米颗粒均未表现出对巨噬细胞的细胞毒性,也未造成正常巨噬细胞的氧化应激。河蚬汤纳米颗粒对处于氧化应激状态下巨噬细胞具有修复保护作用,可恢复巨噬细胞的细胞膜电位并维持其线粒体呼吸代谢速率。本研究的结果提供了食品纳米颗粒与免疫细胞之间直接相互作用的证据,这提示了一种食品与人体相互作用的新模式。
[1]KE L,ZHOU J,LU W,et al.The power of soups:Super-hero or team-work?[J].Trends in Food Ence & Technology,2011,22(9):492-497.
[2]LIN X,GAO X,CHEN Z,et al.Spontaneously assembled nano-aggregates in clear green tea infusions from Camellia ptilophylla and Camellia sinensis[J].Journal of Agricultural & Food Chemistry,2017,7(11):1984-1992.
[3]KE L J,WANG H Q,GAO G Z,et al.Direct interaction of food derived colloidal micro/nano-particles with oral macrophages[J].Npj Science of Food,2017,1(1):3.
[4]WANG H,GAO G,KE L,et al.Isolation of colloidal particles from porcine bone soup and their interaction with murine peritoneal macrophage[J].Journal of Functional Foods,2019,54:403-411.
[5]CAO L,SONG X,SONG Y,et al.Fluorescent nanoparticles from mature vinegar:their properties and interaction with dopamine[J].Food & Function,2017,8(12):4744-4751.
[6]JIANG S S,SHI Y P,LI M,et al.Characterization of Maillard reaction products micro/nano-particles present in fermented soybean sauce and vinegar[J].Scientific Reports,2019,9(1):11285.
[7]YU Z S,GAO G Z,WANG H Q,et al.Identification of protein-polysaccharide nanoparticles carrying hepatoprotective bioactives in freshwater clam(Corbicula fluminea Muller) soup [J].International Journal of Biological Macromolecules,2020,151:781-786.
[8]ZHOU J,GAO G,CHU Q,et al.Chromatographic isolation of nanoparticles from Ma-Xing-Shi-Gan-Tang decoction and their characterization[J].Journal of Ethnopharmacology,2014,151(3):1116-1123.
[9]LU W,GUO J,ZHOU J,et al.Hypothesis review:The direct interaction of food nanoparticles with the lymphatic system[J].Food Ence and Human Wellness,2012,1(1):61-64.
[10]LIN J J,LIU Y C,CHANG C J,et al.Hepatoprotective mechanism of freshwater clam extract alleviates non-alcoholic fatty liver disease:elucidated in vitro and in vivo models[J].Food & Function,2018,9(12):6315-6325.
[11]CHIJIMATSU T,TATSUGUCHI I,ODA H,et al.A Freshwater clam(Corbicula fluminea) extract reduces cholesterol level and hepatic lipids in normal rats and xenobiotics -induced hypercholesterolemic rats[J].Journal of Agricultural and Food Chemistry,2009,57(8):3108-3112.
[12]TAKESHI C,IWAO T,KAZUAKI A,et al.A freshwater clam(Corbicula fluminea) extract improves cholesterol metabolism in rats fed on a highcholesterol diet[J].Takeshi Chijimatsu,2014,72(10):2566-2571.
[13]LIN Y H,TSAI J S,HUNG L B,et al.Hypocholesterolemic effect of compounded freshwater clam protein hydrolysate and Gracilaria[J].Food Chemistry,2010,123(2):395-399.
[14]HUA K F,CHEN G M,HO C L,et al.Freshwater clam extract inhibits inflammatory responses in LPS-activated macrophages by reducing the activation of mitogen-activated protein kinases and NF-κB[J].Natural Product Communications,2012,7(11):1435-1440.
[15]GAO G,WANG H,ZHOU W,et al.Isolation and characterization of bioactive proteoglycan -lipid nanoparticles from freshwater clam(Corbicula fluminea Muller) soup[J].Journal of Agricultural and Food Chemistry,2021,69(5):1610-1618.
[16]GIBRÁN S.ALEMÁN -NAVA,CUELLAR -BERMUDEZ S P,MARÍA CUARESMA,et al.How to use Nile Red,a selective fluorescent stain for microalgal neutral lipids[J].Journal of Microbiological Methods,2016,128:74-79.
[17]VAKIFAHMETOGLU-NORBERG H,OUCHIDA A T,NORBERG E.The role of mitochondria in metabolism and cell death[J].Biochemical and Biophysical Research Communications,2017,482(3):426-431.
[18]BRAND M D,ESTEVES T C.Physiological functions of the mitochondrial uncoupling proteins UCP2 and UCP3[J].Cell Metabolism,2005,2(2):85-93.
[19]GIAMPIERI F,ALVAREZ-SUAREZ,JOSÉ M,et al.An anthocyanin-rich strawberry extract protects against oxidative stress damage and improves mitochondrial functionality in human dermal fibroblasts exposed to an oxidizing agent[J].Food & Function,2014,5(8):1939-1948.
[20]MURPHY M P,ECHTAY K S,BLAIKIE F H,et al.Superoxide activates uncoupling proteins by generating carbon-centered radicals and initiating lipid peroxidation[J].Journal of Biological Chemistry,2003,278(49):48534-48545.
[21]KUMAR S,DWIVEDI P D,DAS M,et al.Macrophages in food allergy:an enigma[J].Molecular Immunology,2013,56(4):612-618.
[22]HAMILTON R,BUCKINGHAM S,HOLIAN A.The Effect of size on Ag nanosphere toxicity in macrophage cell models and lung epithelial cell lines is dependent on particle dissolution[J].IJMS,2014,15(4):6815-6830.
[23]H MULLER K,KULKARNI J,MOTSKIN M,et al.pH -dependent toxicity of high aspect ratio ZnO nanowires in macrophages due to intracellular dissolution[J].Acs Nano,2010,4(11):6767-6779.
[24]TRIPATHY N,HONG T K,HA K T,et al.Effect of ZnO nanoparticles aggregation on the toxicity in RAW 264.7 murine macrophage[J].Journal of Hazardous Materials,2014,270(15):110-117.
[25]ZHANG Z Q,ZHANG C Z,SHAO B,et al.Effects of abnormal expression of fusion and fission genes on the morphology and function of lung macrophage mitochondria in SiO2-induced silicosis fibrosis in rats in vivo[J].Toxicology Letters,2019,312(15):181-187.
[26]ZHANG Y M,MIKHAYLOVA,L.KOBZIK L,et al.Estrogen-mediated impairment of macrophageal uptake of environmental TiO2 particles to explain inflammatory effect of TiO2 on airways during pregnancy[J].Journal of Immunotoxicology,2015,12(1):81-91.
[27]KE L,WANG H,GAO G,et al.Direct interaction of food derived colloidal micro/nano-particles with oral macrophages[J].Npj Science of Food,2017,1(1):3.
[28]WARREN EMILIE A K,PAYNE CHRISTINE K.Cellular binding of nanoparticles disrupts the membrane potential[J].RSC advances,2015,5(18):13660-13666.
[29]ARVIZO ROCHELLE R,MIRANDA OSCAR R,THOMPSON MICHAEL A,et al.Effect of nanoparticle surface charge at the plasma membrane and beyond[J].Nano letters,2010,10(7):2543-2548.