糖尿病是威胁人体健康的重要慢性疾病,也是引起死亡的十大病因之一[1-3]。全球糖尿病患者接近4 亿,而我国约为1 亿,且呈现逐年递增的趋势[4-5]。糖尿病以糖代谢紊乱为主要特征,常伴随氧化应激和脂代谢紊乱,并可能产生肝脏、肾脏等脏器损伤或并发症[6]。临床上常用的二甲双胍、胰岛素(INS)、格列美脲等药物虽然具有明显的降血糖效果,但是长期使用可能对患者产生副作用[7-8]。从药食同源植物中获取天然、高效、安全的降糖因子成为糖尿病相关研究的新方向[1]。
菊花是我国著名的药食同源植物,具有降血糖、抗氧化、降血压、抗癌、抑菌、调节肠道菌群等作用[9-12],在饮料、药膳、休闲食品加工中具有广泛用途[9]。本实验室研究发现,菊花中含有较丰富的香叶木素(diosmetin)、异绿原酸C(isochlorogenic acid C)、木犀草苷(cynaroside)和蒙花苷(buddleo side)[13]。异绿原酸C 具有清除自由基、抗炎等功效[14-15];木犀草苷具有抗菌、保护神经等功效[16-17];蒙花苷具有抗氧化、抗炎等功效[18-19];香叶木素具有抗氧化、抗癌和保护视网膜等功效[20-22]。目前鲜见关于这4 种酚类化合物单体降血糖作用的研究报道。为了揭示菊花降血糖作用的物质基础,了解香叶木素的降血糖活性,本研究通过体外试验筛选活性较高的单体,在此基础上利用高糖、高脂饲料结合链脲佐菌素(STZ)诱导的Ⅱ型糖尿病小鼠模型,探究其降血糖作用以及对脂代谢、氧化应激等的效应。
1 试验材料
4~6 周龄雄性昆明小鼠[SCXK(陕)2012-001,SPF 级],西安交通大学;普通饲料,西安晶博公司;高糖、高脂饲料(65%小鼠维持饲料、20%蔗糖、10%猪脂肪、2.5%胆固醇、1%胆酸钠、1%矿物质混合物、0.5%维生素混合物),北京博爱港公司;异绿原酸C(HPLC 级,纯度≥98%)、木犀草苷(HPLC级,纯度≥98%)、香叶木素(HPLC 级,纯度≥98%)、蒙花苷(HPLC 级、纯度≥98%)、阿卡波糖(Acarbose,HPLC 级,纯度≥98%)、α-淀粉酶(4 000 U/g)、α-葡萄糖苷酶(10 U/mg)、α-D-葡萄糖苷(PNPG),上海源叶公司;INS、糖原、糖化血清蛋白(GSP)、总胆固醇(TC)、总甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、总抗氧化能力(T-AOC)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、丙二醛(MDA)、谷丙转氨酶(ALT)、谷草转氨酶(AST)检测试剂盒或ELISA 试剂,南京建成生物工程研究所;STZ,美国Sigma 公司;格列美脲,天安公司;二甲双胍,中美上海施贵宝公司。
2 试验方法
2.1 分子对接分析
参照周雪雪[1]的方法,选用异绿原酸C、木犀草苷、香叶木素、蒙花苷4 种酚类化合物单体,以阿卡波糖为对照,进行α-葡萄糖苷酶蛋白分子对接分析。
2.2 α-淀粉酶抑制作用分析
参照聂坤伦等[23]的方法分析4 种酚类化合物单体对α-淀粉酶的抑制作用,以阿卡波糖为对照。用Multiskan Go 全波长酶标仪(美国Thermo Electron 公司)测定吸光值。计算各单体对α-淀粉酶的抑制率以及25%抑制质量浓度(IC25)和半抑制质量浓度(IC50)。
2.3 α-葡萄糖苷酶抑制作用分析
参照Thi 等[24]的方法分析4 种酚类化合物单体对α-葡萄糖苷酶的抑制作用,以阿卡波糖为对照。用全波长酶标仪测定吸光度。计算各单体对α-葡萄糖苷酶的抑制率以及25%抑制质量浓度和半抑制质量浓度。
2.4 Ⅱ型糖尿病模型建立与分组处理
取雄性昆明小鼠100 只,用普通饲料喂养1周后,随机分为正常类群和模型类群。模型类群饲喂高糖、高脂饲料,正常类群仍然饲喂普通饲料[25]。4 周后,所有小鼠禁食(不禁水)12 h,给模型类群、正常类群小鼠分别注射STZ、柠檬酸-柠檬酸钠缓冲液。72 h 后,所有小鼠禁食(不禁水)12 h,测定空腹血糖(FBG),结合糖尿病高饮水量等典型症状将FBG≥11.1 mmol/L 的小鼠认定为造模成功[26]。对未成模小鼠,继续补充注射STZ。按照表1对小鼠进行分组处理。
表1 实验动物分组
Table 1 Group of experimental animals

剂量/mg·kg-1 weight正常组 N - -模型组 M - -阳性对照组1 P1 二甲双胍 200阳性对照组2 P2 格列美脲 7高剂量干预组 D50 香叶木素 50中剂量干预组 D30 香叶木素 30低剂量干预组 D15 香叶木素 15组别名称 组别简称 化合物
2.5 生理生化指标测定
2.5.1 小鼠摄食量、饮水量、体重和FBG 测定干预(灌胃)试验期间,除正常组(N 组)外,其余各组进行高糖、高脂饲喂。连续干预30 d,期间每天观察小鼠的饮水量、摄食量、体征变化、精神状态、垫料潮湿程度(排尿量变化)等,每隔6 d 测量1次体重和FBG,用平均值绘图。
2.5.2 葡萄糖耐受量(OGTT)测定 参考Liu 等[27]的方法测定小鼠的OGTT。小鼠禁食(不禁水)12 h后,测定各组小鼠的FBG(0 h)。N 组、模型组(M组)给予生理盐水,阳性对照组1(P1 组)、阳性对照组2(P2 组)分别给予二甲双胍、格列美脲,高剂量干预组(D50 组)、中剂量干预组(D30 组)和低剂量干预组(D15 组)分别给予高、中、低剂量的香叶木素。各组小鼠给予葡萄糖后测定0.5,2 h 的血糖值,求得曲线下面积(AUC)。
2.5.3 样本收集与脏器指数测定 干预试验结束后,参照周雪雪[1]和Yuan 等[26]的方法进行样本收集和脏器指数测定。
2.5.4 GSP 含量测定 取-20 ℃冻存的血清样本,化冻,参照试剂盒说明书测定GSP 含量。
2.5.5 INS 含量测定 取-20 ℃冻存的血清样本,化冻,参照试剂盒说明书测定INS 含量,计算胰岛素抵抗指数(HOMA-IR)[28]。
2.5.6 脂代谢指标测定 取-20 ℃冻存的血清样本,化冻,测定小鼠血清中TG、TC、LDL-C、HDL-C含量[29-30]。
2.5.7 肝脏指标测定
2.5.7.1 肝糖原含量测定 取-20 ℃冻存的肝脏组织样本,化冻,测定肝糖原含量[31]。
2.5.7.2 肝功能相关酶活力测定 取-20 ℃冻存的血清样本,化冻,测定ALT 和AST 活力[32]。
2.5.8 抗氧化指标测定 取-20 ℃冻存的血清和肝组织样本,化冻,按照试剂盒说明书测定小鼠血清和肝脏中抗氧化酶(SOD、GSH-Px) 活力、TAOC 与MDA 含量[30,33]。
3 结果与分析
3.1 分子对接试验
异绿原酸C 能够与α-葡萄糖苷酶蛋白的氨基酸残基ASP232、ASP357、GLU603、ASP630 形成分子间氢键,与 ASP469、ALA602、GLU603、ASP630 形成疏水作用力,配体与蛋白所形成的复合物结合稳定(图1a);木犀草苷能够与酶蛋白的ASP232、ASN237、MET470、ASN496、SER505、ARG552 形成分子间氢键,与ALA231、ILE233、ALA234、MET470、LYS506 形成疏水作用力,但是与MET470 之间产生了一个非特异性排斥力(图1b);香叶木素能够与酶蛋白的ASP232、ASP469、ARG552、ASP630 形成分子间氢键,与TRP329、TRP432、MET470、ASP568、PHE601、ALA602、ALA628 形成疏水作用力,配体与蛋白所形成的复合物结合较稳定(图1c),相互作用能量得分较好(表1);蒙花苷能够与酶蛋白的ASP232、ASN237、ASP469、MET470、ASN496、ARG552、ASP568、ASP630 形成分子间氢键,与ILE233、ALA234、MET470、LYS506 形成疏水作用力(图1d)。由表2可知,4 种酚类化合物单体对α-葡萄糖苷酶蛋白均有一定的亲和活力,其分子对接能力依次为:异绿原酸C>香叶木素>木犀草苷>蒙花苷。
表2 酚类化合物单体与α-葡萄糖苷酶蛋白的分子对接结果
Table 2 Molecular docking results of phenolic compounds to α-glucosidase protein
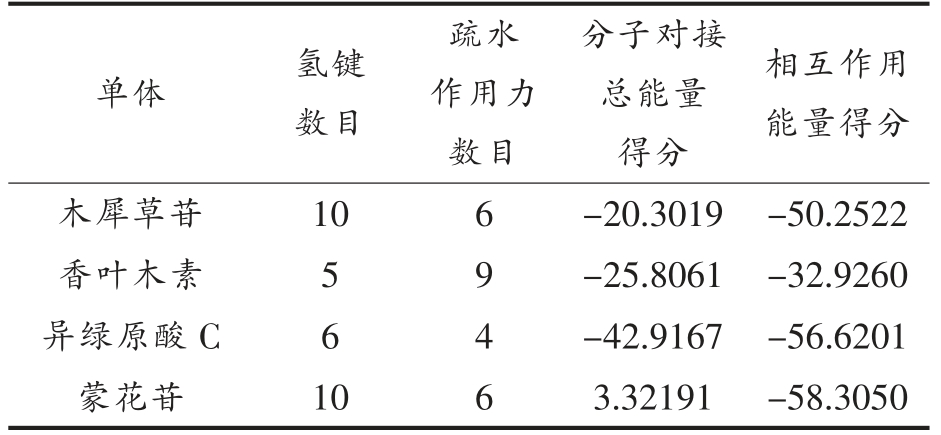
单体 氢键数目疏水作用力数目分子对接总能量得分相互作用能量得分木犀草苷 10 6 -20.3019 -50.2522香叶木素 5 9 -25.8061 -32.9260异绿原酸C 6 4 -42.9167 -56.6201蒙花苷 10 6 3.32191 -58.3050
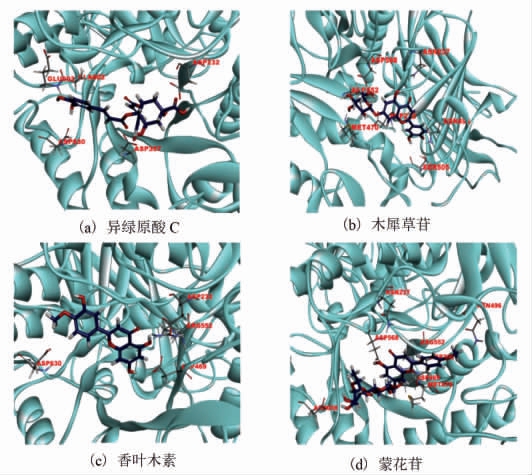
图1 酚类化合物单体与α-葡萄糖苷酶的分子对接模式
Fig.1 Molecular docking mode of phenolic compounds to α-glucosidase
3.2 酶学试验
3.2.1 α-淀粉酶抑制活性 如图2所示,4 种酚类化合物单体对α-淀粉酶的抑制率均随着其浓度的增大而增加。由表3可得,4 种单体浓度与α-淀粉酶抑制率拟合方程的相关系数(R2)在0.9006~0.9605 之间,反映出较好的量效关系。4 种单体对α-淀粉酶的抑制能力依次为:木犀草苷>香叶木素>蒙花苷>异绿原酸C。
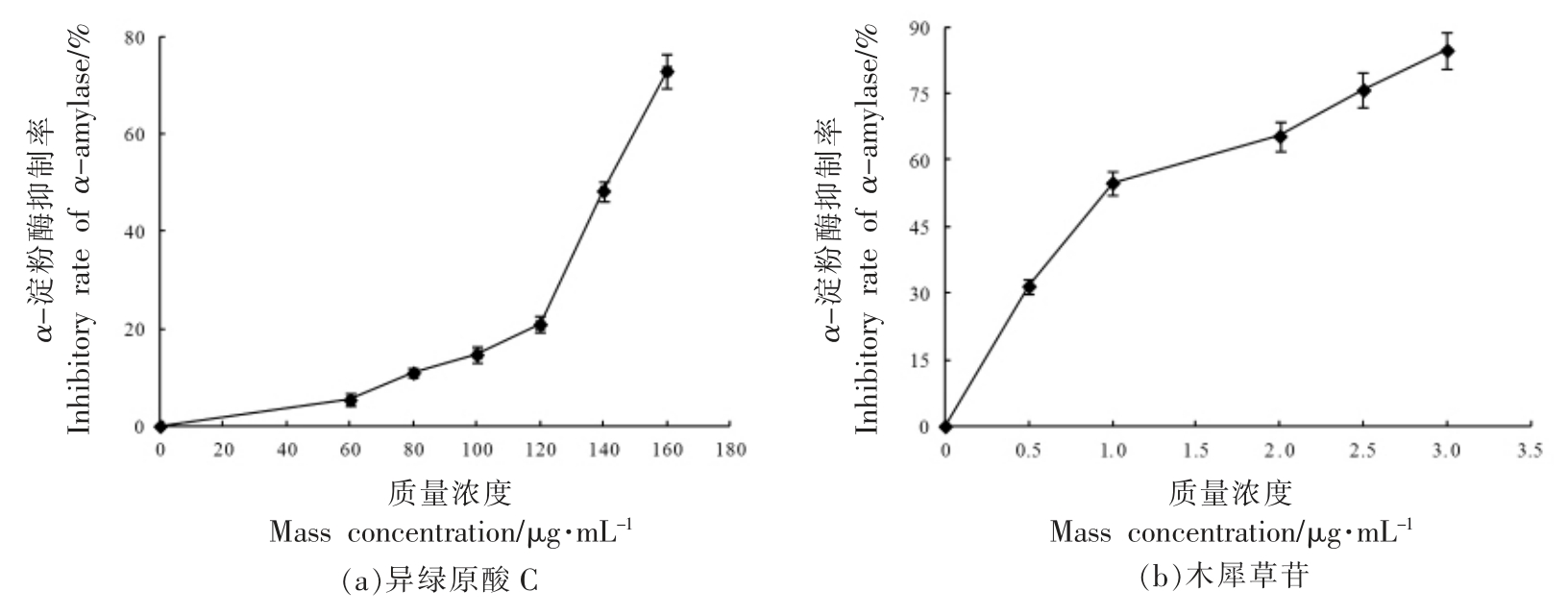
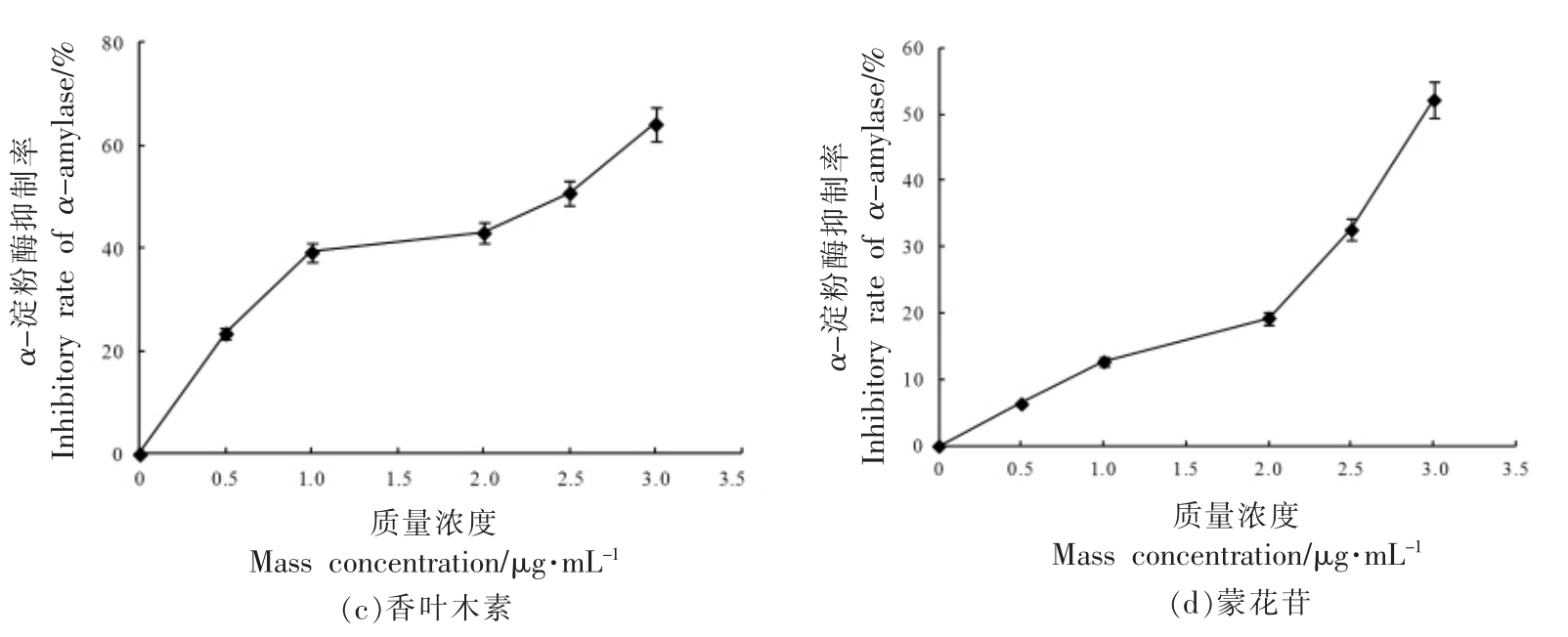
图2 酚类化合物单体对α-淀粉酶的抑制率
Fig.2 Inhibitory rate of phenolic compounds against α-amylase
3.2.2 α-葡萄糖苷酶抑制活性 如图3所示,4种酚类化合物单体对α-葡萄糖苷酶的抑制率均随着浓度的增大而增加。4 种单体浓度与α-葡萄糖苷酶抑制率拟合方程的R2 在0.9165~0.9626 之间,反映出较好的量效关系(表3)。可以看出,4 种单体对α-葡萄糖苷酶均表现出抑制活性,但弱于阿卡波糖。不同单体对α-葡萄糖苷酶的抑制能力依次为:香叶木素>木犀草苷>异绿原酸C>蒙花苷。综合分析4 种单体的分子对接以及α-淀粉酶、α-葡萄糖苷酶试验结果,选择香叶木素进行动物实验,进一步探究其体内降血糖作用。
表3 酚类化合物单体对α-淀粉酶和α-葡萄糖苷酶的抑制活性及其量效关系数学模型
Table 3 Inhibitory activities of phenolic compounds against α-amylase and α-glucosidase and mathematical model of dose-effect relationship

注:方程中的x 和y 分别代表单体浓度和抑制率。
?
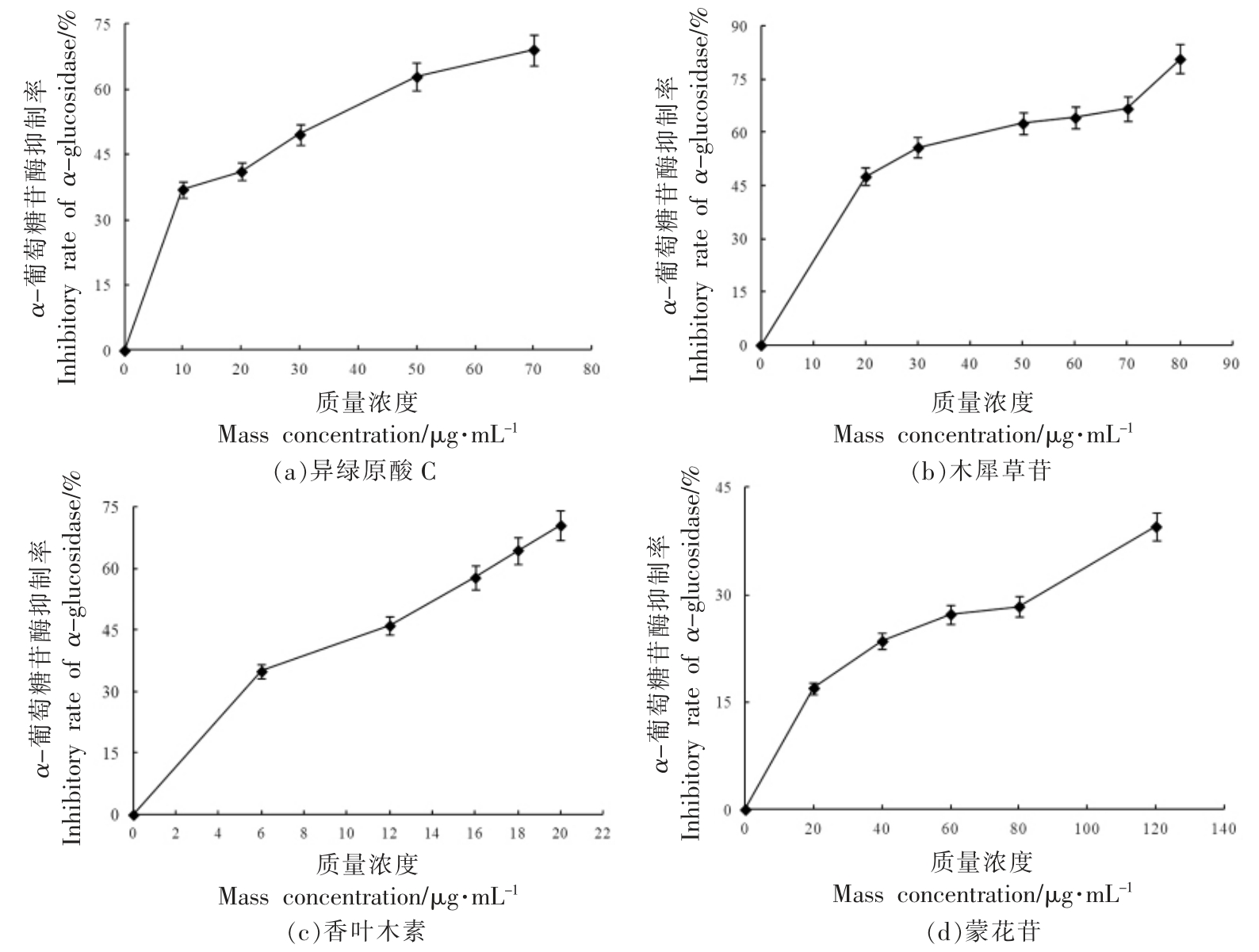
图3 酚类化合物单体对α-葡萄糖苷酶的抑制率
Fig.3 Inhibitory rate of phenolic compounds againist α-glucosidase
3.3 小鼠摄食量、饮水量与体重变化分析
观测发现,Ⅱ型糖尿病模型小鼠行动迟缓,精神萎靡,垫料易湿且臭味明显,而N 组小鼠体型健硕,行动敏捷。干预30 d 后,除D15 组外,其余各干预组小鼠的上述不良状况均有所缓解。由图4可知,造模成功后,小鼠摄食量、饮水量增加,体重减轻。干预30 d 后,与M 组相比,D15、D30、D50、P1、P2 组小鼠的摄食量和饮水量皆有所降低;除D15 组外,其余各干预组小鼠体重减轻的趋向也逐渐减缓。可见,香叶木素对Ⅱ型糖尿病小鼠高摄食量、高饮水量和低体重的病征具有一定的缓解作用。
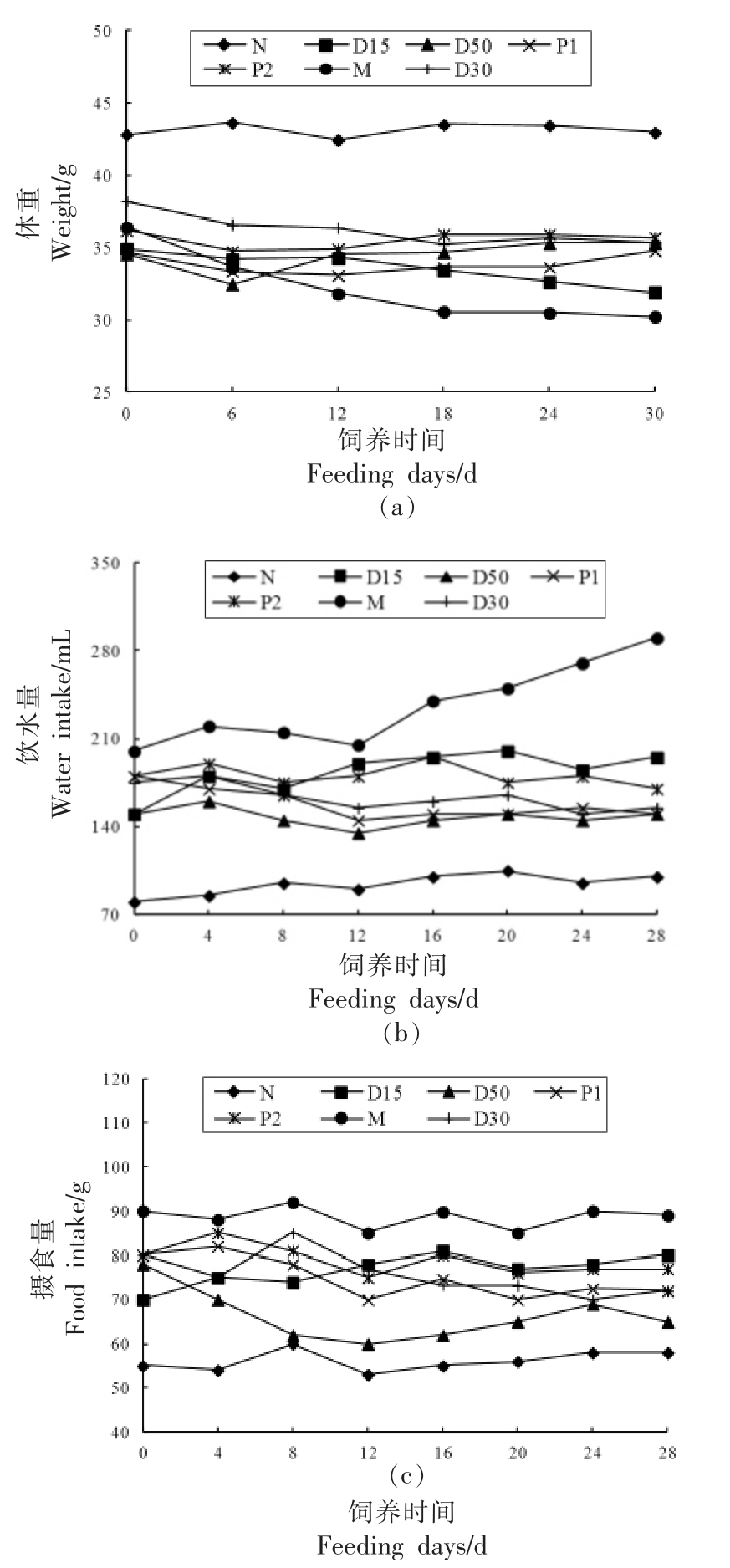
图4 香叶木素对小鼠摄食量、饮水量和体重的影响
Fig.4 Effect of diosmetin on food intake,water intake and body weight of mice
3.4 香叶木素对小鼠FBG、HOMA-IR 和INS含量的影响
由表4可知,随着时间的延长,N 组小鼠的FBG 一直远低于11.1 mmol/L,而M 组的FBG 则持续上升。D15、D30、D50 组小鼠的FBG 在干预12 d 后开始出现不同程度的下降,在干预12,18,24,30 d 的FBG 均显著低于M 组(P<0.05)。D15、D30、D50 组小鼠的FBG 随着香叶木素浓度的增大而降低,呈现出较好的量效关系。由图5和图6可见,与N 组相比,M 组小鼠的INS 含 、HOMA-IR 均极显著提高(P<0.01),说明Ⅱ型糖尿病小鼠出现了胰岛素抵抗症状[34]。干预30 d后,与M 组相比,D15、D30、D50 组小鼠的INS 含量、HOMA-IR 均显著降低(P<0.05),并且INS 含量、HOMA-IR 均随着香叶木素浓度的增大而降低,显示出较好的剂量依赖性。可以看出,香叶木素能够降低Ⅱ型糖尿病小鼠的FBG,缓解其胰岛素抵抗症状。

图5 香叶木素对小鼠胰岛素含量的影响
Fig.5 Effect of diosmetin on insulin content in mice
注:柱形上方不同字母说明组间差别显著(P<0.05)。
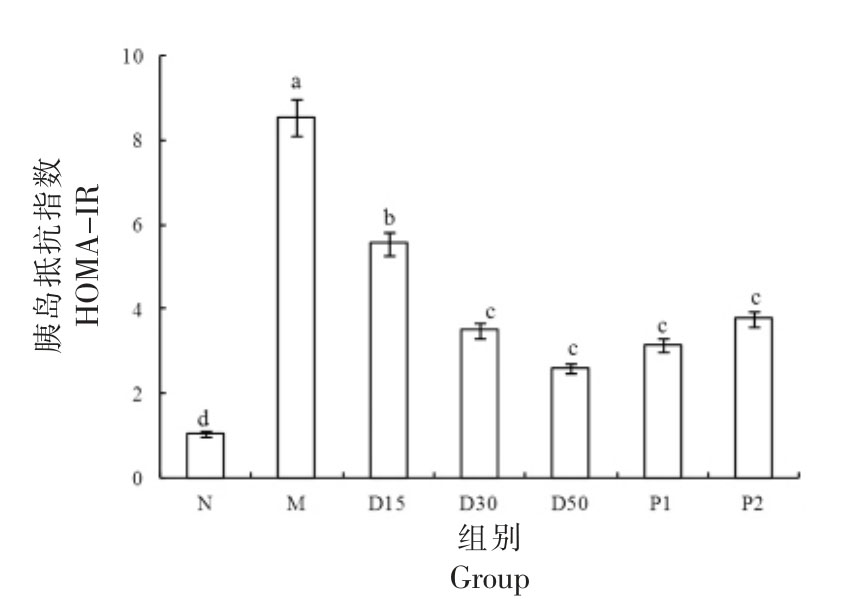
图6 香叶木素对小鼠HOMA-IR 的影响
Fig.6 Effect of diosmetin on HOMA-IR in mice
注:柱形上方不同字母说明组间差别显著(P<0.05)。
表4 香叶木素对Ⅱ型糖尿病小鼠FBG 的影响
Table 4 Effect of diosmetin on FBG in type Ⅱdiabetic mice
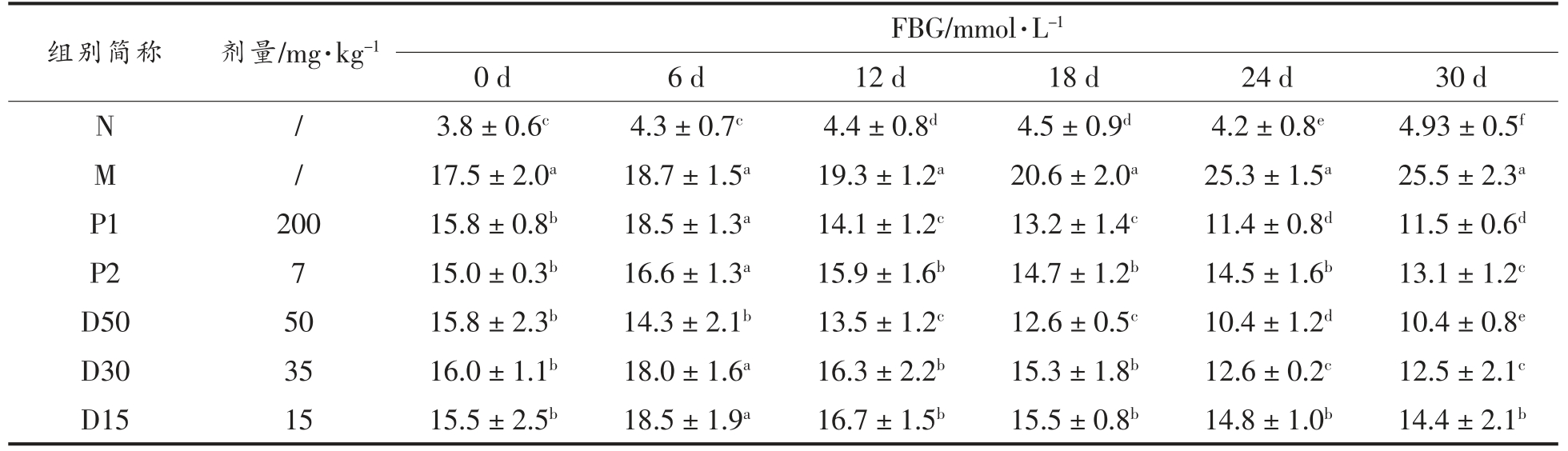
注:同列中不同上标说明组间差别显著(P<0.05)。
组别简称 剂量/mg·kg-1 FBG/mmol·L-1 0 d 6 d 12 d 18 d 24 d 30 d N / 3.8±0.6c 4.3±0.7c 4.4±0.8d 4.5±0.9d 4.2±0.8e 4.93±0.5f M/ 17.5±2.0a 18.7±1.5a 19.3±1.2a 20.6±2.0a 25.3±1.5a 25.5±2.3a P1 200 15.8±0.8b 18.5±1.3a 14.1±1.2c 13.2±1.4c 11.4±0.8d 11.5±0.6d P2 7 15.0±0.3b 16.6±1.3a 15.9±1.6b 14.7±1.2b 14.5±1.6b 13.1±1.2c D50 50 15.8±2.3b 14.3±2.1b 13.5±1.2c 12.6±0.5c 10.4±1.2d 10.4±0.8e D30 35 16.0±1.1b 18.0±1.6a 16.3±2.2b 15.3±1.8b 12.6±0.2c 12.5±2.1c D15 15 15.5±2.5b 18.5±1.9a 16.7±1.5b 15.5±0.8b 14.8±1.0b 14.4±2.1b
3.5 香叶木素对小鼠GSP 含量的影响
GSP 可以反映糖尿病患者在过去1~2 周内血糖的控制情况[29]。由图7可见,M 组小鼠血清中GSP 含量极显著地高于N 组(P<0.01)。干预30 d后,与M 组相比,D15 组小鼠的GSP 含量略有下降(P>0.05),D30、D50、P1、P2 组GSP 含量显著下降(P<0.05)。

图7 香叶木素对小鼠GSP 含量的影响
Fig.7 Effect of diosmetin on GSP content in mice
注:柱形上方不同字母说明组间差别显著(P<0.05)。
3.6 香叶木素对小鼠OGTT 的影响
OGTT 主要反映机体血糖调节能力和胰岛素敏感性[35]。由表5可知,与N 组对比,M 组小鼠的血糖值在给予葡萄糖前(0 h)和给予葡萄糖后(0.5,2 h)均极显著增高(P<0.01);与M 组对比,D30、D50 组小鼠在0.5,2 h 的血糖值皆显著降低(P<0.05);D15 组在0.5 h 的血糖值与M 组相比没有显著差别(P>0.05),而在2 h 的血糖值显著低于M 组(P<0.05)。由图8可见,M 组小鼠的AUC 极显著高于N 组小鼠(P<0.01);D30、D50 组小鼠的AUC 显著低于M 组(P<0.05),D15 组的AUC 略低于M 组(P>0.05)。可见,香叶木素可以缓解小鼠OGTT 异常。
表5 香叶木素对Ⅱ型糖尿病小鼠OGTT 的影响
Table 5 Effect of diosmetin on OGTT in type Ⅱdiabetic mice

注:同列中不同上标说明组间差别显著(P<0.05)。
组别简称 剂量/mg·kg-1 血糖值/mmol·L-1 0 h 0.5 h 2 h N/4.6±0.3d 8.6±0.9d 4.7±0.3d M/23.1±2.2a 29.0±1.8a 22.1±2.3a P1 200 13.8±1.0b 23.9±2.3b 19.0±2.5b P2 7 13.4±1.0b 27.8±1.6a 15.8±2.3c D50 50 10.1±2.4c 21.5±2.4c 13.4±2.3c D30 30 12.1±1.2b 20.8±2.2c 14.0±0.9c D15 15 22.0±2.3a 29.6±1.9a 19.3±2.4b
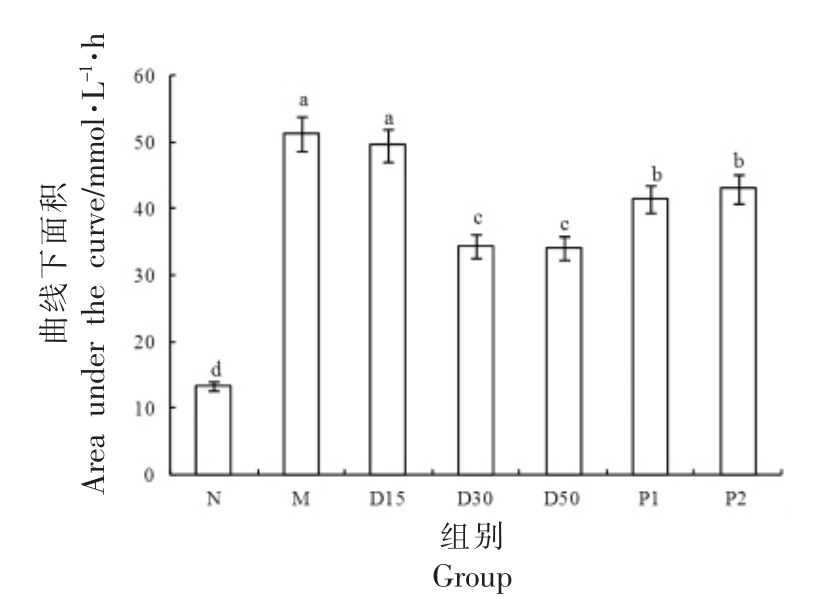
图8 香叶木素对小鼠AUC 的影响
Fig.8 Effect of diosmetin on AUC of mice
注:柱形上方不同字母说明组间差别显著(P<0.05)。
3.7 香叶木素对小鼠脏器指数的影响
糖尿病往往会引起肝、肾等脏器的伤害,通常脏器指数增大说明脏器可能出现了损伤[27,32]。由表6可知,与N 组对比,M 组小鼠肝、脾和肾的脏器指数皆显著提高(P<0.05)。干预30 d 后,与M 组相比,D30、D50 组小鼠肝、脾和肾的脏器指数皆显著降低(P<0.05);D15 组的肾脏指数与M 组相比无明显差异(P>0.05),肝脏、脾脏指数皆显著低于M 组(P<0.05)。由此推测,香叶木素具有缓解Ⅱ型糖尿病小鼠肝、脾和肾损伤的作用。
表6 香叶木素对Ⅱ型糖尿病小鼠脏器指数的影响
Table 6 Effect of diosmetin on organ index of type Ⅱdiabetic mice
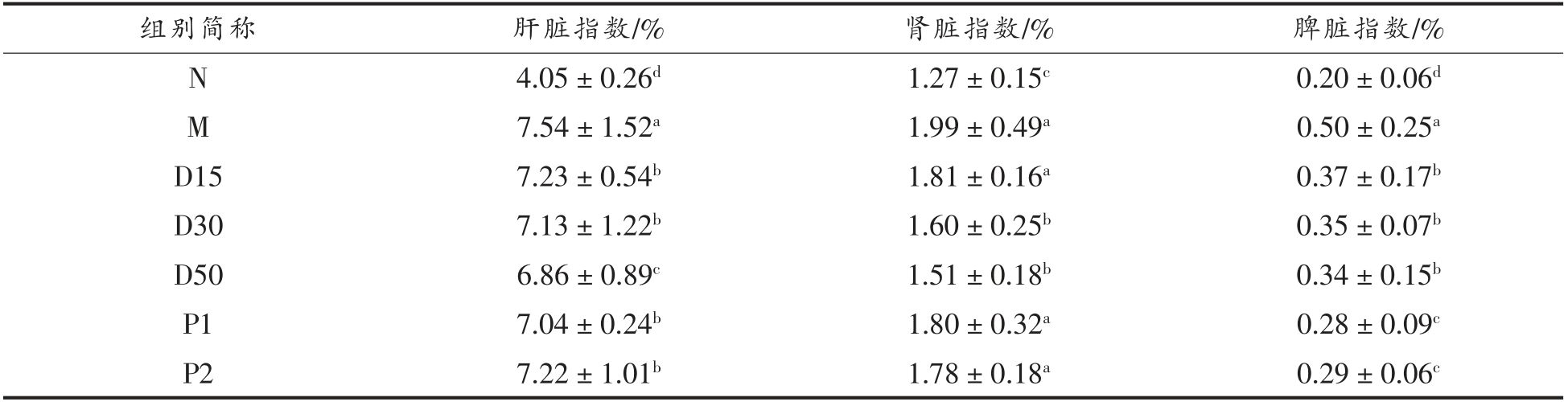
注:同列中不同上标说明组间差别显著(P<0.05)。
组别简称 肝脏指数/% 肾脏指数/% 脾脏指数/%N 4.05±0.26d 1.27±0.15c 0.20±0.06d M 7.54±1.52a 1.99±0.49a 0.50±0.25a D15 7.23±0.54b 1.81±0.16a 0.37±0.17b D30 7.13±1.22b 1.60±0.25b 0.35±0.07b D50 6.86±0.89c 1.51±0.18b 0.34±0.15b P1 7.04±0.24b 1.80±0.32a 0.28±0.09c P2 7.22±1.01b 1.78±0.18a 0.29±0.06c?
3.8 香叶木素对小鼠脂代谢指标的影响
糖代谢与脂代谢密切关联,糖尿病患者容易出现脂代谢紊乱,随着病情加重甚至会引起动脉粥样硬化[36-37]。由图9可知,与N 组对比,M 组小鼠TG、TC、LDL-C 含量均极显著上升(P<0.01),HDL-C 含量极显著降低(P<0.01)。干预30 d 后,与M 组相比,D30、D50 组小鼠血清中TG、TC、LDL-C 含量皆明显降低(P<0.05),HDL-C 含量明显提高(P<0.05);D15、D30、D50 组小鼠的TG、TC、LDL-C 含量均随着香叶木素剂量的增大而降低,HDL-C 含量随着香叶木素剂量的增大而升高,显示出较好的量效关系。可以看出,香叶木素对小鼠脂代谢紊乱表现出较好的缓解作用。
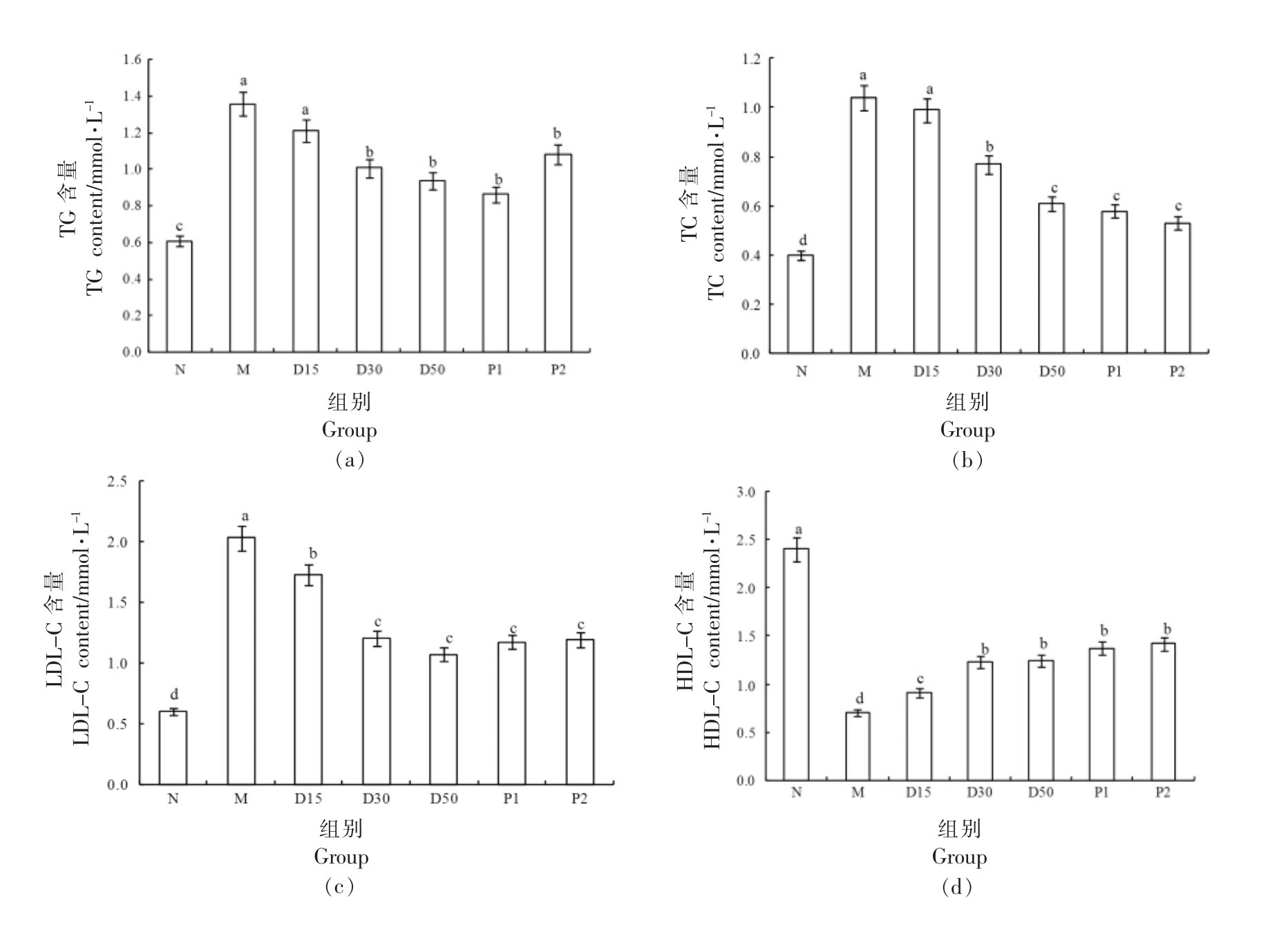
图9 香叶木素对小鼠脂代谢的影响
Fig.9 Effect of diosmetin on lipid metabolism in mice
注:柱形上方不同字母说明组间差别显著(P<0.05)。
3.9 香叶木素对小鼠肝糖原的影响
肝糖原的合成与分解可以反映机体对葡萄糖的吸收和利用情况[27]。由图10可见,与N 组对比,M 组小鼠肝糖原含量极显著降低(P<0.01)。干预30 d 后,与M 组对比,D15、D30、D50 组小鼠的肝糖原含量皆明显提高(P<0.05);随着香叶木素剂量的提升,小鼠肝糖原积累量逐渐增多。
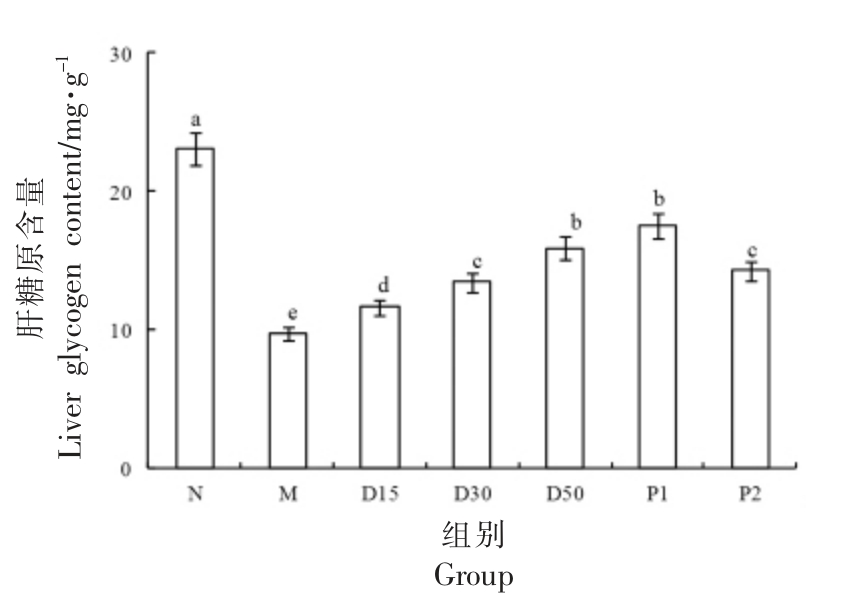
图10 香叶木素对小鼠肝糖原含量的影响
Fig.10 Effect of diosmetin on liver glycogen in mice
注:柱形上方不同字母说明组间差别显著(P<0.05)。
3.10 香叶木素对小鼠肝功能的影响
AST 和ALT 是衡量肝功能的重要标志物[1]。由图11可见,与N 组对比,M 组小鼠血清中AST、ALT 活力极显著升高(P<0.01)。干预30 d 后,与M组对比,D15、D30、D50 组小鼠AST、ALT 活力皆明显下降(P<0.05)。小鼠ALT、AST 活力随着香叶木素剂量的增大而减弱,显示出较好的量效关系。香叶木素可以减弱Ⅱ型糖尿病小鼠血清AST、ALT 活力,降低小鼠肝脏指数(表6),提示其能够缓解糖尿病小鼠的肝功能损伤。
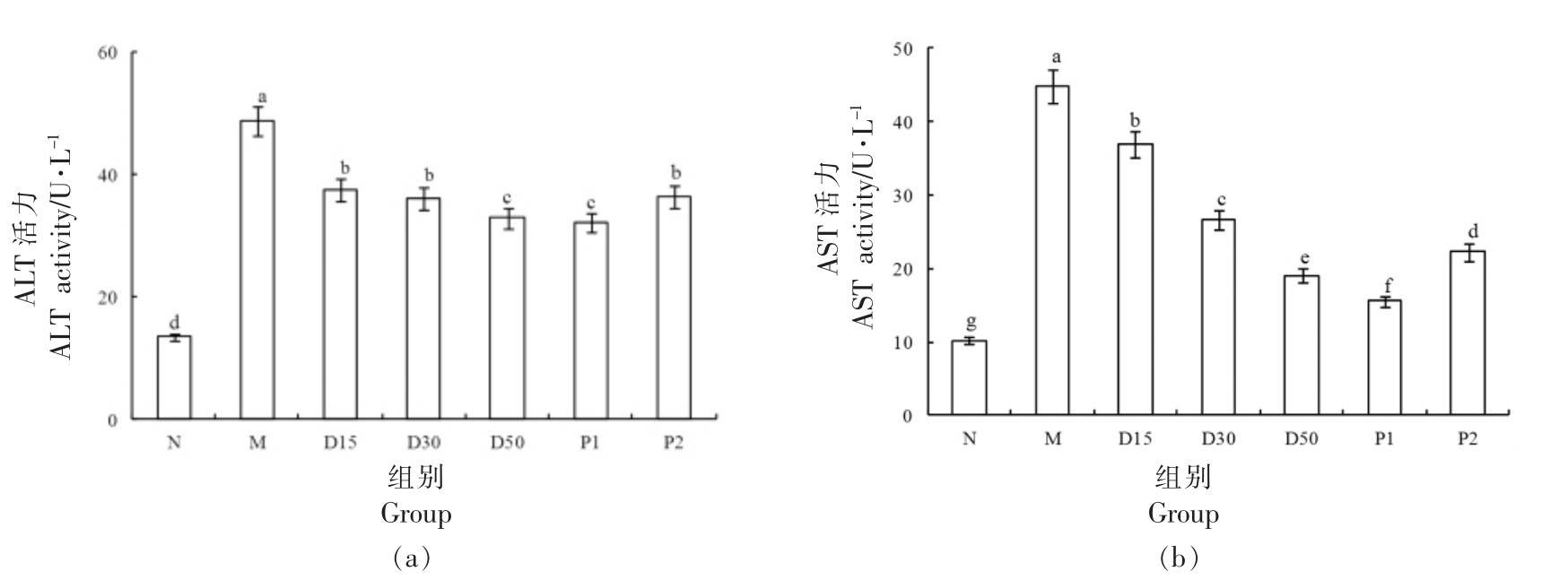
图11 香叶木素对小鼠肝功能相关酶活力的影响
Fig.11 Effect of diosmetin on enzymes related to liver function in mice
注:柱形上方不同字母说明组间差别显著(P<0.05)。
3.11 香叶木素对小鼠抗氧化能力的影响 由图12、13 可见,与N 组相比,M 组小鼠血清和肝脏中MDA 含量极显著上升(P<0.01),T-AOC 以及SOD、GSH-Px 活力极显著降低(P<0.01)。30 d 干预后,与M 组对比,D15、D30、D50 组小鼠肝脏和血清中T-AOC 明显提升(P<0.05),T-AOC 随着香叶木素浓度的增大而升高;D30、D50 组小鼠血清和肝脏中MDA 含量均明显低于M 组(P<0.05),D15 组小鼠血清和肝脏中MDA 含量略低于M 组(P>0.05),MDA 含量随着香叶木素剂量的增大而变少;D30、D50 组小鼠血清和肝脏的抗氧化酶(SOD、GSH-Px)活力皆明显高于M 组(P<0.05),D15 组抗氧化酶活力略高于M 组。氧化应激与糖尿病紧密联系[38]。当机体内血糖浓度过高时,会刺激组织细胞产生大量的活性氧(ROS),可能破坏胰岛B 细胞功能,使胰岛素分泌不足[38-39]。香叶木素有助于改善小鼠的氧化应激状态,对于Ⅱ型糖尿病防治具有积极作用。
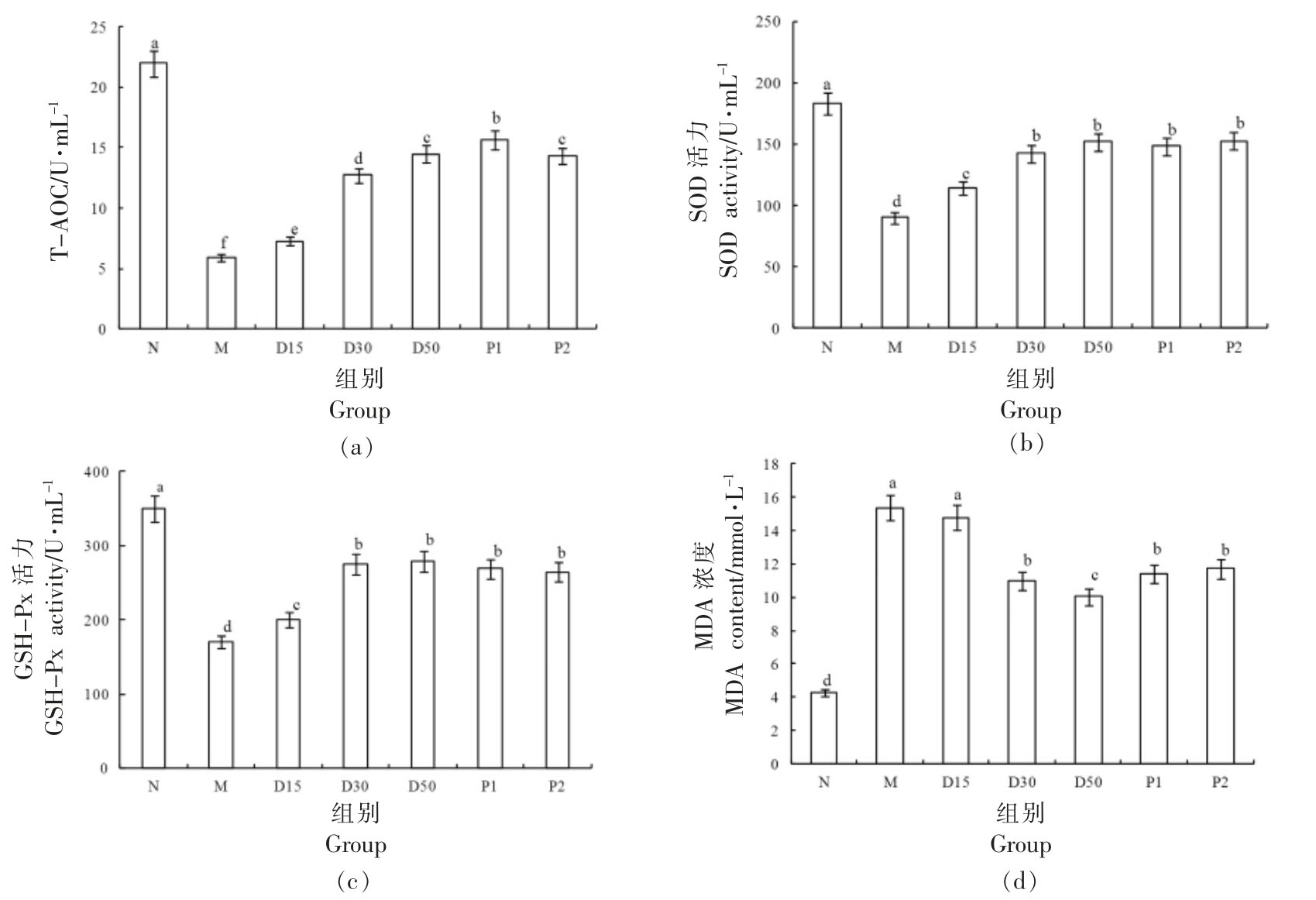
图12 香叶木素对小鼠血清氧化应激指标的影响
Fig.12 Effect of diosmetin on oxidative stress of serum in mice
注:柱形上方不同字母说明组间差别显著(P<0.05)。
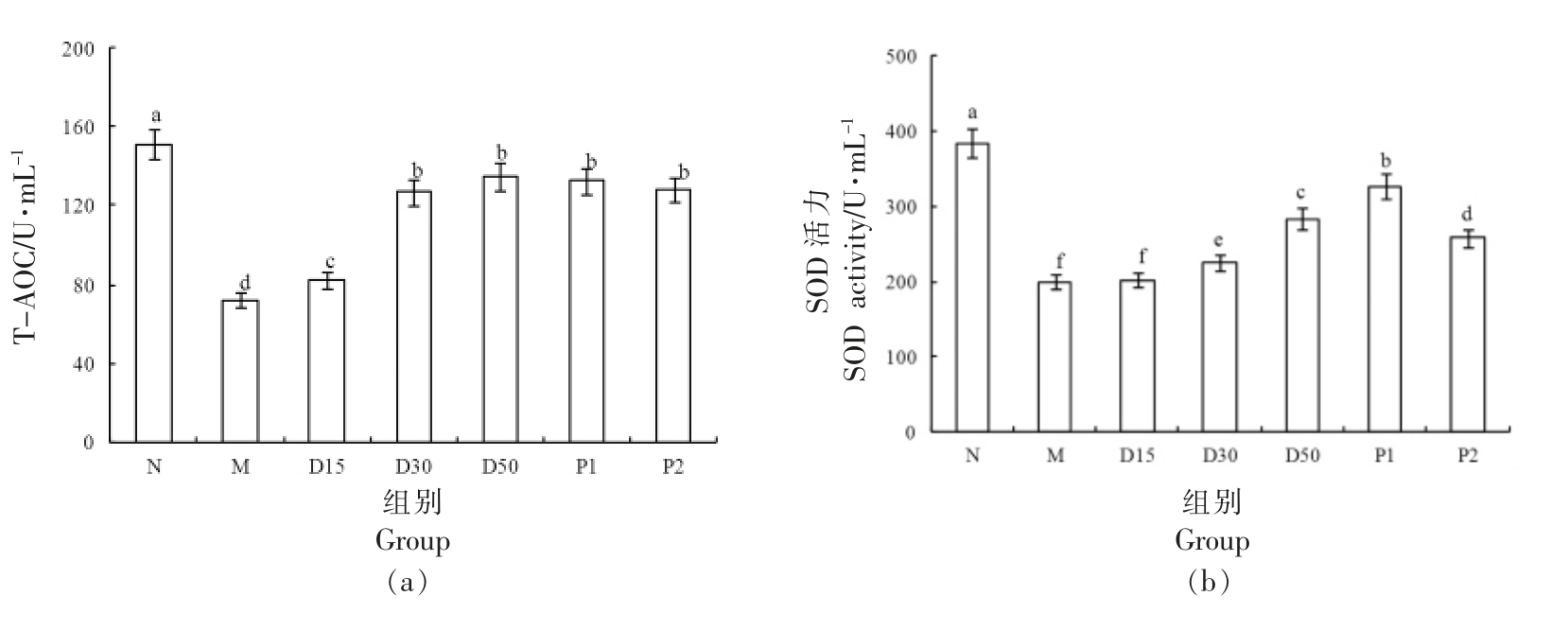
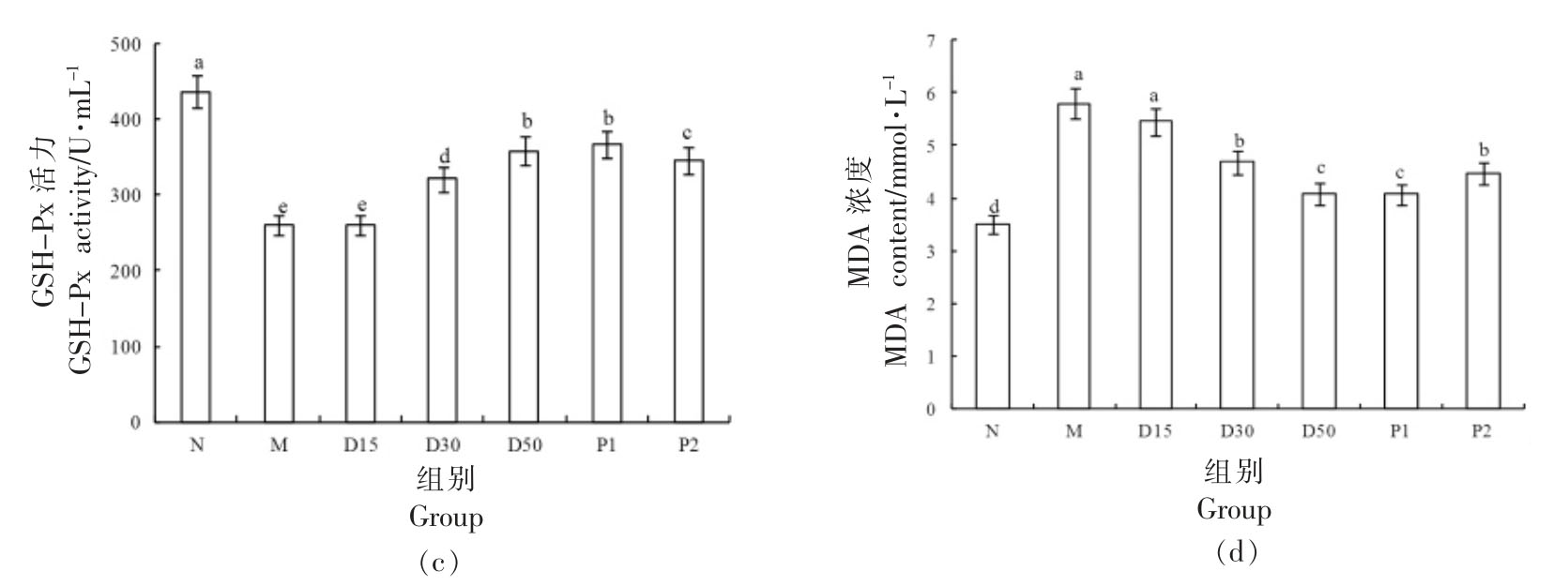
图13 香叶木素对小鼠肝脏氧化应激指标的影响
Fig.13 Effect of diosmetin on oxidative stress of liver in mice
注:柱形上方不同字母说明组间差别显著(P<0.05)。
4 结论
本研究分析了香叶木素与α-葡萄糖苷酶的分子对接能力及其对α-淀粉酶、α-葡萄糖苷酶的抑制活性,在此基础上通过Ⅱ型糖尿病小鼠模型研究了香叶木素的降血糖活性,并探究了其对脂代谢、氧化应激等的效应。香叶木素干预30 d 后,糖尿病小鼠多食、多饮和体重减轻等病征得到缓解,同时,香叶木素还可降低小鼠的FBG 与GSP含量,缓解OGTT 异常与胰岛素抵抗。MDA、TAOC 和SOD 等分析结果证明,香叶木素具有缓解糖尿病氧化应激的作用。TC 和HDL-C 等分析结果发现,香叶木素可以改善小鼠的脂代谢紊乱。肝脏指数和AST、ALT 分析结果显示,香叶木素可以缓解Ⅱ型糖尿病引起的肝功能受损。综上,香叶木素对Ⅱ型糖尿病小鼠具有较好的降血糖作用,但其具体机制尚需通过分子生物学实验等进一步探究。
[1]周雪雪.淫羊藿朝藿定C 对2 型糖尿病小鼠的作用及蛋白质组学研究[D].西安:陕西师范大学,2020.
ZHOU X X.Proteomic analysis of effects of epimedin C on type 2 diabetic mice [D].Xi'an:Shaanxi Normal University,2020.
[2]NIU D,AN S J,CHEN X,et al.Corni fructus as a natural resource can treat type 2 diabetes by regulating gut microbiota[J].American Journal of Chinese Medicine,2020,48(6):1385-1407.
[3]SAEEDI P,SALPEA P,KARURANGA S,et al.Mortality attributable to diabetes in 20-79 years old adults,2019 estimates:Results from the International Diabetes Federation Diabetes Atlas,9 th edition[J].Diabetes Research and Clinical Practice,2020,162(4):1-5.
[4]王俊俊.和厚朴酚抗2 型糖尿病作用与机制实验研究[D].武汉:湖北大学,2016.
WANG J J.Study on anti-diabetic effect and mechanism of honokiol on rats with type 2 diabetes[D].Wuhan:Hubei University,2016.
[5]SAEEDI P,PETERSOHN I,SALPEA P,et al.Global and regional diabetes prevalence estimates for 2019 and projections for 2030 and 2045:Results from the International Diabetes Federation Diabetes Atlas,9 th edition[J].Diabetes Research and Clinical Practice,2019,157(11):1-10.
[6]王云威,王景雪.铁皮石斛多糖对2 型糖尿病小鼠降糖降脂的作用[J].食品科学,2020,41(21):127-132.
WANG Y W,WANG J X.Hypoglycemic and lipidlowering effects of polysaccharides from Dendrobium officinale stems in type 2 diabetic mice[J].Food Science,2020,41(21):127-132.
[7]宁文静.悬钩子根多糖对2 型糖尿病小鼠降糖机制研究[D].延吉:延边大学,2019.
NING W J.Hypoglycemic effects of Rubus root polysaccharide on type 2 diabetic mice[D].Yanji:Yanbian University,2019.
[8]CHOI E H,CHUN Y S,KIM J,et al.Modulating lipid and glucose metabolism by glycosylated kaempferol rich roasted leaves of Lycium chinense via upregulating adiponectin and AMPK activation in obese mice-induced type 2 diabetes[J].Journal of Functional Foods,2020,72(6):1-13.
[9]YUAN H W,JIANG S,LIU Y K,et al.The flower head of Chrysanthemum morifolium Ramat.(Juhua):A paradigm of flowers serving as Chinese dietary herbal medicine[J].Journal of Ethnopharmacology,2020,261(10):1-22.
[10]赵子华,张斐然,韩永旭,等.富硒菊花提取物的抗氧化活性及其对α-淀粉酶和α-葡萄糖苷酶活力的影响[J].天然产物研究与开发,2018,30(7):1105-1110.
ZHAO Z H,ZHANG F R,HAN Y X,et al.Antioxidant activities and effects on α-amylase and αglucosidase of extract from Se-enriched Chrysanthemum morifolium[J].Natural Product Research and Development,2018,30(7):1105-1110.
[11]AMRANI A,MECHERI A,BENSOUICI C,et al.Evaluation of antidiabetic,dermatoprotective,neuroprotective and antioxidant activities of Chrysanthemum fontanesii flowers and leaves extracts[J].Biocatalysis and Agricultural Biotechnology,2019,20(6):1-7.
[12]CUI H Y,BAI M,SUN Y H,et al.Antibacterial activity and mechanism of Chuzhou chrysanthemum essential oil[J].Journal of Functional Foods,2018,48(7):159-166.
[13]冯静.富硒菊花对果蝇寿命和抗氧化防御相关基因表达的影响及其质量标准的制定[D].西安:陕西师范大学,2019.
FENG J.Effects of Se -enriched Chrysanthemum morifolium on lifespan and antioxidant defense-related gene expression of Drosophila melanogaster and establishment of quality standard[D].Xian:Shaanxi Normal University,2019.
[14]HA J,PARK S.Mechanism underlying inhibitory effect of six dicaffeoylquinic acid isomers on melanogenesis and the computational molecular modeling studies[J].Bioorganic and Medicinal Chemistry,2018,26(14):4201-4208.
[15]CHEN J,MANGELINCKX S,MA L,et al.Caffeoylquinic acid derivatives isolated from the aerial parts of Gynura divaricata and their yeast α-glucosidase and PTP1B inhibitory activity[J].Fitoterapia,2014,99(12):1-6.
[16]KIM J S,KWON C S,SON K.Inhibition of alpha-glucosidase and amylase by luteolin,a flavonoid[J].Bioscience,Biotechnology and Biochemistry,2000,64(11):2458-2461.
[17]QIN L Y,CHEN Z Y,YANG L,et al.Luteolin-7-O-glucoside protects dopaminergic neurons by activating estrogen-receptor-mediated signaling pathway in MPTP-induced mice[J].Toxicology,2019,426(10):1-10.
[18]KIM B,LEE J,SEO M J,et al.Linarin downregulates phagocytosis,pro -inflammatory cytokine production,and activation marker expression in RAW264.7 macrophages[J].Food Science and Biotechnology,2016,25(5):1437-1442.
[19]LV G Y,ZHANG Y P,GAO J L,et al.Combined antihypertensive effect of luteolin and buddleoside enriched extracts in spontaneously hypertensive rats[J].Journal of Ethnopharmacology,2013,150(2):507-513.
[20]SHEN Z,SHAO J J,DAI J B,et al.Diosmetin protects against retinal injury via reduction of DNA damage and oxidative stress[J].Toxicology Reports,2016,3(12):78-86.
[21]裴忆雪.香叶木素抗高尿酸血症肾损害作用及机制研究[D].武汉:武汉轻工大学,2019.
PEI Y X.Study on the effect and mechanism of diosmetin againist renel damage in hyperurmia[D].Wuhan:Wuhan Polytechnic University,2019.
[22]ANGAMUTHU H,RAMACHANDRANE M.Investigations on the structural,vibrational,computational,and molecular docking studies on potential antidiabetic chemical agent diosmetin[J].Journal of Molecular Recognition,2020,33(2):1-14.
[23]聂坤伦,何利,速晓娟,等.雅安藏茶抑制α-淀粉酶的活性级分筛选与评价[J].食品科学,2013,34(9):74-79.
NIE K L,HE L,SU X J,et al.Screening and evaluation of α-amylase-inhibiting fractions extracted from Ya'an Tibetan tea[J].Food Science,2013,34(9):74-79.
[24]THI N,TRAM L,HONG T,et al.Inhibitors of aglucosidase,a-amylase and lipase from Chrysanthemum morifolium[J].Phytochemistry Letters,2013,6(4):322-325.
[25]MA T G,ZHENG Z Y,GUO H,et al.4-Omethylhonokiol ameliorates type 2 diabetes-induced nephropathy in mice likely by activation of AMPKmediated fatty acid oxidation and Nrf2-mediated antioxidative stress[J].Toxicology and Applied Pharmacology,2019,370(5):93-105.
[26]YUAN Q C,ZHAN B Y,DU M,et al.Dietary milk fat globule membrane regulates JNK and PI3K/Akt pathway and ameliorates type 2 diabetes in mice induced by a high-fat diet and streptozotocin[J].Journal of Functional Foods,2019,60(7):1-9.
[27]LIU D,REGENSTEIN J,DIAO Y,et al.Antidiabetic effects of water-soluble Korean pine nut protein on type 2 diabetic mice[J].Biomedicine and Pharmacotherapy,2019,117(9):1-13.
[28]LI P C,TANG Y F,LIU L M,et al.Therapeutic potential of buckwheat hull flavonoids in db/db mice,a model of type 2 diabetes[J].Journal of Functional Foods,2019,52(11):284-290.
[29]DONG J,LIANG Q X,NIU Y,et al.Effects of Nigella sativa seed polysaccharides on type 2 diabetic mice and gut microbiota[J].International Journal of Biological Macromolecules,2020,159(9):725-738.
[30]何静,高婉婷,海勒,等.驼乳对2 型糖尿病小鼠肝脏损伤的保护作用[J].中国食品学报,2019,19(7):36-41.
HE J,GAO W T,HAI L,et al.Protective effect of camel milk on liver injury in type 2 diabetic mice[J].Journal of Chinese Institute of Food Science and Technology,2019,19(7):36-41.
[31]LIU X C,WANG K P,ZHOU J,et al.Metformin and Berberine suppress glycogenolysis by inhibiting glycogen phosphorylase and stabilizing the molecular structure of glycogen in db/db mice[J].Carbohydrate Polymers,2020,243(9):1-14.
[32]ZHANG L W,SU S L,ZHU Y,et al.Mulberry leaf active components alleviate type 2 diabetes and its liver and kidney injury in db/db mice through insulin receptor and TGF-β/Smads signaling pathway[J].Biomedicine and Pharmacotherapy,2019,112(4):1-13.
[33]WANG X L,YANG Z M,XU X,et al.Oddnumbered agaro-oligosaccharides alleviate type 2 diabetes mellitus and related colonic microbiota dysbiosis in mice[J].Carbohydrate Polymers,2020,240(15):1-15.
[34]JIAO Y K,WANG X Q,JIANG X,et al.Antidiabetic effects of Morus alba fruit polysaccharides on high-fat diet and streptozotocin-induced type 2 diabetes in rats [J].Journal of Ethnopharmacology,2017,199(3):119-127.
[35]GEIDENSTAM N,DANIELSSON A,SPEGEL P,et al.Changes in glucose-elicited blood metabolite responses following weight loss and long term weight maintenance in obese individuals with impaired glucose tolerance[J].Diabetes Research and Clinical Practice,2016,113(3):187-197.
[36]CAMPBELL-TOFTE J,HANSEN H,MU H L,et al.Increased lipids in non-lipogenic tissues are indicators of the severity of type 2 diabetes in mice[J].Prostaglandins,Leukotrienes and Essential Fatty Acids,2007,76(1):9-18.
[37]JUN J,KANG H S,HWANG Y,et al.The association between lipoprotein(a) and carotid atherosclerosis in patients with type 2 diabetes without preexisting cardiovascular disease:A cross -sectional study[J].Diabetes Research and Clinical Practice,2021,171(12):1-10.
[38]AMIRSHAHROKHI K,ZOHOURI A.Carvedilol prevents pancreatic β-cell damage and the development of type 1 diabetes in mice by the inhibition of proinflammatory cytokines,NF-κB,COX-2,iNOS and oxidative stress[J].Cytokine,2020,138(12):1-9.
[39]于夏.葛根中异黄酮类化合物抗Ⅱ型糖尿病作用的体内外研究[D].沈阳:辽宁大学,2017.
YU X.In vitro and in vivo study of the anti-typeⅡ diabetes mellitus of isoflavones in Pueraria[D].Shenyang:Liaoning University,2017.