燕麦(Avena sativa L)是一种营养价值全面的全谷物杂粮,为禾本科燕麦属一年生粮、饲兼用作物,又名莜麦、玉麦、铃铛麦。燕麦在全世界范围内种植广泛,主要栽培种分为有稃和裸粒两大类型。我国是裸燕麦起源的中心,裸燕麦是河北地区的主要作物。本研究以河北地区的裸燕麦粉为原料。燕麦中含有丰富的B 族维生素,蛋白质以及β-葡聚糖等,具有一定的降脂[1-2]、降糖[3]、抗氧化[4-5]和治疗皮炎[6-7]等功效。青稞(Hordeum vulgare)是大麦的一种特殊类型,是我国西藏地区人们对多棱裸粒大麦的统称,是该地区的主要作物,适应性广,抗逆行强。特殊的生长环境导致青稞有丰富的次生代谢产物[8],富含具有降血脂[9-10]、清肠、调节血糖[11]以及降低胆固醇[12-14]等生理功能的β-葡聚糖及可抗氧化的酚类化合物[15]。以燕麦、青稞为原料的食品虽被广泛开发,但仍需充分挖掘其价值,使产品更加安全、健康。
糖尿病分为I 型糖尿病和II 型糖尿病,II 型糖尿病又被称作非胰岛素依赖型糖尿病。至今,糖尿病患者的数量增长十分快速,预计到2040年,中国的糖尿病患者数量可能多达1.51 亿。临床研究表明糖尿病的发病机制是由多种因素联合作用的结果,糖尿病会使机体氧化损伤程度加剧,生物体内自由基的累积会对细胞及组织器官造成一定程度的氧化损伤,而氧化损伤会加快机体的衰老进程,引发多种疾病。糖尿病会诱发很多并发症,如心脑血管的病变、糖尿病肾病等[16]。对于治疗II型糖尿病,已有很多临床用药,如二甲双胍、阿卡波糖等,然而都有一定的副作用,如胰岛素抵抗或肠胃不适等。通过调节膳食,增加全谷物的摄入,来缓解II 型糖尿病的各种并发症的发生,是食品科学领域的研究方向之一。茶叶、仙草、谷物等人们常食用的材料作为天然降血糖的食材而被广泛关注[17-18]。本研究通过采用高脂饮食配合小剂量链脲佐菌素(streptozotocin,STZ)注射诱导II 型糖尿病模型,探讨燕麦青稞粉对II 型糖尿病小鼠糖脂代谢及体内氧化应激作用,以期为青稞燕麦粉的开发、推广提供理论依据。
1 材料与方法
1.1 动物、材料与试剂
1.1.1 动物及饲料 SPF 级雄性ICR 小鼠100只,体质量20~22 g,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2016-0006。
基础饲料购自北京市博爱科贸有限责任公司;高脂饲料配方为基础饲料52.6%、蔗糖20%、蛋黄粉5%、猪油15%、胆固醇1.2%、酪蛋白5%、胆酸钠0.2%、磷酸氢钙1%。高脂燕麦青稞粉组饲料由高脂饲料与燕麦青稞粉1∶1 混合制成。空白燕麦青稞粉组饲料由基础饲料与燕麦青稞粉1∶1混合制成。混合比例由前期试验所得。
燕麦青稞粉由谷之禅张家口食品有限公司提供。
1.1.2 材料与试剂 链脲佐菌素,美国Sigma 公司;葡萄糖测定试剂盒、甘油三酯(triacylglyceride,TG)试剂盒、胆固醇(total cholesterol,TC)试剂盒、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-c)试剂盒、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-c)试剂盒、丙二醛(malonaldehyde,MDA)试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒、谷胱甘肽(glutathione,GSH)试剂盒和血清胰岛素ELISA 试剂盒,南京建成生物工程研究所。1% STZ 配制:取0.5 g STZ,冰浴条件下溶解在pH 值为4.4 的0.1 mol/L 柠檬酸-柠檬酸钠缓冲液中,定容到50 mL。
1.2 仪器与设备
酶标仪、冷冻低速离机、紫外-可见光分光光度计、7180 型全自动生化分析仪,日本日立高新技术公司。
1.3 方法
1.3.1 动物模型的制备 采用小剂量STZ 注射并给与高脂饲料诱导II 型糖尿病小鼠模型。100 只ICR 小鼠按体质量随机分为两组,包括正常组20只,造模组80 只,在屏障动物房适应性饲养7 d。适应期结束后,禁食12 h,但可自由饮水。造模组小鼠按50 mg/kg 剂量连续多次腹腔注射1% STZ溶液,正常组小鼠腹腔注射等体积柠檬酸-柠檬酸钠缓冲液[19]。腹腔注射STZ 的同时给与高脂饲料。所有小鼠注射3 d 后禁食12 h 检测空腹血糖(fasting blood-glucose,FBG)浓度。以FBG 浓度大于11.1 mmol/L 为成功模型纳入试验组。动物分为5 组,分别为:空白对照组、空白燕麦青稞粉组(图表中简称空白燕麦组)、高脂燕麦青稞粉(图表中简称高脂燕麦组)组、高脂组、阳性对照组。空白对照组给与基础饲料,空白燕麦青稞粉组给予50%添加燕麦青稞粉的基础饲料,高脂燕麦青稞粉组给予50%添加燕麦青稞粉的高脂饲料,高脂组给予高脂饲料,阳性对照组给予高脂饲料且每天用200 mg/kg 浓度二甲双胍灌胃,其余组应当用溶剂灌胃。
1.3.2 指标检测
1.3.2.1 FBG 含量的检测 对小鼠采取眼眶采血的方式,使用葡萄糖试剂盒测定FBG。
1.3.2.2 生化指标的测定 摘眼球采血1 mL 于EP 管中,低速离心取上清,TG、TC、LDL-c 和HDL-c 的含量均使用全自动生化分析仪检测。试剂盒测定小鼠中血清胰岛素的含量。取肝脏组织,测定MDA、GSH 含量以及SOD、GSH-Px 活力。
1.3.2.3 糖耐量试验方法 小鼠禁食且自由饮水12 h,在0,0.5,2 h,3 个时间点对各组小鼠进行眼眶采血,低速离心取得上清液,使用葡萄糖试剂盒测定3 个时间点的FBG。并计算曲线下的面积。
1.4 肠道菌群的测定
小鼠处死前3 d,置于空笼中收集粪便,每组收集5 g。提取样本中的DNA,采取16S rDNA 扩增子测序(16S rDNA Amplicon Sequencing),利用保守区设计通用引物进行PCR 扩增,然后对高变区进行测序分析和菌种鉴定。利用单端测序(Single-End)的方法,构建小片段文库进行单端测序。通过对Reads 剪切过滤,OTUs(Operational Taxonomic Units)聚类,并进行物种注释及丰度分析,揭示样品物种构成。
1.5 数据统计分析
试验数据用SPSS 19.0 软件进行统计学分析,数据以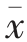 ±s 表示,采用单因素方差分析,组间两两比较采用LSD 和Duncan 检验法,检验水准α取0.05,P<0.05 表明数据间差异有统计学意义。
±s 表示,采用单因素方差分析,组间两两比较采用LSD 和Duncan 检验法,检验水准α取0.05,P<0.05 表明数据间差异有统计学意义。
2 结果与分析
2.1 燕麦青稞粉对糖尿病小鼠体重的影响
给予燕麦青稞粉前,测量各组小鼠体重,根据图1可看出,高脂燕麦组、高脂组以及阳性对照组与空白对照组和空白燕麦青稞粉组小鼠比较,这3 组小鼠体重较为轻,且同时出现了“三多”的典型的糖尿病症状。给予燕麦青稞粉饲料6 周后,各组体重都呈上升趋势,体重较为稳定,无明显波动幅度,空白对照组与空白燕麦青稞粉组比较,小鼠体重并无明显差异(P>0.05)。阳性对照组、高脂燕麦青稞粉组与高脂组比较,小鼠体重并无明显差异(P>0.05)。

图1 燕麦青稞粉对糖尿病小鼠体重的影响
Fig.1 Effect of oat barley powder on body weight of diabetic mice
2.2 燕麦青稞粉对糖尿病小鼠糖耐量的影响
小鼠在6 周喂养结束后进行该试验,如图2a所示,各组血糖值在灌胃葡萄糖30 min 后达到顶峰,之后逐步下降,高脂燕麦青稞粉组、高脂组和阳性对照组血糖值在30~120 min 之间变化缓慢,表现出明显的葡萄糖不耐受。空白对照组和空白燕麦青稞粉组小鼠血糖在120 min 时恢复正常。对曲线AUC 进行计算,如图2b 所示,与空白对照组比较,空白燕麦组有显著差异(P<0.05),高脂组与空白对照组比较有极显著差异(P<0.01),与高脂组相比,高脂燕麦青稞组无明显差异(P>0.05)。50%的燕麦青稞粉并不能改善小鼠糖耐量的效果。

图2 血糖曲线下面积
Fig.2 Area under the blood glucose curve
注:* 与空白对照组相比,P<0.05、**P<0.01;# 与高脂组相比,P<0.05、## P<0.01。
2.3 燕麦青稞对糖尿病小鼠FBG 的影响
在前两周,高脂组的血糖值与空白对照组相比,存在极显著差异(P<0.01)。第6 周,阳性对照组与高脂组比较存在显著差异(P<0.05),6 周内,空白组与空白燕麦青稞粉组比较无显著差异(P>0.05),高脂燕麦青稞粉组与高脂组比较无显著差异(P>0.05)。
2.4 燕麦青稞粉对糖尿病小鼠血脂的影响
高脂组与空白对照组相比,其TC、HDL-c 和LDL-c 水平都存在极显著差异(P<0.01),TG 水平存在显著差异(P<0.05)。与高脂组比较,高脂燕麦青稞粉组的TC 水平显著降低(P<0.05),而TG 水平无显著差异(P>0.05),但HDL-c 和LDL-c 的水平极显著的降低(P<0.01)。以上数据表明,燕麦青稞粉对小鼠血脂起到一定的改善作用。
2.5 燕麦青稞对糖尿病小鼠抗氧化指标的影响
高脂燕麦青稞粉组的GSH-px 水平与高脂组相比,显著升高(P<0.05),SOD 的水平显著升高(P<0.05),MDA 的水平无显著的差异(P>0.05),GSH 的水平无显著差异(P>0.05)。
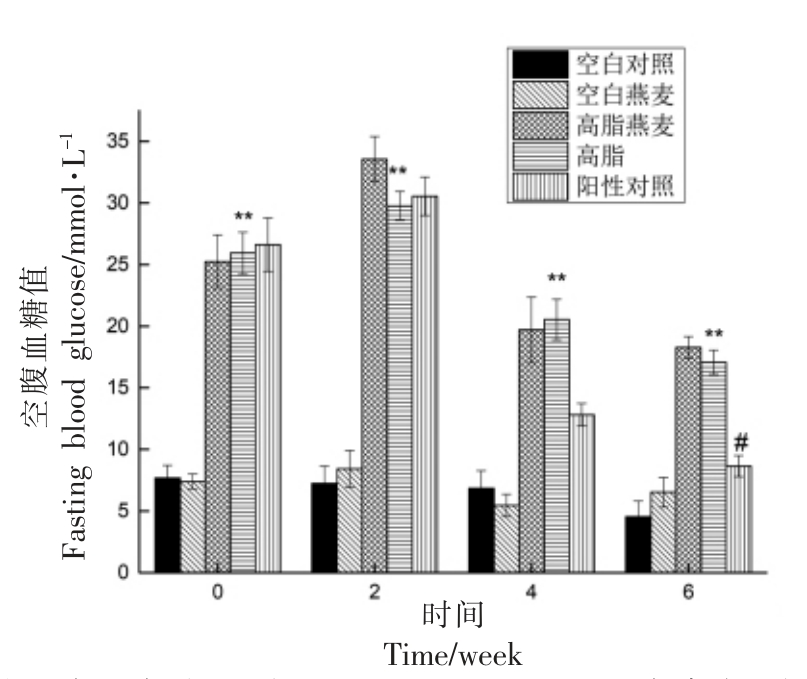
图3 燕麦青稞粉对糖尿病小鼠FBG 的影响
Fig.3 Effect of oat barley powder on FBG in diabetic mice
注:* 与空白对照组相比,P<0.05、** P<0.01;# 与高脂组相比,P<0.05、##P<0.01。
2.6 燕麦青稞粉对糖尿病小鼠血清胰岛素的影响
与高脂组相比较,高脂燕麦青稞粉组胰岛素有极显著差异(P<0.01),阳性对照组与高脂组比较无显著差异(P>0.05)。高脂组与空白对照组比较,有极显著差异(P<0.01)。

图4 燕麦青稞粉对糖尿病小鼠血清胰岛素的影响
Fig.4 Effect of oat barley powder on serum insulin in diabetic mice
注:* 与空白对照组相比,P<0.05,**P<0.01;# 与高脂组相比,P<0.05,## P<0.01。
表1 燕麦青稞粉对糖尿病小鼠血脂的影响
Table 1 Effects of oat barley powder on blood lipids in diabetic mice
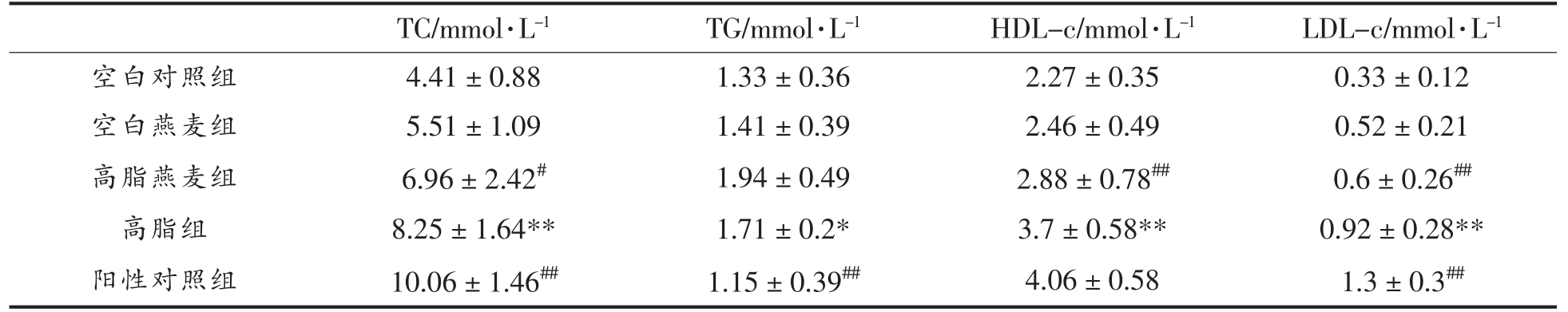
注:* 与空白对照组相比,P<0.05,**P<0.01;#与高脂组相比,P<0.05,##P<0.01。
TC/mmol·L-1 TG/mmol·L-1 HDL-c/mmol·L-1 LDL-c/mmol·L-1空白对照组 4.41±0.88 1.33±0.36 2.27±0.35 0.33±0.12空白燕麦组 5.51±1.09 1.41±0.39 2.46±0.49 0.52±0.21高脂燕麦组 6.96±2.42# 1.94±0.49 2.88±0.78## 0.6±0.26##高脂组 8.25±1.64** 1.71±0.2* 3.7±0.58** 0.92±0.28**阳性对照组 10.06±1.46## 1.15±0.39## 4.06±0.58 1.3±0.3##
表2 燕麦青稞粉对糖尿病小鼠氧化指标的影响
Table 2 Effect of oat barley powder on oxidation index in diabetic mice
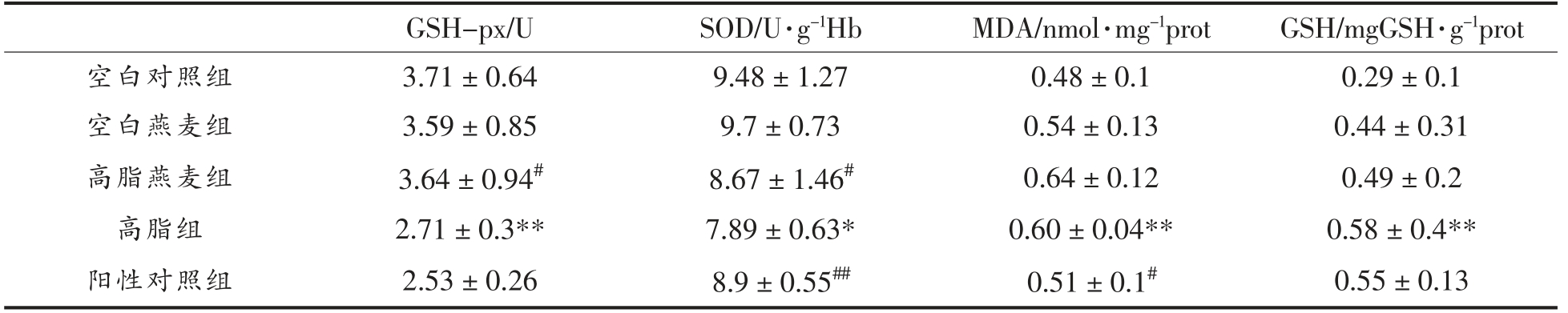
注:* 与空白对照组相比,P<0.05,**P<0.01;#与高脂组相比,P<0.05,##P<0.01。
GSH-px/U SOD/U·g-1Hb MDA/nmol·mg-1prot GSH/mgGSH·g-1prot空白对照组 3.71±0.64 9.48±1.27 0.48±0.1 0.29±0.1空白燕麦组 3.59±0.85 9.7±0.73 0.54±0.13 0.44±0.31高脂燕麦组 3.64±0.94# 8.67±1.46# 0.64±0.12 0.49±0.2高脂组 2.71±0.3** 7.89±0.63* 0.60±0.04** 0.58±0.4**阳性对照组 2.53±0.26 8.9±0.55## 0.51±0.1# 0.55±0.13
2.7 小鼠胰岛HE 染色切片
如图5所示,(图中病理切片放大倍数均为20x)空白对照组组织染色均匀,腺泡细胞形态结构正常,胰岛形状规则,未见明显炎症。空白燕麦组组织染色均匀,腺泡细胞形态结构正常,胰岛形状规则,未见明显炎症。高脂组组织染色均匀,腺泡细胞形态结构正常;胰岛数量大量减少、面积减小,局部仅存胰岛中可见胰岛细胞胞质空泡化;局部淋巴管中可见淋巴细胞数量增多。高脂燕麦组组织染色均匀,腺泡细胞形态结构正常;胰岛数量大量减少、面积减小,局部仅存胰岛中可见分裂象。阳性对照组组织染色均匀,腺泡细胞形态结构正常,胰岛形状规则,未见明显炎症。整体表明,燕麦青稞粉能部分改善小鼠胰腺组织的病理状态。
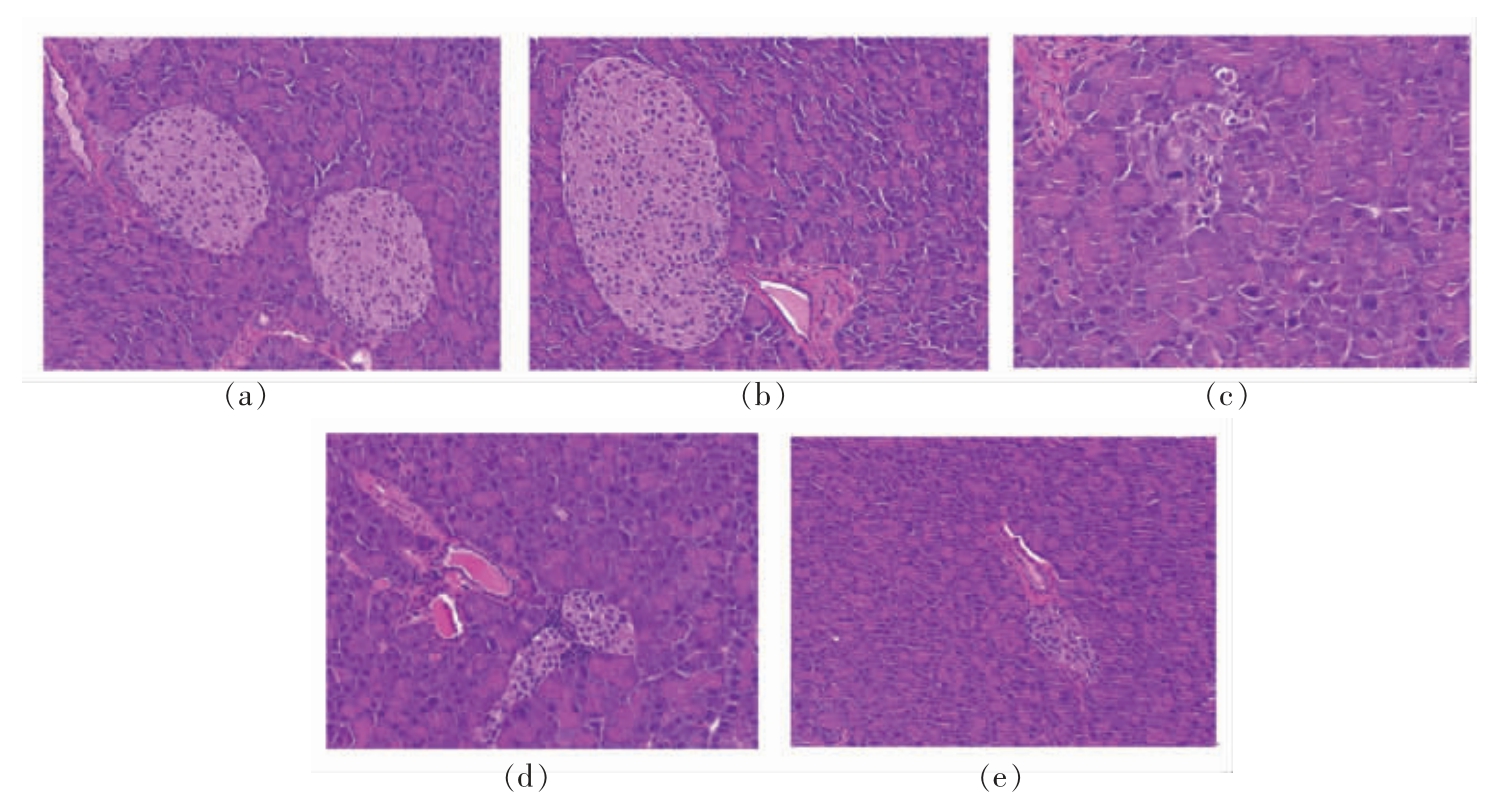
图5 胰岛HE 染色切片
Fig.5 HE-stained sections of pancreatic islets
2.8 燕麦青稞粉对肠道菌群的影响
从图6结果整体来看,各组整体菌群丰度有很大不同,其中乳酸菌(Lactobacillus,图中红色)菌群在几组间变化是非常明显的。正常组中乳酸菌含量最高,极为明显,模型组中乳酸菌含量降低至几乎没有,高脂燕麦青稞粉组乳酸菌含量比高脂模型组的有一定程度的增加,阳性对照组的乳酸菌含量明显高于吃高脂燕麦青稞粉的组,说明燕麦青稞,在肠道菌群的改变中起到一定的作用,从而在一定程度上起到调节血糖的作用。
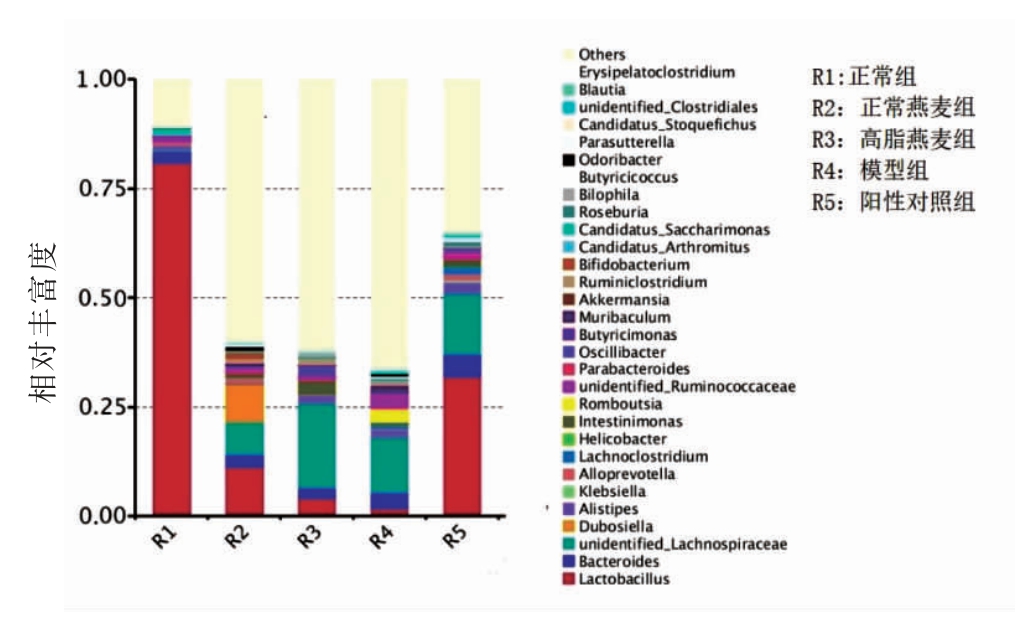
图6 燕麦青稞粉对糖尿病小鼠肠道菌群的影响
Fig.6 The effect of oat barley powder on the intestinal flora of diabetic mice
3 讨论
并发症的产生是糖尿病患者死亡的主要原因。糖尿病患者胰岛素生物学调节障碍,在血糖水平升高时往往伴随着脂代谢异常,糖尿病和高脂血症更可能引起中风,冠状动脉疾病和肢体坏死等并发症,因此调节糖脂代谢紊乱十分重要[20-23]。通过研究数据表明,燕麦青稞粉可以降低II 型糖尿病小鼠的高血脂情况,说明其在降血脂方面有较好的活性,在预防与治疗糖尿病方面有较好的应用价值[24-27]。II 型糖尿病的发生与机体的氧化应激反应密切相关,在糖尿病大鼠体内,氧化应激水平升高[20]。本研究结果显示,燕麦青稞粉对II 型糖尿病小鼠模型具有降低血糖的作用。与高脂组相比,SOD 水平和GSH-Px 活力显著升高,说明燕麦青稞粉起到了一定的抗氧化作用。HDL-c 和LDL-c 水平都发生降低,LDL-c 水平的降低将对糖尿病起到缓解作用,两者水平的同时降低,可能与脂代谢紊乱有关,也可能是燕麦青稞粉只起到一定的调节作用,并不能对其产生治疗的功效。
肠道菌群参与并影响着人体的物质与能量代谢[28]。乳酸菌对糖脂代谢紊乱恢复和肠道菌群营养不良的恢复的影响表现出种内和种内差异[29]。研究发现,乳酸菌可以通过调节脂代谢、糖代谢等对糖尿病产生调节作用[30]。对小鼠的肠道菌群种类进行了检测,乳酸菌在不同组中差异较大,对糖脂代谢可能具有一定的作用,具体的作用方式仍不清楚,可进行进一步探究。一些未知菌群在各组变化也十分明显,但是并不知道具体是什么种类,以及对血糖的调节起到何种作用,对此值得进一步深入研究。燕麦青稞粉可能通过调节肠道菌群来实现降血糖的作用。
[1]陈新宇,兰凤英,张宗颖.几种常见杂粮降血脂功效研究进展[J].粮食与油脂,2019,32(8):18-20.
CHEN X Y,LAN F Y,ZHANG Z Y.Research progress on several common coarse cereals in lowering blood lipid[J].Cereals & Oils,2019,32(8):18-20.
[2]马超月.燕麦多肽的制备及其降血脂和降血压效果研究[D].镇江:江苏大学,2018:25-38.
MA C Y.Preparation of oat polypeptides and their hypolipidemic and hypotensive effects[D].Zhenjiang:Jiangsu University,2018:25-38.
[3]黄远英,汪玉芳.燕麦β-葡聚糖辅助降血糖功能的研究[J].食品 安全质量检 测学报,2019,10(2):369-373.
HUANG Y Y,WANG Y F.Study on the assisting blood sugar reduction function of oat β-glucan[J].Journal of Food Safety & Quality,2019,10(2):369-373.
[4]MARMOUZI I,KARYM E M,SAIDI N,et al.In vitro and in vivo antioxidant and anti-hyperglycemic activities of moroccan oat cultivars[J].Antioxidants(Basel,Switzerland),2017,6(4):102.
[5]YU X,YANG M,DONG J,et al.Comparative analysis of the antioxidant capacities and phenolic compounds of oat and buckwheat vinegars during production processes[J].Journal of Food Science,2018,83(3):844-853.
[6]ILNYTSKA O,KAUR S,CHON S,et al.Colloidal oatmeal(Avena Sativa) improves skin barrier through multi-therapy activity[J].Journal of Drugs in Dermatology:JDD,2016,15(6):684-690.
[7]LISANTE T A,NUNEZ C,ZHANG P,et al.A 1% colloidal oatmeal cream alone is effective in reducing symptoms of mild to moderate atopic dermatitis:Results from two clinical studies[J].Journal of Drugs in Dermatology:JDD,2017,16(7):671-676.
[8]高汪磊.青稞麸皮中阿魏酰糖酯的分离提取及其抗糖化作用研究[D].杭州:浙江大学,2015:16-22.
GAO W L.Isolation and extraction of ferulose esters from barley bran and their anti-glycation effect[D].Hangzhou:Zhejiang University,2015:16-22.
[9]WANG Y,HARDING S V,THANDAPILLY S J,et al.Barley beta-glucan reduces blood cholesterol levels via interrupting bile acid metabolism[J].The British Journal of Nutrition,2017,118(10):822-829.
[10]LI L,PAN M,PAN S,et al.Effects of insoluble and soluble fibers isolated from barley on blood glucose,serum lipids,liver function and caecal shortchain fatty acids in type 2 diabetic and normal rats[J].Food and Chemical Toxicology:an International Journal Published for the British Industrial Biological Research Association,2019,1(135):110937.
[11]LIU R,ZHAO J,GUO J,et al.Postprandial metabolomics:GC-MS analysis reveals differences in organic acid profiles of impaired fasting glucose individuals in response to highland barley loads[J].Food & function,2019,10(3):1552-1562.
[12]BIRD A R,JACKSON M,KING R A,et al.A novel high-amylose barley cultivar(Hordeum vulgare var.Himalaya 292) lowers plasma cholesterol and alters indices of large-bowel fermentation in pigs[J].The British Journal of Nutrition,2004,92(4):607-615.
[13]WILSON T A,NICOLOSI R J,DELANEY B,et al.Reduced and high molecular weight barley betaglucans decrease plasma total and non-HDL-cholesterol in hypercholesterolemic Syrian golden hamsters[J].The Journal of Nutrition,2004,134(10):2617-2622.
[14]YANG J L,KIM Y H,LEE H S,et al.Barley beta-glucan lowers serum cholesterol based on the up-regulation of cholesterol 7alpha-hydroxylase activity and mRNA abundance in cholesterol-fed rats[J].Journal of Nutritional Science and Vitaminology,2003,49(6):381-387.
[15]包雪梅,谢惠春.青稞主要成分及其应用的研究进展[J].现代食品,2019(2):43-47.
BAO X M,XIE H C.Research progress in main components and application of highland barley [J].Modern Food,2019(2):43-47.
[16]周颖文.浅谈糖尿病并发症的危害与防治[J].现代医学与健康研究电子杂志,2018,2(11):59.
ZHOU Y W.Talking about the dangers and prevention of diabetic complications[J].Modern Medicine and Health Research,2018,2(11):59.
[17]刘芷君,林玲,雷郑延,等.茶籽皂苷对链脲佐菌素诱导的糖尿病大鼠血糖的影响[J].食品科学,2020,41(19):179-184.
LIU Z J,LIN L,LEI Z Y,et al.Effect of theasaponin on blood glucose in streptozocin-induced diabetic rats[J].Food Science,2020,41(19):179-184.
[18]何传波,邓婷,魏好程,等.仙草多糖对细胞氧化损伤的保护作用[J].食品科学,2020,41(13):160-168.
HE C B,DENG T,WEI H C,et al.Protective effect of polysaccharide from mesona blumes on oxidative damage of cells[J].Food Science,2020,41(13):160-168.
[19]覃艺,张树球,郭厚基,等.舒糖宝对STZ 造模2型糖尿病小鼠生化指标的影响[J].实用糖尿病杂志2005,1(5):22-24.
QIN Y,ZHANG S Q,GUO H J,et al.Effect of Sugambo on biochemical parameters of STZ-modelled type 2 diabetic mice[J].Liaoning Journal of Practical Diabetology,2005,1(5):21-24.
[20]植飞,邢琪昌,汪莹,等.佛手山药多糖对2 型糖尿病大鼠糖脂代谢及氧化应激的影响[J].食品科学,2017,38(5):262-266.
ZHI F,XING Q C,WANG Y,et al.Effect of Dioscorea opposita Thunb.polysaccharide on glycolipid metabolism and oxidative stress in type 2 diabetic rats[J].Food Science,2017,38(5):262-266.
[21]吴守锋,刘怀珍.2 型糖尿病脂代谢紊乱中医研究进展[J].现代中医药,2012,32(2):77-79.
WU S F,LIU H Z.Advances in Chinese medicine research on disorders of lipid metabolism in type 2 diabetes[J].Modern Traditional Chinese Medicine,2012,32(2):77-79.
[22]郭丹,王福莉,陶黎莉.糖尿病患者脂质代谢紊乱的特点及治疗对策[J].中国医药指南,2019,17(22):122-123.
GUO D,WANG F L,TAO L L.Characteristics of lipid metabolism disorders in diabetic patients and treatment countermeasures [J].Guide of China Medicine,2019,17(22):122-123.
[23]舒珍珍,臧淑妃.糖尿病患者血脂紊乱对大血管病变及胰岛素抵抗的影响[J].中国现代医生,2016,54(7):1-4.
SHU Z Z,ZANG S F.Effects of dyslipidemia on the large vascular disease and insulin resistance in patients with diabetes mellitus [J].China Modern Doctor,2016,54(7):1-4.
[24]朱斌,沈汉超.糖尿病氧化应激的研究进展及其与糖尿病肾病的关系[J].国外医学(泌尿系统分册),2004,24(6):818-822.
ZHU B,SHEN H C.Advances in the study of oxidative stress in diabetes mellitus and its relationship with diabetic nephropathy[J].Medicine Abroad(Urological Division),2004,24(6):818-822.
[25]谢飞舟,施冬云,肖玲,等.2 型糖尿病葡萄糖应激与抗氧化代偿的变化[J].复旦学报(医学版),2009,36(1):23-27.
XIE F Z,SHI D Y,XIAO L,et al.Compensatory changes of antioxidant capacity in response to glucose stress in type 2 diabetes mellitus[J].Fudan Journal(Medical Edition),2009,36(1):23-27.
[26]周俪姗.胡芦巴丸及灰兜巴抗氧化应激治疗糖尿病肾病的机理研究[D].武汉:华中科技大学,2013:46-61.
ZHOU L S.Mechanisms of antioxidant stress treatment of diabetic nephropathy with fenugreek pills and ashwagandha[D].Wuhan:Huazhong University of Science and Technology,2013:46-61.
[27]陈敏,程丽霞.抗氧化应激治疗糖尿病肾病研究进展[J].青岛医药卫生,2016,48(4):292-294.
CHEN M,CHENG L X.Research progress of oxidation stress treatment of diabetic nephropathy [J].Qingdao Medical Journal,2016,48(4):292-294.
[28]张静,吕毅.肠道菌群失调诱发2 型糖尿病的研究进展[J].中国微生态学杂志,2016,28(1):113-116.
ZHANG J,LV Y.Gut microflora induce type 2diabetes mellitus:progress in researches[J].Chinese Journal of Microecology,2016,28(1):113-116.
[29]WANG G,SI Q,YANG S,et al.Lactic acid bacteria reduce diabetes symptoms in mice by alleviating gut microbiota dysbiosis and inflammation in different manners[J].Food & function,2020,11(7):5898-5914.
[30]YAN F,LI N,SHI J,et al.Lactobacillus acidophilus alleviates type 2 diabetes by regulating hepatic glucose,lipid metabolism and gut microbiota in mice[J].Food & Function,2019,10(9):5804-5815.