高血压是常见的慢性病之一,以动脉血压持续升高作为主要特征,也是我国心脑血管(cardiovascular)病人死亡的主要原因[1]。控制高血压是心脑血管病预防的切入点和关键措施,而血管紧张素转化酶(Angiotensin-I-converting enzyme,ACE)可将肾素-血管紧张素系统(Renin-angiotensinsystem,RAS) 的血管紧张素I 转化为血管紧张素Ⅱ(血管收缩剂),使激肽释放酶-激肽系统(Kallikrein-kininsystem,KKS) 中血管舒缓激肽C失活,从而失去降血压的功能[2]。通过抑制ACE 酶活性,降血压肽在降低血压中发挥重要作用[3]。
酪蛋白是活性肽的良好来源,很多研究已验证牛奶、驼奶、山羊奶和牦牛奶来源的酪蛋白具有降血压功能[4-7]。目前对于绵羊奶的研究主要集中在理化特性、营养成分、微生物检测、酸奶和奶酪制作等方面[8-11],关于绵羊奶活性肽方面的研究相对较少。Tagliazucchi 等[12]通过体外模拟胃肠道环境消化牛奶、驼奶、山羊奶和绵羊乳,比较4 种乳源制备的ACE 抑制活性肽,结果表明绵羊奶水解物的降血压效果明显高于其它3 种奶。Hernández-Ledesma 等[13]使用不同蛋白酶水解绵羊奶和山羊奶乳清中分离的β-乳球蛋白,得到高抑制率的ACE 活性肽,而关于酶法制备绵羊奶酪蛋白ACE 抑制肽的研究鲜见报道。研究表明ACE抑制肽C-末端常含有Phe、Trp 等疏水性氨基酸[14],N-末端含有亮氨酸或碱性氨基酸等特点[15],结合蛋白酶的酶切位点,试验选择5 种蛋白酶(碱性蛋白酶、胰蛋白酶、胃蛋白酶、蛋白酶K 和中性蛋白酶)水解酪蛋白。
本研究的目的是确定绵羊乳酪蛋白最佳酶解工艺,并从酪蛋白水解物中筛选和鉴定一种新的ACE 抑制肽,阐明其活性机制。利用LC-MS 鉴定酪蛋白水解物中的肽并合成一种新的ACE 抑制肽,测定其IC50 值和ACE 抑制动力学,使用分子对接解释肽段对ACE 的抑制机制,为绵羊乳产品的开发和降血压肽产品的研究提供理论依据。
1 材料与方法
1.1 材料与试剂
绵羊乳,采自金昌奶绵羊试验示范基地;酪蛋白,实验室制备;碱性蛋白酶(2.4LFG)、中性蛋白酶(0.8 L),诺维信公司提供;胰蛋白酶(2 500 U/mg),上海源叶有限公司;蛋白酶K,德国Meker 公司;胃蛋白酶(≥250 U/mg)、邻苯二甲醛(OPA)、L-丝氨酸,北京索莱宝有限公司;马尿酸-组氨酸-亮氨酸(HHL),上海麦克林有限公司;血管紧张素转换酶(ACE)、色谱级乙腈,美国Sigma 公司;其它试剂均为国产分析纯级。
1.2 仪器与设备
Orbitrap Fusion Lumos Tribrid MS 三合一质谱仪,美国ThermoFisher 公司;ÄKTA 蛋白纯化系统,美国GE 公司;高速冷冻离心机,安徽中科公司;真空冷冻干燥机,北京四环科学仪器厂有限公司;1100 型高效液相色谱,美国Agilent 公司。
1.3 方法
1.3.1 蛋白酶筛选 将酪蛋白配成底物质量分数为5%的溶液,在各酶的最适条件下酶解(见表1),并以1 mol/L NaOH 维持酶解体系的pH 值不变,90 min 后水浴灭活(95 ℃,15 min),冷却至室温后调pH 值为7,离心(10 000×g 15 min,4 ℃)取上清液,测定样品的水解度和ACE 抑制率。
表1 不同蛋白酶最适水解条件
Table 1 The optimum enzyme hydrolysis conditions of different proteases
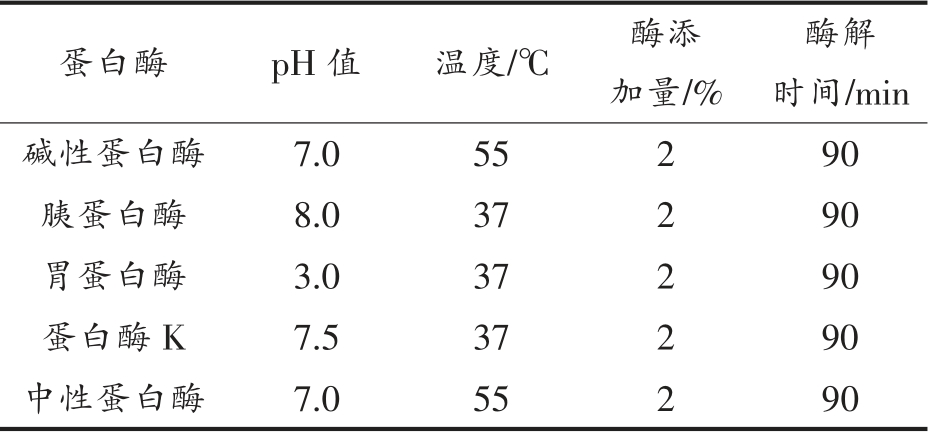
酶解时间/min碱性蛋白酶 7.0 55 2 90胰蛋白酶 8.0 37 2 90胃蛋白酶 3.0 37 2 90蛋白酶K 7.5 37 2 90中性蛋白酶 7.0 55 2 90蛋白酶 pH 值 温度/℃ 酶添加量/%
1.3.2 单因素试验 选择碱性蛋白酶作为酪蛋白最佳水解酶,保持其它条件不变,考察酶解时间(60,90,120,150,180 min)、pH(6,7,8,9,10)、温度(45,50,55,60,65 ℃)、酶添加量E/S(1%,2%,3%,4%,5%)、底物含量(4%,6%,8%,10%,12%)对酪蛋白水解物ACE 抑制率的影响。
1.3.3 响应面优化 基于单因素试验确定pH 值为6,底物含量为8%,在此条件下选择酶解温度、酶添加量、酶解时间3 个因素,以水解液ACE 抑制率为指标,设计三因素三水平试验优化酶解条件,试验因素及水平见表2。
表2 响应面试验设计因素与水平
Table 2 Factors and levels of response surface experiment
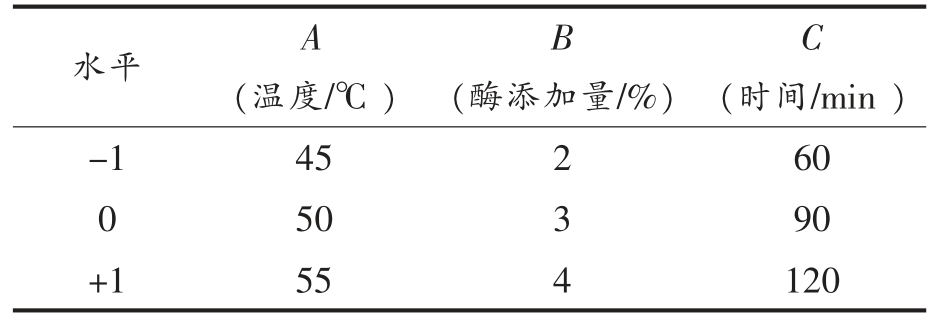
水平 A(温度/℃)B C(时间/min )-1 45 2 60 0 50 3 90+1 55 4 120(酶添加量/%)
1.3.4 ACE 抑制率的测定 ACE 抑制率的测定采用高效液相色谱法[16]。向离心管中加入10 μL样品和30 μL 2.5 mmol/L HHL,37 ℃培养5 min,加入20 μL 0.1 U/mL ACE 后37 ℃振荡培养60 min,最后加入60 μL 的1 mol/L HCL 终止反应。ACE 酶解释放的HA(马尿酸)峰面积通过HPLC测定。
测定马尿酸标准曲线:将马尿酸标准溶液(1 mg/mL)稀释为:25,50,80,100,300 和400 μg/mL,上样量5 μL,以峰面积为纵坐标,马尿酸浓度为横坐标,绘制标准曲线。
ACE 抑制率(%)=(ΔAControl-ΔAsample/ΔAControl)×100
式中:ΔAControl 和ΔAsample 分别代表空白(缓冲液)和样品中HA 的峰面积。
1.3.5 酪蛋白水解度的测定 水解度(Degree of hydrolysis,DH)的测定采用OPA 法[17]。
1.3.6 酪蛋白水解液分子质量的测定 分子质量的测定采用凝胶色谱法(gel filtration chromatography,GFC)[18]。试验选择牛乳白蛋白(6 800 u)、α-乳白蛋白(14 186 u)、维生素B12(1 355 u)、氧化型谷胱甘肽(612.63 u)、甘氨酸(75 u)为标准品,以出峰时间为横坐标,分子质量的对数值为纵坐标绘制标准曲线。
1.3.7 ACE 抑制肽的结构鉴定 采用Orbitrap Fusion Lumos Tribrid MS 三合一质谱仪对小于3 ku 的组分进行多肽的结构鉴定,色谱柱:预柱C18-(2 cm×100 μm)、分析柱C18-(15 cm×75 μm,5 μm 120A);流动相A:0.1%甲酸的水,流动相B:0.1%甲酸的乙腈;梯度洗脱程序为0~2 min,8%~18% B;2~32 min,18%~35% B;32~34 min,35%~100% B;34~42 min,100% B;进样量:5 μL;流速:300 nL/min。质谱条件参考刘静波的方法[19],其中质量扫描范围调整为350~1 600(m/z),比对软件:ThermoproteomeDiscover。
1.3.8 ACE 抑制肽的合成及IC50 的测定 采用固相合成方法对挑选的肽段进行合成(纯度≥98%),此步骤由上海生工生物工程股份有限公司完成,后对合成肽的ACE 抑制率的IC50 进行测定。
1.3.9 ACE 抑制肽动力学研究 肽段对ACE 酶抑制模式参考Bhaskar 等[20]方法并稍加修改。将LFRQFY(0,3,9 μmol/L)和不同浓度的HHL(0.5,2,2.5,3.5 mmol/L) 与ACE 按1.3.5 节方法混合测定马尿酸的含量,使用双倒数做图分析抑制动力学。
1.3.10 分子对接 分析抑制肽和ACE 酶之间的分子水平相互作用,使用Discovery Studio 2019软件模拟分子对接。多肽的分子结构由软件的Macromolecules 模块中Build and Edit Protein 生成,再用Small Molecules 中的Full Minimization进行结构优化。ACE 晶体结构(代码:1O8A)从RCSB 蛋白质数据库下载PDB 格式。使用软件的Macromolecules 模块中的Clean Protein 对ACE 分子进行清洗、制备、除水和加氢处理,然后以Zn2+原子为活性中心,定义活性坐标为(X:38.977,Y:38.645,Z:50.183),对接半径为15Å。选择程序CDOCKER 进行半柔性分子对接[21],基于CDOCKER 能量分数、相互作用位点和与ACE 的相互作用力类型来评估分子对接的结果。
1.3.11 数据分析 通过Design-Expert 11.0 软件进行响应面分析,Origin 2018 分析软件数据处理和作图。
2 结果与分析
2.1 蛋白酶的筛选
在相同酶解条件下,比较5 种蛋白酶对酪蛋白的水解能力。由图1a 所示,5 种蛋白酶中胃蛋白酶的水解度最小为(2.8±0.12)%,胰蛋白酶的水解度最大为(10.58±0.09)%,5 种蛋白酶水解液的水解度存在显著性差异(P<0.05)。在本试验中,5种蛋白酶水解液的水解度排序为:Y>K>Z>J>W。这可能与蛋白酶的酶切位点以及酶活有关。
为了进一步了解5 种蛋白酶对酪蛋白的酶解和多肽释放的影响,酶解前后使用GFC 比较蛋白/肽的分子质量大小分布(图1b)。酶解前,酪蛋白(CP) 溶液主要含有分子质量大于10 ku 的物质。这与报道的酪蛋白中主要蛋白质的分子质量一致[22]。与酪蛋白原液相比,水解后的酪蛋白水解物中(>10 ku)蛋白质的比例显著降低,小分子质量的组分(<3 ku)增多,并且随着水解的增大其所占比例逐渐增加。
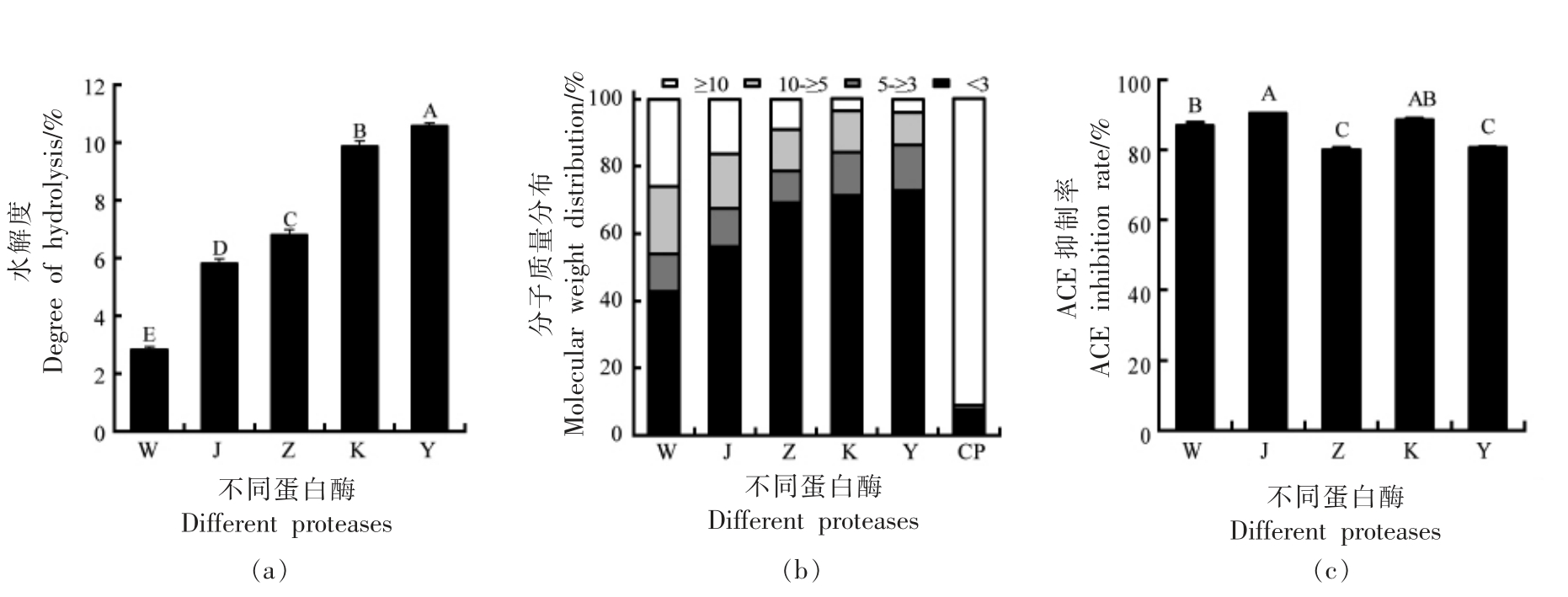
图1 不同蛋白酶酶解对酪蛋白水解液的水解度(a)、分子质量分布(b)和ACE 抑制率(c)的影响
Fig.1 Effects of different proteases on degree of hydrolysis(a),molecular weight distribution(b)and ACE inhibition rate(c) of casein hydrolysate
注:CP、W、J、Z、K、Y 分别代表酪蛋白、胃蛋白酶、碱性蛋白酶、中性蛋白酶、蛋白酶K 和胰蛋白酶;不同字母表示各数值之间存在显著性差异(P<0.05)。
酪蛋白水解液的ACE 抑制率结果如图1c 所示,5 种蛋白水解液中,ACE 抑制率最高的是碱性蛋白酶(90%±0.07%),和蛋白酶K 没有显著差异(P>0.05),中性蛋白酶水解液ACE 抑制率最低(79.8%±0.78%),并与胰蛋白酶水解液无显著差异(P<0.05)。在研究中,绵羊乳酪蛋白水解产物的ACE 抑制率高于Ugwu 等[23]用胃蛋白酶和胰蛋白酶水解驼奶和马奶来源的酪蛋白及Xu 等[24]用中性蛋白酶处理牛乳酪蛋白获得水解产物的ACE抑制率,原因可能与不同乳源的酪蛋白结构存在差异以及酶添加量有关。综合考虑,选择碱性蛋白酶进行单因素试验。
2.2 单因素试验结果
2.2.1 酶解时间对酪蛋白水解液的影响 图2显示,在60 min 至120 min,酪蛋白水解度迅速增加,120 min 之后,酪蛋白水解度趋于稳定。ACE 抑制率随着酶解时间的延长呈先增加后稳定下降的趋势,酪蛋白水解液在90 min 抑制率最高。这一结论与Kim 等[25]研究一致,随着水解时间的延长,ACE 抑制率先增加后降低,最初产生的ACE 抑制肽随后被降解。
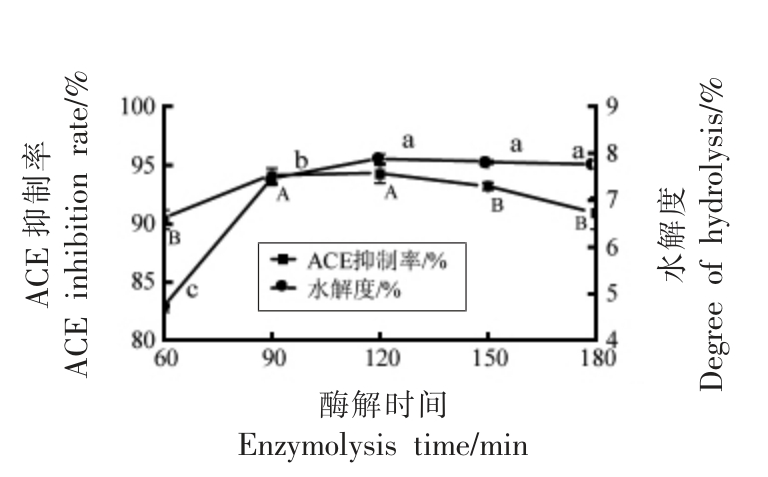
图2 酶解时间对ACE 抑制率和水解度的影响
Fig.2 Effect of enzymolysis time on ACE inhibition rate and degree of hydrolysis
2.2.2 酶解pH 值对酪蛋白水解液的影响 图3显示,随着pH 值的增加,酪蛋白水解度显著性增大(P<0.05),而ACE 抑制率则缓慢降低。这是因为随着水解度增大酪蛋白被过度水解,产生的ACE 抑制肽被酶解更小分子的多肽和氨基酸从而失去降血压作用[26]。因此选择pH 6 为最适酶解条件。
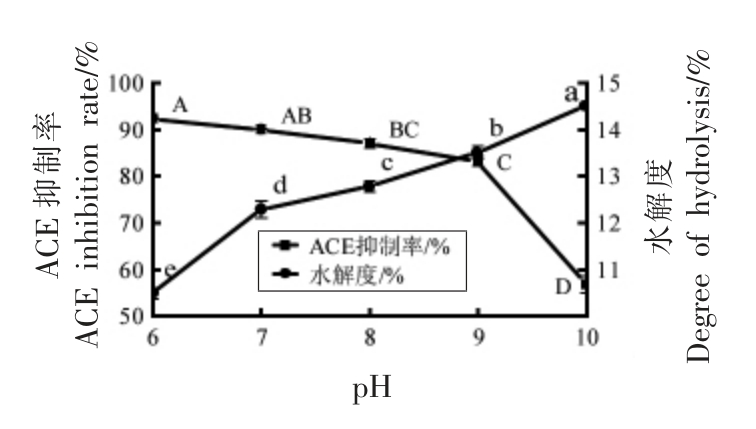
图3 酶解pH 值对ACE 抑制率和水解度的影响
Fig.3 Effect of enzymolysis pH on ACE inhibition rate and degree of hydrolysis
2.2.3 酶解温度对酪蛋白水解液的影响 图4显示,酪蛋白水解度随着酶温度升高而增大。在一定温度范围内,升高温度能够加快化学反应的速度,提高底物和酶的结合几率,使酪蛋白水解度增加[27]。ACE 抑制率随着温度的上升呈现出先增加后下降的趋势,在50 ℃得到最大值。结合水解度分析,适当水解可以提高酪蛋白水解物的ACE 抑制率,但过度水解则会破坏短肽段的分子结构使其失去活性。试验选择50 ℃作为最佳酶解温度。
2.2.4 酶添加量对酪蛋白水解液的影响 图4显示,当酶添加量从1%增加4%时,水解度显著性增加(P<0.05),但当酶添加量增加到5%时,水解度无显著性变化(P>0.05)。这是因为当酶添加量增加到一定程度,酶与底物已充分结合,加大酶用量对于酶解效果的影响越来越小。而ACE 抑制率则先升高后下降,在3%有最大值。试验中水解度和ACE 抑制率随酶添加量的变化趋势与Guo 等[28]使用蛋白酶水解乳清蛋白的结果相似。

图4 酶解温度对ACE 抑制率和水解度的影响
Fig.4 Effect of enzymolysis temperature on ACE inhibition rate and degree of hydrolysis

图5 酶添加量对ACE 抑制率和水解度的影响
Fig.5 Effect of enzyme addition on ACE inhibition rate and degree of hydrolysis
2.2.5 底物含量对酪蛋白水解液的影响 图6显示,随着底物含量的增加,酪蛋白水解度先降低后处于稳定。当底物含量过高时,会减弱反应体系的流动性,限制了酶与底物的接触,导致水解度降低;水解物的ACE 抑制率则先上升后下降,在底物含量8%时达到最大值,因此选择底物含量8%作为最佳水解条件。

图6 底物浓度对ACE 抑制率和水解度的影响
Fig.6 Effect of substrate concentrations on ACE inhibition rate and degree of hydrolysis
2.3 响应面优化
2.3.1 响应面试验结果及分析 按Box-Behnken 原理进行响应面分析,试验结果见表3。
表3 响应面试验设计及结果
Table 3 Experimental design and results for response surface analysis
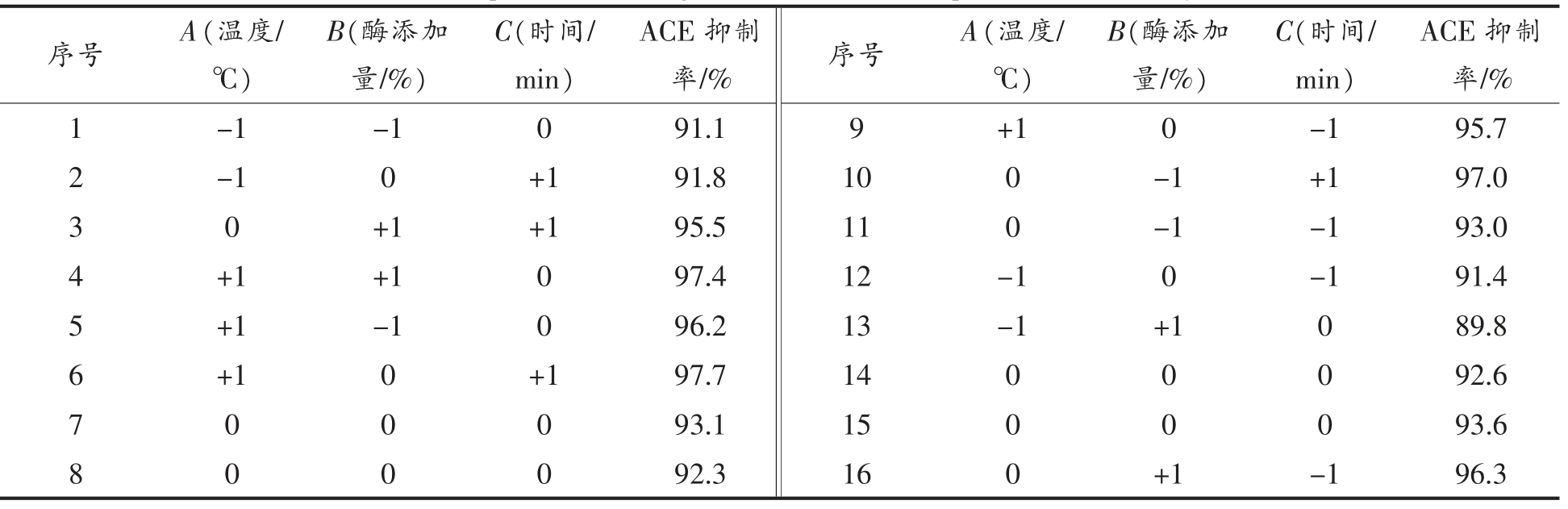
序号 A(温度/℃)ACE 抑制率/%1 -1 -1 0 91.1 9 +1 0 -1 95.7 2 -1 0 +1 91.8 10 0 -1 +1 97.0 3 0 +1 +1 95.5 11 0 -1 -1 93.0 4 +1 +1 0 97.4 12 -1 0 -1 91.4 5 +1 -1 0 96.2 13 -1 +1 0 89.8 6 +1 0 +1 97.7 14 0 0 0 92.6 7 0 0 0 93.1 15 0 0 0 93.6 8 0 0 0 92.3 16 0 +1 -1 96.3 B(酶添加量/%)C(时间/min)ACE 抑制率/% 序号 A(温度/℃)B(酶添加量/%)C(时间/min)
利用Design-Expert 软件获得的ACE 抑制率的二次回归模型为:Y=92.9+2.86A+0.21B+0.7C+0.63AB+0.4AC-1.2BC-0.29A2+1.01B2+1.54C2。
方差分析结果如表4所示。模型的回归系数R2=0.9756,说明方程对试验拟合度良好;R2Adj=0.9390,说明表明该模型能解释93.9%响应值变化。模型P=0.0004<0.001 极显著;失拟项P=0.408>0.05 不显著,表明模型拟合度很好,可用此模型预测酶解温度、酶添加量和酶解时间对酪蛋白水解物的ACE 抑制率影响。模型中一次项A 影响极显著,二次项C2 和交互项BC 影响高度显著,一次项C 和二次项B2 影响显著,根据F 值可知各因素对绵羊乳酪蛋白的影响顺序为酶解温度>酶解时间>酶添加量。
表4 回归模型方差分析
Table 4 Variance analysis of regression model
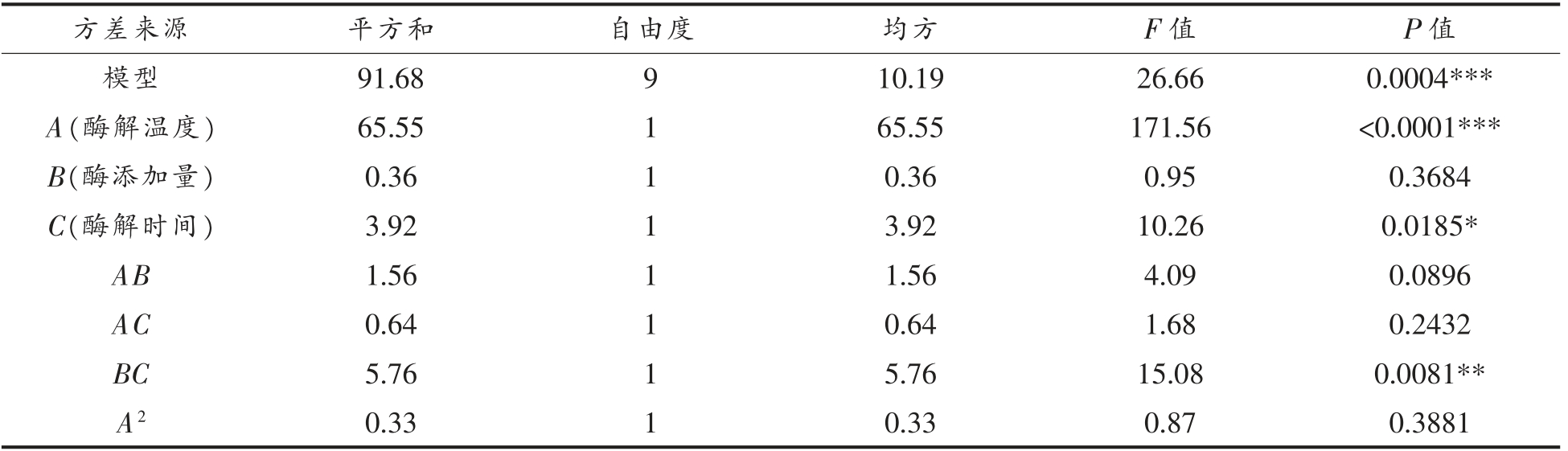
?
(续表4)

注:***.表示影响极显著(P<0.001);**.表示影响高度显著(P<0.01);*.表示影响显著(P<0.05)。R2=0.9756,R2Adj=0.9390。
方差来源 平方和 自由度 均方 F 值 P 值B2 C2残差4.10 1 4.10 10.73 0.0169*9.46 1 9.46 24.75 0.0025**2.29 6 0.38失拟 1.31 3 0.44 1.34 0.4080纯误差 0.98 3 0.33总和 93.97 15
2.3.2 最佳酶解绵羊乳酪蛋白工艺条件的确定及验证 碱性蛋白酶水解绵羊乳酪蛋白最佳工艺参数为pH 6、底物含量为8%、酶解温度55 ℃、酶添加量4%、酶解时间120 min。酪蛋白水解物的ACE 抑制率预测值为99.4%。在此条件下3 次验证试验测得平均值为99.1%,实际值与模型预测值吻合度为99.7%,表明此模型可以用于实际生产。
2.4 响应面优化后酪蛋白水解液的分子质量分布
使用响应面优化后的条件水解酪蛋白得到的水解液的分子质量分布如表5所示,与优化前90 min 相比,优化后的酪蛋白水解液的水解度增加,水解液中大于10 ku 和3~10 ku 的蛋白含量降低,小于1 ku 的多肽含量增加,特别是0.2≤-0.5 ku和0.1≤-0.2 ku 分子质量之间的肽段。在BIOPEP数据库中搜索降血压肽得到992 个肽段并对其相对分子质量进行分析,其中分子质量在0.1~0.2 ku 的肽段比例为2.2%,0.2~0.5 ku 肽段比例为43.9%,0.5~1 ku 肽段比例为41.9%,1~1.5 肽段比例为10.4%,1.5~2 肽段比例为1.6%,降血压肽的相对分子质量主要集中在0.2~1.5 ku。上述结果在一定程度上解释了优化后酪蛋白水解液的ACE抑制率升高的原因。
表5 酪蛋白水解液的分子质量分布
Table 5 The molecular weight distribution of casein hydrolysates
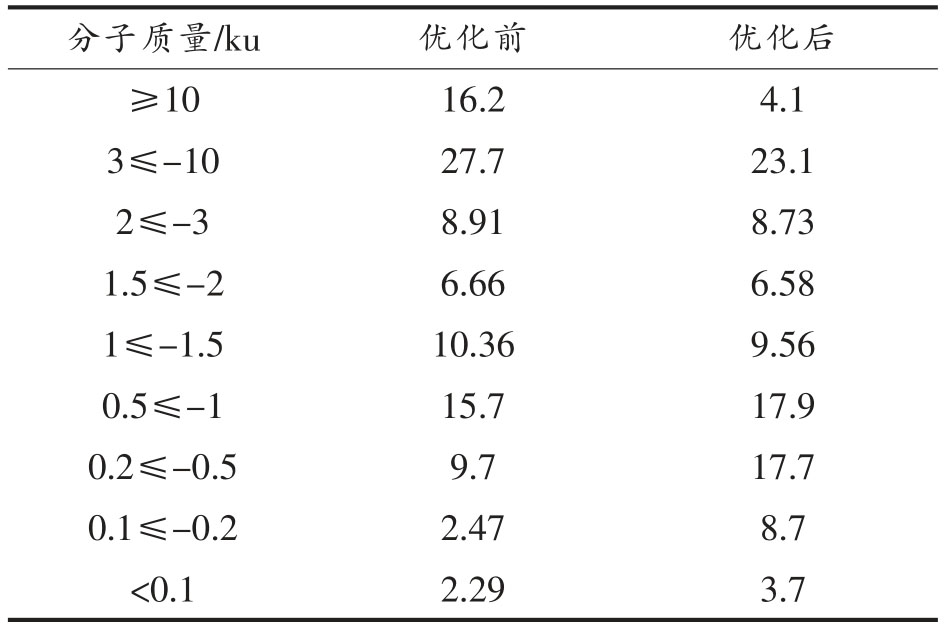
?
2.5 ACE 抑制肽鉴定结果
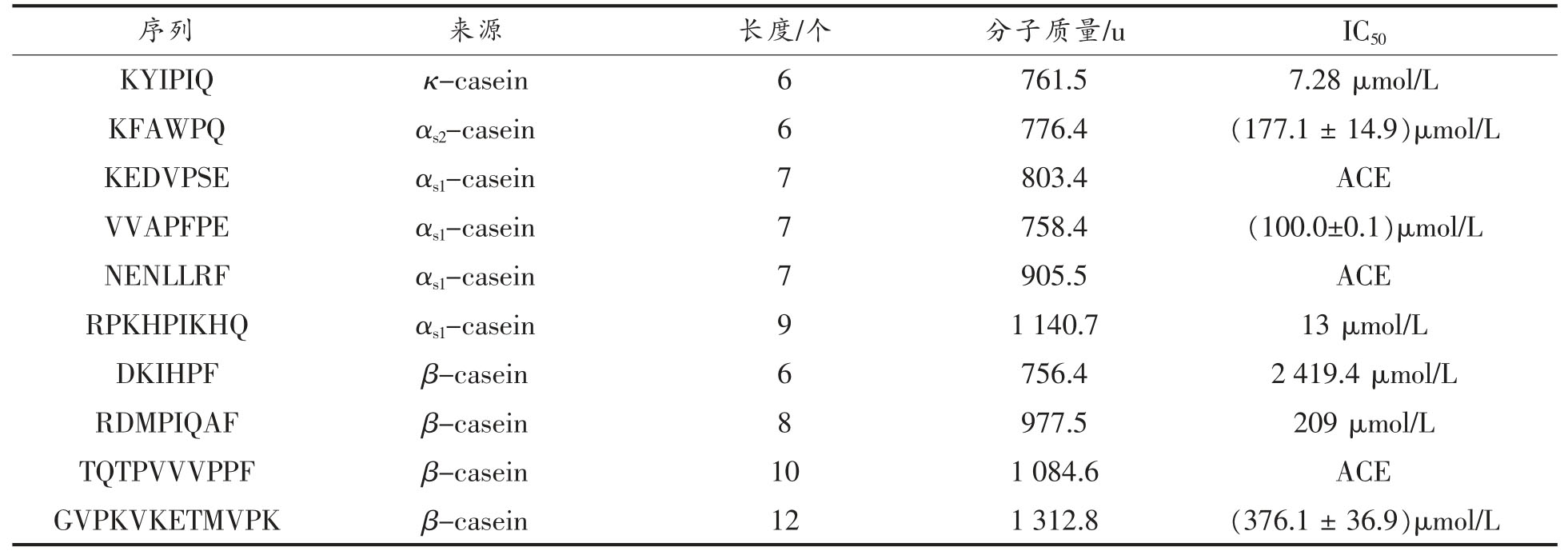
经质谱鉴定出来的结果与UniProt sheepcasin数据库中进行比对,共鉴定出484 条肽段,其中源自αs1-酪蛋白有165 条、源自αs2-酪蛋白有122条、源自β-酪蛋白165 条,源自κ-酪蛋白68 条,将鉴定出来的肽段在数据库中(BIOPEP、AHTPDB、SwePep、EROPMoscow 和PeptideDB)进行搜索比对,发现酪蛋白酶解液中已经验证具有ACE抑制活性的肽段10 条(表7),这也解释了酪蛋白酶解液高ACE 抑制率的原因。同时利用网站PeptideRanker(http://distilldeep.ucd.ie/PeptideRanker/)对肽段进行打分,选择评分大于0.80 的肽段为潜在的生物活性肽,同时选择ToxinPred(http://web.expasy.org/protparam/)网站进行毒性预测、网站Expasy-Compute 的pI/Mw(https://web.expasy.org/compute_pi/)预测肽段的分子质量及等电点,并结合已验证ACE 抑制肽的氨基酸序列结构,在鉴定结果中筛选出一条新的生物活性肽段LFRQFY。
表7 潜在的ACE 抑制肽
Table 7 The potential ACE inhibitory peptides
?
2.6 肽段合成与活性验证
将肽段LFRQFY 进行固相合成法合成,纯度都大于98%。对合成的肽段进行体外ACE 抑制活性验证,其IC50 值(7.9±1.7)μmol/L。这肽段氨基酸序列与封梅[15]的报道相一致:氨基酸序列C 末端含有酪氨酸,N-末端含有亮氨酸或碱性氨基酸,对该肽的ACE 抑制活性起到积极的影响。同时Soleymanzadeh 等[29]从驼奶β-酪蛋白分离得到的7肽MVPYPQR(IC50=30 μmol/L);Villadóniga 等[30]从α-乳白蛋白鉴定的两个ACE 抑制肽:TTFHTSGY(IC50=142 μmol/L) 和GYDTQAIVQ(IC50=1.0 mmol/L)。
表6 酪蛋白水解液中具有ACE 抑制活性的肽段
Table 6 Peptides with ACE inhibitory activity in casein hydrolysate
?
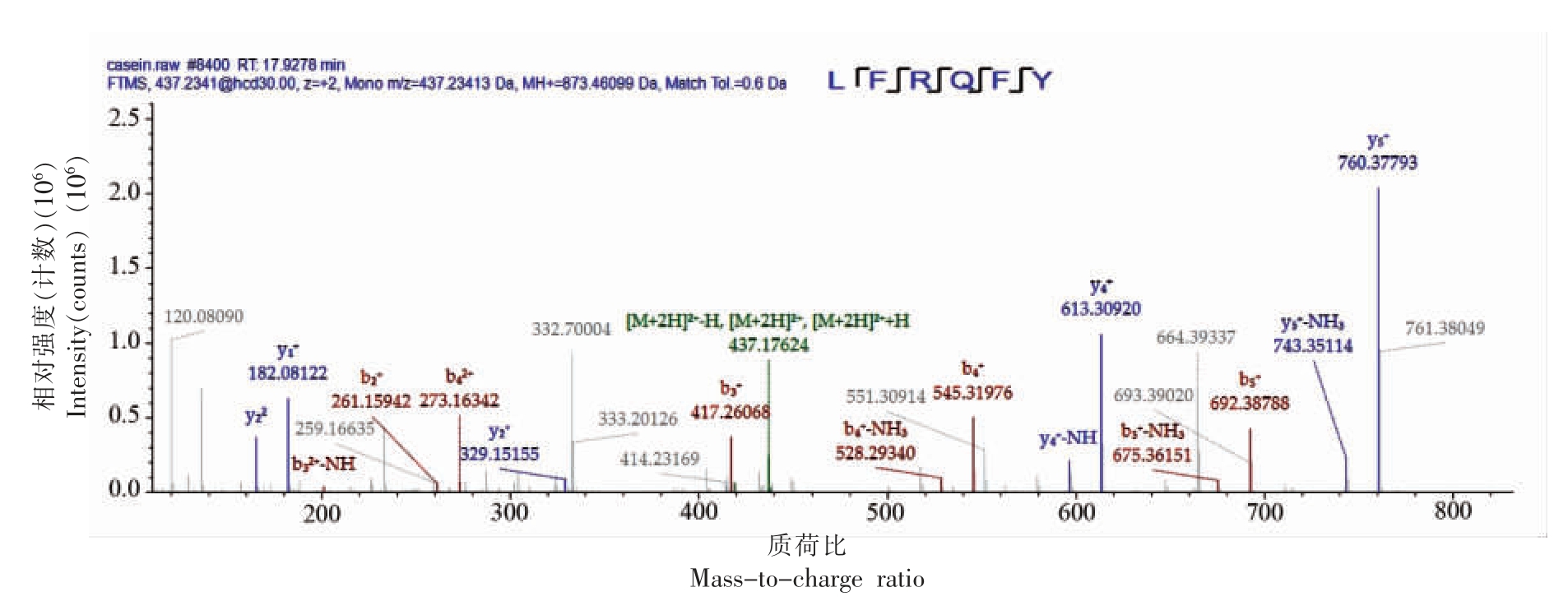
图7 LFRQFY 的二级质谱图
Fig.7 Secondary mass spectra of LFRQFY
2.7 LFRQFY 对ACE 的抑制模式分析
为了评价新的ACE 抑制肽的活性机制,通过使用Linewaver-Burk 图研究抑制肽LFRQFY 对ACE 的抑制模式。有研究表明Lineweaver-Burk 的双倒数作图,若随着抑制物浓度的增加,其Vmax 减小,Km 增大或减小,说明该抑制类型属于混合型抑制[31]。如图8所示,Vm 和Km 值都随着抑制肽浓度的增加而降低,表明抑制肽可以与酶的活性和非活性位点的位置结合,从而降低了血管紧张素转换酶的催化活性。相似的,Sangsawad 等[32]从熟鸡胸肉中分离得到的KPLL 和KP 以及Forghani等[33]从刺参中分离得到的EVSQGRP、VSRHFASYAN 和SAAVGSP 也显示出对ACE 的混合抑制模式。
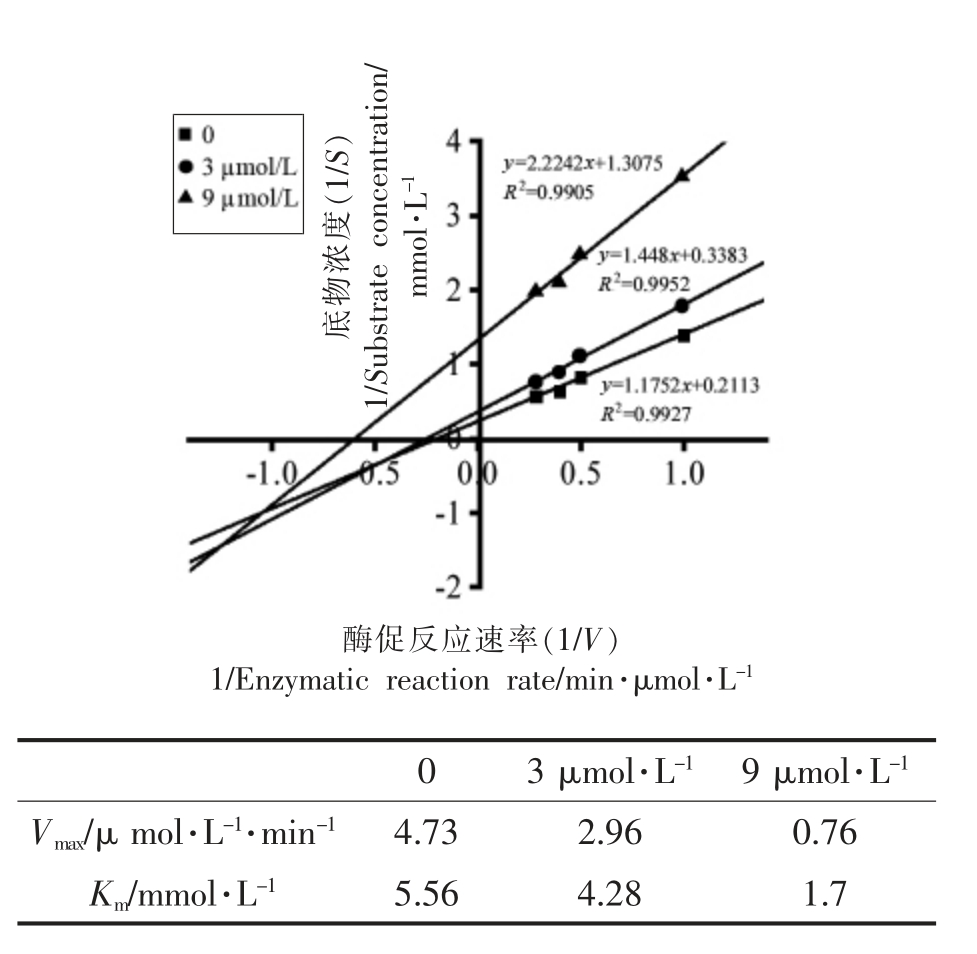
图8 肽段LFRQFY 对ACE 的Lineweaver-Burk 图
Fig.8 Lineweaver-Burk plot of ACE inhibition by the peptide LFRQFY
2.8 LFRQFY 与ACE 的分子对接分析

图9 ACE-LFRQFY 复合体的3D 结构图
Fig.9 3D structure diagram of ACE-LFRQFY
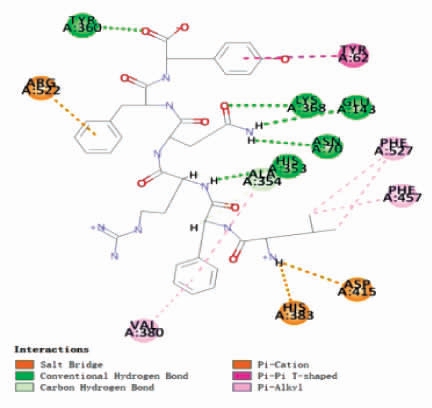
图11 ACE-LFRQFY 复合体的2D 结构图
Fig.11 2D structure diagram of ACE-LFRQFY
使用Discovery Studio 2019 软件将LFRQFY与ACE 进行半柔性对接,分析LFRQFY 与ACE的分子水平的相互作用机制。分子对接结果中的“-CDOCKER Energy”和“-CDOCKER Interaction Energy”值可以评价受体与配体亲和力,其相对值越高,表明肽段与ACE 结合越紧密[34]。ACELFRQFY 复合物的 “-CDOCKER Energy” 值和“-CDOCKER Interaction Energy” 值分别为114.404 和97.433,表明肽段LFRQFY 对ACE 具有很强的结合亲和力。图10和表8显示,肽段LFRQFY 与ACE 残 基Asp 415、Tyr360、His353、Glu143、Asn70、Ala354、Arg522 和His383 形 成8个氢键,研究表明氢键是维持ACE-LFRQFY 复合物稳定的主要作用力[35],与残基Phe457、Ala354、TYR62、Val380 形成的疏水相互作用也有助于LFRQFY-ACE 复合物的稳定性。其中与ACE 催化活性位点上氨基酸残基Ala354(活性口袋S1)形成氢键和疏水相互作用、His353(活性口袋S2)形成的2 个氢键,表明了LFRQFY 能够与ACE 催化位点S1 和S2 口袋紧密结合。Fan 等[36]从大黄鱼中鉴定出具有显著降血压作用的ACE 抑制肽WAR 和WQR 也与ACE 活性残基Ala354、His353形成氢键。因此,肽LFRQFY 是一种新型有效的酪蛋白源ACE 抑制肽。
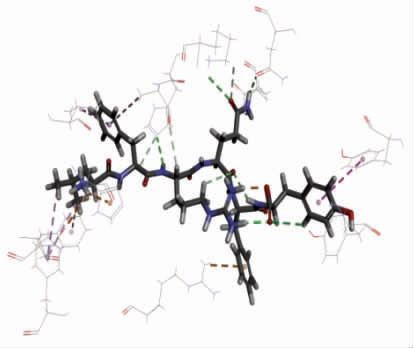
图10 ACE-LFRQFY 复合体的局部图
Fig.10 Partial graph of ACE-LFRQFY
表8 ACE-LFRQFY 复合物在最佳构象中观察到的氢键以及静电和疏水相互作用
Table 8 Hydrogen bonds and electrostatic and hydrophobic interactions observed in the best peptide poses based on the ACE-peptide complex

作用基团 键长(Å) 类型LFRQFY:H2-A:ASP415:OD1 3.29829 氢键;静电力LFRQFY:H60-LFRQFY:O124 1.9474 氢键;静电力A:TYR360:HH-LFRQFY:O123 2.82352 氢键A:LYS368:HZ1-LFRQFY:O77 2.9128 氢键LFRQFY:H43-A:HIS353:NE2 2.69281 氢键LFRQFY:H59-LFRQFY:O82 2.01062 氢键LFRQFY:H63-LFRQFY:O123 2.05461 氢键LFRQFY:H79-A:GLU143:OE1 2.87801 氢键LFRQFY:H80-A:ASN70:OD1 2.29365 氢键LFRQFY:H104-LFRQFY:O82 2.40614 氢键A:LYS368:HE1-LFRQFY:O77 2.84054 氢键LFRQFY:H25-A:HIS353:NE2 2.93048 氢键LFRQFY:H45-A:ALA354:O 2.97238 氢键LFRQFY:H53-LFRQFY:O82 2.88458 氢键A:ARG522:NH1-LFRQFY 3.49908 氢键;氢键LFRQFY:H2-A:HIS383 2.38482 氢键;静电力A:TYR62-LFRQFY 5.25144 疏水作用力A:PHE457-LFRQFY:C12 3.82468 疏水作用力A:PHE527-LFRQFY:C12 4.67027 疏水作用力A:PHE527-LFRQFY:C16 5.19319 疏水作用力LFRQFY-A:ALA354 5.24589 疏水作用力LFRQFY-A:VAL380 4.84468 疏水作用力
3 结论
通过蛋白酶筛选,单因素和响应面试验确定了绵羊乳酪蛋白ACE 抑制肽最佳水解条件,优化后的绵羊乳酪蛋白水解液ACE 抑制率达到99.1%,表现出极佳的降血压潜力。小于3 ku 组分经过质谱鉴定氨基酸序列,在质谱结果中发现了10 条已报道的具有ACE 抑制活性的肽段,这解释了酪蛋白酶解液高ACE 抑制率的原因。同时,发现了一条新颖的肽段LFRQFY,其IC50 值为(7.9±1.7) μmol/L,酶抑制动力学为混合抑制模式;分子对接结果表明,LFRQFY 能够与ACE 的氨基酸残基Ala354(活性口袋S1)、His353(活性口袋S2)形成氢键相互作用,而展现出显著的体外降血压活性。本研究建立了酶解法制备高ACE 抑制活性的绵羊乳酪蛋白肽工艺,为后续绵羊乳精深加工及高值化利用提供一定理论参考依据。
[1]DEOLIVEIRA M R,SILVA T J,BARROS E,et al.Anti-hypertensive peptides derived from caseins:Mechanism of physiological action,production bioprocesses,and challenges for food applications[J].Appl Biochem Biotechnol,2018,185(4):884-908.
[2]YANG H Y,ERDOS E G,LEVIN Y A.dipeptidyl carboxypeptidase that converts angiotensin I and inactivates bradykinin [J].Biochimica Et Biophysica Acta,1970,214(2):374-376.
[3]PUCHALSKA P,MARINA ALEGRE M L,GARCIA LOPEZ M C.Isolation and characterization of peptides with antihypertensive activity in foodstuffs[J].Crit Rev Food Sci Nutr,2015,55(4):521-551.
[4]DE OLIVEIRA T V,POLETO M D,DE OLIVEIRA M R,et al.Casein-derived peptides with antihypertensive potential:Production,identification and assessment of complex formation with an giotensin I-converting enzyme(ACE) through molecular docking studies[J].Food Biophysics,2020,15(2):162-172.
[5]LIN K,ZHANG L W,HAN X,et al.Yak milk casein as potential precursor of angiotensin I-converting enzyme inhibitory peptides based on in silico proteolysis[J].Food Chemistry,2018,254(1):340-347.
[6]GAMMOH S,ALU'DATT M H,TRANCHANT C C,et al.Modification of the functactobacillus delbruional and bioactive properties of camel milk casein and whey proteins by ultrasonication and fermentation with Leckii subsp.lactis[J].LWT,2020,129:109501.
[7]ESPEJO-CARPIO F J,DE GOBBA C,GUADIX A,et al.Angiotensin I-converting enzyme inhibitory activity of enzymatic hydrolysates of goat milk protein fractions[J].International Dairy Journal,2013,32(2):175-183.
[8]PARK Y W,JUÁREZ M,RAMOS M,et al.Physico-chemical characteristics of goat and sheep milk[J].Small Ruminant Research,2007,68(1/2):88-113.
[9]王海燕,葛武鹏,马筱怡,等.绵羊乳脂肪酸组成分析与评价[J].食品科学,2018,39(4):14-15.
WANG H Y,GE W P,MA X Y,et al.Analysis and evaluation of fatty acid composition of sheep milk[J].Food Science,2018,39(4):14-15.
[10]DORE M A R,OSATO M,REALDI G,et al.He licobacter pylori in sheep milk(letter)[J].The Lancet,1999,354(9173):132.
[11]RETTEDAL E A,ALTERMANN E,ROY N C,et al.The effects of unfermented and fermented cow and sheep milk on the gut microbiota[J].Frontiers in Microbiology,2019,10(458):1-12.
[12]TAGLIAZUCCHI D,MARTINI S,SHAMSIA S,et al.Biological activities and peptidomic profile of in vitro-digested cow,camel,goat and sheep milk[J].International Dairy Journal,2018,81(1):19-27.
[13]HERNANDEZ-LEDESMA B,RECIO I,RAMOS M,et al.Preparation of ovine and caprine beta-lactoglobulin hydrolysates with ACE-inhibitory activity.Identification of active peptides from caprine betalactoglobulin hydrolysed with thermolysin[J].International Dairy Journal,2002,12(10):805-812.
[14]GÓMEZ-GUILLÉN M C,GIMÉNEZ B,LÓPEZCABALLERO M E,et al.Functional and bioactive properties of collagen and gelatin from alternative sources:A review[J].Food Hydrocolloids,2011,25(8):1813-1827.
[15]封梅,王慧溪,汪芳安.酶解蛋白质制备降血压肽的研究进展[J].武汉工业学院学报,2007(3):25-27,38.
FENG M,WANG H X,WANG F A,et al.Antihypertensive peptides derived from food proteins by enzymatic hydrolysis and its research advances[J].Journal of Wuhan Polytechnic University,2007(3):25-27,38.
[16]FAN H,WANG J,LIAO W,et al.Identification and characterization of gastrointestinal-resistant angiotensin-converting enzyme inhibitory peptides from egg white proteins[J].Journal of Agricultural and Food Chemistry,2019,67(25):7147-7156.
[17]NIELSEN P M,PETERSEN D,DAMBMANN C.Improved method for determining food protein degree of hydrolysis[J].Journal of Food Science,2001,66(5):642-646.
[18]任娇艳,李宇娟,张婷,等.鲣鱼蛋白肽谱效关系研究[J].中国食品学报,2020,20(3):271-280.
REN J Y,LI Y J,ZHANG T,et al.Studies on the correction of spectrum and activities of protein hydrolysates of bonito[J].Journal of Chinese Institute of Food Science and Technology,2020,20(3):271-280.
[19]刘静波,王子秦,于一丁,等.豆粕血管紧张素转化酶抑制肽的结构鉴定及作用机制解析[J].食品科学,2021,42(12):123-129.
LIU J B,WANG Z Q,YU Y D,et al.Identification and mechanism analysis of angiotensin-I converting enzyme inhibitory peptides from soybean meal[J].Food Science,2021,42(12):123-129.
[20]BHASKAR B,ANANTHANARAYAN L,JAMDAR S.Purification,identification,and characterization of novel angiotensin I-converting enzyme(ACE) inhibitory peptides from alcalase digested horse gram flour[J].Food Science and Technology,2019,103(1):105-161.
[21]FU Y,ALASHI A M,YOUNG J F,et al.Enzyme inhibition kinetics and molecular interactions of patatin peptides with angiotensin I-converting enzyme and renin[J].International Journal of Biological Macromolecules,2017,101(1):207-213.
[22]李文斐,张磊,宋宇轩,等.绵羊,山羊和牛乳的营养成分比较分析[J].食品工业科技,2020,41(24):294-299.
LI W F,ZHANG L,SONG Y X,et al.Comparative analysis of nutrients in sheep,goat and cow milk[J].Science and Technology of Food Industry,2020,41(24):294-299.
[23]UGWU C P,ABARSHI M M,MADA S B,et al.Camel and horse milk casein hydrolysates exhibit angiotensin converting enzyme inhibitory and antioxidative effects in vitro and in silico[J].International Journal of Peptide Research and Therapeutics,2019,25(4):1595-1604.
[24]XU W,KONG B H,ZHAO X H.Optimization of some conditions of Neutrase-catalyzed plastein reaction to mediate ACE-inhibitory activity in vitro of casein hydrolysate prepared by Neutrase[J].J Food Sci Technol,2014,51(2):276-284.
[25]KIM S K,BYUN H G,PARK P J,et al.Angiotensin I converting enzyme inhibitory peptides purified from bovine skin gelatin hydrolysate[J].Journal of Agricultural and Food Chemistry,2001,49(6):2992-2997.
[26]邱娟,沈建东,翁凌,等.利用牡蛎制备ACE 抑制肽的工艺优化[J].食品科学,2017,38(16):165-172.
QIU J,SHEN J D,WENG L,et al.Optimization of preparation of angiotensin-Ⅰ converting enzyme(ACE) inhibitory peptides derived from pacific oyster(Crassostrea gigas)[J].Food Science,2017,38(16):165-172.
[27]吕小京,操德群,徐年军.响应面试验优化酶解法制备海洋微藻微拟球藻抗氧化肽工艺[J].食品科学,2018,39(6):183-188.
LÜ X J,CAO D Q,XU N J.Optimization of enzymatic preparation of antioxidant peptides from protein hydrolysate of the marine microalgae nannochloropsis by response surface methodolog[J].Food Science,2018,39(6):183-188.
[28]GUO Y X,PAN D D,TANOKURA M.Optimisation of hydrolysis conditions for the production of the angiotensin-1 converting enzyme(ACE) inhibitory peptides from whey protein using response surface methodology[J].Food Chemistry,2009,114(1):328-333.
[29]SOLEYMANZADEH N,MIRDAMADI S,MIRZAEI M,et al.Novel β-casein derived antioxidant and ACE-inhibitory active peptide from camel milk fermented by Leuconostoc lactis PTCC1899:Identification and molecular docking[J].International Dairy Journal,2019,97(1):201-208.
[30]VILLADONIGA C,CANTERA A M B.New ACEinhibitory peptides derived from alpha-lactalbumin produced by hydrolysis with Bromelia antiacantha peptidases[J].Biocatalysis and Agricultural Biotechnology,2019,20(c):101258-101258.
[31]杨荣武.生物化学原理[M].北京:高等教育出版社,2012:132-149.
YANG R W.Principles of biochemistry[M].Beijing:Higher Education Press,2012:132-149.
[32]SANGSAWAD P,CHOOWONGKOMON K,DAVID D,et al.Transepithelial transport and structural changes of chicken angiotensin I-converting enzyme(ACE) inhibitory peptides through Caco -2 cell monolayers[J].Journal of Functional Foods,2018,45(1):401-408.
[33]FORGHANI B,ZAREI M,EBRAHIMPOUR A,et al.Purification and characterization of angiotensin converting enzyme-inhibitory peptides derived from Stichopus horrens:Stability study against the ACE and inhibition kinetics [J].Journal of Functional Foods,2016,20(1):276-290.
[34]于志鹏,樊玥,赵文竹,等.鸡蛋蛋白ACE 抑制肽的筛选、鉴定及其作用机制[J].食品科学,2020,41(12):129-135.
YU Z P,FAN Y,ZHAO W Z,et al.Identification and mechanism of action of angiotensin-I converting enzyme inhibitory peptides from hen egg proteins[J].Food Science,2020,41(12):129-135.
[35]YU Z,FAN Y,ZHAO W,et al.Novel angiotensin-converting enzyme inhibitory peptides derived from oncorhynchus mykiss nebulin:Virtual screening and in silico molecular docking study[J].Journal of Food Science,2018,83(9):2375-2383.
[36]FAN Y,YU Z,ZHAO W,et al.Identification and molecular mechanism of angiotensin-converting enzyme inhibitory peptides from Larimichthys crocea titin [J].Food Science and Human Wellness,2020,9(3):257-263.