黄曲霉毒素是由黄曲霉、寄生曲霉等真菌产生的一种次级代谢产物,稳定性强,能长期自然存放,具有较强的致癌性和致畸性,被列为I 型致癌物[1-2]。其中黄曲霉毒素B1(Aflatoxin B1,AFB1)是毒性最大的黄曲霉毒素,其毒性高于氰化钾及砒霜[3]。AFB1 会通过被污染的谷物、粮食、中药等进入人体,产生致癌、致畸的危害[4]。文献报道,我国花生油存在AFB1 的风险最大[5]。有学者对AFB1 检出率进行统计得出AFB1 的超标率较低而检出率很高[6]。在2020年全国各省市场监督管理局公示数据中,AFB1 主要出现在食用油、油脂及其制品、散装花生油、花生米、豆瓣、花生酱等食品中。这些食品尤其食用油是日常生活的必需品,若长期食用含有AFB1 的食用油,经过累积效应不断在体内富集,在一定程度上会损害肝脏健康[7-8]。目前一些学者尝试通过生物脱毒法从根源上将AFB1 除去,虽然在去除效果上取得一定的进展,但是该方法不能被大规模利用,且脱毒后的食物能否食用还需进一步探究[9-10]。
目前检测AFB1 的方法较多,主要有高效液相色谱法、液相色谱-质谱法、分子印迹法、电化学法、电子鼻法、拉曼光谱法和金标免疫层析法等[11-18]。其中,较为精确的方法为高效液相色谱法(high performance liquid chromatography,HPLC)和液相色谱-质谱法,这两种方法对操作人员要求较高,且检测周期长、程序繁琐、成本较高[12]。检测方便、可定量,适用于市场监管部门质量监督和民用的有电子鼻法[15-16]和胶体金免疫层析法[17-18]。其中,电子鼻法是借用化学传感器对真菌生长或代谢过程中产生的挥发性产物进行识别定量,其设备成本较高,检测限尚未得到充分的研究和确定,且相关AFB1 检测的报道较少。胶体金免疫层析法是利用纳米金作为标记物的一种快速测定方法,该技术比较成熟,具有测定结果可直接读取、检测时间短、特异性强、灵敏度高、普适性强等优点[19],然而当检测样品浓度低于检测限时,测定结果则无法反映其实际含量。此外,当需要短时间进行数万样品定量测定时,传统方法较难实现。鉴于此,建立普适、便携、价格低廉、安全的AFB1 快速定量方法具有重要的现实意义。
随着现代信息技术的快速发展,图像信息识别技术得到较为广阔的发展空间,而扫描仪是高效获取图像信息的一种方法。扫描仪的核心部件感光器件为电荷耦合器件(charge coupled device,CCD),通常以百万像素为单位,获取信息量大,能处理相对复杂的图像,数据在传输过程中不存在失真[20]。而图像颜色信息可以用多种色彩模型的空间坐标来表示,这种坐标系统所能定义的色彩范围即颜色空间,它是采用数学方法形象表示颜色,使颜色更加直观,同时,用人们理解的方式对颜色进行说明且具有统一的标准[21-24]。通过CCD 采集图像信息,结合颜色空间建模,使得图像信息的数字化成为可能。近些年,研究人员利用CCD 和颜色空间进行图像信息采集与处理,在检测技术、遥感图像等方面均有进展。例如Zheng 等[25]运用该方法对复杂化学体系进行数字编码,从而为复杂化学体系的检测提供了新的解决途径。本研究利用胶体金免疫层析技术的优势,将AFB1 测定结果以胶体金检测卡形式进行可视化呈现,通过CCD 技术进行图像信息采集,建立基于CCD的AFB1 测定模型——AFB1 快速定量模型(Rapid quantitative method for the determination of AFB1,RqM-AFB1),为AFB1 的快速定量提供一种新的解决方案,同时在流程规范化方面具有一定的参考价值。
1 材料与方法
1.1 材料与试剂
诊断试剂用膜(YNHS-120B)、金标垫(RB45)、PVC 板(SM31-25),上海金标生物;CLOVER 免疫亲和柱。
氯金酸(HAuCL4·3H2O),Sigma-Aldrich 公司;黄曲霉毒素B1 标准品(CAS:1162-65-8;2.0 μg/mL),北京标准物质研究中心;AFB1 抗体、AFB1偶联抗原(AFB1-BSA),北京辉奥生物技术有限公司;三羟甲基氨基甲烷(≥99.5%),Sigma-Aldrich公司;海藻糖(生物试剂),西亚试剂;碳酸钠(分析纯),泸试;牛血清白蛋白(BSA),Sigma-Aldrich 公司;S17(化学纯),泸试;Tween-20(化学纯),泸试;曲拉通X-100(化学纯),泸试;十水合四硼酸钠(分析纯),泸试;三水合柠檬酸三钠(分析纯),泸试;盐酸(优级纯),科密欧;甲醇(色谱纯),Merck;聚乙烯吡咯烷酮K-30(优级纯),沃凯;蔗糖(分析纯),泸试;无水磷酸二氢钠(分析纯),泸试;氯化钠(分析纯),泸试;无水磷酸氢二钠(分析纯),泸试。
1.2 仪器与设备
紫外分光光度计(TUV759),上海佑科;高速冷冻离心机(TGL-16M),上海卢湘仪;真空干燥箱(DZF-6050),上海一恒;感应喷金仪(HM3260),上海金标生物;数控感应斩切机(ZQ4200),上海金标生物;压壳机(YK725),上海金标生物;扫描仪(V370),精工爱普生株式会社印度尼西亚分公司;高效液相色谱仪(2695 具荧光检测器,柱后光化学衍生装置),美国Waters 公司。
1.3 方法
1.3.1 胶体金制备 采用柠檬酸三钠还原氯金酸(HAuCL4)法来制备直径40 nm 的胶体金粒子。取99 mL 超纯水及1 mL 1%氯金酸(0.22 μm 滤膜过滤),加热沸腾后一次性快速加入3 mL 1%柠檬酸钠(0.22 μm 滤膜过滤),开始计时。由于胶体金溶液继续保持沸腾时间较长,体系易在沸腾状态下不稳定,易发生聚沉现象,因此,3 min 后将磁力搅拌器温度调至95 ℃。在均匀搅拌(200 r/min)过程中使整个反应时间控制在15 min,溶液颜色为浅黄色-紫灰色-酒红色。静置冷却至室温后用超纯水补充至原体积。最后,将制备成酒红色的胶体金溶液,经0.22 μm 滤膜过滤后用棕色玻璃试剂瓶4 ℃保存。
1.3.2 胶体金紫外扫描 将制备好的胶体金用紫外分光光度计测量其最大吸收波长。
1.3.3 AFB1 标准溶液的配制 用甲醇将AFB1 溶解配制成1.0 μg/mL 的标准储备液,临用前用甲醇稀释液逐级稀释至所需浓度,4 ℃保存备用。
1.3.4 K2CO3 加入量筛选 pH 值是胶体金标记物制备的关键,通过分别加入不同量的(0,1,2,3,4,8,16 μL/mL)0.2 mol/L K2CO3,以不变色的最低K2CO3 加入量确定为最适加入量。其中,抗体固定加入量为2 μL/mL。
1.3.5 金标记量的筛选 取制备的胶体金溶液并加入3 μL/mL 0.2 mol/L K2CO3,搅拌5 min 后加入2 μL/mL 标记的抗体,搅拌15 min,按1/10 体积逐滴加入10% BSA,搅拌封闭30 min,用冷冻离心机13 000 r/min,4 ℃离心20 min,弃去上清液后加入原体积1/10 复溶液(0.01 mol/L Tris8.0+1% BSA+3% 海藻糖)重悬金标抗体。采用感应喷金仪,将不同量(1,2,3 μL/cm)的金标抗体喷在金标垫上(37 ℃,1.5 h 烘干),此外,NC 膜上T 线和C 线浓度均为确定值(T 线质量浓度为0.05 mg/mL;C 线质量浓度为0.8 mg/mL)[17]。
1.3.6 试纸条的组装 检测卡主要组成部分,包括样品垫,喷金垫,NC 膜,吸收垫、PVC 板等。通过使用竞争免疫试验对AFB1 进行检测。用切割机将贴好的板切割成3.5 mm 宽的条,放入带干燥剂的铝箔袋中密闭储存。
1.3.7 稳定性试验 将制备好的装有干燥剂的试纸条放在37 ℃、相对湿度23%的条件下分别保存7 d 和14 d。取空白花生油样品2 份,分别加入AFB1 标准溶液,使样品中AFB1 的含量为0 μg/kg和20 μg/kg,随机取不同环境下保存的试纸条,进行样本检测。
1.3.8 回收率试验 取30 份花生油空白样品加入AFB1 标准溶液,使花生油中AFB1 的含量分别为2.5,5,10,20,30 μg/kg,其中每个浓度进行6 组平行试验。
1.3.9 AFB1 信息识别与定量表达方法的构建 本研究以AFB1 胶体金检测卡为载体,将AFB1 检测信息通过胶体金检测技术进行可视化呈现;采用CCD 记录检测信息,利用颜色空间进行数学建模并将可视化信息进行数字化提取。通过建立基于CCD 的AFB1 智能测定模型(RqM-AFB1)将获取的AFB1 的含量信息进行识别与表达。如图1所示,当测定样品C 线不显示信息时,系统自动识别并退出;若CT 线显示正常,系统对CT 线显色信息进行智能提取与标准化处理,将处理后的信息以数字化形式再一次传送到RqM-AFB1 系统,通过该模型的建立可以对AFB1 含量信息进行识别分析,这一模型是AFB1 定量信息最为直接的表达。

图1 AFB1 定量检测方法构建
Fig.1 A quantitative recognition strategy of AFB1
1.3.10 方法验证试验 为验证构建方法的可行性,本研究设计了验证试验。验证试验分两部分构成:1 RqM-AFB1 智能读取结果与人工计算(30 组平行)得出的结果进行对比;2 RqM-AFB1 智能读取结果与HPLC 试验结果对比。其中HPLC 试验如下:称取混匀样品5 g,分4 个梯度加入标准溶液,再加入1 g 氯化钠和25 mL 甲醇水溶液,混匀后振荡30 min,经离心机7 500 r/min 离心5 min,取5 mL 上清液,加10 mL 水混匀,过柱,待液体过完,用20 mL 水清洗,最后用1 mL 甲醇洗脱,洗脱液待测。试验测定花生油样品AFB1 的含量为2.5,5,10,20 μg/kg。
2 结果与分析
2.1 胶体金质量分析
为确保制备的胶体金具有较好的稳定性,本研究做了3 组平行,并用紫外可见光分光光度计对胶体金在可见光范围(490~600 nm)进行测定。如图2显示:整体波峰比较突出且峰宽比较窄,说明制备的胶体金颗粒具有较好的均一性和分散性。3 组试验胶体金的波峰宽度整体趋势基本一致,最大吸光度值在1.117~1.118 之间,最大吸收波长均在520~521 nm 之间。得出制备的胶体金符合在40 nm 的范围内,且具有较好的稳定性。
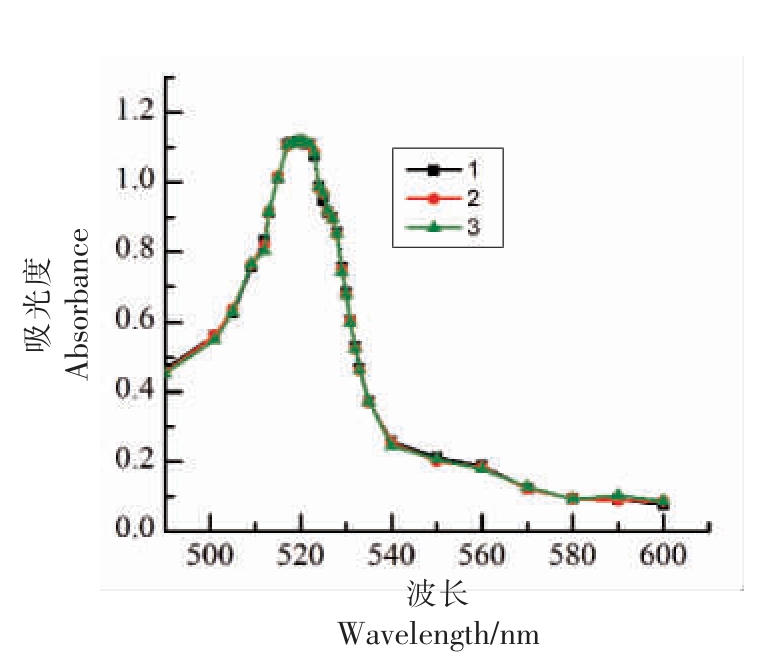
图2 胶体金紫外可见分光光度计测定结果图
Fig.2 Determination of colloidal gold by spectrophotometry
2.2 K2CO3 加入量筛选结果与分析
如图3所示为不同K2CO3 加入量对金标记物的活性影响,随着K2CO3 加入量的增多,颜色由酒红色逐渐变为紫灰色,最后变为灰色;金标记物随着活性减弱颜色逐渐加深。由颜色可看出,当K2CO3 加入量为3 μL/mL,其颜色为酒红色,通过测定pH 值为8.2,该pH 值与结合垫的酸碱度一致,因此本试验所选取的K2CO3 加入量为3 μL/mL。

图3 K2CO3 最适加入量筛选
Fig.3 The screening of K2CO3 optimal addition quantity
2.3 最适喷金量筛选结果
将制备好的试纸条加入空白样本,观察T、C线显色情况,可以看出喷金量为3 μL/cm,(T,C)=(0.05,0.8 mg/mL)时,检测卡显色最好(图4),其C线和T 线均显色均匀,同时做阳性样本检测,20 μg/kg 时,阳性明显。

图4 胶体金检测卡制备条件筛选
Fig.4 Optimum conditions for the preparation about test card
2.4 稳定性试验结果
将制备的试纸条置于37 ℃的条件下分别保存7 d(图5a)和14 d(图5b),并进行阳性和阴性样品检测,结果显示试纸条均有效,但保存14 d后的试纸条阴性样本显色亮度变弱。

图5 稳定性试验结果对比图
Fig.5 Comparison diagram of stability test results
2.5 AFB1 回收率与精密度试验
AFB1 的回收率,如表1所示。AFB1 的浓度越小,回收率越低,当质量浓度为2.5 μg/kg 时,其平均回收率为90.26%;当质量浓度为30 μg/kg 时,其平均回收率可达到94.89%。经计算得出:AFB1的整体平均回收率为92.33%左右,最大标准差为1.12%。因此,本试验所采用的提取方法对AFB1 检测结果的准确度影响较小。
表1 胶体金检测卡测定花生油中AFB1 的加标回收率
Table 1 Recovery analysis of AFB1 from peanut oil by colloidal gold detection card

?
2.6 AFB1 胶体金检测卡检测结果与CT 线颜色的线性关系表达
AFB1 检测卡和阳性样本之间的显色反应与样本浓度大小呈负相关关系(T 线颜色越浅,阳性样本浓度越大),当加入少量的阳性样本时,细微的颜色变化肉眼很难直接辨别。因此,本研究中将图像信息进行了数字化处理,以便将反应结果的差异性放大后再进行分析研究。所有反应结果的图像通过软件标准化处理后,提取出反应区域图像的RGB 值,通过颜色空间的计算公式[26],对显色图像进行数字化处理并将试验数据进行计算分析(表2)。从图表中得出,浓度与颜色距离具有线性相关性,浓度越大,距离越远。基于该方法,本研究进行了30 组重复试验,并对其取平均值,绘制标准曲线。
表2 AFB1 胶体金检测卡TC 线上的RGB 值与浓度之间的关系
Table 2 Relationship between RGB and concentration on AFB1
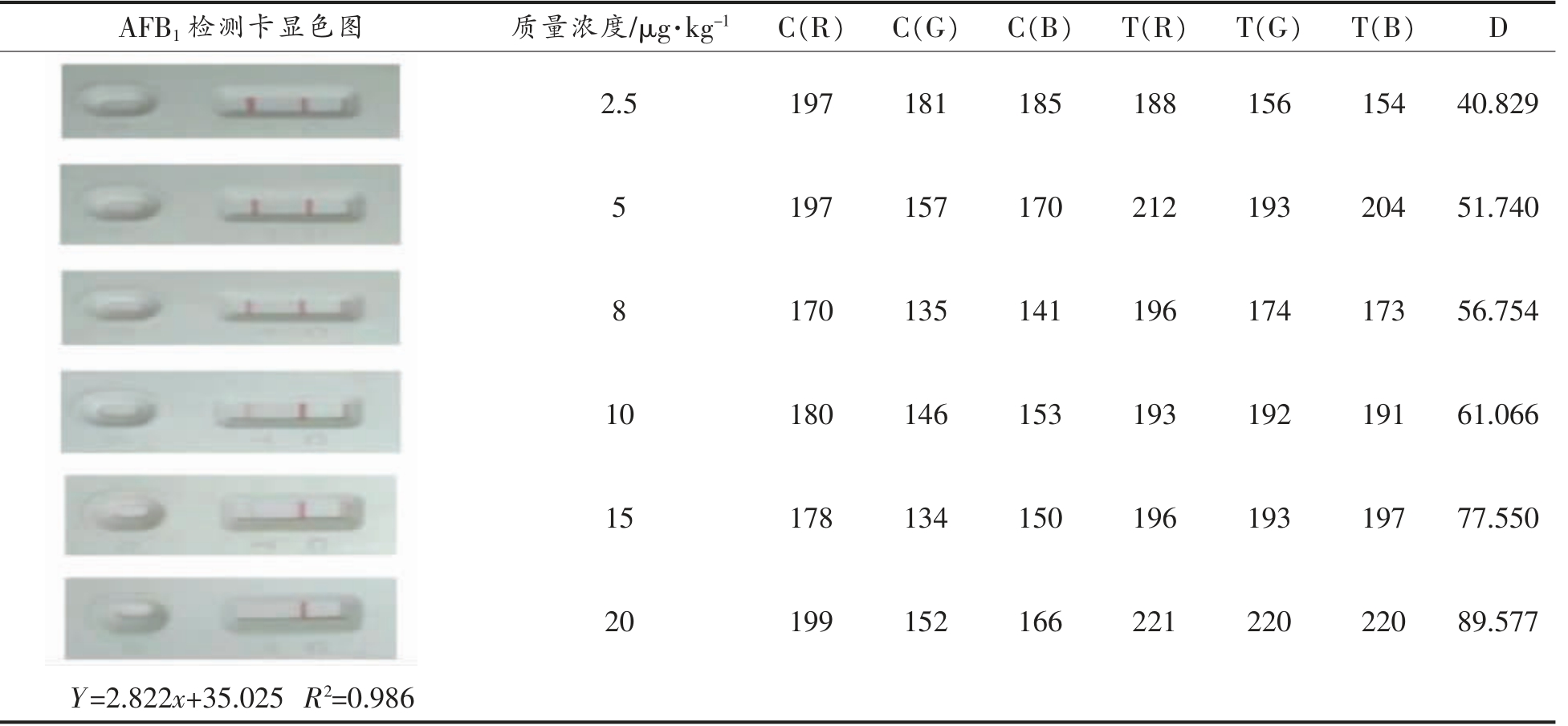
AFB1 检测卡显色图 质量浓度/μg·kg-1 C(R) C(G) C(B) T(R) T(G) T(B) D 2.5 197 181 185 188 156 154 40.829 5 197 157 170 212 193 204 51.740 8 170 135 141 196 174 173 56.754 10 180 146 153 193 192 191 61.066 15 178 134 150 196 193 197 77.550 20 199 152 166 221 220 220 89.577 Y=2.822x+35.025 R2=0.986
式中:D——距离;C——质控线;T——检测线。
2.7 图像信息读取精确度分析
为验证结果的精确性,确保构建方法的可重复性。研究选取不同浓度平行试验,通过进行误差分析,继而判断结果的精确程度。随机选取3 组不同含量(高20 μg/kg)、中10 μg/kg、低5 μg/kg)AFB1 样品的检测卡进行两平行试验,计算平行样反应区图片上每个对应点之间的相对标准偏差,并对计算结果进行统计,绘制图片上不同相对标准偏差值下的像素数累积趋势线。如图6所示,质量浓度为20 μg/kg 的平行样之间的相对标准偏差小于2.7%的点占97%;质量浓度为10 μg/kg 的平行样之间的相对标准偏差小于3.6%的点为90%;质量浓度为5 μg/kg 的平行样之间的相对标准偏差小于4%的点达到96%以上,说明图像信息读取结果具有较高的精确度。
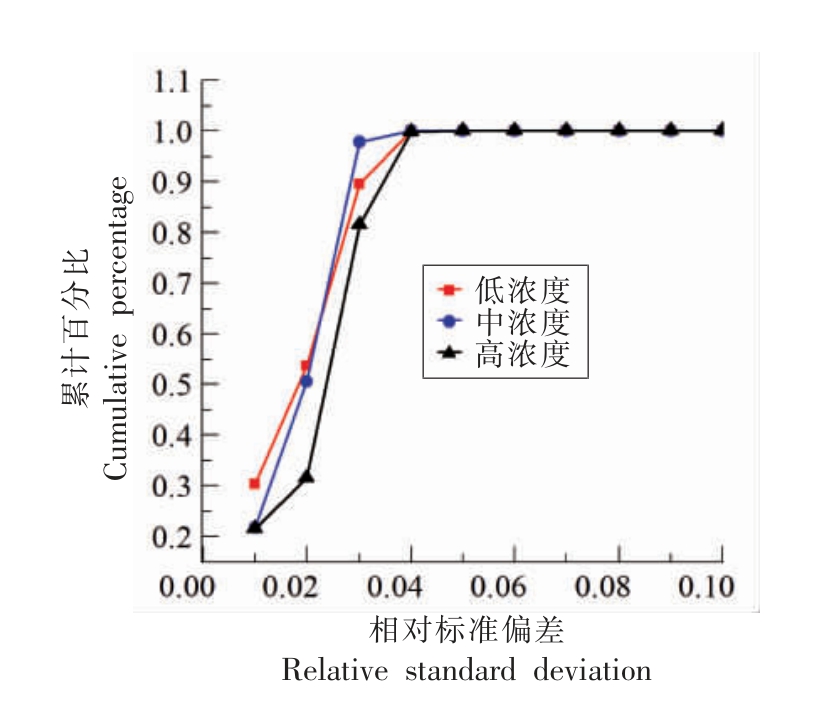
图6 重复样相对标准偏差累计百分数
Fig.6 Error analyze of three different parallel samples
2.8 RqM-AFB1 可行性分析
本研究利用CCD 采集AFB1 检测结果的显色信息,将AFB1 定量检测信息进行输出与呈现,并与人工试验(30 组平行)进行对比,结果如图7a 所示。其中,RqM-AFB1 得出的线性公式为:y=3.130x+31.746,R2=0.985;人工试验得出的线性公式为:y=2.822x+35.025,R2=0.986。通过对比分析,两条线性公式的拟合度较高,在X=2.5μg/kg 时误差最大,经计算得出其最大误差为5.93%,说明该方法在一定范围内可行性较强。此外,本研究将RqM-AFB1 的测定结果与HPLC 试验结果进行对比分析,如图7b 所示:RqM-AFB1 测定的结果与HPLC 试验无显著性差异(P>0.05),且它们之间的相对误差在10%以内。因此,通过RqM-AFB1 与HPLC 试验结果的对比,验证了的RqM-AFB1 可行性与有效性。
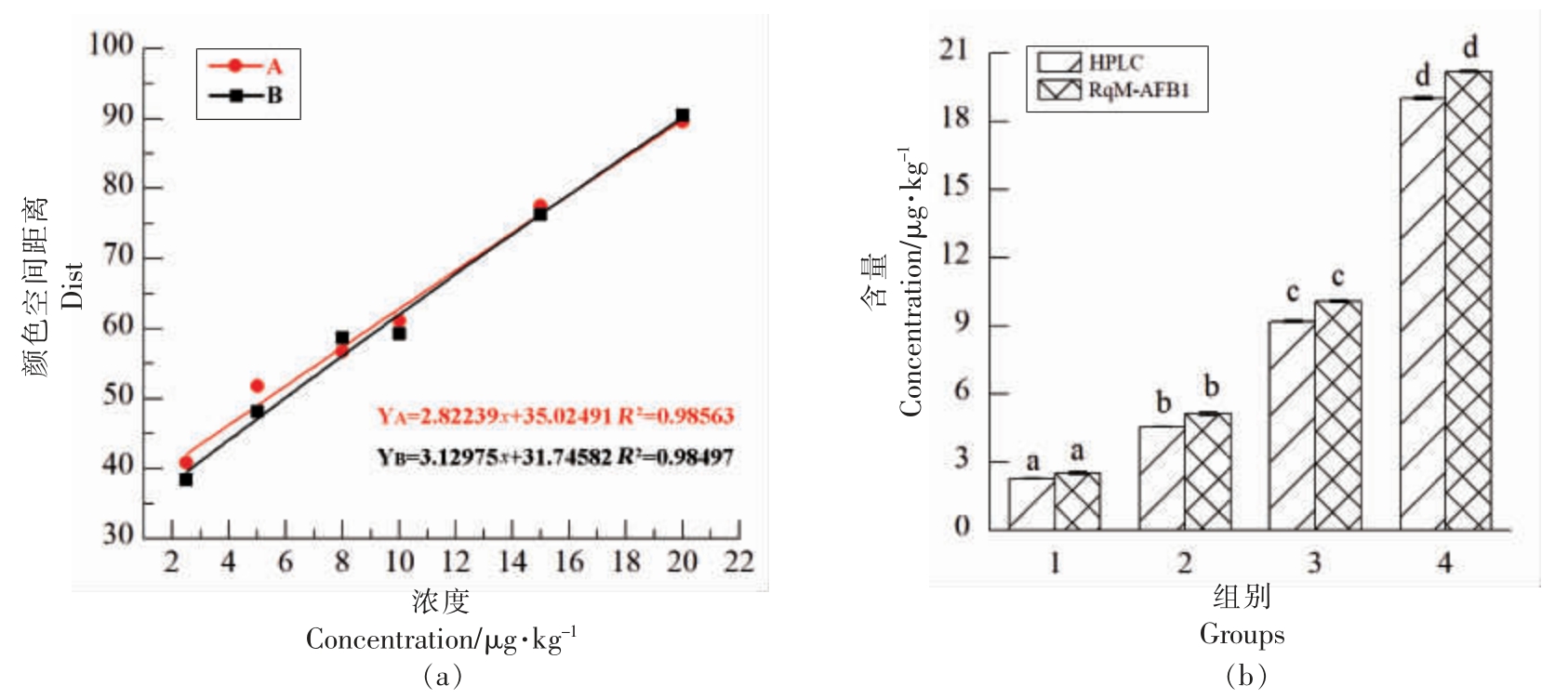
图7 AFB1 快速定量方法可行性分析
Fig.7 The feasibility analysis of RqM-AFB1
注:(a)A 是人工试验建立的线性标准曲线;B 是本研究模型智能读出的线性趋势线;(b) 同一浓度相同字母表示RqMAFB1 与HPLC 试验测定值之间无显著性差异(P>0.05)。
3 结论与展望
本研究通过CCD 技术和颜色空间模型建立了一种AFB1 快速定量的新策略,实现了多个样本检测结果的同时记录和一次性输出,与传统方法相比,检测效率明显提高。研究结果表明,该方法可快速准确地进行定量检测,且整个检测过程中人工参与度较低,误差率在可控范围内,满足基本的市场需求。本文所提出的RqM-AFB1 在AFB1 定量识别的准确度方面有较好表现,但测量精度方面仍有局限性,如何改进模型并融入机器学习来提升测量精度可以考虑为未来研究的一个方向。
[1]SANDOVAL I G,WESSELING S,RIETJENS M I.Predicting the acute liver toxicity of aflatoxin B1 in rats and humans by an in vitro-in silico testing strategy[J].Molecular Nutrition & Food Research,2020,64(13):1-10.
[2]MASINDE L A,SHENG W,XU X,et al.Colloidal gold based immuno-chromatographic strip for the simple and sensitive determination of aflatoxin B1 and B2 in corn and rice[J].Microchimica Acta,2013,180(9/10):921-928.
[3]SANDOVAL G I,WESSELING S,RIETJENS M I.Aflatoxin B1 in nixtamalized maize in Mexico;occurrence and accompanying risk assessment[J].Toxicology Reports,2019,6:1135-1142.
[4]LIU D W,LIU H Y,ZHANG H B,et al.Potential natural exposure of endangered red -crowned crane(Grus japonensis) to mycotoxins aflatoxin B1,deoxynivalenol,zearalenone,T-2 toxin,and ochratoxin A[J].Journal of Zhejiang University.Science.B,2016,17(2):158-168.
[5]QI N L,YU H L,YANG C L,et al.Aflatoxin B1 in peanut oil from Western Guangdong,China,during 2016-2017[J].Food Additives & Contaminants.Part B,Surveillance,2019,12(1):45-51.
[6]张宸.我国主要食品中黄曲霉毒素B1 调查与风险评估[D].杨凌:西北农林科技大学,2008:19-29.
ZHANG C,Investigation and risk assessment of aflatoxin B1 in main foods of China[D].Yangling:Northwest A & F University,2008:19-29.
[7]CHEN S J,GAN L,GUO Y C,et al.Changes in growth performance,aflatoxin B1 residues,immune response and antioxidant status of Litopenaeus vannamei fed with AFB1 contaminated diets and the regulating effect of dietary myo-inositol supplementation[J].Food Chemistry,2020,324:126888.
[8]SHI D Y,LIAO S Q,GUO S N,et al.Protective effects of selenium on aflatoxin B1 induced mitochondrial permeability transition,DNA damage,and histological alterations in duckling liver[J].Biological Trace Element Research,2015,163(1/2):162-168.
[9]XU C P,YE S Y,CUI X L,et al.Modelling photocatalytic detoxification of aflatoxin B1 in peanut oil on TiO2 layer in a closed-loop reactor[J].Current Nanoscience,2019,15(2):87-95.
[10]赵萌,高婧,褚华硕,等.黄曲霉毒素B1 的分子致毒机理及其微生物脱毒研究进展[J].食品科学,2019,40(11):235-245.
ZHAO M,GAO J,CHU H S,et al.Recent progress in research on toxicity mechanism and mi crobial detoxification of aflatoxin B1[J].Food Science,2019,40(11):235-245.
[11]马梦戈,吕佼,杨柳,等.食品中黄曲霉毒素检测方法研究进展[J].粮食与油脂,2020,33(1):26-28.MA M G,LV J,YANG L,et al.Research progress on the detection of aflatoxins in food[J].Cereals & Oils,2020,33(1):26-28.
[12]ALEJANDRA P,M,MARÍA L,et al.Validation of a liquid chromatography/tandem mass spectrometry method for the detection of aflatoxin B1 residues in broiler liver[J].Revista Argentina de Microbiologia,2018,50(2):157-164.
[13]HUI Y Y,WANG B N,REN R,et al.An electrochemical aptasensor based on DNA-AuNPs-HRP nanoprobes and exonuclease-assisted signal amplifi cation for detection of aflatoxin B1[J].Food Control,2020,109:106902.
[14]WANG C,LI Y P,ZHAO Q.A competitive electrochemical aptamer-based method for aflatoxin B1 detection with signal-off response[J].Analytical Methods,2020,12(5):646-650.
[15]MARCO C L,MARCO M,SIHEM F,et al.An electronic nose supported by an artificial neural network for the rapid detection of aflatoxin B1 and fu monisins in maize[J].Food Control,2021,123:107722.
[16]武琳霞,翟文磊,韦迪哲,等.无损检测技术在真菌鉴定及毒素检测中的应用[J].食品科学,2020,41(21):248-258.
WU L X,ZHAI W L,WEI D Z,et al.Application of non-destructive techniques in the detection of fungal infection and mycotoxins:A review[J].Food Science,2020,41(21):248-258.
[17]陈宗伦.食品中黄曲霉毒素B1 高灵敏度定量免疫层析检测方法的建立[D].杭州:浙江工商大学,2018:14-75.
CHEN Z L.Study on the quantitative detection of aflatoxin B1 in food using immuno-chromatographic method[D].Hangzhou:Zhejiang Gongshang University,2018:14-75.
[18]XIAO W,HUANG C H,XU F,et al.A simple and compact smartphone-based device for the quantitative readout of colloidal gold lateral flow immunoassay strips[J].Sensors and Actuators:B.Chemical,2018,266:63-70.
[19]马江媛,桑晓霞,黄登宇.黄曲霉毒素B1 的检测方法[J].食品安全质量检测学报,2019,10(24):8399-8404.
MA J Y,SANG X X,HUANG D Y.Detection method for aflatoxin B1[J].Journal of Food Safety and Quality,2019,10(24):8399-8404.
[20]曹进辉.基于扫描仪控制器GL847 的图像校正技术研究[D].西安:西安电子科技大学,2011:12-31.
CAO J H.Study of image calibration technology based on scanner controller GL847[D].Xi'an:Xidian University,2011:12-31.
[21]AHMED A Z,MOHAMMED F H,OAYS M S.Color image steganography in YCbCr space[J].International Journal of Electrical and Computer Engineering(IJECE),2020,10(1):202-209.
[22]FENG J,JIANG L L,ZHANG J L,et al.Nondestructive determination of soluble solids content and ph in red bayberry(Myrica Rubra) based on color space[J].Food Weekly News,2020,57(12):4541-4550.
[23]MOHAMED A A,SHALABY A A,SALEM A.The Yxy colour space parameters as novel signalling tools for digital imaging sensors in the analytical laboratory[J].RSC Advances,2018,8(19):10673-10679.
[24]LI X,LI S,LIU Q,et al.A triple-channel colorimetric sensor array for identification of biothiols based on color RGB(Red/Green/Blue) as signal readout[J].ACS Sustainable Chemistry & Engineering,2019:17482-17490.
[25]ZHENG Y Y,LEE J C,DUAN Q N,et al.A novel encoded recording strategy of complex chemical system[J].The Chemical Society of Japan,2017,46(3):360-363.
[26]杨振亚,王勇,杨振东,等.RGB 颜色空间的矢量-角度距离色差公式[J].计算机工程与应用,2010,46(6):154-156.
YANG Z Y,WANG Y,YANG Z D,et al.Vector-angular distance color difference formula in RGB color space[J].Computer Engineering and Applications,2010,46(6):154-156.