沙门氏菌(Salmonella)是常见的肠道致病菌,其导致的食源性疾病爆发与食用畜禽产品关联较多,引发的肠胃炎、败血症等疾病对人类健康和社会经济造成很大的影响[1-4]。沙门氏菌对人类的感染主要取决于其血清型和食用者的身体状况。有研究表明,不同血清型沙门氏菌在我国各省份不同食品中检出程度不同。胡豫杰等[5]对我国6 省份零售整鸡中沙门菌血清型分布研究显示,肠炎沙门氏菌、印第安纳沙门氏菌和婴儿沙门氏菌为优势血清型。钟舒红等[6]、刘雪杰等[7]对广西省畜禽产品源和福建省食源性沙门氏菌的研究发现,鼠伤寒沙门氏菌、德尔卑沙门氏菌和肠炎沙门氏菌亦为主要血清型。由于肠炎沙门氏菌、鼠伤寒沙门氏菌和猪霍乱沙门氏菌等均可产生耐热的肠毒素,不仅可导致宿主产生腹泻等食源性疾病,而且会引发其它更为严重的症状[3,8-10]。这些沙门氏菌常在动物性食品[5,11-13]和食品环境[5,14]被检出,对食品安全带来极大威胁。
沙门氏菌在食品中流行状况不同,不同血清型的沙门氏菌及菌株个体在宿主体内代谢各异[3],其同源关系及来源追溯可通过基因分型的方法进行。作为沙门氏菌基因型分析的“黄金标准”,脉冲场凝胶电泳(Pulse field gel electrophoresis,PFGE)技术在国内外被应用于各种病原菌的分子分型 [15-19]。开展鸡肉源沙门氏菌的血清型和基因型,可丰富我国食源性致病菌分子流行病学特性数据库,为预警和控制食源性疾病爆发、保障食品安全提供依据。
1 材料和方法
1.1 材料
1.1.1 菌株 沙门氏菌共399 株,分离于采集自广东省、广西省、福建省和上海市的576 份零售鸡肉样品,菌株的分离和鉴定参考Cui 等[20]的方法进行。布伦登卢普沙门氏菌(Salmonella Braenderup)H9812 为中国食品药品检定研究院惠赠。
1.1.2 培养基和试剂 Luria-Bertani(LB)营养琼脂、胰酪胨大豆琼脂(Trypticase Soy Agar;TSA)和半固体营养琼脂,北京陆桥技术股份有限公司;PFGE 专用琼脂糖(SeaKem Gold Agarose),美国Cambrex Bio Science 公司;十二烷基硫酸钠(Sodium dodecyl sulfate,SDS)、三羟甲基氨基甲烷盐酸(Tris-Hcl)、乙二胺四乙酸(Ethylenediaminetetraacetic acid,EDTA)、苯甲基磺酰氟(Phenylmethylsulfonyl Fluoride,PMSF) 等均为分析纯,Sigma 公司;硼酸和氯化钠均为分析纯,西安化学试剂厂;蛋白酶K 和限制性内切酶XbaI,宝生物工程(大连)有限公司(TaKaRa);Xba I 酶切缓冲液、蛋白酶K 缓冲液和牛血清蛋白(BSA)为商品酶自带;细胞悬浮液(Cell Suspension Buffer;CSB)、细胞裂解液(Cell Lysis Buffer;CLB)、TE 缓冲液和0.5×TBE 电泳缓冲液均自行配制。
1.1.3 沙门氏菌分型用血清 抗血清为泰国S &A 公司的沙门氏菌诊断血清,包括沙门氏菌O 多价抗血清(Salmonella O Polyvalent Antisera),O群抗血清(Salmonella O Group Antisera),O 单因子抗血清(Salmonella O Factor Antisera),H 多价抗血清(Salmonella H Polyvalent Antisera),H 相抗血清(Salmonella H phase Antisera),H 单因子抗血清(Salmonella H Factor Antisera)和H 抗原诱导相抗血清(Salmonella H for Phase Inversion Antisera)。
1.2 血清型鉴定
鉴定按照泰国S&A 公司提供的沙门氏菌诊断血清操作步骤和说明进行,查阅S&A 公司沙门氏菌抗血清诊断附录和沙门氏菌检验国家标准(GB/T 4789.4-2016),根据测定得到的抗原式,确定沙门氏菌的血清型。
1.3 PFGE
PFGE 分型按照美国疾病预防控制中心推荐的分型方法进行。电泳凝胶使用溴化乙锭染色后成像,用MINITAB 16 对数据进行统计学分析(P<0.05 表示差异显著),并用BioNumerics 软件聚类分析,确定沙门氏菌基因型及同源关系。布伦登卢普沙门氏菌H9812 为分型标准质控菌。
2 结果和分析
2.1 零售鸡肉中沙门氏菌血清型分布
399 株沙门氏菌共检出47 种血清型(表1)。检出率最高的为肠炎沙门氏菌(17.04%),但与鼠伤寒沙门氏菌(16.04%) 和印第安纳沙门氏菌(14.04%)的检出率间无显著性差异。该3 种血清型沙门氏菌的检出率显著高于汤卜逊沙门氏菌(9.02%)和阿贡纳沙门氏菌(7.52%)。肠炎沙门氏菌在福建省、上海市和广西省的检出率显著高于广东省,鼠伤寒沙门氏菌、汤卜逊沙门氏菌和阿贡纳沙门氏菌的检出率在4 省份间无显著性差异(表1)。
表1 零售鸡肉中不同血清型沙门氏菌的检出率
Table 1 Detection rate Salmonella serovars in retail chickens
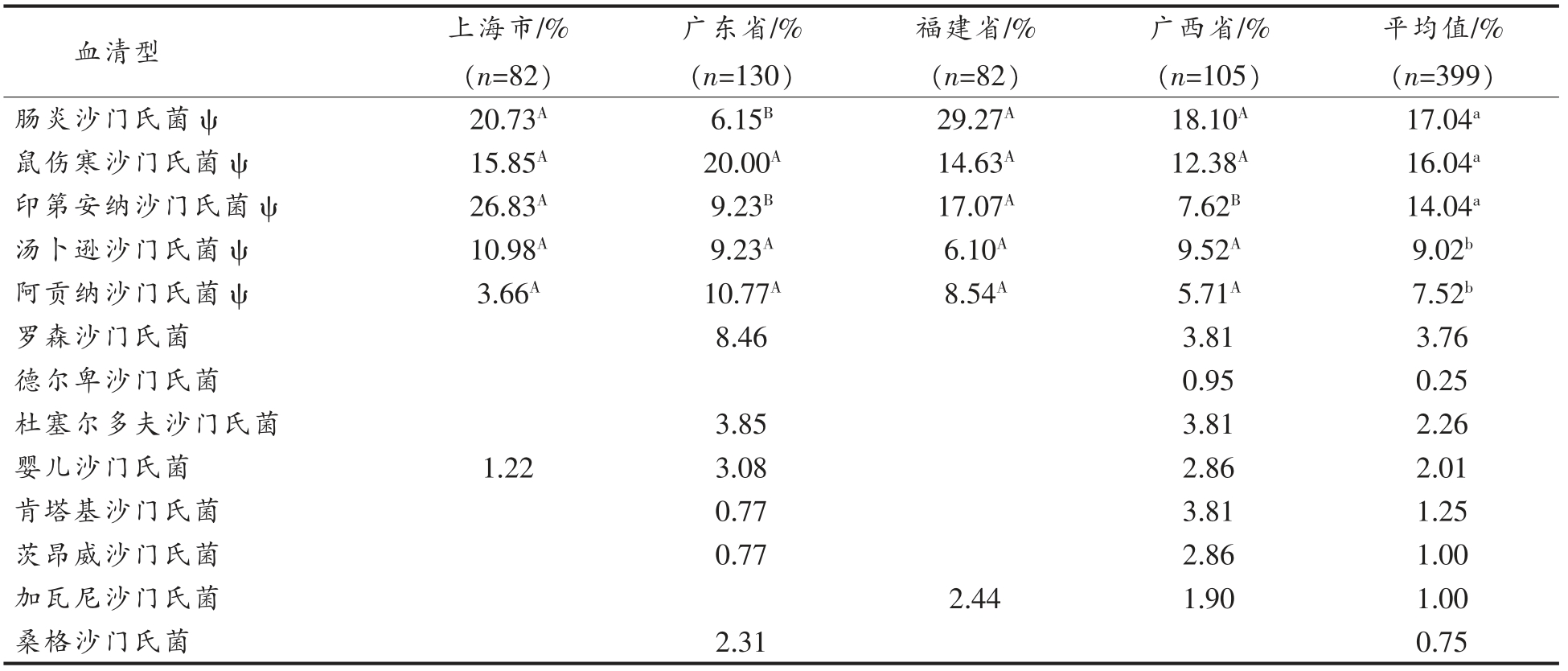
平均值/%(n=399)肠炎沙门氏菌ψ 20.73A 6.15B 29.27A 18.10A 17.04a鼠伤寒沙门氏菌ψ 15.85A 20.00A 14.63A 12.38A 16.04a印第安纳沙门氏菌ψ 26.83A 9.23B 17.07A 7.62B 14.04a汤卜逊沙门氏菌ψ 10.98A 9.23A 6.10A 9.52A 9.02b阿贡纳沙门氏菌ψ 3.66A 10.77A 8.54A 5.71A 7.52b罗森沙门氏菌 8.46 3.81 3.76德尔卑沙门氏菌 0.95 0.25杜塞尔多夫沙门氏菌 3.85 3.81 2.26婴儿沙门氏菌 1.22 3.08 2.86 2.01肯塔基沙门氏菌 0.77 3.81 1.25茨昂威沙门氏菌 0.77 2.86 1.00加瓦尼沙门氏菌 2.44 1.90 1.00桑格沙门氏菌 2.31 0.75血清型 上海市/%(n=82)广东省/%(n=130)福建省/%(n=82)广西省/%(n=105)
(续表1)
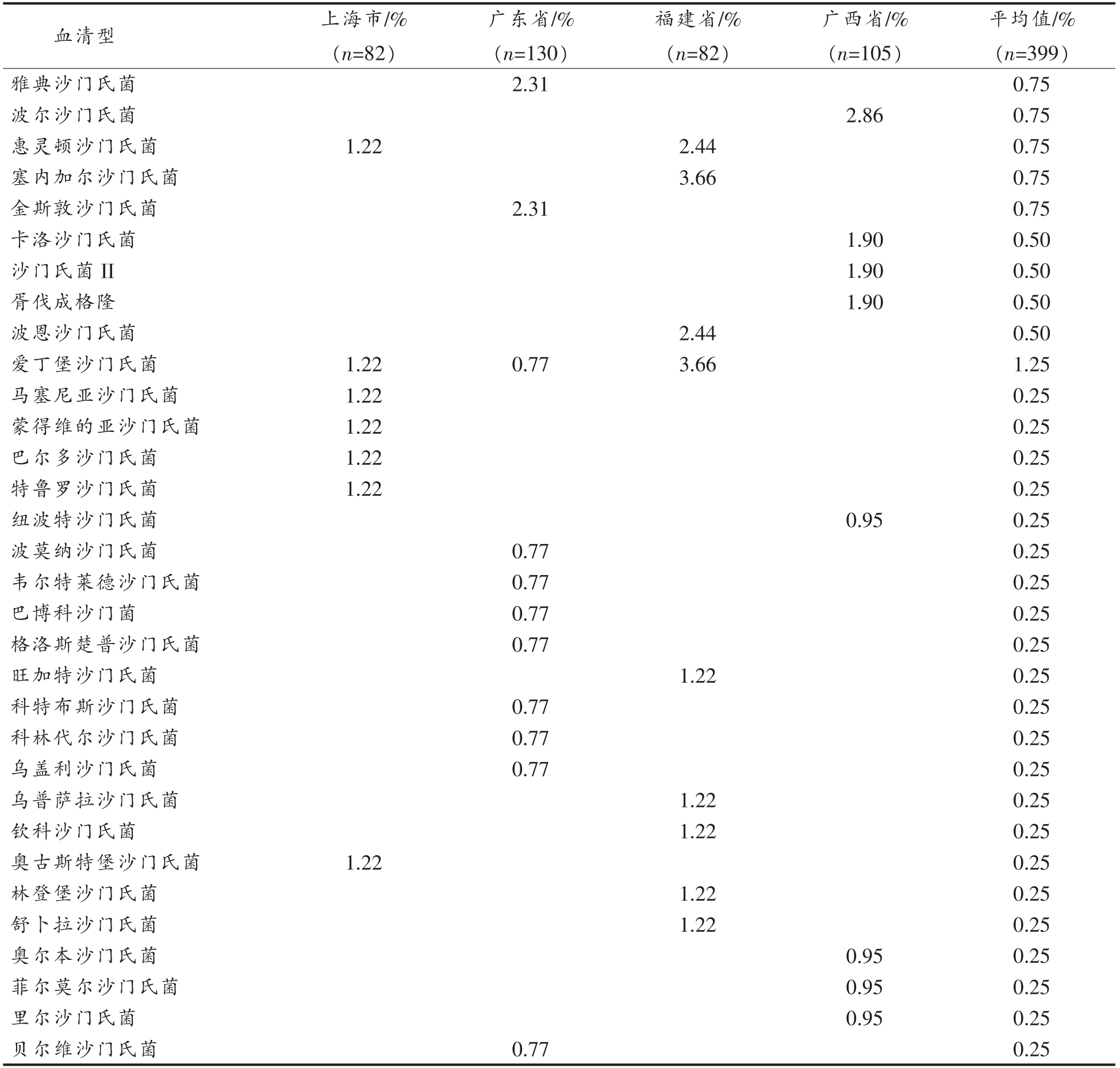
注:ψ:只对在4 个省市均有检出的沙门氏菌血清型的检出率进行统计分析;空格表示未检出;相同大写字母标记的数值表示同一血清型的沙门氏菌在不同采样省市间的检出率间没有显著性差异;相同小写字母标记的数值表示不同血清型的沙门氏菌总检出率间无显著性差异。
平均值/%(n=399)雅典沙门氏菌 2.31 0.75波尔沙门氏菌 2.86 0.75惠灵顿沙门氏菌 1.22 2.44 0.75塞内加尔沙门氏菌 3.66 0.75金斯敦沙门氏菌 2.31 0.75卡洛沙门氏菌 1.90 0.50沙门氏菌II 1.90 0.50胥伐成格隆 1.90 0.50波恩沙门氏菌 2.44 0.50爱丁堡沙门氏菌 1.22 0.77 3.66 1.25马塞尼亚沙门氏菌 1.22 0.25蒙得维的亚沙门氏菌 1.22 0.25巴尔多沙门氏菌 1.22 0.25特鲁罗沙门氏菌 1.22 0.25纽波特沙门氏菌 0.95 0.25波莫纳沙门氏菌 0.77 0.25韦尔特莱德沙门氏菌 0.77 0.25巴博科沙门菌 0.77 0.25格洛斯楚普沙门氏菌 0.77 0.25旺加特沙门氏菌 1.22 0.25科特布斯沙门氏菌 0.77 0.25科林代尔沙门氏菌 0.77 0.25乌盖利沙门氏菌 0.77 0.25乌普萨拉沙门氏菌 1.22 0.25钦科沙门氏菌 1.22 0.25奥古斯特堡沙门氏菌 1.22 0.25林登堡沙门氏菌 1.22 0.25舒卜拉沙门氏菌 1.22 0.25奥尔本沙门氏菌 0.95 0.25菲尔莫尔沙门氏菌 0.95 0.25里尔沙门氏菌 0.95 0.25贝尔维沙门氏菌 0.77 0.25血清型 上海市/%(n=82)广东省/%(n=130)福建省/%(n=82)广西省/%(n=105)
广东省零售鸡肉源沙门氏菌中共检出22 种血清型,主要为鼠伤寒沙门氏菌(20.00%)、阿贡纳沙门氏菌(10.77%)、印第安纳沙门氏菌和汤卜逊沙门氏菌(9.23%)、罗森沙门氏菌(8.46%)、肠炎沙门氏菌(6.15%)和杜塞尔多夫沙门氏菌(3.85%)等。上海市共检出13 种血清型,以印第安纳沙门氏菌(26.83%)最为常见,其次分别为肠炎沙门氏菌(20.73%)、鼠伤寒沙门氏菌(15.85%)、汤卜逊沙门氏菌(10.98%)和阿贡纳沙门氏菌(3.66%)等。福建省共检出15 种血清型,以肠炎沙门氏菌(29.27%)最为常见,其次分别为印第安纳沙门氏菌(17.07%)、鼠伤寒沙门氏菌(14.63%)、阿贡纳沙门氏菌(8.54%)、汤卜逊沙门氏菌(6.10%)、爱丁堡沙门氏菌和塞内加尔沙门氏菌(3.66%,3.66%)等。广西省共检出20 种血清型,较常见的血清型为肠炎沙门氏菌(18.10%)、鼠伤寒沙门氏菌(12.38%)、汤卜逊沙门氏菌(9.52%)、印第安纳沙门氏菌(7.62%)和阿贡纳沙门氏菌(5.71%)等。
4 省市检出的鸡肉源沙门氏菌优势血清型各不相同,上海市为印第安纳沙门氏菌,广东省为鼠伤寒沙门氏菌,福建省和广西省为肠炎沙门氏菌。德尔卑沙门氏菌在广东省、福建省和广西省都有不同程度的检出,但却未在上海市检出。罗森沙门氏菌和杜塞尔多夫沙门氏菌在广东省和广西省均有检出,却未在上海市和福建省检出。由此可见,沙门氏菌血清型分布具有明显的地域性。
2.2 零售鸡肉源沙门氏菌的基因型
399 株沙门氏菌中有32 株XbaⅠ酶切、PFGE分型不成功。367 株菌分型、聚类后,可被分为13大簇和219 个基因型(具体聚类结果未展示)。同一血清型的沙门氏菌分型后基本处于同一大簇或其相邻簇中。部分同一血清型的菌株分型后DNA带谱差异较大,聚类后分布于不同大簇,表明分离株亲缘关系较远或其基因型本身就存在明显的多样性。
一些源于不同地区、血清型不同的菌株PFGE分型后DNA 带谱具有较高相似度,聚类后处于同一簇中,表明具有该基因型的菌株在不同地域流行比较广泛,虽然血清型不同,但在自然界演化过程中可能有着较近的亲源关系。
2.3 常见血清型沙门氏菌的基因型
2.3.1 肠炎沙门氏菌的基因型 65 株肠炎沙门氏菌经XbaⅠ酶切、PFGE 分型、结果聚类后共呈现出38 种不同的基因型,所有菌株的基因同源性为96%。尽管这些肠炎沙门氏分离于不同时间、地点和零售鸡肉样品,但却具有较高的基因同源性,表明这些来源各异的肠炎沙门氏菌在进化上可能为某一克隆的沙门氏菌演变而来,也可能是采样期间在这几个省市零售鸡肉中流行的肠炎沙门氏菌种类,表明肠炎沙门氏菌对食品造成的污染在时间和空间上具有立体性及普遍性特征。
2.3.2 印第安纳沙门氏菌的基因型 54 株印第安纳沙门氏菌使用XbaⅠ酶切、PFGE 分型并聚类分析后共呈现出34 种基因型(图2)。所有菌株的同源性为97.5%。按98.2%的相似度可将其分为4个大簇,分别为IA、IB、IC、ID(图2),IC 簇内各菌株的同源性最高。菌株DNA 带谱相似性与采样地点、采样时间、鸡肉类型和贮存条件间没有明显的相关性,表明在这4 个不同省市零售鸡肉中印第安纳沙门氏菌的存在形式较为稳定,克隆体间差异不大。

图1 65 株零售鸡肉源肠炎沙门氏菌PFGE 基因型和聚类结果
Fig.1 Phylogeny of PFGE patterns of 65 Salmonella serovar Enteritidis isolates from chicken

图2 54 株零售鸡肉源印第安纳沙门氏菌PFGE 基因型和聚类结果
Fig.2 Phylogeny of PFGE patterns of 54 Salmonella serovar Indiana isolates from chicken
2.3.3 鼠伤寒沙门氏菌的基因型 58 株鼠伤寒沙门氏菌使用XbaⅠ酶切、PFGE 分型后共呈现出40 种不同的基因型(图3)。所有菌株的同源性为97%。按98%的相似度可将菌株分为3 大簇,分别为TA、TB 和TC。第3 簇TC 中的菌株在4 省均有检出,表明该基因型的菌株在零售鸡肉中流行状况较为稳定,其克隆体间差异不大。
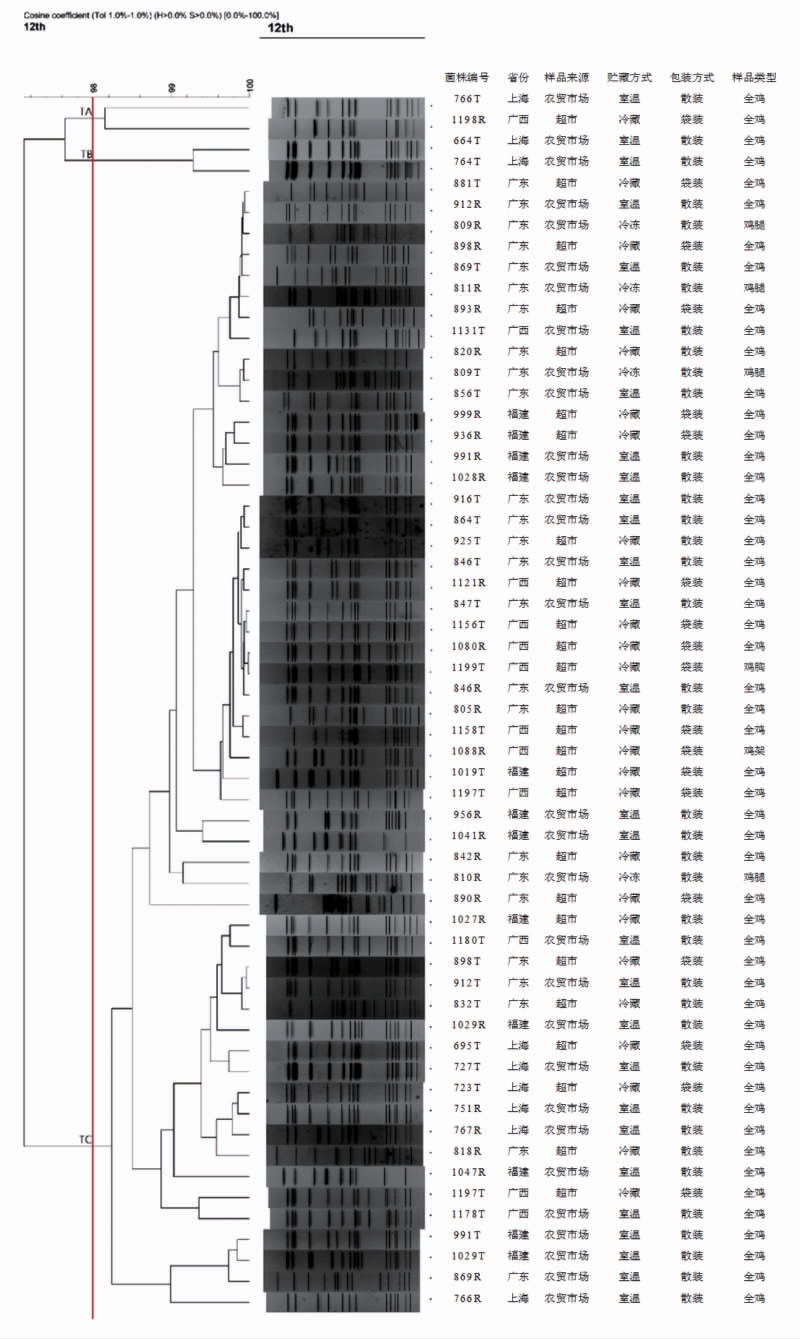
图3 58 株零售鸡肉源鼠伤寒沙门氏菌PFGE 基因型和聚类结果
Fig.3 Phylogeny of PFGE patterns of 58 Salmonella serovar Typhimurium isolates from chicken
2.2.4 汤卜逊沙门氏菌的基因型 20 株汤卜逊沙门氏菌经过XbaⅠ酶切、PFGE 分型后共呈现出18 种不同的基因型(图4)。所有菌株的同源性为97%。按99%的相似度可将其分为5 大簇,分别为ThA、ThB、ThC、ThD 和ThE。
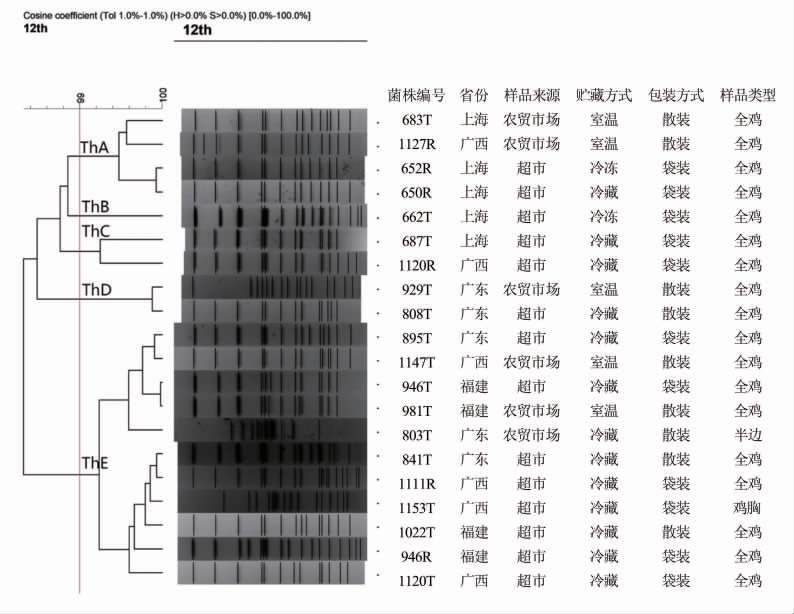
图4 20 株零售鸡肉源汤卜逊沙门氏菌PFGE 基因型和聚类结果
Fig.4 Phylogeny of PFGE patterns of 20 Salmonella serovar Thompson isolates from chicken
2.2.5 阿贡纳沙门氏菌的基因型 27 株阿贡纳沙门氏菌经过XbaⅠ酶切、PFGE 分型后共呈现出23 种基因型(图5)。按98%的相似度可将其分为4 大簇,分别为AA、AB、AC 和AD。

图5 27 株零售鸡肉源阿贡纳沙门氏菌PFGE 基因型和聚类结果
Fig.5 Phylogeny of PFGE patterns of 27 Salmonella serovar Agona isolates from chicken
3 讨论
沙门氏菌在自然界分布广泛、血清型众多。在美国、欧洲和中国流行的主要是肠炎沙门氏菌和鼠伤寒沙门氏菌[21-25]。王茂起[26]2001年在我国不同省市设点采样4 034 份,与刘雯静[27]2011年对我国6 个地区分离到的191 株沙门氏菌及李薇薇等[28]2018年研究我国4 省份肉鸡生产中沙门氏菌污染研究结果相同,优势血清型均为肠炎沙门氏菌[29-31]。本研究结果表明鸡肉源沙门氏菌最常见血清型同为肠炎沙门氏菌,符合我国近年来沙门氏菌在零售鸡肉中的流行规律。
各地区流行的沙门氏菌血清型和优势血清型不完全相同[13]。Qi 等[16]、高付敏等[32]和张庆贺[31]分别对上海市导致肠炎感染的主要沙门氏菌血清型、安徽省零售鸡肉中沙门氏菌污染情况及其血清型研究结果均显示肠炎沙门氏菌为主要流行血清型,表明肠炎沙门氏菌在我国零售食品中广泛存在,且容易导致消费者患病。与这些研究不同的是,谢爱蓉等[33]发现温州市生禽肉和生畜肉中的优势血清型为鼠伤寒沙门氏菌,而朱海华等[34]研究显示河南省零售鸡肉中主要为印第安纳沙门氏菌。这些不同的研究也显示出沙门氏菌在不同食品和不同地域间存在血清型差异性特征。
同一地区的流行沙门氏菌的优势血清型可能会随年份发生变化,但主要流行血清型种类却不会发生太多变化。Qi 等[16]研究发现,上海市1998-2006年从肠胃炎患者分离的565 株沙门氏菌主要为鼠伤寒沙门氏菌(21.59%) 和肠炎沙门氏菌(16.82%),胡海贇等[35]发现上海市2015-2017年腹泻病患儿中分离得到的196 株沙门氏菌仍以鼠伤寒沙门氏菌(40.3%) 为主,肠炎沙门氏菌(28.1%)次之。这与本研究从上海市零售食品中分离的沙门氏菌的主要血清型为肠炎沙门氏菌(20.73%)和鼠伤寒沙门氏菌(15.85%)结果比较吻合。
刘雪杰等[36]研究了2015-2018年福建省食源性疾病沙门氏菌感染情况,发现主要为鼠伤寒沙门氏菌(57.85%)和肠炎沙门氏菌(15.42%),而本研究从福建省的零售鸡肉中检出的优势血清型为肠炎沙门氏菌(29.27%) 和鼠伤寒沙门氏菌(14.63%)。虽然我们检测到的零售鸡肉中优势沙门氏菌血清型和导致感染的沙门氏菌血清型不完全一致,但流行型几乎相同。孟昭赫等[21]研究发现广东等4 省市零售鸡肉中比较常见的血清型为肠炎沙门氏菌(20.2%)、伤寒沙门氏菌(17.3%)、印第安纳沙门氏菌(15.6%)、汤卜逊沙门氏菌(10.8%)、阿贡纳沙门氏菌(8.4%)和罗森沙门氏菌(3.8%),与本研究检出的血清型结果比较一致。
虽然部分研究中采集的样品和本研究不同,但仍在相应的省市检出相同或相似的沙门氏菌血清型。诸葛石养等[37]在广西省农贸市场生鸡肉中检出的沙门氏菌以德尔卑血清型为主,肉鸡肛试沙门氏菌以肠炎血清型为主。钟舒红等[38]在广西省零售生鲜畜禽肉中检出的沙门氏菌主要为德尔卑(35.23%)和鼠伤寒沙门氏菌(11.93%),这些研究结果和本研究在相应的省市采集的零售鸡肉中沙门氏菌主要的血清型流行结果基本一致。
PFGE 分型过程不受菌株表型干扰,结果具有重复性好、分辨力强、易标准化、高准确性和稳定性等优点,对追溯传染源、确认传播链和发现新的流行菌株等方面具有重要作用[40-41]。本研究采用美国Pulse-Net 使用的PFGE 方法将399 株沙门氏菌分型后,同一血清型的菌株PFGE 分型后基本处于同一大簇,或其相邻簇中,且各省市均未显示出优势基因型的菌株。这与周正等[42]对我国食源性鼠伤寒沙门氏菌耐药谱及PFGE 分型研究的结果,与王晓泉等[43]对分离自我国江苏、上海、山东、陕西、河南和新疆等地的鸡白痢沙门氏菌,分离自新鲜鸡肉、猪肉和牛肉中的沙门氏菌及从事饮食行业人员肠道排泄物的沙门氏菌进行FFGE 分型后所得结论均比较一致,即沙门氏菌的PFGE 基因型既表现出地域间的多样性,也同时表现出地域内的高度同源性。
沙门氏菌是最常见的食源性致病菌之一,每年由沙门氏菌引发病例及致死病例数呈上升趋势[44],开展沙门氏菌的分型研究对沙门氏菌的防控和风险评估,保障食品安全具有重要意义[45]。
[1]THRELFALL E J.Antimicrobial drug resistance in Salmonella:problems and perspectives in food- and water-borne infections[J].FEMS Microbiology Reviews,2002,26(2):141-148.
[2]GUT A M,VASILJEVIC T,YEAGER T,et al.Salmonella infection-prevention and treatment by antibiotics and probiotic yeasts:A review[J].Microbiology,2018,164(11):1327-1344.
[3]HERRERO-FRESNO A,OLSEN J E.Salmonella Typhimurium metabolism affects virulence in the host - A mini-review[J].Food Microbiology,2018,71:98-110.
[4]KUMAR Y,SINGH V,KUMAR G,et al.Serovar diversity of Salmonella among poultry[J].Indian Journal of Medical Research,2019,150(1):92-95.
[5]胡豫杰,赫英英,王晔茹,等.中国六省份零售整鸡中沙门菌血清型分布和耐药性特征研究[J].中华预防医学杂志,2018,52(4):372-377.
HU Y J,HE Y Y,WANG Y R,et al.Serotype distribution and antimicrobial resistance of Salmonella isolates from retail chicken carcasses in six provinces of China[J].Chinese Journal of Preventive Medicine,2018,52(4):372-377.
[6]钟舒红,潘艳,冯世文,等.广西畜禽产品中沙门氏菌血清型、耐药性及耐药基因调查[J].中国畜牧兽医,2018,45(3):770-780.
ZHONG S H,PAN Y,FENG S W,et al.Investigation on serotype,drug resistance and drug resistance gene of Salmonellain livestock and poultry products of Guangxi[J].China Animal Husbandry &Veterinary Medicine,2018,45(3):770-780.
[7]刘雪杰,陈伟伟,傅祎欣,等.2015-2018年福建省食源性疾病沙门氏菌监测情况分析[J].中国人兽共患病学报,2020,36(3):223-228.
LIU X J,CHEN W W,FU Y X,et al.Surveillance situation of Salmonella in foodborne diseases in Fujian,China,2015-2018[J].Chinese Journal of Zoonoses,2020,36(3):223-228.
[8]HIYOSHI H,TIFFANY C R,BRONNER D N,et al.Typhoidal Salmonella serovars:ecological opportunity and the evolution of a new pathovar[J].FEMS Microbiology Reviews,2018,42(4):527-541.
[9]FERRARI R G,ROSARIO D K A,CUNHA-NETO A,et al.Worldwide Epidemiology of Salmonella serovars in animal-based foods:A meta-analysis[J].Applied and Environmental Microbiology,2019,85(14):591-628.
[10]GILCHRIST J J,MACLENNAN C A.Invasive nontyphoidal Salmonella disease in Africa [J].EcoSal Plus,2019,8(2):23.
[11]杨保伟,张秀丽,曲东,等.2007-2008 陕西部分零售畜禽肉沙门氏菌血清型和基因型[J].微生物学报,2010,50(5):654-660.
YANG B W,ZHANG X L,QU D,et al.Serotype and genotypic characterization of Salmonella Serovars from retails meat in Shaanxi province(2007-2008)[J].Acta Microbiologica Sinica,2010,50(5):654-660.
[12]GUO Z,SU C H,HUANG J,et al.A food-borne outbreak of Gastroenteritis caused by different Salmonella serotypes in 2 Universities in Xiamen,Fujian,China,in 2012[J].Japanese Journal of Infectious Diseases,2015,68(3):187-191.
[13]LUVSANSHARAV U O,VIEIRA A,BENNETT S,et al.Salmonella serotypes:A novel measure of association with foodborne transmission[J].Foodborne Pathogens and Disease,2019,17(2):151-155.
[14]TAVECHIO A T,GHILARDI,ÂNGELA C R,et al.Salmonella serotypes isolated from nonhuman sources in So Paulo,Brazil,from 1996 through 2000 [J].Journal of Food Protection,2002,65(6):1041-1044.
[15]DUDEK B,KSIAZ˙CZYK M,KRZYZ˙EWSKA E,et al.Comparison of the phylogenetic analysis of PFGE profiles and the characteristic of virulence genes in clinical and reptile associated Salmonella strains[J].BMC Veterinary Research,2019,15(1):312-324.
[16]QI X,LI P,XU X,et al.Epidemiological and molecular investigations on Salmonella Responsible for gastrointestinal infections in the southwest of Shanghai from 1998 to 2017[J].Front Microbiol,2019,10:2025-2034.
[17]WEI Z,XU X,YAN M,et al.Salmonella Typhimurium and Salmonella Enteritidis infections in sporadic diarrhea in children:Source tracing and resistance to third -generation cephalosporins and ciprofloxacin[J].Foodborne Pathogens and Diseases,2019,16(4):244-255.
[18]MASHE T,GUDZA-MUGABE M,TARUPIWA A,et al.Laboratory characterisation of Salmonella enterica serotype Typhi isolates from Zimbabwe,2009-2017[J].BMC Infectious Diseases,2019(19):487-496.
[19]TANG S,ORSI R H,LUO H,et al.Assessment and comparison of molecular subtyping and characterization methods for Salmonella[J].Front Microbiol,2019,10:1591-1614.
[20]CUI S,ZHENG J,MENG J.An improved method for rapid isolation of Salmonella from chicken carcasses[J].Journal of Food Safety,2006,26(1):49-61.
[21]孟昭赫,刘宏道,何晓青,等.食品卫生检验方法(微生物学部分)[J].医学研究杂志,1988(9):26-27.
MENG Z H,LIU H D,HE X Q,et al.Methods of food hygiene inspection(microbiology section)[J].Journal of Medical Research,1988(9):26-27.
[22]朱其太.沙门氏菌血清型的流行病学分类[J].兽医科技信息,1996(3):1-2.
ZHU Q T.Epidemiological classification of Salmonella serotypes[J].Chinese Journal of Animal Husbandry and Veterinary Medicine,1996(3):1-2.
[23]郑林,祝令伟,郭学军,等.沙门氏菌主要流行血清型耐药性的研究进展[J].江苏农业科学,2020,48(6):8-12.
ZHENG L,ZHU L W,GUO X J,et al.Research progress of antimicrobial resistance of major epidemic serotypes of Salmonella[J].Jiangsu Agricultural Sciences,2020,48(6):8-12.
[24]张燕,朱超.我国沙门氏菌病和菌型分布概况[J].现代预防医学,2002(3):400-401.
ZHANG Y,ZHU C.Distribution of salmonellosis and Salmonella types in China[J].Modern Preventive Medicine,2002(3):400-401.
[25]李光辉,高雪丽,郭卫芸,等.1996-2015年间沙门氏菌食物中毒事件特征分析[J].食品工业,2018,260(5):259-261.
LI G H,GAO X L,GUO W Y,et al.Epidemiological Analysis of Salmonella Food Poisoning Event in China during 1996-2015[J].The Food Industry,2018,260(5):259-261.
[26]王茂起.2001年中国食源性致病菌及其耐药性主动监测研究[J].卫生研究,2004,33(1):49-54.
WANG M Q.Study on national active monitoring for food borne pathogens and antimicrobial resistance in China 2001[J].Journal of Hygiene Research,2004,33(1):49-54.
[27]刘雯静.我国部分地区沙门氏菌的分子分型及流行特征分析[D].北京:中国人民解放军军事医学科学院,2011.
LIU W J.The molecular typing and Epidemiological Analysis of Salmonella In some regions of China[D].Beijing:Academy of Military Medical Sciences,2011.
[28]李薇薇,白莉,张秀丽,等.中国四省份规模化肉鸡生产全过程沙门菌的污染状况和耐药特征研究[J].中华预防医学杂志,2018(4):352-357.
LI W W,BAI L,ZHANG X L,et al.Study on Salmonella contamination and drug resistance of broiler chickens in four provinces of China[J].Chinese Journal of Preventive Medicine,2018(4):352-357.
[29]申永秀,周丽萍,王艳,等.不同来源沙门氏菌耐药性及相关性研究[J].食品安全质量检测学报,2018,9(7):1513-1517.
SHEN Y X,ZHOU L P,WANG Y,et al.Antimicrobial resistance and correlation of Salmonella from different sources[J].Journal of Food Safety & Quality,2018,9(7):1513-1517.
[30]侯海燕,刘靓,李兵兵,等.淮安市2010~2016年肉及肉制品中沙门氏菌污染状况及耐药性分析[J].食品安全质量检测学报,2018,9(3):659-663.
HOU H Y,LIU L,LI B B,et al.Contaminant status and antibiotic resistance analysis of Salmonella in meat and meat products in Huai'an from 2010 to 2016[J].Journal of Food Safety & Quality,2018,9(3):659-663.
[31]张庆贺.安徽地区鸡源沙门氏菌分离鉴定及其耐药性及基因分型研究[D].合肥:安徽农业大学,2019.
ZHANG Q H.Isolation,identification,drug resistance and genotyping of Salmonella gallinarum from anhui province[D].Hefei:Anhui Agricultural University,2019.
[32]高付敏,陈培超,陈伟鑫,等.上海市嘉定区生禽畜类食品中沙门氏菌污染情况及血清学研究[J].上海预防医学,2018,30(9):755-758.
GAO F M,CHEN P C,CHEN W X,et al.Salmonella contamination and its serologic research with raw poultry and livestock foodstuff in Jiading District of Shanghai[J].Shanghai Journal of Preventive Medicine,2018,30(9):755-758.
[33]谢爱蓉,章乐怡,李毅,等.温州市食品中沙门菌污染状况及特征分析[J].中国食品卫生杂志,2019,31(5):461-464.
XIE A R,ZHANG L Y,LI Y,et al.Contamination and characteristics of foodborne Salmonella in Wenzhou[J].Chinese Journal of Food Hygiene,2019,31(5):461-464.
[34]朱海华,周莉,李向力,等.河南省肉鸡沙门菌血清型分布及耐药检测[J].中国家禽,2018,40(5):76-80.
ZHU H H,ZHOU L,LI X L,et al.Serotype distribution and drug resistance detection of Salmonella in broiler in Henan Province [J].China Poultry,2018,40(5):76-80.
[35]胡海贇,洪燕,王春.儿童沙门氏菌感染性腹泻的血清学及临床特征分析[J].北京医学,2018,40(3):225-228.
HU H Y,HONG Y,WANG C.Analysis of clinical features and microbiology of the diarrhea children of nontyphoid Salmonella infection[J].Beijing Medical Journal,2018,40(3):225-228.
[36]刘雪杰,陈伟伟,傅祎欣,等.2015-2018年福建省食源性疾病沙门氏菌监测情况分析[J].中国人兽共患病学报,2020,36(3):223-228.
LIU X J,CHEN W W,FU Y X,et al.Surveillance situation of Salmonella in foodborne diseases in Fujian,China,2015-2018[J].Chinese Journal of Zoonoses,2020,36(3):223-228.
[37]诸葛石养,韦程媛,李秀桂.广西食源性与禽源性沙门氏菌血清型分布及耐药性研究[J].中国热带医学,2013,13(9):1061-1063.
ZHUGE S Y,WEI C Y,LI X G.Serotype distribution and drug resistance of food-borne and poultry-borne Salmonella in Guangxi[J].China Tropical Medicine,2013,13(9):1061-1063.
[38]钟舒红,潘艳,冯世文,等.广西畜禽产品中沙门氏菌血清型、耐药性及耐药基因调查[J].中国畜牧兽医,2018,45(3):770-780.
ZHONG S H,PAN Y,FENG S W,et al.Investigation on serotype,drug resistance and drug resistance gene of Salmonellain livestock and poultry products of Guangxi[J].China Animal Husbandry &Veterinary Medicine,2018,45(3):770-780.
[39]丛彬,傅胜才,李军.脉冲场凝胶电泳及其在兽医领域的应用[J].湖南畜牧兽医,2019(2):37-40.
CONG B,FU S C,LI J.Pulsed field gel electrophoresis and its application in veterinary medicine[J].Hunan Journal of Animal Science & Veterinary,2019(2):37-40.
[40]孟庆峰,潘乐,王伟利.脉冲场凝胶电泳技术的研究进展[J].黑龙江畜牧兽医,2012(13):26-28.
MENG Q F,PAN L,WANG W L.Research progress of pulsed field gel electrophoresis technology[J].Heilongjiang Animal Science and Veterinary Medicine,2012(13):26-28.
[41]KANG X L,MENG C,PAN Z M.Molecular typing of Salmonella by pulsed-field gel electrophoresis[J].Methods in Molecular Biology,2021,2182:187-96.
[42]周正,刘秀梅.中国食源性鼠伤寒沙门菌株耐药谱及PFGE 分型研究[J].中国食品卫生杂志,2007,19(3):221-224.
ZHOU Z,LIU X M.Antimicrobial resistance patterning and molecular typing for isolates of foodborne Salmonella typhimurium in China[J].Chinese Journal of Food Hygiene,2007,19(3):221-224.
[43]王晓泉,焦新安,刘晓文,等.江苏部分地区食源性和人源沙门氏菌的多重耐药性研究[J].微生物学报,2007,47(2):221-227.
WANG X Q,JIAO X A,LIU X W,et al.Characterization of multidrug-resistant Salmonella serovars isolated from meats and human samples in some regions of Jiangsu[J].Acta Microbiologica Sinica,2007,47(2):221-227.
[44]丽敏,宋佳春,王云华,等.浅谈沙门氏菌的研究进展[C].吉林:2018.
LI M,SONG J C,WANG Y H,et al.Brief introduction to the research progress of Salmonella[C].Jilin:2018.
[45]张文成,朱丽臻,李富强,等.沙门氏菌血清型研究进展[J].山东轻工业学院学报,2019,33(5):10-14.
ZHANG W C,ZHU L Z,LI F Q,et al.Progress in Serotype of Salmonella[J].Journal of Qilu University of Technology,2019,33(5):10-14.