蜂蜜是蜜蜂采集植物的花蜜、分泌物或蜜露,与自身分泌物混合后,经充分酿造而成的天然甜物质[1-3],含有果糖、葡萄糖、氨基酸、蛋白质、酶类、有机酸、类黄酮及多酚类物质等多种营养活性成分[4],深受消费者喜爱。然而,由于历史和现实原因,国内蜂蜜市场混乱,存在严重质量问题。市售蜂蜜主要分为3 种:(一般未成熟) 需加工的原料蜜、加工浓缩蜜和成熟蜜,其中前者是蜂农在蜜蜂转地饲养时生产的含水量高,易发酵的未成熟蜜(或水蜜);这些未成熟蜜必须经浓缩才能保证不发酵并符合国家行业标准中一级蜜要低于20%含水量的要求[2],这些加工浓缩蜜是商超蜂蜜的主要类型;而成熟蜜是自然成熟至封盖的蜂蜜,经蜜蜂自身充分酿造而成,含水量低(17%以下),浓度较高(不需浓缩),口感醇厚,活性成分含量丰富,具有较高的营养价值和保健功效[5-7]。
目前,对于不同品质蜂蜜产品的检测是科研工作的重点。蜂蜜的主要成分是葡萄糖和果糖,其它成分含量都比较低,这给蜂蜜品质辨别带来极大困难[8]。现行国家标准也未对蜂蜜品质进行有效区分[1-2]。现有的蜂蜜品质辨别方法主要有高效液相色谱法[9]、气相色谱法及气相色谱-质谱法[10]、光谱法[11]、碳同位素法[12]等,这些方法在一定程度上可以有效辨别不同品质的蜂蜜产品。然而,都存在仪器价格昂贵、操作复杂、检测时间长、需要专业知识以及仪器不便携带等缺陷[13]。建立一种新型的能够区分成熟蜂蜜、加工浓缩蜜以及果葡糖浆的方法,对于完善蜜蜂产品市场监管、食品安全以及保障消费者的正当权益具有重要的意义。
蜜蜂的味觉系统主要由口器、触角等组织构成[14]。它的口器组织由下唇须、中唇舌组成,组织表面分布着大量能够感知化学分子的味觉感受器,而感受器中的味觉感受蛋白和味觉受体,可与糖、盐、氨基酸等物质结合,在寻找蜜源时发挥着重要的作用[14-16]。从品质上讲,成熟蜜显然优于加工浓缩蜜,更优于果葡糖浆,研究表明蜜蜂能够通过味觉系统分辨出三者的异同[17]。利用这种仿生学原理,使开发生物传感器来分辨不同品质蜂蜜成为可能。循环伏安法是一种具有较高准确度和灵敏度的电化学分析方法,也非常适合作为生物传感器的信号采集方法,来准确记录和检测生物元件反应时电极表面的电特性变化[18]。
本研究利用蜜蜂对蜂蜜分辨的仿生学原理,构建一种利用蜜蜂口器组织制备的生物传感器,并采用循环伏安法建立一种辨别不同品质蜂蜜的新方法。作者将蜜蜂口器组织固定在玻碳电极表面形成传感器,利用循环伏安法记录电极表面电位变化,通过检测口器组织细胞被不同蜂蜜刺激的响应特征,构建出成熟蜂蜜、市售蜂蜜以及果葡糖浆的线性回归模型标定传感器,通过重复试验验证传感器及其分析模型的有效性和区分能力的稳定性和可靠性,最终确定最佳的区分浓度区间。以期为蜂蜜品质鉴定提供一套准确、灵敏、高效的方法,为蜂蜜的食品安全检测开拓新的思路。
1 材料与方法
1.1 材料和试剂
蜜蜂在中国计量大学校园内饲养;铁氰化钾、亚铁氰化钾、氯化钾等,均购自生工生物工程(上海)有限公司;成熟蜂蜜为新疆北屯新原养蜂农民专业合作社提供,市售蜂蜜和果葡糖浆购自附近超市,其中糖浆中果糖含量不低于55%。上述成熟蜂蜜编号为H0,4 种市售蜂蜜分别编号H1、H2、H3、H4,果葡糖浆编号为F55。
1.2 仪器与设备
CHI660E 电化学工作站,三电极系统:玻碳电极(D=3 mm)、银/氯化银电极(KCl,c=3 mol/L)、铂丝对电极(D=0.5 mm,L=35 mm),购自上海辰华仪器有限公司;德国IKAC-MAGHS 4 恒温加热磁力搅拌器,购自艾卡(广州)仪器设备有限公司(IKA,中国)。
1.3 试验方法
1.3.1 蜜蜂组织传感器制备
1.3.1.1 解剖蜜蜂口器组织 用吸蜂器在蜂箱出入口处吸取供试采集蜂(工蜂),置于试管并存放于-20 ℃环境2 min,低温冻晕蜜蜂。将晕厥的蜜蜂置于解剖镜下,借助解剖工具取下口器组织,并用生理盐水冲洗。
1.3.1.2 口器组织修饰玻碳电极 用0.05 μm 氧化铝粉末打磨玻碳电极,并使用Microcloth 抛光布抛光。打磨抛光前使用湿润的擦镜纸轻拭电极表面,防止污垢颗粒干扰打磨效果。采用黏性材料将口器组织的一端固定于电极绝缘材料部分,保证口器组织与玻碳电极充分接触,去离子水淋洗后备用。
1.3.2 循环伏安法测试
1.3.2.1 测试口器组织修饰前后的电极 配制测试底液(铁氰化钾/亚铁氰化钾/氯化钾:0.001/0.001/0.1 mol/L)。使用三电极系统、电化学工作站,采用循环伏安对电极、修饰电极进行扫描测试。操作参数:扫描电压范围-0.3~0.8V,初始扫描极性为负,扫描段数为2,扫描速率30 mV/s。氧化峰电压记为EpA1,氧化峰电流记为IpA1,还原峰电压记为EpC1,还原峰电流记为IpC1。
1.3.2.2 循环伏安法检测样品 利用制备的蜜蜂组织传感器对不同种类的蜂蜜样品溶液进行检测。取适量蜂蜜H0,使用测试底液将其稀释备用,最终质量浓度分别为0.02,0.04,0.06,0.08,0.01,0.12,0.14,0.16,0.18,0.2 g/mL。其它测试样品进行同样的操作。试验温度条件控制在(22±1)℃,每个质量浓度进行3 次重复扫描。每个组织传感器采用1 只蜜蜂口器构建,试验中采用5 个生物学重复的传感器对每种样品重复进行试验。
1.4 数据分析
利用CHI660E 软件将测试数据转换为文本数据,导入Microsoft Excel 2016 软件统计,计算出峰值电流变化比:
式中:ΔI——峰值电流变化比;I0——质量浓度为0.02 g/mL 时的峰值电流,μA;I——质量浓度增加后的峰值电流,μA。数据以重复试验的平均数表示,使用Origin 对循环伏安曲线进行拟合,采用Prism 8.3 软件进行单因素方差分析(P<0.05)。
2 结果与分析
2.1 制备蜜蜂口器组织传感器并表征
以玻碳电极为工作电极,用蜜蜂下唇须活体组织进行修饰,对其检测性能进行测试,检测结果如图1a。虚线为蜜蜂口器组织修饰前玻碳电极的循环伏安曲线,黑色曲线为修饰后玻碳电极的循环伏安曲线。检测环境中,正向扫描时出现氧化峰A1,负向扫描时出现还原峰C1[19],即检测底液中的电极表面发生氧化还原过程。当口器组织修饰工作电极后,工作电极表面的导电特性发生改变,氧化峰电流IpA1 值略小于IpC1,二者均由(6.43±0.02)μA 降低至(6.09±0.02)μA,经过多次重复测定,IpA1、IpC1 值稳定,这种导电特性在整个检测过程中是稳定的且能长久存在,对EpA1、EpC1、EpA1、IpC1 无显著影响。因此,用这种修饰过的工作电极(即蜜蜂口器组织传感器)来检测蜂蜜样品是可行的。

图1 蜜蜂口器组织传感器与蜂蜜样品的循环伏安图
Fig.1 Cyclic voltammograms of bee mouthpart tissue sensors and honey samples
注:(a)图中A1 是氧化峰,对应的峰电流和峰电位分别为IpA1 和EpA1;C1 是还原峰,对应的峰电流和峰电位分别IpC1 和EpC1;(b)图箭头所指为浓度从小到大分别为0.02,0.04,0.06,0.08,0.1,0.12,0.14,0.16,0.18,0.2 g/mL 共10 个梯度。
2.2 蜜蜂口器组织传感器检测样品
蜜蜂口器组织传感器检测10 个质量浓度梯度(0.02,0.04,0.06,0.08,0.01,0.12,0.14,0.16,0.18,0.2 g/mL)的H0 样品溶液,利用CHI660E 采集记录循环伏安检测图,如图1b 所示。氧化峰、还原峰峰值电压分别为:EpA1,(0.171±0.006)V;EpC1,(0.238±0.004)V。H0 样品不同质量浓度的检测结果中,氧化峰、还原峰的峰值电流见表1。工作电极表面具有生物活性的口器组织对不同质量浓度的H0 样品发生不同程度的识别作用,表现为循环伏安图中峰电流的变化[20]。由图1b,随样品质量浓度的增加,电流峰值呈现一定的下降规律。电流峰值的梯度下降反映了H0 蜂蜜的质量浓度,且随着蜂蜜含量的增大,电流峰值即传感器的响应信号逐渐降低,这说明质量浓度越大,口器组织对蜂蜜成分的结合作用越明显,对电极表面的导电特性影响越大,因此能够将电流峰值作为传感器的响应信号表征蜂蜜质量浓度,甚至蜂蜜的种类。但是,这种作用和影响并不会无限增加,因为口器组织的表面受体结合物质的能力有限,并且具有一定的活性时间限制[21-22],检测结果中表现为峰电流下降的梯度逐渐减小。
表1 H0 样品10 个质量浓度梯度对应的氧化峰、还原峰峰值电流
Table 1 Peak current of oxidation peak and reduction peak corresponding to 10 mass concentration gradients of H0
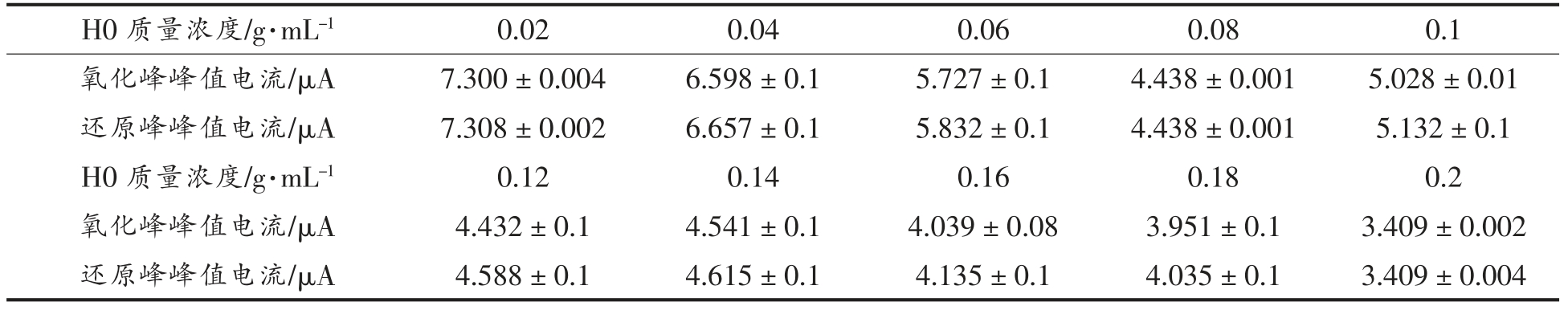
H0 质量浓度/g·mL-1 0.02 0.04 0.06 0.08 0.1氧化峰峰值电流/μA 7.300±0.004 6.598±0.1 5.727±0.1 4.438±0.001 5.028±0.01还原峰峰值电流/μA 7.308±0.002 6.657±0.1 5.832±0.1 4.438±0.001 5.132±0.1 H0 质量浓度/g·mL-1 0.12 0.14 0.16 0.18 0.2氧化峰峰值电流/μA 4.432±0.1 4.541±0.1 4.039±0.08 3.951±0.1 3.409±0.002还原峰峰值电流/μA 4.588±0.1 4.615±0.1 4.135±0.1 4.035±0.1 3.409±0.004?
2.3 构建样品检测线性回归分析模型
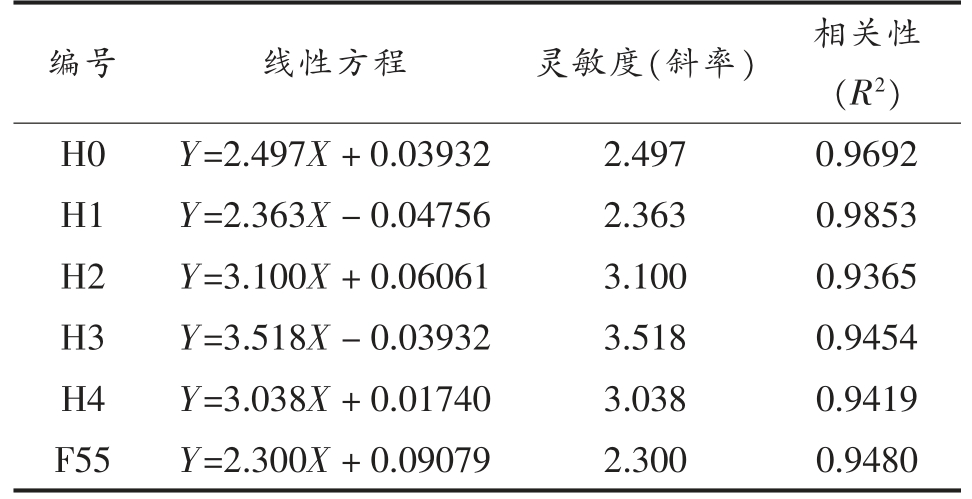
各蜂蜜样品的质量浓度与峰值电流变化比具有高度相关性。利用蜜蜂口器组织传感器检测5种蜂蜜样品和1 种果葡糖浆,电化学工作站采集记录循环伏安图,提取每种样品各质量浓度时的峰值电流Ip,计算ΔI,即获得ΔI 与质量浓度的线性回归曲线(图2)和回归模型(表2)。如表2所示,6 种样品的相关系数均在0.9365~0.9853 之间;灵敏度即线性分析的斜率在2.363~3.518 之间;与果葡糖浆F55 相比(相关性和灵敏度分别为0.9480 和2.300),成熟蜜H0 均显示出较高的灵敏度和线性相关性(分别为0.9692 和2.497),表明本研究开发的传感器对成熟蜜质量浓度的变化更为敏感。对于商超蜂蜜样品,本传感器对H1 的灵敏度最低,而对H2、H3、H4 的灵敏度均超过3.0(表2),也具有较高的灵敏度。
表2 各样品线性回归方程及灵敏度和相关性参数
Table 2 Linear regression equation,sensitivity and correlation parameters for each sample
?

图2 各样品峰值电流变化比与质量浓度的线性回归曲线
Fig.2 Linear regression curve of peak current change
ratio and mass concentration of each sample
H0 是由蜂农合作社提供的成熟蜂蜜,未经过浓缩和加工,而商超蜂蜜由于原料浓度低而大都需要浓缩加工,其营养成分及糖含量与成熟蜜存在一定差异,该生物传感器在与各样品结合过程中能够基本分辨出成熟蜜与糖浆的区别,然而并不能区别商超的浓缩蜜。Wang 等[9]利用高效液相色谱通过建立纯蜂蜜特征峰来区分糖浆以及商超蜂蜜,提高了蜂蜜检测的准确度,但仅能区分C4淀粉糖浆。汤明杰等[19]利用电化学技术采集3 种蜜源蜂蜜的电化学响应信号检测蜂蜜,预测模型的相关性为0.9392,相对低于本研究的检测模型。初步认为该传感器峰值电流变化比能够一定程度上反映检测样品的质量浓度变化,但是从灵敏度上对于分辨不同品质的蜂蜜仍有一定的欠缺。
2.4 确定辨别的最佳质量浓度区间
在各质量浓度下,对获得的不同样品的峰电流变化比,进行单因素方差分析(P<0.05),并根据显著性差异来判断该传感器辨别不同蜂蜜时的最佳质量浓度。如图3所示,在质量浓度为0.04~0.08 g/mL 时(图3a、3b、3c),传感器对6 个样品的峰值电流变化比之间差异性并不显著,可以将H0和H1、H3、H4 区别开来,而与其它不能区分,检测区分能力较弱;在质量浓度为0.1~0.14 g/mL 时(图3d、3e、3f),根据峰值电流变化比的差异性可以将6 种样品分为3 类,明显区分出H0、H1、H2蜂蜜,H3、H4、F55 蜂蜜样品辨别结果不明确;在质量浓度为0.16~0.2 g/mL 时(图3g、3h、3i),H0、H1、H2、H3 的峰值电流变化比之间具有显著性差异,表明在该质量浓度范围内,传感器能够通过电流变化比将4 种蜂蜜辨别出来,而H0 和F55 未体现出显著性差异。0.16 g/mL 和0.18 g/mL 时(图3g、3h),差异性分析结果一致,H4 和H3 检测结果一致,F55 和H0 检测结果一致;0.2 g/mL 时(图3i),H4、F55 与H0 的ΔI 未体现出显著性差异。该结果可能是由于随着蜂蜜质量浓度的升高,蜂蜜中的特殊成分(如酮类、酚类、维生素等营养物质)在结合过程中的比重逐渐增大,并占据主导作用[22],有效地将H0~H3 蜂蜜区分开来。在0.16~0.18 g/mL 时(图3g、3h),H4 与H2 检测结果仍然无显著差异,推测两种蜂蜜来自同一蜜源的可能性更大;而F55 与H0 的检测结果同样无显著差异,该浓度范围内难以区分果葡糖浆和成熟蜜,但是,在质量浓度0.08~0.1 g/mL 范围时(图3c、3d),二者的峰电流变化比具有显著差异,能够被明显且稳定区分开来,且质量浓度为0.14 g/mL 时(图3f),二者表现为显著差异,但浓度邻域内情况不明确。综上所述,该传感器辨别蜂蜜的最佳质量浓度区间是0.16~0.18 g/mL,辨别果葡糖浆和蜂蜜的最佳质量浓度区间可能为0.08~0.1 g/mL。
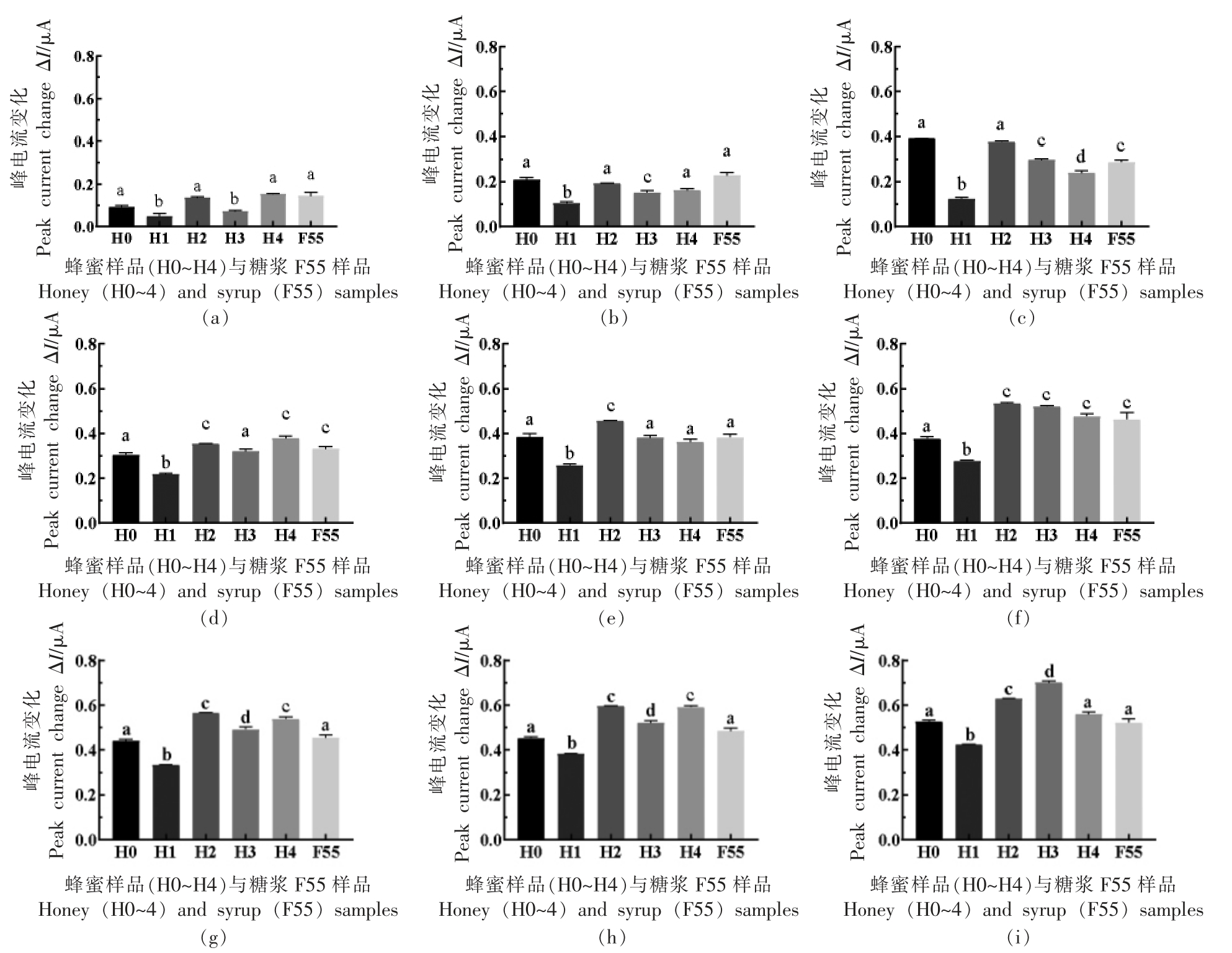
图3 相同质量浓度下6 种蜂蜜样品的峰电流变化比显著性分析结果
Fig.3 Results of significance analysis of the peak current change ratio of the 6 honey samples at the same mass concentration
注:单因素方差分析(P<0.05),小写字母表示5%显著水平;a~i 对应的样品质量浓度分别为0.04,0.06,0.08,0.1,0.12,0.14,0.16,0.18,0.2 g/mL。
2.5 模型及最佳区分浓度区间检测验证
蜜蜂口器组织传感器检测样品实际测量电流峰值变化比与传感器线性回归模型计算出的峰值电流变化比的对比,如图4所示。柱状图的高度体现峰值电流变化比的情况下,质量浓度为0.16 g/mL(图4a)时,实际测量值和模型计算值基本一致,最高相差0.043;质量浓度为0.18 g/mL(图4b)时,实测变化比与模型计算变化比稍有差距,但整体保持一致,最高相差0.066,重复试验验证结果表明在最佳辨别质量浓度区间中,传感器的线性检测模型具有较好的稳定性和可靠性。分别对样品质量浓度为0.16,0.18 g/mL 的实际测量结果进行显著性分析(P<0.05),结果与2.4 节保持一致,能够稳定区分H0、H1、H2、H3 4 种蜂蜜,表明0.16~0.18 g/mL 确为最佳辨别质量浓度区间,并且该质量浓度区间内区分能力具有很好的稳定性。在成熟蜜与果葡糖浆的最佳辨别质量浓度验证中,实际测量值的显著性分析结果仍然表现为显著性差异,表明在质量浓度区间确能稳定区分二者。但是,0.08 g/mL(图4c)时,成熟蜜的测量变化比高于模型计算变化比约0.147,果葡糖浆的变化比基本不变;0.1 g/mL(图4d)时,成熟蜜的测量变化比高于模型计算变化比约0.015,果葡糖浆的测量变化比高于模型计算变化比约0.047,推测在质量浓度0.08~0.1 g/mL 区间内,检测浓度越靠近中间区域,模型对二者区分的有效性和稳定性越好,即传感器对二者的辨别能力最优。
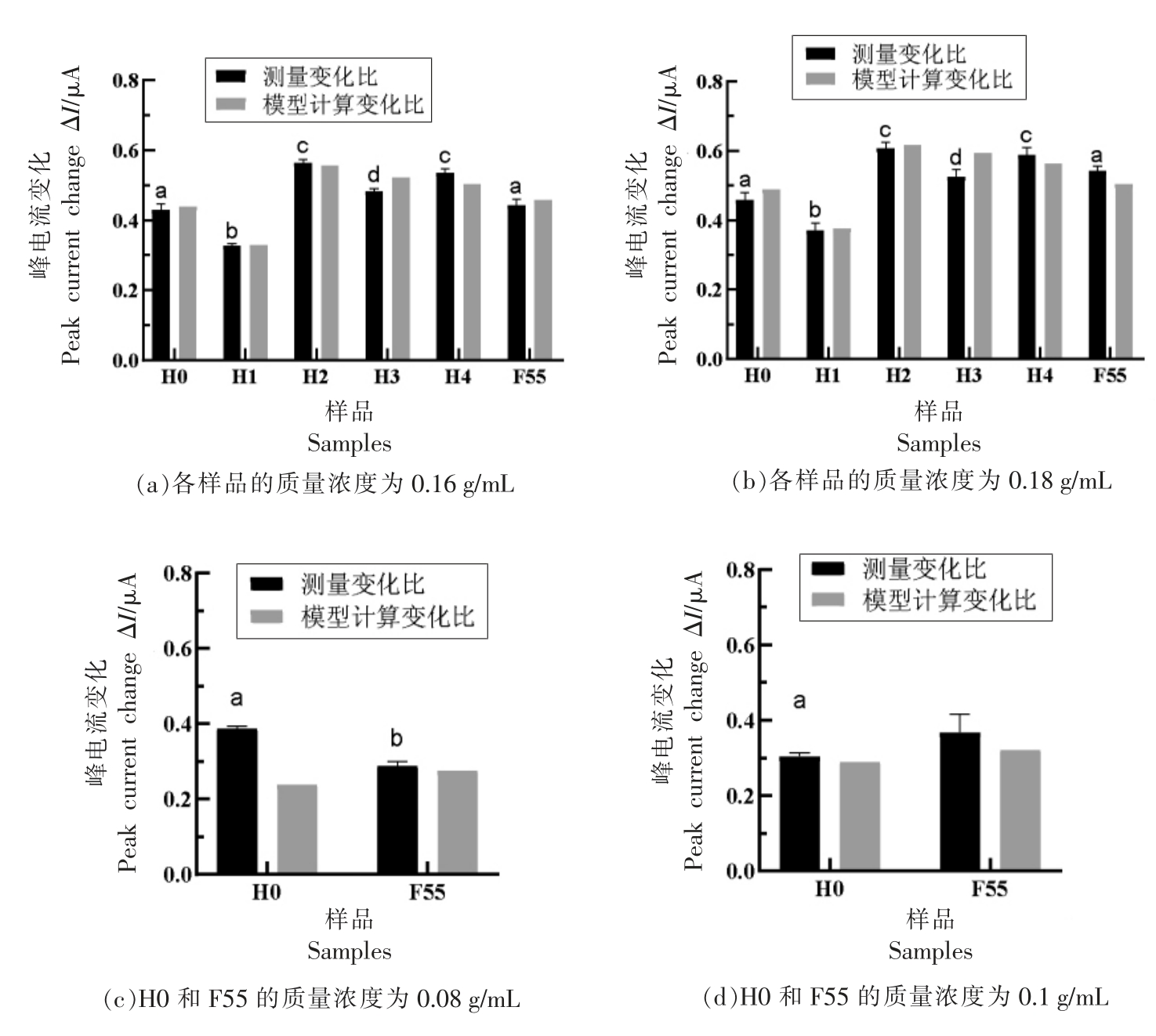
图4 最佳辨别质量浓度下传感器实际测量变化比与模型计算变化比对比图
Fig.4 Comparison of the actual detected change ratio of the sensor and the calculated change ratio of the model at the best identification mass concentration
3 结论
利用蜜蜂口器组织修饰玻碳电极,成功制备了一种味觉组织生物传感器,采用循环伏安法结合线性回归分析模型可以辨别不同蜂蜜样品。结果表明,利用该味觉组织传感器检测信号的线性模型能够稳定且可靠地区分不同品质蜂蜜或糖浆,且辨别成熟蜜和商超蜂蜜的最佳质量浓度区间为0.16~0.18 g/mL,辨别成熟蜜和果葡糖浆的最佳质量浓度区间为0.08~0.1 g/mL。本研究构建的味觉组织传感器能够用于蜂蜜检测,为蜂蜜品质鉴定提供了一项新的解决方案,为不同品质蜂蜜的仪器辨别提供了新的思路。
[1]中华人民共和国卫生部.食品安全国家标准蜂蜜:GB14963-2011[S].北京:中国标准出版社,2012:1.
Ministry of Health of the People's Republic of China.National Food Safety Standard Honey:GB 14963-2011[S].Beijing:China Standard Press,2012:1.
[2]中华全国供销合作总社全国蜂产品标准化技术委员会.蜂蜜:GH/T18796-2012[S].中华人民共和国供销合作总社,2013:1.
All China Federation of Supply and Marketing Cooperatives National Bee Product Standardization Technical Committee.Honey:GH/T18796-2012[S].Federation of Supply and Marketing Cooperatives of the People's Republic of China,2013:1.
[3]Codex Alimentarius International Food Standards,Codex standard for honey:CXS 12-2019[S].Office Journal of the European Communities,2020:1.
[4]樊永华,许辉.蜂蜜的营养及药用价值[J].科技,经济,市场,2015,10:115-116.
FAN Y H,XU H.Nutritional and medicinal value of honey [J].Science and Technology,Economy,Market,2015,10:115-116.
[5]高庆菊.蜂蜜的营养与保健[J].中国保健食品,2002,15(6):18.
GAO Q J.Nutrition and health care of honey[J].China Health Food,2002,15(6):18.
[6]中国药典委员会.中华人民共和国药典[M].北京:中国医药科技出版社,2020:571.
Chinese Pharmacopoeia Commission.Pharmacopoeia of the People's Republic of China[M].Beijing:China Pharmaceutical Science and Technology Press,2020:571.
[7]周萍,钱志来,胡福良,等.浅谈蜂蜜质量控制指标制定及质量控制措施[J].中国蜂业,2011(Z8):55-58.
ZHOU P,QIAN Z L,HU F L,et al.Talking about the formulation of honey quality control indicators and quality control measures[J].China Bee Industry,2011(Z8):55-58.
[8]张一帆,陈启,崔宗岩,等.蜂蜜真伪鉴别和检测技术研究进展[J].浙江大学学报(农业与生命科学版),2018,44(6):649-658.
ZHANG Y F,CHEN Q,CUI Z Y,et al.Research progress in authenticity identification and detection technology of honey[J].Journal of Zhejiang University(Agric.& Life Sci.),2018,44(6):649-658.
[9]WANG S,GUO Q,WANG L,et al.Detection of honey adulteration with starch syrup by high performance liquid chromatography [J].Food Chemistry,2015,172(1):669-674.
[10]RUIZ-MATUTE A I,SORIA A C,MARTÍNEZCASTRO I,et al.A new methodology based on GC-MS to detect honey adulteration with commercial syrups[J].Journal of Agricultural and Food Chemistry,2007,55(18):7264-7269.
[11]屠振华,朱大洲,籍保平,等.红外光谱技术在蜂蜜质量检测中的研究进展[J].光谱学与光谱分析,2010,30(11):93-97.
TU Z H,ZHU D Z,JI B P,et al.Progress in quality analysis of honey be infrared spectroscopy[J].Spectroscopy and Spectral Analysis,2010,30(11):93-97.
[12]SOUZA-KRULISKI C R D,DUCATTI C,FILHO W G V,et al.A study of adulteration in brazilian honeys by carbon isotope ratio[J].Ciência E Agrotecnologia,2010,34(2):434-439.
[13]GULER A,BAKAN A,NISBET C,et al.Determination of important biochemical properties of honey to discriminate pure and adulterated honey with sucrose(Saccharum officinarum L.) syrup[J].Food Chemistry,2007,105(3):1119-1125.
[14]JUNG J W,PARK K W,AHN Y J,et al.Functional characterization of sugar receptors in the western honeybee,Apis mellifera[J].Journal of Asia-Pacific Entomology,2015,18(1):19-26.
[15]SIMCOCK N K,WAKELING L A,FORD D,et al.Effects of age and nutritional state on the expression of gustatory receptors in the honeybee(Apis mellifera)[J].PLoS One,2017,12(4):e0175158.
[16]SIMCOCK N K.The expression and function of gustatory receptors in the honeybee(Apis mellifera)[D].Newcastle:Faculty of Medical Sciences,Newcastle University,2015.
[17]SANDERSON C E,COOK P,HILL P S M,et al.Nectar quality perception by honey bees(Apis mellifera ligustica)[J].Journal of Comparative Psychology,2013,127(4):341-351
[18]南安普敦电化学小组.电化学中的仪器方法[M].复旦大学出版社,1992:202-208.
Southampton Electrochemistry Group.Instrumental Methods in Electrochemistry [M].Fudan University Press,1992:202-208.
[19]汤明杰,蔡健荣,吴小娟,等.蜂蜜还原能力的电化学传感器检测[J].农业工程学报,2011,27(2):366-366.
TANG M J,CAI J R,WU X J,et al.Determination of reducing power of honey by electrochemical sensor[J].Transactions of the CSAE,2011,27(2):366-366.
[20]刘怡,陈珍珍,方旭东,等.基于微纳敏感材料的蜂蜜种类区分方法研究[J].传感技术学报,2020,33(3):370-374.
LIU Y,CHEN Z Z,FANG X D,et al.Study of honey species discrimination based on micro/nano sensing material[J].Chinese Journal of Sensors and Actuators,2020,33(3):370-374.
[21]宋轶琳,林楠森,刘春秀,等.用于离体组织电生理检测的微电极阵列传感器研究:中国微米纳米技术学会年会论文集[C].哈尔滨,2009.
SONG Y L,LIN N S,LIU C X,et al.Research on microelectrode array sensors for electrophysiological detection of in vitro tissue:Proceedings of the annual meeting of the Chinese society for micron and nanotechnology[C].Harbin,2009.
[22]庞广昌,陈庆森,胡志和,等.味觉受体及其对食品功能评价的应用潜力[J].食品科学,2016,37(3):217-228.
PANG G C,CHEN Q S,HU Z H,et al.Odorant and taste receptors and their potential applications in evaluation of functional foods[J].Food Science,2016,37(3):217-228.