多糖、蛋白质等亲水胶体是食品中典型的天然高分子,具有生物相容性、生物活性高、环境友好、生物可降解、无毒等诸多优点,在食品、化妆品、医学材料、包装材料等领域应用广泛。与一般高分子体系相同,在高浓度、强相互作用等热力学不相容条件下,多糖、蛋白质等食品亲水胶体混合体系会发生相分离[1-3]。利用天然高分子混合体系的相分离,可丰富材料微结构[4-5],改善食品物料营养特性[6]、荷载活性成分[7-10],设计食品物理特性[11],是食品物性学的重要研究内容。
水/水乳液是一种基于高分子相分离而形成的新型胶体分散体系,由两个或两个以上的热力学不相容的亲水大分子形成的不混溶的内、外相均为水相的分散体系[1-4]。水/水乳液是一种“双水相体系”,也称为相分离的海岛,该海岛结构在自然界和食品体系中非常普遍[3]。水/水乳液在国际食品科学学术界获广泛认可,在国际期刊中被广泛报道,然而,相较于传统的水包油或油包水乳液,对水/水乳液研究较少,国内尚无相关的中文文献报道。本文综述食品亲水胶体水/水乳液的研究进展,重点介绍了水/水乳液的形成和稳定,以及其在食品中的应用,并展望其未来发展方向。
1 水/水乳液的形成机制与特性
1.1 水/水乳液的形成机制
相分离是形成水/水乳液的首要步骤和必备条件。根据亲水性高分子之间的斥力/吸引力不同,相分离可分为两种类型的相分离,即:隔离型相分离和结合型相分离(图1)。目前,水/水乳液的形成绝大多数是基于隔离型相分离[12]。隔离型相分离是两种带同种电荷或一种带电荷、一种不带电的天然高分子混合,在高分子间的静电排斥作用或空间排阻作用下,产生的一种相分离现象。如图1左侧所示,当混合浓度低于临界浓度时体系较稳定,混合物仍为单相,两种组分都在溶液中;当高于临界浓度时,体系发生隔离型相分离,两种组分在热力学平衡状态下分离为两个不混溶的水相,每相中富集了一种高分子,然而,每一富集相中并不是绝对的只存在一种高分子,也会含有少量另一种高分子[12]。隔离型相分离通常发生在热力学不相容的蛋白质/阴离子多糖、蛋白质/中性多糖等体系中[13]。Grinberg 等[3]列举出大约有100 种不同的蛋白质和多糖混合体系,可以导致隔离型相分离。
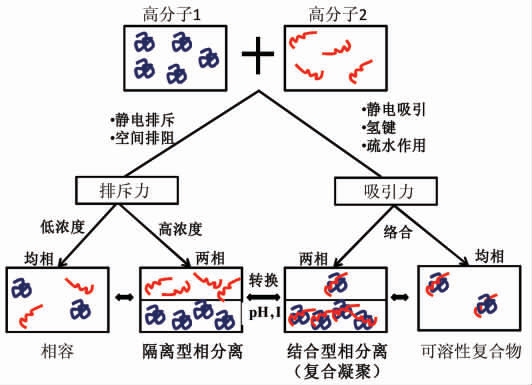
图1 高分子混合体系的相行为[12]
Fig.1 Phase behaviors of macromolecule mixture systems[12]
如图2所示,当两个或两个以上热力学不相容的生物高分子在水溶液中混合时,生成不混溶的水-水两相。与油-水两相类似,搅拌后,水-水两相发生微观相分离,生成水/水乳液。其中,被分散的不连续相为内相,也叫分散相;连续相也称为外相[12]。目前研究较多的食品级水/水乳液有明胶-麦芽糊精、明胶-葡聚糖、明胶-羟丙基甲基纤维素、明胶-淀粉等体系[13]。

图2 水/水乳液的形成[12]
Fig.2 Formation of water-in-water emulsions[12]
1.2 水/水乳液的影响因素
高分子浓度是影响水/水乳液相行为的第1要素。水/水乳液在较低的高分子浓度下出现均相,在较高的高分子浓度下会出现两相,这是由于稀溶液中有大量的自由空间可供高分子占据,随着高分子浓度的增加,可利用的自由空间减少,使得高分子之间表现出排斥作用。两个高分子中浓度较大的高分子容易形成外相,当两者浓度相近时容易形成双连续相。以明胶-麦芽糊精混合体系为例,3% 明胶-20% 麦芽糊精混合体系形成“明胶/麦芽糊精”乳液,12% 明胶-6% 麦芽糊精混合体系形成“麦芽糊精/明胶”乳液,6%明胶/9%麦芽糊精混合体系形成双连续乳液[14-15]。
离子强度(盐浓度)通过屏蔽带电高分子间的排斥作用而促进水/水乳液的形成。Lundin 等[2]发现当NaCl 浓度从100 mmol/L 降至0 mmol/L 时,带电明胶与中性麦芽糊精的相容性增加。Antonov等[16]研究表明NaCl 浓度从250 mmol/L 降到80 mmol/L 时,酪蛋白-瓜尔豆胶体系的相容性显著增加。Edelman 等[17]研究表明向明胶-葡聚糖体系中添加适量浓度的NaCl(>10 mmol/L)有利于水/水乳液的形成。Moschakis 等[18]研究发现与不添加NaCl 的体系相比,添加300 mmol/L NaCl 的酪蛋白酸钠-刺槐豆胶体系形成水/水乳液更加明显且迅速,表明NaCl 的加入提高了两种生物高分子间的热力学不相容性。
pH 值通过控制高分子的电荷分布而影响水/水乳液的形成。一般来说,高分子的净电荷量越高,形成水/水乳液的趋势越低。对于蛋白质-多糖体系,蛋白质的自聚集特性可影响连续相的形成,蛋白质自聚集特性在等电点处最强,其随pH 值远离等电点(蛋白质净电荷增加)而降低。Antonov[16]等研究了酪蛋白-瓜尔豆胶混合体系,结果表明随着体系pH 值的增加(6.86~9.50),远离酪蛋白的等电点(pI=4.6),酪蛋白随之解离,两种生物高分子的相容性显著增加。Ji 等[19]研究不同pH 值(3.00,4.10,4.50,4.75,5.00,7.00,9.00) 下的A 型明胶-羟丙基甲基纤维素混合体系,当pH≤4.50时,形成“A 型明胶/羟丙基甲基纤维素”乳液;当pH=4.75 时,形成双连续相;当pH≥5.00 时,形成“羟丙基甲基纤维素/A 型明胶”乳液,这主要是因为在pH 值较高时(pH=7.00~9.00),接近明胶的等电点(pI=8.6),由于弱的静电斥力,使明胶分子相互聚集,形成三螺旋网络的可能性增大,稳定的三螺旋网络使明胶具有较高的凝胶速率而形成连续相。
温度是影响水/水乳液形成的另一重要因素。降低温度,可减少混合熵对整体热力学稳定性的影响,有利于形成稳定的水/水乳液。Lundin 等[2]研究发现随着温度的降低(60~25 ℃),明胶-葡聚糖混合体系的不相容性增加,且凝胶化过程没有阻碍相分离,因此,可通过将混合物迅速冷却到不同末端温度来控制凝胶化速率,获得稳定的水/水乳液结构。Edelman 等[17]发现在高于明胶的胶凝温度(40~80 ℃)时,明胶-葡聚糖体系的相组成基本没有温度依赖性,其形成水/水乳液的生物高分子总浓度几乎不受温度影响。
1.3 水/水乳液的特性
水/水乳液的突出特征是界面张力低、界面厚度大且极不稳定。首先,水/水乳液的界面张力比油和水之间的界面张力小3~6 个数量级[20],常低于10-2mN/m,且在临界点附近达到极低值,几乎为零。研究者常采用改进的液滴回缩法、旋滴法、流变光学法等测定水/水乳液的界面张力,其中测得明胶-葡聚糖体系在临界点处的界面张力值为0[21],明胶-阿拉伯胶体系在临界点附近的界面张力低至10-3 mN/m[22],酪蛋白酸钠-海藻酸钠体系接近临界点的界面张力为10-5 mN/m[23],葡聚糖-聚乙二醇体系的界面张力仅为0.07 mN/m,在临界点附近甚至更低[24]。此外,在水/水乳液中,两相之间的界面定义不清,界面厚度大,从理论上计算为几十纳米[25]到几百纳米[26]。由于小分子表面活性剂的分子长度明显小于水-水界面的厚度,因此传统表面活性剂分子不能通过两亲基团横跨界面来稳定水/水乳液[20]。稳定性差是水/水乳液实际应用的主要困难。
1.4 典型水/水乳液体系
表1归纳总结了典型的天然高分子水/水乳液,其中研究最多的是蛋白-多糖混合体系,如明胶-葡聚糖[17,22,25,27]、明胶-麦芽糊精[2,15,28-29]等,而多糖-多糖混合体系研究较少,目前报道的体系有蜡质玉米淀粉-刺槐豆胶[30-31]、支链淀粉-木葡聚糖等[32-33]。水/水乳液体系不仅存在于天然高分子混合体系中,在合成高分子体系中同样广泛存在,如葡聚糖-聚乙二醇体系[20,34-35]、葡聚糖-聚环氧乙烷[36-38]等,是目前水/水乳液研究最多的两种合成高分子-多糖混合体系。
表1 典型天然高分子水/水乳液
Table 1 Typical water-in-water emulsions based on natural macromolecules

体系 水/水乳液形成条件 研究进展蛋白-多糖混合体系明胶(GE)-葡聚糖(DE) 1) 2.5% GE+2.0% DE、60℃、pH=8.5、500 mmol/LNaI 2) 3%GEA+9% DE(GEA in DE)、60 ℃、pH=6.2、5 mmol/L NaCl 3) 8% GEA+4% DE(DE in GEA)、60 ℃、pH=5.6;4) 5% GE+5% DE、60 ℃、pH=6、100 mmol/L NaCl 1) 利用旋光法构造相图,采用纺丝滴法测定水/水乳液界面张力随临界点的变化[22]2) 研究六角三水铝石纳米板对水/水乳液稳定性的影响[25]3) 研究玉米醇溶蛋白颗粒与GE 和DE 之间的相互作用,以及颗粒在水-水界面之间的相互作用[27]4) 研究GE-DE 体系在高于凝胶化温度的组成相图[17]明胶(GE)-麦芽糖糊精(MD)1) 6.1% GEA+ 6.9% MD(MD in GEA),4.9% GEA+ 7.3% MD(双连续相)、80 ℃、pH=7 2) 3% GEB + 20% MD(GEB in MD),6%GEB+ 9% MD(双连续相),12% GEB+ 6%MD(MD in GEB)、50 ℃、pH=5;3) 6% GEA + 6% MD(MD in GEA)、40℃、自然pH 值4) 4.5%GE+2.25%MD、60 ℃、100 mmol/L NaCI、自然pH 值1) 研究在交联GE-MD 相分离水凝胶中不同分子质量荧光标记物的溶胀和释放行为[28]2) 研究交联明胶微凝胶作为载体来运载β-半乳糖苷酶[15]3) 研究单细胞微生物对GE-MD 相分离水凝胶的微观结构和流变特性的影响[29]4) 通过研究GE-MD 等混合体系的相行为阐述混合生物高分子相分离的应用与机理[2]明 胶(GE)-阿 拉 伯 胶(GA)利用旋光法构造了相图,采用纺丝滴法测定水/水乳液界面张力随临界点的变化[22]明 胶(GEB)-氧 化 淀 粉(OS)0.3%GE+0.4%GA、60 ℃、pH=8.5、500 mmol/L NaI研究聚苯乙烯乳胶颗粒在GEB-OS 乳液中的分布情况以及对该体系微观结构演变的影响[39]明胶(GEB)-羧甲基纤维素钠(NaCMC)7 % GEB+ 4% OS(OS in GEB)、40 ℃、pH=5.2、低离子强度1%NaCMC + 7.5% GEB(NaCMC in GEB)、60 ℃、pH=6.3~7.3利用GEB-NaCMC 乳液包埋益生菌及其活性的研究[40]
(续表1)
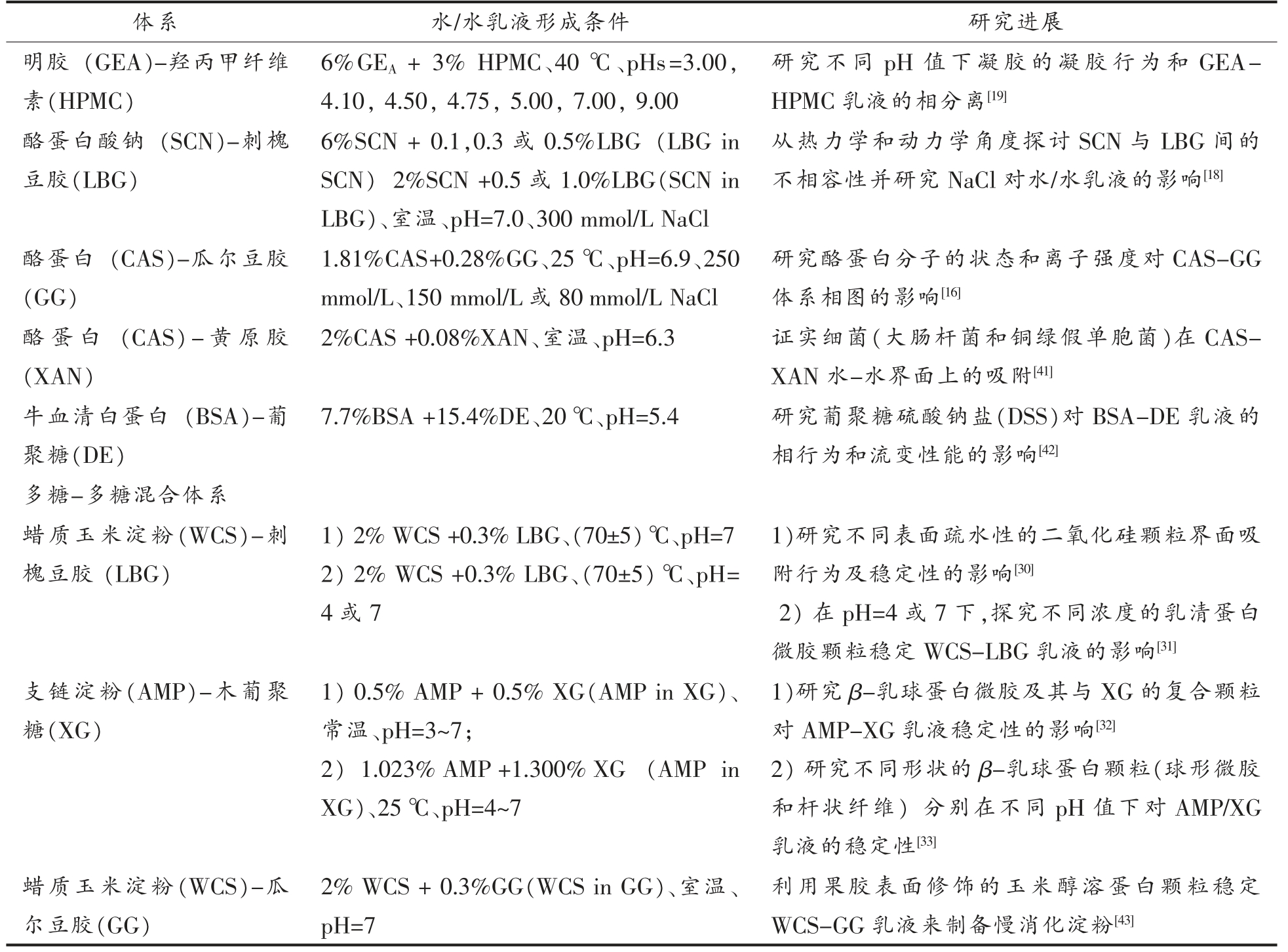
注:GEA 代表A 型明胶,GEB 代表B 型明胶,若为GE 则原文中没有指明是哪类明胶。
体系 水/水乳液形成条件 研究进展明胶(GEA)-羟丙甲纤维素(HPMC)研究不同pH 值下凝胶的凝胶行为和GEAHPMC 乳液的相分离[19]酪蛋白酸钠(SCN)-刺槐豆胶(LBG)6%GEA + 3% HPMC、40 ℃、pHs=3.00,4.10,4.50,4.75,5.00,7.00,9.00 6%SCN + 0.1,0.3 或0.5%LBG(LBG in SCN) 2%SCN +0.5 或1.0%LBG(SCN in LBG)、室温、pH=7.0、300 mmol/L NaCl从热力学和动力学角度探讨SCN 与LBG 间的不相容性并研究NaCl 对水/水乳液的影响[18]酪蛋白(CAS)-瓜尔豆胶(GG)研究酪蛋白分子的状态和离子强度对CAS-GG体系相图的影响[16]酪 蛋 白(CAS)-黄 原 胶(XAN)1.81%CAS+0.28%GG、25 ℃、pH=6.9、250 mmol/L、150 mmol/L 或80 mmol/L NaCl 2%CAS +0.08%XAN、室温、pH=6.3 证实细菌(大肠杆菌和铜绿假单胞菌)在CASXAN 水-水界面上的吸附[41]牛血清白蛋白(BSA)-葡聚糖(DE)7.7%BSA +15.4%DE、20 ℃、pH=5.4 研究葡聚糖硫酸钠盐(DSS)对BSA-DE 乳液的相行为和流变性能的影响[42]多糖-多糖混合体系蜡质玉米淀粉(WCS)-刺槐豆胶(LBG)1)研究不同表面疏水性的二氧化硅颗粒界面吸附行为及稳定性的影响[30]2) 在pH=4 或7 下,探究不同浓度的乳清蛋白微胶颗粒稳定WCS-LBG 乳液的影响[31]支链淀粉(AMP)-木葡聚糖(XG)1) 2%WCS+0.3%LBG、(70±5)℃、pH=7 2) 2% WCS +0.3% LBG、(70±5)℃、pH=4 或7 1)研究β-乳球蛋白微胶及其与XG 的复合颗粒对AMP-XG 乳液稳定性的影响[32]2) 研究不同形状的β-乳球蛋白颗粒(球形微胶和杆状纤维) 分别在不同pH 值下对AMP/XG乳液的稳定性[33]蜡质玉米淀粉(WCS)-瓜尔豆胶(GG)1) 0.5% AMP + 0.5% XG(AMP in XG)、常温、pH=3~7;2) 1.023%AMP+1.300%XG(AMP in XG)、25 ℃、pH=4~7 2% WCS + 0.3%GG(WCS in GG)、室温、pH=7利用果胶表面修饰的玉米醇溶蛋白颗粒稳定WCS-GG 乳液来制备慢消化淀粉[43]
2 水/水乳液的稳定
水/水乳液界面张力低、界面厚度大且两相皆为水相,不能由传统表面活性剂分子来稳定[44],需要通过颗粒、嵌段化合物、聚电解质等特殊物质进行稳定。
2.1 颗粒稳定水/水乳液的机理
皮克林颗粒吸附是目前水/水乳液稳定的主要策略。皮克林颗粒是一种可替代小分子表面活性剂的乳化剂和稳定剂[45],可吸附到界面上降低界面自由能而稳定水/水乳液。近年来,颗粒稳定水/水乳液受到越来越多的关注。如表2所示,已报道的皮克林颗粒包括:1) 玉米醇溶蛋白(zein)、β-乳球蛋白、乳清蛋白、二氧化硅、聚苯乙烯、羧酸盐、聚多巴胺等组分形成的球形颗粒;2)纤维素纳米晶体、纤维素纳米棒、蛋白纳米纤维、无机材料层板等各向异性颗粒;3)蛋白微胶、油滴、脂质体等可变形颗粒;4)乳杆菌、酿酒酵母、螺旋藻、小球藻、大肠杆菌、铜绿假单胞菌等微生物。
表2 水/水乳液颗粒的稳定
Table 2 Stabilization of water-in-water emulsions with different particles

?水/水乳液 皮克林颗粒葡聚糖(DE)-聚环氧乙烷(PEO) 1) 乳胶颗粒[34]2) β-乳球蛋白颗粒[35]3) 聚(丙烯酸乙酯-甲基丙烯酸-1,4 丁二醇二丙酸酯)微胶颗粒[20]4) 3 种β-乳球蛋白聚集体(蛋白纤维、微胶、无定形聚集体)[48-49]5) 纤维素纳米晶体[47]6) 纤维素纳米棒[50]7) κ-卡拉胶或壳聚糖表面修饰的蛋白微胶颗粒[51]葡聚糖(DE)-聚乙二醇(PEG) 1) 蛋白纳米纤维[36]2) 席夫碱反应合成的甲氧基聚乙二醇-牛血清蛋白共轭颗粒[37]3) 聚丙交酯板[38]4) 羧酸盐乳胶颗粒[46]5) 聚多巴胺纳米颗粒[52]6) 脂质体[4]明胶(GE)-葡聚糖(DE) 1) 六角三水铝石板[25]2) 玉米醇溶蛋白颗粒[27]蜡质玉米淀粉(WCS)-刺槐豆胶(LBG) 1) 二氧化硅纳米颗粒[30]2) 乳清蛋白微胶[31]明胶(GE)-氧化淀粉(OS) 聚苯乙烯乳胶[39]酪蛋白酸钠(SCN)-黄原胶(XAN) 蛋白质表面修饰的油滴[53-54]支链淀粉(APM)-木葡聚糖(XG) 1) β-乳球蛋白微胶[33,55]2) β-乳球蛋白纤维[33]蜡质玉米淀粉(WCS)-瓜尔豆胶(GG) 果胶表面修饰的玉米醇溶蛋白(zein)颗粒[43]葡聚糖(DE)-甲基纤维素(MC) 脂肪颗粒、石英颗粒、乳清蛋白颗粒[56]普鲁兰多糖(Pu)-聚环氧乙烷(PEO) 蒙脱石板[57]酪蛋白(CAS)-黄原胶(XAN) 活菌(大肠杆菌和铜绿假单胞菌)[41]明胶(GE)-麦芽糖糊精(MD) 灭活单细胞微生物(乳杆菌、酿酒酵母、螺旋藻和小球藻)[29]
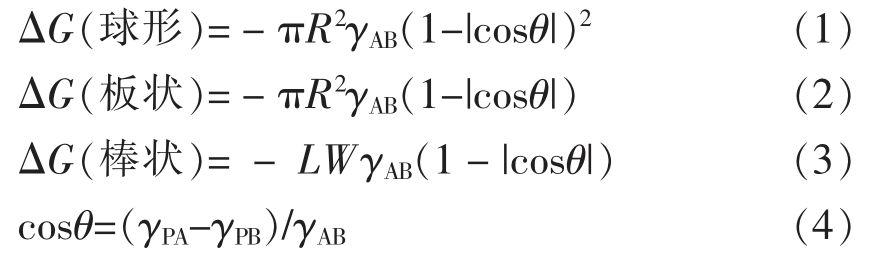
公式1 给出了半径为R 的单个球形颗粒吸附时的自由能变化,对于半径为R 的球形颗粒,占据的界面面积为πR2(1-|cosθ|)2,θ 为颗粒在界面的接触角,ΔG 等于界面面积的减少量乘以界面张力,γAB 指A、B 两相之间的界面张力。公式2 给出了半径为R 的板状颗粒吸附时的自由能变化。公式3 给出了长L、宽W 的棒状纳米晶体吸附时的自由能变化。由公式4 可知,接触角θ 由颗粒与相A(γPA)和相B(γPB)之间的界面张力差决定[44]。
若使一个粒子强吸附到液体界面上,自由能变化量(ΔG)要远大于动能(kT)。通常情况下,对于油-水界面上的纳米颗粒,只要(γPA-γPB)<γAB,ΔG 就会比kT 大几个数量级;而理想水/水乳液界面张力比油/水乳液低3~6 个数量级,且在由两相变成单相的临界点处接近0,很难满足条件ΔG 远大于kT。在实际颗粒稳定水/水乳液的体系中,只要颗粒足够大,混合物两相状态不接近临界点,ΔG 也可远大于kT。文献报道,在热力学不相容的高分子溶液界面上存在有效的粒子吸附[27,45]。
2.2 颗粒稳定水/水乳液的影响因素
2.2.1 颗粒的大小和形状 根据公式1,球形颗粒吸附的能量在很大程度上取决于颗粒的大小,并随半径R 的增大而增大。天然蛋白不能有效稳定水/水乳液,而蛋白颗粒和蛋白微胶的稳定效果较好。Nguyen 等[35]研究发现半径为100 nm 的蛋白颗粒有效吸附在水/水界面上,可持续数周稳定葡聚糖-聚环氧乙烷乳液,而天然蛋白由于粒径太小,因此不能通过皮克林效应稳定水/水乳液。Abbasi 等[46]比较了不同粒径的羧酸盐乳胶颗粒在“葡聚糖/聚环氧乙烷”乳液界面上的吸附情况,发现直径低于1 μm 的颗粒不能吸附在界面上,直径较大(d=10 μm)的颗粒比直径小的颗粒(d=6 μm)稳定水/水乳液的效果更好。Inam 等[38]研究发现,在低至0.3%的含量下,长度为1~10 μm、厚度约12 nm 的聚丙交酯板中,较大的层板比较小的层板能更好地稳定葡聚糖-聚乙二醇乳液,这是由于大层板对水/水界面的吸附力更强,使其脱离乳液界面更为困难。
板状、棒状等各向异性颗粒与具有相同体积分数的均质球形颗粒相比,覆盖水/水乳液的面积更大,所需浓度更低。纳米板厚度与水/水乳液界面厚度相当,横跨了大部分的中心界面区域,板状颗粒所覆盖的界面面积与吸附接触角无关。Vis 等[25]研究发现,有效直径为170 nm、厚度为7 nm 的六角三水铝石板可吸附在明胶-葡聚糖乳液的界面上,使乳液在数周内保持稳定。有报道[36]称蛋白纳米纤维的有效含量可低至0.025%,稳定葡聚糖-聚乙二醇乳液在30 d 以上,且蛋白形成的二维纳米纤维网络可赋予水/水乳液更好的稳定性和机械强度。Peddireddy 等[47]研究表明含量0.05%、平均尺寸为160 nm×6 nm×6 nm 的纤维素纳米晶体可在几个月内稳定葡聚糖-聚环氧乙烷乳液,且随纤维素纳米晶体浓度的增加,带电的纤维素纳米晶体之间产生静电排斥,使它们在界面彼此平行排列,粒子的表面覆盖率保持在50%左右。与之相比,球形蛋白颗粒稳定水/水乳液时,粒子的表面覆盖率在30%左右便达到饱和[35]。
2.2.2 颗粒的表面性质 界面颗粒的疏水性、表面基团、荷电性等表面特性影响颗粒的三相接触角大小及其对水/水乳液两相的亲和性,从而影响颗粒稳定水/水乳液的能力。
通过控制颗粒表面的化学基团可以改变其表面疏水性,从而影响颗粒对水/水乳液的稳定性。Murray 等 [30] 通过控制SiO2 表面的SiOH 基团含量,制备不同表面疏水性的SiO2 颗粒,探究其对糊化的蜡质玉米淀粉-刺槐豆胶混合体系相分离的影响,研究表明,随着颗粒疏水性和颗粒浓度的增加,大量颗粒在蜡质玉米淀粉相和两相间界面上的聚集增加,相分离的速度明显减弱,该水/水乳液的稳定性显著提高。蛋白微胶颗粒可有效稳定葡聚糖-聚环氧乙烷、蜡质玉米淀粉-刺槐豆胶、支链淀粉-木葡聚糖等各种高分子体系形成的水/水乳液,对离子强度和pH 值很敏感,可以制备pH响应性水/水乳液[31-33,48],然而,它们在等电点附近容易絮凝,显著降低了水/水界面稳定性。可利用带电多糖来修饰蛋白微胶形成稳定核壳颗粒,从而改善颗粒稳定水/水乳液的能力。Khemissi 等[51]探究了蛋白微胶颗粒吸附阴离子多糖(κ-卡拉胶)或阳离子多糖(壳聚糖)来改变蛋白颗粒的表面性质,从而稳定“葡聚糖/聚环氧乙烷”乳液,结果发现在低于和高于蛋白微胶等电点(PI=5.0) 时,即pH 4.5~6.5 范围,可以形成稳定的蛋白-多糖复合颗粒,该颗粒吸附在水/水界面上并亲和于聚环氧乙烷相,可有效稳定水/水乳液。
2.2.3 其它影响因素 当颗粒亲和于连续相时,有利于水/水乳液稳定[58]。颗粒与高分子之间的亲疏水性影响颗粒在水/水乳液两相间的分布。Firoozmand 等[39]发现在pH=5.2、低离子强度下,聚苯乙烯乳胶颗粒具有较低的表面净电荷和疏水性,在“氧化淀粉/明胶”乳液中,该乳胶颗粒亲和于连续相明胶相,可有效稳定水/水乳液。De freitas 等[32]探究了β-乳球蛋白微胶与木葡聚糖的结合来稳定“支链淀粉/木葡聚糖”乳液,研究发现在pH<5.5 时,木葡聚糖自发地与蛋白微胶结合,抑制蛋白微胶在等电点附近的大规模聚集,增加了蛋白微胶对木葡聚糖连续相的亲和力,因此蛋白微胶吸附到界面上而稳定了水/水乳液。Xue 等[37]以甲氧基聚乙二醇、乙醛和牛血清蛋白为原料,通过席夫碱反应制备 “甲氧基聚乙二醇-牛血清蛋白”共轭颗粒,有效增加了牛血清蛋白的疏水性,特别是(CH2CH2O)n 段增强了牛血清蛋白对连续相聚乙二醇相的亲和力,改变了牛血清蛋白颗粒亲和于葡聚糖分散相(θ=35.8°)的特性,最终“甲氧基聚乙二醇-牛血清蛋白”共轭颗粒很好地吸附在界面上(θ=91.6°)而稳定“葡聚糖/聚乙二醇”水/水乳液。
颗粒在水-水界面聚集形成网络,是颗粒稳定水/水乳液体系的一种常用机制。Hanazawa 等[53-54]研究发现在pH=6.4、[Ca2+]=22 mmol/L 时,向酪蛋白酸钠-黄原胶混合体系中添加酪蛋白酸钠包裹的油滴,“酪蛋白酸钠/黄原胶”水/水乳液的宏观相分离得到抑制,且半固体状态的油滴在水/水界面部分聚集形成较强的网络结构,有效稳定了水/水乳液。Ganley 等[57]研究发现蒙脱石板可吸附聚环氧乙烷形成随机取向的聚集物,在普鲁兰-聚环氧乙烷界面上形成一层坚固的粒子层,从而使“普鲁兰/聚环氧乙烷”乳液在数周内保持稳定。
2.3 其它稳定水/水乳液的方法
2.3.1 嵌段共聚物稳定水/水乳液 嵌段共聚物是一种可稳定水/水乳液的新型表面活性剂,其不同嵌段对两相及界面的亲和力不同。Buzza 等[24]报道了一种利用二嵌段和三嵌段共聚物稳定聚环氧乙烷-葡聚糖乳液的方法,他们以聚[(乙二醇)甲基丙烯酸甲醚](PEGMA,P)、聚(甲基丙烯酸正丁酯)(BuMA,B)和聚[2-(二甲基氨基)甲基丙烯酸乙酯](DMAEMA,D)合成了不同链长(p,b,d)的共聚物(Pp-Bb-Dd),其中,共聚物的两个亲水外链(P、D)对两相有不同的亲和性,由疏水中心链(B)连接。通过测定乳液在不同组分共聚物下的稳定性发现,在中性pH 值条件下,三嵌段共聚物可有效稳定“聚环氧乙烷/葡聚糖”和“葡聚糖/聚环氧乙烷”水/水乳液,另发现二嵌段共聚物(B-D)比大多数三嵌段共聚物(Pp-Bb-Dd)更有效。
最近,Pavlovic 等[59]提出一种温度触发可逆和可切换的嵌段共聚物稳定乳液的新方法,他们以聚(N,N-二甲基丙烯酰胺)-b-聚(N,N-二乙基丙烯酰胺)(PDMA-b-PDEA)为原料,合成具有热响应性PDEA 块的嵌段共聚物来稳定葡聚糖-聚乙二醇乳液。研究发现,当温度在云点(TCP)以上时,共聚物倾向于形成尺寸较大的胶束和超分子聚合体,可有效稳定水/水乳液;当温度降到TCP 以下时,该嵌段共聚物链处于卷曲状态,不能覆盖在水-水界面上,会导致乳液发生宏观相分离。
2.3.2 聚电解质稳定水/水乳液 聚电解质在水-水界面络合形成的静电大分子复合物也可能为水/水乳液的稳定提供一条新的途径。2016年,Tromp 等[60]构建了一个由中性聚合物A 和弱正电荷聚合物B 组成的模型系统,通过自洽场理论计算表明,当加入与聚合物A 的化学成分相似,而与聚合物B 的电荷相反的模型聚电解质时,该聚电解质可在水-水界面吸附聚集,这种吸附是由两种竞争性的相互作用驱动的,即:一方面,由于化学成分的原因,该聚电解质更倾向于聚合物A;另一方面,该聚电解质与聚合物B 之间存在静电吸引。2019年,Tea 等[61]研究在葡聚糖-聚环氧乙烷混合体系中加入少量线性聚电解质对水/水乳液稳定性的影响,结果表明,两种阳离子多糖壳聚糖和二乙氨乙基葡聚糖以及阴离子多糖海藻酸丙二醇酯等带有电荷和含有疏水性基团的聚电解质通过静电位阻和空间位阻的结合来稳定水/水乳液。
3 水/水乳液在食品中的应用
3.1 生物活性组分的荷载及递送
与水包油乳液相同,水/水乳液也可用来荷载和递送生物活性组分。2011年,Khan 等[28]提供了一种控制生物相容性基质释放的方法,他们以明胶连续型和双连续型的明胶-麦芽糖糊精相分离水凝胶为对象,研究发现在交联密度、溶剂pH 值和微观结构的适当组合下,可以形成具有特定溶胀行为的水凝胶,再加上适当大小的标记,便可控制释放水平和速率。2017年,Singh 等[40]首次利用水/水乳液包埋益生菌,以羧甲基纤维素钠-明胶体系作为益生菌包埋基质,其模拟胃肠液存活数较好,为利用可食用蛋白质和多糖形成的生物相容性水/水乳液包埋益生菌开辟了一条新途径。2018年,Beldengrun 等[15]研究了在明胶-麦芽糖糊精乳液中以京尼平为交联剂形成的交联明胶微凝胶作为载体来运载β-半乳糖苷酶,通过测定酶在pH 5.8 和37 ℃时的稳定性,得出交联明胶微凝胶可在食品中应用,其中β-半乳糖苷酶载体可用于水解乳制品中的乳糖。
3.2 制备慢消化淀粉
淀粉水解的速度和程度是导致血糖浓度升高的决定性因素,长期食用高血糖指数食物的人患慢性疾病的风险较高[62]。Chen 等[43]提出一种通过构建胶体结构来降低淀粉中葡萄糖释放速率的方法。将蜡质玉米淀粉液滴分散在瓜尔豆胶水溶液中,制备“蜡质玉米淀粉/瓜尔豆胶”乳液,并以果胶改性得到的玉米醇溶蛋白颗粒稳定乳液,阻碍淀粉与相关降解酶的相互作用。通过分析淀粉消化率曲线发现,蜡质玉米淀粉消化过程中存在一个快速消化(k1:0.145 min-1)和一个缓慢消化(k2:0.022 min-1)的阶段,在“蜡质玉米淀粉/瓜尔豆胶”乳液中只存在一个缓慢消化(k2:0.019 min-1)的阶段。以上研究表明,水/水乳液结构改变了淀粉消化的酶动力学,对减缓淀粉的消化十分有效。
4 结语
水/水乳液研究虽处于起步阶段,但已成为胶体与界面领域的研究热点。与油-水、气-水等其它胶体分散体系相同,水/水乳液可用于食品质构设计与调控、活性组分荷载等领域。另外,水/水乳液生物相容性好、绿色天然,可避免非水相造成的蛋白变性、脂肪氧化等缺点,特别适合生物大分子的加工储藏、生物活性药物递送、人工细胞模拟等领域。目前,葡聚糖-聚环氧乙烷、葡聚糖-聚乙二醇两个体系是研究最多的颗粒稳定的水/水乳液体系,这是由于这两个体系在常温下是液体状态,且在较低的浓度下也会形成水/水乳液。聚环氧乙烷和聚乙二醇是合成大分子,未来可开发更多的食品级水/水乳液体系,研究其颗粒稳定的机制和规律,研究水/水乳液在活性组分荷载、质构设计与调控、3D 打印等领域的应用。
[1]PICULELL L,LINDMAN B.Association and segregation in aqueous polymer/polymer,polymer/surfactant,and surfactant/surfactant mixtures:similarities and differences[J].Advances in Colloid & Interface Science,1992,41(9):149-178.
[2]LUNDIN L,NORTON I T,FOSTER T J,et al.Phase separation in mixed biopolymer systems[M].Gums and stabilisers for the food industry 10:Woodhead Publishing,2000:167-180.
[3]GRINBERG V Y,TOLSTOGUZOV V B.Thermodynamic incompatibility of proteins and polysaccharides in solutions[J].Food Hydrocolloids,1997,11(2):145-158.
[4]DEWEY D C,STRULSON C A,CACACE D N,et al.Bioreactor droplets from liposome-stabilized allaqueous emulsions[J].Nature Communications,2014,5(1):1-9.
[5]CACACE D,ROWLAND A,STAPLETON J J,et al.Aqueous emulsion droplets stabilized by lipid vesicles as microcompartments for biomimetic mineralization[J].Langmuir,2015,31(41):11329-11338.
[6]NORTON J E,GONZALEZ ESPINOSA Y,WATSON R L,et al.Functional food micros-tructures for macronutrient re-lease and delivery[J].Food&Function,2015,6(3):663-678.
[7]POORTINGA A T.Microcapsules from self-assembled colloidal particles using aqueous phase-separat ed polymer solutions[J].Langmuir,2008,24(5):1644-1647.
[8]SAGIS L M C.Dynamics of controlled release systems based on water-in-water emulsions:a general theory[J].Journal of Controlled Release,2008,131(1):5-13.
[9]SAGIS L M.Dynamics of encapsulation and controlled release systems based on water -in -water emulsions:negligible surface rheology [J].The Jour nal of Physical Chemistry B,2008,112(43):13503-13508.
[10]MATALANIS A,LESMES U,DECKER E A,et al.Fabrication and characterization of filled hydrogel particles based on sequential segregative and aggregative biopolymer phase separation[J].Food Hydrocolloids,2010,24(8):689-701.
[11]DICKINSON E.Exploring the frontiers of colloidal behaviour where polymers and particles meet[J].Food Hydrocolloids,2016,52(1):497-509.
[12]MCCLEMENTS D J.Non-covalent interactions between proteins and polysaccharides[J].Biotechnology Advances,2006,24(6):621-625.
[13]ESQUENA J.Water-in-water(W/W) emulsions[J].Current opinion in Colloid&Interface Science,2016,25(10):109-119.
[14]NORTON I T,FRITH W J.Microstructure design in mixed biopolymer composites[J].Food Hydrocolloids,2001,15(4/5/6):543-553.
[15]BELDENGRUN Y,ARAGON J,PRAZERES S F,et al.Gelatin/maltodextrin wa ter -in -water(w/w)emulsions for the preparation of cross-linked enzyme-loaded microgels[J].Langmuir,2018,34(33):9731-9743.
[16]ANTONOV Y,LEFEBVRE J,DOUBLIER J L.Phase separation in aqueous casein-guar gum systems[J].Polymer Bulletin,2007,58(4):723-730.
[17]EDELMAN M W,ERIK V D L,DE HOOG E,et al.Compatibility of gelatin and dextran in aqueous solution[J].Biomacromolecules,2001,2(4):1148-1154.
[18]MOSCHAKIS T,CHANTZOS N,BILIADERIS C G,et al.Microrheology and microstructure of water-inwater emulsions containing sodium caseinate and locust bean gum[J].Food & Function,2018,9(5):2840-2852.
[19]JI Z L,LIU H S,YU L,et al.pH controlled gelation behavior and morphology of gelatin/hydroxypropylme-thylcellulose blend in aqueous solution[J].Food Hydrocolloids,2020,104(7):105733.
[20]NGUYEN B T,WANG W,SAUNDERS B R,et al.pH-Responsive water-in-water pickering emulsions[J].Langmuir,2015,31(12):3605-3611.
[21]DING P,WOLF B,FRITH W J,et al.Interfacial tension in phase-separated gelatin/dextran aqueous mixtures[J].Journal of Colloid and Interface Science,2002,253(2):367-376.
[22]SCHOLTEN E,VISSER J E,SAGIS L M C,et al.Ultralow interfacial tensions in an aqueous phaseseparated gelatin/dextran and gelatin/gum Arabic system:a comparison[J].Langmuir,2004,20(6):2292-2297.
[23]ANTONOV Y A,PUYVELDE P V,MOLDENAERS P.Interfacial tension of aqueous biopolymer mixtures close to the critical point[J].International Journal of Biological Macromolecules,2004,34(1/2):29-35.
[24]BUZZA D M A,FLETCHER P D I,GEORGIOU T K,et al.Water-in-water emulsions based on incompatible polymers and stabilized by triblock copolymers-templated polymersomes[J].Langmuir,2013,29(48):14804-14814.
[25]VIS M,OPDAM J,VAN'T OOR I S J,et al.Water-in-water emulsions stabilized by nanoplates[J].ACS Macro Letters,2015,4(9):965-968.
[26]SCHOLTEN E,SAGIS L M C,LINDEN E V D.Bending rigidity of aqueous phase-separated biopolymer mixtures[J].Harrogate Uk,2004,108(32):12164-12169.
[27]CHATSISVILI N,PHILIPSE A P,LOPPINET B,et al.Colloidal zein particles at water-water interfaces[J].Food Hydrocolloids,2017,65(4):17-23.
[28]KHAN R S,NICKERSON M T,PAULSON A T,et al.Release of fluorescent markers from phaseseparated gelatin-maltodextrin hydrogels[J].Journal of Applied Polymer Science,2011,21(5):2662-2673.
[29]FIROOZMAND H,ROUSSEAU D.Tailoring the morphology and rheology of phase-separated biopolymer gels using microbial cells as structure modifiers[J].Food Hydrocolloids,2014,42(12):204-214.
[30]MURRAY B S,PHISARNCHANANAN N.The effect of nanoparticles on the phase separation of waxy corn starch+ locust bean gum or guar gum[J].Food Hydrocolloids,2014,42(12):92-99.
[31]MURRAY B S,PHISARNCHANANAN N.Whey protein microgel particles as stabilizers of waxy corn starch + lo cust bean gum water-in-wa ter emul sions[J].Food hydrocolloids,2016,56(5):162-169.
[32]DE FREITAS R A,NICOLAI T,CHASSENIEUX C,et al.Stabilization of water-in-water emulsions by polysaccharide-coated protein particles[J].Langmuir,2016,32(5):1227-1232.
[33]HAZT B,BASSANI H P,ELIAS-MACHADO J P,et al.Effect of pH and protein particle shape on the stability of amylopectin-xyloglucan water-in-water emulsions[J].Food Hydrocolloids,2020,104(7):105769.
[34]BALAKRISHNAN G,NICOLAI T,BENYAHIA L,et al.Particles trapped at the droplet interface in water-in-water emulsions[J].Langmuir,2012,28(14):5921-5926.
[35]NGUYEN B T,NICOLAI T,BENYAHIA L.Stabilization of water-in-water emulsions by addition of protein particles[J].Langmuir,2013,29(34):10658-10664.
[36]YANG,SONG,ULYANA,et al.Fabrication of fibrillosomes from droplets stabilized by protein nanofibrils at all-aqueous interfaces[J].Nature communications,2016,7(10):12934.
[37]XUE L H,XIE C Y,MENG S X,et al.Polymerprotein conjugate particles with biocatalytic activity for stabilization of water-in-water emulsions[J].ACS Macro Letters,2017,6(7):679-683.
[38]INAM M,JONES J R,P REZ-MADRIGAL M M,et al.Controlling the size of two-dimensional polymer platelets for water-in-water emulsifiers [J].ACS Central Science,2018,4(1):63-70.
[39]FIROOZMAND H,MURRAY B S,DICKINSON E.Interfacial structuring in a phase-separating mixed biopolymer solution containing colloidal particles[J].Langmuir,2009,25(3):1300-1305.
[40]SINGH P,MEDRONHO B,MIGUEL M G,et al.On the encapsulation and viability of probiotic bacteria in edible carboxymethyl cellulose-gelatin waterin-water emulsions[J].Food Hydrocolloids,2018,75(2):41-50.
[41]HANN SD,GOULIAN M,LEE D,et al.Trapping and assembly of living colloids at water/water interfaces[J].Soft Matter,2015,11(9):1733-1738.
[42]ANTONOV Y A,WOLF B A,MOLDENAERS P.Inducing mixing of water -in water BSA/dextran emulsion by a strong polyelectrolyte[J].Food Hydrocolloids,2015,43(1):243-251.
[43]CHEN J F,GUO J,ZHANG T,et al.Slowing the starch digestion by structural modification through preparing zein/pectin particle stabilized water-inwater emulsion[J].Journal of Agricultural and Food Chemistry,2018,66(16):4200-4207.
[44]DICKINSON E.Particle-based stabilization of waterin-water emulsions containing mixed biopolymers[J].Trends in Food Science & Technology,2019,83(1):31-40.
[45]BINKS B P.Colloidal particles at a range of fluidfluid interfaces[J].Langmuir,2017,33(28):6947-6963.
[46]ABBASI N,NAVI M,TSAI S S H.Microfluidic generation of particle -stabilized water -in -water emulsions[J].Langmuir,2018,34(1):213-218.
[47]PEDDIREDDY K R,NICOLAI T,BENYAHIA L,et al.Stabilization of water-in-water emulsions by nanorods[J].ACS Macro Letters,2016,5(3):283-286.
[48]GONZALEZ-JORDAN A,NICOLAI T,BENYAHIA L.Influence of the protein particle morphology and partitioning on the behavior of particle -stabilized water-in-water emulsions[J].Langmuir,2016,32(28):7189-7197.
[49]GONZALEZ-JORDAN A,BENYAHIA L,NICOLAI T.Cold gelation of water in water emulsions stabi lized by protein particles[J].Colloids & Surfaces A Physicochemical & Engineering Aspects,2017,532(11):332-341.
[50]BEN AYED E,COCHEREAU R,DECHANC C,et al.Water-in-water emulsion gels stabilized by cellulose nanocrystals[J].Langmuir,2018,34(23):6887-6893.
[51]KHEMISSI H,BASSANI H,ASCHI A,et al.Exploiting complex formation between polysaccharides and protein microgels to influence particle stabilization of w/wemulsions[J].Langmuir,2018,34(39):11806-11813.
[52]ZHANG JR,HWANG J,ANTONIETTI M,et al.Water -in -water pickering emulsion stabilized by polydopamine particles and crosslinking[J].Biomacromolecules,2018,20(1):204-211.
[53]HANAZAWA T,MURRAY B S.The influence of oil droplets on the phase separation of protein -polysaccharide mixtu -res [J].Food Hydrocolloids,2014,34(1):128-137.
[54]HANAZAWA T,MURRAY B S.Effect of oil droplets and their solid/liquid composition on the phase separation of protein-polysaccharide mixtures[J].Langmuir,2013,29(31):9841-9848.
[55]FREITAS R A D,NICOLAI T,CHASSENIEUX C,et al.Stabilization of water-in-water emulsions by polysaccharide-coated protein particles[J].Langmuir,2016,32(5):1227-1232.
[56]POORTINGA,ALBERT T.Microcapsules from selfassembled colloidal particles using aqueous phaseseparated polymer solutions[J].Langmuir,2008,24(5):1644-1647.
[57]GANLEY W J,RYAN P T,VAN DUIJNEVELDT J S.Stabilisation of water -in -water emulsions by montmorillonite platelets[J].Journal of Colloid and Interface Science,2017,505(11):139-147.
[58]GONZALEZ-JORDAN A,NICOLAI T,BENYAHIA L.Enhancement of the particle stabilization of water-in -water emulsions by modulating the phase preference of the particles[J].Journal of Colloid and Interface Science,2018,530(11):505-510.
[59]PAVLOVIC M,PLUCINSKI A,ZEININGER L,et al.Temperature sensitive water-in-water emulsions[J].Chemical Communications,2020,56(50):6814-6817.
[60]TROMP R H,TUINIER R,VIS M.Polyelectrolytes adsorbed at water-water interfaces[J].Physical Chemistry Chemical Physics,2016,18(45):1-9.
[61]TEA L,NICOLAI T,RENOU F.Stabilization of water-in-water emulsions by linear homo-polyelectrolytes[J].Langmuir,2019,35(27):9029-9036.
[62]SVIHUS B,HERVIK A K.Digestion and metabolic fates of starch,and its relation to major nutritionrelated health pr-oblems:A review[J].Starch-Strke,2016,68(3/4):302-313.