细菌的毒力因子通常除自身侵袭力外,还包括产生的毒素[1],后者是引起细菌性食物中毒的主要致病因子。根据细菌毒素热稳定性的不同,可以分为耐热性和不耐热性毒素。目前耐热性毒素没有严格的定义,通常认为能够在100 ℃高温下能长时间稳定存在的细菌毒素为细菌耐热性毒素,因其在热处理过程中难以被破坏,故对人体健康和食品安全构成极大的威胁,尤其是当食品被产耐热性毒素的致病菌污染时,菌因高温被杀灭而具有生物活性毒素的残留所形成的近似安全的状态,往往是造成食物中毒事件频发的重要原因之一。
2020年10月,于黑龙江发生的因食用“酸汤子”而导致多人死亡的事件引起广泛关注,已被定性为由椰毒假单胞菌污染产生的米酵菌酸引发的食物中毒事件[2]。事实上,椰毒假单胞菌不耐热[3],当事人在食用酸汤子前已加热,然而米酵菌酸是一种耐热的毒素,正常的烹饪未使其失活。金黄色葡萄球菌为一种典型的产耐热性肠毒素的细菌,所引起的食物中毒是由于食用此菌产生的肠毒素。在美国,该菌每年约引起185 000 例食物中毒[4],在2016年欧洲食源性疾病爆发事件中,有8%的病例被确诊为由金黄色葡萄球菌肠毒素(Staphylococcus aureus enterotoxin,SE)所致[5]。在日本,副溶血性弧菌食物中毒占细菌性食物中毒的40%~60%,而耐热性直接溶血素(thermotolerant direct hemolysin,TDH)是副溶血性弧菌的主要毒力因子[6]。
鉴于在细菌性食物中毒事件中,耐热性毒素造成的食品安全事故占据较大的比例,而国内对此类毒素的研究较少,本文综述食品中耐热性毒素的产生以及进入人体后的致病性,并提出应对措施,旨在为我国食品安全建设和相关方面的临床研究提供依据。
1 食品中细菌耐热性毒素的概况
常出现在食品中引起人们中毒的耐热性毒素主要有耐热性肠毒素、耐热性直接溶血素和米酵菌酸,除米酵菌酸的化学本质为脂肪酸外,其它多为毒力蛋白。其中耐热性肠毒素的种类较多,也是引起发病率较高的一种细菌毒素。由于细菌生长需要特定的条件,某些毒素通常也只会在特定的食品基质中检出,主要的食源性致病菌耐热性毒素的化学本质、耐热程度及易被检出的食物如表1所示。
表1 食品中耐热性毒素概况
Table 1 General situation of heat-resistant toxin in food

耐热性毒素 化学本质 耐热程度 易存在的食物 参考文献金黄色葡萄球菌肠毒素一组对热稳定的可溶性蛋白100 ℃处理30 min,不能被完全破坏奶制品、肉类、米饭 [7]大肠杆菌耐热性肠毒素多肽 纯化的耐热性肠毒素(heat stable enterotoxin,ST) 对热稳定,100 ℃,15~30 min 不失去活性动物源性食品 [8]蜡样芽孢杆菌呕吐毒素环状肽 126 ℃加热90 min 仍有活性 含淀粉的食物、奶酪、沙拉和肉制品[9]、[10]、[11]奇异变形杆菌耐热性肠毒素蛋白质和碳水化合物的复合物100 ℃加热60 min 才失活 动物性食品 [12]、[13]小肠结肠炎耶尔森氏菌耐热肠毒素蛋白质 耐受121 ℃,30 min 蔬菜、动物源性食品 [14]副溶血性弧菌耐热性直接溶血素蛋白质 100 ℃加热10 min 仍不被破坏海产品 [15]椰毒假单胞菌米酵菌酸三羧酸脂肪酸 用100 ℃的开水煮沸或用高压锅蒸煮也不能破坏其毒性变质银耳、谷类发酵制品以及薯类制品;完全或不完全发酵的玉米和椰子产品[16]、[17]、[18]
2 耐热性毒素的产生及影响因素
细菌所携带的编码耐热性毒素的基因,只有在特定的条件下才能表达出来。耐热性毒素的产生由菌种本身及外界环境共同决定[19],不同菌株产生的耐热性毒素不同,即使是同种类型的菌株在相同环境下的耐热性毒素合成量也可能不同,一是由于携带基因的不同,二是由于外来因素造成基因表达的变化,因而可以从载体及贮藏条件、活性物质及益生菌、菌株差异3 个方面来分析一些典型耐热性毒素的产生及影响其产生的因素。
2.1 载体及贮藏条件
细菌所存在食品基质的水分活度(Aw)、酸碱度(pH 值)、营养成分与所处环境的温度、氧气对于其耐热性毒素基因的表达和产毒量的影响极其关键。通常,耐热性毒素生成的条件比相应菌生长的条件更加严苛。
由金黄色葡萄球菌引起的食物中毒,实质上是因为食用了含有预先形成SE 的食物[20]。SE 基因在菌中的表达由DNA 结合蛋白和多个调控元件协调[21-22]。SE 产生的环境条件要求低,整体范围较广,所以很容易在食品中检出,根据物理性质和作用特性的不同将其分为SEA、SEB、SEC、SEE等,不同SE 的产生也存在一定的差异性。例如,pH 值范围一般要求大于4.5,Aw>0.86 才可以产生SEA,而SEB 和SEC 产生的pH 值范围较窄,均为中性,Aw 要求较高,需要大于0.96[23]。由于在通风不良,氧气压较低的时候,SE 更容易形成,常建议将食品贮藏在通风良好的条件下以抑制肠毒素的产生[24],且将温度控制在10 ℃以下也可以达到同种目的[25]。
蜡样芽孢杆菌呕吐毒素具有极强的耐热性,由一种非核糖体肽合成酶合成[26],cesA 和cesB 是合成酶的结构编码基因,呕吐毒素的产生是一个严格控制的过程,涉及多个调控领域,包括转录后和翻译后调控[27-28]。从严格意义上讲,产呕吐毒素的蜡样芽胞杆菌菌株是生长在10~48 ℃之间的嗜温菌株,虽然ces 基因的转录和翻译是在整个生长范围内观察到的,但呕吐毒素的产生,被限制在12~40 ℃的温度范围内[29],准确的产毒温度范围,还是要根据基质的不同来具体测定。蜡样芽孢杆菌呕吐毒素易存在于淀粉含量高的食品中,事实上,食品淀粉与蜡样芽孢杆菌产毒量有密切关系,Jääskeläinen 等[30]已经证明淀粉含量越高,该菌产生的呕吐毒素Cereulide 越多,而且,食品中L-亮氨酸和L-缬氨酸的存在可能会使Cereulide 的量增大10~20 倍。此外,具有中性至碱性酸碱度、高水分和淀粉含量以及中等葡萄糖浓度的食品也可能会对人体健康构成潜在威胁,因为其营养成分会刺激食物和小肠中蜡样芽孢杆菌呕吐毒素的表达[31]。氧气也是其形成的一大限制因素,尽管蜡样芽孢杆菌是兼性厌氧型菌株,无氧条件下也能生存,但氧气的存在对于呕吐毒素的合成却是必须的,有研究表明,当≥90%的大气被氮气替代时,在4 d 中几乎没有催吐剂(≤0.005 μg/g)在水稻中积累[32],这也就表明如果要防止此菌产生的呕吐毒素,隔绝氧气将是非常有效的措施。
副溶血性弧菌含有多种不同的毒力因子,包括TDH、TDH 相关的溶血素(thermotolerance related hemolysin,TRH)、两种Ⅲ型分泌系统T3SS1和T3SS2、黏附素[33],其中,TDH 毒素在大多数由副溶血弧菌引起的食源性疾病中占优势。tdh 是编码TDH 的基因,跨膜调节蛋白ToxR、新的ToxR样调节蛋白VtrA 和VtrB 对tdh 基因的表达起到正调控的作用,LysR 型转录调节蛋白CalR 与调节因子H-NS 则起到负调控的作用[34],此外,一些环境因素或生长条件直接或者间接调节着tdh 的表达,Feng 等[35]应用逆转录实时PCR 分析出副溶血弧菌在25 ℃诱导的tdh 表达水平明显高于4 和37 ℃诱导的tdh 的表达水平。又有研究表明,副溶血性弧菌存在于有共轭胆汁酸或者铁元素得到限制的基质中,TDH 的产量会更高[34],而在极端pH值和高盐浓度环境下会抑制副溶血性弧菌tdh 基因的表达[36]。
米酵菌酸是由椰毒假单胞菌属酵米面亚种在发酵玉米面制品及其它变质淀粉类制品等中产生的耐热毒素[37]。目前对于其在菌体内合成,确定了其生物合成部分的前体物质及几个关键碳原子的来源,但尚未实现分子水平上的突破,与毒素合成的相关基因未明确[38]。米酵菌酸产生菌的适宜生长温度是37 ℃,而26~28 ℃是该菌最适的产毒范围。米酵菌酸的产量取决于脂质浓度和脂肪酸的类型,在涉及椰子脂肪不同水平的试验中,当平均脂肪含量少于20%时,基质中未检测到毒素;比较4 种具有不同饱和度的18 碳游离脂肪酸时,同种条件下含油酸(18∶1)的基质中产生的米酵菌酸浓度最高[39]。
2.2 活性物质及益生菌
目前,在众多耐热性毒素中,对于抑制SE 生成的物质的研究较多,包括生物活性肽、生物碱、益生菌等。这些物质在之后的研究中,可以考虑用于抑制其它菌产生毒素。
生物活性肽由于它们的生物活性,具有多种生理功能,例如抗高血压、抗微生物,抗氧化剂和抗癌作用等[40]。sea 基因是一种SE 编码基因已得到证明,鱼水解蛋白(从鱼皮中提取)的IC50 水平能显著抑制sea 基因的转录,又由于其具有低毒性而对患者没有副作用和任何并发症,鱼水解蛋白可以通过抑制金黄色葡萄球菌肠毒素的形成作为一种新的抗菌剂应用于食品[41]。Kusumaningrum等[42]研究了从冷冻干燥过的木瓜叶片中提取的粗生物碱对食品中4 株金黄色葡萄球菌细胞的影响及sea 基因的表达,金黄色葡萄球菌分别暴露在质量浓度为0.25 mg/mL 和0.5 mg/mL 的粗生物碱中2 h 不会显著降低其数量,然而,sea 基因的相对表达在不同菌株之间有所下降,于0.25 mg/mL粗生物碱中暴露后下降了1.8~27 倍,在0.5 mg/mL 粗生物碱中下降了33.2~113.6 倍,研究表明,青木瓜叶片中含有粗生物碱,对试验用的4 株金黄色葡萄球菌的sea 基因表达有一致的影响,则此生物碱具有减少SE 产生的巨大潜力。近些年,Misaghi 等[43]又报道了益生菌,如乳杆菌、嗜酸乳杆菌和副干酪乳杆菌能对SEA、SEC 和SEE 的产生具有抑制作用,在与乳酸菌分离株共培养的金黄色葡萄球菌中,sea 基因的表达被显著抑制,但细菌-细菌相互作用对SE 基因表达的影响未得到进一步的研究。
2.3 菌株差异
同类型的菌株产毒能力也有差异。Apetroaie等[44]对从人类肠道、环境、食品和食物中毒中分离出来的24 株蜡样芽胞杆菌,从生理学和基因产物上进行了研究,其中有11 株不产生呕吐毒素Cereulide 的菌株、4 株低产量Cereulide 菌株、7 株普通产量菌株和2 株高产菌株。
一些代谢物的浓度随着某种基因突变而变化,采用聚合酶链反应分析发现,携带trh 基因(编码TRH 的基因)和tdh 基因的副溶血性弧菌菌株产生的TDH 比只携带tdh 基因的菌株产生的少4到16 倍,这表明tdh 基因的表达被trh 基因的存在抑制,其机制尚待确定[45-46]。因此,有必要评估基因型和表型之间的可能联系。
椰毒假单胞菌产毒能力的强弱与菌体脂肪颗粒的量、血清型(Ⅴ型>Ⅳ型>Ⅲ型)及内膜系统是否发达有关[47],米酵菌酸是不饱和脂肪酸,一些产毒量低的菌株膜系统发达,胞浆膜由两个单位膜构成,脂肪颗粒较少,细胞代谢旺盛,毒素及时被氧化而分解较快,因而产生的米酵菌酸量少;强产毒株膜系统不发达,脂肪颗粒较多,毒素容易聚集,故产毒量高。菌体的脂肪酸组成对产毒能力也产生了一定的影响,陈卫真等[48]的研究表明,饱和脂肪酸含量越高的椰毒假单胞菌,相同环境下产生的米酵菌酸越多。
3 耐热性毒素的致病性及作用机制
耐热性肠毒素、TDH、米酵菌酸在人体内作用时均可以将肠作为靶器官,某些毒素具有多个作用靶点且有多种致病机制。其中,耐热性肠毒素的发病症状相似,且SE 和蜡样芽孢杆菌呕吐毒素、大肠杆菌和小肠结肠炎耶尔森氏菌耐热性肠毒素的作用机制存在内在联系。
3.1 耐热性肠毒素
3.1.1 金黄色葡萄球菌肠毒素 许多SE 对蛋白水解酶具有高度抵抗力且能抵抗低pH 值,因而金黄色葡萄球菌在食物中产生的SE 可以到达小肠中的靶细胞,而不受消化酶的影响[49],引起的发病症状主要表现为恶心、呕吐、腹痛、腹泻等。
SE 具有超抗原特性,会刺激T 细胞大量增殖和无控制地释放促炎性细胞因子,导致威胁生命的中毒性休克综合征[50]。在众多类型由SE 引起的病例,SEA 与大型金葡萄球菌食物中毒爆发有关,催吐作用位点位于小肠,其诱导的是肠而不是脑中5-羟色胺(5-hydroxytryptamine,5-HT) 的释放,迷走神经传入神经元上的5-羟色胺受体是SEA 刺激呕吐的关键,如图1所示。利用大麻素减少肠内5-羟色胺的释放可以下调由SEA 引起的呕吐[51]。

图1 SE 引发呕吐的作用机制[51]
Fig.1 The mechanism of SE inducing vomit[51]
注:5-HT3 受体为5-羟色胺受体的一种。
3.1.2 蜡样芽孢杆菌呕吐毒素 蜡样芽孢杆菌呕吐毒素已被证明是一种有效的离子载体,对K+有很高的亲和力。因此,它可以通过干扰离子细胞平衡和线粒体跨膜电位来伤害哺乳动物细胞,在严重中毒情况下,可能导致肝损伤、横纹肌溶解、多器官衰竭甚至死亡[52]。呕吐毒素和SE 诱发呕吐的作用机制相同,与5-羟色胺受体结合,引发迷走神经传入神经的刺激[53]。蜡样芽孢杆菌呕吐毒素中毒除了恶心和呕吐等典型症状外,对中枢神经系统有直接作用[54]。
3.1.3 其它耐热性肠毒素 由大肠杆菌和小肠结肠炎耶尔森氏菌产生的ST 均能引起动物和人的水样腹泻。STa(与人和动物腹泻都有关的一种大肠杆菌耐热性肠毒素)活性有组织特异性,在回肠可以使结肠下段和上皮细胞内cGMP 分别增加1.8 倍和10 倍,但对其它组织器官无作用,选择性地激活小肠细胞膜刷状缘绒毛上颗粒性鸟苷酸环化酶使cGMP 增加,从而引起小肠离子分泌增加导致腹泻的致病机制已被相继证明[8],但有关STa激活酶的机理却存在争议(如图2所示)。一是“瀑布学说”:需要激活钙调蛋白来触发磷酸酯酶A2,膜磷脂会释放花生四烯酸,其过氧化物及过氧化氢代谢使鸟苷酸环化酶被激活;另一假说为“直接偶联学说”,该学说认为不需要介导酶,STa 就能直接激活鸟苷酸环化酶[55]。部分纯化的小肠结肠炎耶尔森氏菌ST 的特性和作用机制与大肠杆菌ST 密切相关。像大肠杆菌ST 一样,小肠结肠炎耶尔森氏菌ST 刺激颗粒鸟苷酸环化酶活性,增加cGMP 浓度,导致电位差和短路电流增加,并抑制兔回肠黏膜中活性CI-吸收。尚不清楚在分离的膜中刺激鸟苷酸环化酶活性比刺激完整上皮中的短路电流需要更高浓度的大肠杆菌和小肠结肠炎耶尔森氏菌ST 制剂的原因。然而,在激素-腺苷酸环化酶相互作用的研究中,膜分离后激素敏感性的丧失并不少见[56]。
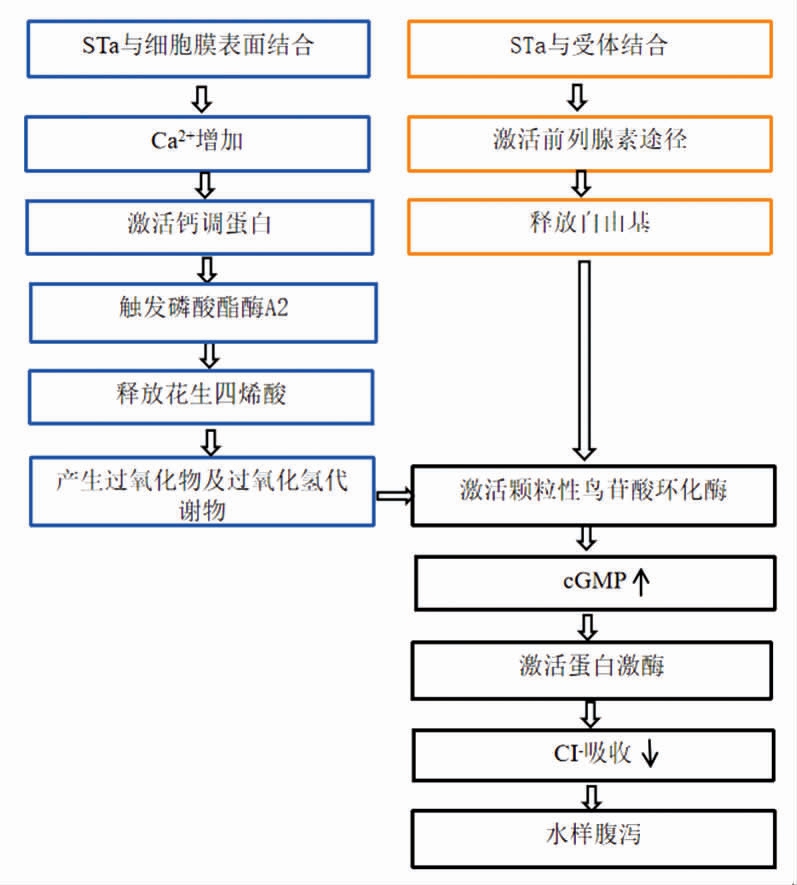
图2 ST 致泻的两种可能机制[55]
Fig.2 Two possible mechanisms of ST induced diarrhea[55]
奇异变形杆菌致病机理复杂[57],一直以来国内外研究重点主要集中在其它会引起的尿路感染或败血症的毒力因子,因而目前关于该菌产生耐热性肠毒素具体的危害及作用机制未进行研究和验证。
3.2 耐热性直接溶血毒素
TDH 具有包括细胞毒性、溶血活性、心脏毒性和肠毒性在内的多种生物学活性[58],作用的靶器官是心脏、肺、肾脏、脾脏、胃和肠[59]。
TDH 是神奈川现象的决定因素[15],在红细胞膜的磷脂双层中形成跨膜孔,可渗透水和离子。细胞内外离子的不平衡导致细胞膜通透性增大和红细胞膨胀,导致溶解。同时,TDH 能作用于培养细胞内外部来诱导细胞毒性,并通过促进细胞凋亡来杀死细胞,它的细胞毒性作用依赖于脂筏,其中鞘磷脂对于TDH 与脂筏的联系最为重要[60]。TDH通过激活NLRP3 和NLRC4 炎症体诱导caspase-1 依赖性细胞凋亡[61],细胞骨架组织和Ca2+稳态的调节似乎也在TDH 依赖性细胞毒性中起关键作用。人们认为副溶血性弧菌对于引起生物体的严重腹泻也有重要的影响,Takahashi 等[62]调查研究了TDH 对肠道细胞的肠毒性,发现TDH 通过细胞结合和Ca2+流入的机制增加人类结肠上皮细胞CI-分泌,后续与蛋白激酶C 磷酸化相关的Ca2+浓度升高。这两种毒性(细胞毒性和肠毒性)均会因为细菌暴露于胆汁而增强[63]。
关于TDH 造成的心脏毒性已经利用小鼠进行了论证。当将TDH 添加到培养基中时,培养的心脏细胞的跳动节律暂时增加,然后突然停止,毒素与神经节苷脂混合物的预温育可阻断毒素对培养的小鼠心脏细胞的作用[64]。
3.3 米酵菌酸
米酵菌酸中毒初期会引起胃肠道症状和高血糖症,后者迅速发展为低血糖症,将耗尽包括心脏和肝脏在内的各种组织中的糖原储备[65-66];严重时会导致多器官衰竭,如大脑、肝脏和肾脏,这三者是主要的靶器官,其引发的死亡率很高[16]。
腺嘌呤核苷酸转运体(adenine nucleotide translocase,ANT)是一种ADP/ATP 转运体和非特异性孔,它介导胞质ADP 和线粒体ATP 的交换,并通过其形成致死孔的能力促进凋亡[67]。米酵菌酸对于线粒体有一种独特的毒性机制:它抑制的是ANT,而不是电子传递链,如图3所示。米酵菌酸与ANT 结合改变其构型,将干扰ADP 的转运过程和阻碍ADP 和ATP 在线粒体内膜之间的交换,使ATP 生成减少或不产生,导致线粒体内膜依赖ATP 的生理机制停止工作,作为呼吸作用和能量重要交换场所的线粒体的功能出现了异常,不能向细胞正常提供能量,最终导致细胞死亡,这一机制的发现对于癌症的治疗有一定意义[67-68]。此外,ANT 作为一个特定的,核苷酸调节的钾离子和氢离子通道[69],米酵菌酸因为抑制ATP 依赖的K+通道开放,能诱导线粒体氧化磷酸化解偶联[70],干扰ATP 的产生,直接影响生物细胞的能量供应。
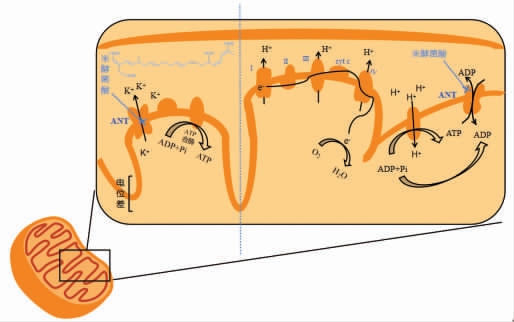
图3 米酵菌酸致病机制[16]
Fig.3 Pathogenic mechanism of bongkrek acid[16]
注:虚线左边描述的是作用于K+通道,右边表述的是干扰转运和交换;I、Ⅱ、Ⅲ、Ⅳ分别表示NADH 脱氢酶复合物、琥珀酸-CoQ 还原酶复合物、细胞色素bc1 复合物、细胞色素氧化酶。
4 总结与展望
关于食品中易存在的耐热性毒素,除金黄色葡萄球菌产生的肠毒素外,其它毒素的研究并不多;长期以来人们重点关注食品中是否存在致病菌及其是否超标这一问题,但仅仅关注这些并不能达到全面预防食物中毒和保证食品安全的目的,因而致病菌产生的毒素,尤其是耐热性毒素的防控和研究亟待加强,具体的措施可以从如下3个方面考量:
1)防控细菌耐热性毒素造成食物中毒最有效的方式就是避免相关细菌对食品的污染。Necidová 等[71]在分别用100,110 和121 ℃高压灭菌来灭活牛奶中葡萄球菌肠毒素,发现热灭活结果受SE 初始浓度的影响,热处理使金黄色葡萄球菌的数量降至最低,由于存在热稳定的SE,它仍可能引起葡萄球菌肠毒素中毒。虽然巴氏杀菌是确保牛奶安全的关键步骤,但防止冷链中断,从源头上防止菌的生长,使耐热性毒素无法产生才是治本之策[72]。在生产过程中保持良好的卫生环境及工人们有良好的卫生习惯也是减少菌污染的有效措施。在巴塞罗那体育俱乐部爆发的一次SE 食物中毒事件中,传播的来源被证明是无症状携带者的食品生产者,他们的双侧指甲刮擦和鼻拭是这种污染物传播的常见来源[73]。
2)当细菌产生的毒素的危害远远超过自身菌体的侵袭力对人体造成的危害时,可以采取防止或者减少细菌耐热性毒素的产生的措施。此种情况下,探究影响细菌耐热性毒素生成的因素,从而干扰相关毒力基因的表达至关重要。食品应尽量放置于不利于细菌产毒的环境,如酸化的发酵环境可以减少椰毒假单胞菌生成米酵菌酸;蜡样芽孢杆菌在无氧的条件下不能生成呕吐毒素等;通过菌之间的相互作用影响,同样可以降低耐热性毒素的产生。对于可能会存在活性状态的耐热性毒素的食品,工业上应有一定的预见性,针对不同食品中可能会出现的耐热性毒素有相应的灭活方式,根据每种耐热性毒素的热稳定性选择合适的加热温度和加工方式,使毒素分解;家庭自制食品及烹饪时,无论是一些关键环节的管控还是加热杀菌设施通常都比不上食品工业,因而更需要注意将食物煮熟、煮透再食用。
3)如果已经食入带有耐热性毒素的食品,重点就在于治疗,因而明确这些毒素的致病性及作用机制是必须的,干扰耐热性毒素作用的靶点或者影响整个机制中关键物质的作用,来达到有效减轻危害和治疗的目的。事实上,还能通过注射疫苗激发宿主抗毒素免疫力来达到预防中毒的目的[74]。
要从源头上避免相关菌的污染及此类毒素的产生,进一步考虑除热处理外,其它可以使此类毒素更加高效的分解失活的方式也可以考虑在内,而毒素经物理、化学或生物因素处理后,降解成小分子物质或生成新的化合物对人体是否还有负面影响还有待探索。目前,控制米酵菌酸合成的相关基因没有明确,奇异变形杆菌耐热性肠毒素具体的危害及作用机制也未进行研究和验证,而且对于影响耐热性毒素产生的因素的探究尚不完全,这些科学问题还有待在后续的研究中得到解决,以便建立系统的从减少或避免食品中耐热性毒素的产生到即使中毒也可以接受到有效治疗方案的双重保障,来防控毒素对人体的危害。
[1]刘晓琳,宋雪娇,徐程程,等.植物提取物对细菌毒力因子抑制作用研究进展[J].动物医学进展,2015,36(12):137-140.
LIU X L,SONG X J,XU C C,et al.Progress on inhibitory effects of plant extracts on virulence factors in Bacteria[J].Progress in Veterinary Medicine,2015,36(12):137-140.
[2]阮光锋.科学解读“酸汤子”为什么会引发米酵菌酸中毒[J].中国食品,2020(20):128-129.
RUAN G F.Scientific interpretation of why “sour soup” causes Bongkrekic Acid Poisoning[J].China Food,2020(20):128-129.
[3]陈瑾.椰毒假单胞菌中毒案例[J].法制博览,2016(36):116-117.CHEN J.Cases of Pseudomonas cocoanum poisoning[J].Legality Vision,2016(36):116-117.
[4]李琼琼,范一灵,宋明辉,等.食源性金黄色葡萄球菌肠毒素及其检测方法[J].食品安全质量检测学报,2016,7(2):555-560.
LI Q Q,FAN Y L,SONG M H,et al.Research advances on foodborne staphylococcal enterotoxins and its detection methods[J].Journal of Food Safety& Quality,2016,7(2):555-560.
[5]EFSA.The European Union summary report on trends and sources of zoonoses,zoonotic agents and food-borne outbreaks in 2016[J].EFSA Journal,2017,15(12):5077.
[6]薛华.副溶血性弧菌所致食物中毒研究进展[J].世界最新医学信息文摘,2017,17(83):26.
XUE H.Research progress on food poisoning caused by Vibrio parahaemolyticus[J].Digest World Latest Med Inf,2017,17(83):26.
[7]陈万义,游春萍,刘振民.金黄色葡萄球菌肠毒素的研究进展[J].乳业 科学与 技术,2015,38(6):31-37.
CHEN W Y,YOU C P,LIU Z M.Progress in research on Staphylococcus aureus exotoxins[J].Journal of Dairy Science and Technology,2015,38(6):31-37.
[8]贺秀媛,李玉峰,王建华.大肠杆菌耐热性肠毒素的研究进展[J].动物医学进展,2000(S1):175-179.
HE X Y,LI Y F,WANG J H.Research progress on thermotolerant enterotoxin of Escherichia coli[J].Progress In Veterinary Medicine,2000(S1):175-179.
[9]刘芳,罗臻,黄静敏,等.致病性蜡样芽胞杆菌的研究进展[J].检验检疫学刊,2016,26(1):68-71.
LI F,LUO Z,HUANG J M,et al.Research progress of pathogenic Bacillus Cereus[J].Journal of Inspection and Quarantine,2016,26(1):68-71.
[10]陆湘华,崔昌,王远萍,等.蜡样芽孢杆菌食物中毒的研究进展[J].传染病信息,2015,28(4):251-254.
LU X H,CUI C,WANG Y P,et al.Research progress of Bacillus cereus foodborne diseases[J].In fectious Disease Information,2015,28(4):251-254.
[11]MESSELHÄUSSER U,FRENZEL E,BLÖCHINGER C,et al.Emetic Bacillus cereus are more volatile than thought:Recent foodb -orne outbreaks and prevalence studies in bavaria(2007-2013)[J].BioMed Research International,2014,2014:465603.
[12]江汉湖,董明盛.食品微生物学[M].北京:中国农业出版社,2010:364-365.
JIANG H H,DONG M S.Food Microbiology[M].Beijing:China Agriculture Press,2010:364-365.
[13]张斐,俞一兵,张平,等.奇异变形杆菌耐热性肠毒素的初步研究[J].微生物学通报,1990,17(6):343-345.
ZHANG F,YU Y B,ZHANG P,et al.Preliminary study on thermotolerant enterotoxin of Proteus mirabilis[J].Microbiology,1990,17(6):343-345.
[14]ROBERTSON D,罗建辉.结肠炎耶尔森氏菌产生的耐热肠毒素的化学特性及其产毒营养要求[J].微生物学免疫学译刊,1998(3):52-53.
ROBERTSON D,LUO J H.Chemical characteristics and nutritional requirements of thermotolerant enterotoxin produced by Yersinia coli[J].Journal of Microbiology and Immunology,1998(3):52-53.
[15]贺羽,王帅,尹娴婷,等.副溶血性弧菌毒性相关因子及其外分泌蛋白的研究进展[J].食品工业科技,2020,41(9):340-347.
HE Y,WANG S,YIN X T,et al.Progress of virulence factors and secreted proteins in Vibrio Parahaemolyticus[J].Science and Technology of Food Industry,2020,41(9):340-347.
[16]ANWAR M,KASPER A,ALAINA R,et al.Bongkrekic acid-a review of a lesser-known mitochondrial toxin[J].Journal of Medical Toxicology,2017,13(2):173-179.
[17]LI J,ZHOU L U,LONG C,et al.An Investigation of bongkrekic acid poisoning caused by consumption of a nonfermented rice noo-dle product without noticeable signs of spoilage[J].Journal of Food Protection,2019,82(10):1650-1654.
[18]黄媛.米酵菌酸检测技术的研究进展[J].广东化工,2020,47(6):136-137.
HUANG Y.Research progress on the detection method of bongkrekic acid[J].Guangdong Chemical Industry,2020,47(6):136-137.
[19]EWALD J C,MATT T,ZAMBONI N.The integrated response of primary metabolites to gene deletions and the environment[J].Molecular BioSystems,2013,9(3):440-446.
[20]ANGELIDIS A S,KALAMAKI M S,PEXARA A S,et al.Investigation of Staphylococcus aureus growth and enterotoxin production during artisanal kefir fermentation[J].LWT,2020,134(12):109956.
[21]SCHUBERT J,PODKOWIK M,BYSTRON J,et al.Production of staphylococcal enterotoxins in microbial broth and milk by Staphylococcus aureus strains harboring seh gene[J].International Journal of Food Microbiology,2016,235(10):36-45.
[22]韩乃寒,刘映,赵燕英,等.金黄色葡萄球菌肠毒素研究进展[J].现代生物医学进展,2015,15(1):181-187.
HAN N H,LIU Y,ZHAO Y Y,et al.Review on Staphylococcus Aureus enterotoxin [J].Progress in Modern Biomedicine,2015,15(1):181-187.
[23]徐振波,刘晓晨,李琳,等.金黄色葡萄球菌肠毒素在食源性微生物中的研究进展[J].现代食品科技,2013,29(9):2317-2324.
XU Z B,LIU X C,LI L,et al.Development of Staphylococcus aureus enterotoxin in food -borne Bacteria[J].Modern Food Science and Technology,2013,29(9):2317-2324.
[24]张婧,张易,施春雷.食源性金黄色葡萄球菌肠毒素基因及其表达检测[J].中国食品学报,2020,20(1):246-251.
ZHANG J,ZHANG Y,SHI C L.The detection of enterotoxin Gene and its expression of foodborne Staphylococcus aureus[J].Journal of Chinese Institute of Food Science and Technology,2020,20(1):246-251.
[25]ONJONG H A,NTULI V,MWANIKI M,et al.Exposure assessment to staphylococcus enterotoxins in Nile tilapia(Oreochromis niloticus) supplied through semi-regulated and unregulated value chains[J].Food Control,2021,119(1):107487.
[26]EHLING-SCHULZ M,VUKOV N,SCHULZ A,et al.Identification and partial characterization of the nonribosomal peptide synthetase gene responsible for cereulide production in emetic Bacillus cereus[J].Applied and Environmental Micobiology,2005,71(1):105-113.
[27]EHLING-SCHULZ M,FRENZEL E,GOHAR M.Food-bacteria interplay:Pathometabolism of emetic Bacillus cereus[J].Frontiers in Microbiology,2015,6(7):704.
[28]LÜCKING G,FRENZEL E,RUÜTSCHLE A,et al.Ces locus embedded proteins control the non-ribosomal synthesis of the cereulide toxin in emetic Bacillus cereus on multiple levels[J].Frontiers in Microbiology,2015,6(10):1101.
[29]KRANZLER M,STOLLEWERK K,ROUZEAU K,et al.Temperature exerts control of Bacillus cereus emetic toxin production onpost-transcriptional levels[J].Frontiers in Microbiology,2016,7(10):1640.
[30]JÄÄSKELÄINEN E L,HÄGGBLIM M M,ANDERSSON M A,et al.Potential of Bacillus cereus for producing an emetic toxin cereulide,in bakery products:quantitative analysis by chemical and biological methods[J].Journal of Food Protection,2003,66(6):1047-1054.
[31]AMOR M,JAN S,BARON F,et al.Toxigenic potential and antimicrobial susceptibility of Bacillus cereus group bacteria isolated from Tunisian foodstuffs[J].BMC Microbiology,2019,19(1):196.
[32]JSKELINEN E L,HGGBLIM M M,ANDERSSON M A,et al.Atmospheric oxygen and other conditions affecting the production of cereulide by Bacillus cereus in food[J].International Journal of Food Microbiology,2004,96(1):75-83.
[33]ZHANG L,ORTH K.Virulence determinants for Vibrio parahaemolyticus infection[J].Current Opinion in Microbiology,2013,16(1):70-77.
[34]CAI Q,ZHANG Y Q.Structure,function and regulation of the thermostable direct hemolysin(TDH)in pandemic Vibrio parahaem-olyticus[J].Microb-Pathog,2018,123(10):242-245.
[35]FENG B,GUO Z,ZHANG W,et al.Metabolome response to temperature-induced virulence gene expression in two genotypes of pathogenic Vibrio parahaemolyticus[J].BMC Microbiol,2016,16(4):75.
[36]王润东.副溶血性弧菌在六种食品中致病力的差异及与肠道菌群的关联性研究[D].湛江:广东海洋大学,2019.
WANG R D.Pathogenicity of Vibrio parahaemolyticus in six kinds of foods and its relationship with gut microbiota[D].Zhanjiang:Guangdong Ocean University,2019.
[37]GUDO E S,COOK K,KASPER A M,et al.Description of a mass poisoning in a rural district in mozambique:The first documented bongkrekic acid poisoning in Africa[J].Clin Infect Dis,2018,66(9):1400-1406.
[38]王岗,郭云昌,裴晓燕.米酵菌酸的生物合成及其机制研究进展[J].卫生研究,2012,41(2):341-344.
WANG G,GUO Y C,PEI X Y.Research progress in the biosynthesis and mechanism of bongkrekic acid[J].Journal of Hygiene Research,2012,41(2):341-344.
[39]GARCIA RAFAEL A,HOTCHKISS JOSEPH H,STEINKRAUS H.The effect of lipids on bongkrekic(bongkrek) acid toxin produ-ction by Burkholderiacocovenenans in coconut media[J].Food AdditContam,1999,16(2):63-69.
[40]YAGHOUBZADEH Z,PEYRAVII GHADIKOLAII F,KABOOSI H,et al.Antioxidant activity and anticancer effect of bioactive peptides from rainbow trout(Oncorhynchus mykiss) skin hydrolysate[J].International Journal of Peptide Research and Therapeutics,2020,26(1):625.
[41]YAGHOUBZADEH Z,KABOOSI H,PEYRAVII GHADIKOLAII F,et al.The half maximal inhibitory concentration(IC50) effect of Protein hydrolysates from rainbow trout(Oncorhynchus mykiss) skin on enterotoxin A gene expression in Staphylococcus aureus[J].International Journal of Peptide Research and Therapeutics,2020,26(4):2411-2418.
[42]KUSUMANINGRUM H D,NOFRIANTI R,FARIDAH D N.Reduced expression of enterotoxin-encoding gene in four isolates Staphylococcus aureus by crude alkaloids from young papaya leaves[J].International Food Research Journal,2017,24(1):406-413.
[43]MISAGHI A,PARSAEIMEHR M,AKHONDZADEH A,et al.The inhibitory effects of Lactobacillus fermentum,Lactobacillus acidophilus and Lactobacillus paracasei isolated from yoghurt on the growth and enterotoxin A gene expression of S.aureus[J].Iranian Journal of Veterinary Medicine,2017,11(2):191-201.
[44]APETROAIE C,ANDERSSON M A,SPRÖER C,et al.Cereulide-producing strains of bacillus cereus show diversity[J].Arch Microbiol,2005,184(3):141-151.
[45]OKITSU T,OSAWA R,PORNRUANGWONG S,et al.Urea hydrolysis and suppressed production of thermostable direct hemolysinr(TDH) by Vibrio parahaemolyticus associated with presence of TDHrelated hemolysin genes[J].Curr Microbiol,1997,34(5):314-317.
[46]BAKER-AUSTIN C,OLIVER J D,ALAM M,et al.Vibrio spp.infections[J].Nature Reviews Disease Primers,2018,4(1):7.
[47]王夏,孟昭赫.酵米面黄杆菌产毒性能与菌株血清型的关系[J].中华微生物学和免疫学杂志,1987,7(1):54-55.
WANG X,MENG Z H.The relationship between the virulence of xanthobacillus oryzae and its serotype[J].Chinese Journal of Microbiology and Immunology,1987,7(1):54-55.
[48]陈卫真,周方.椰酵假单胞菌毒素-米酵菌酸形成机理的探讨[J].中华微生物学和免疫学杂志,1991,11(3):151-154.
CHEN W Z,ZHOU F.Study on the formation mechanism of bongkrekic acid from Pseudomonas cocoanum toxin[J].Chinese Journal of Microbiology and Immunology,1991,11(3):151-154.
[49]SUZUKI Y,ONO H K,SHIMOJIMA Y,et al.A novel staphylococcal enterotoxin SE02 involved in a staphylococcal food poisoning outbreak that occurred in Tokyo in 2004[J].Food Microbiology,2020,92(12):103588.
[50]GRUMANN D,SCHARF S S,HOLTFRETER S,et al.Immune cell activation by enterotoxin gene cluster(egc)-encoded and non-egc superantigens from Staphylococcus aureus[J].J Immunol,2008,181(7):5054-5061.
[51]HU D L,ZHU G,MORI F,et al.Staphylococcal enterotoxin induces emesis through increasing serotonin release in intestine and it isdownregulated by cannabinoid receptor 1[J].Cell Microbiol,2007,9(9):2267-2277.
[52]TSCHIEDEL E,RATH P M,STEINMANN J,et al.Lifesaving liver transplantation for multi-organ failure caused by Bacillus cereus food poisoning[J].Pediatr.Transplant,2015,19(1):E11-E14.
[53]李敏,李东光,王美菡,等.食物中呕吐毒素Cereulide 特性及检测研究进展[J].中国公共卫生,2007,23(9):1116-1117.
LI M,LI D G,WANG M H,et al.Research progress on characteristics and detection of emetic toxin cereulide in food[J].Chinese Journal of Public Health,2007,23(9):1116-1117.
[54]ROUZEAU -SZYNALSKI K,STOLLEWERK K,MESSELHÄUSSER U,et al.Why be serious about emetic Bacillus cereus:Cereulide production and industrial challenges[J].Food Microbiology,2020,85(2):103279.
[55]陈文建.大肠杆菌耐热性肠毒素[J].赣南医专学报,1985(1):84-93.
CHEN W J.Escherichia coli heat stable enterotoxin[J].Journal of Gannan Medical University,1985(1):84-93.
[56]RAO M C,GUANDALINI S,LAIRD W J,et al.Effects of heat-stable enterotoxin of Yersinia enterocoliticaon ion transport and cyclic guanosine 3',5'-monophosphate metabolism in rabbit ileum[J].Infect Immun,1979,26(3):875-878.
[57]陈小敏,杨华,桂国弘,等.奇异变形杆菌毒力因子的研究进展[J].微生物学杂志,2019,39(1):109-114.
CHEN X M,YANG H,GUI G H,et al.Advances in virulence factors of Proteus mirabilis[J].Journal of Microbiology,2019,39(1):109-114.
[58]RAGHUNATH P.Roles of thermostable direct hemolysin(TDH) and TDH -related hemolysin(TRH) in Vibrio parahaemolyticus[J].Front Microbiol,2015,5(1):805.
[59]李诗怡,杨靖亚,马燕,等.副溶血弧菌耐热直接溶血毒素的急性毒性研究[J].安徽农业大学学报,2020,47(3):386-390.
LI S Y,YANG J Y,MA Y,et al.Study on acute toxicity of Vibrio parahaemolyticus thermostable direct hemolysin[J].Journal of Anhui Agricultural University,2020,47(3):386-390.
[60]檀利军,王敬敬,石千黛,等.副溶血性弧菌耐热性直接溶血素(TDH)的研究进展[J].微生物学报,2020,60(8):1563-1573.
TAN L J,WANG J J,SHI Q D,et al.Advances in research on thermostable direct hemolysin(TDH)of Vibrio parahaemolyticus[J].Acta Microbiologica Sinica,2020,60(8):1563-1573.
[61]HIGA N,TOMA C,KOIZUMI Y,et al.Vibrio parahaemolyticus effector proteins suppress inflammasome activation by interfering with host autophagy signaling[J].PLoS pathogens,2013,9(1):e1003142.
[62]TAKAHASHI A,SATO Y,SHIOMI Y,et al.Mechanisms of chloride secretion induced by thermostable direct haemolysin of Vibrio parahaemolyticus in human colonic tissue and a human intestinal epithelial cell line[J].Journal of Medical Microbiology,2000,49(9):801-810.
[63]郜蓉,后来旺,赵勇,等.副溶血性菌vtrB 基因敲除菌株的构建及其在抵抗胆汁中的作用[J].上海海洋大学学报,2021,30(3):555-563.
GAO R,HOU L W,ZHAO Y,et al.Construction of vtrb gene knockout strain of Vibro parahaemolytic and its role in bile resistance[J].Journal of Shanghai Ocean University,2021,30(3):555-563.
[64]HONDA T,GOSHIMA K,TAKEDA Y,et al.Demonstration of the cardiotoxicity of the thermostable direct hemolysin(lethal toxin) produced by Vibrio parahaemolyticus[J].Infection and Immunity,1976,13(1):163-171.
[65]SHI R,LONG C,DAI Y,et al.Bongkrekic acid poisoning:Severe liver function damage combined with multiple organ failure caused by eating spoiled food[J].Legal Medicine,2019,41(11):101622.
[66]FALCONER T M,KERN S E,BRZEZINSKI J L,et al.Identification of the potent toxin bongkrekic acid in a traditional African beverage linked to a fatal outbreak[J].Forensic Science International,2017,270(1):e5-e11.
[67]BELZACQ-CASAGRANDE A-S,BRENNER C.The adenine nucleotide translocator:A new potential chemotherapeutic target [J].Current Drug Targets,2003,4(7):517-524.
[68]彭子欣,李凤琴.唐菖蒲伯克霍尔德菌米酵菌酸生物合成机制[J].卫生研究,2020,49(2):336-338.
PENG Z X,LI F Q.Mechanism of acid biosynthesis in Burkholderia gladioli[J].Journal of Health Research,2020,49(2):336-338.
[69]KOPUSTINSKIENE D,TOLEIKIS A,SARIS N E.Adenine nucleotide translocase mediates the KATPchannel-openers-induced proton and potassium flux to the mitochondrial matrix[J].Journal of Bioenergetics and Biomembranes,2003,35(2):141-148.
[70]MOEBIUS N,ROSS C,SCHERLACH K,et al.Biosynthesis of the respiratory toxin bongkrekic acid in the pathogenic bacterium Burkholderia gladioli[J].Chem.Biol,2012,19(9):1164-1174.
[71]NECIDOVÁ L,BURSOVÁ Š,HARUŠTIAKOVÁ D,et al.Effect of heat treatment on activity of staphylococcal enterotoxins of type A,B,and C in milk[J].Journal of Dairy Science,2019,102(5):3924-3932.
[72]NECIDOVA L,BOGDNOVICOVA K,HARUSTIAKOVA D,et al.Short communication:Pasteurization as a means of inactivating staphylococcal enterotoxins A,B,and C in milk[J].Journal of Dairy Science,2016,99(11):8638-8643.
[73]SOLANO R,LAFUENTE S,SABATE S,et al.Enterotoxin production by Staphylococcus aureus:An outbreak at a Barcelona sports club in July 2011[J].Food Control,2013,33(1):114-118.
[74]夏芃芃,孟宪臣,朱国强.人源产肠毒素大肠杆菌疫苗的研发进展[J].微生物学报,2016,56(2):198-208.
XIA P P,MENG X C,ZHU G Q.Advances in new vaccines against human enterotoxigenic Escherichia coli-A review[J].Acta Microbiologica Sinica,2016,56(2):198-208.