随着生活水平的提高,人们对膳食水果和蔬菜中具有健康功效,且无毒副作用的天然活性物质日益关注,例如黄酮类化合物[1]。黄酮类化合物是一类普遍存在于绿茶、可可豆、葡萄籽、大豆和柑橘果皮等的多酚类物质,是植物和真菌的次生代谢物[2-4]。黄酮在植物中主要起到改善色泽、提供风味和抵抗氧化应激的作用[5]。黄酮类化合物被证明具有多种促进人体健康的生物学活性,包括抗炎、抗氧化、抗肥胖、抗菌、抗癌、抗糖尿病和保护肝脏等,被认为是功能性食品、化妆品和药品的重要原料[6-10]。基于黄酮类化合物的广泛存在及其生物学作用,本文综述黄酮类化合物和肠道菌群的相互作用及其对宿主健康效应的最新研究进展,旨在为黄酮类化合物在功能性食品中的应用提供参考。
1 黄酮类化合物的结构及分类
黄酮类化合物是指以2-苯基色原酮为母核的一类多酚类化合物,通常与羟基、糖基和甲氧基相连。如图1,它是由两个苯环(A 环和B 环)和一个吡喃环(C 环)组成,即具有C6-C3-C6 的骨架[11]。

图1 黄酮类化合物的基本骨架
Fig.1 The basic skeleton of flavonoids
黄酮类化合物可根据B 环和C 环的连接方式,C 环的氧化程度和3 个环的羟基化程度分为不同的亚类[12-13]。如表1所示,这些亚类包括:黄酮醇类、黄酮类、黄烷酮醇类、黄烷酮类、黄烷-3 醇类和异黄酮类[5,13-15]。黄酮类化合物在膳食中主要存在于水果、蔬菜、茶和巧克力等。黄酮类化合物在有些食物中会富集在某些特定部位,例如在柑橘类水果中,多甲氧基黄酮在果皮中的含量远高于果肉等其它部位[16]。
表1 黄酮类化合物的分类、结构和食物来源[5,13-15]
Table 1 Classification,structure and food sources of flavonoids[5,13-15]
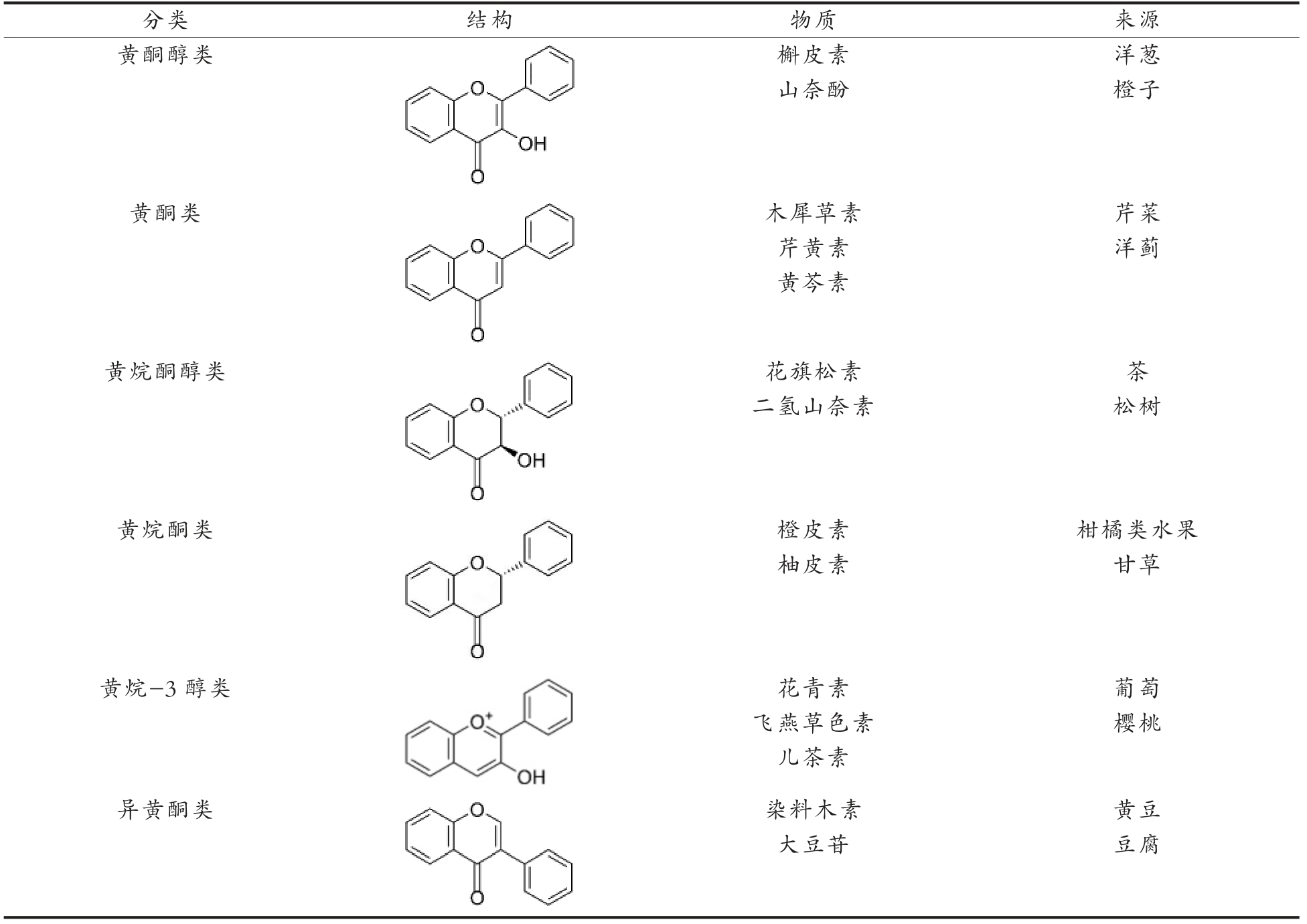
分类 结构 物质 来源黄酮醇类images/BZ_375_833_554_1092_776.png槲皮素 洋葱山奈酚 橙子黄酮类images/BZ_375_833_791_1092_1013.png木犀草素 芹菜芹黄素 洋蓟黄芩素黄烷酮醇类images/BZ_375_833_1027_1092_1249.png花旗松素 茶二氢山奈素 松树黄烷酮类images/BZ_375_833_1264_1092_1486.png橙皮素 柑橘类水果柚皮素 甘草黄烷-3 醇类花青素 葡萄飞燕草色素 樱桃儿茶素异黄酮类images/BZ_375_833_1500_1092_1667.pngimages/BZ_375_833_1682_1092_1854.png染料木素 黄豆大豆苷 豆腐
2 肠道菌群与常见慢性疾病的关系
人体的胃肠道是一个复杂的微生物系统,因为其中含有上万亿个微生物,它们的基因组是人类基因组的100 倍。婴儿在母体阶段是没有肠道菌群的,直到分泌过程经过产道时,母体的微生物便可在婴儿体内定植。婴儿在母乳喂养的过程中,消化道内主要的肠道菌是双歧杆菌,随着食物的逐渐摄入,肠道菌群逐渐改变,成年时接近稳定[17-18]。研究表明多种因素可显著地影响肠道菌群。在时间上,肠道菌群会随着饮食习惯、抗生素的使用和抽烟等因素而改变[19]。例如西方国家的高脂高糖饮食通常会降低菌群的多样性[20]。非洲儿童饮食中含有较多的植物多糖,这使他们体内厚壁菌门的丰度降低和拟杆菌门的丰度升高,而欧洲的高脂、高糖饮食会造成他们体内肠杆菌科的丰度增加[21-22]。在空间上,从胃到结肠,菌群的量逐渐增加,尤其在结肠中,肠道菌群的数量和活性都是最高的[23]。肠道菌群按门类来划分可分为5 个门类:厚壁菌门、拟杆菌门、放线菌门、变形菌门和疣微菌门,其中前两个菌门占据了肠道菌群数量的90%以上[24-25]。
越来越多的研究已表明,肠道菌群对人体健康具有重要的调控作用。肠道菌群可以发酵人体膳食摄入各种营养物质,比如碳水化合物、脂质和蛋白质等以促进其吸收;肠道菌群可以保持肠黏膜的完整性和抑制病原体的产生;肠道菌群还具有免疫调节的作用,可以通过促进T 细胞的发育和发挥其功能[26]。此外,肠道菌群还能产生维生素和酶,刺激细胞再生和脂多糖生物合成,防止病原体定植,通过分泌黏液和调节连接复合体来维持肠道屏障功能[18]。近些年,研究者们发现肠道菌群可以显著影响膳食摄入的活性物质在体内的生物转化及代谢过程,进而共同调控人体健康。
2.1 肠道菌群与炎症性肠病
炎症性肠病(Inflammatory Bowel Disease,IBD)是一种持续性和复发性的肠道炎症,导致了胃肠道器官的损坏,进而造成体重减轻、腹痛、持续性腹泻、痉挛和直肠出血等。炎症性肠病可能降低生活质量和预期寿命,并会增加患结直肠癌的风险[27]。炎症性肠病的两种主要类型是克罗恩病(Crohn's Disease,CD)和溃疡性结肠炎(Ulcerative Colitis,UC)[28]。克罗恩病的发病部位通常在整个消化道,而溃疡性结肠炎的发病部位通常在结肠[29]。炎症性肠病的病因通常包括遗传因素和环境因素,环境因素包括饮食和抗生素滥用等[30]。
健康的宿主对微生物群有耐受性,并且能保持免疫稳态。报道称炎症性肠病通常与菌群失调相关联。菌群失调的定义是致病菌数量的增加与有益菌种类的减少,导致菌群多样性的下降[29,31]。Walker 等[32]对CD 和UC 患者的炎症和非炎症肠组织进行双黏膜活检,与健康对照组的进行比较,对细菌的16S rRNA 基因进行深度测序。该结果表明,患炎症性肠病后,肠道细菌的总量都会下降,尤其以患克罗恩病的患者的炎症区菌群下降最为显著。身患炎症性肠病后,肠道菌群的多样性会下降,尤其以患克罗恩病较为明显。患有炎症性肠病后的患者的肠道菌群发生了改变,原因可能是通过改变肠道黏膜的抗原暴露,以及减少与有益微生物的接触和它们的代谢产物,进而促进更多促炎物种的产生[33-34]。总体来说,与健康个体相比,炎症性肠病患者的肠道菌群多样性较低,且体内具有抗炎特性的菌群较少,而具有促炎特性的菌群较多[35]。
2.2 肠道菌群与肥胖
肥胖是一种慢性代谢紊乱的疾病,并迅速成为全球性的健康问题。近年来,肠道菌群对肥胖的影响已成为研究热点,是治疗肥胖的潜在有效靶点[36]。某些特定的肠道菌群可能会导致肥胖的发生,被定义为致肥胖肠道菌群,如厚壁菌门、肠杆菌、卟啉单胞菌属、根瘤菌和梭菌属等。致肥胖肠道菌群主要是通过为宿主提供过剩的能量和产生能够引起低度炎症的代谢物的方式来诱发肥胖。不同于致肥胖肠道菌群,某些种类的肠道菌群被证明具有抗肥胖活性,主要有双歧杆菌、某些亚种乳酸菌和拟杆菌。抗肥胖肠道细菌可以通过多种方式抑制肥胖:包括降低肠道黏膜通透性、增强肠道黏膜完整性、升高紧密连接蛋白水平、减少胰岛素抵抗和促进白色脂肪的褐变等[37]。因此,宿主的肠道菌群中促肥胖菌群增加和抑制肥胖菌群减少可能会引发和促进肥胖的发生。
2.3 肠道菌群与结直肠癌
结直肠癌是世界上第三大常见的癌症[38]。患有炎症性肠病的患者比健康的人更容易患上结直肠癌。肠道微生物可以调节T 细胞的发育和Th17反应,两者都与结直肠癌和炎症性肠病的发病有关[39]。肠道微生物群可以产生大量对局部和全身有影响的代谢产物,比如能促进结肠癌的次级胆汁酸和有抗炎作用的短链脂肪酸,同时肠道菌群还能调节上皮黏膜细胞修复和增殖[40]。因此,肠道菌群的紊乱不仅会影响宿主的炎症反应和细胞增殖反应,还会增加患上结直肠癌的风险[41]。越来越多报道称肠道菌群会影响癌症的产生、发展和治疗效果。近年来,通过调控肠道菌群来预防和治疗癌症吸引了越来越多学者的关注[42]。
综上,健康、稳定的肠道菌群有助于维持人体的正常机能。肠道菌群的紊乱(总量和多样性下降、有益菌的数量下降和有害菌的数量上升等因素)通常被认为与宿主的某些慢性疾病有关,如肥胖、癌症和炎症性肠病等(如图2)。因此,通过调控肠道菌群已被证明可以预防和辅助治疗炎症性肠炎、肥胖和结直肠癌等慢性疾病,而黄酮类化合物已被证明能与肠道菌群进行相互作用,这为上述研究思路提供了物质基础。
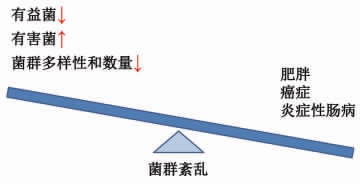
图2 肠道菌群的紊乱与疾病
Fig.2 Diseases and dysbiosis of gut microbiota
3 黄酮类化合物对肠道菌群的调控作用
近年来,黄酮类化合物对于肠道菌群的调控,被认为是其体内生物学活性的重要作用机制之一。黄酮类化合物在被摄入后,能够对宿主体内肠道菌群的多样性、结构和短链脂肪酸的含量等方面进行调控,表2总结了部分文献报道的黄酮类化合物对肠道菌群及其代谢产物的调控作用。
表2 黄酮类化合物对肠道菌群的调控及其健康效应
Table 2 Regulation of gut microbiota by flavonoids and their healthy effects
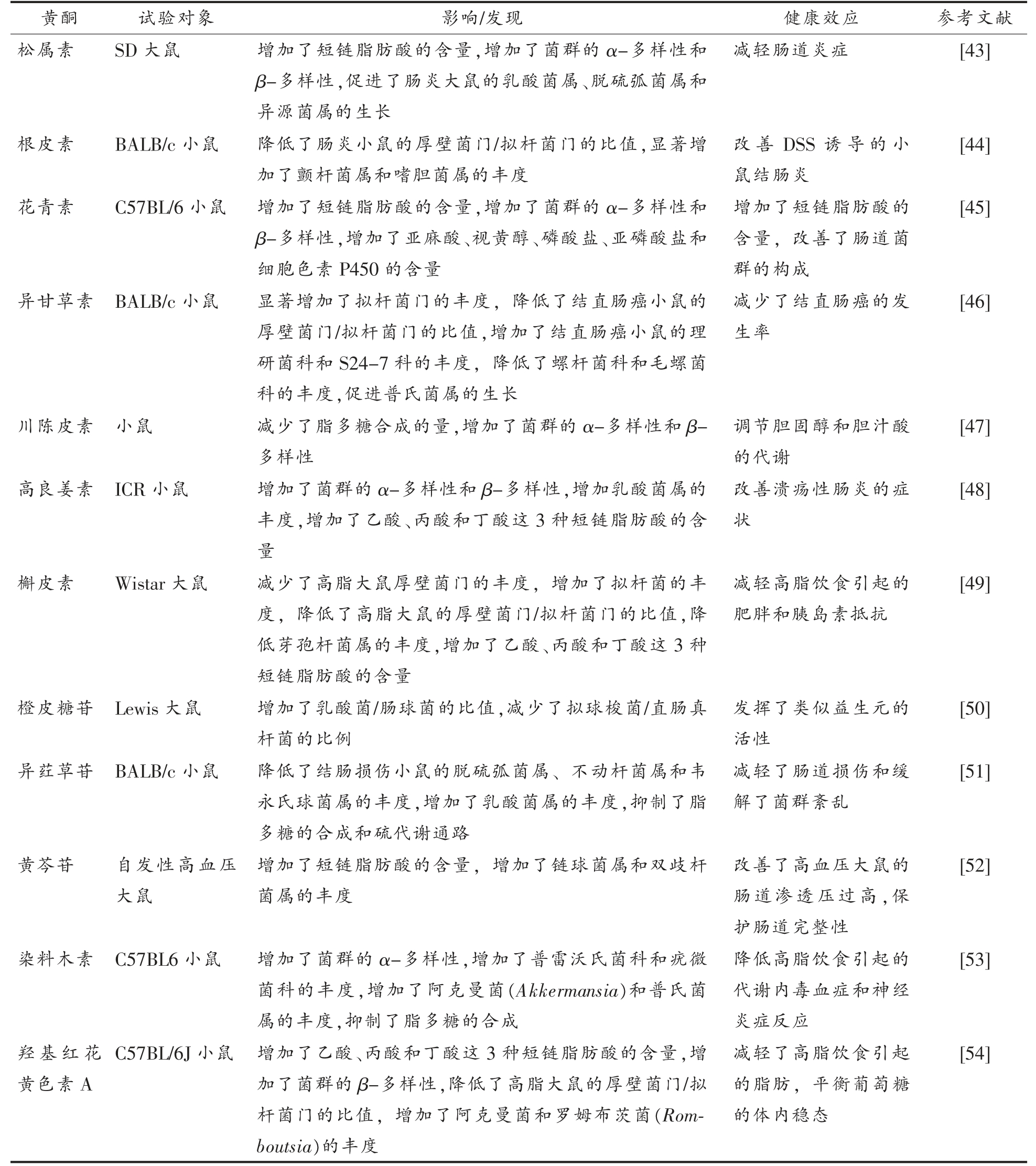
黄酮 试验对象 影响/发现 健康效应 参考文献松属素 SD 大鼠 增加了短链脂肪酸的含量,增加了菌群的α-多样性和β-多样性,促进了肠炎大鼠的乳酸菌属、脱硫弧菌属和异源菌属的生长减轻肠道炎症 [43]根皮素 BALB/c 小鼠 降低了肠炎小鼠的厚壁菌门/拟杆菌门的比值,显著增加了颤杆菌属和嗜胆菌属的丰度花青素 C57BL/6 小鼠 增加了短链脂肪酸的含量,增加了菌群的α-多样性和β-多样性,增加了亚麻酸、视黄醇、磷酸盐、亚磷酸盐和细胞色素P450 的含量异甘草素 BALB/c 小鼠 显著增加了拟杆菌门的丰度,降低了结直肠癌小鼠的厚壁菌门/拟杆菌门的比值,增加了结直肠癌小鼠的理研菌科和S24-7 科的丰度,降低了螺杆菌科和毛螺菌科的丰度,促进普氏菌属的生长川陈皮素 小鼠 减少了脂多糖合成的量,增加了菌群的α-多样性和β-多样性高良姜素 ICR 小鼠 增加了菌群的α-多样性和β-多样性,增加乳酸菌属的丰度,增加了乙酸、丙酸和丁酸这3 种短链脂肪酸的含量槲皮素 Wistar 大鼠 减少了高脂大鼠厚壁菌门的丰度,增加了拟杆菌的丰度,降低了高脂大鼠的厚壁菌门/拟杆菌门的比值,降低芽孢杆菌属的丰度,增加了乙酸、丙酸和丁酸这3 种短链脂肪酸的含量橙皮糖苷 Lewis 大鼠 增加了乳酸菌/肠球菌的比值,减少了拟球梭菌/直肠真杆菌的比例异荭草苷 BALB/c 小鼠 降低了结肠损伤小鼠的脱硫弧菌属、不动杆菌属和韦永氏球菌属的丰度,增加了乳酸菌属的丰度,抑制了脂多糖的合成和硫代谢通路改善DSS 诱导的小鼠结肠炎增加了短链脂肪酸的含量,改善了肠道菌群的构成减少了结直肠癌的发生率调节胆固醇和胆汁酸的代谢改善溃疡性肠炎的症状减轻高脂饮食引起的肥胖和胰岛素抵抗发挥了类似益生元的活性减轻了肠道损伤和缓解了菌群紊乱[44][45][46][47][48][49][50][51]黄芩苷 自发性高血压大鼠增加了短链脂肪酸的含量,增加了链球菌属和双歧杆菌属的丰度改善了高血压大鼠的肠道渗透压过高,保护肠道完整性[52]染料木素 C57BL6 小鼠 增加了菌群的α-多样性,增加了普雷沃氏菌科和疣微菌科的丰度,增加了阿克曼菌(Akkermansia)和普氏菌属的丰度,抑制了脂多糖的合成降低高脂饮食引起的代谢内毒血症和神经炎症反应[53]羟基红花黄色素A C57BL/6J 小鼠 增加了乙酸、丙酸和丁酸这3 种短链脂肪酸的含量,增加了菌群的β-多样性,降低了高脂大鼠的厚壁菌门/拟杆菌门的比值,增加了阿克曼菌和罗姆布茨菌(Romboutsia)的丰度减轻了高脂饮食引起的脂肪,平衡葡萄糖的体内稳态[54]
3.1 黄酮类化合物对肠道菌群多样性的影响
黄酮类化合物可以提高肠道菌群的多样性来发挥其生物学功能。肠道菌群的多样性通常可以用α-多样性和β-多样性来分析。α-多样性包括物种的丰富度和均匀度,通常用Shannon 指数和Simpson 指数来分析。β-多样性是用来反映样本间的显著差异,通常用PCoA 的方法来分析[45,55]。Lopez 等[53]报道了经过高脂饮食诱导后,小鼠的肠道菌群的α-多样性会下降,而摄食染料木素提高了高脂饮食小鼠的肠道菌群的α-多样性。Xuan等[48]也研究了高良姜素对患有结肠炎小鼠肠道菌群的影响。研究表明,患有结肠炎小鼠的肠道菌群的α-多样性会下降,而β-多样性和正常小鼠相比也具有显著差异;摄食高良姜素后,患有结肠炎小鼠α-多样性会显著提高。Peng 等[45]发现了摄食12周的花青素后的小鼠与空白组相比,肠道菌群方面有显著差异,花青素可以显著增加小鼠肠道菌群的α-多样性和β-多样性,从而调节肠道菌群的多样性。这些研究结果均表明,膳食黄酮类化合物对于肠道菌群的多样性,特别是在患慢性疾病小鼠中具有显著的提高作用。肠道菌群的多样性越低,通常对健康也就越不利[56]。因此黄酮类化合物这种对肠道菌群多样性的上调作用,可能是其多种促健康生物学活性的作用机制之一。黄酮类化合物在结肠停留时间较长,可以与结肠中丰富的肠道菌群进行反应,起到一种益生元的作用,可以促进有益菌的生长以及抑制有害菌的繁殖,进而来调控菌群[48]。因此,黄酮类化合物可以增加肠道菌群的多样性指数,进而来维持肠道菌群的稳态。
3.2 黄酮类化合物对肠道菌群代谢产物的影响
短链脂肪酸是肠道菌群非常重要的代谢产物,它们通常是来自不能被人体自身消化的多糖比如膳食纤维等经过肠道菌群发酵产生的,主要包括乙酸、丙酸、丁酸和戊酸等[57-58]。这部分短链脂肪酸可以直接被人体利用,作为免疫调节剂和代谢调节剂,而且还能作为生理介质来提供能量[57]。其中,丁酸是保持肠道免疫稳态的一个关键物质,它可以抑制炎症因子的转录来提高免疫力[59-60]。Hu 等[43]报道了松属素能够增加DSS 诱导的结肠炎小鼠体内短链脂肪酸含量。Wu 等[52]证明了黄芩苷可以通过增加产生短链脂肪酸的肠道菌群的丰度(例如,能产生丁酸的疣微菌科、能产生丙酸和丁酸的阿克曼菌和能产生乙酸和丁酸的双歧杆菌)来增加短链脂肪酸的含量。同时短链脂肪酸的增加还能与黄芩苷协同缓解肠道的紧密连接蛋白的紊乱,减轻炎症和肠道通透性。Liu 等[54]发现了羟基红花黄色素A 会显著增加高脂喂养小鼠的丁酸弧菌(Butyricimonas)和拟普雷沃氏菌属(Alloprevotella)这两种产短链脂肪酸的细菌的丰度,进而增加了乙酸、丙酸和丁酸这3 种短链脂肪酸的含量。综上,黄酮类化合物可以通过促进产短链脂肪酸的菌群生长,来促进菌群对膳食纤维等多糖的发酵,进而产生丙酸、乙酸和丁酸等短链脂肪酸。这些肠道菌群介导产生的短链脂肪酸可以通过发挥自身的生理活性,也能与黄酮类化合物产生协同作用,表现出抗炎、抗肥胖和保护肠道等生物学活性。
3.3 黄酮类化合物对肠道菌群结构的影响
黄酮类化合物对肠道菌群结构的影响主要分为以下2 种:一方面,黄酮类化合物影响肠道菌群的门水平;另一方面,黄酮类化合物影响肠道菌群的属水平。
3.3.1 黄酮类化合物对肠道菌群门水平的影响 黄酮类化合物能通过降低肠道菌群的厚壁菌门/拟杆菌门的比值,进而维持身体健康。厚壁菌门/拟杆菌门的比值通常与炎症性肠病、肥胖和结直肠癌等慢性疾病相关联。比如,拟杆菌门的丰度通常与能量摄入和肥胖呈负相关,厚壁菌门的丰度通常与肥胖呈正相关[37,61]。高比值的厚壁菌门/拟杆菌门通常可以作为肥胖发生的一个标志物[62]。Etxeberria 等[49]发现了槲皮素在高脂大鼠模型表现出的抗肥胖功能,可能的作用机制之一是通过降低大鼠的厚壁菌门/拟杆菌门的比值。Wu 等[44]研究了在DSS 诱导的结肠炎小鼠中,厚壁菌门/拟杆菌门的比值比正常小鼠高。但是高剂量的根皮素可以改善这种趋势,摄入根皮素后,患有结肠炎小鼠的厚壁菌门/拟杆菌门的比值降低。高丰度的拟杆菌通常具有抗炎效果[63]。所以根皮素可能是通过降低厚壁菌门的丰度和提高拟杆菌门的丰度来发挥抗炎效果的[44]。Wu 等[46]报道了患结直肠癌小鼠的厚壁菌门/拟杆菌门的比值会升高,而异甘草素会降低厚壁菌门/拟杆菌门的比值,进而改善体重减轻等症状和降低炎症因子的水平。因此,黄酮类化合物可以降低肠道菌群的厚壁菌门/拟杆菌门的比值,进而来发挥抗炎、抗肥胖和缓解结直肠癌症状的生物学功能。
3.3.2 黄酮类化合物对肠道菌群属水平的影响黄酮类化合物不仅对肠道菌群的门水平有影响,也对肠道菌群的属水平有影响。Xuan 等[48]报道了用DSS 诱导的急性结肠炎小鼠的乳酸菌属的水平下降,而埃希氏杆菌属的水平上升,高良姜素可以增加乳酸菌属的丰度,以及诱导丁酸弧菌和牧斯皮氏菌属(Mucispirillum)等有益菌的生长。Etxeberria 等发现了在补充槲皮素6 周后,高脂大鼠模型的芽孢杆菌属会减少,服用反式白藜芦醇的高脂大鼠的副杆菌属(Parabacteroides)会减少。Wu等[44]报道了根皮素增加了患结肠炎小鼠的阿克曼菌、另支菌属、柔膜细菌_RF9(Mollicutes_RF9)和乳酸菌属的丰度,减少了颤杆菌克属(Oscillibacter),瘤胃梭菌属_6(Ruminiclostridium_6)和瘤胃梭菌属_9(Ruminiclostridium_9)的丰度。因此,黄酮类化合物可以通过影响肠道菌群的门水平和属水平,进而影响肠道菌群的结构。
4 肠道菌群对黄酮类化合物的代谢
如图3所示,黄酮类化合物在体内的生物转化是一个复杂的过程,涉及多个脏器及酶的作用[14,64-65]。大部分天然黄酮都是以糖苷形式存在,在被摄入后,只有水解为苷元才能被人体有效吸收利用[66]。但是,只有小部分黄酮糖苷在小肠中能够被像乳糖酶连翘苷水解酶(lactase phloridzin hydrolase,LPH)等酶水解为苷元,或者被像钠依赖葡萄糖共转运蛋白(sodium dependent glucose cotransporter,SGLT1) 等转运蛋白主动转至小肠上皮细胞内,随后被这些细胞胞浆中的β-葡萄糖苷酶(cytosolic β-glucosidases,CBG)等酶水解为苷元[67-68]。除此之外,超过70%的黄酮糖苷无法在小肠中被有效地水解和吸收,它们会以糖苷的形式进入结肠,被其中的肠道菌群和机体自身水解成苷元,然后进一步代谢成多种代谢产物及酚酸。这些在结肠中产生的代谢产物,一部分通过肝肠循环进入肝脏,而未被吸收的部分通过粪便排出体外[24]。那部分进入肝脏的多种代谢产物将会通过血液循环进入其它组织和器官,最后通过肾脏以尿液的形式排出体外[65,68]。
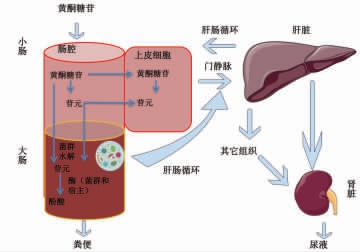
图3 黄酮类化合物在体内的生物转化过程[17,64-65]
Fig.3 In-vivo biotransformation of flavonoids[17,64-65]
研究表明,肝脏中的多种酶可以与黄酮类化合物发生Ⅰ相代谢(氧化、还原、羟基化和去甲基化等)而产生Ⅰ相代谢产物,然后Ⅱ相代谢酶像葡萄糖醛酸转移酶(UDP-glucuronosyltransferases,UGTs) 和硫酸转移酶(Sulphotransferases,SULTs)将与Ⅰ相代谢产物进一步发生Ⅱ相代谢(葡萄糖醛酸化和硫酸化等)[68]。研究表明,人体通过Ⅰ相代谢和Ⅱ相代谢过程,增大了黄酮类化合物的极性,促进它们被排出机体。同时,与黄酮类化合物母体相比,这些Ⅱ相代谢产物的生物学活性极低,对于黄酮类化合物的生物利用度以及生物学活性的表达是非常不利的。但近些年研究发现,这些在肝脏中产生的Ⅱ相代谢产物会通过肝肠循环进入结肠,结肠中的菌群可以将它们从无生物学活性的结合态形式(葡萄糖醛酸化和硫酸化形式)转化为具有生物学活性的游离态形式,同时能够更好地被吸收[64-65,69]。据文献报道,在小肠相关水解酶系分泌不足的个体,肠道菌群可以部分替代小肠酶的水解作用,产生与正常分泌水解酶系个体等量的代谢产物[68]。因此,肠道菌群介导的生物转化过程,对于提高黄酮类化合物的生物利用度以及生物学活性的表达,具有极其重要的作用。
4.1 肠道菌群对黄烷酮类的代谢
柑橘黄酮中的川陈皮素和橘皮素缺少糖基所以比较容易被人体吸收,但是像柚皮糖苷和橙皮糖苷通常与糖基相连,所以须水解糖基,转化为柚皮苷元和橙皮苷元才能被人体吸收[70]。橙皮苷和柚皮苷是橙子的果肉和果汁中含量非常丰富的黄烷酮。橙皮苷具有抗炎、抗癌、抗氧化、降血糖和降胆固醇等生物学活性[71]。Van 等[72]利用人体肠道微生物模拟器来模拟橙皮糖苷的代谢过程。结果表明橙皮糖苷在胃和小肠可以抵御相关酶系的降解,但当它到达结肠近端时会迅速被肠道菌群降解,在结肠近端可以检测到二氢异阿魏酸和二氢咖啡酸,在结肠末端可以检测到氢化阿魏酸。柚皮素是柑橘类水果中一种重要的黄酮类化合物,它具有多种重要的药理学和营养价值,特别是其表现出的极强的抗氧化作用,作为重要的自由基清除剂和抗氧化酶激活剂被广泛关注[73]。Zou 等[74]利用人体的粪便悬浊液进行了柚皮糖苷的体外培养试验。结果表明柚皮糖苷可以被粪便悬浊液中的肠道菌群代谢成柚皮素,接着再被代谢成3-(4-羟苯基)丙酸(3-(4-hydroxyphenyl)propionic acid,4-HPPA)。4-HPPA 是由柚皮素的C 环开环断裂而形成的。Pereira-Caro 等[75]报道了用双歧杆菌和鼠李糖乳酸菌去孵化柚皮糖苷,结果发现两种细菌和柚皮糖苷共培养也能产生4-HPPA。该研究证明了双歧杆菌和鼠李糖乳酸菌的酶可以对柚皮糖苷分解代谢,而且它们产生的苯丙酸类代谢产物的生物利用度和生物学活性都比母体高。这些研究表明,肠道菌群可以通过代谢黄酮类化合物,产生比母体活性更强的代谢产物,进而增强其在体内的生物学活性。
4.2 肠道菌群对黄酮类的代谢
黄芩苷存在于黄芩中,是我国传统中药中一种有效的成分。黄芩在欧美等国家也经常作为膳食补充剂去摄入。黄芩具有抗炎、抗氧化、抗HIV和抗糖尿病等多种生物学活性[76]。Xing 等[77]通过给大鼠服用抗生素来灭活其肠道菌群,进而来分析黄芩苷的代谢产物,结果表明正常大鼠粪便中的β-葡萄糖苷酶和α-鼠李糖苷酶的活性比服用抗生素的大鼠高。而且在服用抗生素大鼠的盲肠和尿液中检测不到黄芩苷的水解产物和葡萄糖醛酸产物,表明肠道菌群对于黄芩苷的代谢具有重要影响。Lin 等[78]利用体外的发酵模型和抗生素诱导的小鼠体内模型来探讨木犀草素的代谢,研究表明木犀草素的粪便悬浊液的体外发酵产物是p-对羟基苯甲酸、p-对羟基苯乙酸、原儿茶酸和3-(4-羟苯基)丙酸。在体内模型中,无菌小鼠尿液中的原儿茶酸和p-对羟基苯乙酸的量会比正常小鼠的低。而且无菌小鼠粪便中的木犀草素的量比正常小鼠的高,表明肠道菌群加快了木犀草素的代谢效率,提高了木犀草素的生物利用度。芹黄素在一些蔬菜和草药里的含量很丰富,比如芹菜、洋蓟和荷兰芹等。芹黄素糖苷(Apigenin-7-glucoside,A7G) 是芹黄素的母体化合物,具有抗过敏、抗突变和抗恶性细胞增生等生物学活性[79]。Hanske 等[80]通过用无菌大鼠模型和人类肠菌移植(human microbiota-associated,HMA) 的大鼠模型做对比,来分析肠道菌群对芹黄素糖苷的代谢。在摄入芹黄素糖苷48 h 后,无菌大鼠尿液和粪便中的代谢物主要是芹黄素和木犀草素以及它们各自的结合态形式。HMA 大鼠的尿液和粪便中的代谢物主要是柚皮素、根皮素、圣草酚、4-HPPA、3-(3,4-二羟苯基)丙酸、3-(3-羟苯基)丙酸和4-羟基肉桂酸的自由态以及各自的结合态形式。4-HPPA在结肠癌细胞中可以抑制环氧合酶的表达[81]。同时,HMA 大鼠的代谢物在摄入A7G 的24 h 之后就可检测到,但是无菌大鼠的代谢物需要在摄入A7G 的48 h 之后才能检测到。这表明肠道菌群会缩短胃肠道内A7G 的转运时间[80]。这些结果表明肠道菌群通过转化芹黄素糖苷以及它的代谢物来影响其母体的生物利用度。所以肠道菌群可以提高黄酮类化合物的生物利用度。
4.3 肠道菌群对黄烷-3 醇类的代谢
儿茶素是黄烷-3 醇类中的一种,主要来源于茶叶、梅子和可可豆等。儿茶素的代谢产物具有抗氧化、降血糖和保护神经中枢等作用[82-83]。Kutschera 等[84]从人类粪便悬浊液中分离出迟缓埃格特菌(Eggerthella lenta)和普氏梭杆菌(Flavonifractor plautii)两株菌,进而探讨它们对儿茶素的转化作用。研究表明迟缓埃格特菌可以将儿茶素的C 环开环,变成1(3,4-二羟苯基)-3-(2,4,6-三羟苯基)异丙醇。接着普氏梭杆菌将其继续分解成5-(3,4-二羟苯基)γ-戊内酯和4-羟基-5(3,4-二羟苯基)戊酸。花青素通常被认为相对于其它黄酮类化合物,生物利用度是较低的。但是,在最近的报道中,却发现花青素的生物利用度被低估了[85]。研究发现,花青素的生物活性不仅来自其本身,还来自肠道菌群代谢母体化合物产生的代谢产物[86]。Cheng 等[87]研究了肠道益生菌对桑葚花青素的转化,用5 种肠道益生菌和花青素在体外厌氧孵化。研究表明,5 种肠道益生菌降解了31.24%~46.17%的花青素,生成原儿茶酸、绿原酸和阿魏酸等生物可利用性代谢产物。Gonzalez-Barrio 等[88]研究了花青素在体内外的代谢过程,通过应用体外厌氧发酵模型和人体饮食摄入覆盆子的模型来进行。体外厌氧发酵模型研究发现在高温下酶失活的肠道菌群不能将花青素分解,表明菌群酶系的失活是花青素能否代谢的关键。人体摄入覆盆子后,尿液中的4'-羟基苯乙酸、3',4'-二羟基苯乙酸、3-(4'-羟苯基)乳酸、4'-羟基马尿酸和马尿酸的量显著增加。而且这些酚酸的量增加大多来自覆盆子中的花青素。这些酚酸的产生是因为肠道菌群分解花青素糖苷,产生游离花青素,A 环和B 环中间的花青素骨架进而开环形成酚酸。同时不同个体的菌群差异也会导致花青素的酚酸代谢物有所不同[88]。而且大量的酚酸代谢物已经报道具有降血糖、抗炎和神经保护作用[89-90]。这些结果表明肠道菌群可以代谢黄酮类化合物来发挥其生物学活性。
4.4 肠道菌群对其它黄酮类化合物的代谢
肠道菌群不仅能代谢黄烷酮类、黄酮类和黄烷-3 醇类,还能代谢异黄酮类、黄酮醇类和黄烷酮醇类等其它黄酮类化合物。大豆异黄酮是豆科植物里面含量较为丰富的异黄酮。Rafii 等[91]报道了在摄食大豆异黄酮后,肠道菌群可以将其代谢成雌马酚,这是一种雌激素的类似物,可以减轻妇女绝经期的相关症状。山奈酚,3,4′,5,7-四羟基黄酮,是一种具有缓解气管炎症状的黄酮醇[92]。Vollmer 等[93]研究了人体的粪便对山奈酚的体外发酵,研究发现人体的肠道菌群可以将山奈酚先开环成4-HPPA,接着脱羟基变成3-苯基丙酸,最后再代谢成苯乙酸。花旗松素是一种广泛存在于花旗松、洋葱和水飞蓟的黄烷酮醇[94]。Braune 等[95]利用细支真杆菌分泌的还原酶去体外催化花旗松素,结果表明花旗松素在细支真杆菌的还原酶催化下,开环形成高朦胧木素(alphitonin)。因此,肠道菌群以及自身产生的酶能将黄酮类化合物代谢成各种酚酸类的小分子物质,更加有利于它们在体内的生物转化。
5 结论
肠道菌群对人体健康有非常重要的调控作用。当肠道菌群处于稳态时,可以帮助人体维持身体健康。但当肠道菌群长期处于紊乱状态,就可能会增加人体患上炎症性肠炎、肥胖和结直肠癌等慢性疾病的风险。黄酮类化合物可以通过调控肠道菌群来预防和辅助治疗某些慢性疾病。其作用机制可能是(且不限于)通过促进益生菌的生长和抑制病原菌的繁殖,增加菌群的多样性,促进一些像短链脂肪酸等有益代谢物的产生来维持机体健康。与此同时,人体在摄入黄酮类物质之后,也依赖肠道菌群将其代谢成各种小分子活性物质。肠道菌群通过其自身介导的生物转化过程,也会提高黄酮类化合物的生物利用度,促进其发挥更强的生物学活性。因此,肠道菌群和黄酮类化合物这种相辅相成的关系(图4)将是相关领域未来研究的重点和方向。
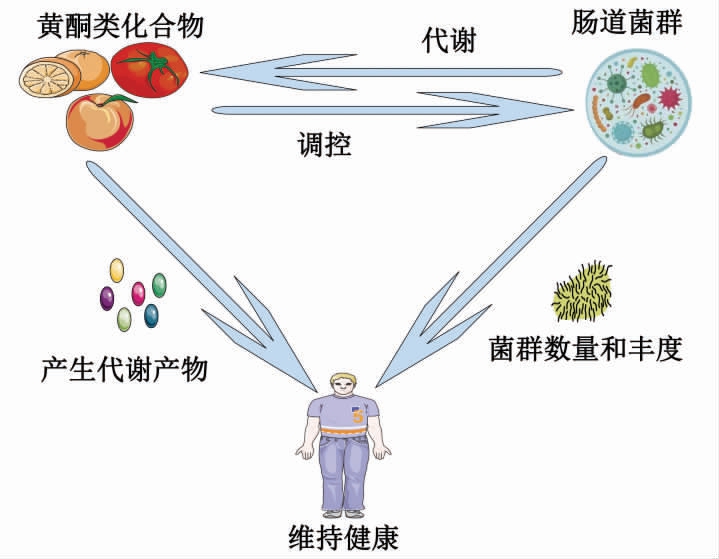
图4 黄酮类化合物和肠道菌群的相互作用
Fig.4 Interactions between flavonoids and gut microbiota
6 展望
黄酮类化合物具有多种有益健康的生物学活性,是营养膳食不可或缺的部分,同时也是开发功能性食品的重要原料。但是,其生物学活性的作用机制仍不完善,因此对于黄酮类化合物与肠道菌群的相互作用的机制还需要进一步深入研究,进而为促进黄酮类化合物的应用提供理论基础。一方面,由于不同个体的肠道菌群是有所差异的,同一种黄酮类化合物与不同个体会产生的生理作用也具有极大差异。因此在未来的研究中,探究不同的肠道菌对黄酮类化合物的具体转化作用及量效关系,对于明确黄酮类化合物的个体效应,进而促进个性化饮食及个性化治疗的发展,具有极其重要的作用。另一方面,由于黄酮类化合物会与膳食中的其它组分进行反应,进而影响菌群与黄酮类化合物的相互作用。因此,在明晰了黄酮类化合物与肠道菌群相互作用的基础上,应当进一步研究复杂膳食体系对于这种相互作用的影响。
[1]GAO Z,GAO W,ZENG S,et al.Chemical structures,bioactivities and molecular mechanisms of citrus polymethoxyflavones[J].Journal of Functional Foods,2018,40:498-509.
[2]PARK M,CHOI J,LEE H.Flavonoid-rich orange juice intake and altered gut microbiome in young adults with depressive symptom:A randomized controlled study[J].Nutrients,2020,12(6):1815.
[3]PIAO Y,EUN J.Physicochemical characteristics and isoflavones content during manufacture of shorttime fermented soybean product(cheonggukjang)[J].Journal of Food Science and Technology-Mysore,2020,57(6):2190-2197.
[4]RYTSYK O,SOROKA Y,SHEPET I,et al.Experimental evaluation of the effectiveness of resveratrol as an antioxidant in colon cancer prevention[J].Natural Product Communications,2020,15(6):1-10.
[5]ZHAO C,WANG F,LIAN Y,et al.Biosynthesis of citrus flavonoids and their health effects[J].Critical Reviews in Food Science and Nutrition,2020,60(4):566-583.
[6]PANCHE A N,DIWAN A D,CHANDRA S R.Flavonoids:an overview[J].Journal of Nutritional Science,2016,5(e47):1-15.
[7]AROUI S,FETOUI H,KENANI A.Natural dietary compound naringin inhibits glioblastoma cancer neoangiogenesis[J].BMC Pharmacology & Toxicology,2020,21(1):46.
[8]OFOSU F K,ELAHI F,DALIRI E B,et al.Flavonoids in decorticated sorghum grains exert antioxidant,antidiabetic and antiobesity activities [J].Molecules(Basel,Switzerland),2020,25(12):2854.
[9]WANG J,CHI Z,ZHAO K,et al.A transcriptome analysis of the antibacterial mechanism of flavonoids from Sedum aizoon L.against Shewanella putrefaciens[J].World Journal of Microbiology & Biotech nology,2020,36(7):94.
[10]MARQUEZ CAMPOS E,JAKOBS L,SIMON M.Antidiabetic effects of flavan-3-ols and their microbial metabolites[J].Nutrients,2020,12(6):1592.
[11]STEVENS Y,VAN RYMENANT E,GROOTAERT C,et al.The intestinal fate of citrus flavanones and their effects on gastrointestinal health[J].Nutrients,2019,11(7):1464.
[12]MALEKI S J,CRESPO J F,CABANILLAS B.Anti-inflammatory effects of flavonoids[J].Food Chemistry,2019,299:125124.
[13]WANG T,LI Q,BI K.Bioactive flavonoids in medicinal plants:Structure,activity and biological fate[J].Asian Journal of Pharmaceutical Sciences,2018,13(1):12-23.
[14]KUMAR S,PANDEY A K.Chemistry and biological activities of flavonoids:An overview[J].Scientific World Journal,2013,2013:162750.
[15]CHEN L,TENG H,JIA Z,et al.Intracellular signaling pathways of inflammation modulated by dietary flavonoids:The most recent evidence[J].Critical Reviews in Food Science and Nutrition,2018,58(17):2908-2924.
[16]LI X,WANG T,BIN Z,et al.Chemical composition and antioxidant and anti-inflammatory potential of peels and flesh from 10 different pear varieties(Pyrus spp.)[J].Food Chemistry,2014,152:531-538.
[17]GREINER A K,PAPINENI R V L,UMAR S.Chemoprevention in gastrointestinal physiology and disease.Natural products and microbiome[J].American Journal of Physiology-Gastrointestinal and Liver Physiology,2014,307(1):G1-G15.
[18]TOMASELLO G,MAZZOLA M,LEONE A,et al.Nutrition,oxidative stress and intestinal dysbiosis:Influence of diet on gut microbiota in inflammatory bowel diseases[J].Biomedical Papers-Olomouc,2016,160(4):461-466.
[19]COSTELLO E K,LAUBER C L,HAMADY M,et al.Bacterial community variation in human body habitats across space and time[J].Science,2009,326(5960):1694-1697.
[20]LEWIS J D,ABREU M T.Diet as a trigger or therapy for inflammatory bowel diseases[J].Gastroenterology,2017,152(2SI):398.
[21]SINGH A K,CABRAL C,KUMAR R,et al.Beneficial effects of dietary polyphenols on gut microbiota and strategies to improve delivery efficiency[J].Nutrients,2019,11(9):2216.
[22]DE FILIPPO C,CAVALIERI D,DI PAOLA M,et al.Impact of diet in shaping gut microbiota revealed by a comparative study in children from Europe and rural Africa[J].Proceedings of the National Academy of Sciences of the United States of America,2010,107(33):14691-14696.
[23]ROOKS M G,GARRETT W S.Gut microbiota,metabolites and host immunity[J].Nature Reviews Immunology,2016,16(6):341-352.
[24]BRAUNE A,BLAUT M.Bacterial species involved in the conversion of dietary flavonoids in the human gut[J].Gut Microbes,2016,7(3SI):216-234.
[25]HUTTENHOWER C,GEVERS D,KNIGHT R,et al.Structure,function and diversity of the healthy human microbiome[J].Nature,2012,486(7402):207-214.
[26]JANDHYALA S M,TALUKDAR R,SUBRAMANYAM C,et al.Role of the normal gut microbiota[J].World Journal of Gastroenterology,2015,21(29):8787-8803.
[27]YAN F,WANG L,SHI Y,et al.Berberine promotes recovery of colitis and inhibits inflammatory responses in colonic macrophages and epithelial cells in DSS-treated mice[J].American Journal of Physiology-Gastrointestinal and Liver Physiology,2012,302(5):G504-G514.
[28]AHMED I,ROY B C,KHAN S A,et al.Microbiome,metabolome and inflammatory bowel disease[J].Microorganisms,2016,4(2):20.
[29]NI J,WU G D,ALBENBERG L,et al.Gut microbiota and IBD:causation or correlation?[J].Nature Reviews Gastroenterology & Hepatology,2017,14(10):573-584.
[30]MANICHANH C,BORRUEL N,CASELLAS F,et al.The gut microbiota in IBD[J].Nature Reviews Gastroenterology & Hepatology,2012,9(10):599-608.
[31]COMITO D,CASCIO A,ROMANO C.Microbiota biodiversity in inflammatory bowel disease[J].Italian Journal of Pediatrics,2014,40:32.
[32]WALKER A W,SANDERSON J D,CHURCHER C,et al.High-throughput clone library analysis of the mucosa-associated microbiota reveals dysbiosis and differences between inflamed and non-inflamed regions of the intestine in inflammatory bowel disease[J].Bmc Microbiology,2011,11:7.
[33]KASER A,ZEISSIG S,BLUMBERG R S.Inflammatory bowel disease[J].Annual Review of Immunology,2010,28:573-621.
[34]SARTOR R B.Microbial influences in inflammatory bowel diseases[J].Gastroenterology,2008,134(2):577-594.
[35]HANSEN R,THOMSON J M,EL-OMAR E M,et al.The role of infection in the aetiology of inflammatory bowel disease[J].Journal of Gastroenterology,2010,45(3):266-276.
[36]MOKDAD A H,FORD E S,BOWMAN B A,et al.Prevalence of obesity,diabetes,and obesity-related health risk factors,2001[J].Jama-Journal of the American Medical Association,2003,289(1):76-79.
[37]CAO S,ZHAO C,XU X,et al.Dietary plants,gut microbiota,and obesity:Effects and mechanisms[J].Trends in Food Science & Technology,2019,92:194-204.
[38]BRAY F,FERLAY J,SOERJOMATARAM I,et al.Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J].Ca-A Cancer Journal for Clinicians,2018,68(6):394-424.
[39]HURTADO C G,WAN F,HOUSSEAU F,et al.Roles for interleukin 17 and adaptive immunity in pathogenesis of colorectal cancer[J].Gastroenterology,2018,155(6):1706-1715.
[40]LOUIS P,HOLD G L,FLINT H J.The gut microbiota,bacterial metabolites and colorectal cancer[J].Nature Reviews Microbiology,2014,12(10):661-672.
[41]LI Y,ZHANG T,CHEN G Y.Flavonoids and colorectal cancer prevention[J].Antioxidants,2018,7(12):187.
[42]ZITVOGEL L,GALLUZZI L,VIAUD S,et al.Cancer and the gut microbiota:An unexpected link[J].Science Translational Medicine,2015,7(271):271.
[43]HU L,WU C,ZHANG Z,et al.Pinocembrin protects against dextran sulfate sodium -induced rats colitis by ameliorating inflammation,improving barrier function and modulating gut microbiota[J].Frontiers in Physiology,2019,10:908.
[44]WU M,LI P,AN Y,et al.Phloretin ameliorates dextran sulfate sodium-induced ulcerative colitis in mice by regulating the gut microbiota[J].Pharmacological Research,2019,150:104489.
[45]PENG Y,YAN Y,WAN P,et al.Effects of longterm intake of anthocyanins from Lycium ruthenicum Murray on the organism health and gut microbiota in vivo[J].Food Research International,2020,130:108952.
[46]WU M,WU Y,DENG B,et al.Isoliquiritigenin decreases the incidence of colitis-associated colorectal cancer by modulating the intestinal microbiota[J].Oncotarget,2016,7(51):85318-85331.
[47]NOHARA K,NEMKOV T,D'ALESSANDRO A,et al.Coordinate regulation of cholesterol and bile acid metabolism by the clock modifier nobiletin in metabolically challenged old mice[J].Int J Mol Sci,2019,20(17):4281.
[48]XUAN H,OU A,HAO S,et al.Galangin protects against symptoms of dextran sodium sulfate-induced acute colitis by activating autophagy and modulating the gut microbiota[J].Nutrients,2020,12(2):347.
[49]ETXEBERRIA U,ARIAS N,BOQUE N,et al.Reshaping faecal gut microbiota composition by the intake of trans-resveratrol and quercetin in high-fat sucrose diet-fed rats[J].Journal of Nutritional Biochemistry,2015,26(6):651-660.
[50]ESTRUEL -AMADES S,MASSOT -CLADERA M,PEREZ-CANO F J,et al.Hesperidin effects on gut microbiota and gut -associated lymphoid tissue in healthy rats[J].Nutrients,2019,11(2):324.
[51]HE S,LI X,LI C,et al.Isoorientin attenuates benzo [a]pyrene-induced colonic injury and gut microbiota disorders in mice[J].Food Research International,2019,126:108599.
[52]WU D,DING L,TANG X,et al.Baicalin protects against hypertension-associated intestinal barrier impairment in part through enhanced microbial production of short-chain fatty acids[J].Frontiers in Pharmacology,2019,10:1271.
[53]LOPEZ P,SANCHEZ M,PEREZ-CRUZ C,et al.Long-term genistein consumption modifies gut microbiota,improving glucose metabolism,metabolic endotoxemia,and cognitive function in mice fed a high-fat diet[J].Molecular Nutrition & Food Research,2018,62(16):1800313.
[54]LIU J,YUE S,YANG Z,et al.Oral hydroxysafflor yellow A reduces obesity in mice by modulating the gut microbiota and serum metabolism[J].Pharmacological Research,2018,134:40-50.
[55]HILLS R D,PONTEFRACT B A,MISHCON H R,et al.Gut microbiome:Profound implications for diet and disease[J].Nutrients,2019,11(7):1613.
[56]COTILLARD A,KENNEDY S P,KONG L C,et al.Dietary intervention impact on gut microbial gene richness[J].Nature,2013,500(7464):585.
[57]KAWABATA K,YOSHIOKA Y,TERAO J.Role of intestinal microbiota in the bioavailability and physiological functions of dietary polyphenols[J].Molecules,2019,24(2):370.
[58]ZHANG F,HE F,LI L,et al.Bioavailability based on the gut microbiota:a new perspective[J].Microbiology and Molecular Biology Reviews:MMBR,2020,84(2):e00072-19.
[59]KELLY C J,ZHENG L,CAMPBELL E L,et al.Crosstalk between microbiota -derived short -chain fatty acids and intestinal epithelial HIF augments tissue barrier function [J].Cell Host & Microbe,2015,17(5):662-671.
[60]WANG H,SHI P,ZUO L,et al.Dietary non-digestible polysaccharides ameliorate intestinal epithelial barrier dysfunction in IL-10 knockout mice[J].Journal of Crohns & Colitis,2016,10(9):1076-1086.
[61]TREMAROLI V,BACKHED F.Functional interactions between the gut microbiota and host metabolism[J].Nature,2012,489(7415):242-249.
[62]TURNBAUGH P J,LEY R E,MAHOWALD M A,et al.An obesity-associated gut microbiome with increased capacity for energy harvest[J].Nature,2006,444(7122):1027-1031.
[63]CHAPUT N,LEPAGE P,COUTZAC C,et al.Baseline gut microbiota predicts clinical response and colitis in metastatic melanoma patients treated with ipilimumab[J].Annals of Oncology,2017,28(6):1368-1379.
[64]CASSIDY A,MINIHANE A.The role of metabolism(and the microbiome) in defining the clinical efficacy of dietary flavonoids[J].American Journal of Clinical Nutrition,2017,105(1):10-22.
[65]KARN A,ZHAO C,YANG F,et al.In-vivo biotransformation of citrus functional components and their effects on health[J].Critical Reviews in Food Science and Nutrition,2020,61(5):756-776.
[66]PEREZ-JIMENEZ J,HUBERT J,HOOPER L,et al.Urinary metabolites as biomarkers of polyphenol intake in humans:a systematic review[J].American Journal of Clinical Nutrition,2010,92(4):801-809.
[67]NIELSEN I,CHEE W,POULSEN L,et al.Bioavailability is improved by enzymatic modification of the citrus flavonoid hesperidin in humans:A randomized,double-blind,crossover trial[J].Journal of Nutrition,2006,136(2):404-408.
[68]MUROTA K,NAKAMURA Y,UEHARA M.Flavonoid metabolism:the interaction of metabolites and gut microbiota[J].Bioscience Biotechnology and Biochemistry,2018,82(4SI):600-610.
[69]TENG H,CHEN L.Polyphenols and bioavailability:an update[J].Critical Reviews in Food Science and Nutrition,2019,59(13):2040-2051.
[70]GONG X,LI X,BO A,et al.The interactions between gut microbiota and bioactive ingredients of traditional Chinese medicines:A review[J].Pharmacological Research,2020,157:104824.
[71]MAS-CAPDEVILA A,TEICHENNE J,DOMENECHCOCA C,et al.Effect of hesperidin on cardiovascular disease risk factors:the role of intestinal microbiota on hesperidin bioavailability[J].Nutrients,2020,12(5):1488.
[72]VAN RYMENANT E,SALDEN B,VOORSPOELS S,et al.A critical evaluation of in vitro hesperidin 2S bioavailability in a model combining luminal(microbial) digestion and Caco-2 cell absorption in comparison to a randomized controlled human trial[J].Molecular Nutrition & Food Research,2018,62(8):1700881.
[73]YU L,DONG X,XUE X,et al.Naringenin improves mitochondrial function and reduces cardiac damage following ischemia -reperfusion injury:the role of the AMPK-SIRT3 signaling pathway[J].Food& Function,2019,10(5):2752-2765.
[74]ZOU W,LUO Y,LIU M,et al.Human intestinal microbial metabolism of naringin[J].European Journal of Drug Metabolism and Pharmacokinetics,2015,40(3):363-367.
[75]PEREIRA -CARO G,FERNANDEZ -QUIROS B,LUDWIG I A,et al.Catabolism of citrus flavanones by the probiotics Bifidobacterium longum and Lactobacillus rhamnosus[J].European Journal of Nutrition,2018,57(1):231-242.
[76]ZHANG B,DONG Y,YU N,et al.Intestinal metabolism of baicalein after oral administration in mice:Pharmacokinetics and mechanisms[J].Journal of Functional Foods,2019,54:53-63.
[77]XING S,WANG M,PENG Y,et al.Effects of intestinal microecology on metabolism and pharmacokinetics of oral wogonoside and baicalin[J].Natural Product Communications,2017,12(4):509-514.
[78]LIN W,WANG W,YANG H,et al.Influence of intestinal microbiota on the catabolism of flavonoids in mice[J].Journal of Food Science,2016,81(12):H3026-H3034.
[79]MATTILA P,ASTOLA J,KUMPULAINEN J.Determination of flavonoids in plant material by HPLC with diode-array and electro-array detections[J].Journal of Agricultural and Food Chemistry,2000,48(12):5834-5841.
[80]HANSKE L,LOH G,SCZESNY S,et al.The bioavailability of apigenin-7-glucoside is influenced by human intestinal microbiota in rats[J].Journal of Nutrition,2009,139(6):1095-1102.
[81]KARLSSON P C,HUSS U,JENNER A,et al.Human fecal water inhibits COX-2 in colonic HT-29 cells:Role of phenolic compounds[J].Journal of Nutrition,2005,135(10):2343-2349.
[82]RAMIS M R,SARUBBO F,TEJADA S,et al.Chronic polyphenon-60 or catechin treatments increase brain monoamines syntheses and hippocampal SIRT1 LEVELS improving cognition in aged rats[J].Nutrients,2020,12(2):326.
[83]TAKAHASHI M,OZAKI M,TSUBOSAKA M,et al.Effects of timing of acute and consecutive catechin ingestion on postprandial glucose metabolism in mice and humans[J].Nutrients,2020,12(2):565.
[84]KUTSCHERA M,ENGST W,BLAUT M,et al.Isolation of catechin -converting human intestinal bacteria[J].Journal of Applied Microbiology,2011,111(1):165-175.
[85]CZANK C,CASSIDY A,ZHANG Q,et al.Human metabolism and elimination of the anthocyanin,cyanidin-3-glucoside:a C-13-tracer study[J].American Journal of Clinical Nutrition,2013,97(5):995-1003.
[86]HIDALGO M,MARTIN-SANTAMARIA S,RECIO I,et al.Potential anti-inflammatory,anti-adhesive,anti/estrogenic,and angiotensin -converting enzyme inhibitory activities of anthocyanins and their gut metabolites[J].Genes and Nutrition,2012,7(2):295-306.
[87]CHENG J,LIU X,CHEN Z,et al.Mulberry anthocyanin biotransformation by intestinal probiotics[J].Food Chemistry,2016,213:721-727.
[88]GONZALEZ-BARRIO R,EDWARDS C A,CROZIER A.Colonic catabolism of ellagitannins,ellagic acid,and raspberry anthocyanins:In vivo and in vitro studies[J].Drug Metabolism and Disposition,2011,39(9):1680-1688.
[89]VERZELLONI E,PELLACANI C,TAGLIAZUCCHI D,et al.Antiglycative and neuroprotective activity of colon-derived polyphenol catabolites[J].Molecular Nutrition & Food Research,2011,551(SI):S35-S43.
[90]LARROSA M,LUCERI C,VIVOLI E,et al.Polyphenol metabolites from colonic microbiota exert anti-inflammatory activity on different inflammation models[J].Molecular Nutrition & Food Research,2009,53(8):1044-1054.
[91]RAFII F.The role of colonic bacteria in the metabolism of the natural isoflavone daidzin to equol[J].Metabolites,2015,5(1):56-73.
[92]LI X,JIN F,LEE H J,et al.Kaempferol regulates the expression of airway MUC5AC mucin gene via IκBα-NF-κB p65 and p38-p44/42-Sp1 signaling pathways[J].Biomolecules & Therapeutics,2021,29(3):303-310.
[93]VOLLMER M,ESDERS S,FARQUHARSON F M,et al.Mutual interaction of phenolic compounds and microbiota:Metabolism of complex phenolic apigenin- C - and kaempferol - O - derivatives by human fecal samples[J].Journal of Agricultural and Food Chemistry,2018,66(2):485-497.
[94]ZHAN Z,WU M,SHANG Y,et al.Taxifolin ameliorate high-fat-diet feeding plus acute ethanol binge-induced steatohepatitis through inhibiting inflammatory caspase-1-dependent pyroptosis[J].Food& Function,2021,12(1):362-372.
[95]BRAUNE A,GÜTSCHOW M,BLAUT M,et al.An NADH -dependent reductase from eubacterium ramulus catalyzes the stereospecific heteroring cleavage of flavanones and flavanonols[J].Applied and Environmental Microbiology,2019,85(19):e01233-19.