在植物蛋白中,大豆蛋白是一种优质的植物蛋白来源,具有营养丰富、易加工、成本较低及保健功能等优点。大豆蛋白质作为食品基质中重要的组成部分在食品领域的应用越来越广泛,据预测,到2050年大豆将成为提供可持续性蛋白的首要来源[1-5]。
长期以来,大豆蛋白的功能性问题一直是研究重点。众多学者针对大豆分离蛋白(soy protein isolate SPI)、大豆球蛋白和伴大豆球蛋白进行了大量研究。早期研究认为大豆分离蛋白功能性质主要由11S 球蛋白和7S 球蛋白决定,而近年越来越多研究显示SPI 和11S 与7S 球蛋白混合体系行为的不一致性。2007年,Samoto 等[6]首次通过分步酸沉分离出磷脂含量约为10%的疏水性蛋白-大豆亲脂蛋白,他们建立了一种通过逐步调节pH值,依次获得11S、SLP 和7S 的方法。根据过往对大豆品种的研究和分离程序,得知7S、11S 和SLP的含量分别为23%,46%和31%[7-9]。与11S 和7S相比,SLP 对考马斯亮蓝的染色(用于检测凝胶电泳中分离的蛋白质带)相对不敏感,这可能是导致SLP 在早期研究中没有被认为是SPI 主要成分的原因。SLP 中的磷脂和疏水油体蛋白组合形成的复合界面,对维持乳液稳定性的效果良好,因此SLP 可以直接作为乳化剂使用。
多酚是具有多元酚状结构的次级代谢产物,不参与人体内正常的生长和能量代谢[10]。多酚来源丰富,包括水果(葡萄、苹果、梨、樱桃、浆果)、茶、咖啡、红酒、谷类食品、干豆和巧克力等食品,可作为有效的抗氧化剂[11-12]。这些化合物被证明可以诱导抗氧化酶(如超氧化物歧化酶和过氧化氢酶)的过度表达[13]。研究表明,多酚具有经济和健康优势,并能减少疾病。富含多酚的饮食是有效的抗氧化剂,既可以在体外发挥作用,也可以在体内发挥作用。多酚化合物,如白藜芦醇、槲皮素和姜黄素,作为一种具有抗衰老活性的含苯多羟基化合物,对氧化应激损伤具有保护作用;同时可以预防各种疾病,延长寿命[14]。
在食品体系中,酚类和蛋白质在储存和加工过程中的相互作用是无法避免的,可能会改变蛋白质的结构、功能和营养特性[15]。蛋白质和多酚相互作用引起功能性质的变化取决于其诱导的复合物的非共价或共价性质[15]。Sui 等[16]发现与非共价相互作用诱导的复合物相比,共价键合的SPI-花青素复合物的乳化性和起泡性能显著提高。此外,Liu 等[17]认为乳铁蛋白-绿原酸或乳铁蛋白-表没食子儿茶素没食子酸酯的共价复合物的稳定作用显著改善了乳状液的理化性能。多酚与蛋白质的共价结合可以展开蛋白质的结构,从而增加蛋白质在油滴表面的吸附量,提高乳状液的稳定性。
近年来,关于大豆蛋白与多酚互作已有一些研究,然而,对于亲脂蛋白与酚类物质互作的研究并不广泛,更多的研究集中在7S 或11S 与酚类化合物的相互作用上[18-20]。为了更好地了解植物多酚-蛋白质的相互作用,并在加工、运输和储存过程中控制食品中蛋白质的功能特性,本文综述亲脂蛋白-多酚复合物的功能性质及其潜在用途,总结亲脂蛋白与多酚的非共价和共价结合的机制,对于开发具有更好功能和生物活性的新型复合物用于食品系统具有重要的意义。
1 影响亲脂蛋白-多酚复合物形成的因素
影响亲脂蛋白与多酚之间相互作用的主要因素有两类,即外部因素(pH 值和温度)和内部因素(多酚的结构和类型)。这些因素决定了通过非共价或共价相互作用形成的蛋白质-多酚复合物的功能性质。
1.1 温度对亲脂蛋白多酚复合物形成的影响
温度可能通过疏水相互作用或氢键诱导亲脂蛋白质多酚复合物的形成。通常,加热会诱导蛋白质构象变化,并暴露先前包埋的疏水位点,从而影响疏水化合物的结合[21]。疏水基团的暴露可以引发与酚类化合物上的非极性基团的疏水相互作用。Bonomi 等[22]发现了酪蛋白与姜黄素之间的疏水相互作用。Suryaprakash 等[23]发现,随着温度在10~45 ℃范围内升高,咖啡酸可以通过离子或氢键与向日葵蛋白(向日葵种子中的多亚基蛋白)中的赖氨酸、色氨酸和酪氨酸残基相互作用。但当温度从40 ℃升高至90 ℃时,牛血清白蛋白(BSA)与没食子酸、阿魏酸和绿原酸之间疏水作用的亲和力降低[15]。在适当的温度下加热会导致亲脂蛋白的部分变性和构象变化,从而暴露更多的结合位点,并且加热可诱导亲脂蛋白和多酚之间的共价相互作用。加热时,多酚发生氧化,导致形成醌衍生物。但是,这种方法可能会导致多酚分解,从而丧失其生物活性。因此,温度是影响亲脂蛋白与多酚相互作用,功能特性以及生物活性的重要参数之一。
1.2 pH 值对亲脂蛋白多酚复合物形成的影响
亲脂蛋白多酚复合物可以通过共价或非共价相互作用在很宽的pH 值范围(4.0~10.0)内形成[24]。在低pH 值(pH<7.0)条件下,亲脂蛋白发生解离,导致结合位点暴露出来,从而通过静电相互作用与多酚发生相互作用[15]。几种球状蛋白质(例如牛血乳清蛋白)在pH 4.9 时与单宁酸结合的亲和力比在pH 7.8 时更高。然而,Rawel 等[25]发现没食子酸与牛血清白蛋白在pH 3.5 条件下的结合作用很弱。随着pH 值的增加(pH>7.0),蛋白质和多酚之间的共价相互作用通过非酶促氧化进行。多酚在碱性pH 值条件下容易被氧化成自由基和醌。随后,这些化合物与蛋白质进行共价相互作用[24]。这些现象表明了pH 值对亲脂蛋白构象或多酚结构具有一定的影响,从而确定SLP 与多酚具有相互作用并可以生成复合物。
1.3 多酚的类型对亲脂蛋白-多酚复合物形成的影响
多酚是一种多样化的化合物,大致分为四类,包括酚酸、黄酮、木脂素和羟基肉桂酸[26]。每一类都根据杂环的氧化程度进行分类。因此,不同的酚类化合物在分子质量、羟基化、甲基化、氢化和糖基化方面各不相同,这会影响亲脂蛋白-多酚的相互作用。Dubeau 等[27]研究表明,亲脂蛋白与多酚的结合亲和力主要取决于它们的分子大小。与黄酮(儿茶素)单体相比,红茶中较大的酚类化合物,如茶红素和茶黄素,对牛奶蛋白的反应显示出更高的偏好,因为在较大的酚类化合物的情况下,可用于相互作用的结合位点更多[27]。Chanphai 等[28]研究发现稳定的多酚-β-乳球蛋白复合物,其载药率由高到低依次为:表没食子儿茶素没食子酸酯(EGCG)>表儿茶素没食子酸酯(ECG)>表儿茶素(EC)>儿茶素(C)。Chanphai 等[29]还观察到,儿茶素与不同蛋白形成的复合物的负载效率也不同。儿茶素的载药率越高,多酚-蛋白质结合物的稳定性越高。此外,多酚的羟基化程度也被证明影响亲脂蛋白与多酚的复合亲和力和负载效率。黄酮类化合物的羟基化水平越高,与牛血乳清蛋白的结合效率就越高[30]。Hasni 等[31]发现酪蛋白多酚复合物的负载率随多酚中羟基数量的增加而增加,其顺序为:儿茶素表儿茶素>表儿茶素没食子酸酯>EGCG。Jarosaw 等[26]研究发现黄酮类化合物的羟基化可以提高结合效率,而甲基化降低了亲和力。然而,多酚的氢化是导致复合亲和力降低的原因。黄酮类化合物C2=C3 双键的氢化会降低膳食多酚与牛奶蛋白的结合亲和力[32]。
2 大豆亲脂蛋白-多酚复合物的功能特性
大豆亲脂蛋白和多酚分别具有不同的功能特性。亲脂蛋白和多酚制备的复合物可能产生具有独特或多功能属性,如胶凝性、起泡性和乳化特性。复合物的抗氧化性能也有所提高。
2.1 乳化性
食品中乳状液通常由水相和油相组成。由于两不相容相间的界面面积较大,乳液的热力学稳定性较差。在加工或储存过程中经常观察到絮凝与沉淀。加入乳化剂可以起到稳定乳液的作用。乳化剂是一种两亲性成分,它自身定位在油/水界面,可以降低界面张力,并减少絮凝和沉淀[33]。蛋白质与多酚的复合可有效改善蛋白质功能特性。
亲脂蛋白的主要蛋白质是蛋白磷脂复合物(OL-PL),它是油体的原始成分,与油有亲和力,因此亲脂蛋白表现出较高的表面活性。在水中加入0.0001%亲脂蛋白可使表面张力降低10 mN/m,而加入等量的大豆球蛋白和β-伴大豆球蛋白则无明显变化。说明亲脂蛋白的表面活性优于大豆球蛋白和β-伴大豆球蛋白,具有作为一种优良乳化剂的潜力。在高浓度盐和表面活性剂存在下,亲脂蛋白复合乳液表现出较好的稳定性,而大豆球蛋白和β-伴大豆球蛋白乳状液表现出明显的絮凝[34]。此外,多酚部分的共价结合可以改变亲脂蛋白的构象,增加其表面疏水性,从而降低界面张力[26]。蛋白质-多酚复合物对乳状液的形成有负面影响,而对乳状液的稳定性有正向影响。Chen 等[35]最近的一项研究中发现单宁酸与卵清蛋白有很强的相互作用。卵清蛋白单宁酸的复合物对卵清蛋白的疏水基团产生了掩盖,从而降低了卵清蛋白的界面活性。单宁酸的加入降低了乳化力,但通过在卵蛋白等电点延缓乳状液的乳化,提高了乳状液的稳定性。这种现象可能是由于单宁酸的存在增强了乳液滴之间的静电斥力,可能会阻止液滴在卵蛋白等电点附近聚集[35]。
2.2 凝胶性
许多植物多酚与蛋白质相互作用后,可以形成具有优良性质的凝胶。由共价相互作用形成的凝胶与由其它非共价相互作用形成的凝胶具有更好的热稳定性。Strauss 等[36]发现含有多酚的凝胶的机械强度和硬度显著增加。加入多酚的复合物可以显著增强凝胶强度,表面更致密。Staszewski等[37]的研究发现,绿茶多酚修饰的β-乳球蛋白的凝胶温度更低,凝胶时间更短,从而提高了凝胶的稳定性。将茶多酚加入到β-乳球蛋白中会影响凝胶的黏弹性。由于多酚的种类不同,可以充分发挥亲脂蛋白与多酚的共价复合,用来制备具有更好凝胶性能的亲脂蛋白-多酚复合物。
2.3 抗氧化性
抗氧化活性是蛋白质-多酚结合物最重要的性质之一。有研究表明,蛋白多酚复合物可以比初始蛋白显示出更强的抗氧化活性[38-39]。Jiang 等[40]发现,当乳清蛋白和酪蛋白与绿原酸复合时,自由基清除能力明显增强,EGCG 与乳清蛋白、α-酪蛋白、β-乳球蛋白和β-酪蛋白复合物的抗氧化活性高于天然蛋白。Chen 等[41]研究了用绿原酸或单宁酸复合的猪血浆蛋白复合物的抗氧化活性,结果表明随着多酚浓度的增加,复合物的自由基清除活性、螯合活性都有显著增加。在所有的复合物中,卵清蛋白-EGCG 复合物具有最高的抗氧化活性。蛋白多酚复合物抗氧化活性的增加是因为将多酚中的羟基引入蛋白质中。因此,蛋白多酚复合物可以用来增强抗氧化性能,改善几种脂类食品的氧化稳定性。
3 大豆亲脂肪蛋白-多酚复合物的形成机理
基本上,大豆亲脂蛋白和多酚能够通过疏水键、离子键和氢键等非共价键或共价键相互作用[42],并且是可逆的。然而,由于共价键形成的结合物更牢固,相互作用更持久,稳定性更高,在碱性条件下,多酚被氧化成相应的醌,随后这些醌与蛋白质侧链上的赖氨酸或半胱氨酸残基等反应,分别形成C-N 键或CS-键[43],因此更优选用于食品[44]。蛋白多酚复合物一般可以通过碱性反应或自由基接枝的非酶反应或多酚氧化酶、漆酶、酪氨酸酶等的酶促反应共价形成[44-45]。
3.1 大豆亲脂蛋白与多酚之间的非共价相互作用
大豆亲脂蛋白和多酚之间的非共价相互作用通常是可逆的相互作用,并且与共价反应相比相对较弱[46-47]。一般来说,主要是氢键和疏水相互作用参与大豆亲脂蛋白-多酚复合物的形成 [48-49]。酚类基团一直被认为是优秀的供氢体,可以与亲脂蛋白的C=O 基团形成氢键[50]。此外,多酚羟基基团与氧或氮,特别是蛋白质的羟基(-OH)和氨基(-NH2)之间的相互作用也形成氢键[51]。Ojha 等[52]发现阿魏酸的酚羟基可以通过形成氢键与牛血清白蛋白主要多肽链的C,O 和NH 相互作用。EGCG 与人血清白蛋白的结合位点为Glu 141、Leu 182、Tyr 138、Tyr 161,从而形成氢键[53]。Chanphai 等[54]研究发现酪蛋白能够通过氢键和疏水相互作用在Phe 23、Phe 24、Phe 28、Phe 32、Val 31 残基与儿茶素相互作用。
大豆亲脂蛋白质和多酚的结合也涉及疏水相互作用,其中亲脂蛋白的疏水氨基酸(亮氨酸、异亮氨酸、甘氨酸、蛋氨酸、丙氨酸、苯丙氨酸、缬氨酸、酪氨酸、半胱氨酸和色氨酸)残基与多酚的非极性芳环相互作用[55]。其它相互作用,例如离子键,可以在亲脂蛋白-多酚相互作用中发挥次要作用,在这种相互作用中,亲脂蛋白的正电荷基团,如赖氨酸的ε-氨基与多酚的负电荷羟基反应[56]。非共价蛋白质-多酚相互作用通常是不同相互作用组合的结果[44]。虽然形成的键可能是可逆的,能量较低,但亲脂蛋白-多酚的非共价相互作用可能在食品工业中发挥重要作用,以改善食品的功能和质量。
3.2 大豆亲脂蛋白与多酚的共价相互作用
大豆亲脂蛋白与多酚可以通过碱性和酶反应进行共价结合以及蛋白质的交联,也可利用自由基接枝法实现亲脂蛋白与多酚的共价复合和蛋白质的交联。这是两种广泛使用的共价制备亲脂蛋白和多酚复合物的常用方法。碱性反应是用于多酚和亲脂蛋白偶联的常用非酶方法之一[41]。多酚在有氧存在的碱性条件下(pH 9.0)容易氧化生成半醌自由基,再重排成醌基。这些反应性中间产物很容易与亲脂蛋白侧链中的残基如蛋氨酸、赖氨酸、色氨酸和半胱氨酸等基团的反应。因此,亲脂蛋白和多酚之间可以形成共价交联(C-N 或C-S)[44]。Ishii 等[57]发现EGCG 主要与甘油醛-3-磷酸脱氢酶活性中心的半胱氨基-3-磷酸脱氢酶结合形成共价键。此外,儿茶素可以与蛋白质形成共价键,蛋白质结合的儿茶素可以在基于乳剂的体系中提高蛋白质的抗氧化活性[58]。
通过自由基接枝,抗坏血酸和过氧化氢用作引发剂体系进行氧化还原,事实证明这种非酶法是最简单快捷的,可用于亲脂蛋白和多酚的互作[45]。首先,位于亲脂蛋白质侧链的氨基酸被最初由氧化还原反应产生的羟基自由基氧化,自由基在蛋白质分子上通过共价键与多酚发生反应,从而形成亲脂蛋白-多酚复合物。Gu 等[45]证明,自由基诱导的共轭物表现出比碱性方法更高的抗氧化活性。此外,该反应可以在室温下进行而不会产生有毒产物或抗氧化剂分解。因此,该方法被认为是生产生物活性蛋白-多酚复合物的有效方法。
酶催化形成亲脂蛋白与多酚复合物方法中,首先是单酚酶(或甲酚酶)诱导的单酚氧化为邻二酚的反应。随后,在氧气存在下使用邻二酚酶(或儿茶酚酶)将邻二酚转化为邻醌[59]。另一方面,醌也可以由漆酶形成,漆酶可以同时氧化邻二酚和对二酚[60]。醌可以很容易地与蛋白质链中的氨基酸残基相互作用而形成交联的蛋白质或聚合物。酶法通常被认为是具有高特异性的方法,且对环境因素要求不高。酶促反应的复合物表现出强的自由基清除活性。但是,使用的制备方法和步骤复杂且成本高[45]。
综上所述,大豆脂蛋白与多酚形成复合物的互作机理如图1所示。
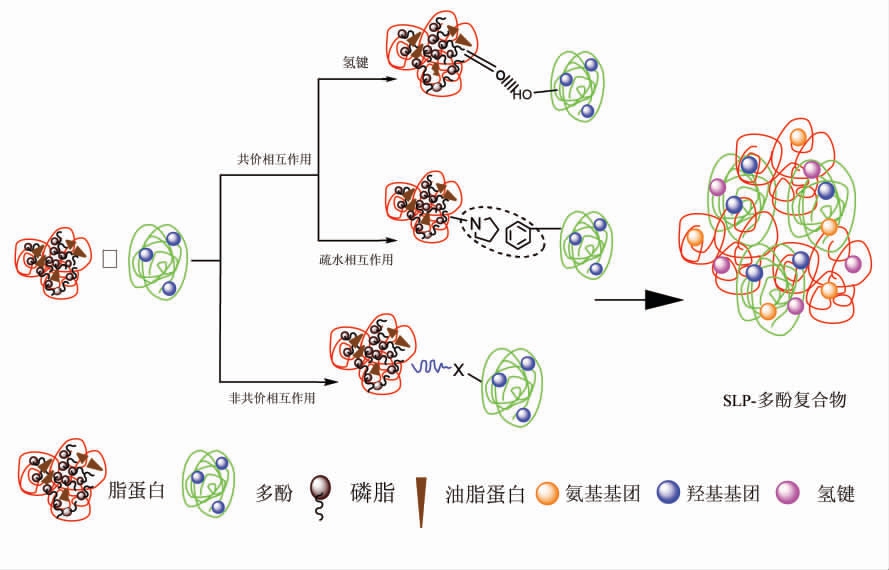
图1 脂蛋白-多酚互作机理图
Fig.1 Mechanism diagram of lipoprotein polyphenol interaction
4 脂蛋白-多酚复合物的潜在应用及展望
脂蛋白和多酚作为食品体系中重要的组成部分,会有越来越多针对两者和其复合物的研究,且近些年对大豆植物蛋白的研究愈加的深入与广泛,相信在不久的将来亲脂蛋白与多酚的复合产物会越来越多的出现在公众面前。
4.1 皮克林乳液
采用亲脂蛋白和多酚(花色苷)制备一种新型的复合纳米粒子稳定的皮克林乳状液。亲脂蛋白和多酚在纳米颗粒中共价键合,制备具有氧化稳定性的皮克林乳液。皮克林乳状液表现出许多优良的特性,包括乳状液稳定性、更好的氧化稳定性和抗体外消化能力。该乳状液在低热量食品生产与应用中有很大市场潜力。
4.2 蛋白质基膜
可食性薄膜或蛋白质基膜是涂在食品上的薄层,具有保护食品和提高食品质量的作用。薄膜是从自然产生的可再生资源,如亲脂蛋白与多酚的复合物中制备的,可以直接食用。这些薄膜对环境友好,含有抗氧化剂、防褐变剂和着色剂,具有很好的发展前景。
4.3 传送载体
亲脂蛋白-多酚复合物的研究证明,复合物对疏水和亲水化合物都具有很强的亲和力。因此,亲脂蛋白-多酚复合物可用作多种生物活性化合物的载体,如药物、脂肪酸、类固醇激素和许多其它亲脂性化合物。牛奶蛋白-多酚结合物作为生物活性物质的载体已被广泛研究。因此亲脂蛋白-多酚复合物同样可以被认为是潜在的营养物质递送载体。
[1]LIU Y,YANG J,LEI L,et al.7S protein is more effective than total soybean protein isolate in reducing plasma cholesterol[J].Journal of Functional Foods,2017,36(9):18-26.
[2]REYNOLDS L P,WULSTER-RADCLIFFE M C,AARON D K,et al.Importance of animals in agricultural sustainability and food security[J].Journal of Nutrition,2015,145(7):1377-1379.
[3]CHEN K I,ERH M H,SU N W,et al.Soyfoods and soybean products:From traditional use to modern applications[J].Applied Microbiology and Biotechnology,2012,96(1):9-22.
[4]曾剑华,刘琳琳,杨杨,等.大豆蛋白热改性及其解离缔合反应研究进展[J].大豆科学,2019,38(1):142-147,158.
ZENG J H,LIU L L,YANG Y,et al.Research progress on thermal modification and its dissociation association action of soy proteins[J].Soybean Science,2019,38(1):142-147,158.
[5]曾剑华,杨杨,刘琳琳,等.热处理过程中大豆11s 球蛋白解离缔合行为研究进展[J].食品科学,2019,40(11):303-312.
ZENG J H,YANG Y,LIU L L,et al.Research progress on thermal modification and its dissociation association action of soy proteins[J].Soybean Science,2019,40(11):303-312.
[6]SAMOTO M,MAEBUCHI M,MIYAZAKI C,et al.Abundant proteins associated with lecithin in soy protein isolate[J].Food Chemistry,2007,102(1):317-322.
[7]HUGHES S A,MURPHY P A.Varietal influences on the quantity of glycinin in soybeans[J].Journal of Agricultural and Food Chemistry,1983,31(2):357-369.
[8]KHATIB K A,HERALD T J,ARAMOUNI E M,et al.Characterization and functional properties of soy β-congycnin and glycinin of selected genotypes[J].Journal of Food Science,2010,67(8):2923-2929.
[9]LIU C,WANG H,CUI Z,et al.Optimization of extraction and isolation for 11S and 7S globulins of soybean seed storage protein[J].Food Chemistry,2007,102(4):1310-1316.
[10]HAMLY J M,BHAGWAST S,LIN L Z.Profilingmethods for the determination of phenolic compoundsin foods and dietary supplements [J].Anal BioanalChem,2007,389(1):47-61.
[11]MENAA F,MENAA A,TRÉTON J.Polyphenols against skin aging,polyphenols in human health and disease[J].Elsevier,2014,1(49):819-830.
[12]PANDEY K B,RIZVI S I.Plant polyphenols as dietary antioxidants in human healthand disease[J].Oxidative Med.Cell.Longev.,2009,2(5):270-278.
[13]SHEN Y,ZHANG H,CHENG L,et al.In vitro and in vivo anti-oxidant activity of polyphenols extracted from black highland barley[J].Food Chem,2016,194:1003-1012.
[14]SALEHI A,EMAMI S,KEIGHOBADI M,et al.An overview of the effects ofpolyphenols on cardiac mitochondrial function[J].Journal of Mazandaran Universityof Medical Sciences,2019,28(170):211-224.
[15]OZDAL T,CAPANOGLU E,ALTAY F.A review on protein -phenolic interactions and associated changes[J].Food Research International,2013,51(2):954-970.
[16]SUI X,SUN H,Qi B,et al.Functional and conformational changes to soy proteins accompanying anthocyanins:Focus on covalent and non-covalent interactions[J].Food Chemistry,2017,245:871-878.
[17]LIU F,WANG D,SUN C,et al.Utilization of interfacial engineering to improve physicochemical stability of β-carotene emulsions:Multilayer coatings formed using protein and protein-polyphenol conjugates[J].Food Chemistry,2016,205:129-139.
[18]CHEN S,ZHANG N,TANG C H.Influence ofnanocomplexation with curcumin on emulsifyingproperties and emulsion oxidative stability of soyprotein isolate at p H 3.0 and 7.0[J].Food Hydrocol-loids,2016,61(12):102-112.
[19]LI M,JIA X,YANG J,et al.Effect of tannic acid on properties of soybean(Glycine max) seed ferritin:A model for interaction between naturally-occurring components in foodstuffs[J].Food Chemistry,2012,133(2):410-415.
[20]WAN Z L,WANG J M,WANG L Y,et al.Complexation of resveratrol with soy protein and its improvement on oxidative stability of corn oil/water emulsions[J].Food Chemistry,2014,161:324-331.
[21]KULMYRZAEY A A,LEVIEUX D,DUFOR É.Front-face fluorescence spectroscopyallows the characterization of mild heat treatments applied to milk.relations with thedenaturation of milk proteins[J].Journal of Agricultural and Food Chemistry,2005,53(3):502-507.
[22]BONOMI F,IAMETTI S,PAGLIARINI E,et al.A spectrofluorimetric approach to the estimation of the surface hydrophobicity modifications in milk proteins upon thermal treatment[J].Milchwissenschaft,1988,43(5):281-285.
[23]SURYAPRAKASH P,KUMAR R P,PEAKASH V.Thermodynamics of interaction of caffeic acid and quinic acid with multisubunit proteins[J].International Journal of Biological Macromolecules,2000,27(3):219-228.
[24]WANG X,ZHANG J,LEI F,et al.Covalent complexation and functional evaluation of -epigallocatechin gallate and α-lactalbumin[J].Food Chemistry,2014,150:341-347.
[25]RAWEL H M,MEIDTNER K,KROLL,et al.Binding of selected phenolic compounds to proteins[J].Journal of Agricultural & Food Chemistry,2005,53(10):4228-4235.
[26]JAROSAW,CZUBINSKI,KRZYFZTOF,et al.A review of methods used for investigation of proteinphenolic compound interactions[J].International Journal of Food Science & Technology,2017,52(3):573-585.
[27]DUBEAU S,SAMSON G,TAJMIR-RIAHI H A.Dual effect of milk on the antioxidant capacity of green,darjeeling,and English breakfast teas[J].Food Chemistry,2010,122(3):539-545.
[28]CHANPHAI P,BOURASSA P,KANAKIS C D,et al.Review on the loading efficacy of dietary tea polyphenols with milk proteins[J].Food Hydrocolloids,2018,77:322-328.
[29]CHANPHAI P,TAJMIR-RIAHI H A.Tea polyphenols bind serum albumins:A potential application for polyphenol delivery - science direct[J].Food Hydrocolloids,2019,89(4):461-467.
[30]YILDIRIM -ELIKOGLU,ERDEM.Interactions between milk proteins and polyphenols:Binding mechanisms,related changes,and the future trends in the dairy industry[J].Food Reviews International,2018,34(7):665-697.
[31]HASNI I,BOURASSA P,HAMDANI S,et al.Interaction of milk α- and β-caseins with tea polyphenols[J].Food Chemistry,2011,126(2):630-639.
[32]XIAO J B,MAO F F,YANG F,et al.Interaction of dietary polyphenols with bovine milk proteins:molecular structure-affinity relationship and influencing bioactivity aspects[J].Molecular Nutrition &Food Research,2011,55(11):1637-1645.
[33]MCCLEMENTS,JLIAN D.Emulsion design to improve the delivery of functional lipophilic components[J].Annu Rev Food Sci Technol,2010,1(1):241-269.
[34]MATSUMURA,YASUKI,SIRISON,et al.Soybean lipophilic proteins - Origin and functional properties as affected by interaction with storage proteins[J].Current Opinion in Colloid and Interface Science,2017,28(1):120-128.
[35]CHEN Y,HU J,YI X,et al.Interactions and emulsifying properties of ovalbumin with tannic acid[J].LWT,2018,95(4):282-288.
[36]STRAUSS G,GIBSON S M.Plant phenolics as cross-linkers of gelatin gels and gelatin-based coacervates for use as food ingredients[J].Food Hydrocolloids,2004,18(1):81-89.
[37]STASZEWSKI M V,JARA F L,RUIZ A,et al.Nanocomplex formation between β-lactoglobulin or caseinomacropeptide and green tea polyphenols:Impact on protein gelation and polyphenols antiproliferative activity[J].Journal of Functional Foods,2012,4(4):800-809.
[38]FAN Y,LIU Y,GAO L,et al.Oxidative stability and in vitro digestion of menhaden oil emulsions with whey protein:effects of EGCG conjugation and interfacial cross-linking[J].Food Chemistry,2018,265:200-207.
[39]FENG J,CAI H,WANG H,et al.Improved oxidative stability of fish oil emulsion by grafted ovalbumincatechin conjugates[J].Food Chemistry,2018,241:60-69.
[40]JIANG J,ZHANG Z,JING Z,et al.The effect of non -covalent interaction of chlorogenic acid with whey protein and casein on physicochemical and radical-scavenging activity of in vitro protein digests[J].Food Chemistry,2018,268(12):334-341.
[41]CHEN Y,JIANG S,CHEN Q,et al.Antioxidant activities and emulsifying properties of porcine plasma protein hydrolysates modified by oxidized tannic acid and oxidized chlorogenic acid[J].Process Biochemistry,2019,79:105-113.
[42]YOU J,LUO Y,WU J.Conjugation of ovotransferrin with catechin shows improved antioxidant activity[J].Journal of Agricultural & Food Chemistry,2014,62(12):2581-2587.
[43]ROHN S.Possibilities and limitations in the analysis of covalent interactions between phenolic compounds and proteins[J].Food Research International,2014,65:13-19.
[44]LIU F G,MA C C,GAO Y X,et al.Food-grade covalent complexes and their application as nutraceutical delivery systems:A review[J].Comprehensive Reviews in Food Science & Food Safety,2016,16(1):76-95.
[45]GU L,PENG N,CHANG C,et al.Fabrication of surface-active antioxidant food biopolymers:Conjugation of catechin polymers to egg white proteins[J].Food Biophysics,2017,12(2):1-13.
[46]JAROSLAW,CZUBINSKI,KRZYSZTOF,et al.A review of methods used for investigation of proteinphenolic compound interactions[J].International Journal of Food Science & Technology,2017,52(3):573-585.
[47]JAKOBEK,LIDIJA.Interactions of polyphenols with carbohydrates,lipids and proteins[J].Food Chemistry,2015,175(5):556-567.
[48]BOURVELEC C L,RENARD C M G C.Interactions between polyphenols and macromolecules:Quantification methods and mechanisms[J].Critical Reviews in Food Science and Nutrition,2012,52(3):213-248.
[49]PRIGENT S V E,VORAGEN A G J,KOGINGSVELD G A V,et al.Interactions between globular proteins and procyanidins of dif ferent degrees of polymerization[J].Journal of Dairy Science,2009,92(12):5843-5853.
[50]NYDIA E,BUITIMEA-CANTUA,JANET A,et al.Phenolic-protein interactions:effects on food properties and health benefits [J].Journal of Medicinal Food,2018,21(2):188-198.
[51]YILDIRIM-ELIKOGLU S,ERDEM Y K.Interactions between milk proteins and polyphenols:Binding mechanisms,related changes,and the future trends in the dairy industry[J].Food Reviews International,2017,34(7):665-697.
[52]OJHA H,MISHRA K,HASSAN M I,et al.Spectroscopic and isothermal titration calorimetry studies of binding interaction of ferulic acid with bovine serum albumin[J].Thermochimica Acta,2012,548(11):56-64.
[53]CHANPHAI P,TAJMIR-RIAHI H A.Tea polyphenols bind serum albumins:A potential application for polyphenol delivery - science direct[J].Food Hydrocolloids,2019,89(11):461-467.
[54]CHANPHAI P,BOURASSA P,KANAKIS C D,et al.Review on the loading efficacy of dietary tea polyphenols with milk proteins[J].Food Hydrocolloids,2018,77:322-328.
[55]KANAKIS C,HASNI I,BORASSA P,et al.Milk β-lactoglobulin complexes with tea polyphenols[J].Food Chemistry,2011,127(3):1046-1055.
[56]BOURVELEC C L,RENARD C M G C.Interactions between polyphenols and macromolecules:Quantification methods and mechanisms[J].Critical Reviews in Food Science and Nutrition,2012,52(3):213-248.
[57]ISHII T,MORI T,TANAKA T,et al.Covalent modification of proteins by green tea polyphenol(-)-epigallocatechin-3-gallate through autoxidation[J].Free Radic Biol Med,2008,45(10):1384-1394.
[58]ALMAJANO M P,DELGAD M E,GORDON M H.Changes in the antioxidant properties of protein solutions in the presence of epigallocatechin gallate[J].Food Chemistry,2007,101(1):126-130.
[59]VELICKOVIC T,DJ STANIC-VUCINIC.The role of dietary phenolic compounds in protein digestion and processing technologies to Improve their antinutritive properties[J].Comprehensive Reviews in Food Science and Food Safety,2018,17(1):82-103.
[60]PRIGENT S V,VORAGEN A G,VISSER A J,et al.Covalent interactions between proteins and oxidation products of caffeoylquinic acid(chlorogenic acid)[J].Journal of the Science of Food & Agriculture,2010,87(13):2502-2510.