由微生物引起的食品污染和腐败是全球食品工业面临的两个主要问题,也是各国政府对食品质量安全与食品供应保障的关注焦点[1]。世界卫生组织(World Health Organization,WHO)报告,每年全世界约6 亿人口患食源性疾病,42 万人因食源性疾病而死亡,其中细菌污染是引起健康问题的主要原因[2-3]。此外,微生物腐败还造成全球约25%的食品损失,不但给生产者带来巨大经济压力,还加重了社会的环境负担[4]。食品腐败菌与致病微生物检测方法的建立(如细胞培养、菌落计数方法[5]、ELISA[6]、表面等离子共振[7]等)可在早期预测食品微生物的污染情况,对降低食源性疾病发病率和食品腐败具有重要意义。然而,这些方法常常繁琐、费时、灵敏度或特异性差,难以满足当前食品安全检测技术的市场需求[8]。
分子印迹聚合物(Molecularly imprinted polymers,MIPs) 是基于分子印迹技术(Molecularimprinting technology,MIT) 制备而成的高分子聚合物,可通过三维空间结构和分子间作用力(氢键作用力、范德华力、静电作用力、疏水作用力等)与模板分子或模板分子结构类似物特异性识别[9],已在食品中农兽药残留检测、活性成分分离、模拟酶催化危害物降解等方面进行了广泛研究[10-12]。
近年来,随着MIT 和纳米技术的发展,新型功能单体的开发以及蛋白、多糖、多肽等生物大分子印迹聚合物的成功制备大大促进了细菌、病毒等微生物印迹技术的发展及应用。本文主要综述微生物MIPs 合成方法以及分子印迹技术在食品腐败菌与致病微生物检测中的应用,为提升我国食品中有害微生物检测能力提供参考。
1 微生物MIPs 合成方法
与化学污染物相比,细菌、病毒等微生物体积大,表面化学成分多样(蛋白、脂多糖、肽聚糖等),构象柔顺多变,易受pH 值、有机溶剂、离子等多种因素影响[13-14]。因此,微生物MIPs 的制备多在水相体系或水-有机溶剂两相体系中进行。
1.1 乳液聚合法
乳液聚合是指模板分子分散在水相中在稳定剂作用下通过搅拌水相-油相形成乳液而制备生物大分子MIPs 的方法,该方法可保证蛋白等生物大分子模板在聚合过程中构象的稳定,提高了生物大分子MIPs 对目标物识别的特异性[15]。基于乳液聚合原理,Long 等[16]以铜绿假单胞菌(Pseudomonas aeruginosa) 细胞壁的特有成分脂多糖(Lipopolysaccharide,LPS)为模板分子,丙烯酰胺为功能单体、N,N-亚甲基双丙烯酰胺为交联剂,三者溶于蒸馏水为分散相(水相);以溶有表面活性剂聚氧乙烯月桂醚、磺基琥珀酸钠二辛酯的正己烷为连续相(油相),在过硫酸铵、N,N,N,N-四甲基乙二胺引发体系下制备了可选择性识别铜绿假单胞菌的分子印迹聚合物(图1)。
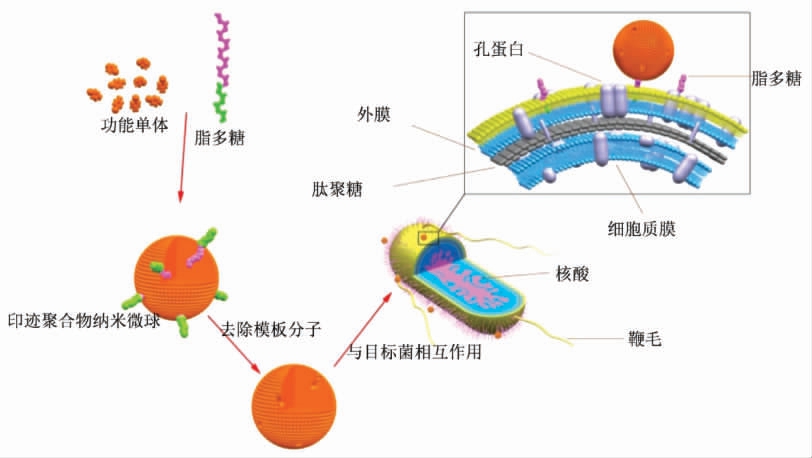
图1 分子印迹纳米微球特异性识别细菌的过程示意图[16]
Fig.1 Molecularly imprinted nanoparticles for specific recognition of bacteria[16]
以胶体粒子为稳定剂的乳液称为Pickering乳液,制备过程中不使用表面活性剂,已用于多种目标物的MIPs 制备过程中[14]。Shen 等[17]创新性的以乙烯基N-丙烯酸壳聚糖修饰的细菌为粒子稳定剂,构建水相中稳定的油相乳液,含有交联剂单体的油相通过自由基引发聚合,聚合过程中细菌被印迹在聚合物微球表面。洗脱细菌后,聚合物微球表面留下模板细菌的特异性吸附位点(图2)。依据同样方法,Zhao 等[18]合成了单增李斯特菌(Listeria monocytogenes)荧光MIPs。该合成方法简单,修饰物可根据细菌表面的理化性质进行调节,适合推广到其它微生物MIPs 的制备。
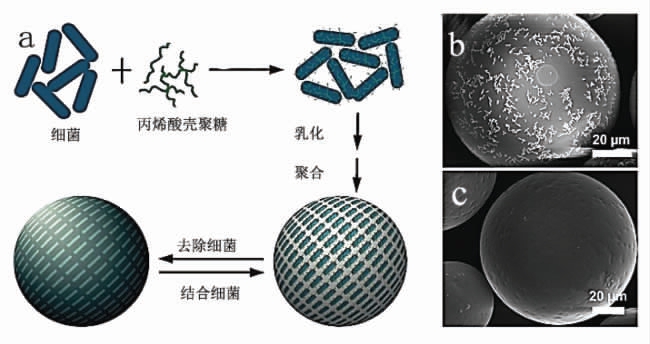
图2 细菌乳液聚合示意图(a),洗脱前(b)后(c)细菌印迹聚合物扫描电镜图[17]
Fig.2 Bacterial imprinting by Pickering emulsion polymerization(a),SEM images of bacterial imprinted polymers before(b)and after(c) removal of the template[17]
1.2 电化学聚合方法
电化学聚合方法是指在有电极浸入电解质溶液中,利用电化学氧化或还原反应,使功能单体、交联剂、模板分子等在电极表面发生聚合反应制备MIPs 膜的方法,该方法制备过程简单,聚合物膜厚度可控[19-20]。
Golabi 等[21]以表皮葡萄球菌(Staphylococcus epidermidis)为模板,3-氨基苯硼酸为功能单体,以NaF 的磷酸盐缓冲液为电解质,在金电极表面成功合成了细菌MIPs 膜,该印迹膜厚度可通过控制电流进行调节。印迹在MIPs 表面的细菌通过果糖的竞争性吸附而分离,再用流动的去离子水洗脱细菌模板。保存金电极前用磷酸盐溶液浸泡以去除吸附在MIPs 中的果糖分子,并活化聚合物表面的硼酸基团。该方法为食品腐败菌和致病微生物的MIPs 电化学传感器的制备奠定了基础。Lachen等[22]以蜡样芽孢杆菌(Bacillus cereus)芽孢为模板细胞,以吡咯为功能单体,在LiClO4 溶液中、100mV/s 电压下,在聚吡咯修饰的碳糊电极表面成功制备了芽孢MIPs 膜。
1.3 微接触印迹法
细菌微接触印迹法是整细胞印迹的一种。Fu等[23]采用微接触印迹法在玻璃板上制备了副溶血弧菌(Vibrio parahaemolyticus)MIPs 膜,该方法分为细菌模板制备和印迹膜制备两个步骤(图3)。细菌模板制备:(a)无水乙醇和去离子水将显微镜玻璃载玻片清洗干净,用酸性食人鱼溶液浸泡1h;(b)将福尔马林灭活的副溶血弧菌悬浮液展涂于玻璃片上,4 ℃保持30 min 使细菌沉降于载玻片表面;(c)将载玻片置于旋转涂布机上,1 500 r/min 下离心去除多余溶剂后用作细菌模板。印迹膜制备:(a)将聚二甲基硅氧烷溶于环己烷中,真空去除混合物中气体;(b)取一定量的混合物展涂于干净的玻璃载玻片上,80 ℃热板上预固化2 min 以提高预聚物黏度;(c)将带有细菌模板的玻璃片压入预聚合物中,室温过夜后再用80 ℃热板固化1 h;(d)去离子水超声辅助清洗压印膜,然后在空气中干燥;(e)为降低印迹膜的非特异性吸附,采用蒸发-沉积法制备副溶血弧菌氟化聚二甲基硅氧烷印迹膜。该印迹膜对副溶血弧菌具有较好的选择吸附特性,捕获率可达62.9%。
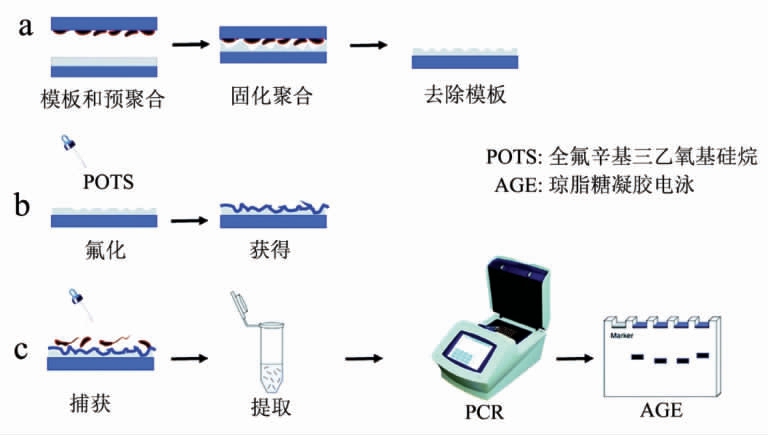
图3 细菌印迹膜制备及副溶血弧菌的PCR 检测示意图[23]
Fig.3 The schematic diagram of bacteria-imprinted film fabrication and PCR detection of Vibrio parahaemolyticus[23]
2 检测方法
2.1 荧光检测方法
荧光分析法是利用荧光信号强弱或颜色深浅进行定性或定量分析的检测方法,该方法具有灵敏度高、操作简单、响应时间短等特点,已广泛应用于食品安全检测[24]。
单增李斯特菌(Listeria monocytogenes)是奶制品、水产品、肉制品、蔬菜等食品中一种重要污染菌,是欧美等国家食品中毒事件爆发的主要致病菌之一。Zhao 等[18]将N-丙烯酸壳聚糖修饰的CdTe 量子点与单增李斯特菌的复合物分散于PBS(磷酸盐)溶液中作为乳液稳定剂,以三羟甲基丙烷三甲基丙烯酸酯、二乙烯基苯为功能单体,以过氧化苯甲酰、N,N-二甲基苯胺为引发剂,采用Pickering 乳液聚合方法制备了细菌荧光探针。该探针特异性好,随着目标细菌吸附量的增加,荧光强度显著降低,最优条件下探针对单增李斯特菌的检出限为103 CFU/mL(图4),可用于牛奶样品中单增李斯特菌污染状况的监测。
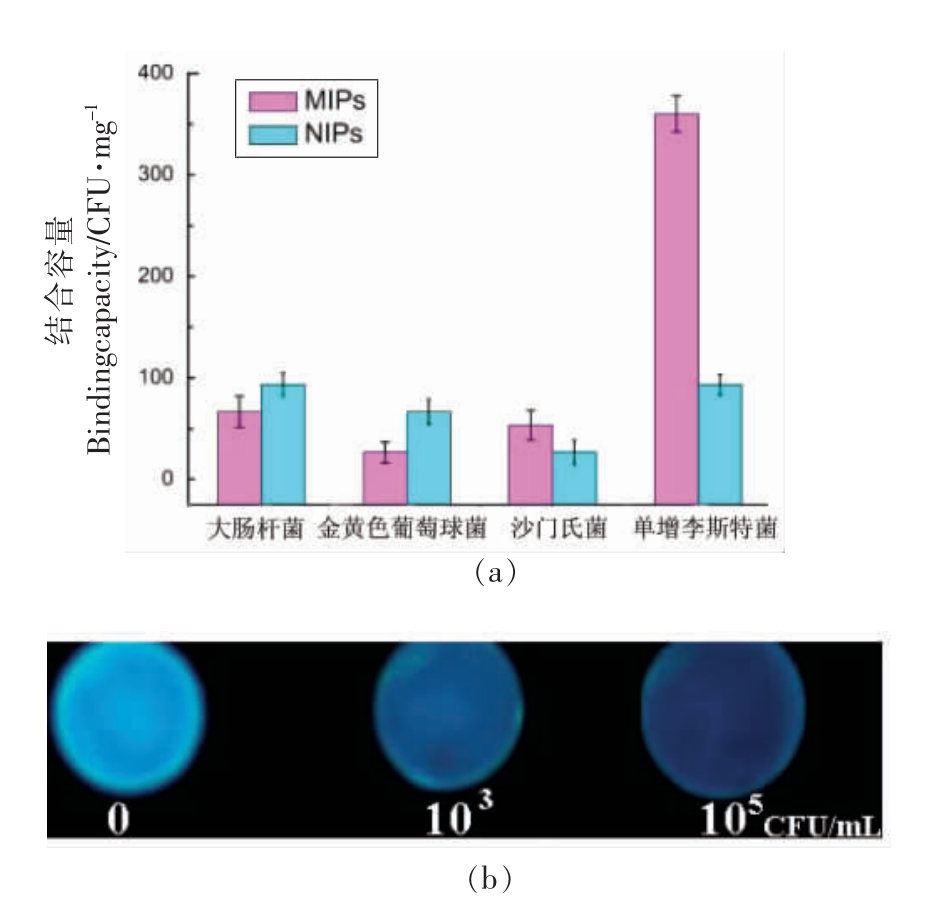
图4 印迹荧光探针选择性吸附结果(a)及不同单增李斯特菌浓度荧光强度图(b)[18]
Fig.4 The selectivity adsorption of MIPs and NIPs on four bacteria mixing solutions(a),fluorescence images of MIPs adsorbing different concentrations of L.monocytogens(b)[18]
金黄色葡萄球菌(Staphylococcus aureus)是一种常见的食源性革兰氏阳性致病微生物,约5%的微生物食物中毒由该菌肠毒素引起[25]。Bezdekova等[26]以金黄色葡萄球菌为模板,多巴胺为功能单体,Tirs 缓冲液为溶剂,分别在96 孔板孔内和Fe3O4 磁性纳米材料表面合成了高特异性金黄色葡萄球菌MIPs,聚合物中的模板用Tirs 缓冲液洗脱。制备的金黄色葡萄球菌MIPs 可直接与牛奶等液态样品混合对目标菌进行吸附,去除样品后MIPs 用去离子水洗去未结合的细菌,加入碘化丙锭后通过荧光显微镜观察确定样品中的细菌,结果表明该MIPs 在牛奶样品中对金黄葡萄球菌的检出限为103 CFU/mL。该研究中应用的新型功能单体多巴胺具有水溶性好、反应条件温和,生物相容性好等特点,大大促进了食品腐败菌及致病微生物印迹聚合物材料的发展及新型检测方法的建立。
2.2 电化学传感器检测方法
电化学传感器的开发是电分析检测方法的发展方向,MIPs 等选择性电极修饰材料大大提高了电化学检测方法的选择性,在环境、医药、食品分析等领域发挥了重要作用[27]。
芽孢杆菌的孢子在环境胁迫下可长时间休眠,待适合萌发时又能重新生长返回营养体,引起食物腐败和食源性疾病[28]。Lachen 等[22]首次通过电化学聚合方法成功将蜡样芽孢杆菌(Bacillus cereus)芽孢MIPs 膜修饰于碳糊工作电极表面,建立了循环伏安法电化学传感器检测方法,孢子与电极的最佳孵育时间为5 min,最优条件下该方法对蜡样芽孢杆菌(Bacillus cereus)芽孢的检测范围为102~105 CFU/mL,相对标准偏差(RSD,n=3)为13%~30%,该方法可快速检测食品中蜡样芽孢杆菌(Bacillus cereus)芽孢的污染情况,为细菌芽孢电化学检测方法的建立奠定了基础。
大肠杆菌(Escherichia coli)是一种革兰氏阴性无芽孢细菌,常存在于饮用水和食品中,是引起肠胃炎的主要原因[29]。Chen 等[30]以大肠杆菌O157:H7 为模板,多巴胺为功能单体,通过电化学方法直接在玻璃电极表面成功合成了MIPs 膜,该印迹膜可特异性的吸附目标细菌,与偶联大肠杆菌多克隆抗体的掺氮石墨烯量子点(pAb-NGQDs)的溶液结合后,可形成MIPs-EscherichiacoliO157:H7-pAb-N-GQDs 复合物,该复合物在K2S2O8 作用下能发生电化学发光现象,吸附的目标细菌越多,发光强度越大,基于该原理建立了大肠杆菌O157:H7 的电化学发光检测方法(图5)。最优条件下,该方法的检测范围为101~107 CFU/mL,检出限为8 CFU/mL。
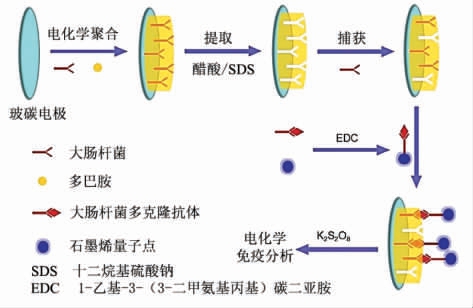
图5 电化学发光传感器构建与检测过程示意图[30]
Fig.5 Schematic presentation of fabrication procedure of electrochemiluminescence biosensor and detection process[30]
Idil 等[31]以N-甲基丙烯酰-L-组氨酸甲酯、甲基丙烯酸-2-羟乙基酯为功能单体,以乙二醇二甲基丙烯酸酯为交联剂,大肠杆菌为模板,采用微接触紫外引发印迹聚合方法在成功制备了大肠杆菌MIPs 金电极传感器,并建立了电容式电化学检测方法。最优条件下,该方法对大肠杆菌的检测范围为102~107 CFU/mL,检出限为70 CFU/mL,实际水样品的检测回收率为81%~97%。Wu 等[32]以大肠杆菌为模板,吡咯为单体,采用电化学聚合方法制备了玻璃电极MIPs 电化学传感器,并建立了阻抗型电化学检测方法。该方法可在1 h 内实现对大肠杆菌O157:H7 的检测,定量限为103 CFU/mL,在实际水样、苹果汁及牛奶样品中性能稳定,检测回收率为96%~107.9%,RSD 小于4%。
2.3 表面等离子共振检测方法
表面等离子共振(Surface Plasmon Resonance,SPR)检测是一种基于金属介质波导表面等离子的无损伤、无标记检测技术,具有样品使用量少、灵敏度高、快捷方便、可实时监测等优点[33]。
Yilmaz 等[34]以甲基丙烯酸-2-羟乙基酯、N-甲基丙烯酰-L-组氨酸甲酯为功能单体、乙二醇二甲基丙烯酸酯为交联剂,偶氮二异丁腈为引发剂,大肠杆菌为模板,采用微接触印迹方法在SPR 传感器表面制备大肠杆菌MIPs 膜,并建立了SPR 检测方法。最优条件下,该方法的最低检出限和定量限分别为1.54×106 CFU/mL 和5.13×106 CFU/mL,响应为113 s。为增强SPR 传感器相应信号,提高SPR 检测方法的灵敏度,Özgür 等[35]在SPR 传感器表面合成MIPs 时加入Ag 纳米粒子,结果显示该SPR 传感器检测大肠杆菌的灵敏度显著提高,最优条件下检出限达到0.57 CFU/mL。
粪肠球菌(Enterococcus faecalis)隶属于肠球菌属,常作为食物中粪便污染指示菌,也是一种重要的机会性人畜共患致病菌[36]。Erdem 等[37]首先将模板粪肠球菌与功能单体N-甲基丙烯酰-L-组氨酸甲酯混合形成复合体,将乳液稳定剂聚乙烯醇,表面活性剂十二烷基硫酸钠溶于水相(NaHCO3 调水溶液pH 值),将聚乙烯醇、十二烷基硫酸钠、第二功能单体甲基丙烯酸羟乙酯、交联剂乙二醇二甲基丙烯酸酯溶于有机相,水相-有机相搅拌成乳液后加入粪肠球菌-功能单体复合体,混合体系在NaHSO3 和(NH4)2S3O8 引发剂作用下(40 ℃,24 h,500 r/min)制备粪肠球菌聚合物微球。经NaCl 溶液洗脱模板后的MIPs 微球经旋涂系统将其均匀涂盖于等离子体传感器表面,然后将制备的MIPs-SPR 传感器分别在紫外灯(100 W,365 nm)和烘箱(40 ℃)中固化MIP s(图6)。试验结果表明,该SPR 传感器对目标菌具有较高的选择性,对大肠杆菌、枯草杆菌和金黄色葡萄球菌的响应信号弱,检测的线性范围为2×104~1×108 CFU/mL,最低可检测出~100 细菌/mL。该研究通过涂抹技术将乳液聚合的细菌印迹纳米颗粒作为识别元件固定于SPR 传感器表面,为其它微生物的广泛检测提供了技术支撑。
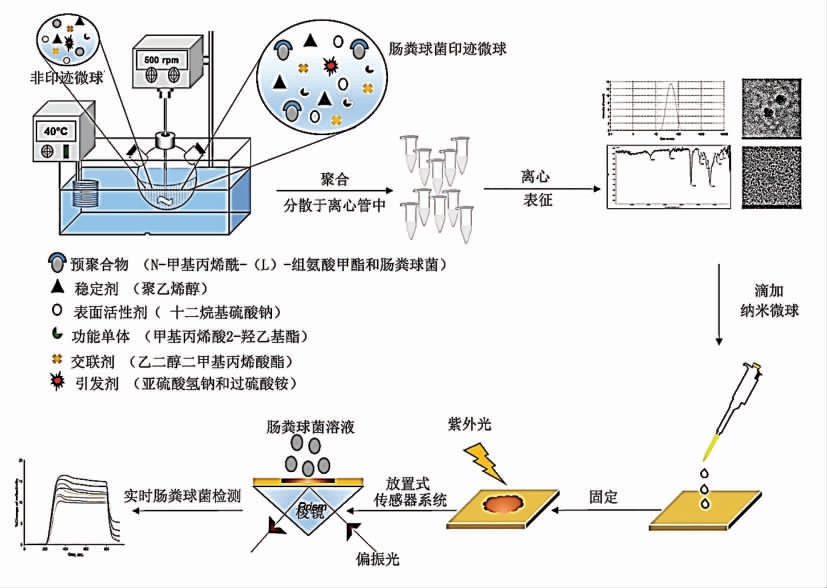
图6 粪肠球菌印迹等离子共振传感器制备示意图[37]
Fig.6 The preparation of E.faecalis-imprinted plasmonic sensor[37]
食源性病毒是导致食源性疾病的重要病原之一,检测技术是开展食源性病毒监测与防控工作的基础[38]。Altintas 等[39]将固定于戊二醛处理的玻璃球表面噬菌体MS2 作为模板,以N-异丙基丙烯酰胺、N-叔丁基丙烯酰胺、N,N′-亚甲基双丙烯酰胺、丙烯酸为功能单体,功能单体与模板混合后再加入N-(3-氨基丙基)甲级丙烯酰胺盐酸盐,在过硫酸铵、N,N,N′,N′-四甲基乙二胺引发下室温聚合2 h,然后用双馏水洗脱(60 ℃)高亲和力的MIPs 纳米微球。1,1-巯基十一酸修饰的SPR传感器芯片经NHS 和EDC 活化后与MIPs 反应,使其固定于传感器表面,乙醇胺封闭非特异性结合位点。该方法制备噬菌体MS2 MIPs 聚合物纳米颗粒直径为200~230 nm,最优条件下,SPR 检测方法的检出限为5×106 PFU/mL。该研究为食源性病毒分子印迹SPR 传感器的构建及检测方法的推广奠定了基础。
2.4 石英晶体微天平检测方法
石英晶体微天平是一种质量传感器装置,具有简单、经济、高分辨等特点,可根据传感器表面吸附物质引起的质量变化进行定量分析[40]。
铜绿假单胞菌(Pseudomonas aeruginosa)具鞭毛,是引起肉品和水产品的一种重要革兰氏阴性腐败菌,给食品安全带来巨大隐患[41]。Tokonami等[42]首先通过等离子蚀刻技术处理石英晶体微天平的镀金芯片,再以吡咯为功能单体、铜绿假单胞菌为模板,通过电聚合技术在芯片表面聚合形成含有菌体的聚吡咯(PPy)膜。然后,制备的聚吡咯经过氧化处理(OPPy)去除模板细菌,包括溶菌酶处理(消除菌体细胞壁多糖与聚合物表面的强相互作用) 和氧化纳溶液洗脱铜绿假单胞菌模板两部分(图7)。以醋酸钙不动杆菌(Acinetobacter calcoaceticus),大肠杆菌(Escherichia coli),粘质沙雷氏菌(Serratia marcescens)为模板菌的形状类似菌进行选择性试验,结果表明制备的MIPs 对铜绿假单胞菌具有高选择性;最优条件下,建立的微天平检测方法对目标菌的信号响应范围为103~109 CFU/mL。

图7 基于过氧化聚吡咯细菌电极示意图(a),聚吡咯(b)和过氧化聚吡咯(c)电镜图[42]
Fig.7 Schematic illustration of electrode arrangement for bacterial detection with OPPy film(a),SEM images of target bacteria and prepared PPy(b) and OPPy(c) films[42]
2.5 共振光散射检测方法
共振光散射是指当电子吸收电磁波频率与散射频率相同时,电子因共振而强烈吸收光能量并再次发生散射的过程称为共振光散射[43]。基于共振光散射光谱建立的检测方法具有灵敏度高、检测速度快、操作简单等特点,已广泛用于食品中危害物残留检测[44]。
甲型肝炎病毒(Hepatitis A virus,HAV)是一种重要的食源性病毒,可引起大规模疾病爆发。Yang 等[45]以制备的SiO2 纳米粒子为核,以多巴胺为功能单体、HAV 为模板,在Tris 缓冲液中(25 ℃)通过自组装制备了分子印迹纳米微球,去离子水洗去聚合物微球表面反应的功能单体和病毒模板,然后分别用乙酸和十二烷基硫酸钠溶液洗脱印迹的HAV(图8)。聚合物微球共振光散射光谱强度随着结合HAV 数量的增加而增强,最优条件下该方法对目标物的检测浓度为0.04~6.0 nmol/L,检出限为8.6 pmol/L。Liu 等[46]以氨基修饰的SiO2 纳米微球为核,N-异丙基丙烯酰胺、N,N′-亚甲基双丙烯酰胺为功能单体,HAV 为模板,过硫酸铵为引发剂,室温反应2 h 制备了HAV 印迹聚合物,最后以甲醇/乙酸混合溶剂为洗脱溶剂去除HAV 模板。最优条件下,基于该聚合物纳米微球建立的共振光散射检测方法对HAV 的线性范围为5~25 pmol/L,检出限为1.1 pmol/L。
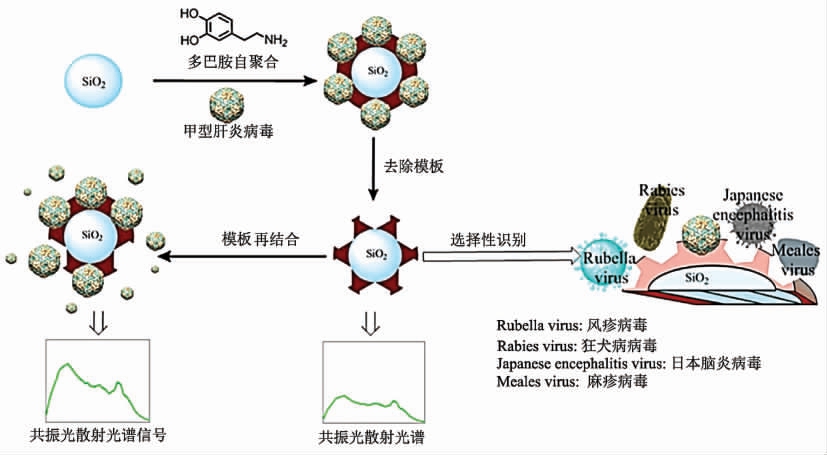
图8 病毒印迹聚合物和检测方法示意图[45]
Fig.8 Principle of preparation of the virus-MIPs and detection of virus[45]
3 结语与展望
分子印迹技术作为合成具有特异识别性能合成材料的技术,已成为一种新的研究方向。近年来,MIPs 在从小分子识别到生物大分子及微生物的高效识别过程中取得了很大进展,逐渐成为天然受体的完美代替品。准确、快速监测食品中微生物的污染状况对降低食物浪费和食源性疾病爆发具有重要意义。当前针对细菌、病毒等微生物形态结构和表面化学基团开发的新型功能单体及合成方法显著提高了MIPs 在水相环境中对微生物的识别性能,基于MIPs 建立的新型检测方法也为食品腐败菌和致病微生物的监测提供了新的技术支撑。然而,当前基于分子印迹技术对食品腐败菌及致病微生物的检测仍处于发展阶段,依然存在以下问题需要深入研究:1) 多巴胺作为新的功能单体促进了食品腐败菌及治病微生物印迹聚合物的发展,但是聚多巴胺表面的官能团密度大,致使聚多巴胺印迹材料的非特异性吸附问题突出。可通过利用多巴胺衍生物或采用进一步通过物理或化学方法改性聚多巴胺膜的方法降低非特异性吸附,提高选择性;2)开发新的功能单体或优化功能单体组合以提高MIPs 对目标微生物的特异性吸附,开发新的微生物印迹方法以适应不同食品微生物MIPs 的制备;3)目前只有细菌细胞壁的脂多糖作为特征识别基团用于制备MIPs,这大大限制了MIT 的应用范围,探索新的微生物特征组成MIPs;4)食品样品基质对微生物MIPs 选择吸附性能及检测灵敏度的影响较大,研究消除基质影响的方法对加快MIT 在食品腐败菌及致病微生物污染检测中应用有重要意义。
[1]VANEGAS D C,GOMES C L,CAVALLARO N D,et al.Emerging biorecognition and transduction schemes for rapid detection of pathogenic bacteria in food[J].Comprehensive Reviews in Food Science and Food Safety,2017,16(6):1188-1205.
[2]SHEN Y,XU L,LI Y.Biosensors for rapid detection of Salmonella in food:A review[J].Comprehensive Reviews in Food Science and Food Safety,2021,20(1):147-149.
[3]NAHAR S,HA J W,BYUN K H,et al.Efficacy of flavourzyme against Salmonella Typhimurium,Escherichia coli,and Pseudomonas aeruginosa biofilms on food-contact surfaces[J].International Journal of Food Microbiology,2021,336:108897.
[4]ELISSEEVA S,KELLY C,CRUZ-ROMERO M,et al.The use of optical oxygen sensing and respirometry to quantify the effects of antimicrobials on common food spoilage bacteria and food samples[J].Sensors and Actuators B:Chemical,2020,322:128572.
[5]SONG SX,WANG XY,XU K,et al.Visualized detection of vibrio parahaemolyticus in food samples using dual -functional aptamers and cut -assisted rolling circle amplification[J].Journal of Agricultural and Food Chemistry,2019,67(4):1244-1253.
[6]ZHU L J,HE J,CAO X H,et al.Development of a double-antibody sandwich ELISA for rapid detection of Bacillus Cereus in food [J].Scientific Reports,2016,6:10.
[7]MAZUMDAR S D,BARLEN B,KAMPFER P,et al.Surface plasmon resonance(SPR) as a rapid tool for serotyping of Salmonella[J].Biosensors and Bioelectronics,2010,25(5):967-971.
[8]GAVRILA A M,ZAHARIA A,PARUCH L,et al.Molecularly imprinted films and quaternary ammonium-functionalized microparticles working in tandem against pathogenic bacteria in wastewaters[J].Journal of Hazardous Materials,2020,399:123026.
[9]GUO MK,GAO Y H,CHEN G,et al.Recent advances and future trends in the detection of contaminants by molecularly imprinted polymers in food samples[J].Frontiers in Chemistry,2020,8:616326.
[10]HU T L,CHEN R,WANG Q,et al.Recent advances and applications of molecularly imprinted polymers in solid-phase extraction for real sample analysis[J].Journal of Separation Science,2021,44(1):274-309.
[11]MAHMOUDPOUR M,TORBATI M,MOUSAVI M M,et al.Nanomaterial-based molecularly imprinted polymers for pesticides detection:Recent trends and future prospects[J].TrAC Trends in Analytical Chemistry,2020,129:115943.
[12]WANG R,PAN J,QIN M,et al.Molecularly imprinted nanocapsule mimicking phosphotriesterase for the catalytic hydrolysis of organophosphorus pesticides[J].European Polymer Journal,2019,110:1-8.
[13]李梦圆,赵慕华,翟筠秋,等.以多巴胺为功能单体的生物大分子印迹聚合物[J].科学通报,2019,64(13):1321-1329.LI M Y,ZHAO M H,ZHAI Y Q,et al.Dopamine-based molecularly imprinted polymers for the recognition of biomacromolecules[J].Chinese Science Bulletin,2019,64(13):1321-1329.
[14]李宁.荧光分子印迹传感器快速检测微生物活性及其毒素[D].武汉:华中科技大学,2017.
LI N.Rapid detection of microbial activity and its toxin by fluorescent molecularly imprinted sensor[D].Wuhan:Huazhong University of Science and Technology,2017.
[15]赵娜,胡小玲,管萍,等.乳液聚合法制备红霉素分子印迹聚合物微球及其吸附性能[J].物理化学学报,2014,30(1):121-128.
ZHANG N,HU X L,GUAN P,et al.Preparation of erythromycin-imprinted polymeric microspheres by emulsion polymerization and their adsorption properties[J].Acta Physico-ChimicaSinica,2014,30(1):121-128.
[16]LONG Y,LI Z,BI Q,et al.Novel polymeric nanoparticles targeting the lipopolysaccharides of Pseudomonas aeruginosa[J].International Journal of Pharmaceutics,2016,502(1/2):232-241.
[17]SHEN X T,BONDE J S,KAMRA T,et al.Bacterial imprinting at Pickering emulsion interfaces[J].Angewandte Chemie International Edition,2014,53(40):10687-10690.
[18]ZHAO X L,CUI Y,WANG J P,et al.Preparation of fluorescent molecularly imprinted polymers via pickeringemulsioninterfaces and the application for visual sensing analysis of Listeria Monocytogenes[J].Polymers,2019,11(6):984.
[19]鹿萌,张若楠,刘慧芳,等.分子印迹技术在新烟碱类农药残留分析中的应用研究进展[J].食品工业科技,2019,40(21):307-314.
LU M,ZHANG R N,LIU H F,et al.Research progress on the application of molecular imprinting technology for neonicotinoid pesticide residues analysis[J].Science and Technology of Food Industry,2019,40(21):307-314.
[20]张娟.电化学聚合的聚合物修饰电极的改进制备及其性能研究[D].济南:山东大学,2018.
ZHANG J.Preparation innovation and performance study of electrochemically synthesized polymer-modi fied electrodes[D].Jinan:Shandong University,2018.
[21]GOLABI M,KURALAY F,JAGER E W H,et al.Electrochemical bacterial detection using poly(3-aminophenylboronic acid)-based imprinted polymer[J].Biosensors and Bioelectronics,2017,93:87-93.
[22]LACHEN A A,ARDUINI F,LISTA F,et al.Label-free electrochemical sensor based on spore-imprinted polymer for Bacillus cereus spore detection[J].Sensors and Actuators B:Chemical,2018,276:114-120.
[23]FU K Y,ZHANG H W,GUO Y Y,et al.Rapid and selective recognition of Vibrio parahaemolyticus assisted by perfluorinated alkoxysilane modified molecularly imprinted polymer film [J].RAC Advance,2020,24(10):14305-14312.
[24]孙敏君,高雪,徐阳鑫,等.食品中氟喹诺酮类药物残留的快速检测研究进展[J].食品科学,2022,43(5):383-391.
SUN M J,GAO X,XU Y X,et al.Progress in rapid detection of fluoroquinolone residues in foods[J].Food Science,2022,43(5):383-391.
[25]ERTASS N,GONULALAN Z,YILDIRIM Y,et al.Detection of Staphylococcus aureus enterotoxins in sheep cheese and dairy desserts by multiplex PCR technique[J].International Journal of Food Microbiology,2010,142(1/2):74-77.
[26]BEZDEKOVA J,ZEMANKOVA K,HUTAROVA J,et al.Magnetic molecularly imprinted polymers used for selective isolation and detection of Staphylococcus aureus[J].Food Chemistry,2020,321:126673.
[27]牛家华,王勇,卢明华.电分析化学法检测食品中有机合成色素的应用进展[J].理化检验-化学分册,2020,56(10):1137-1144.
ZHU J H,WANG Y,LU M H.Advances of application of electroanalytical chemistry in detection of organic synthetic pigments in food[J].Physical Testing and Chemical Analysis Part B:Chemical Analysis,2020,56(10):1137-1144.
[28]RUIZ V,ALONSO R,SALVADOR M,et al.Impact of shoulders on the calculus of heat sterilization treatments with different bacterial spores[J].Food Microbiology,2021,94:103663.
[29]DU J,WU S,NIU L,et al.A gold nanoparticlesassisted multiplex PCR assay for simultaneous detection of Salmonella typhimurium,Listeria monocytogenes and Escherichia coli O157:H7[J].Analytical Methods,2020,12:212-217.
[30]CHEN S F,CHEN X Q,ZHANG L J,et al.Electrochemiluminescence detection of Escherichia coli O157:H7 based on a novel polydopamine surface imprinted polymer biosensor[J].ACS Applied Materials & Interfaces,2017,9(6):5430-5436.
[31]IDIL N,HEDSTROM M,DENIZLI A,et al.Whole cell based microcontact imprinted capacitive biosensor for the detection of Escherichia coli[J].Biosensors and Bioelectronics,2017,87:807-815.
[32]WU J,WANG R,LU Y,et al.Facile preparation of a bacteria imprinted artificial receptor for highly selective bacterial recognition and label-free impedimetric detection[J].Analytical Chemistry,2019,91(1):1027-1033.
[33]ZHOU J,QI Q,WANG C,et al.Surface plasmon resonance(SPR) biosensors for food allergen detection in food matrices[J].Biosensors and Bioelectronics,2019,142:111449.
[34]YILMAZ E,MAJIDI D,OZGUR E,et al.Whole cell imprinting based Escherichia coli sensors:a study for SPR and QCM[J].Sensors and Actuators B:Chemical,2015,209:714-721.
[35]ÖZGUR E,TOPCU A A,YILMAZ E,et al.Surface plasmon resonance based biomimetic sensor for urinary tract infections[J].Talanta,2020,212:120778.
[36]吕娜,高原.粪肠球菌致病因子的研究进展[J].内蒙古民族大学学报(自然科学版),2015,30(4):323-326.
LV N,GAO Y.Advances in research on pathogenic factor of Enterococcus Faecalis[J].Journal of Inner Mongolia University for Nationalities(Natural Sciences),2015,30(4):323-326.
[37]ERDEM Ö,SAYLAN Y,CIHANGIR N,et al.Molecularly imprinted nanoparticles based plasmonic sensors for real-time Enterococcus faecalis detection[J].Biosensors and Bioelectronics,2019,126:608-614.
[38]秦智伟,薛亮,高珺珊,等.食源性病毒核酸恒温检测技术研究进展[J].微生物学通报,2021,48(1):266-277.
QIN Z W,XUE L,GAO J S,et al.Advances in nucleic acid isothermal detection technologies for foodborne viruses[J].Microbiology China,2021,48(1):266-277.
[39]ALTINTAS Z,GITTENS M,GUERREIRO A,et al.Detection of waterborne viruses using high affinity molecularly imprinted polymers[J].Analytical Chemistry,2015,87(13):6801-6807.
[40]CHEN J Y,PENN L S,XI J.Quartz crystal microbalance:Sensing cell-substrate adhesion and beyond[J].Biosensors and Bioelectronics,2018,99:593-602.
[41]贾飞,闫文杰,戴瑞彤,等.基于还原氧化石墨烯/碳纳米管-纳米金复合纳米材料的阻抗型电化学适配体传感器检测铜绿假单胞菌[J].食品科学,2021,42(18):284-291.
JIA F,YAN W J,DAI R T,et al.An impedimetric aptasensorbased on reduced graphene oxide/carbon nanotube-gold nanoparticles nanocomposite for the detection of Pseudomonas aeruginosa [J].Food Science,2021,42(18):284-291.
[42]TOKONAMI S,NAKADOI Y,TAKAHASHI M,et al.Label-free and selective bacteria detection using a film with transferred bacterial configuration [J].Analytical Chemistry,2013,85(10):4925-4929.
[43]徐雅莉.共振光散射法快速检测食品中的毒死蜱和新霉素残留的研究[D].郑州:河南农业大学,2012.
XU Y L.Research on rapid determination of chlorpyfifosand neomycin residues in food by Resonance Light Scattering method[D].Zhengzhou:Henan Agricultural University,2012.
[44]LUO L H,YANG J Y,LIANG K S,et al.Fast and sensitive detection of Japanese encephalitis virus based on a magnetic molecular imprinted polymerresonance light scattering sensor[J].Talanta,2019,202:21-26.
[45]YANG B,GONG H,CHEN C Y,et al.A virus resonance light scattering sensor based on musselinspired molecularly imprinted polymers for high sensitive and high selective detection of hepatitis A virus[J].Biosensors and Bioelectronics,2017,87:679-685.
[46]LIU Y,SHEN T,HU L,et al.Development of a thermosensitive molecularly imprinted polymer resonance light scattering sensor for rapid and highly selective detection of hepatitis A virus in vitro[J].Sensors and Actuators B:Chemical,2017,253:1188-1193.