蛹虫草 (Cordyceps militaris) 又名北冬虫夏草,是一种常用的食药用真菌,其含有虫草素、腺苷、多糖、类胡萝卜素和蛋白质等多种生物活性成分,具有多种药理作用[1]。研究发现,蛹虫草中的虫草素、多糖和多肽能够抑制癌细胞增殖,具有抗氧化和免疫调节等有益作用[2-4]。此外,蛹虫草子实体的热水或乙醇提取物具有促进葡萄糖代谢,诱导细胞凋亡,抑制炎症反应等功效[5-7]。蛹虫草被广泛应用于食品、医药、保健品中。
固态发酵(Solid-state fermentation,SSF)是生物在没有或基本没有游离水的固态基质上的发酵方式。固态发酵含水量少,具有不易污染,设备投资少,技术要求低,基质营养成分丰富,节约能源等特点,为此,越来越受到人们的重视[8-9]。研究表明,食用菌经固体发酵后,可积累更多药用有效成分,提高成分活性[10-12],同时降低了从子实体(生长周期约80 d)中提取生物活性物质的成本。固态发酵是蛹虫草高效生产和富集生物活性物质的常用方法。
蛹虫草经过固体发酵后会得到被蛹虫草真菌生态转化的培养基和菌丝体共存的结构。除菌丝体的活性物质,培养基经蛹虫草菌发酵后,具有微生物产生的代谢产物以及微生物酶对谷物分解后产生的分解产物[13],因此,固态发酵物具有更丰富的活性物质。目前研究多集中于对蛹虫草子实体功能的验证方面,对其SSF 产物的功能尚待研究。研究蛹虫草SSF 产物的健康功能活性,为蛹虫草固体饮料保健食品的开发利用提供了科学依据。
本研究测定蛹虫草SSF 产物的含量,并与子实体进行比较。利用体内实验,从小鼠行为活动、体质量、脏器指数等方面探索SSF 产物的毒性,并从细胞特异性免疫、肠道菌群的影响探讨SSF 产物的功能性。
1 材料与方法
1.1 试验材料
蛹虫草菌株 (Cordyceps militaris,编号CM-10),农业真菌菌株公司。雄性无特定病原体(SPF)BALB/C 雄性小鼠,8 周龄,广东医学实验动物中心。马铃薯葡萄糖琼脂培养基(PDA):20%土豆、2%葡萄糖、2%琼脂,自然pH。马铃薯葡萄糖肉汤(PDB):20%土豆、2%葡萄糖,自然pH。固体发酵培养基(SSF 培养基):小麦73%、麸皮20%和玉米7%,颗粒直径在550~1 700 μm 之间。
1.2 主要试剂与仪器
RPMI1640 培养液、新生牛血清、无菌Hank's液、无菌PBS,Gibico 公司;Con A,美国Sigma 公司;谷氨酰胺(分析纯)、巯基乙醇(化学纯)、葡萄糖(分析纯)、氯化钾(分析纯),广州化学试剂厂;Extaq 酶,日本Takara 公司;乙腈(色谱纯),天津市科密欧化学试剂公司;其它化学试剂均为分析纯级,广州成硕生物工程有限公司。
SAF-680T 酶标仪,上海巴玖实业有限公司;5810R Eppendorf 离心机,德国Eppendorf 公司;HZQ-F160 金属振荡培养箱,哈尔滨东联电子技术开发有限公司;DHG-9140 电热鼓风干燥箱,上海精宏仪器公司;SPX-250AB 生化培养箱,广州深华生物技术有限公司;Elga 超纯水仪Ultra Bioscience,英国Elga 公司。
1.3 蛹虫草固体发酵
将CM-10 保存菌种接种于马铃薯葡萄糖琼脂培养基(PDA)中,于23 ℃培养,待菌丝生长满平板3/4 后光照5 d,然后将活化好的菌种接种于马铃薯葡萄糖肉汤(PDB)中,于25 ℃,150 r/min振荡培养4 d,得到均匀菌丝球的液体种子。
称取20 g SSF 培养基置于6 cm×9 cm 的透明玻璃组培瓶中,按1∶1.25 的料水比加入无机盐溶液(0.3%磷酸二氢钾,0.15%硫酸镁,0.05%维生素,自然pH),121 ℃高压灭菌40 min,冷却至室温,在无菌条件下以25 mL/100 g SSF 培养基的比例接种液体种子培养物。SSF 于25 ℃暗培养10 d后,转至25 ℃光培养15 d。然后,将SSF 所获菌质于55 ℃干燥48 h,经粉碎机粉碎,80 μm 筛子过滤,-80 ℃冻存备用。
1.4 蛹虫草SSF 产物组分探究
测定SSF 产物中蛋白质、粗多糖、虫草素、腺苷和类胡萝卜素的含量,并与蛹虫草子实体进行比较。
蛋白质的含量参照GB 50095.95-2010 食品安全国家标准进行测定。粗多糖含量采用Saha等[14]的方法测定。虫草素和腺苷的含量按Shih等[15]的方法测定。类胡萝卜素浓度的测定参照Dong 等[16]方法。
1.5 动物膳食干预
1.5.1 动物分组及处理 每只小鼠在使用前单独饲养在SPF 房间内,温度控制在22 ℃,光暗循环12 h,自由饮食、饮水适应1 周。适应期结束后,将小鼠随机分为4 组(n=10):正常对照组(NCN,灌喂无菌蒸馏水),低剂量组[NCL,SSF 产物35 mg/(kg·d)],中剂量组[NCM,SSF 产物70 mg/(kg·d)]和高剂量组[NCH,SSF 产物210 mg/(kg·d)]。所有的动物都是在每天上午9~10 点之间进行灌胃处理,持续4 周。
1.5.2 体质量测定 小鼠自适应期开始至灌喂结束,每天观察小鼠活动和饮食情况,每周称量并记录小鼠的体质量。
1.5.3 粪便样品采集 通过轻轻按压小鼠腹部,采集小鼠新鲜粪便,每只小鼠每周收集1 次。小鼠最后1 次灌喂24 h 后,采集每组小鼠的粪便,液氮保存。
1.5.4 血液样品采集 对所有小鼠摘眼球采血,储存在-80 ℃,待测血清中细胞因子。
1.5.5 组织样品采集 小鼠颈椎脱臼处死后解剖,迅速取出脾、肺、心、肝、肾、附睾白色脂肪组织并称重。脏器指数=脏器重(g)/小鼠体质量(g)×100%,以此公式分别计算脾、肺、心、肝、肾、附睾白色脂肪组织指数。
1.5.6 Con A 诱导的小鼠脾淋巴细胞转化实验脾脏淋巴细胞制备:无菌取出上述试验小鼠脾脏,用Hanks 液漂洗后,将取出的脾细胞置于200 目细胞筛上研磨,获得脾细胞悬浮液。Hanks 液漂洗2 次后,再用完全培养基(89% RPMI-1640 培养基,10%胎牛血清,1%谷氨酰胺,5×10-5 mol/L 巯基乙二醇,100 U/mL 链霉素和100 U/mL 青霉素)将细胞重新悬浮至密度为3×106 个/mL 的细胞悬液。
MTT 法检测细胞增殖转化[17-18]:在24 孔板中每孔加入1 mL 细胞悬浮液,一孔加7.5 μL Con A 液 (终质量浓度为7.5 μg/mL),另一孔作为对照,将24 孔板置于5%CO2,37 ℃的CO2 培养箱中孵育68 h,每孔用0.7 mL 不含胎牛血清的完全培养基替换0.7 mL 培养基,再用50 μL MTT(5 mg/mL)培养4 h。培养结束后,每孔加入1 mL 酸性异丙醇(0.04 mol/L HCL),充分混匀,使紫色结晶完全溶解。然后将悬液转移到96 孔培养板上,每个孔200 μL,用酶标仪测定570 nm 波长处的吸光值(OD),计算淋巴细胞的增殖转化能力。脾淋巴细胞的增殖转化能力以加或不加ConA 的吸光值差值表示。
1.5.7 蛹虫草SSF 产物对血清中IL-2 和IFN-γ含量的影响 用ELISA 试剂盒检测小鼠血清干扰素-γ(IFN-γ)和白细胞介素-2(IL-2)。
1.6 肠道菌群分析
粪便样本在液氮中冷冻,并保存在-80 ℃中。使用粪便DNA 提取试剂盒提取DNA,通过PCR扩增出包含V3 和V4 区的16S rRNA 基因。送样至上海美吉生物医药科技有限公司进行Illumina Miseq 测序,利用I-Sanger 分析云平台对每个16S rRNA 基因序列进行物种组成分析,对多样本的群落组成和差异显著性检验等进行统计学和可视化分析。
1.7 统计分析
应用SPSS 软件处理数据,SSF 产物与子实体成分含量、体质量、脏器系数、脾淋巴细胞转化、血清中细胞因子变化结果以“平均值±标准差”表示。采用SPSS 软件中的方差分析法对实验数据进行显著性差异分析,P<0.05 表示差异有统计学意义。
2 结果与分析
2.1 蛹虫草SSF产物与子实体成分含量比较
经蛹虫草发酵后得到的发酵菌质中含有与蛹虫草子实体中一致的多糖、虫草酸和虫草素等,并且具有与子实体中活性物质相同的抗氧化、抗肿瘤等功效,可替代子实体用于营养和功能食品开发[19]。蛹虫草SSF 产物与子实体成分含量见表1。由表1可知,SSF 产物的蛋白质、粗多糖和虫草素含量显著高于子实体(P<0.001),而SSF 产物中腺苷的含量低于子实体的含量 (P<0.001)。报道显示,腺苷和腺嘌呤等嘌呤代谢的中间代谢物与虫草素结构类似,被认为是参与虫草素生物合成的前体物质[20]。腺苷和腺苷受体亚型A1 和A2A 具有高亲和力,而对腺苷受体A2B 和A3 亚型则亲和力较低。虫草素和A1、A2A、A2B、A3 的亲和力都很好,这是虫草素比较优越的方面。相比腺苷,虫草素能够更好地激活A3 亚型消除慢性炎症,细胞修复[21-23]。结果表明,经固态发酵后,大部分腺苷可被转化为虫草素积累在SSF 产物,SSF 具有更好的潜在生物活性。
表1 SSF 产物与子实体成分含量
Table 1 Comparisons of contents of SSF products and fruiting body
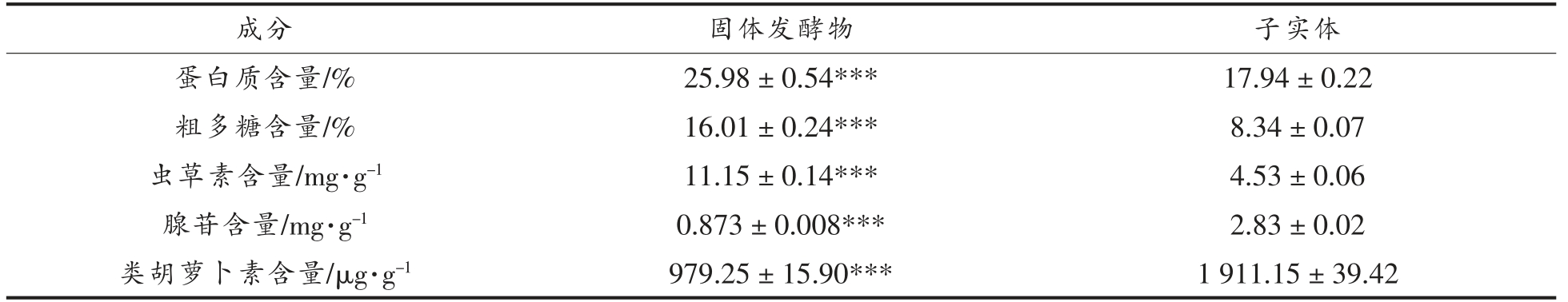
注:与子实体组相比,*.表示差异显著(P<0.05),**.表示差异极显著(P<0.01),***.表示差异极显著(P<0.001)。
?
2.2 蛹虫草SSF 产物对小鼠体质量的影响
对小鼠进行28 d 观察,实验期间各组小鼠饮食情况正常,精神状态良好。每周对各组小鼠进行称重,4 组小鼠的体质量如表2所示。各剂量组小鼠体质量与对照组无显著性差异,表明SSF 产物对正常小鼠的体质量生长无明显影响。
表2 小鼠体质量变化情况
Table 2 The change of mice body weight

?
2.3 蛹虫草SSF 产物对小鼠脏器系数的影响
在药物安全评价中,由于药物作用的影响,会引起动物脏器质量下降,可根据脏器系数来检验动物的脏器是否受到药物的不良影响[24]。给予小鼠不同剂量受试物28 d,SSF 产物对小鼠各脏器的影响结果见表3。不同组各脏器系数无显著性变化,因而可以认为不同剂量的SSF 产物对小鼠的脏器无显著性影响,说明SSF 产物安全无毒性。内脏脂肪是人体内主要围绕着脏器的脂肪。肥胖代谢综合征与内脏脂肪的关系比总脂肪更密切。睾丸脂肪属于内脏白色脂肪中的一种,各剂量组的睾丸脂肪垫系数皆有不同程度的降低,与对照组相比具有显著性差异(P<0.05)。由此可见,SSF产物有降低正常小鼠脂肪含量的功效。
表3 SSF 产物对小鼠脏器系数的影响
Table 3 Effect of SSF products on organ index of mice

注:与空白组相比,*.表示差异显著(P<0.05),**.表示差异极显著(P<0.01)。下同。
?
2.4 蛹虫草SSF 产物对小鼠特异性免疫的影响
脾脏是重要的淋巴器官,是T、B 淋巴细胞聚集的部位。脾淋巴细胞转化百分率是反映机体细胞免疫功能的基本指标,主要表现为淋巴细胞的活化和分化为免疫活性细胞[25]。不同剂量SSF 产物摄入对Con A 诱导小鼠脾淋巴细胞转化的影响如表4所示。与空白组相比,低剂量组对Con A诱导小鼠脾淋巴细胞转化无显著性影响 (P>0.05)。中、高剂量组显著提高脾淋巴细胞转化率(P<0.05,P<0.01),并且随着剂量的增加,小鼠脾淋巴细胞转化程度逐渐增加,表明中、高剂量浓度SSF 有增强细胞免疫功能的作用。
表4 SSF 产物对Con A 诱导小鼠脾淋巴细胞转化的影响
Table 4 Effect of SSF products on spleen lymphocyte transformation induced by Con A in mice

?
IFN-γ 是最重要的Th1 型细胞因子,是激活免疫细胞的关键信号分子[26]。IL-2 是主要由T 淋巴细胞分泌的一种淋巴因子,其主要作用是诱导T 淋巴细胞的增殖和分化。IL-2 的分泌水平高低反映机体的免疫机能强弱[27]。给予小鼠不同剂量受试物28 d,SSF 产物对小鼠血清中IL-2 和IFNγ 含量的影响结果见表5。与对照组相比,SSF 干预组中的细胞因子浓度无显著差异。
表5 SSF 产物对血清中IL-2 和IFN-γ 含量的影响
Table 5 Effect of SSF products on the contents of IL-2 and IFN-γ in serum

?
这些结果表明,中、高浓度的SSF 能够在一定程度上提高细胞的免疫功能,体现在促进淋脾巴细胞转化方面。然而在正常个体中,SSF 摄入并不引起血清中细胞因子浓度的改变。
2.5 蛹虫草SSF 产物对小鼠肠道菌群的影响
2.5.1 小鼠肠道菌群多样性分析 本次研究共收集了空白对照组(Con)、中剂量组(Text2)共16 只小鼠的粪便,进行测序。
Ace 指数是评价肠道菌群丰富度的指数,与菌群丰富度成正比[28]。Ace 指数的组间差异见图1a,结果可知对照组和中剂量组的Ace 指数差异显著,SSF 产物对肠道菌群的物种均匀度和丰度有显著影响。
通过PLS-DA 将2 组样本在属水平分析 (图1b)发现,2 组间区别明显,在SSF 产物的饮食干预后,小鼠肠道菌群由相对分散朝一种菌型聚拢,表明其具有调节肠道菌群的作用。利用Venn 图统计2 组间所共有和独有的OTU 数目(图1c)。组间或组间重叠的OTUs 相似度≥97%,2 组中共有OTUs 为69 个,对照组组独有的OTUs 有37 个,实验组独有的OTUs 有2 个。这表明实验组和对照组之间有较大差异,且SSF 产物会降低小鼠肠道菌群的多样性。

图1 各组小鼠粪便样品多样性分析
Fig.1 Analysis of fecal samples diversity of mice in each group
注:Con 为对照组,Test2 代表蛹虫草SSF 产物中剂量灌喂组。*.0.01
2.5.2 小鼠肠道菌群物种组成分析 2 组样本基于门水平进行T 检验比较分析,可以看出,在门水平(图2a),摄入SSF 产物后,会在一定程度上降低拟杆菌门和变形菌门的相对丰度,升高厚壁菌门的相对丰度,差异不显著。

图2 基于门、属水平的小鼠粪便样品组间物种差异分析
Fig.2 Species difference analysis among fecal samples of mice based on phylum and genus level
根据2 组在属水平的组成和序列分布,逐一比较2 组之间的丰度差异,可以更加直观的看到对照组与实验组肠道菌群基于属水平的总体结构变化(图2b)。小鼠进行SSF 产物饮食干预后,与对照组相比,拟杆菌属(Bacteroides)、罗氏菌属(Roseburia)、瘤胃球菌属(Ruminococcus)、Lachnospiraceae、Parabacteroides、Anaerostipes 等菌属丰度显著升高。通过对菌属代谢特性的分析发现,这些丰度升高的菌属均为典型的有机酸产生菌。肠道有机酸包括各类短链脂肪酸 (Shortchain fatty acids,SCFAs)、琥珀酸等。短链脂肪酸给肠道上皮细胞提供能量,能够加强肠道屏障功能,参与免疫调节,降低胆固醇的合成,改善肥胖,预防糖尿病[29-31]。琥珀酸能够预防肥胖症,而且还可以改善胰岛素敏感性和葡萄糖耐量[32]。研究显示拟杆菌属是机体中主要分泌丙酸的细菌,可修复肠黏膜屏障、肠上皮的通透性。脆弱拟杆菌是拟杆菌属模式菌种,是一种新型益生菌,可修复肠道屏障,具有治疗肠道炎症的功效[33-34]。罗斯氏菌属能够利用乳酸和乙酸作为底物进行代谢产生丁酸,可降低全身低度炎症,改善宿主机体代谢[35-36]。Ruminococcus、Lachnospiracea、Anaerostipes 同 样也是丁酸产生菌。丁酸是厚壁菌门的主要代谢产物,是肠腔中SCFAs 的主要成分,丁酸盐是肠道黏膜的能量来源,提高肠道免疫及维持肠道稳态,可预防和缓解高脂饮食引起的肥胖[37-40]。Parabacteroides 是人体和小鼠的核心菌群之一,具有广泛的胆酸转化功能,产生大量琥珀酸,改善宿主糖代谢紊乱,具有抗炎,免疫调节,预防饮食诱导的肥胖的潜在功能。因此,SSF 产物的摄入可增加肠道中有益菌群的丰度水平,提高肠道内SCFA的浓度,发挥维持肠道正常功能,调节宿主代谢,提高机体免疫的作用[41-42]。
与对照组相比,产碱菌属(Alcaligenes)、葡萄球菌属(Staphylococcus)、类香味菌属(Myroides)等明显减少。通过对菌属致病性的分析,发现这些菌属的丰度与肠道代谢疾病的发生有关。其中产碱杆菌属(Alcaligenes)被认为是条件致病菌。螺杆菌属(Helicobacter)中的幽门螺杆菌、胆汁螺杆菌、肝螺杆菌已被证实具有一定的致病性,可诱发胃肠道疾病[43-44]。类香味菌属(Myroides)是一种机会致病菌,可引起尿路感染、感染性休克[45-46]。
综上可知,SSF 产物通过降低多种条件致病菌的丰度,提高肠道产SCFAs 有益菌属的丰度,使菌群朝肠道优势益生菌靠拢,从而发挥改善免疫功能和肠道屏障功能方面作用。
3 结论
固体发酵技术因具有成本低,易于管理,大量生产等特点,是一种经济、环保、有效的发酵方式,逐渐成为各种生物活性成分生产研究的新焦点。近年来,越来越多的研究发现食药用菌的固体发酵产物具有良好的生物活性,是一种廉价有效的功能食品基质,被广泛应用于食品的生产和加工过程中。蛹虫草作为一种重要的、具有较高保健价值的食药用真菌,对其研究和开发已成为国内外的研究热点。随着蛹虫草中活性物质虫草素、多糖的保健价值和药用价值被不断证实,使得市场对于虫草素、多糖产量的需求日趋增加[47-48]。由于固体发酵环境与大部分真菌在自然状态下的生长环境更为接近,因此也更有利于发酵活性产物的积累。固体发酵能够节约能源,大量、高效获得活性物质。本研究发现,SSF 产物的蛋白质、粗多糖和虫草素含量显著高于子实体,这意味着SSF 产物有利于活性产物的积累,提高蛹虫草的利用价值,具有更好的潜在生物活性和进一步利用的前景。
肠道菌群是饮食分析的新靶点,是调节脂肪储存和能量代谢的重要环境因素。不同的膳食干预改变菌群的结构和代谢产物的组成,从而导致健康功能的转变。肠道益生菌可以抑制病原菌的生长,在改善肠黏膜屏障功能方面具有重要作用。肠道致病菌则会通过侵袭力及毒素破坏正常的肠黏膜屏障,使得肠黏膜通透性增加,为菌群移位创造条件[49-51]。研究发现食用菌能够通过调节肠道菌群的组成和结构,促进SCFAs 的产出,增强免疫功能,保护肠道健康。某些化学成分通过微生物在结肠中分解为微生物代谢产物,其中许多代谢产物具有比其前体更高的抗炎活性和生物利用度,可提高有益菌的相对丰度[52-54]。本研究得出,拟杆菌属(Bacteroides)、罗氏菌属(Roseburia)、瘤胃球菌属(Ruminococcus)等有益菌属显著升高,产碱菌属(Alcaligenes)、葡萄球菌属(Staphylococcus)、类香味菌属(Myroides)等有害菌群显著降低。这显示出SSF 产物在调节肠道菌群方面具有明显的积极作用。
综上所述,SSF 产物安全无毒性,并能降低体内脂肪,增强机体免疫功能。同时增加肠道中SCFA 产生菌群的数量,促进肠道有益菌的增殖,抑制有害微生物的生长繁殖,优化肠道菌群的组成。这表明其具有潜在促进机体健康的作用,具有开发为功能性产品的前景和优势。
[1]左锦辉,贡晓燕,董银卯,等.蛹虫草的活性成分和药理作用及其应用研究进展[J].食品科学,2018,39(21):330-339.
ZUO J H,GONG X Y,DONG Y M,et al.Research achievements in bioactive components,pharmacological effects and applications of Cordyceps militaris[J].Food Science,2018,39(21):330-339.
[2]RAETHONG N,LAOTENG K,VONGSANGNAK W.Uncovering global metabolic response to cordycepin production in Cordyceps militaris through transcriptome and genome -scale network -driven analysis[J].Scientific Reports,2018,8(1):1-13.
[3]项婷,夏琛,刘健华,等.蛹虫草中新化合物的分离纯化、结构鉴定及抗肿瘤活性[J].食品科学,2021,42(8):235-242.
XIANG T,XIA C,LIU J H,et al.Separation,structural identification and anti-tumor effects of new compounds from Cordyceps militaris[J].Food Science,2021,42(8):235-242.
[4]BI S,JING Y,ZHOU Q,et al.Structural elucidation and immunostimulatory activity of a new polysaccharide from Cordyceps militaris[J].Food &Function,2018,9(1):279-293.
[5]KIM D J,KANG Y H,KIM K K,et al.Increased glucose metabolism and alpha-glucosidase inhibition in Cordyceps militaris water extract-treated HepG2 cells[J].Nutritional Research and Practice,2017(11):180-189.
[6]HSIAO F S,CHENG Y,WANG S,et al.Cordyceps militaris hot water extract inhibits lipopolysaccharide-induced inflammatory response in porcine alveolar macrophages by regulation of mitogen-activated protein kinase signaling pathway[J].Canadian Journal of Animal Science,2017,98(1):44-52.
[7]PARK S J,JANG H J,HWANG I H,et al.Cordyceps militaris extract inhibits the NF -KB pathway and induces apoptosis through MKK7-JNK signaling activation in TK -10 human renal cell carcinoma[J].Natural Product Communications,2018(13):465-470.
[8]高宇,程俊文,贺亮,等.蛹虫草固体培养菌质粗多糖提取与分离工艺研究[J].中国林副特产,2011(4):1-4.
GAO Y,CHENG J W,HE L,et al.Research on extraction and separation of polysaccharides from solid -state fermentation substance of Cordyceps militaris[J].Forest By-Product and Speciality in China,2011(4):1-4.
[9]唐庆九,薛俊杰,张劲松,等.发酵法生产虫草素研究进展[J].食用菌学报,2011,18(3):100-104.
TANG Q J,XUE J J,ZHANG J S,et al.Cordycepin production using fermentation methodspresent status and future prospects[J].Acta Edulis Fungi,2011,18(3):100-104.
[10]俞商婷,宋婷婷,金群力,等.桑黄燕麦固体发酵菌质多酚含量及其抗氧化活性分析[J].食药用菌,2018,26(2):84-87.
YU S T,SONG T T,JIN Q L,et al.Analysis of polyphenol content and its antioxidant activity of oats solid fermentation fungal substance of Phellinus igniarius[J].Edible and Medicinal Mushrooms,2018,26(2):84-87.
[11]盛悦,何音华,沈月,等.猴头菌液体固体发酵产物多糖抗氧化活性研究[J].农产品加工,2017(4):9-12.
SHENG Y,HE Y H,SHEN Y,et al.Study on antioxidant activity of polysaccharide from Hericium erinaceus liquidand solid fermentation products [J].Farm Products Processing,2017(4):9-12.
[12]李尽哲,耿立,黄雅琴,等.生物发酵技术在食药用真菌领域的应用现状[J].食药用菌,2019,27(6):366-369.
LI J Z,GENG L,HUANG Y Q,et al.Application status of biofermentation technology in edible and medicinal mushrooms[J].Edible and Medicinal Mushrooms,2019,27(6):366-369.
[13]李里特,马艳莉.发酵食品酿造过程中组分和营养功能因子的变化和调控[J].中国食品学报,2011,11(9):82-92.
LI L T,MA Y L.The changes and regulation on ingredients and nutritional-functional factors during food fermenting[J].Journal of Chinese Institute of Food Science and Technology,2011,11(9):82-92.
[14]SAHA S K,BREWER C F.Determination of the concentrations of oligosaccharides,complex type carbohydrates,and glycoproteins using the phenolsulfuric acid method[J].Carbohydr Res,1994,254:157-167.
[15]SHIH I,TSAI K,HSIEH C.Effects of culture conditions on the mycelial growth and bioactive metabolite production in submerged culture of Cordyceps militaris[J].Biochemical Engineering Journal,2007,33(3):193-201.
[16]DONG J Z,WANG S H,AI X R,et al.Composition and characterization of cordyxanthins from Cordyceps militaris fruit bodies[J].Journal of Functional Foods,2013,5(3):1450-1455.
[17]MOSMANN T.Rapid colorimetric assay for cellular growth and survival:Application to proliferation and cytotoxicity assays[J].Immunol Methods,1983,65(1/2):55-63.
[18]张岚,王丹,聂晶石.蚕蛹虫草片剂对体液免疫和细胞免疫功能的影响[J].食品工业科技,2016,37(5):349-352,357.
ZHANG L,WANG D,NIE J S.Effect of Cordyceps militaris on humoral immunity and cellular immunity[J].Scienceand Technologyof Food Industry,2016,37(5):349-352,357.
[19]朱丽娜,高新华,刘艳芳,等.蛹虫草液体发酵菌丝体和固体栽培子实体中活性成分的比较[J].上海农业学报,2019,35(4):57-62.
ZHU L N,GAO X H,LIU Y F,et al.Effect of culture method on the active components in Cordyceps militaris[J].Acta Agriculturae Shanghai,2019,35(4):57-62.
[20]赵星月,李倩,刘文静,等.蛹虫草菌生物合成虫草素的研究进展[J].生物工程学报,2020,36(7):1293-1304.
ZHAO X Y,LI Q,LIU W J,et al.Advances in biosynthesis of cordycepin from Cordyceps militaris[J].Chinese Journal of Biotechnology,2020,36(7):1293-1304.
[21]CAO H,LIU Z,CHANG Z.Cordycepin induces apoptosis in human bladder cancer cells via activation of A3 adenosine receptors[J].Tumor Biology,2017,39(7):1393382749.
[22]CHENA Y,YANG S,HUENG D,et al.Cordycepin induces apoptosis of C6 glioma cells through the adenosine 2A receptor-p53-caspase-7PARP pathway [J].Chemico-Biological Interactions,2014,216:17-25.
[23]杜静,阚伟京,杨健,等.腺苷受体及蛹虫草虫草素在新冠肺炎防治中相关的药理机制[J].世界科学技术-中医药现代化,2020,22(3):573-584.
DU J,KAN W J,YANG J,et al.Possible pharmacological mechanisms of adenosine receptor and Cordycepin from Cordyceps militaris in the prevention and treatment of COVID-19 pneumonia[J].Modernization of Traditional Chinese Medicine and Materia Materia -World Science and Technology,2020,22(3):573-584.
[24]LIUFU G S,ZHU Z R,LIU J,et al.The acute toxicity and subchronic toxicity test of Zhuqin extract[J].Medicinal Plant,2015,Z2(6):25-27.
[25]官佳懿,张永红,崔德凤,等.绿原酸对小鼠脾脏淋巴细胞体外增殖和分泌功能的影响[J].中国农学通报,2013,29(29):27-31.
GUANG J Y,ZHANG Y H,CUI D F,et al.Effects of chlorogenic acid on proliferations and secretion function ofmouse spleen lymphocytes in vitro[J].Chinese Agricultural Science Bulletin,2013,29(29):27-31.
[26]潘烨,郑起.干扰素在肿瘤治疗中应用的研究进展[J].国外医学(外科学分册),2005,32(1):10-13.
PANG Y,ZHENG Q.Research progress on the application of interferon in tumor treatment [J].International Journal of Surgery,2005,32(1):10-13.
[27]陈黎龙,朱晓彤,江青艳,等.三肽囊素对鸡脾脏淋巴细胞增殖转化、IL-2 和IL-6 分泌及其基因表达的影响[J].动物学报,2006,52(1):170-174.
CHEN L L,ZHU X T,JIANG Q Y,et al.Effects of synthetic bursin on proliferation of chicken splenic lymphocytes and expression of IL-2 and IL-6[J].Acta Zoologica Sinica,2006,52(1):170-174.
[28]曲巍,张智,马建章,等.高通量测序研究益生菌对小鼠肠道菌群的影响[J].食品科学,2017,38(1):214-219.
QU W,ZHANG Z,MA J Z,et al.Effect of probiotics on gut microbiota in mice evaluated by high-throughput sequencing[J].Food Science,2017,38(1):214-219.
[29]武明月,孔祥丽,张天阳,等.菊粉和大豆膳食纤维对牛肉饮食的小鼠肠道菌群及代谢产物的改善作用[J].食品科学,2022,43(5):158-167.
WU M Y,KONG X L,ZHANG T Y,et al.Inulin and soybean dietary fiber improved the intestinal flora and metabolites in mice fed a beef-containing diet[J].Food Science,2022,43(5):158-167.
[30]刘荣瑜,王昊,张子依,等.多糖与肠道菌群相互作用的研究进展[J].食品科学,2022,43(5):363-373.
LIU R Y,WANG H,ZHANG Z Y,et al.Progress in understanding interaction of polysaccharides with intestinal flora[J].Food Science,2022,43(5):363-373.
[31]CANFORA E E,MEEX R,VENEMA K,et al.Gut microbial metabolites in obesity,NAFLD and T2DM[J].Nature Reviews Endocrinology,2019,15(5):261-273.
[32]FAN Y,PEDERSEN O.Gut microbiota in human metabolic health and disease [J].Nature Reviews Microbiology,2021,19(1):55-71.
[33]范宏英.脆弱拟杆菌抑制阪崎克罗诺杆菌致坏死性小肠结肠炎效果评价及机制研究[D].广州:南方医科大学,2019.
FAN H Y.Efficacy and mechanism of Bacteroides fragilis on the prevention and treatment of Cronobacter sakazakii-induced necrotizing enterocolitis[D].Guangzhou:Southern Medical University,2019.
[34]HSIAO E Y,MCBRIDE S W,HSIEN S,et al.Microbiota modulate behavioral and physiological abnormalities associated with neurodevelopmental disorders[J].Cell,2013,155(7):1451-1463.
[35]BELENGUER A,DUNCAN S H,CALDER A G,et al.Two routes of metabolic cross-feeding between Bifidobacterium adolescentis and butyrate-producing anaerobes from the human gut[J].Applied and Environmental Microbiology,2006,72(5):3593-3599.
[36]张仟鹏.人体肠道内丁酸盐产生菌的分离鉴定和功能评价[D].上海:上海交通大学,2016.
ZHANG Q P.Isolation,identification and funtional evaluation of butyrate-producing bacteria from human gut[D].Shanghai:Shanghai Jiao Tong University,2016.
[37]LOUIS P,FLINT H J.Formation of propionate and butyrate by the human colonic microbiota [J].Environmental Microbiology,2017,19(1):29-41.
[38]张琳倩,李小兵,包云光.腹型过敏性紫癜患儿急性期与恢复期肠道菌群变化的分析[J].中国微生态学杂志,2020,32(2):146-150.
ZHANG L Q,LI X B,BAO Y G,et al.The changes of intestinal microflora in children with abdominal allergic purpura at acute and convalescent stages[J].Chinese Journal of Microecology,2020,32(2):146-150.
[39]许真源,李小雅,许雅青,等.产丁酸菌调节肠道微生态及中药的干预作用研究进展[J].中国实验方剂学杂志,2020,26(6):226-233.
XU Z Y,LI X Y,XU Y Q,et al.Research progress of butyrate-producing bacteria in regulating intestinal microecology and interventional effect of Chinese herbal medicine [J].Chinese Journal of Experimental Traditional Medical Formulae,2020,26(6):226-233.
[40]LOUIS P,FLINT H J.Diversity,metabolism and microbial ecology of butyrate-producing bacteria from the human large intestine[J].FEMS Microbiol Lett,2009,294(1):1-8.
[41]WU T,LIN C,CHANG C,et al.Gut commensal Parabacteroides goldsteinii plays a predominant role in the anti-obesity effects of polysaccharides isolated from Hirsutella sinensis[J].Gut,2019,68(2):248-262.
[42]AHMED S,BUSETTI A,FOTIADOU P,et al.In vitro characterization of gut microbiota -derived bacterial strains with neuroprotective properties [J].Frontiersin Cellular Neuroscience,2019,13:402.
[43]胡守奎,徐建国.螺杆菌属及其致病性研究[J].疾病监测,2014,29(4):321-326.
HU S K,XU J G.Research of Helicobacter spp.and its pathogenicity[J].Disease Surveillance,2014,29(4):321-326.
[44]周雪亮,周渊,朱强,等.幽门螺旋杆菌的研究进展[J].中国继续医学教育,2018,10(33):101-104.
ZHOU X L,ZHOU Y,ZHU Q,et al.Recent advance on Helicobacter Pylori[J].China Continuing Medical Education,2018,10(33):101-104.
[45]LICKER M,SORESCU T,RUS M,et al.Extensively drug-resistant Myroides odoratimimus-a case series of urinary tract infections in immunocompromised patients[J].Infection and Drug Resistance,2018,11:743-749.
[46]张培培,闫文娟,李轶,等.22 株香味类香味菌的临床特点及耐药性分析[J].国际检验医学杂志,2020,41(1):25-28.
ZHANG P P,YAN W J,LI Y,et al.Analysis of clinical characteristics and drug resistance of 22 strains of aromatic bacteria[J].International Journal of Laboratory Medicine,2020,41(1):25-28.
[47]周思静,刘桂君,尚宏忠,等.蛹虫草人工培养技术研究进展[J].江苏农业科学,2014,42(7):13-17.
ZHOU S J,LIU G J,SHANG H Z,et al.Research progress on artificial culture technology of Cordyceps militaris[J].Jiangsu Agricultural Sciences,2014,42(7):13-17.
[48]韩瑜玮,刘洋洋,陈伟.蛹虫草多糖酸奶对酒精性肝损伤昆明种小鼠的协同保护作用[J].食品科学,2020,41(1):209-214.
HAN Y W,LIU Y Y,CHEN W.Synergistic protective effects of Cordyceps militaris polysaccharide supplemented yogurt on alcoholic liver injury in Kunming mice[J].Food Science,2020,41(1):209-214.
[49]冉艳,肖莫凡,陈思玮,等.肠道菌群与炎症性肠病的研究进展[J].胃肠病学和肝病学杂志,2021,30(1):6-9.
RAN Y,XIAO M F,CHEN S W,et al.Research progress of gut microbiota and inflammatory bowel disease[J].Chin J Gastroenterol Hepatol,2021,30(1):6-9.
[50]SANDERS M E,MERENSTEIN D J,REID G,et al.Probiotics and prebiotics in intestinal health and disease:From biology to the clinic[J].Nature Reviews Gastroenterology &Hepatology,2019(16):605-616.
[51]PICKARD J M,ZENG M Y,ROBERTA C,et al.Gut microbiota:Role in pathogen colonization,immune responses,and inflammatory disease [J].Immunol Rev,2017,279(1):70-89.
[52]王勇,宋歌,庞邵杰,等.应用Illumina NovaSeq 测序技术比较3 种杂粮对大鼠肠道菌群的影响[J].食品科学,2021,42(9):100-106.
WANG Y,SONG G,PANG S J,et al.Effects of three kinds of coarse cereals on gut microbiota of rats explored by Illumina NovaSeq sequencing technology[J].Food Science,2021,42(9):100-106.
[53]肖璇,杨伟超,杜蓓蓓,等.干酪乳杆菌对虫草素的生物转化研究[J].微生物学杂志,2019,39(1):38-42.
XIAO X,YANG W C,DU B B,et al.Study on biotransformation of cordycepin by Lactobacillus casei[J].Journal of Microbiology,2019,39(1):38-42.
[54]LI H,CHRISTMAN L,LI R,et al.Synergic interactions between polyphenols and gut microbiota in mitigating inflammatory bowel diseases[J].Food &Function,2020,11(6):4878-4891.