2021年国际糖尿病联盟 (The International Diabetes Federation,IDF)数据显示,全球糖尿病患者数高达5.37 亿,中国糖尿病患者数达1.40 亿,位居世界第一。我国糖尿病与肥胖症患者数量剧增,严重影响人们的身体健康,其防控形势相当严峻。在多相、多组分和多尺度同时存在的复杂食品体系中,食物组分之间的相互作用机制与糖尿病和肥胖患者的糖代谢和血糖应答水平有着密不可分的关系。餐后血糖应答很大程度上取决于快消化淀粉的含量。慢消化或抗性淀粉含量高的食物属低血糖生成指数(Glycemic index,GI)食品,可维持餐后血糖稳定,能改善餐后血糖负荷,提高机体对胰岛素的敏感性。食物组分间的相互作用及其对淀粉消化性的影响已成为国际食品科学界的研究热点。
我国马铃薯资源丰富,马铃薯是世界第三大食用作物[1]。2016年农业农村部主张推进马铃薯主粮化[2-3]。生的马铃薯淀粉中抗性淀粉(Resistant starch,RS)含量丰富,然而,经蒸煮后其快消化淀粉(Rapidly digestible starch,RDS)显著升高,属于高GI 食品[4]。文献报道过多地摄食马铃薯及其产品可能与慢性疾病与代谢病征风险相关[5-6]。降低马铃薯淀粉及其产品的消化性,对丰富马铃薯主粮化产品种类,实现更大的经济效益至关重要。
富含淀粉的食品体系中,蛋白质是影响淀粉消化的重要组分。研究表明,内源蛋白和外源蛋白均会对淀粉的消化酶解特性产生影响[7-10]。近年来,学者开始关注蛋白酶解产物对淀粉消化性的影响[11-12]。水解豌豆蛋白与原豌豆蛋白相比更能显著降低淀粉酶解,两者可能是通过氢键增强淀粉与蛋白质的相互作用。与原大豆蛋白相比,水解大豆蛋白明显降低了淀粉中RDS 含量[10]。
大豆分离蛋白 (Soybean isolation protein,SPI)是一种丰富、廉价、营养、优质的植物蛋白[13]。大豆肽(Soybean peptide,SPT)是大豆分离蛋白酶解后的产物,是一种对人体有益的小分子肽,可以预防肥胖和糖尿病等疾病[11,14]。湿热处理(Heat moisture treatment,HMT) 作为一种常用的物理改性手段,对淀粉的理化、结构和消化特性有显著影响[15]。前期研究发现SPT 在湿热处理条件下可以显著降低玉米淀粉和马铃薯淀粉的消化性,且对马铃薯淀粉较玉米淀粉影响更大,并呈现剂量依赖性[16]。
本文在前期研究基础上,研究不同湿热处理水分条件下马铃薯淀粉与大豆肽的互作机制,探究不同湿热处理条件对马铃薯淀粉-大豆肽复合物形貌、理化结构和消化特性的影响,为碳水化合物限制饮食体系低GI 食品的开发提供理论参考。
1 材料与方法
1.1 材料与试剂
马铃薯淀粉(食用级),杭州普罗星淀粉有限公司;大豆肽(食用级),西安绿如泉生物科技有限公司;猪胰α-淀粉酶 (≥1 000 units/mg),美国Sigma-Aldrich 公司;葡萄糖氧化酶/过氧化物酶葡萄糖检测试剂盒(GOPOD),Megazyme 国际有限公司;无水乙醇、氢氧化钠、盐酸、苯甲酸、醋酸,天津大茂化学试剂厂;其它化学品均为分析纯级。
1.2 仪器与设备
电子精密天平(JAI1003),湖南力辰仪器科技有限公司;台式高速离心机(TG20-WSI),湘麓离心机仪器有限公司;磁力加热搅拌器(Hei-Tec),德国Heidolph 公司;紫外分光光度计(UV-3200),深圳市科力易翔仪器设备有限公司;扫描电子显微镜(JSM-6701F),德国Zeiss 公司;傅立叶变换红外光谱仪(IS5),美国Nicolet 公司;热台偏光显微镜(BX-51),日本Olympus 公司;布拉班德粘度仪(Viscograph-E),德国Branbender 公司;差示扫描量热仪(DSC-Diamond 型),美国Perkin-Elmer公司。
1.3 方法
1.3.1 样品的制备 将马铃薯淀粉与适量蒸馏水混合,使其水分含量分别为15%,25%,35%,并在室温下平衡24 h。加入淀粉干基10%的大豆肽,充分搅拌混匀,将混合物放在反应釜中,置于100 ℃的鼓风烘箱中反应12 h。取出冷却至室温,37 ℃干燥过夜,粉碎并过100 目筛。不同湿热处理的样品按照水分从低到高依次标记为:H1-PSSP,H2-PSSP 和H3-PSSP。将马铃薯淀粉和大豆肽进行物理混合作为空白对照,标记为P-PSSP。
1.3.2 颗粒形态分析
1.3.2.1 电子显微镜 将静电胶带贴于扫描电子显微镜的载物台,取微量样品均匀粘在胶带上,将胶带置于真空条件下喷金,再放入扫描电子显微镜,以不同放大倍数对其进行扫描与拍照。
1.3.2.2 热台偏光显微镜 在普通光或偏振光下,用Olympus BX-51 光学显微镜获得光学显微照片。把样品平铺在载玻片上,再把载玻片置于载物台中,用1 滴甘油水溶液(1∶1,体积比)覆盖并用压片压住。调整样品位置正对光孔,转动转换器,调节光圈,以500×放大率记录图像。
1.3.3 膨胀度测定 称取0.2 g 样品(干基),加入去离子水配制成质量分数为10%的淀粉乳,分别置于60,70,80,90 ℃水浴锅中水浴搅拌30 min,再以3 000 r/min 离心15 min 后倒出上清液,根据剩余固体质量计算得到[17]膨胀度。计算公式如下:
1.3.4 黏度测定 称取6 g 干基淀粉样品,加入去离子水配制成质量分数为6%的淀粉乳,转移至布拉班德粘度测量杯。设置参数:初始温度30 ℃,设置升温速率为6 ℃/min,温度升至95 ℃时保持5 min,设置降温速率为7.5 ℃/min,冷却至50 ℃保温5 min 结束,记录保存黏度与温度曲线。
1.3.5 差示量热扫描仪分析 称取样品干基3 mg,加入去离子水配制为质量分数30%的淀粉乳液,密封条件下在室温平衡水分2 h。以空白铝盘作对照,使用差示量热扫描仪,在密封的铝盘中以10 ℃/min 的速率,扫描30~120 ℃的样品,并分析确定热力学特征参数To,Tp,Tc 和焓变(ΔH)。
1.3.6 体外消化性测定 参照Englyst 等[18]的方法进行体外消化性的测定。称量0.6 g 干基样品,加入20 mL 乙酸钠缓冲溶液,涡旋5 min 充分混合。样品置于沸水浴中搅拌30 min,再放入37 ℃水浴锅振荡30 min。在每个离心管中加入5 mL 含有猪胰酶(3×103 USP)和葡萄糖淀粉酶(40 U)的混合酶,在20 min 和120 min 2 个时间点取出0.25 mL 酶解液,与10 mL 66%(V/V)乙醇混合进行灭酶。水解酶解液的葡萄糖含量依次记为G20 和G120。分别移取100 μL 的空白试剂、酶解液和标准葡萄糖液于5 mL 离心管中,分别加入3 mL 的GOPOD 溶液,涡旋将其充分混合,再于50 ℃水浴避光显色20 min,在510 nm 波长下测定其吸光值。
2 结果与分析
2.1 颗粒形貌
图1为湿热处理条件下马铃薯淀粉与大豆肽复合物的扫描电镜图。在物理混合的样品中,大豆肽部分附着在淀粉颗粒表面或者周围。相比而言,在湿热处理低水分条件下,马铃薯淀粉-大豆肽复合物形貌特征无明显变化,而在中水分和高水分的湿热处理条件下,马铃薯淀粉-大豆肽复合物团聚现象增加,归因于湿热处理过程中产生的压力和热量使颗粒聚集成团簇状[19]。经湿热处理后,15%湿热处理水分条件没有明显改变复合物的形貌,而25%和35%湿热处理水分条件形成团簇状,可能归因于在较高湿热处理水分条件下,直链淀粉的逸出和支链淀粉膨胀,使其与大豆肽之间的黏附性和相互作用力增强[20]。此外,随着湿热处理水分含量的增加,马铃薯淀粉颗粒出现熔融,且破损程度增加。归因于HMT 过程中部分淀粉颗粒吸水膨胀、糊化[21]。
图2为湿热处理条件下马铃薯淀粉与大豆肽复合物的偏光显微图。在物理混合中,样品有清晰的轮廓和偏光十字。而在湿热处理中,随着水分含量的增加,偏光十字变得越来越模糊。偏光十字表征淀粉分子有序排列,淀粉颗粒双折射的强度由淀粉颗粒半径大小和螺旋结构决定[22-23]。湿热处理后复合物颗粒中心双折射强度减弱,表明HMT 期间释放的热能与水分使淀粉链迁移程度增大[24]。双螺旋结构可能发生解旋或重组,由此导致径向取向的丧失[22,25]。随着水分含量的增加,偏光十字变得越来越模糊,可能是由于在较高水分含量下,发生部分或完全糊化[26]。Pinto 等[20]研究表明,水分含量对淀粉偏光十字的影响大于温度,并且有利于淀粉团聚物的形成,这与图1所显现的规律一致。

图1 湿热处理条件下马铃薯淀粉与大豆肽复合物的扫描电镜图
Fig.1 Scanning electron microscopy of potato starch and soybean peptide complex after heat moisture treatment
注:第1 行放大倍数为500;第2 行放大倍数为1 000。
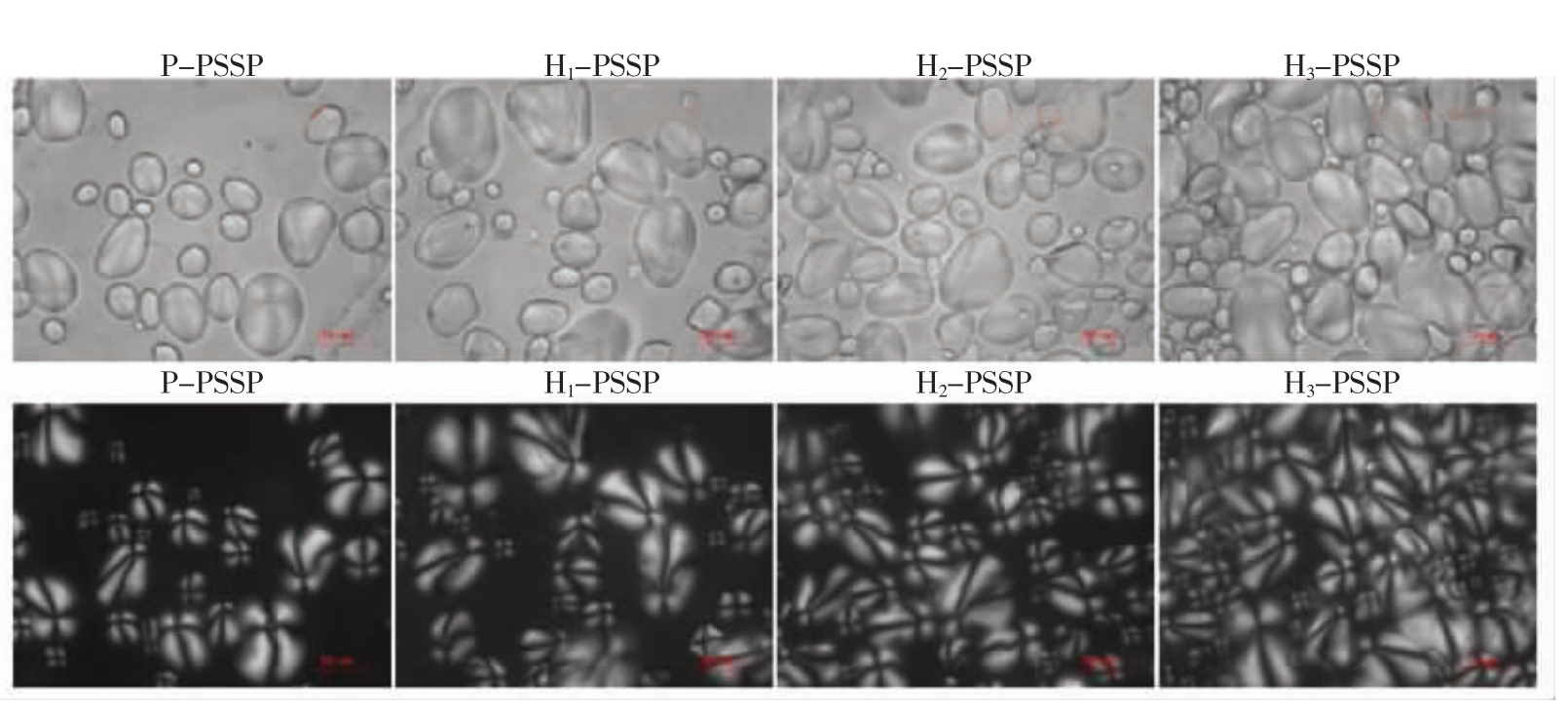
图2 湿热处理条件下马铃薯淀粉与大豆肽复合物的偏光显微图
Fig.2 Polarized light micrograph of potato starch and soybean peptide complex after heat moisture treatment
注:第1 行为普通光;第2 行为偏振光。
2.2 膨胀度
湿热处理条件下马铃薯淀粉与大豆肽复合物的膨胀度如图3所示。从图3可知,无论是物理混合的对照样品,还是湿热处理的复合物,其膨胀度均随着温度的升高而降低。与物理混合的样品相比,经湿热处理后,马铃薯淀粉-大豆肽复合物的膨胀度显著降低,且随着湿热处理水分含量的升高呈逐渐降低的趋势,与文献[24],[27],[28]报道结果一致。湿热处理过程中淀粉内部分子链发生重排,直链淀粉和直链淀粉之间以及支链淀粉和支链淀粉之间的相互作用增强,使其形成更加紧密的双螺旋结构,同时阻碍了淀粉颗粒与水分子的结合,从而限制了马铃薯淀粉的水合能力和膨胀[19,27]。覆盖在淀粉颗粒表面的大豆肽可以结合部分水分,从而影响水分进入淀粉颗粒内部,进而影响其膨胀度[29]。此外,在湿热处理过程中,马铃薯淀粉中带负电荷基团的磷酸单酯可能与大豆肽中的侧链基团发生相互作用,导致马铃薯淀粉-大豆肽复合物的膨胀度显著降低[30-31]。
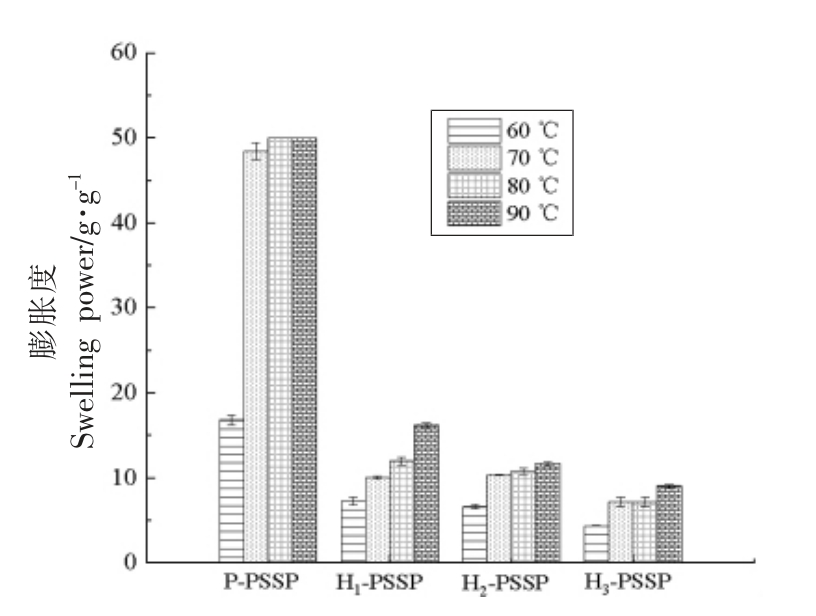
图3 湿热处理条件下马铃薯淀粉与大豆肽复合物的膨胀度曲线
Fig.3 Swelling power plot of potato starch and soybean peptide complex after heat moisture treatment
2.3 黏度特性
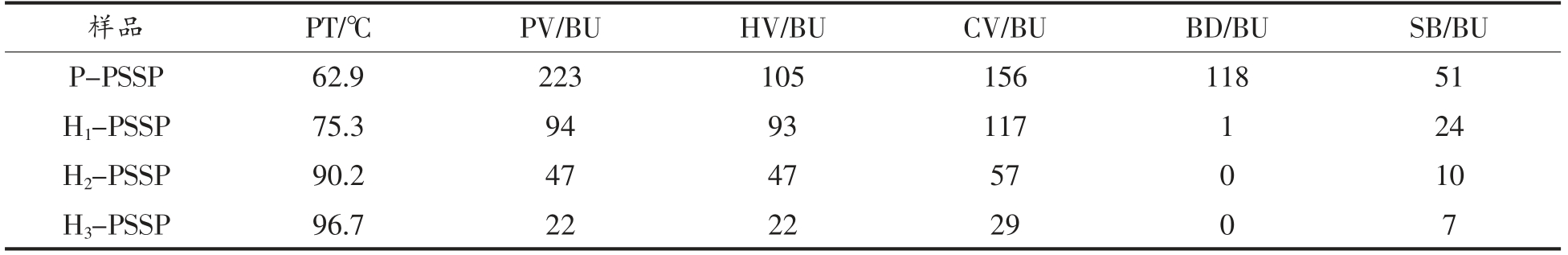
图4和表1分别为湿热处理条件下马铃薯淀粉与大豆肽复合物的黏度曲线和黏度特性值。与物理混合的样品相比,湿热处理后复合物的起糊温度(PT)升高,峰值黏度(PV)、热糊黏度(HV)和冷糊黏度(CV)均出现大幅下降,归因于在HMT过程中,淀粉链流动性增加,分子链经重排、重组形成有序的双螺旋支链淀粉团簇。这种刚性结构可以限制淀粉膨胀,提高淀粉在加热过程中的稳定性[26,32],与膨胀度结果一致。HMT 期间的热能促使支链淀粉长链断裂,产生与直链淀粉紧密相关的短链[21,33-34]。同时,颗粒间的相互交联增强了氢键的作用,导致直链淀粉浸出并增加淀粉的耐热性,从而降低淀粉黏度[35]。表1显示随着HMT 水分含量增加,淀粉的PV 逐渐降低,与文献[36]~[38]的研究结果一致。HMT 中淀粉和大豆肽之间的相互作用也会影响体系的黏度。前期研究表明,变性蛋白与淀粉颗粒以及变性蛋白与变性蛋白之间的相互作用,可能会延缓淀粉颗粒的膨胀[16,26]。
表1 湿热处理条件下马铃薯淀粉与大豆肽复合物的黏度特性数据
Table 1 Pasting characteristics of potato starch and soybean peptide complex after heat moisture treatment
?
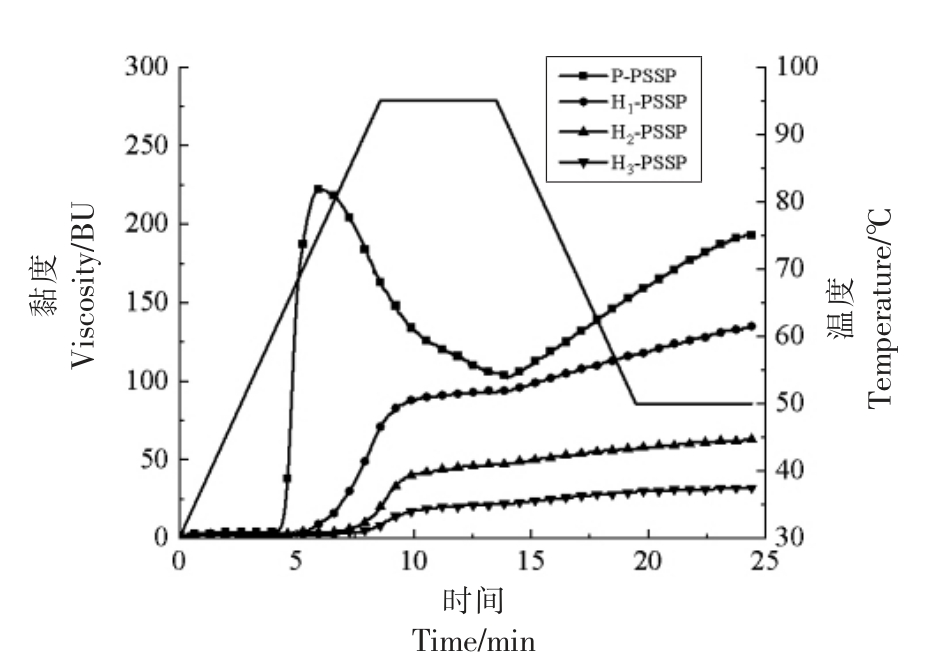
图4 湿热处理条件下马铃薯淀粉与大豆肽复合物的黏度图
Fig.4 Pasting profile of potato starch and soybean peptide complex after heat moisture treatment
2.4 热力学特性
湿热处理条件下淀粉-大豆肽复合物的糊化温度(To、Tp 和Tc)和焓变(ΔH)如表2所示。与物理混合的样品相比,HMT 后马铃薯淀粉-大豆肽复合物的糊化温度升高,且随着水分含量的增加而升高,焓值则有着相反的趋势。HMT 改性后,淀粉链之间的相互作用增强,延缓了淀粉的糊化进程,导致To 升高[33]。从表2可知,随着水分含量的增加,To、Tp 和Tc 也随之升高,与Zavareze 和Dias[21]报道一致。可能是由于HMT 过程中会引起结晶区和非晶区链段变化并发生重组,使淀粉的糊化能力降低,因此需要更高的温度才能使链断裂,使颗粒发生膨胀[39]。湿热处理过程中水分的增加引起了更大的淀粉分子链迁移率,直链淀粉和支链淀粉之间的氢键相互作用增强,淀粉的热稳定性增加,故而Tp 值增大。水分增加后Tc 与To 值较高的原因也可能是HMT 破坏了淀粉颗粒结晶区和非晶区的双螺旋,分子的重排形成了一些有序稳定的结构[40]。从另一个角度来看,To 和Tp 的显著增加也可能是因为淀粉与大豆肽的相互作用,限制了淀粉的水合作用和溶胀。热变性增强了大豆肽的表面疏水性,而且改变了其水合能力,从而影响淀粉对水的可利用性和水合作用[41]。与物理混合对照相比,HMT 可能促进了颗粒晶体结构的破坏,导致ΔH 降低,最终归因于淀粉链部分破裂和重组[24,42]。
表2 湿热处理条件下马铃薯淀粉与大豆肽复合物的热力学性质数据
Table 2 Thermal property data of potato starch and soybean peptide complex after heat moisture treatment

注:同列不同小写字母表示差异显著(P<0.05)。
?
2.5 体外消化性
湿热处理条件下,淀粉-大豆肽复合物在未蒸煮和蒸煮条件下的快消化淀粉(RDS)、慢消化淀粉(SDS)和抗性淀粉(RS)含量如表3所示。未经蒸煮时,与物理混合组对比,15%和25%水分含量的湿热处理条件下,混合物的RDS 含量降低,SDS含量增加。据报道,与天然淀粉相比,在湿热处理的温度和水分含量影响下,可能使淀粉的SDS 含量增加1 倍[25]。HMT 后SDS 和RS 含量的增加可能与淀粉结构的变化有关,由于直链淀粉链和直链淀粉-支链淀粉之间发生了相互作用,以及有序晶体结构的重排,导致SDS 和RS 增加[19]。此外,在HMT 中淀粉链可能与大豆肽的侧链基团发生了相互作用[42]。35%水分含量的湿热处理条件下,与物理混合处理相比,混合物的RDS 含量增加,RS含量减少。RS 含量下降归因于HMT 的高水分条件下淀粉颗粒发生糊化现象[43]。
表3 湿热处理条件下马铃薯淀粉与大豆肽复合物的体外消化性
Table 3 In vitro digestibility of potato starch and soybean peptide complex after heat moisture treatment

注:同列不同小写字母表示差异显著(P<0.05)。
?
马铃薯淀粉-大豆肽复合物经蒸煮后,较蒸煮前RDS 含量显著增加,SDS 和RS 含量明显减少。与蒸煮后的物理混合样品相比,马铃薯淀粉-大豆肽复合物中RDS 含量降低,RS 含量显著提高,且RDS 和RS 含量随着湿热处理水分含量增加呈逐渐降低和逐渐升高的趋势。可能归因于在蒸煮过程中,淀粉和大豆肽之间相互作用增强,结果说明大豆肽从蒸煮前共混物中的分散剂转变为蒸煮后共混物中酶的物理屏障[44],淀粉颗粒表面的大豆肽可能是有效阻碍淀粉快速消化的物理屏障[45]。
3 结论
湿热处理对马铃薯淀粉-大豆肽复合物的理化和消化特性有很大影响。在中水分(25%)和高水分(35%)条件下HMT 使淀粉-大豆肽复合物颗粒黏附聚集成团,随着水分含量的增加,复合物发生的团聚现象更为明显,复合物的偏光十字变得越来越模糊,淀粉双螺旋结构可能发生部分糊化。在HMT 过程中,淀粉-大豆肽复合物的膨胀度降低,且随着水分含量的增加而降低。与物理混合处理相比较,湿热处理后混合物的起糊温度升高,峰值黏度、热糊黏度和冷糊黏度均出现大幅度下降,随着HMT 水分含量增加,淀粉的峰值黏度逐渐降低。在热力学性质中,To、Tp 和Tc 值随着水分含量的增加而升高,HMT 促进了颗粒晶体结构的破坏,导致焓值降低。蒸煮后HMT 使马铃薯淀粉-大豆肽复合物的RDS 含量降低,而抗性淀粉含量升高。35%水分条件下HMT,马铃薯淀粉-大豆肽复合物样品中RDS 含量最低,RS 含量最高。综上所述,HMT 过程中淀粉直链淀粉/支链淀粉的重组,大豆肽的物理包埋作用,以及马铃薯淀粉带负电荷基团与大豆肽侧链基团之间的相互作用,会共同影响马铃薯淀粉-大豆肽复合体系的消化性。研究结果可以提高对食品多组分间相互作用的认识,为优化含慢消化淀粉和抗性淀粉的新型低GI食品的加工方法提供重要的理论指导。
[1]CAMIRE M E,KUBOW S,DONNELLY D J.Potatoes and human health[J].Crit Rev Food Sci Nutr,2009,49(10):823-840.
[2]SORIN C C,GHEORGHE O,PAUL C S.Preface to the Special Issue 51 (3/4):Potato in a Changing World[J].Potato Research,2008,51(3/4):215-216.
[3]高雅.解读 《马铃薯产业开发指导意见》16 个关键点[J].种子科技,2016(3):8-9.
GAO Y.Interpretation of the “potato industry development guidance” 16 key points[J].Seed Technology,2016(3):8-9.
[4]曾凡逵,许丹,刘刚.马铃薯营养综述[J].中国马铃薯,2015(4):55-65.
ZENG F K,XU D,LIU G.Potato nutrition:A critical review[J].China Potatoes,2015(4):55-65.
[5]GRASGRUBER P,SEBERA M,HRAZDIRA E,et al.Food consumption and the actual statistics of cardiovascular diseases:An epidemiological comparison of 42 European countries [J].Food &Nutrition Research,2016,60(1):31694.
[6]BORGI L,RIMM E B,WILLETT W C,et al.Potato intake and incidence of hypertension:Results from three prospective US cohort studies[J].BMJ(online),2016,353:i2351.
[7]陈旭.蛋白和脂质对淀粉消化特性的影响机理研究[D].广州:华南理工大学,2017.
CHEN X.Mechanism for the digestion properties of starch influenced by lipid and protein[D].Guangzhou:South China University of Technology,2017.
[8]CHEN X,HE X W,ZHANG B,et al.Effects of adding corn oil and soy protein to corn starch on the physicochemical and digestive properties of the starch [ J ].International Journal of Biological Macromolecules,2017,104:481-486.
[9]NA - NAKORN K,KULRATTANARAK T,HAMAKER B R,et al.Starch digestion kinetics of extruded reformed rice is changed in different ways with added protein or fiber[J].Food &Function,2019,10(8):4577-4583.
[10]LOPEZ-BARON N,SAGNELLI D,BLENNOW A,et al.Hydrolysed pea proteins mitigate in vitro wheat starch digestibility [J].Food Hydrocolloids,2018,79:117-126.
[11]MANDERS R J F,HANSEN D,ZORENC A H G,et al.Protein co -ingestion strongly increases postprandial insulin secretion in type 2 diabetes patients[J].Journal of Medicinal Food,2014,17(7):758-763.
[12]OGIWARA M,OTA W,MIZUSHIGE T,et al.Enzymatic digest of whey protein and wheylin-1,a dipeptide released in the digest,increase insulin sensitivity in an Akt phosphorylation -dependent manner[J].Food &Function,2018,9(9):4635-4641.
[13]GALUS S,MATHIEU H,LENART A,et al.Effect of modified starch or maltodextrin incorporation on the barrier and mechanical properties,moisture sensitivity and appearance of soy protein isolatebased edible films[J].Innovative Food Science &Emerging Technologies,2012,16:148-154.
[14]AOYAMA T,FUKUI K,TAKAMATSU K,et al.Soy protein isolate and its hydrolysate reduce body fat of dietary obese rats and genetically obese mice(Yellow KK)[J].Nutrition,2000,16(5):349-354.
[15]刘珂.热处理、交联反应对马铃薯淀粉性质的对比研究[D].广州:华南理工大学,2019.
LIU K.Comparative study on the properties of potato starch by heat treatment and cross-linking reaction[D].Guangzhou:South China University of Technology,2019.
[16]CHEN X,LUO J,FU L,et al.Structural,physicochemical,and digestibility properties of starch-soybean peptide complex subjected to heat moisture treatment[J].Food Chemistry,2019,297:124957.
[17]CHEN X,LUO J W,LIANG Z L,et al.Structural and physicochemical/digestion characteristics of potato starch-amino acid complexes prepared under hydrothermal conditions[J].International Journal of Biological Macromolecules,2020,145:1091-1098.
[18]ENGLYST K N,ENGLYST H N,HUDSON G J,et al.Rapidly available glucose in foods:An in vitro measurement that reflects the glycemic response[J].American Journal of Clinical Nutrition,1999,69(3):448-454.
[19]PHAN THANH BAOT,LUU BUI BAON,PHAN NGOCH,et al.Impact of heat -moisture and annealing treatments on physicochemical properties and digestibility of starches from different colored sweet potato varieties [J].International Journal of Biological Macromolecules,2017,105:1071-1078.
[20]PINTO VZ,MOOMAND K,VANIER N L,et al.Molecular structure and granule morphology of native and heat -moisture -treated pinhao starch [J].International Journal of Food Science And Technology,2014,50(2):282-289.
[21]ZAVAREZE E D R,GUERRA D,ALVARO R.Impact of heat-moisture treatment and annealing in starches A review[J].Carbohydrate Polymers,2011,83(2):317-328.
[22]高群玉,叶营,王琳.湿热处理对不同晶型淀粉理化性质及消化性的影响[J].现代食品科技,2015(3):60-65.
GAO Q Y,YE Y,WANG L.Effect of heatmoisture treatment on the physicochemical properties and digestibility of starches with different crystal structures[J].Modern Food Technology,2015(3):60-65.
[23]武俊超,高群玉,梁楚琴.采用不同方法制备豌豆抗性淀粉及其性质研究[J].食品与发酵工业,2011(9):123-127.
WU Q C,GAO Q Y,LIANG C Q.Study on preparation and properties of pea resistant starches with different methods[J].Food and Fermentation Industry,2011(9):123-127.
[24]BARTZ J,DA ROSA ZAVAREZE E,DIASA R G.Study of heat-moisture treatment of potato starch granules by chemical surface gelatinization[J].Journal of the Science of Food &Agriculture,2016,97(10):3114-3123.
[25]CHUNG H J,LIU Q,HOOVER R.Impact of annealing and heat-moisture treatment on rapidly digestible,slowly digestible and resistant starch levels in native and gelatinized corn,pea and lentil starches[J].Carbohydrate Polymers,2009,75(3):436-447.
[26]CHENX,HE X W,FU X,et al.In vitro digestion and physicochemical properties of wheat starch/flour modified by heat-moisture treatment[J].Journal of Cereal Science,2015,63:109-115.
[27]张晶,刘庆庆,陈兵,等.湿热处理过程中水分含量对多孔淀粉理化性质的影响[J].现代食品科技,2016(8):148-155.
ZHANG J,LIU Q Q,CHEN B,et al.Effect of moisture content on the physicochemical properties of porous starch during heat-moisture treatment[J].Modern Food Technology,2016(8):148-155.
[28]ZAVAREZE E D R,STORCK C R,CASTRO L A S D,et al.Effect of heat-moisture treatment on rice starch of varying amylose content[J].2010,121(2):358-365.
[29]崔亚楠,张晖,齐希光,等.脱脂脱蛋白质对黑麦粉理化特性及体外消化特性的影响[J].食品与生物技术学报,2019(5):37-43.
CUI Y N,ZHANG H,QI X G,et al.Physicochemical properties,in vitro starch digestibility of rye as affected by defatted and deproteined treatment[J].Food and Biotechnology,2019(5):37-43.
[30]孙旸,孙春玉,陈光.大豆蛋白与大豆肽对淀粉糊性能的影响[J].安徽农业科学,2010,38(17):9161-9162.
SUN Y,SUN C Y,CHEN G.Effect of soy protein and soy peptide on the performance of starch paste[J].Anhui Agricultural Science,2010,38 (17):9161-9162.
[31]JANE J,CHEN Y Y,LEE L F,et al.Effects of amylopectin branch chain length and amylose content on the gelatinization and pasting properties of starch[J].Cereal Chemistry,1999,76(5):629-637.
[32]SUN Q,ZHU X,SI F,et al.Effect of acid hydrolysis combined with heat moisture treatment on structure and physicochemical properties of corn starch[J].Journal of Food Science and Technology-Mysore,2015,52(1):375-382.
[33]KLEIN B,PINTO V Z,VANIER N L,et al.Effect of single and dual heat-moisture treatments on properties of rice,cassava,and pinhao starches[J].Carbohydrate Polymers,2013,98(2):1578-1584.
[34]VERMEYLEN R,GODERIS B,DELCOUR J A.An X-ray study of hydrothermally treated potato starch[J].Carbohydrate Polymers,2006,64(2):364-375.
[35]HORMDOK R,NOOMBORM A.Hydrothermal treatments of rice starch for improvement of rice noodle quality[J].Lwt-Food Science And Technology,2007,40(10):1723-1731.
[36]JIRANUNTAKUL W,PUTTANLEK C,RUNGSARDTHONG V,et al.Microstructural and physicochemical properties of heat-moisture treated waxy and normal starches[J].Journal of Food Engineering,2011,104(2):246-258.
[37]PUNCHA-ARNON S,UTTAPAP D.Rice starch vs.rice flour:Differences in their properties when modified by heat-moisture treatment[J].Carbohydrate Polymers,2013,91(1):85-91.
[38]WATCHARATEWINKUL Y,PUTTANLEK C,RUNGSARDTHONG V,et al.Pasting properties of a heat-moisture treated canna starch in relation to its structural characteristics[J].Carbohydrate Polymers,2009,75(3):505-511.
[39]BET C D,DEOLIVEIRAC S,TIAGO A,et al.Organic amaranth starch:A study of its technological properties after heat-moisture treatment[J].Food Chemistry,2018,264:435-442.
[40]WONGSAGONSUP R,VARAVINIT S,BEMILLER J N.Increasing slowly digestible starch content of normal and waxy maize starches and properties of starch products [J].Cereal Chemistry,2008,85(6):738-745.
[41]LOPEZ-BARO N,GU Y,VASANTHAN T,et al.Plant proteins mitigate in vitro wheat starch digestibility[J].Food Hydrocolloids,2017,69:19-27.
[42]TAN X,LI X,CHEN L,et al.Effect of heatmoisture treatment on multi -scale structures and physicochemical properties of breadfruit starch [J].Carbohydrate Polymers,2017,161:286-294.
[43]KIM J Y,HUBER K C.Heat-moisture treatment under mildly acidic conditions alters potato starch physicochemical properties and digestibility [J].Carbohydrate Polymers,2013,98(2):1245-1255.
[44]LU Z H,DONNER E,YADA R Y,et al.Physicochemical properties and in vitro starch digestibility of potato starch/protein blends[J].Carbohydrate Polymers,2016,154:214-222.
[45]DUPUIS J H,LIU Q,YADA R Y.Methodologies for increasing the resistant starch content of food starches:A review[J].Comprehensive Reviews in Food Science &Food Safety,2014,13(6):1219-1234.