植物油容易发生氧化,导致油脂变质。植物油品质劣变的主要原因是自动氧化,其被公认为是一种由自由基引发的链式反应。根据自由基理论,整个氧化过程中伴随着自由基的传递、引发以及含量的变化[1-4]。在自由基链式反应进程中,先生成烷基自由基 (R·),R·与O2 反应生成过氧化自由基(ROO·),ROO·传递链反应,形成大量氢过氧化物(ROOH),ROOH 容易发生氧化分解反应形成次级氧化产物(醇、酸、酮和醛等),从而导致油脂酸败变质[5-8]。
电子顺磁共振 (Electron paramagnetic resonance,EPR)是一种可直接测定自由基种类和含量的方法[9-11]。油脂氧化产生的自由基特别活泼,周期性短暂,需通过自旋加合物(自旋捕获剂与自由基反应所生成)来测定,常用的捕获剂有N-叔丁基-α-苯基硝酮(PBN)和5,5-二甲基-1-吡咯啉-N-氧化物(DMPO)[11-13]。目前,EPR 在食品领域主要用于食用油的自由基监测[11-15],以及食品抗氧化能力的评价等[16-18]。Raitio 等[11]通过EPR 方法研究半固态棕榈油早期氧化的特点。结果表明,半固态棕榈油在50 ℃下贮藏7 d 的过程中,产生的自由基与次级氧化产物的形成呈正相关。李培等[13]研究了花生油加速氧化过程的自由基变化,结果表明,加速氧化过程中自由基含量由大到小为R·>RO·>ROO·。Chen 等[14]利用EPR 研究了温度对棕榈酸热氧化的影响。采用烷基和烷氧基自旋加合物模拟试验光谱,发现棕榈酸从175 ℃到180 ℃的氧化速率迅速增加,表明棕榈酸在一定温度下的热氧化是由自由基生成所致。Ottaviani 等[15]采用EPR 方法研究黑孜然籽油、芫荽籽油和小葵籽油中不同组分对自由基的清除能力,评估3 种油脂中不同成分的抗氧化能力。核磁共振氢谱(1H NMR) 能够提供油脂脂肪酸中不同质子氢的化学位移,它利用不同的质子氢与相应的脂肪酸建立起对应关系,可快速、准确测定油脂样品中各质子氢的含量[19-20]。这项技术提供了关于油在热变质过程中产生的许多变化的信息,不仅涉及酰基的降解,而且涉及各种氧化产物的形成和降解。
本文以4 种常见的植物油为研究对象,采用EPR 结合1H NMR 技术研究其在室温氧化过程中产生的自由基种类、总量以及各类自由基的变化情况。同时解析不同植物油中不饱和脂肪酸的1H NMR 在氧化前、后的变化,以期为植物油的自动氧化自由基变化提供参考。
1 材料与方法
1.1 材料与试剂
4 种植物油分别购于国内4 家油脂生产企业,均声称未添加任何抗氧化剂,具体信息如表1所示,主要脂肪酸组成如表2所示。不同油脂的主要脂肪酸组成不同,其中亚麻籽油中主要脂肪酸是亚麻酸;花生油中主要是油酸和亚油酸;葵花籽油中主要是亚油酸;油茶籽油中主要是油酸。
表1 样品信息
Table 1 Information of oil samples

?
表2 4 种植物油主要脂肪酸组成(%)
Table 2 Composition of fatty acid in 4 vegetable oils (%)
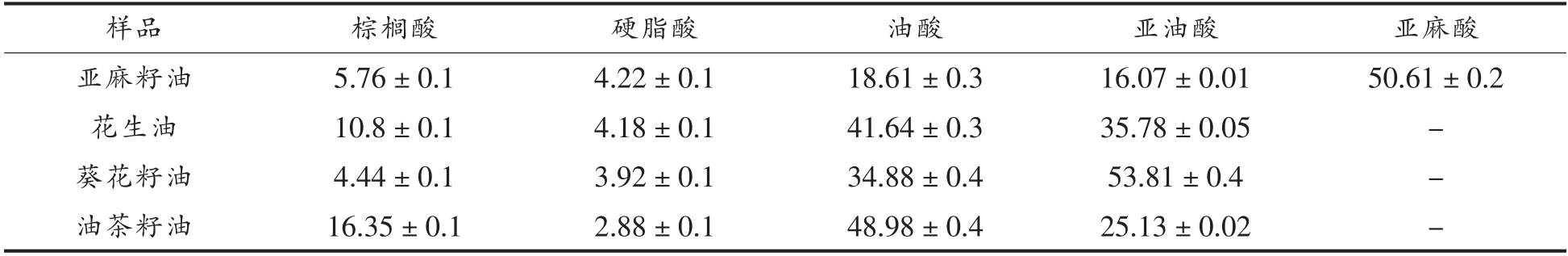
注:“-”为未检出。
?
异辛烷、冰乙酸、碘化钾、硫代硫酸钠、氢氧化钾、四甲基硅烷(TMS)、氘代氯仿(CDCl3)、DMPO(纯度97%)等均为分析纯级,天津科密欧化学试剂有限公司。
1.2 仪器与设备
EMX plus-10/12 电子自旋共振波谱仪,德国布鲁克(Bruker)公司。主要技术参数:磁场强度为磁极距72 mm 时,最大1.45 T;扫场分辨率为128 000 点;微波频率为X-波段,9.2~9.8 GHz;灵敏度为1.5×109 自旋数/G;液氮变温为100~700 K;液氦变温为1.8~300 K。
Bruker Avance Ⅲ型核磁共振波谱仪,瑞士布鲁克(Bruker)公司。规格:500 MHz;技术参数:1H分辨率为0.45 Hz。
1.3 试验方法
1.3.1 EPR 分析 准确称量一定的DMPO,采用甲苯溶解,使其终浓度为2.0 mol/L,置于-20 ℃中避光密封保存,待用。
分别取3 mL 的亚麻籽油、葵花籽油、花生油和茶籽油于50 mL 小烧杯中,使其暴露在空气中,在室温下自然氧化,每隔1 d 取200 μL 样品置于核磁管中,加入20 μL 配好的DMPO 溶液,置于EPR 仪器谐振腔内,采用如下检测参数模式进行检测。
EPR 仪器的检测参数:中心磁场为3 350.00 G,扫场宽度为100.00 G,扫场时间为20.0 s,微波功率为3.99 mW,调制幅度为1.000 G,转换时间为10.00 ms,加热温度为373.15 K。然后打开高纯氮气流并开始加热,待谐振腔温度稳定后,将核磁管置于谐振腔中,同时开始计时,每隔24 h 测定1次。
1.3.2 NMR 分析 将亚麻籽油、葵花籽油、花生油和油茶籽油暴露在空气中 (模拟家用存储条件),在室温下自然氧化,取氧化前和氧化10 d 后的样品进行1H NMR 谱测定。分别取20~50 μL 的亚麻籽油、葵花籽油、花生油和茶籽油置于直径5 mm 核磁管,以500 μL 氘代氯仿溶解,溶剂内含0.03%四甲基硅烷作为内标,混合均匀进行检测[21-22]。
1H NMR 测定条件参考杨登辉等[19]方法。具体参数为:每次测定都进行调谐和匀场,温度为297.3 K,工作频率为400.13 MHz,采集时间为4.0895 s,光谱宽度为8 012.82 Hz,扫描16 次,空扫2 次。
1.3.3 过氧化值的测定 过氧化值的测定参考GB 5009.227-2016 《食品安全国家标准食品中过氧化值的测定》[23]。
1.4 数据处理与分析
EPR 谱分析:自由基的自旋朗德因子(g 值)为自由基谱图中心点,通过Xenon 软件点击谱图中心点可以直接读出g 值,脂类自由基的g 值都在2.0 附近。然后对样品的自由基谱图进行基线校正,校正后进行二次积分,使用Xenon 软件自带的自旋定量功能,可得到该样品的自旋总数和自由基浓度。通过Xenon 软件中的自旋拟合(Spin fit)功能对样品的试验谱图进行计算机拟合,得到与试验结果相匹配的拟合结果,并以此为根据判定样品中自由基的种类并进行相对定量。
1H NMR 谱图使用Topspin 软件进行处理,以四甲基硅烷内标物的峰作为化学位移零点,谱图处理时以TMS 定位,谱图经校正零点后标峰,并读出峰面积。
所有试验均重复3 次,结果用“平均值±标准差”表示。采用SPSS 20.0 软件进行数据分析,Origin 9.0 软件绘图。
2 结果与分析
2.1 4 种植物油室温氧化过程中过氧化值变化分析
过氧化值表示油脂和脂肪酸等被氧化程度的一种指标,过氧化值越高其酸败就越严重。在自由基链式反应中,一般来说,多不饱和脂肪酸比单不饱和脂肪酸的反应性更强。根据经典的润滑脂理论,亚油酸的自氧化率约为油酸的10 倍,在0 ℃或更低的温度下,亚油酸酯可被空气氧化。4 种植物油室温氧化过程中过氧化值变化结果见图1。
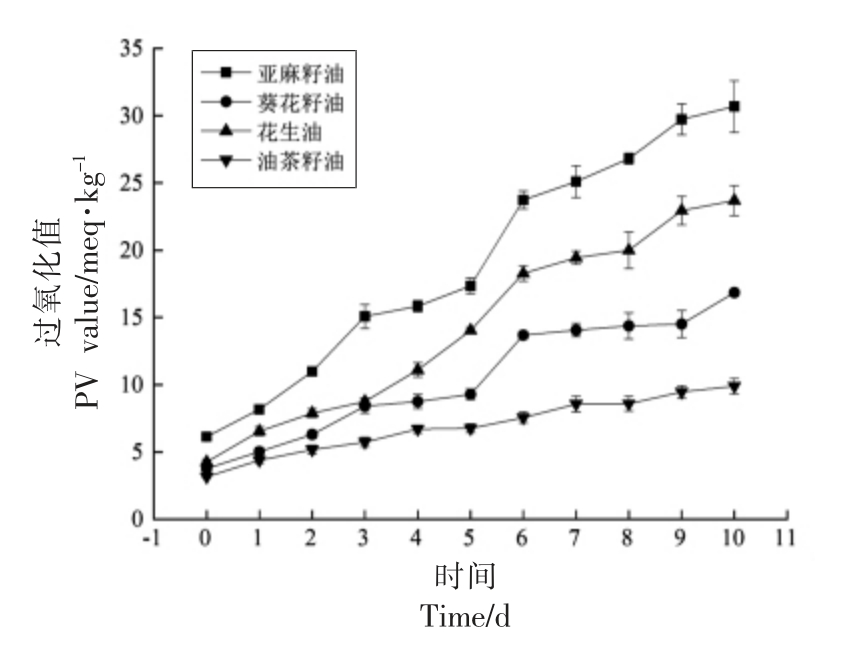
图1 4 种食用油室温氧化中的过氧化值变化情况
Fig.1 Peroxide values changes of 4 vegetable oils at room temperature
由图1可知,这4 种植物油按氧化速率排序为:亚麻籽油>花生油>葵花籽油>油茶籽油。从自由基生成的角度来看,虽然亚油酸产生自由基的速度比油酸快,但两者之间的差异小于10 倍。在4 种油中,葵花籽油和茶籽油的过氧化值变化趋势相对较小。在油脂的自动氧化过程中,R·主要存在于自动氧化的链传递阶段,在这一阶段不饱和脂肪酸中双键旁亚甲基上的氢被夺取,形成大量的R·,由此,脂肪酸中的不饱和碳碳双键越多,氧化时生成R·就越多,油脂就越容易氧化。
2.2 4 种植物油室温氧化过程中自由基分析
2.2.1 植物油室温氧化过程中自由基种类分析4 种植物油室温氧化的谱图如图2所示,从上到下依次是试验谱图(Exp)、拟合谱图(Simu)及4 种拟合出的自由基谱图。
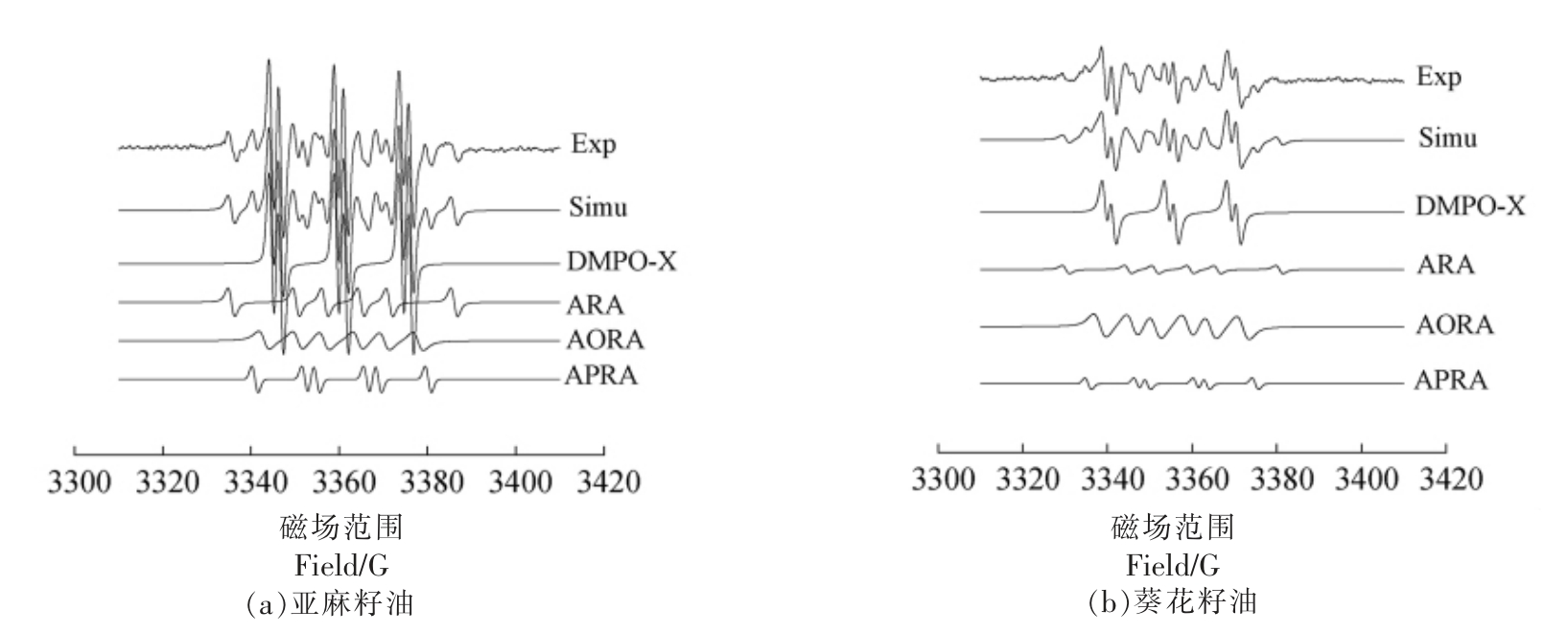
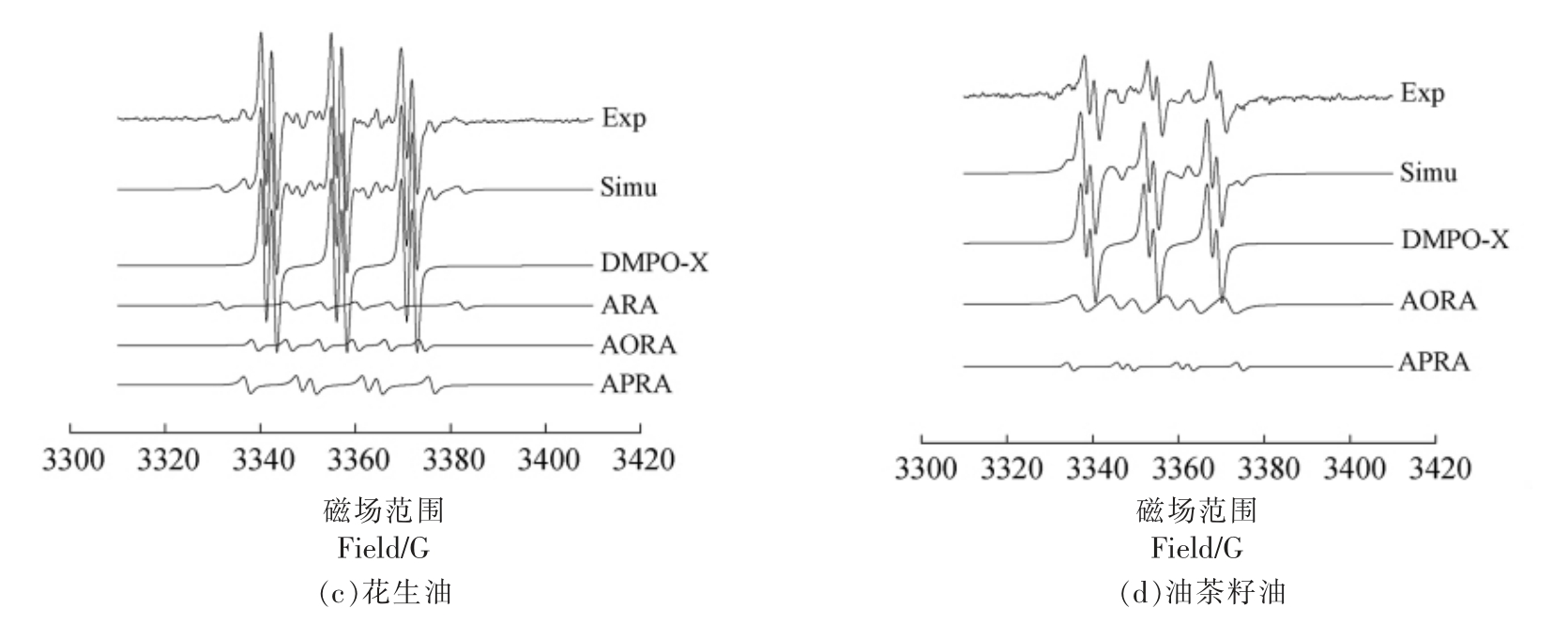
图2 4 种植物油室温氧化的EPR 图谱
Fig.2 EPR Spectra of four kinds of vegetable oils oxidized at room temperature
由图2可以看出,4 种植物油EPR 试验谱图与拟合谱图二者基本一致,拟合效果良好。进一步拟合分析得出4 种自由基加合物分别是烷基自由基加合物(Alkyl radical adducts,ARA)、烷氧自由基加合物(Alkoxyl radical adducts,AORA)、烷过氧自由基加合物 (Alkyl peroxyl radical adducts,APRA)以及DMPO-X(一般被认为是DMPO 发生氧化后产生的自由基)。
如表3所示,根据4 种植物油的超精细耦合分裂常数(αN,αH),确定这些加合物分别是DMPO-X、R·、RO·、ROO·。
由图2和表3可知,4 种植物油在室温氧化过程中除油茶籽油外,其它植物油均产生了4 种自由基。而油茶籽油中只检测到3 种自由基,分别是DMPO-X、RO·、ROO·。油茶籽油中可能含有极少量的R·,由于其含量过低与基线无异,难以拟合。Novakov 等[24]研究了体内测定大鼠肝和肺提取物中的烷基自由基(R·),而未观察到可检测的烷基自由基,这是由它们的低稳态浓度所致[25]。
表3 DMPO 捕获的自由基EPR 参数
Table 3 EPR parameters of radical adducts to DMPO
?
2.2.2 4 种植物油室温氧化过程中自由基含量变化分析 4 种植物油的自旋总数随时间的变化见图3。
由图3a 可以看出,容易氧化的亚麻籽油在第1 天时信号强度是4 种油中最低的,到第5 天时,信号强度降到最低。可能是由于亚麻籽油中最主要的脂肪酸是亚麻酸,相对活跃,引发的自由基在短时间内相互结合转化为氧化产物,导致DMPO捕获到的自由基的量偏少[12]。花生油在第5 天时其信号强度处于最低,这和亚麻籽油比较相似。而葵花籽油和油茶籽油的波动幅度总体处于一个较低的水平。4 种植物油初始信号强度的变化趋势不同,这是由于植物油中的脂肪酸种类和含量不同所致。4 种植物油中自由基含量在贮藏过程中是不断变化和波动的,说明油脂氧化在不断进行[26]。
由图3b 可以看出,亚麻籽油中波动最明显的自由基是DMPO-X,含量最多的也是DMPO-X。在0~6 d 时其自旋总量不同,样品的自旋总量基本保持在较低水平。在6~7 d 时,所有自由基的自旋总量突然急剧增加。这可能是由于DMPO 容易受到O2 影响,不断发生反应表现出波动的状态。到第10 天时均略有下降,这可能是由于新形成的自由基可以与稳定的自旋加合物发生反应,从而导致信号强度减弱[27]。而烷氧基在整个氧化过程中都是在一个比较低的范围内波动。由图3c 可以看出,葵花籽油中含量最多的自由基是RO·,而且在氧化第1 天后含量急剧增加,在第2 天时又下降,处于一个不稳定的状态,这可能是由于氧化反应进一步加深,氢过氧化物不断分解所导致[9,28]。其它3 种自由基一直维持在一个较低的水平上。由图3d 可以看出,花生油中自由基按相对含量从高到低排序为DMPO-X>RO·>R·>ROO·。而且在氧化过程中RO·的数量在大幅度波动,在1~2 d急剧上升,在3~4 d 时又呈下降趋势。RO·在第4天之后一直呈现缓慢上升的趋势,表明花生油正处于氢过氧化物二次引发阶段[28]。由图3e 可以看出,油茶籽油中的自由基主要是由R·组成,DMPO-X 的量次之,ROO·的量最少,而且在氧化前期R·的含量非常少以至于无法拟合,这与之前的EPR 图谱相吻合。RO·一直处于动态变化中,可能原因是链式反应中氢过氧化物的分解。仅在氧化第9 天开始出现R·且含量与ROO·相差无几,基本处于同一水平。

图3 4 种植物油自旋总数随时间的变化
Fig.3 Changes of the total amounts of spins of four vegetable oils with time
2.3 4 种植物油室温氧化前、后的1H NMR 分析
核磁共振氢谱1H NMR 是阐明脂质初级和二级氧化产物分子结构最常用的方法,它能提供化合物分子中氢原子的信息,可以分析油脂组成成分,探讨油脂氧化过程中脂肪酸的变化等[29],这对于全面认识氧化过程和氧化机理意义重大。通过在氧化过程中监测脂质分子反应位点的质子峰,1H NMR 可用于评估脂质氧化状态,解析主要1H NMR 谱的化学位移信号的归属信息,见表4[30]。
表4 食用油核磁共振氢谱中各峰的归属
Table 4 Signals of the 1H NMR spectra edible oil

峰符号 化学位移/ppm 氢核 质子的功能基团A?0.75~0.95 -CH3 除亚麻酸甘油酯基以外的所有端甲基B 0.95~1.03 -CH3 亚麻酸甘油酯中的端甲基C 1.10~1.52 -(CH2)n- 酯链中其余的亚甲基D 1.52~1.70 -OCO-CH2-CH2- 羰基β 位质子基E 1.90~2.24 -CH2-CH=CH- 烯丙基质子(所有不饱和脂肪酸)F 2.24~2.50 -OCO-CH2- 羰基α 位质子基G 2.60~2.96 CH=HC-CH2-CH=CH 双烯丙基质子氢(多不饱和脂肪酸)H 4.00~4.50 -CH2OCOR 甘油骨架的sn-1 位置I 5.23~5.28 >CHOCOR 甘油骨架的sn-2 位置J 5.28~5.60 -CH=CH- 所有不饱和脂肪酸(烯烃氢)
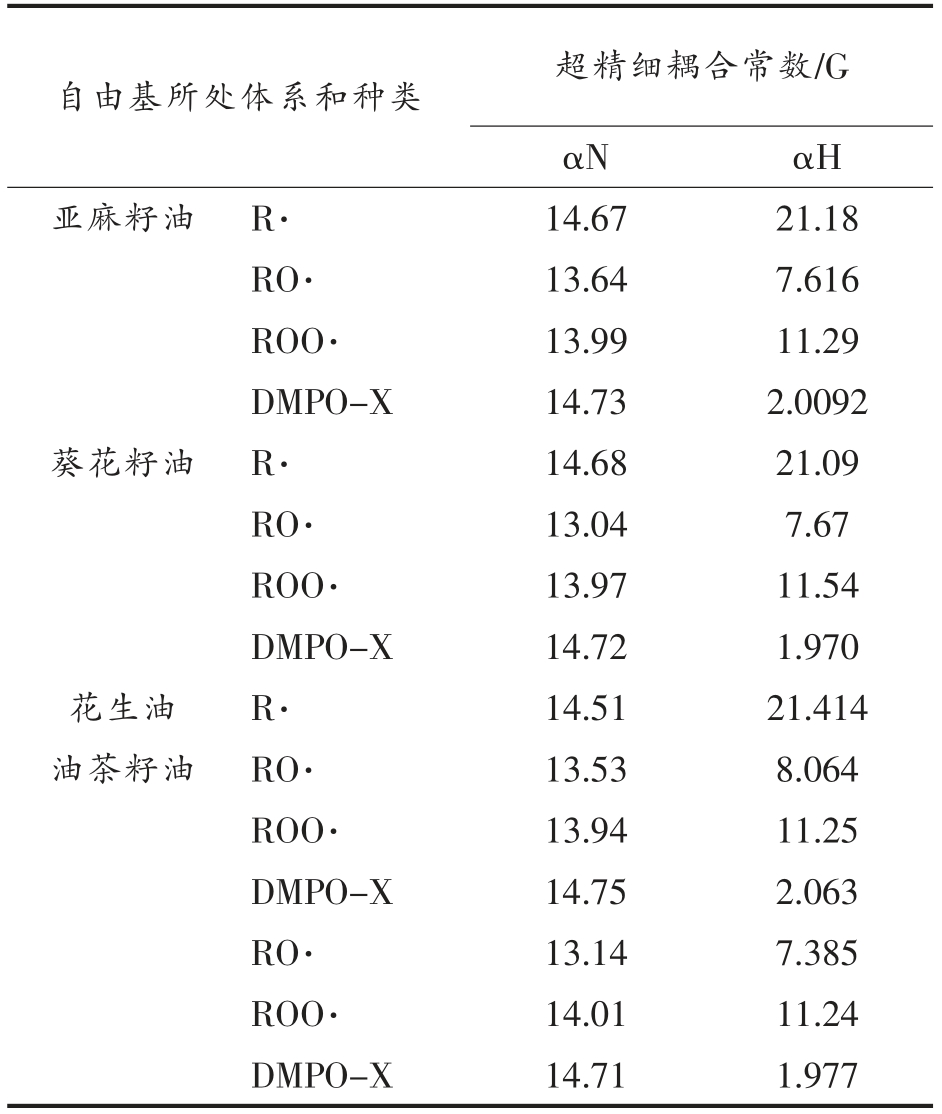
2.3.1 亚麻籽油氧化前、后1H NMR 谱 亚麻籽油氧化前、后1H NMR 谱见图4。
亚麻籽油和花生油的NMR 图谱变化趋势基本一致,以亚麻籽油的NMR 图谱为例,如图4所示。光谱在信号B 处是亚麻酸末端-CH3 上的H,信号A、C、E 和A、G 分别与油酸、亚油酸含量有关[31]。结果表明,样品的烯丙基质子(E)、二烯丙基质子(G)和烯质子(J)的信号强度都有衰减。据报道,烯烃质子与样品中不饱和酯的含量有关。表明在室温氧化降解过程中不饱和酯含量减少。同时,烯烃脂肪酸链与氧分子反应良好,证实了样品的降解[32]。同时花生油的不饱和脂肪酸(G)的信号积分区域明显低于亚麻籽油的,由此可知,花生油相比于亚麻籽油具有较高的稳定性。在室温氧化10 d后,两种油中并未检测到主要的二级氧化产物醛(δ=9.2~9.9)的特征信号峰,说明氧化正处于初级阶段。
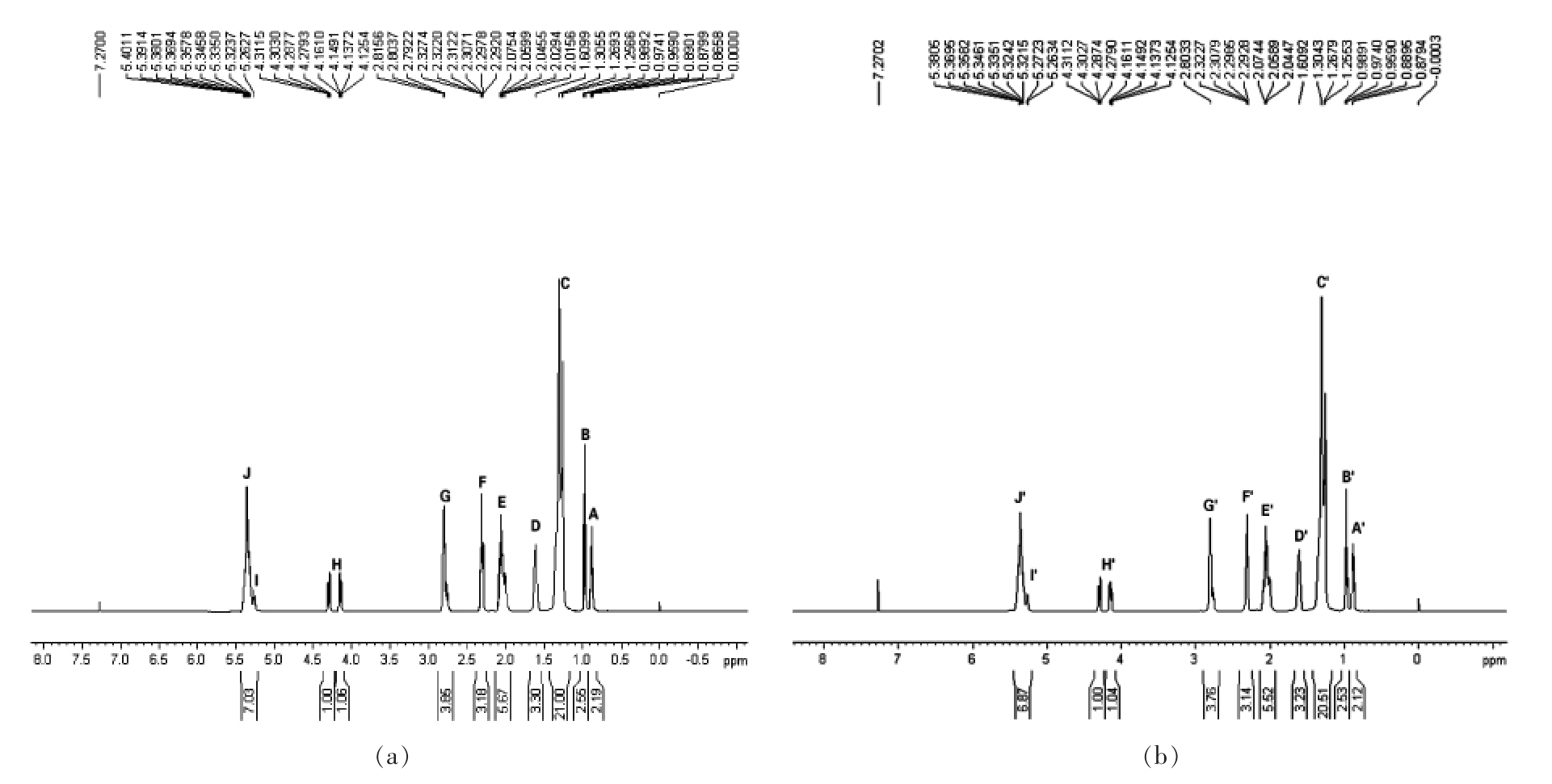
图4 亚麻籽油氧化前(a)和室温氧化10 d 后(b)的1H NMR 谱
Fig. 4 1H NMR spectra of linseed oil before oxidation (a) and after 10 d oxidation at room temperature (b)
2.3.2 葵花籽油氧化前、后1H NMR 谱 葵花籽油氧化前、后1H NMR 谱见图5。
葵花籽油和油茶籽油的NMR 图谱变化趋势基本一致,以葵花籽油的NMR 图谱为例,如图5所示。与亚麻籽油和花生油相比,葵花籽油整体信号强度均有降低。可以看出,随着氧化时间延长,亚油基酰基(A 和G)对应的信号强度减弱。因此,在图5可观察到以δ=1.90~2.24 为中心的双烯丙基质子信号强度的下降,这主要是由于亚油基酰基所致[33]。根据María 等[34]的研究表明,亚油基酰基的降解速度略高于油酸的降解速率,PV 值的增长趋势也符合这一规律。同时在油茶籽油中,信号强度在δ=1.5 附近增加,这可能是由于与叔碳结合的氢原子浓度增加所致;后者可在交联反应中产生,在不同的酰基链之间形成碳碳键,导致聚合物的形成[34]。样品的烯丙基质子、二烯丙基质子和烯质子的信号强度变化都很小,说明氧化降解的速率和产量都很低。同样的,在这两种油中也没有检测到氢过氧质子和二级氧化产物的特征信号,氧化处于初级阶段,比较缓慢。
图5 葵花籽油氧化前(a)和室温氧化10 d 后(b)的1H NMR 谱
Fig. 5 1H NMR spectra of sunflower seed oil before oxidation (a) and after 10 d oxidation at room temperature (b)
3 结论
亚麻籽油是4 种植物油中最易氧化的,其在室温氧化时主要形成4 种自由基,按含量排序为DMPO-X>RO·>R·>ROO·。花生油的氧化速度仅次于亚麻籽油,且其氧化自由基含量排序与亚麻籽油相似。葵花籽油的氧化速度略慢于花生油,其自由基含量排序为RO·>DMPO-X>R·>ROO·,且在氧化前期主要是烷氧自由基的含量在大幅度波动,其它3 种自由基一直维持在一个较低的水平。油茶籽油稳定性最高,其氧化自由基组成类似葵花籽油,主要是RO·,DMPO-X 次之,ROO·的量最少,且在氧化前期R·的量少以至于无法拟合。总得来说,通过1H NMR 对4 种植物油的室温氧化自由基进行分析,得出氧化前、后氢质子化学位移信号并没有发生变化,而氧化前、后各特征峰的峰面积所占比例均有不同程度的变化。这与自由基链式反应的引发、传递阶段变化情况一致。并且通过EMR 和1H NMR 分析,发现自由基种类和含量与脂肪酸组成相关,且自由基增长速度差别较大,与油脂的脂肪酸组成特征相吻合。在后续研究中,还需要结合自由基链式反应的不同阶段,探究自由基变化与氧化产物的关系。
[1]季敏,刘忠义,张剑,等.食用油使用过程中存贮条件对其氧化稳定性的影响研究[J].中国油脂,2018,43(5):92-94.
JI M,LIU Z Y,ZHANG J,et al.Effect of storage conditions of edible oils on its oxidative stability during using[J].China Oils and Fats,2018,43(5):92-94.
[2]曹文明,薛斌,袁超,等.油脂氧化酸败研究进展[J].粮食与油脂,2013,26(3):1-5.
CAO W M,XUE B,YUAN C,et al.Research progress on the oxidative rancidity of oils and fats[J].Journal of Cereals &Oils,2013,26(3):1-5.
[3]FEREIDOON S H,ZHONG Y.Lipid oxidation and improving the oxidative stability [J].Chemical Society Reviews,2010,39(11):4067-4079.
[4]邓鹏,王守经,王文亮.食用油氧化机理及检测方法研究[J].中国食物与营养,2008(8):17-19.
DENG P,WANF S J,WANG W L.Study on oxidation mechanism and detection method of edible oil[J].Food and Nutrition in China,2008(8):17-19.
[5]GOODMAN B A,PASCUAL E C,YERETZIAN C.Real time monitoring of free radical processes during the roasting of coffee beans using electron paramagnetic resonance spectroscopy [J].Food Chemistry,2011,125(1):248-254.
[6]THOMSEN M K,JACOBSEN C,SKIBSTED L H.Mechanism of initiation of oxidation in mayonnaise enriched with fish oil as studied by electron spin resonance spectroscopy[J].European Food Research&Technology,2000,211(6):381-386.
[7]李春焕,王晓琴,曾秋梅.植物油脂氧化过程及机理、检测技术以及影响因素研究进展[J].食品与发酵工业,2016,42(9):277-284.
LI C H,WANG X Q,ZENG Q M.Research progress of the process and mechanism,detemination and influential factors of vegetable lipid oxidation[J].Food and Fermentation Industries,2016,42(9):277-284.
[8]赵保路.ESR 自旋捕集技术的发展和在生物学研究中的应用[J].波谱学杂志,2011,28(1):18-41.
ZHAO B L.Development of ESR spin trapping technology and its application in biological research[J].Chinese Journal of Magnetic Resonance,2011,28(1):18-41.
[9]姜寿浩.电子自旋共振技术在评价油脂氧化稳定性中的应用研究[D].无锡:江南大学,2016.
JIANG S H.The application of electron spin resonance spectroscopy in oxidative stability evaluation of edible oil[D].Wuxi:Jiangnan University,2016.
[10]KOZŁOWSKA M,ZAWADA K.Evaluation of oxidative stability of vegetable oils enriched with herb extracts by EPR spectroscopy[J].Chemical Papers,2015,69(7):950-957.
[11]RAITIO R,ORLIEN V,SKIBSTED L H.Electron spin resonance spectroscopy for evaluation of early oxidative events in semisolid palm oil[J].Europen Journal Lipid Science and Technology,2011,113(2):208-213.
[12]XIE Y F,JIANG S H,LI M,et al.Evaluation on the formation of lipid free radicals in the oxidation process of peanut oil [J].LWT - Food Science and Technology,2019,104:24-29.
[13]李培,刘海楠,姜寿浩,等.电子自旋共振波谱法评价花生油氧化稳定性的可行性研究[J].食品工业科技,2015,36(24):120-123.
LI P,LIU H N,JIANG S H,et al.The application of electron spin resonance spectroscopy in oxidative stability evaluation of edible oil[J].Science and Technology of Food Industry,2015,36(24):120-123.
[14]CHEN H J,WANG Y,CAO P R,et al.Effect of temperature on thermal oxidation of palmitic acid studied by combination of EPR spin trapping technique and SPME-GC-MS/MS[J].Food Chemistry,2017,234(1):439-444.
[15]OTTAVIANI M F,SPALLACI M,CANGIOTTI M,et al.Electron paramagnetic resonance investigations of free radicals in extra virgin olive oils[J].Journal of Agricultural &Food Chemistry,2001,49(8):3691-3696.
[16]石硕,于鑫淼,张馨心,等.电子自旋共振技术及其在食品脂质氧化检测中的应用进展[J].食品工业科技,2019,40(5):343-351.
SHI S,YU X M,ZHANG Q X,et al.Electron spin resonance technology and its applications progress in the detection of food lipid oxidation[J].Science and Technology of Food Industry,2019,40(5):343-351.
[17]MOHAMED F R,LOTHAR W K,JORG T M.Radical scavenging activity of black cumin (Nigella sativa),coriander (Coriandrum sativum),and niger(Guizotia abyssinica cass) crude seed oils and oil fractions[J].Journal of Agricultural and Food Chemistry,2003,51(24):6961-6969.
[18]CHEN Q M,XIE Y F,XI J Z,et al.Characterization of lipid oxidation process of beef during repeated freeze-thaw by electron spin resonance technology and Raman spectroscopy[J].Food Chemistry,2018,243(15):58-64.
[19]杨登辉,江秀明.核磁共振氢谱法在食用油研究中的应用[J].云南化工,2019(6):119-121.
YANG D H,JIANG X M.Application of nuclear magnetic resonance spectroscopy in the study of edible oil[J].Yunnan Chemical Technology,2019(6):119-121.
[20]张琰.基于核磁共振技术的食用植物油成分检测与品质鉴别研究[D].厦门:厦门大学,2017.
ZHANG Y.NMR spectroscopy for component analysis and quality identification of edible oils[D].Xiamen:Xiamen University,2017.
[21]王云鹏,徐华,杨德孟,等.核磁共振氢谱定量法分析樟树籽油的甲酯化率[J].中国粮油学报,2020,35(2):159-164.
WANG Y P,XU H,YANG D M,et al.Analysis of methyl esterification rate of camphor tree seed oil by quantitative proton nuclear magnetic resonance spectroscopy[J].Chinese Journal of Cereals and Oils,2020,35(2):159-164.
[22]DROUZA C,DIERONITOU A,HADJIADAMOU I,et al.Investigation of the phenols activity in early stage oxidation of edible oils by electron paramagnetic resonance and 19F NMR spectroscopies using novel lipid vanadium complexes as radical initiators[J].Journal of Agricultural and Food Chemistry,2017,65(24):4942-4951.
[23]国家卫生和计划生育委员会.食品安全国家标准食品中过氧化值的测定:GB 5009.227-2016[S].北京:中国标准出版社,2016:1-4.
National Health and Family Planning Commission.Determination of peroxide value in national standard food for food safety:GB 5009.227-2016[S].Beijing:Standards Press of China,2016:1-4.
[24]NOVAKOV C P,FEIERMAN D,CEDERBAUM A I,et al.An ESR and HPLC-EC assay for the detection of alkyl radicals[J].Chemical Research in Toxicology,2001,14(9):1239-1246.
[25]AMFT J,STEFFEN -HEINS A,SCHWARZ K.Analysis of radical formation by EPR in complex starch-protein-lipid model systems and corn extrudates[J].Food Chemistry,2020,331:127314.
[26]FREDERIKSEN A M,FESTERSEN R M,ANDERSEN M L.Oxidative reactions during early stages of beer brewing studied by electron spin resonance and spin trapping[J].Journal of Agricultural &Food Chemistry,2008,56(18):8514-8520.
[27]STEVEN Y Q,HONG P W,FREYA Q S,et al.EPR detection of lipid-derived free radicals from PUFA,LDL,and cell oxidations[J].Free Radical Biology and Medicine,2000,29(6):568-579.
[28]ROMAN O,COURTOIS F,MARIE-NOËLLE M,et al.Kinetic study of hydroperoxide degradation in edible oils using electron spin resonance spectroscopy[J].Journal of the American Oil Chemists Society,2012,89(8):1409-1417.
[29]RUIZ-ARACAMA A,GOICOECHEA E,GUILLÉN M D.Direct study of minor extra-virgin olive oil components without any sample modification.1H NMR multisupression experiment:A powerful tool[J].Food Chemistry,2017,228:301-314.
[30]杨扬,殷乐,尹芳华,等.几种食用油的核磁共振光谱特征与地沟油的快速检测[J].中国油脂,2015,40(7):45-50.
YANG Y,YIN L,YIN F H,et al.NMR spectra characteristics of several kinds of edible oils and quick discerning of swill-cooked dirty oil[J].China Oils and Fats,2015,40(7):45-50.
[31]MANTOVANI A,THAÍSCHENDYNSKI L,GALVAN D,et al.Evaluation of the oxidation degradation process of biodiesel via 1H NMR spectroscopy[J].Journal of the Brazilian Chemical Society,2020,31(8):1661-1667.
[32]CASTEJÓN D,HERRERA A,ÁNGELES H,et al.Oil quality control of culinary oils subjected to deep -fat frying based on NMR and EPR spectroscopy[J].Food Analytical Methods,2017,10(7):2467-2480.
[33]MARÍA D G,AINHOA R.Oxidation process of oils with high content of linoleic acyl groups and formation of toxic hydroperoxy- and hydroxyalkenals.A study by 1H nuclear magnetic resonance[J].Journal of the Science of Food &Agriculture,2010,85(14):2413-2420.
[34]MARÍA D G,AINHOA R.Study by proton nuclear magnetic resonance of the thermal oxidation of oils rich in oleic acyl groups[J].Journal of the American Oil Chemists' Society,2005,82(5):349-355.