辣椒,又称海椒、辣角,属于茄科辣椒属植物,被认为是矿物质、类胡萝卜素、维生素A、维生素C 和酚类化合物的良好来源[1],具有降糖、降脂[2]、镇痛止痒[3]、消炎抑菌[4]、抗氧化[5]、抗癌[6]等功效。发酵辣椒是一种传统的发酵调味品,在我国贵州、云南、四川、陕西等地食用广泛,其味酸辣可口,香气浓郁,在发酵过程中,以乳酸菌为主的微生物进行厌氧发酵,不仅能保留辣椒原有的营养物质,还能明显增加酒石酸、芳樟醇及乙酸乙酯等成分的含量[7-8],使氨基酸比例趋于平衡,产品风味更加突出[9]。
传统发酵方式虽加工工艺简单,但发酵周期长,结果不可控[10]。采用纯种植物乳杆菌发酵,不仅能大大缩短发酵周期,还能提高安全品质[11]。韩江雪等[12]采用不同乳酸菌强化接种发酵辣椒,结果发现使用发酵乳杆菌、乳酸片球菌以及植物乳杆菌强化发酵得到的产品较自然发酵辣椒产品风味品质更加突出。贾洪锋等[13]对比了小米椒与其它辣椒在发酵时的风味物质变化,发现小米椒发酵后风味物质的种类更加丰富,酯和醚类等物质所占比例较其它产品有明显的增大。
目前,对于发酵辣椒的研究多集中在发酵条件的优化、发酵菌种的筛选及风味物质的变化上,而对不同地区辣椒在发酵过程中的品质差异鲜有研究报道[14-15]。本文采用纯菌种接种发酵技术,对陕西、四川、云南3 个地区种植的小米椒进行发酵,测定其发酵过程中亚硝酸盐含量、pH 值、辣素含量、挥发性成分和脆度的变化规律,并对发酵产品进行感官评定。通过比较不同地区辣椒发酵产品的品质,为小米椒发酵产品的选择和工业化生产提供理论依据。
1 材料与方法
1.1 材料与试剂
植物乳杆菌(Lactobacillus plantarum)由西北农林科技大学食品科学与工程学院微生物实验室提供,辣椒样品选取陕西、四川、云南当地种植的小米椒。
吐温-80,成都市克隆化学品有限公司;牛肉膏、蛋白胨、酵母粉,北京奥博星生物技术有限公司;葡萄糖、硫酸镁、无水乙酸钠、亚铁氰化钾、盐酸、磷酸氢二钾、硫酸锌均为分析纯级,天津博迪化工股份有限公司。
1.2 仪器与设备
SPME 手动进样手柄、50/30 μm DVB/PDMS萃取头,美国Supelco 公司;GC-MS-QP2010 气相色谱质谱联用仪、UV-1750 紫外分光光度计,岛津仪器有限公司;BXM-50VE 立式压力蒸汽灭菌锅,上海博讯医疗生物仪器股份有限公司;TA-XT 质构仪,英国Stable Micro System 公司。
1.3 试验方法
1.3.1 植物乳杆菌的活化与扩培 培养基制备:参照樊康等[16]的方法制备MRS 固体培养基和MRS 液体培养基;植物乳杆菌的活化与扩培:将灭菌完成的MRS 固体培养基进行紫外消毒,倒平板,用-80 ℃下保存的纯种植物乳杆菌进行平板划线接种,并在37 ℃下恒温培养24 h,待活化完成后,接种到MRS 液体培养基进行扩培,最后放入冷冻高速离心机中离心(转速5 000 r/min,温度4℃),倒去上清液,再加入无菌生理盐水,密封放入4 ℃冰箱备用。
1.3.2 辣椒发酵 工艺流程:新鲜辣椒挑选→洗净→去蒂→切块→装瓶→加水→接种→密封→30℃下发酵→杀菌→成品→检验。
操作要点:选用新鲜小米椒,洗去泥土灰尘,去蒂,切成2 m×2 cm 左右小块。不同地区小米椒各取4 份,每份30 g,分别放入100 mL 发酵瓶中,参照赖晓英[17]的发酵条件进行改进,设计发酵配方为:小米椒∶食盐水(质量分数8%)=1∶2,植物乳杆菌接种量6%,白糖添加量4%,恒温30 ℃发酵15 d。
1.3.3 发酵辣椒品质指标的测定 将陕西辣椒记作SX,四川辣椒记作SC,云南辣椒记作YN,分别测定发酵第0,5,10,15 天辣椒的亚硝酸盐含量、pH 值、辣素含量、挥发性成分及脆度。
1.3.3.1 亚硝酸盐含量的测定 参照GB 5009.33-2016[18]中的盐酸萘乙二胺法测定亚硝酸盐含量。
1.3.3.2 pH 值的测定 使用pH 计直接测定。
1.3.3.3 辣素含量的测定 采用紫外-可见分光光度法[19]测定辣素含量。绘制标准曲线:准确称取天然辣椒碱(CAS:404-86-4)25 mg,用甲醇溶解,定容得到1.00 mg/mL 标准贮备液,并稀释配成质量浓度为0.02,0.04,0.06,0.08,0.10,0.12 mg/mL的标准溶液,以试剂空白做参比,用紫外分光光度计测定其吸光度 (波长为280 nm),绘制标准曲线。
样品中辣素含量测定:称取5 g 样品,用甲醇溶解提取辣素,离心后将上清液移至50 mL 容量瓶中,用甲醇定容,振荡,静置10 min。用紫外分光光度计测其吸光度,计算辣素含量。
1.3.3.4 挥发性成分测定 采用顶空固相微萃取法和气相色谱-质谱联用技术分析发酵辣椒的挥发性成分[20]。
顶空固相微萃取:称取5.00 g 样品于15 mL顶空进样瓶中,在40 ℃环境中平衡30 min,插入装有50/30 μm DVB /PDMS 萃取头的手动进样手柄,萃取30 min 后,在GC 进样口解吸5 min。
气相色谱条件:HP-5 石英毛细管柱 (30 m×0.25 mm,0.25 μm);升温程序:40 ℃保持3 min,以4 ℃/min 升至120 ℃,无保留,以6 ℃/min 升至240 ℃,保持9 min;进样口温度250 ℃;载气为He;流速为1.00 mL/min;分流进样,分流比为6∶1。
质谱条件:电子电离源;电子能量70 eV;离子源温度230 ℃;接口温度230 ℃;扫描质谱范围为m/z 45~550 u。
1.3.3.5 脆度测定 参考谢靓等[21]的方法利用质构仪(Texture profile analysis,TPA)测定发酵辣椒的脆度。
1.3.4 感官评定 成立10 人感官评定小组,对发酵结束的产品进行观察品尝,评价结果分为4 个等级。
评价方法:称取5 g 发酵结束的样品于白色器皿中,在自然光线下评价其形态、色泽、风味和口感,评价时要在口中充分咀嚼后咽入,用温水漱口,按照表1标准[22]进行评定。
表1 感官评定标准
Table 1 The standard of sensory evaluation

?
1.4 数据处理
采用Origin 2018 软件作图,IBM SPSS Statistics 25 统计软件分析试验结果,试验数据表示为“平均值±标准差”(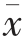 ±s,n=3)。
±s,n=3)。
2 结果与分析
2.1 辣椒发酵过程中亚硝酸盐含量的变化
由图1可知,发酵辣椒的亚硝酸盐含量在前10 d 内急速上升,尤其以四川辣椒上升速度最快,到第10 天左右达到峰值,随后开始下降,并在第15 天时降至2.0 mg/kg 左右。由于发酵初期植物乳杆菌生长快,发酵环境中的pH 值较高,硝酸还原酶活性较强,菌株将辣椒中的硝酸盐大量还原成亚硝酸盐,从而亚硝酸盐含量逐渐达到最大值;然而随着发酵时间的延长,植物乳杆菌生物量不断增大,产酸能力逐渐增强,导致环境的pH 值不断下降,菌株分解亚硝酸盐的能力增强;同时植物乳杆菌也可以产生亚硝酸还原酶,进一步降解亚硝酸盐,因此在发酵中后期亚硝酸盐含量迅速下降至较低水平并趋于稳定[23-24]。亚硝酸盐作为强致癌物,在腌菜中的限量值为20 mg/kg[25],应尽量避免在含量较高时期食用。

图1 不同地区小米椒经植物乳杆菌发酵后亚硝酸盐含量的变化
Fig.1 Changes of nitrite content in pepper fermented by Lactobacillus plantarum from different regions
2.2 辣椒发酵过程中pH 值的变化
pH 值是衡量辣椒是否发酵成熟的一个重要标志。由图2可知,3 个地区的辣椒在发酵过程中pH 值均呈前期迅速下降,5 d 之后逐渐趋于平稳的特点,并在第15 天时发酵成熟可食用,其中云南辣椒前期下降速度最快,后期较为平缓,陕西辣椒在第15 天时pH 值降低至3.2 左右,略低于四川和云南辣椒。前期pH 值大幅度下降可能是因为纯植物乳杆菌接种发酵,快速主导发酵过程,产生大量乳酸,随着发酵时间的延长,酸度升高,氧气被耗尽,造成菌株部分死亡从而抑制其进一步产酸,导致发酵后期pH 值下降缓慢[26]。
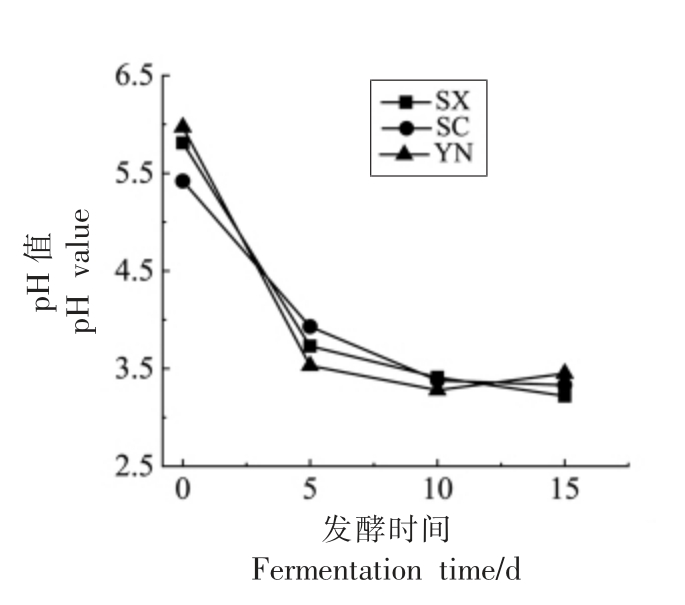
图2 不同地区小米椒经植物乳杆菌发酵后pH 值的变化
Fig.2 Changes of pH value in pepper fermented by Lactobacillus plantarum from different regions
2.3 辣椒发酵过程中辣素含量的变化
由图3可知,3 个地区的辣椒在发酵过程中,前5 d 辣素含量均有下降,在5~10 d 时由于植物乳杆菌的作用,辣素含量有所上升,到最后5 d 时辣素含量继续下降。对比不同地区辣椒发酵过程中的辣素含量的变化,四川辣椒要明显高于其它2 个地区的辣椒,云南辣椒在5~10 d 时辣素含量快速增加,超过了陕西辣椒,第15 天时陕西辣椒的辣素含量最低,约为0.15 mg/g。
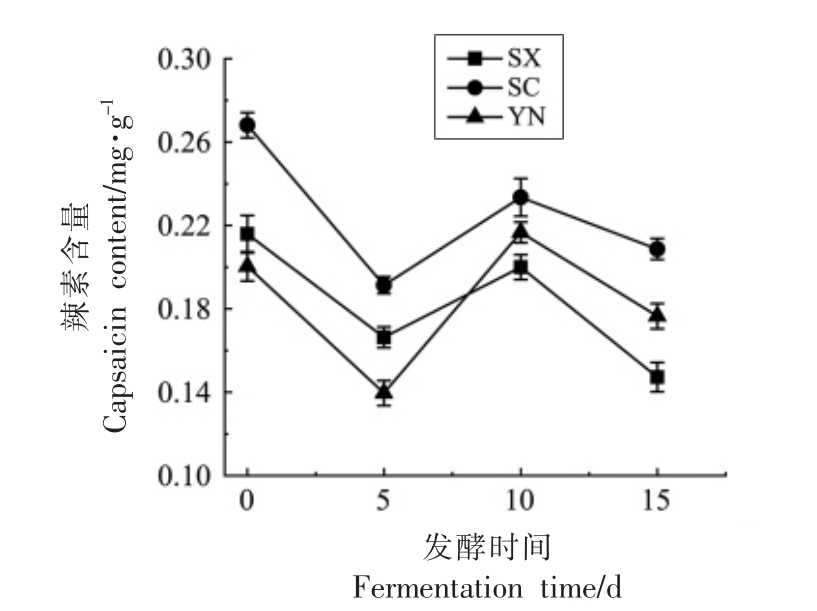
图3 不同地区小米椒经植物乳杆菌发酵后辣素含量的变化
Fig.3 Changes of capsaicin content in pepper fermented by Lactobacillus plantarum from different regions
2.4 辣椒发酵过程中挥发性成分的变化
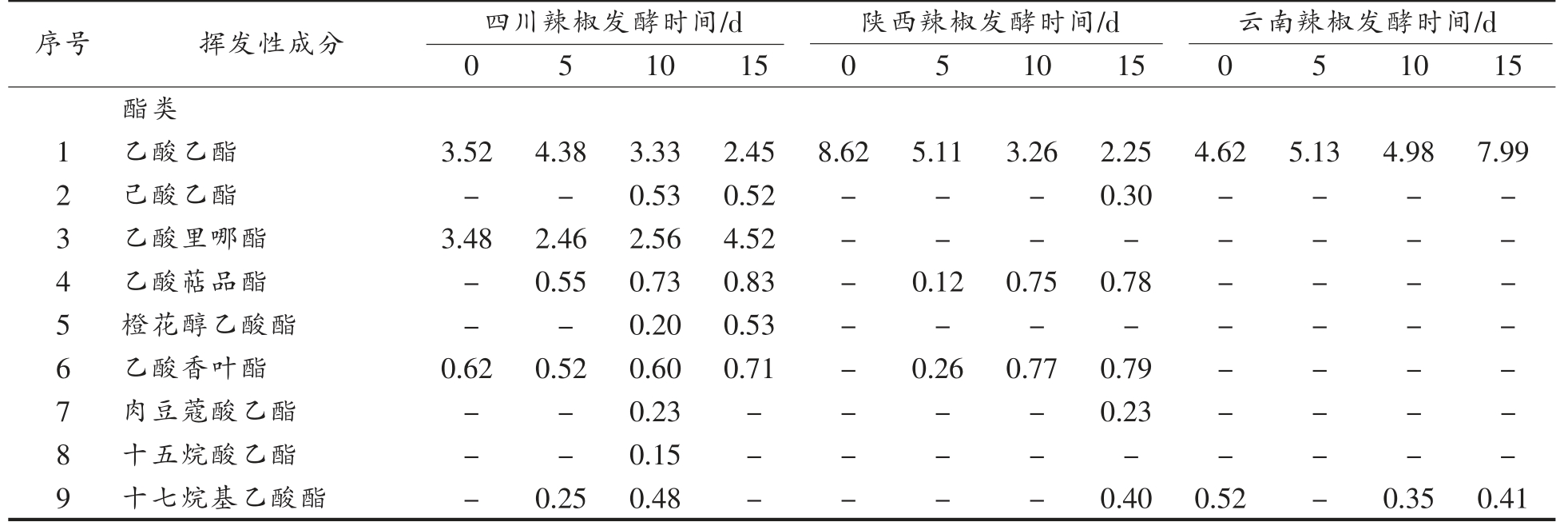
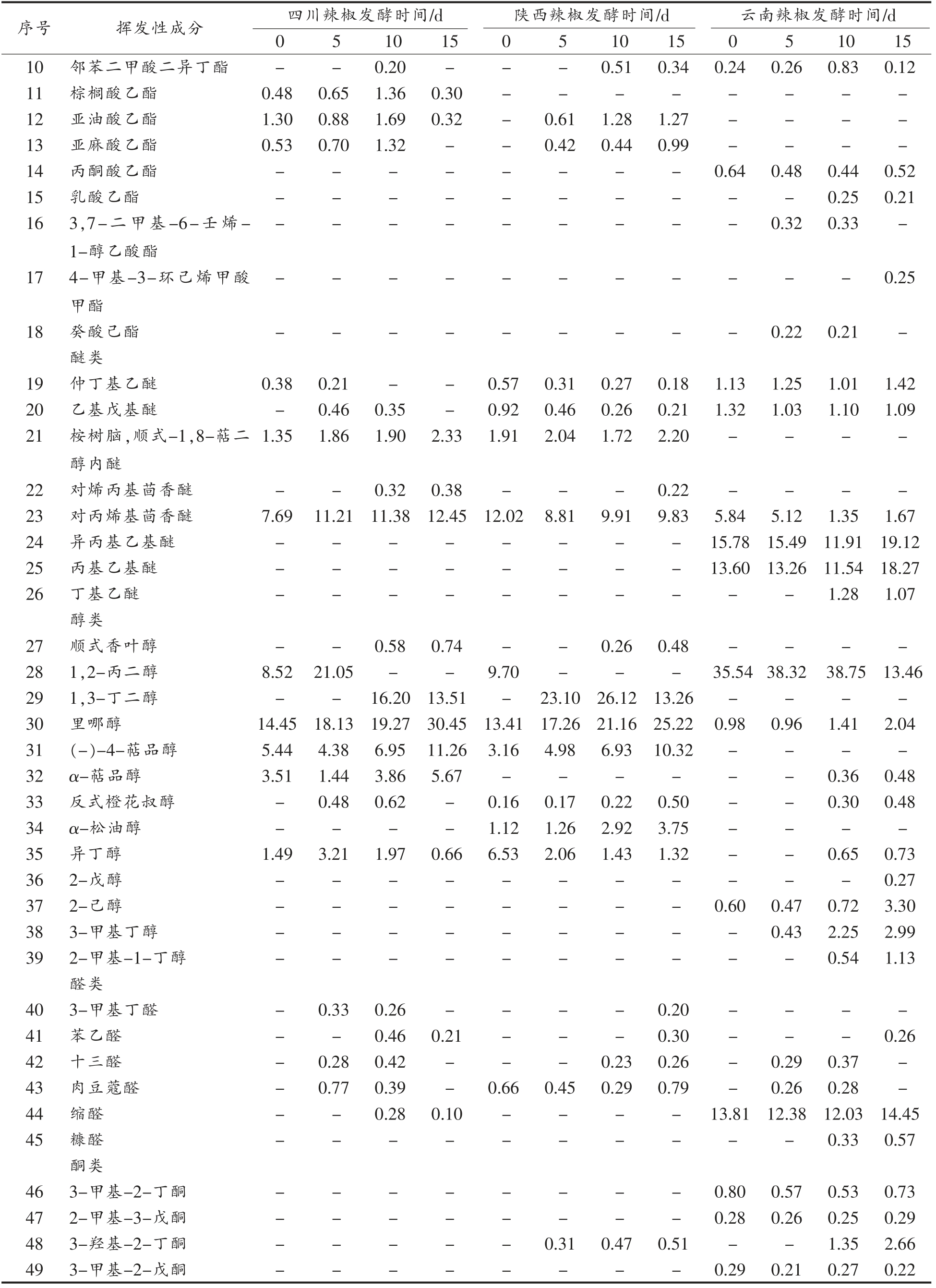
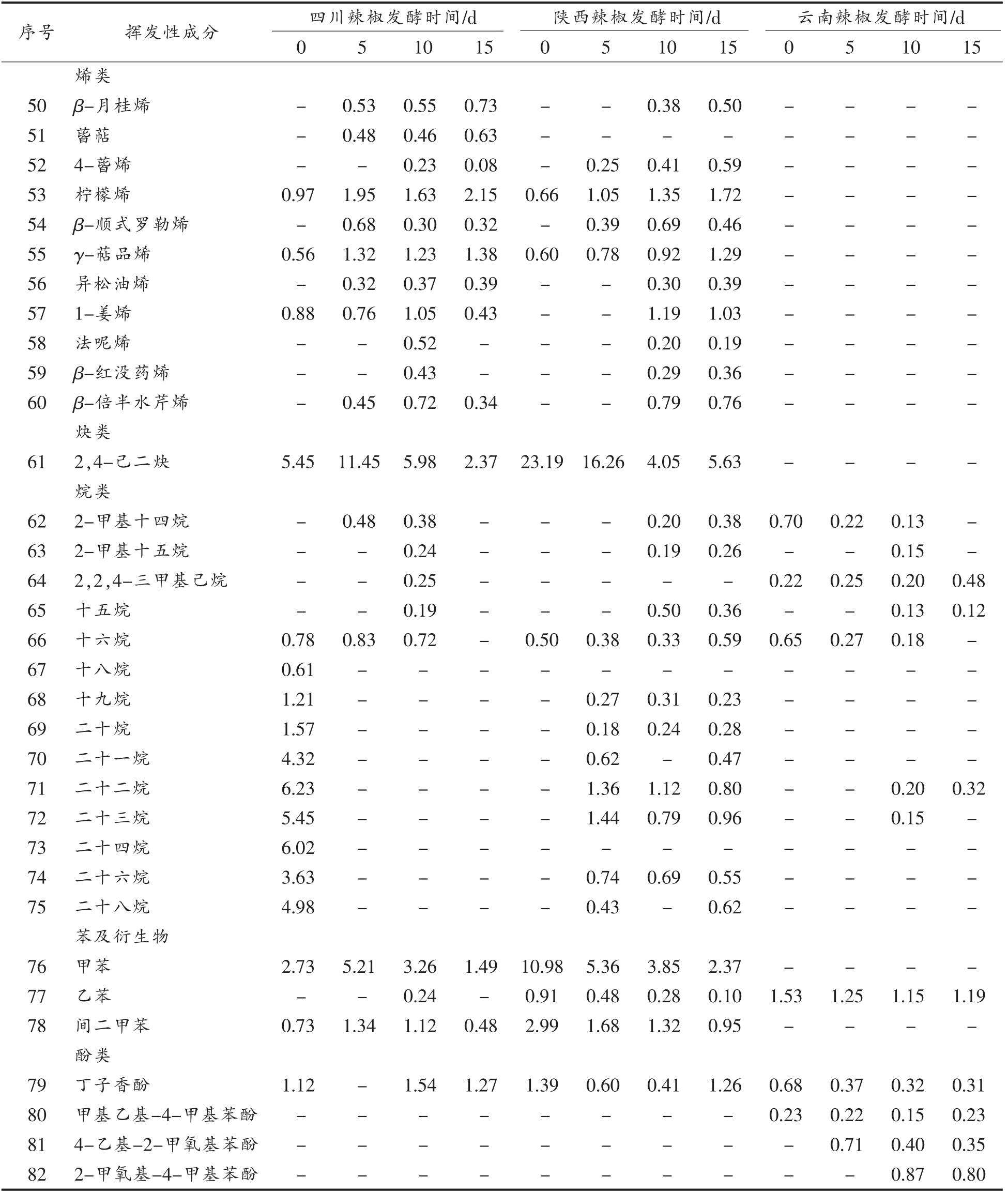
如表2所示,3 种发酵辣椒中共检测出82 种挥发性风味物质,其中酯类18 种,醚类8 种,醇类13 种,醛类6 种,酮类4 种,烯类11 种,烷烃类14种,苯酚类7 种及炔类1 种。从种类上来看,酯类、醇类及烷烃类占比较多,然而在含量上,醇类、醚类及酯类含量更高。
表2 不同地区辣椒发酵过程中挥发性成分的变化(相对百分含量/%)
Table 2 Changes of volatile components of pepper from different regions during fermentation (relative percentage/%)
?
(续表2)
序号 挥发性成分 四川辣椒发酵时间/d 陕西辣椒发酵时间/d 云南辣椒发酵时间/d 0 5 10 15 0 5 10 15 0 5 10 15 10 邻苯二甲酸二异丁酯 - - 0.20 - - - 0.51 0.34 0.24 0.26 0.83 0.12 11 棕榈酸乙酯 0.48 0.65 1.36 0.30 - - - - - - - -12 亚油酸乙酯 1.30 0.88 1.69 0.32 - 0.61 1.28 1.27 - - - -13 亚麻酸乙酯 0.53 0.70 1.32 - - 0.42 0.44 0.99 - - - -14 丙酮酸乙酯 - - - - - - - - 0.64 0.48 0.44 0.52 15 乳酸乙酯 - - - - - - - - - - 0.25 0.21 16 3,7-二甲基-6-壬烯-1-醇乙酸酯- - - - - - - - - 0.32 0.33 -17 4-甲基-3-环己烯甲酸甲酯- - - - - - - - - - - 0.25 18 癸酸己酯 - - - - - - - - - 0.22 0.21 -醚类19 仲丁基乙醚 0.38 0.21 - - 0.57 0.31 0.27 0.18 1.13 1.25 1.01 1.42 20 乙基戊基醚 - 0.46 0.35 - 0.92 0.46 0.26 0.21 1.32 1.03 1.10 1.09 21 桉树脑,顺式-1,8-萜二醇内醚1.35 1.86 1.90 2.33 1.91 2.04 1.72 2.20 - - - -22 对烯丙基茴香醚 - - 0.32 0.38 - - - 0.22 - - - -23 对丙烯基茴香醚 7.69 11.21 11.38 12.45 12.02 8.81 9.91 9.83 5.84 5.12 1.35 1.67 24 异丙基乙基醚 - - - - - - - - 15.78 15.49 11.91 19.12 25 丙基乙基醚 - - - - - - - - 13.60 13.26 11.54 18.27 26 丁基乙醚 - - - - - - - - - - 1.28 1.07醇类27 顺式香叶醇 - - 0.58 0.74 - - 0.26 0.48 - - - -28 1,2-丙二醇 8.52 21.05 - - 9.70 - - - 35.54 38.32 38.75 13.46 29 1,3-丁二醇 - - 16.20 13.51 - 23.10 26.12 13.26 - - - -30 里哪醇 14.45 18.13 19.27 30.45 13.41 17.26 21.16 25.22 0.98 0.96 1.41 2.04 31 (-)-4-萜品醇 5.44 4.38 6.95 11.26 3.16 4.98 6.93 10.32 - - - -32 α-萜品醇 3.51 1.44 3.86 5.67 - - - - - - 0.36 0.48 33 反式橙花叔醇 - 0.48 0.62 - 0.16 0.17 0.22 0.50 - - 0.30 0.48 34 α-松油醇 - - - - 1.12 1.26 2.92 3.75 - - - -35 异丁醇 1.49 3.21 1.97 0.66 6.53 2.06 1.43 1.32 - - 0.65 0.73 36 2-戊醇 - - - - - - - - - - - 0.27 37 2-己醇 - - - - - - - - 0.60 0.47 0.72 3.30 38 3-甲基丁醇 - - - - - - - - - 0.43 2.25 2.99 39 2-甲基-1-丁醇 - - - - - - - - - - 0.54 1.13醛类40 3-甲基丁醛 - 0.33 0.26 - - - - 0.20 - - - -41 苯乙醛 - - 0.46 0.21 - - - 0.30 - - - 0.26 42 十三醛 - 0.28 0.42 - - - 0.23 0.26 - 0.29 0.37 -43 肉豆蔻醛 - 0.77 0.39 - 0.66 0.45 0.29 0.79 - 0.26 0.28 -44 缩醛 - - 0.28 0.10 - - - - 13.81 12.38 12.03 14.45 45 糠醛 - - - - - - - - - - 0.33 0.57酮类46 3-甲基-2-丁酮 - - - - - - - - 0.80 0.57 0.53 0.73 47 2-甲基-3-戊酮 - - - - - - - - 0.28 0.26 0.25 0.29 48 3-羟基-2-丁酮 - - - - - 0.31 0.47 0.51 - - 1.35 2.66 49 3-甲基-2-戊酮 - - - - - - - - 0.29 0.21 0.27 0.22
(续表2)
注:“-”.未检出。
序号 挥发性成分 四川辣椒发酵时间/d 陕西辣椒发酵时间/d 云南辣椒发酵时间/d 0 5 10 15 0 5 10 15 0 5 10 15烯类50 β-月桂烯 - 0.53 0.55 0.73 - - 0.38 0.50 - - - -51 蒈萜 - 0.48 0.46 0.63 - - - - - - - -52 4-蒈烯 - - 0.23 0.08 - 0.25 0.41 0.59 - - - -53 柠檬烯 0.97 1.95 1.63 2.15 0.66 1.05 1.35 1.72 - - - -54 β-顺式罗勒烯 - 0.68 0.30 0.32 - 0.39 0.69 0.46 - - - -55 γ-萜品烯 0.56 1.32 1.23 1.38 0.60 0.78 0.92 1.29 - - - -56 异松油烯 - 0.32 0.37 0.39 - - 0.30 0.39 - - - -57 1-姜烯 0.88 0.76 1.05 0.43 - - 1.19 1.03 - - - -58 法呢烯 - - 0.52 - - - 0.20 0.19 - - - -59 β-红没药烯 - - 0.43 - - - 0.29 0.36 - - - -60 β-倍半水芹烯 - 0.45 0.72 0.34 - - 0.79 0.76 - - - -炔类61 2,4-己二炔 5.45 11.45 5.98 2.37 23.19 16.26 4.05 5.63 - - - -烷类62 2-甲基十四烷 - 0.48 0.38 - - - 0.20 0.38 0.70 0.22 0.13 -63 2-甲基十五烷 - - 0.24 - - - 0.19 0.26 - - 0.15 -64 2,2,4-三甲基己烷 - - 0.25 - - - - - 0.22 0.25 0.20 0.48 65 十五烷 - - 0.19 - - - 0.50 0.36 - - 0.13 0.12 66 十六烷 0.78 0.83 0.72 - 0.50 0.38 0.33 0.59 0.65 0.27 0.18 -67 十八烷 0.61 - - - - - - - - - - -68 十九烷 1.21 - - - - 0.27 0.31 0.23 - - - -69 二十烷 1.57 - - - - 0.18 0.24 0.28 - - - -70 二十一烷 4.32 - - - - 0.62 - 0.47 - - - -71 二十二烷 6.23 - - - - 1.36 1.12 0.80 - - 0.20 0.32 72 二十三烷 5.45 - - - - 1.44 0.79 0.96 - - 0.15 -73 二十四烷 6.02 - - - - - - - - - - -74 二十六烷 3.63 - - - - 0.74 0.69 0.55 - - - -75 二十八烷 4.98 - - - - 0.43 - 0.62 - - - -苯及衍生物76 甲苯 2.73 5.21 3.26 1.49 10.98 5.36 3.85 2.37 - - - -77 乙苯 - - 0.24 - 0.91 0.48 0.28 0.10 1.53 1.25 1.15 1.19 78 间二甲苯 0.73 1.34 1.12 0.48 2.99 1.68 1.32 0.95 - - - -酚类79 丁子香酚 1.12 - 1.54 1.27 1.39 0.60 0.41 1.26 0.68 0.37 0.32 0.31 80 甲基乙基-4-甲基苯酚 - - - - - - - - 0.23 0.22 0.15 0.23 81 4-乙基-2-甲氧基苯酚 - - - - - - - - - 0.71 0.40 0.35 82 2-甲氧基-4-甲基苯酚 - - - - - - - - - - 0.87 0.80
不同地区辣椒在发酵过程中其风味物质的种类和含量及变化情况都有所不同。四川辣椒的风味物质中酯类、烷烃和烯烃种类较多,在发酵过程中酯类和烯烃类的种类明显增加,烷烃种类却显著减少,在第15 天时数量降为0,显然其在发酵过程中烷烃转化为其它风味物质;在含量上,四川辣椒的醇类物质含量在发酵过程中明显增加,由31.92%增长为62.29%,这可能是发酵过程中植物乳杆菌代谢的结果;烷烃类含量显著降低,由34.80%降至0%,其它成分变化较不明显,表明发酵前期的风味物质主要是烷烃,而在发酵过程中逐渐转化为醚类、烯烃等成分,导致含量下降。陕西辣椒和四川辣椒的风味物质中在种类及变化上相似,然而其烷烃的种类大幅度增加,由1 种变为11 种,烯烃的种类也由2 种变为10 种。烷烃类物质大多香气较弱或无气味[27],烯烃类物质是辣椒风味物质中种类较多、含量相对较高的化合物[28],对辣椒风味有一定贡献,如柠檬烯能赋予辣椒好闻的柠檬香味;异松油烯有松木树脂似的香气。与其它地区相比,云南辣椒的风味物质的种类及含量有所不同,其醇类、酮和酚类物质的种类较其它地区多,其烷烃种类少,并没有检出烯烃和炔烃类物质。在发酵过程中云南辣椒风味物质在含量上变化不大,醚类和醇类物质含量极高,约占总量的65%~75%,是主要的风味物质,其次是醛类物质,约占总量的13%,其它风味物质总含量较低,约占总量的13%。
2.5 辣椒发酵过程中脆度的变化
辣椒的脆度受辣椒品种、水分分布情况等因素的影响,辣椒在发酵过程中,微生物会分泌果胶酶水解果胶,同时食盐水会通过渗透作用使细胞组织失水,从而软化组织,使脆度降低。由图4可知,3 个地区的辣椒在发酵过程中脆度呈直线下降的趋势,其中云南辣椒脆度下降幅度最大,在第15 天时其最大承受压力仅为3 142 g,四川辣椒和陕西辣椒分别为3 695 g 和3 966 g,由此可知,发酵后陕西辣椒的脆度最好,四川辣椒次之,云南辣椒脆度最差。
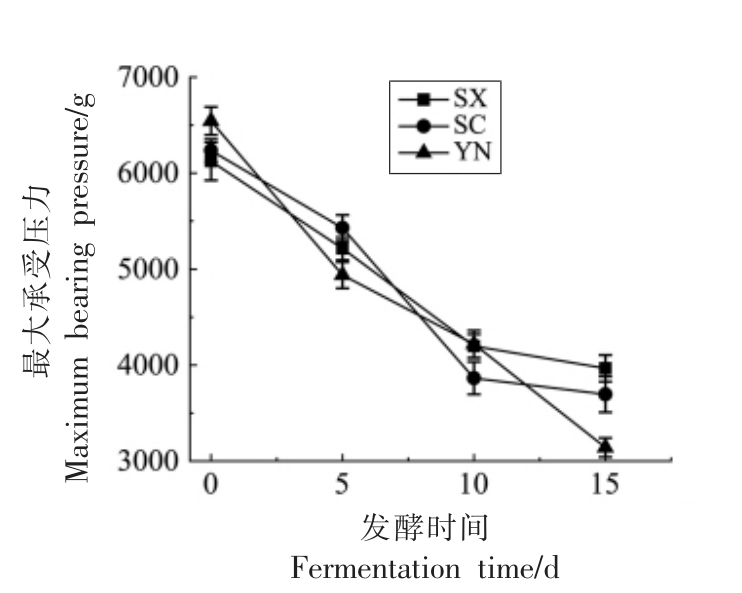
图4 不同地区小米椒经植物乳杆菌发酵后脆度的变化
Fig.4 Changes of crispness in pepper fermented by Lactobacillus plantarum from different regions
2.6 感官评定结果
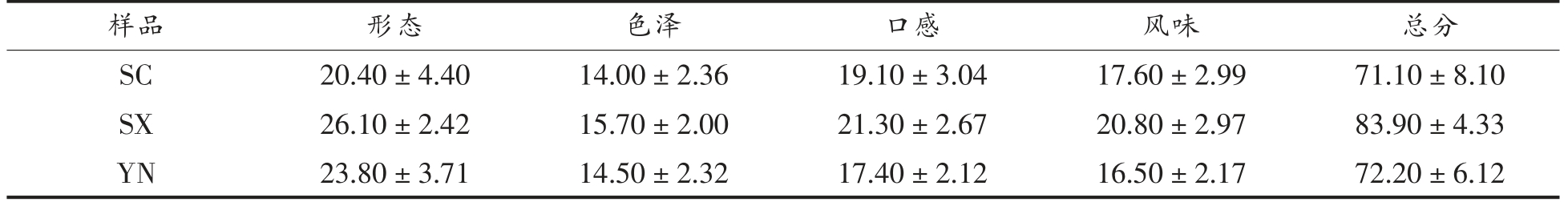
从表3可以看出,云南、陕西、四川的感官评定的平均分分别是72.20,83.90,71.10,3 种发酵辣椒的感官评分结果为陕西>云南>四川,陕西辣椒经植物乳杆菌发酵的产品色泽自然鲜艳,酸度、咸度适中,风味浓厚,口感清爽,无论是形态、色泽还是口感风味均优于四川、云南辣椒。
表3 不同地区发酵辣椒的感官评价结果
Table 3 Sensory evaluation of fermented pepper from different regions
?
3 结论
通过分析陕西、四川、云南3 个地区的小米椒在植物乳杆菌发酵过程中的品质,发现3 种辣椒的亚硝酸盐含量和pH 值在发酵过程中无明显差异;陕西辣椒经植物乳杆菌发酵后其脆度的最大承受压力要明显高于其它两地的发酵辣椒,在口感上表现为更脆;四川辣椒经发酵后辣素含量最高,其次是云南辣椒、陕西辣椒;发酵结束时陕西辣椒的挥发性成分种类更多,酯类、醇类的相对含量在第15 天时明显高于其它2 个地区,其香味更优于另外2 个地区的辣椒产品;结合感官评定结果可知,陕西小米椒经植物乳杆菌发酵后口感最佳,发酵产品最受欢迎,其次是云南小米椒、四川小米椒。本研究为我国传统的辣椒发酵制品的开发提供了一定的理论参考。目前对发酵辣椒的研究集中在发酵条件优化、风味物质的变化上,对于发酵辣椒的生理功效还有待进一步研究。
[1]OLATUNJI T L,AFOLAYAN A J.The suitability of chili pepper (Capsicum annuum L.) for alleviating human micronutrient dietary deficiencies:A review[J].Food Science &Nutrition,2018,6(8):2239-2251.
[2]VARGHESE S,KUBATKA P,RODRIGO L,et al.Chilipepper as a body weight-loss food[J].International Journal of Food Sciences and Nutrition,2017,68(4):392-401.
[3]BASITH S,CUI M,HONG S,et al.Harnessing the therapeutic potential of capsaicin and its analogues in pain and other diseases [J].Molecules,2016,21(8):966-994.
[4]BACON K,BOYER R,DENBOW C,et al.Evaluation of different solvents to extract antibacterial compounds from jalapeño peppers[J].Food Science &Nutrition,2016,5(3):497-503.
[5]REDA F M,ALAGAWANY M,MAHMOUD H K,et al.Use of red pepper oil in quail diets and its effect on performance,carcass measurements,intestinal microbiota,antioxidant indices,immunity and blood constituents[J].Animal,2020,14(5):1025-1033.
[6]FRIEDMAN J R,NOLAN N A,BROWN K C,et al.Anticancer activity of natural and synthetic capsaicin analogs[J].The Journal of Pharmacology and Experimental Therapeutics,2018,364(3):462-473.
[7]CHEN Y Y,XU H S,DING S H,et al.Changes in volatile compounds of fermented minced pepper during natural and inoculated fermentation process based on headspace-gas chromatography-ion mobility spectrometry[J].Food Science &Nutrition,2020,8(7):3362-3379.
[8]LEE S M,LEE J Y,CHO Y J,et al.Determination of volatiles and carotenoid degradation compounds in red pepper fermented by Lactobacillus parabuchneri[J].Journal of Food Science,2018,83(8):2083-2091.
[9]YANG H J,LEE Y S,CHOI I S.Comparison of physicochemical properties and antioxidant activities of fermented soybean -based red pepper paste,Gochujang,prepared with five different red pepper(Capsicum annuum L.) varieties[J].Journal of Food Science and Technology,2018,55(2):792-801.
[10]张郁松.乳酸菌接种发酵辣椒酱工艺研究[J].中国调味品,2019,44(12):104-107.
ZHANG Y S.Study on fermentation of chili sauce by inoculation of lactic acid bacteria [J].China Condiment,2019,44(12):104-107.
[11]李晓博,胡文忠,姜爱丽,等.自然发酵与人工接种发酵酸菜的研究进展[J].食品与发酵工业,2016,42(3):251-255.
LI X B,HU W Z,JIANG A L,et al.Research and advancement on natural fermented and inoculated fermented sauerkraut[J].Food and Fermentation Industries,2016,42(3):251-255.
[12]韩江雪,丁筑红,李仲军,等.不同乳酸菌强化接种发酵辣椒挥发性风味成分分析[J].食品科学,2012,33(10):179-183.
HAN J X,DING Z H,LI Z J,et al.Volatile analysis of chili fermented by different Lactobacillus species[J].Food Science,2012,33(10):179-183.
[13]贾洪锋.发酵辣椒中风味物质的研究[D].重庆:西南大学,2007.
JIA H F.Study on the flavor components of fermented Capsicum annuum[D].Chongqing:Southwest University,2007.
[14]王雪雅,吴华丽,丁筑红,等.纯种乳酸菌接种发酵辣椒综合品质特性研究[J].中国酿造,2016,35(9):119-124.
WANG X Y,WU H L,DING Z H,et al.Comprehensive quality characteristics of fermented chili by pure lactic acid bacteria [J].China Brewing,2016,35(9):119-124.
[15]尹小庆,汤艳燕,阚建全,等.小米辣鲊辣椒发酵过程中风味物质及微生物多样性的变化[J].食品与发酵工业,2020,46(5):74-82.
YIN X Q,TANG Y Y,KAN J Q,et al.Analysis of flavor components and microbial diversity of Xiaomila Zhalajiao during fermentation[J].Food and Fermentation Industries,2020,46(5):74-82.
[16]樊康,李榕,雷华威,等.Weissella hellenica 1501对发酵香肠品质的影响[J].食品与机械,2011,27(6):56-59.
FAN K,LI R,LEI H W,et al.Effects of Weissella hellenica 1501 on color and qualities of fermented sausages[J].Food and Machinery,2011,27(6):56-59.
[17]赖晓英.发酵辣椒工艺的研究[D].重庆:西南大学,2006.
LAI X Y.Studies on fermenting technics of Capsicum[D].Chongqing:Southwest University,2006.
[18]国家卫生和计划生育委员会,国家食品药品监督管理总局.食品安全国家标准 食品中亚硝酸盐与硝酸盐的测定:GB 5009.33-2016[S].北京:中国标准出版社,2016:4-9.
National Health and Family Planning Commission of the People's Republic of China,State Food and Drug Administration.National food safety standard determination of nitrite and nitrate in foods:GB 5009.33-2016[S].Beijing:Standards Press of China,2016:4-9.
[19]王穗萍,夏延斌.辣椒素类物质测定方法的研究进展[J].中国食品添加剂,2005(2):110-113.
WANG S P,XIA Y B.Review on determination of capsaiciniods[J].China Food Additives,2005(2):110-113.
[20]王雪梅,孙文佳,李亚隆,等.不同产地鲜辣椒发酵郫县豆瓣的品质分析[J].食品科学,2020,41(10):213-221.
WANG X M,SUN W J,LI Y L,et al.Quality analysis of Pixian broad -bean pastes made with fresh hot peppers from different producing areas[J].Food Science,2020,41(10):213-221.
[21]谢靓,蒋立文.不同食盐含量对发酵辣椒质构的变化研究[J].中国酿造,2014,33(11):59-62.
XIE J,JIANG L W.Effect of different salt content on change of fermented chili texture[J].China Brewing,2014,33(11):59-62.
[22]韦宗卉.乳酸菌发酵对辣椒酱品质影响的研究[D].扬州:扬州大学,2017.
WEI Z H.Study on the quality of chili sauce fer mented by lactic acid bacteria[D].Yangzhou:Yangzhou University,2017.
[23]李泽丽.应用植物乳杆菌降解亚硝酸盐的研究[D].上海:上海师范大学,2015.
LI Z L.Study on the degradation of nitrite by Lactobacillus plantarum[D].Shanghai:Shanghai Normal University,2015.
[24]何玲,张祖德.不同条件下辣椒发酵过程硝酸还原酶活性和亚硝酸盐含量变化[J].中国酿造,2012,31(1):125-129.
HE L,ZHANG Z D.Changes of nitrate reductase activity and nitrite contents in pepper under different fermentation conditions[J].China Brewing,2012,31(1):125-129.
[25]国家卫生和计划生育委员会,国家食品药品监督管理总局.食品安全国家标准 食品中污染物限量:GB 2762-2017[S].北京:中国标准出版社,2017:9.
National Health and Family Planning Commission of the People's Republic of China,State Food and Drug Administration.National food safety standard Maximum levels of contaminants in foods:GB 2762-2017[S].Beijing:Standards Press of China.2017:9.
[26]叶陵,王晶晶,王蓉蓉,等.剁辣椒发酵过程中菌群与有机酸变化规律分析[J].食品科学,2018,39(6):116-121.
YE L,WANG J J,WANG R R,et al.Changes in microflora and organic acid contents during the fermentation of chopped pepper [J].Food Science,2018,39(6):116-121.
[27]田维芬,周君,明庭红,等.基于电子鼻和GC-MS的不同品牌橄榄油挥发性风味物质研究[J].食品工业科技,2017,38(7):285-292.
TIAN W F,ZHOU J,MING T H,et al.Analysis of volatile flavor components from different regions of olive oil by electronic nose and gas chromatography technology[J].Science and Technology of Food Industry,2017,38(7):285-292.
[28]陆宽,王雪雅,孙小静,等.电子鼻结合顶空SPME-GC-MS 联用技术分析贵州不同品种辣椒发酵后挥发性成分[J].食品科学,2018,39(4):199-205.
LU K,WANG X Y,SUN X J,et al.Analysis of the volatile components of fermented hot pepper from different varieties grown in Guizhou by electronic nose combined with SPME-GC-MS[J].Food Science,2018,39(4):199-205.