2001年,联合国粮农组织(Food and Agriculture Organization,FAO) 和世界卫生组织(World Health Organization,WHO) 提出益生菌的定义:益生菌系指活的微生物,当摄取足够数量时,对宿主健康有益[1]。2020年,中国食品科学技术学会发布了《益生菌的科学共识(2020年版)》[2],进一步明确了益生菌的3 个核心特征,即:足够数量、活菌状态及有益健康功能。同时提出:益生菌有益健康的功能属性是建立在科学严谨的临床试验评价和循证医学证据基础上的。临床研究发现益生菌对人体的健康作用存在一定的剂量-反应关系(Dose-response relationship)[3-5]。由于益生菌菌株健康作用具有菌株差异性,对于“足够数量”一词,标准法规中尚未有统一的表述,因此,探讨益生菌的摄入量与肠道健康之间的关系,对于益生菌产业的健康可持续发展至关重要。本文主要围绕益生菌摄入量与肠道健康作用的关系,首先整理了目前国内外益生菌的活菌精准计数的方法,其次综述了益生菌临床有效剂量与功能性便秘、腹泻及肠易激综合征等健康作用的关系及影响益生菌摄入量与肠道健康作用的因素,最后介绍了国际标准法规中对益生菌摄入量的建议等,在此基础上凝练形成六大科学观点,以期为我国益生菌的标准法规建设及产业化健康发展提供理论参考。
1 益生菌活菌精准计数
益生菌活菌的精准计数是评价益生菌量效关系的重要前提,也是我国市场监管益生菌相关产品货架期内菌种有效活菌数的重要依据。目前,国内外常见的乳杆菌、双歧杆菌、酵母菌等的推荐标准计数方法(见表1),以平板计数【以菌落形成单位(Colony-forming units,CFU)计数】和流式细胞数(Flow cytometry,FCM)方法为主。对于单一菌株的益生菌产品,传统平板计数法通过对培养基的优化,能够相对准确地检测食品中菌种的属或种层级的活菌数,而对于多菌株混合的产品,平板计数法无法在菌株水平进行分别计数。在“第十六届益生菌与健康国际研讨会”上发布的“益生菌产品六大创新趋势”提出:多菌株益生菌及益生元复配提升益生菌的健康功能,逐渐成为益生菌产品的创新趋势,如乳杆菌、双歧杆菌等不同菌种/株的组合,亦或是益生菌与低聚果糖等益生元的复配,起到增加益生菌活菌数量或互补益生菌的健康作用。
表1 益生菌活菌计数的参考标准方法及适用范围
Table 1 Standard methods for enumeration of viable probiotics

菌种类型 方法 适用范围乳酸菌 GB 4789.35-2016[6] 平板计数方法对乳杆菌属(Lactobacillus)、双歧杆菌属(Bifidobacterium)和嗜热链球菌属(Streptococcus)菌种的计数SN ISO/T 5436-2022[7] 流式细胞仪法对乳及乳制品发酵剂、发酵产品中乳酸菌的计数19344:2015[8] 流式细胞仪法对乳制品中总乳酸菌和益生菌的计数;也适用于乳制品中使用的益生菌和发酵乳制品的计数,例如:主要含有乳酸菌的酸奶ISO 27205:2010[9] 对酸奶、酸奶油、发酵奶油以及干酪等发酵乳制品中乳酸菌、双歧杆菌、丙酸杆菌菌种的定义、安全性评价标准、加工卫生标准进行描述ISO 7889:2003[10] 适用于37 ℃条件下,平板计数酸奶中特征微生物【德氏乳杆菌保加利亚亚种 (Lactobacillus delbrueckii subsp.bulgaricus)、嗜热链球菌(Streptococcus thermophilus)】的计数ISO 17792:2006[11] 适用于25 ℃条件下,平板计数乳、乳制品和中温发酵剂中柠檬酸盐发酵乳酸菌 【乳酸乳球菌乳脂双乙酰亚种 (Lactococcus lactis subsp.Lactis biovar diacetylactis)、肠膜明串珠菌肠膜亚种 (Leuconotoc mesenteroides subsp.mesenteroides)、肠膜明串珠菌右旋葡聚糖亚种 (Leuconotoc mesenteroides subsp.dextranicum)等】的计数双歧杆菌 GB 4789.34-2016[12] 适用于双歧杆菌纯菌菌种的鉴定及计数;食品中仅含有单一双歧杆菌的菌种鉴定;食品中仅含有双歧杆菌属的计数,即食品中可包含1 个或多个不同的双歧杆菌菌种ISO 29981:2010[13] 适用于37 ℃条件下,平板计数发酵/非发酵乳、奶粉、婴儿配方奶粉中双歧杆菌的计数嗜酸乳杆菌 ISO 20128:2006[14] 适用于37 ℃条件下,平板计数发酵/非发酵乳、奶粉、婴儿配方奶粉中嗜酸乳杆菌的计数真 菌 GB 4789.15-2016[15] 食品中霉菌和酵母菌的计数DB22/T 394.5-2017[16] 保健用品中霉菌和酵母菌数的计数
研究表明高通量测序技术、流式细胞技术、叠氮溴化丙啶(Propidium monoazide,PMA)与实时定量PCR (Quantitative real-time PCR,qPCR)等技术方法可实现菌株水平的活菌计数。PMAqPCR 活菌计数法已用于不同基质食物中益生菌的特异性定量,其基于膜完整性检测细胞活力,可有效区分活菌与死菌,且结果具有较高的准确性。Yang 等[17]建立的PMA-qPCR 方法用于乳杆菌活菌的定量检测,检测耗时仅为3 h,检测结果与平板计数法一致。Morovic 等[18]基于Illumina MiSeq平台的高通量测序技术对益生菌产品中混合菌株进行分类并量化其相对数量,然而该方法对益生菌菌株的种水平鉴定准确性不高。此外,流式细胞术也逐渐成为活菌计数的重要手段。Raymond 等[19]在以巧克力为基质的条件下,评估鼠李糖乳酪杆菌(Lactobacillus rhamnosus R0011)活菌计数的精确度和准确性,结果发现流式细胞术可确定产品中低水平的死亡细胞,而且益生菌粉末与食品基质的混合均匀程度并不影响活菌计数的精确度。
2 益生菌摄入量与肠道健康
益生菌一词在定义中要求“足够数量”,意味着益生菌的健康作用与摄入量有着密切的关系。临床研究表明(见表2),针对益生菌有效改善功能性便秘、腹泻和肠易激综合征等肠道健康问题,多数菌株的有效摄入量范围是107~1011 CFU/d。
表2 部分益生菌与肠道健康作用的研究文献
Table 2 Publications related to the effects of probiotics on gut health

健康作用 益生菌菌株 推荐摄入量 方法功能性便秘 两歧双歧杆菌 (Bifidobacterium bifidum KCTC 12199BP)、乳双歧杆菌(B.lactis KCTC 11904BP)、长双歧杆菌(B.longum KCTC 12200BP)、嗜酸乳杆菌(Lactobacillus acidophilus KCTC 11906BP)、鼠李糖乳酪杆菌(L.rhamnosus KCTC 12202BP) 和嗜热链球菌 (S.thermophilus KCTC 11870BP)2.5×108 CFU/d 非随机对照队列/随访研究[20]罗伊氏粘液乳杆菌 (Limosilactobacillus reuteri DSM 17938)1×108 CFU;2 次/d 非随机对照队列/随访研究[21]干酪乳酪杆菌Zhang (Lacticaseibacillus casei Zhang)和动物双歧杆菌乳亚种V9(Bifidobacterium animalis subsp.lactis V9)的发酵乳干酪乳酪杆菌Zhang (1×105 CFU/mL),动物双歧杆菌乳亚种V9(4×107 CFU/mL);200 g/d随机试验/观察性研究[22]成人抗生素相 关 腹 泻(AAD)含有干酪乳酪杆菌DN114、保加利亚乳杆菌和嗜热链球菌的发酵乳嗜酸乳杆菌CL1285 和干酪乳酪杆菌 (L.casei Bio-K+ CL1285)≥1010 CFU/d 系统评价随机试验[23]≥1010 CFU/d 系统评价随机试验[23]布拉迪氏酵母菌 (Saccharomyces boulardii CNCM I-745)5×109 CFU/胶 囊 或250 mg;2次/d系统评价随机试验[23-24]罗伊氏粘液乳杆菌DSM 17938 1×108 CFU;2 次/d 非随机对照队列/随访研究[25]嗜酸乳杆菌NCFM、副干酪乳酪杆菌Lpc-37(Lacticaseibacillus paracasei Lpc-37)、动物双歧杆菌乳亚种(Bifidobacterium animalis subsp.lactis Bi-07)、乳双歧杆菌(B.lactis Bl-04)1.710 CFU 随机试验/观察性研究[26]两歧双歧杆菌W23、乳双歧杆菌W18、长双歧杆菌W51、屎 肠 球 菌(Enterococcus faecium W54)、嗜酸乳杆菌W37 和W55、副干酪乳酪杆菌W72、植物乳植杆菌(L.plantarum W62)、鼠李糖乳酪杆菌W71 和唾液链球菌(L.salivarius W24)109 CFU/g(5 g;2 次/d) 随机试验/观察性研究[27]艰难梭菌相关腹泻嗜酸乳杆菌CL1285 和干酪乳酪杆菌LBC80R 5×1010 CFU/d 和4×1010~10×1010 CFU/d随机试验/观察性研究[28]副干酪乳酪杆菌DN114、保加利亚乳杆菌和嗜热链球菌107~108 CFU;2 次/d 随机试验/观察性研究[29]布拉迪氏酵母菌CNCM I-745 5×109 CFU/胶 囊 或250 mg;2次/d非随机对照队列/随访研究[29]鼠李糖乳酪杆菌HN001+嗜酸乳杆菌NCFM 109 CFU/d 非随机对照队列/随访研究[30]嗜酸乳杆菌+两歧双歧杆菌 2×1010 CFU/d 非随机对照队列/随访研究[31]肠易激综合征(IBS)两歧双歧杆菌MIMBb75 109 CFU/d 非随机对照队列/随访研究[32]植物乳植杆菌229v(DSM 9843) 109 CFU/d 随机试验/观察性研究[33]
(续表2)
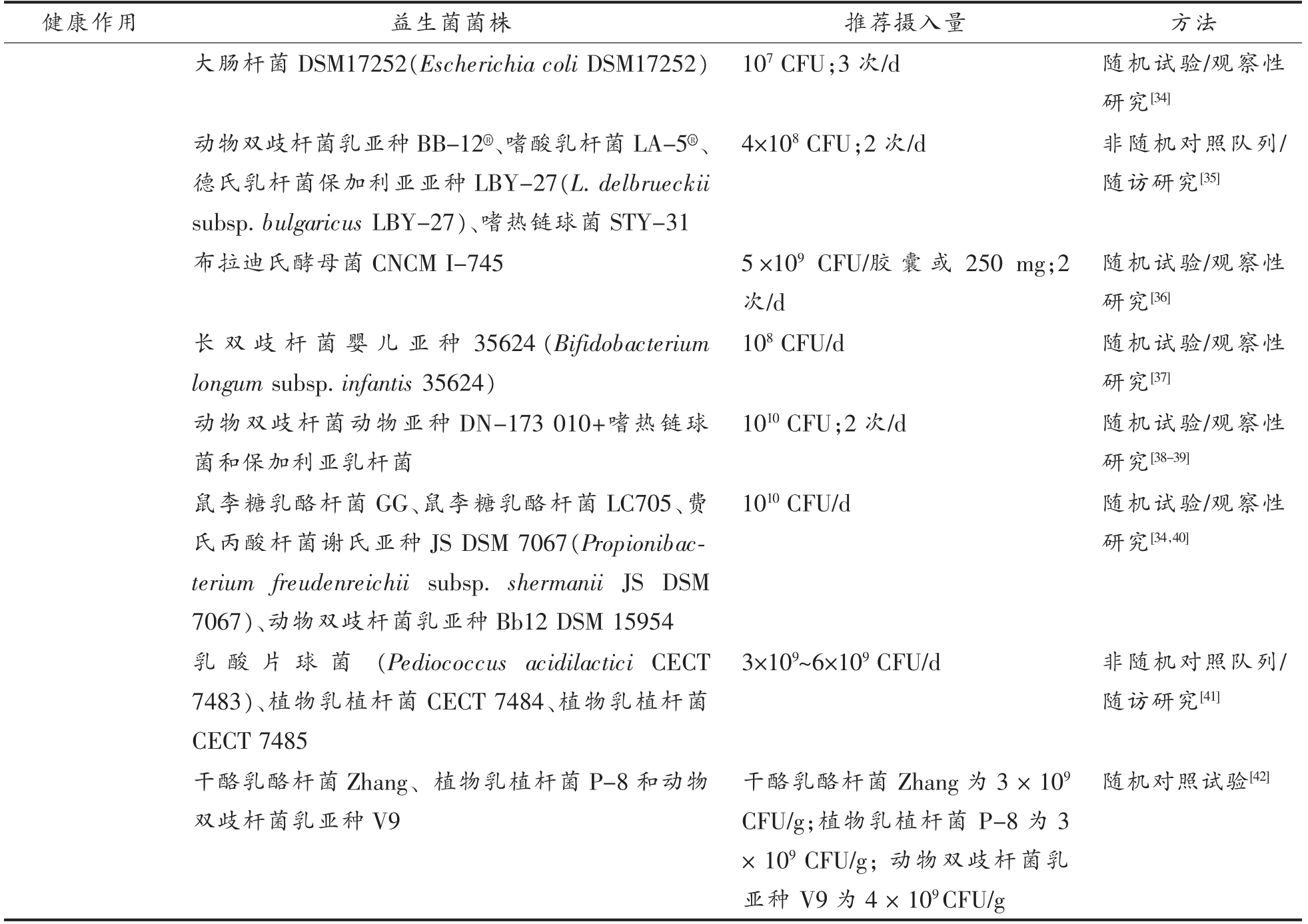
健康作用 益生菌菌株 推荐摄入量 方法大肠杆菌DSM17252(Escherichia coli DSM17252)107 CFU;3 次/d 随机试验/观察性研究[34]动物双歧杆菌乳亚种BB-12R、嗜酸乳杆菌LA-5R、德氏乳杆菌保加利亚亚种LBY-27(L.delbrueckii sub sp.bulgar拉迪氏酵icus LBY-27)、嗜热链球菌STY-31 4×108 CFU;2 次/d 非随机对照队列/随访研究[35]随机试验/观察性研究[36]长双歧杆菌婴儿亚种35624(Bifidobacterium longum subsp.infantis 35624)布母菌CNCM I-745 5×109 CFU/胶囊或250 mg;2次/d 108 CFU/d 随机试验/观察性研究[37]动物双歧杆菌动物亚种DN-173 010+嗜热链球菌和保加利亚乳杆菌1010 CFU;2 次/d 随机试验/观察性研究[38-39]鼠李糖乳酪杆菌GG、鼠李糖乳酪杆菌LC705、费氏丙酸杆菌谢氏亚种JS DSM 7067(Propionibacterium freudenreichii subsp.shermanii JS DSM 7067)、动物双歧杆菌乳亚种Bb12 DSM 15954乳酸片球菌(Pediococcus acidilactici CECT 7483)、植物乳植杆菌CECT 7484、植物乳植杆菌CECT 7485 1010 CFU/d 随机试验/观察性研究[34,40]3×109~6×109 CFU/d 非随机对照队列/随访研究[41]干酪乳酪杆菌Zhang、植物乳植杆菌P-8 和动物双歧杆菌乳亚种V9干酪乳酪杆菌Zhang 为3 × 109 CFU/g;植物乳植杆菌P-8 为3× 109 CFU/g;动物双歧杆菌乳亚种V9 为4 × 109CFU/g随机对照试验[42]
2.1 益生菌与功能性便秘
便秘主要分为功能性便秘和器质性便秘两大类。器质性便秘是由脏器的器质性病变所致。功能性便秘主要与饮食类型、结肠蠕动、肠神经元和神经递质异常等因素有关。研究表明[4,22,43-44],益生菌可通过调节肠道菌群,影响短链脂肪酸(SCFAs)和胆汁酸等肠道代谢物,进而刺激连接肠或迷走神经的黏膜受体直接作用于结肠平滑肌,或增加肠道内血清素(一种兴奋性神经递质)的浓度,或改变肠道内电解质和水的运输,通过肠道神经系统及内分泌系统影响肠道蠕动等方式,达到改善功能性便秘的作用。
一项荟萃分析表明[43],补充益生菌动物双歧杆菌乳亚种HN019 和动物双歧杆菌乳亚种DN-173 010 有助于减少成人全肠转运时间,改善效果与益生菌菌株特异性有关。针对100 名有功能性胃肠道症状的患者(平均年龄44 岁,其中64 名女性,36 名男性)进行三盲、随机、安慰剂对照试验,结果发现,与安慰剂组相比,益生菌干预组摄入标志物的排泄时间显著缩短,表明益生菌具有改善肠蠕动,缓解便秘的作用[44]。摄入1.8×108 CFU/d 的B.lactis HN019,能够显著缩短全肠转运时间,减少功能性胃肠道症状出现频率,在一定范围内增加益生菌剂量(1.72×109 CFU/d),改善效果更明显。
Larsen 等[4]研究动物双歧杆菌乳亚种BB-12和副干酪乳酪杆菌CRL-341 混合菌株对健康年轻人(18~40 岁)粪便性状的影响,设置108,109,1010 CFU/d 和1011 CFU/d 4 个剂量组,持续干预3周,结果发现,摄入108 CFU/d 的混合菌株能够降低受试者粪便性状,并随益生菌剂量的增加,受试者粪便硬度呈线性显著降低。此外,益生菌发酵乳也具有改善功能性便秘的功效,患者每日饮用含1.0×105 CFU/mL 干酪乳酪杆菌 Zhang 和4.0×107 CFU/mL 动物双歧杆菌乳亚种 V9 益生菌发酵乳200 g,通过调节胃肠道菌群和代谢途径,增加排便次数,显著改善患者便秘症状[22]。
2.2 益生菌与腹泻
腹泻一般是因使用抗生素和感染致病菌等因素引起。抗生素常用于治疗感染性疾病,然而,其副作用之一是破坏肠道菌群平衡,从而引起抗生素相关性腹泻(Antibiotic associated diarrhea,AAD)症状。研究表明[26,45-47]:益生菌可通过抵抗潜在致病菌预防感染,并增强先天性和适应性免疫系统功能;益生菌也可产生有机酸,促进肠道SCFAs 生成,或降低肠道pH 值和氧水平,为产SCFAs 的细菌提供更适宜的生存环境。此外,益生菌介导的肠道电解质转运体的改变可能也是预防腹泻的有效机制之一。
在1 项临床随机三盲对照试验[26]中,接受抗生素治疗的503 例成年住院患者被随机分配到安慰剂组、低剂量组和高剂量组,3 组患者每天分别服用剂量为0,4.17×109 CFU 和1.70×1010 CFU 4株益生菌组合制剂(嗜酸乳杆菌NCFM、副干酪乳酪杆菌Lpc-37、动物双歧杆菌乳亚种Bi-07、动物双歧杆菌乳亚种Bl-04)。持续观察14 d 后,与对照组相比,摄入4.17×109 CFU 益生菌组合制剂能够减轻患者的AAD 发病症状。此外,研究发现,嗜酸乳杆菌CL1285 和干酪乳酪杆菌LBC80R 混合株能够缓解成年住院患者AAD 症状[45],与安慰剂相比,摄入5×1011 CFU/d 混合株胶囊能够降低患者AAD 发病率,即使发病,患者症状持续时间较短。研究表明[46-47]益生菌在改善儿童腹泻和艰难梭菌感染方面也显示一定的作用。在针对艰难梭菌感染治疗的荟萃研究[47]表明,摄入剂量小于1010 CFU/d 的鼠李糖乳酪杆菌GG、丁酸梭菌 588(Clostridium butyricum 588) 和代田菌(Lacticaseibacillus casei Shirota)等特定益生菌,能够改善成人和儿童艰难梭菌感染。
2.3 益生菌与肠易激综合征
肠易激综合征(Irritable bowel syndrome,IBS)作为一种多因素的胃肠道功能障碍,与肠道微生物紊乱、胃肠道通透性改变、低级别炎症、免疫反应失调等因素有关。益生菌可通过调节肠道菌群,产生抗菌物质和干扰肠黏膜黏附来调节胆汁酸代谢,促进肠道黏液分泌和肠上皮细胞连接结构关键蛋白的合成,增强上皮细胞的完整性,减少低度炎症和病原体数量,改善肠道内环境,维持肠屏障功能,调节先天性免疫和适应性免疫系统等方式,来缓解IBS 的临床症状。此外,益生菌还可能通过调节小肠中的免疫细胞群和肠道/黏膜相关的淋巴组织,通过刺激调节T 细胞来修复病原体引起的组织损伤,缓解IBS 的症状。
鼠李糖乳杆菌GG 已被证明能够有效干预儿童急性肠胃炎。研究发现,摄入鼠李糖乳杆菌GG 1010 CFU/d 能够显著减少患者腹泻持续时间和住院时间,干预效果也随剂量增加呈上升趋势[48]。在一项针对362 名成年IBS 女性患者的试验发现,干预4 周后,摄入106 CFU/d 长双歧杆菌婴儿亚种35624 能够显著改善IBS 综合症状评分,提高患者生活质量[37]。然而,另一项研究发现服用嗜酸乳杆菌NCFM 12 周后,109 CFU/d 和1010 CFU/d 两种剂量均可缓解患者中度至重度腹痛,且两组间无显著量效关系[49]。多菌株也被证明可用于缓解IBS 症状,与安慰剂相比,服用3×109~6×109 CFU/d 的植物乳植杆菌CECT7484、植物乳植杆菌CECT7485 和乳酸片球菌(Pediococcus acidilactici CECT7483),能够显著增加IBS 患者生活质量评分,改善焦虑症状[50]。另一项复合益生菌干预IBS 患者的临床研究表明[42],每日摄入1×1010 CFU 的干酪乳酪杆菌Zhang、动物双歧杆菌乳亚种V9 和植物乳植杆菌P-8 复合益生菌可显著减少部分加重肠易激综合征的细菌,缓解IBS相关症状。
3 影响益生菌摄入量与肠道健康作用的因素
3.1 不同基质形式对益生菌健康作用的影响
益生菌通常作为原料或配料添加到食品基质中,形成不同配方的食品。益生菌在不同产品中的活菌数受环境条件(温度、pH 值、水分活度、氧气含量、氧化还原电势等)、食品基质、包装材料的影响。精准计数益生菌食品在临近货架期的活菌数量,是对益生菌功能评价的重要手段。
益生菌可与食品基质中的成分相互作用,从而影响益生菌活性和健康作用的发挥[51-52]。环境条件、基质成分等可能影响益生菌功能成分的含量,从而影响菌株的功能。例如,菌体分离或喷雾干燥过程可能会降低鼠李糖乳杆菌GG 的黏附能力[53-54]。乳品中的乳清蛋白、β-乳球蛋白可与鼠李糖乳杆菌GG 的菌毛pili 结合,可能影响菌株免疫调节功能的发挥[55-56]。一项荟萃分析发现,不同菌株和不同食用配方的益生菌在临床上均表现出缓解结肠袋炎、抗生素相关腹泻、艰难梭菌相关腹泻的症状,其中鼠李糖乳杆菌GG 或布拉迪氏酵母菌在不同食品基质中的健康作用效果稳定[57]。
基于目前的研究结果表明,益生菌在不同食品基质中的添加量存在差异,一般食品基质对益生菌健康作用的发挥没有实质性影响,不同食品基质中益生菌的有效作用剂量相对稳定[57-58]。
3.2 单菌株或多菌株对益生菌健康作用的影响
目前,多菌株复配益生菌的健康作用受到广泛关注。研究发现,多菌株的效果受到配伍菌种和目标人群等因素的影响。在针对幽门螺旋杆菌感染时,使用单一益生菌菌株或4 菌株混合物均未发现显著的改善效果,而双菌株混合物使其感染得以明显缓解[59]。针对某些生理异常(如肠易激综合症、抗生素相关性腹泻、特异反应性皮炎等),多菌株混合物并未体现出比单菌株更显著的效果[60],然而,在一些疾病(比如小儿坏死性肠炎、幽门感染),益生菌组合干预具有更好的功效[61-62]。
研究表明多菌株发挥健康功效的原因可能是:
1)多菌种复合益生菌制剂可分解转化更多的营养物质(比如增加消化酶的多样性)和创造更好的微生态环境(厌氧、适宜pH),以更好维护人体肠道微生态多样性[61]。
2)菌种之间存在交叉互养行为,进而发挥了协同增效的作用[63]。普拉梭菌和青春双歧杆菌可协同增强丁酸盐的形成[64]。双歧杆菌和霍氏真杆菌的营养互作,可促进肠道中乙酸盐、丁酸盐、丙酸盐和甲酸盐的形成[65]。同一菌属之间也存在潜在的肠道共生关系,由两歧双歧杆菌引发的黏蛋白交叉互养能够促进短双歧杆菌(Bifidobacterium breve)的生长和代谢物积累[66]。
3)菌种复配丰富了其潜在的生理调节机制。与单一益生菌相比,瑞士乳杆菌和长双歧杆菌联合使用在调节糖皮质激素对HPA(下丘脑-垂体-肾上腺轴)轴的负反馈方面更有效,进而在缓解应激性内脏疼痛方面表现出更显著的效果[67]。益生菌组合相对于单一菌株,在缓解toll 样受体3(TLR3) 相关炎症和维持细胞稳态方面具有协同作用[59]。基于VSL#3 微生态制剂的研究证明,多菌株复配可以增加各类目标菌株的肠道黏附性,进而促进菌株与宿主细胞的相互作用[68]。
总体来说,益生菌的健康调节作用并不存在明显的菌株复配数量依赖性,而是受到多种因素的复杂影响(例如:益生菌菌株、饮食模式的差异、目标人群特征、干预时间等)。无论是多菌株复配增效的益生菌组合,还是单一益生菌菌株,其健康作用效果主要取决于体外试验、循证医学证据等,而不仅仅是复配菌株的数量。
4 国内外标准、法规中对益生菌摄入量的要求
益生菌的健康作用与益生菌菌株、目标人群等多种因素有关。在标准法规或行业指南中很难统一规定益生菌的推荐摄入量。目前,国内外对于益生菌产品每日推荐摄入活菌数量的要求不尽相同。
国际上,益生菌的推荐摄入量主要在107~1011 CFU/d。国际益生菌和益生元科学协会(Internatioal Scientific Associiation for Probiotics and Prebiotics,ISAPP)专家团队Binda 等[57]在益生菌应用指南中提出:目前多数研究提出益生菌的推荐量为108~1011 CFU/d。2017年,世界胃肠病学组织益生菌与益生元指南 (World Gastroenterology Organization Global Guidelineso Probiotics and Prebiotics)提出[69]:添加益生菌的产品所需剂量根据菌株和产品不同而有很大差异,在针对成年人或儿童的循证医学的证据中,大部分菌株的推荐摄入量是108~1011 CFU/d,少数菌株推荐摄入量为106~107 CFU/d。2018年,FAO/WHO 食品标准组联合国际食品法典委员会营养与特殊膳食食品委员会的讨论稿中指出:添加益生菌的食品推荐摄入活菌数要达到109 CFU/d[70]。加拿大对于非特定益生菌菌株在食品中活菌数量的最低要求达到109 CFU/份[71],而作为医药配料的特定益生菌菌株建议摄入活菌总量不得少于107 CFU/d[72]。2018年,意大利卫生部发布的《益生菌及益生元指南》[73]中提出,建议食用的益生菌产品应含有至少1 个菌株的活菌数达到109 CFU/d,当有充分的科学依据支持所使用的菌种在肠道中具有定植能力,可以降低微生物的活菌数量。2020年,中华预防医学会微生态学分会发布的《中国微生态调节剂临床应用专家共识(2020 版)》指出,益生菌的作用具有菌株特异性和剂量依赖性,益生菌的补充剂量通常限制在108~1011 CFU 的范围[74]。
5 小结与展望
综上所述,本文通过对益生菌摄入量与人体肠道健康作用研究现状的系统分析,经专家组多次讨论,形成以下六大科学观点:
1)益生菌的摄入量是其发挥健康作用的关键因素 “足够数量”是益生菌的三大核心特征之一,研究发现益生菌与对宿主的健康作用存在一定的剂量相关性。益生菌到达人体作用靶点,需要经过多个生物屏障,满足一定数量的活菌是其发挥健康作用的关键因素。益生菌相关产品中的活菌数量成为行业研发及创新过程重点关注的内容之一。
2)菌株水平活菌精准计数是度量益生菌剂量的重要技术条件 在益生菌相关产品的标签上标示益生菌在保质期内的活菌数量,已成为行业共识。根据益生菌原料的稳定性状况与生产过程中菌株的实际添加量,可初步判断产品中益生菌菌株的活菌数。采用多技术联用的菌株水平活菌精准计数,是度量益生菌剂量的重要技术手段,也是我国市场监管益生菌相关产品保质期内活菌数是否符合要求的重要依据。
3)现有研究文献及国际相关标准法规对益生菌的推荐摄入量主要集中在107~1011 CFU/d 益生菌的核心功能是改善人体肠道健康,其对肠道健康作用具有一定的剂量依赖性。益生菌应用指南、临床研究文献及国际相关标准法规中对益生菌的推荐摄入量主要集中在107~1011 CFU/d。随着益生菌在多元化产品中的创新应用及下一代益生菌的出现,明确益生菌的推荐摄入量,有利于推动益生菌行业规范化发展。
4)益生菌的健康作用剂量具有菌株差异性,添加量并非越高越好 由于益生菌功效的发挥具有菌株和人群特异性,每株益生菌的有效剂量具有差异性,有些菌株在较低剂量情况下也可以发挥健康作用,因此在益生菌菌株开发过程中应注重其生物学特性的研究,明确目标菌株在产品中的健康作用剂量,避免陷入益生菌添加量越高越好的误区。
5)益生菌在不同类型食品中的临床剂量相对稳定 食品加工方式、基质成分、贮存方式的差异会在一定程度上影响益生菌的活性。对于含益生菌的食品,有必要在产品标签标示的贮存条件下评估菌株在货架期内的稳定性。益生菌在不同食品中的添加量存在差异。基于目前研究发现,一般食品基质对益生菌健康作用的发挥并没有实质性影响,益生菌在不同类型食品中的健康作用剂量相对稳定。
6)益生菌的健康作用不存在菌株复配数量依赖性,应以菌株间互作的科学研究为基础 目前,益生菌多菌株复配的健康效应受到科技界和产业界的广泛关注。研究表明,多菌株复配的健康作用会受复配菌株和目标人群等因素的影响,并不存在明显的菌株复配数量依赖性。在益生菌菌株复配研究中须以菌株间互作的科学研究为基础,既要考虑菌株之间的交叉互养、协同增效的作用,还需充分考虑复配菌株之间是否存在竞争或拮抗关系。
顾问:
陈 卫 中国工程院院士、江南大学
邵 薇 中国食品科学技术学会
共同执笔人:
张国华 山西大学
孙志宏 内蒙古农业大学
翟齐啸 江南大学
赵 亮 中国农业大学
夏永军 上海理工大学
陈 铮 中国食品科学技术学会
罗江钊 中国食品科学技术学会
项目组专家(按姓氏汉语笔画排序):
云战友 内蒙古伊利实业集团股份有限公司
艾连中 上海理工大学
何国庆 浙江大学
张和平 内蒙古农业大学
金 苏IFF 健康与生物科技
姚 粟 中国食品发酵工业研究院
顾 青 浙江工商大学
徐 进 国家食品安全风险评估中心
董 英 江苏大学
[1]NATIONS F,ORGANIZATION W H.Probiotics in food - Health and nutritional properties and guidelines for evaluation[M].Food and Agriculture Organization of the United Nations,2006:1-3.
[2]中国食品科学技术学会益生菌分会.益生菌的科学共识 (2020年版)[J].中国食品学报,2020,20(5):303-307.
Probiotics Society of the Chinese institute oof Food Science and Technology.Scientific consensus of probiotics (2020)[J].Journal of Chinese Institute Food Science and Technology,2020,20(5):303-307.
[3]OUWEHAND A C.A review of dose-responses of probiotics in human studies[J].Beneficial Microbes,2017,8(2):143-151.
[4]LARSEN C N,NIELSEN S,KAESTEL P,et al.Dose-response study of probiotic bacteria Bifidobacterium animalis subsp.lactis BB-12 and Lactobacillus paracasei subsp.paracasei CRL-341 in healthy young adults[J].European Journal of Clinical Nutrition,2006,60(11):1284-1293.
[5]MINELLI E B,BENINI A.Relationship between number of bacteria and their probiotic effect[J].Microbial Ecology in Health and Disease,2008,20(4):180-183.
[6]中华人民共和国国家卫生和计划生育委员会,国家食品药品监督管理总局.食品安全国家标准 食品微生物学检验 乳酸菌检验:GB 4789.35-2016[S].北京:中国标准出版社,2016:1-8.
National Health Commission of the People’s Republic of China,State Administration for Market Regulation.National food safety standard,Microbiological examination of Lactic Acid Bacteria:GB 4789.35-2016[S].Beijing:China Standards Press,2016:1-8.
[7]中华人民共和国国家卫生和计划生育委员会.乳及乳制品发酵剂、发酵产品中乳酸菌计数 流式细胞仪法:SN/T 5436-2022[S].北京:中国标准出版社,2022:1-4.
National Health Commission of the People’s Republic of China.Enumeration of lactic acid bacteria in milk and dairy starter,fermented products by flow cytometry:SN/T 5436-2022[S].Beijing:China Standards Press,2022:1-4.
[8]International Organization for Standardization.Milk and milk products — Starter cultures,probiotics and fermented products — Quantification of lactic acid bacteria by flow cytometry:ISO 19344:2015[S].Switzerland,2015.https://www.iso.org/obp/ui/#iso:std:iso:19344:ed-1:v1:en.
[9]International Organization for Standardization.Fermented milk products -Bacterial starter cultures -Standard of identity ISO 27205:2010[S].Switzerland,2010,https://www.iso.org/obp/ui/#iso:std:iso:27205:ed-1:v1:en.
[10]International Organization for Standardization.Yogurt- Enumeration of characteristic microorganisms -Colony count technique at 37 degrees C,ISO 7889:2003[S].Switzerland,2003,https://www.iso.org/obp/ui/#iso:std:iso:7889:ed-1:v1:en.
[11]International Organization for Standardization.Milk,milk products and mesophilic starter cultures -Enumeration of citrate-fermenting lactic acid bacteria- Colony count technique at 25 degrees C,ISO 17792:2006 [S].Switzerland,2006,https://www.iso.org/obp/ui/#iso:std:iso:17792:ed-1:v1:en.
[12]中华人民共和国国家卫生和计划生育委员会,国家食品药品监督管理总局.食品安全国家标准 食品微生物学检验 双歧杆菌检验:GB 4789.34-2016[S].北京:中国标准出版社,2016:1-10.
National Health Commission of the People’s Republic of China,State Administration for Market Regulation.National food safety standard,Microbiological examination of Bifidobacterium:GB 4789.34-2016[S].Beijing:China Standards Press,2016:1-10.
[13]International Organization for Standardization.Milk products - Enumeration of presumptive Bifidobacteria- Colony count technique at 37 degrees C:ISO 29981:2010[S].Switzerland,2010.https://www.iso.org/obp/ui/#iso:std:iso:29981:ed-1:v1:en.
[14]International Organization for Standardization.Milk products - Enumeration of presumptive Lactobacillus acidophilus on a selective medium - Colony-count technique at 37 degrees C:ISO 20128:2006[S].Switzerland,2006.https://www.iso.org/obp/ui/#iso:std:iso:20128:ed-1:v1:en.
[15]中华人民共和国国家卫生和计划生育委员会.食品微生物学检验 霉菌和酵母计数:GB 4789.15-2016[S].北京:中国标准出版社,2016:1-5.
National Health Commission of the People’s Republic of China.Microbiological examination of moulds and yeasts:GB 4789.15-2016[S].Beijing:China Standards Press,2016:1-5.
[16]吉林省质量技术监督局.保健用品微生物检验方法第5 部分:霉菌和酵母菌数测定:DB22/T 394.5-2017[S].吉林省卫生和计划生育委员会,2017:1-10.
Jilin Provincial Bureau of quality and technical supervision.Microbiological examine method for health care material Part 5:Determination of molds and yeast count:DB22/T 394.5-2017[S].Health Commission of Jilin Province,2017:1-10.
[17]YANG Y,LIU Y R,SHU Y H,et al.Modified PMA-qPCR method for rapid quantification of viable Lactobacillus spp.in fermented dairy products[J].Food Analytical Methods,2021,14(9):1908-1918.
[18]MOROVIC W,HIBBERD A A,ZABEL B,et al.Genotyping by PCR and high-throughput sequencing of commercial probiotic products reveals composition biases[J].Frontiers in Microbiology,2016,7(11):1-11.
[19]RAYMOND Y,CHAMPAGNE C P.The use of flow cytometry to accurately ascertain total and viable counts of Lactobacillus rhamnosus in chocolate[J].Food Microbiology,2015,46(4):176-183.
[20]YEUN Y,LEE J.Effect of a double-coated probiotic formulation on functional constipation in the elderly:A randomized,double blind,controlled study[J].Archives of Pharmacal Research,2015,38(7):1345–1350.
[21]OJETTI V,IANIRO G,TORTORA A,et al.The effect of Lactobacillus reuteri supplementation in adults with chronic functional constipation:A randomized,double-blind,placebo-controlled trial[J].Journal of Gastrointestinal &Liver Diseases JGLD,2014,23(4):387-391.
[22]WANG J C,BAI X Y,PENG C T,et al.Fermented milk containing Lactobacillus casei Zhang and Bifidobacterium animalis ssp.lactis V9 alleviated constipation symptoms through regulation of intestinal microbiota,inflammation,and metabolic pathways - ScienceDirect[J].Journal of Dairy Science,2020,103(12):11025-11038.
[23]HEMPEL S,NEWBERRY S J,MAHER A R,et al.Probiotics for the prevention and treatment of antibiotic-associated diarrhea:A systematic review and meta-analysis[J].Jama the Journal of the American Medical Association,2012,307(18):1959-1969.
[24]SZAJEWSKA H,KOŁODZIEJ M.Systematic review with meta-analysis:Saccharomyces boulardii in the prevention of antibiotic-associated diarrhoea[J].Alimentary Pharmacology &Therapeutics,2015,42(7):793-801.
[25]CIMPERMAN L,BAYLESS G,BEST K,et al.A randomized,double-blind,placebo-controlled pilot study of Lactobacillus reuteri ATCC 55730 for the prevention of antibiotic-associated diarrhea in hospitalized adults[J].Journal of Clinical Gastroenterology,2011,45(9):785-789.
[26]OUWEHAND A C,CAI D L,XU W J,et al.Probiotics reduce symptoms of antibiotic use in a hospital setting:A randomized dose response study[J].Vaccine,2014,32(4):458-463.
[27]KONING C J,JONKERS D M,STOBBERINGH E E,et al.The effect of a multispecies probiotic on the intestinal microbiota and bowel movements in healthy volunteers taking the antibiotic amoxycillin[J].American Journal of Gastroenterology,2008,103(1):178-89.
[28]JOHNSON S,MAZIADE P J,MCFARLAND L V,et al.Is primary prevention of Clostridium difficile infection possible with specific probiotics?[J].International Journal of Infectious Diseases,2012,16(11):e786-e792.
[29]GOLDENBERG J Z,MA S S,SAXTON J D,et al.Probiotics for the prevention of Clostridium difficile-associated diarrhea in adults and children[J].Cochrane Database of Systematic Reviews,2013(5):1-110.
[30]LAHTINEN S J,FORSSTEN S,AAKKO J,et al.Probiotic cheese containing Lactobacillus rhamnosus HN001 and Lactobacillus acidophilus NCFM modifies subpopulations of fecal lactobacilli and Clostridium difficile in the elderly[J].Age,2012,34(1):133-143.
[31]PLUMMER S,WEAVER M A,HARRIS J C,et al.Clostridium difficile pilot study:Effects of probiotic supplementation on the incidence of C.difficile diarrhoea[J].International Microbiology,2004,7(1):59-62.
[32]GUGLIELMETTI S,MORA D,GSCHWENDER M,et al.Randomised clinical trial:Bifidobacterium bifidum MIMBb75 significantly alleviates irritable bowel syndrome and improves quality of life--a doubleblind,placebo-controlled study[J].Alimentary Pharmacology &Therapeutics,2011,33(10):1123-1132.
[33]DUCROTTÉ P,SAWANT P,JAYANTHI V.Clinical trial:Lactobacillus plantarum 299v (DSM 9843)improves Symptoms of irritable bowel syndrome[J].World Journal of Gastroenterology,2012,18(30):4012-4018.
[34]FORD A C,QUIGLEY E M M,LACY B E,et al.Efficacy of prebiotics,probiotics,and synbiotics in irritable bowel syndrome and chronic idiopathic constipation:Systematic review and Meta-analysis[J].American Journal of Gastroenterology,2014,109(10):1547-1561.
[35]JAFARI E,VAHEDI H,MERAT S,et al.Therapeutic effects,tolerability and safety of a multistrain probiotic in Iranian adults with irritable bowel syndrome and bloating[J].Archives of Iranian Medicine,2014,17(7):466-470.
[36]CHANG H C,SUN Y J,PARK H J,et al.A randomized,double-blind,placebo-controlled multicenter trial of saccharomyces boulardii in irritable bowel syndrome:Effect on quality of life[J].Journal of Clinical Gastroenterology,2011,45(8):679-683.
[37]WHORWELL P J,ALTRINGER L,MOREL J,et al.Efficacy of an encapsulated probiotic Bifidobacterium infantis 35624 in women with irritable bowel syndrome[J].American Journal of Gastroenterology,2006,101(7):1581-1590.
[38]GUYONNET D,CHASSANY O,DUCROTTE P,et al.Effect of a fermented milk containing Bifidobacterium animalis DN-173 010 on the health-related quality of life and symptoms in irritable bowel syndrome in adults in primary care:A multicentre,randomized,double-blind,controlled trial[J].Alimentary Pharmacology &Therapeutics,2007,26(3):475-486.
[39]AGRAWAL A,HOUGHTON L A,MORRIS J,et al.Clinical trial:The effects of a fermented milk product containing Bifidobacterium lactis DN -173 010 on abdominal distension and gastrointestinal transit in irritable bowel syndrome with constipation[J].Alimentary Pharmacology &Therapeutics,2009,29(1):104-114.
[40]KAJANDER K,MYLLYLUOMA E,RAJILI-STOJANOVI M,et al.Clinical trial:Multispecies probiotic supplementation alleviates the symptoms of irritable bowel syndrome and stabilizes intestinal microbiota[J].Alimentary Pharmacology &Therapeutics,2010,27(1):48-57.
[41]LORENZO-ZUNIGA V,LLOP E,SUÁREZ C,et al.I.31,a new combination of probiotics,improves irritable bowel syndrome-related quality of life[J].World Journal of Gastroenterology,2014,20(26):8709-8716.
[42]XU H Y,MA C,ZHAO F Y,et al.Adjunctive treatment with probiotics partially alleviates symptoms and reduces inflammation in patients with irritable bowel syndrome[J].European Journal of Nutrition,2021,60(5):2553-2565.
[43]MILLER L E,ZIMMERMANN A K,OUWEHAND A C,et al.Contemporary meta-analysis of shortterm probiotic consumption on gastrointestinal transit[J].World Journal of Gastroenterology,2016,22(21):5122-5131.
[44]WALLER P A,GOPAL P K,LEYER G J,et al.Dose -response effect of Bifidobacterium lactis HN019 on whole gut transit time and functional gastrointestinal symptoms in adults[J].Scandinavian Journal of Gastroenterology,2011,46(9):1057-1064.
[45]GAO X W,MUBASHER M,FANG C Y,et al.Dose-response efficacy of a proprietary probiotic formula of Lactobacillus acidophilus CL1285 and Lactobacillus casei LBC80R for antibiotic-associated diarrhea and Clostridium difficile-associated diarrhea prophylaxis in adult patients[J].American Journal of Gastroenterology,2010,105(7):1636-1641.
[46]URBANSKA M,GIERUSZCZAK-BIAŁEK D,SZYMAN SKI H,et al.Effectiveness of Lactobacillus reuteri DSM 17938 for the prevention of nosocomial diarrhea in children:A randomized,double-blind,placebo-controlled trial[J].The Pediatric Infectious Disease Journal,2016,35(2):142-145.
[47]MCFARLAND L V.Probiotics for the primary and secondary prevention of C.difficile infections:A Meta-analysis and systematic review[J].Antibiotics,2015,4(2):160-178.
[48]SZAJEWSKA H,SKÓRKA A,RUSZCZYNSKI M,et al.Meta-analysis:Lactobacillus GG for treating acute gastroenteritis in children--updated analysis of randomised controlled trials[J].Alimentary Pharmacology &Therapeutics,2013,38(5):467-476.
[49]LYRA A,HILLILÄ M,HUTTUNEN T,et al.Irritable bowel syndrome symptom severity improves equally with probiotic and placebo[J].World Journal of Gastroenterology,2016,22(48):10631-10642.
[50]LORENZO-ZUÑIGA V,LLOP E,SUÄREZ C,et al.I.31,A new combination of probiotics,improves irritable bowel syndrome-related quality of life[J].World Journal of Gastroenterology,2014,20(26):8709-8716.
[51]FLACH J,MARK V D W,MAURITS V D N,et al.The underexposed role of food matrices in probiotic products:Reviewing the relationship between carrier matrices and product parameters[J].Critical Reviews in Food Science and Nutrition,2018,58(15):2570-2584.
[52]CUNNINGHAM M,VINDEROLA G,CHARALAMPOPOULOS D,et al.Applying probiotics and prebiotics in new delivery formats-Is the clinical evidence transferable?[J].Trends in Food Science &Technology,2021,112:495-506.
[53]TRIPATHI M K,GIRI S K.Probiotic functional foods:Survival of probiotics during processing and storage[J].Journal of Functional Foods,2014,9:225-241.
[54]KIEKENS S,VANDENHEUVEL D,BROECKX G,et al.Impact of spray-drying on the pili of Lactobacillus rhamnosus GG[J].Microbial Biotechnology,2019,12(5):849-855.
[55]GUERIN J,BACHAROUCHE J,BURGAIN J,et al.Pili of Lactobacillus rhamnosus GG mediate interaction with β-lactoglobulin[J].Food Hydrocolloids,2016,58:35-41.
[56]BURGAIN J,SCHER J,LEBEER S,et al.Impacts of pH-mediated EPS structure on probiotic bacterial pili-whey proteins interactions [J].Colloids and Sur faces B:Biointerfaces,2015,134:332-338.
[57]BINDA S,HILL C,JOHANSEN E,et al.Criteria to qualify microorganisms as "probiotic" in foods and dietary supplements [J].Frontiers in Microbiology,2020,11:1-9.
[58]SANDERS M E,KLAENHAMMER T R,OUWEHAND A C,et al.Effects of genetic,processing,or product formulation changes on efficacy and safety of probiotics[J].Annals of the New York Academy of Sciences,2014,1309(1):1-18.
[59]MACPHERSON C W,SHASTRI P,MATHIEU O,et al.Genome-wide immune modulation of TLR3-mediated inflammation in intestinal epithelial cells differs between single and multi -strain probiotic combination[J].PLoS One,2017,12(1):1-18.
[60]MCFARLAND L V.Efficacy of single-strain probiotics versus multi-strain mixtures:Systematic review of strain and disease specificity[J].Digestive Disease and Sciences,2021,66(3):694-704.
[61]KWOJI I D,AIYEGORO O A,OKPEKU M,et al.Multi-strain probiotics:Synergy among isolates enhances biological activities[J].Biology (Basel),2021,10(4):322-342.
[62]CHANG H Y,CHEN J H,CHANG J H,et al.Multiple strains probiotics appear to be the most effective probiotics in the prevention of necrotizing enterocolitis and mortality:An updated meta-analysis[J].The Piblic Library of Science One,2017,12(2):e0171579-23.
[63]BÖGER M,LAMMERTS VAN BUEREN A,DIJKHUIZEN L.Cross-feeding among probiotic bacterial strains on prebiotic inulin involves the extracellular exo-inulinase of Lactobacillus paracasei strain W20 [J].Applied and environmental microbiology,2018,84(21):e01539-18.
[64]RIOS-COVIAN D,GUEIMONDE M,DUNCAN S H,et al.Enhanced butyrate formation by crossfeeding between Faecalibacterium prausnitzii and Bifidobacterium adolescentis[J].FEMS Microbiology Letters,2015,362(21):1-7.
[65]BUNESOVA V,LACROIX C,SCHWAB C.Mucin Cross-Feeding of Infant Bifidobacteria and Eubacterium hallii[J].Microbial Ecology,2018,75(1):228-238.
[66]EGAN M,MOTHERWAY M O,KILCOYNE M,et al.Cross-feeding by Bifidobacterium breve UCC2003 during co-cultivation with Bifidobacterium bifidum PRL2010 in a mucin-based medium[J].BMC Microbiology,2014,14:1-14.
[67]AIT-BELGNAOUI A,PAYARD I,ROLLAND C,et al.Bifidobacterium longum and Lactobacillus helveticus synergistically suppress stress-related visceral hypersensitivity through hypothalamic -pituitary -adrenal axis modulation[J].Journal of Neurogastroenterology and Motility,2018,24(1):138-146.
[68]DOUILLARD F P,MORA D,EIJLANDER R T,et al.Comparative genomic analysis of the multispecies probiotic-marketed product VSL#3[J].PLoS One,2018,13(2):1-19.
[69]World Gastroenterology Organisation.World Gastroenterology Organisation Global Guidelines:Probiotics and prebiotics[EB/OL].(2017-02)[2020-04-10].https://www.worldgastroenterology.org/guidelines/globalguidelines/probiotics -and -prebiotics/probiotics -and -prebiotics-english ebiotics-english.
[70]Codex Alimentarius Commission.Discussion Paper on Harmonized Probiotic Guidelines for Use in Foods and Dietary Supplements[EB/OL].(2018-11)[2022-06-10]https://www.fao.org/fao-who-codexalimentarius/meetings/detail/ru/?meeting=CCNFSDU&session=39.
[71]Health Canada.Accepted claims about the nature of probiotic microorganisms in food.[EB/OL].(2009-04)[2022-06-10]https://www.canada.ca/en/health-canada/services/food-nutrition/food-labelling/health-claims/accepted-claims-about-nature-probiotic-microorganisms-food.html.
[72]Health Canada.Natural health product probiotics[EB/OL].(2021-11-11)[2022-06-10]http://webprod.hcsc.gc.ca/nhpid-bdipsn/atReq.do?atid=probio&lang=eng.
[73]per la nutrizione e la dietetica.Guidelines on probiotics and prebiotics.Ministero della Salute[EB/OL].(2018)[2022-06-10].https://www.salute.gov.it/imgs/C_17_pubblicazioni_1016_allegato.pdf.
[74]中华预防医学会微生态学分会.中国微生态调节剂临床应用专家共识(2020 版)[J].中国微生态学杂志,2020,32(8):953-965.
Chinese Society of Microecology,Chinese Preventive Medicine Association.Chinese expert consensus on clinical application of microecological agents (2020 version)[J].Chinese Journal of Microecology,2020,32(8):953-965.