抗性淀粉 (Resistant starch,RS) 作为益生元,被誉为影响人体健康的“第七大营养因素”,具有可被以双歧杆菌为主的结肠细菌选择性利用而降解为短链脂肪酸等代谢产物的特性[1]。在Englyst 对淀粉的经典分类中,抗性淀粉被定义为“在37 ℃消化酶体系培养120 min 时仍存在非水解残基的淀粉部分”[2],这也是目前大多数III 型抗性淀粉(RS3)制备时酶解纯化步骤普遍参考的方法[3-4]。然而,在多营养素及不同加工方式的食物体系中,淀粉的来源和分布,人体的咀嚼和胃肠道转运时间,以及体内消化酶分泌情况等均存在个体差异,表明这种受时间限定的“抗性”存在相对性[5]。研究表明,在用人工胃液和肠液消化处理后,马铃薯抗性淀粉的结构越来越疏松,大块晶体多转变为小颗粒并进一步裂化成具有较大比表面积和堆积密度的结构[4]。该过程发生在抗性淀粉经120 min 初次酶解制备后的二次消化阶段,说明在动物消化道中,初次酶解后的抗性淀粉仍可能因胃肠液作用而导致部分晶体结构发生变化,对其消化后构效关系的研究将更有助于抗性淀粉的开发和利用。
抗性淀粉是肠道细菌的碳源物质,其晶体结构与促进细菌增殖的能力相关。其中,RS3 比RS2更有利于细菌的发酵[6],对双歧杆菌、嗜酸乳杆菌、保加利亚乳杆菌和乳链球菌4 种益生菌最适添加量和最大促增殖水平的影响显著不同[7]。与A 型相比,B 型RS3 还可将近段结肠中双歧杆菌的数量维持在更高的水平,并生成更多的丁酸盐产物[8]。在细菌对植物多糖的降解过程中,菌体与作用底物之间的接触性黏附被认为是首要条件[9]。淀粉结构对细菌增殖水平产生影响的原因,很可能与二者之间的黏附能力相关。RS3 表面的粗糙沟壑状表面和空腔凹陷可能具有黏附双歧杆菌的作用[10]。这种黏附作用不仅可以提高菌体的胆盐耐受性,而且还通过碳源利用实现促进菌株增殖的目的[3]。
莲子淀粉(Lotus seed starch)中直链淀粉含量高达40%左右,是制备RS3 的良好原料[11]。与其它植物来源抗性淀粉的形成机制和结构特性类似,莲子淀粉糊化后,其直链淀粉聚合物发生回生反应,形成莲子抗性淀粉(LRS3),具有由氢键连接的稳定双螺旋结构、B 型晶体特征和很高的热稳定性[3]。压热、微波和超声波压热等不同制备方法导致LRS3 产生结构差异[12]。该阶段LRS3 还具有比其它碳源(高直链玉米淀粉、葡萄糖等)更好的促双歧杆菌增殖效果,推测这可能与其结构特性有关。消化后LRS3 的结构变化以及对双歧杆菌增殖和黏附的影响尚未见报道。
本研究通过物性结构测定技术比较微波法和水浴法制备的两种LRS3 在体外模拟消化过程中的结构变化规律,阐明各消化阶段LRS3 对短双歧杆菌的促增殖能力和黏附能力,探讨由体外消化环境介导的LRS3 结构变化对短双歧杆菌增殖的影响,以了解抗性淀粉在体内的转化过程。
1 材料与方法
1.1 材料与试剂
鲜莲,由绿田(福建)食品有限公司提供,产自福建建宁。
短双歧杆菌(Bifidobacterium breve,B.breve),德国DSMZ 微生物菌种保藏中心。
葡萄糖(GLU)基础培养基、高直链玉米淀粉(HAMS) 基础培养基、耐热α-淀粉酶,美国ANKOM 科技公司;糖化酶、胃蛋白酶、胰酶,美国Sigma 公司;其它试剂均为国产分析纯级。
1.2 莲子抗性淀粉的制备和纯化
1) 微波法制备莲子抗性淀粉 (Microwavepower LRS3,MP-LRS3) 将150 g 鲜莲破碎后分散于1 L 蒸馏水中,将淀粉悬浮液在微波功率640 W 下加热3 min,冷却至室温后,4 ℃下保存24 h。随后,将糊化淀粉置于50 ℃烘箱中干燥6 h,80 μm 筛网过筛,根据Zhang 等[3]的方法纯化。
2) 水浴法制备莲子抗性淀粉 (Water-bath LRS3,WB-LRS3) 将300 g 鲜莲破碎后分散于1 L 蒸馏水中,将淀粉悬浮液在80 ℃水浴锅中隔水放置20 min。冷却、干燥和纯化步骤同MPLRS3 制备方法。
1.3 体外消化过程
1) 唾液消化 将0.16 g NaCl,0.02 g KCl 和0.02 g α-淀粉酶加至100 mL PBS 缓冲液(10 mmol/L,pH 7.0)中制成模拟唾液。将未经消化的两种LRS3(MP-LRS3-0 与WB-LRS3-0)分别与唾液以质量比1 ∶1 混合后,37 ℃摇床振荡5 min(100 r/min),离心处理(4 000×g,10 min),热风干燥2 h 后取LRS3 样记为MP-LRS3-1 与WBLRS3-1,剩余混合液继续胃液消化试验。
2) 胃液消化[13-15] 将0.32%胃蛋白酶和0.2% NaCl 溶解于10 mmol/L PBS 缓冲液(pH 2.5)中制成模拟胃液。将唾液完成样与胃液以质量比1∶1 混合后,37 ℃摇床振荡4 h (100 r/min),离心(4 000×g,10 min),热风干燥2 h 后取LRS3样记为MP-LRS3-2 与WB-LRS3-2,剩余混合液用于小肠液消化试验。
3) 小肠液消化[13-15] 将1 g 猪胰α-淀粉酶(24 U/mg) 溶于100 mL 醋酸钠-盐酸缓冲液(0.1 mol/L,pH 5.2) 中制成胰酶液。将2 g 糖化酶(105 U/g) 溶于相同缓冲液后移入25 mL 容量瓶中摇匀、定容,纱布过滤后滤液为糖化酶液。将0.4 g 胆盐溶于10 mL 醋酸钠-盐酸缓冲液 (0.1 mol/L,pH 5.2)中制成胆盐溶液。然后,将胰酶液、糖化酶液和胆盐溶液以质量比16 ∶2 ∶1 的比例混合制成模拟小肠液。取8 mL 小肠液转入同体积含LRS3的胃液完成样中,混合物于37 ℃摇床振荡16 h(100 r/min)后离心处理(4 000×g,10 min),热风干燥2 h 后取LRS3 样记为MP-LRS3-3 与WBLRS3-3。
1.4 各消化阶段LRS3 结构测定
以上各消化阶段LRS3 的环境扫描电镜(Environmental scanning electron microscope,ESEM)观察、固态13C-NMR 核磁共振扫描和X-射线衍射测定参照Zhang 等[3]的方法。
1.5 各消化阶段LRS3 源培养基厌氧发酵短双歧杆菌
分别配制碳源质量浓度为20 g/L 的GLU 基础培养基、HAMS 基础培养基和各消化阶段LRS3试验培养基,均为以TPY 培养基为基础,将其中碳源分别以GLU、HAMS 和LRS3 替代。将短双歧杆菌以体积分数2%接种后置37 ℃恒温培养箱中厌氧培养36 h,在培养过程中定时取样,测定其在波长600 nm 处的吸光值。
1.6 各消化阶段LRS3 与短双歧杆菌的黏附能力测定
将对数期短双歧杆菌菌体用10 mL 0.1 mol/L PBS 缓冲液(pH 7.0)洗涤2 次,重悬于相同缓冲液中至细胞终浓度为107 CFU/mL。取其中2 mL 细胞重悬液与LRS3 重悬液(10 g/L,所用PBS 缓冲液条件同上)在直径1 cm 试管中同体积混匀,室温静置1 h,至淀粉沉淀后,在液面下0.5 cm 处吸取两份150 μL 样液,用酶标仪测定波长540 nm 处的吸光值,以PBS 为空白对照。为计算黏附于淀粉上而后共沉淀于试管底部的细胞比例,将上述吸光值结果与以下两个对照试管中的样品OD540nm 值作比较:1)不添加淀粉的细菌重悬液;2)不添加细菌的淀粉重悬液。黏附于抗性淀粉上细菌比例的计算公式[16]:
式中:a——既有抗性淀粉又有细菌的吸光值;b——有抗性淀粉而无细菌的吸光值;c——无抗性淀粉而有细菌的吸光值。
1.7 数据统计分析
所有样品检测试验重复3 次,取平均值。采用MDI Jade 6.5 和Peakfit 4.12 进行图谱分析,Origin 8.5 绘制图像,DPS 9.0 进行数据处理分析。
2 结果与分析
2.1 LRS3 在体外消化后的ESEM 观察结果
由ESEM 结果(图1和图2)可知,MP-LRS3和WB-LRS3 经消化液作用后均发生明显的形态变化。消化前,MP-LRS3-0 颗粒呈薄片堆积的片层结构,表面较粗糙(图1a)。这是因为受微波辐照后的淀粉分子在冷却过程中,直链淀粉分子相互靠近形成新的双螺旋并沉降,而且纯化作用加速了无定形部分的酶解,剩下高度结晶的直链淀粉[17]。WB-LRS3-0 片层特性虽不明显,但也呈较大粒径的晶体形态(图2a)。
随着消化的进行,各阶段MP-LRS3 和WBLRS3 颗粒的尺寸均呈明显渐小趋势,晶体层崩裂解体,棱角逐渐圆润;在模拟胃液和小肠液作用阶段均可看出,晶体表面出现凹坑,且蜂窝状孔洞的数量逐渐增加(图1c 和d,图2c 和d),这些可能是由于消化酶或酸性消化液导致抗性淀粉结构解聚。此外,从图1和图2中还可看出,MP-LRS3 与相同消化阶段的WB-LRS3 相比,颗粒粒径普遍偏小,且晶体表面片层更多,说明MP-LRS3 在消化环境中更易发生结构性解聚[18]。

图1 各消化阶段MP-LRS3 环境扫描电镜照片
Fig.1 ESEM micrographs of MP-LRS3 at each digestive stage

图2 各消化阶段WB-LRS3 环境扫描电镜照片
Fig.2 ESEM micrographs of WB-LRS3 at each digestive stage
2.2 LRS3 在体外消化后的X-射线衍射结果
抗性淀粉的结构包括结晶区和无定形区,其中结晶区又可分为微晶区和亚微晶区[19]。结晶区主要由直链淀粉双螺旋叠加而成,无定形区主要由无序淀粉组成[20]。由于淀粉的结构解聚通常始于无定形区而非亚微晶区[21],因此LRS3 的形态变化主要为消化液对其无定形区的作用。由图3可以看出,MP-LRS3-0 和WB-LRS3-0 表现出相似的图谱趋势,表明微波法和水浴法LRS3 具有相似的晶体结构,且分别在2θ 为17°,22°,19.77°和25.60°时出现馒头峰,均为B-型晶体[22]。经消化后,MP-LRS3-1 和WB-LRS3-1 仍为B-型结晶;而MP-LRS3-2、MP-LRS3-3 和WB-LRS3-2 和WB-LRS3-3 分别在2θ 为11.62°,22°,23.26°,29°,31°和35°时出现尖锐的衍射峰,这可能是消化液中的有机物、盐等物质,也有可能为消化过程中游离的直链淀粉单螺旋在体系中发生分子间双螺旋重排,以结晶形式对消化具有高抗性,从而成为RS 一部分[23-24]。
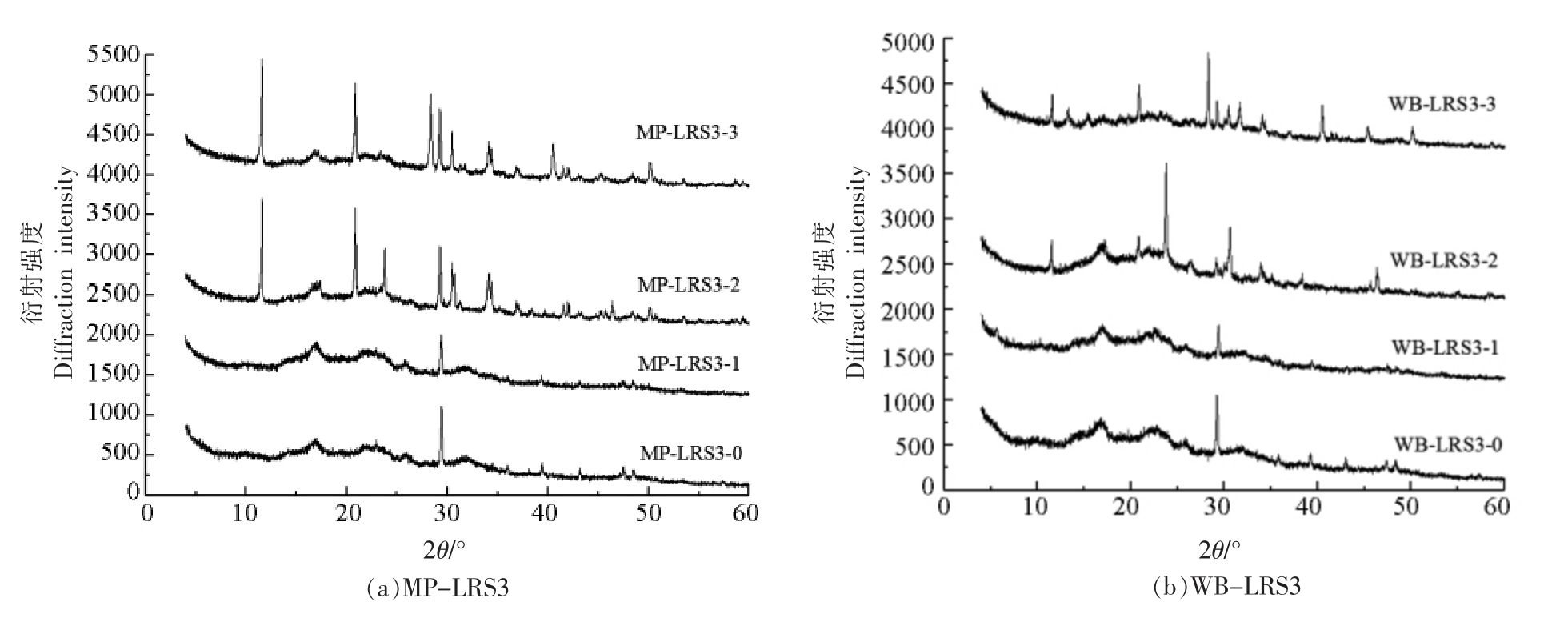
图3 各消化阶段MP-LRS3(a)和WB-LRS3(b)的X-射线衍射图谱
Fig.3 X-ray diffractogram characteristics of MP-LRS3 (a) and WB-LRS3 (b) at each digestive stage
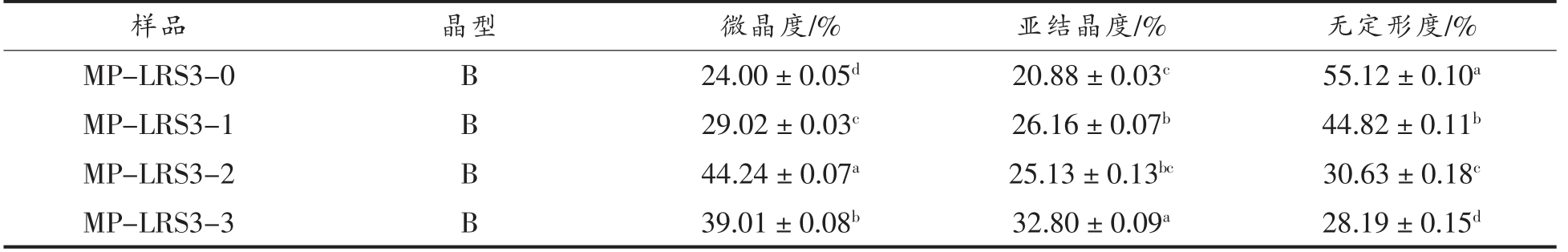
随着消化的进行,MP-LRS3 和WB-LRS3 呈结晶度整体上升、无定形度整体下降趋势(表1和表2),其中MP-LRS3 微晶度普遍高于WBLRS3,说明MP-LRS3 的结构比WB-LRS3 更稳定[18]。抗性淀粉的抗酶解能力主要来自支链淀粉晶体,消化酶水解MP-LRS3 的无定形区,使其直链淀粉溶出,体系中的直链淀粉含量增加[25]。胃肠液消化后MP-LRS3 微晶度与亚结晶度有较大提高,说明经胃液强酸环境的侵蚀与分散,肠液的作用被进一步增强,淀粉中无定形区的结构被完全破坏,体系中支链淀粉含量增大,从而增加了淀粉的结晶度。此外游离的直链淀粉单螺旋重排并聚集为更稳定的双螺旋结构[18]。然而,WB-LRS3-3 的无定形度高于WB-LRS3-2,小肠阶段的亚结晶度不升反降,说明小肠液作用阻碍了WB-LRS3 完全结晶的生长[18],这可能与二者制备方式不同导致的空间结构差异有关。
表1 各消化阶段MP-LRS3 结晶特性
Table 1 Crystallinity characteristics of MP-LRS3 at each digestive stage
?
表2 各消化阶段WB-LRS3 结晶特性
Table 2 Crystallinity characteristics of WB-LRS3 at each digestive stage

?
2.3 LRS3 在体外消化后的核磁共振检测结果
由X-射线衍射结果可知,MP-LRS3-0 与WB-LRS3-0 具有相似的波谱特征,然而,经消化处理后二者的结晶度和无定形度却呈现不同的变化趋势。本研究通过核磁共振扫描技术研究此过程中MP-LRS3 和WB-LRS3 的内部结构变化(图4)。淀粉晶体结构的改变主要是由CH 和CH2 基团分子间移动,以及直链和支链淀粉不同的葡萄糖残基分布引起的[26-27]。碳化学位移在106~96 处晶体峰与葡萄糖单元C1 有关,位移的多样性反映淀粉结晶度和双螺旋对称性,B-型晶体在101 和100 处有两个C1 共振峰;72~76 范围的峰与C2、C3、C5 的无序结构有关,主要表示直链淀粉残基形成的B-型双螺旋结构;79~85 范围的峰与C4有关,若82 处出现宽共振,表明无定形区增加;59~62 范围的峰与C6 有关[26,28]。
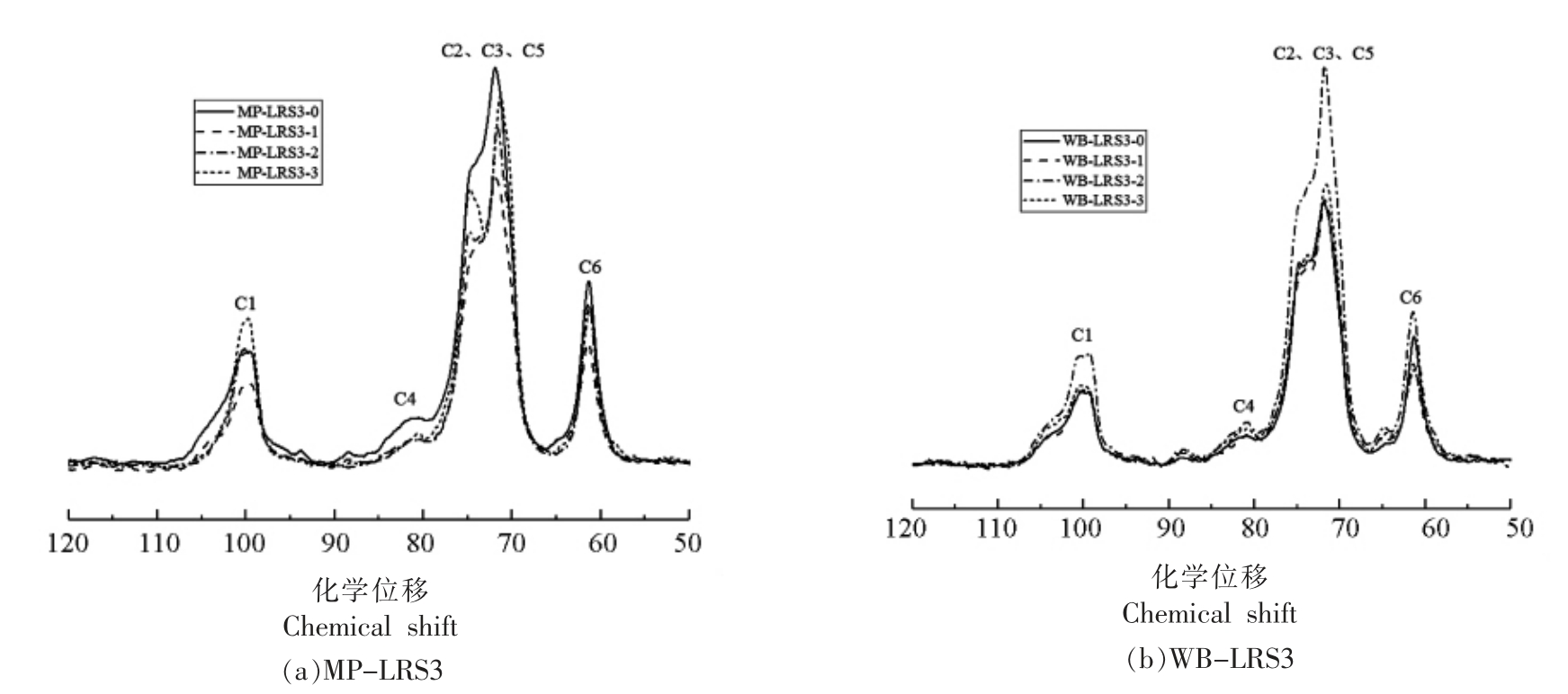
图4 各消化阶段MP-LRS3(a)和WB-LRS3(b)的CP/MPS 核磁共振扫描波谱
Fig.4 CP/MPS NMR spectra of MP-LRS3 (a) and WB-LRS3 (b) at each digestive stage
由表3和表4可知,MP-LRS3 和WB-LRS3的C1 位均显示多重共振峰 (除MP-LRS3-3 和WB-LRS3-3),为典型的B-型晶体特征;且两者的相对结晶度随消化过程的进行而增大,变化趋势分别呈先降后升和先降后升再降,这与X-射线衍射结果一致。而MP-LRS3-3 和WB-LRS3-3 在C1 位仅出单峰(100.03),说明形成更稳定的晶体结构[18,29],这与X-衍射结果一致。
表3 各消化阶段MP-LRS3 的化学位移和相对结晶度
Table 3 Chemical shifts and relative crystallinity of MP-LRS3 at each digestive stage
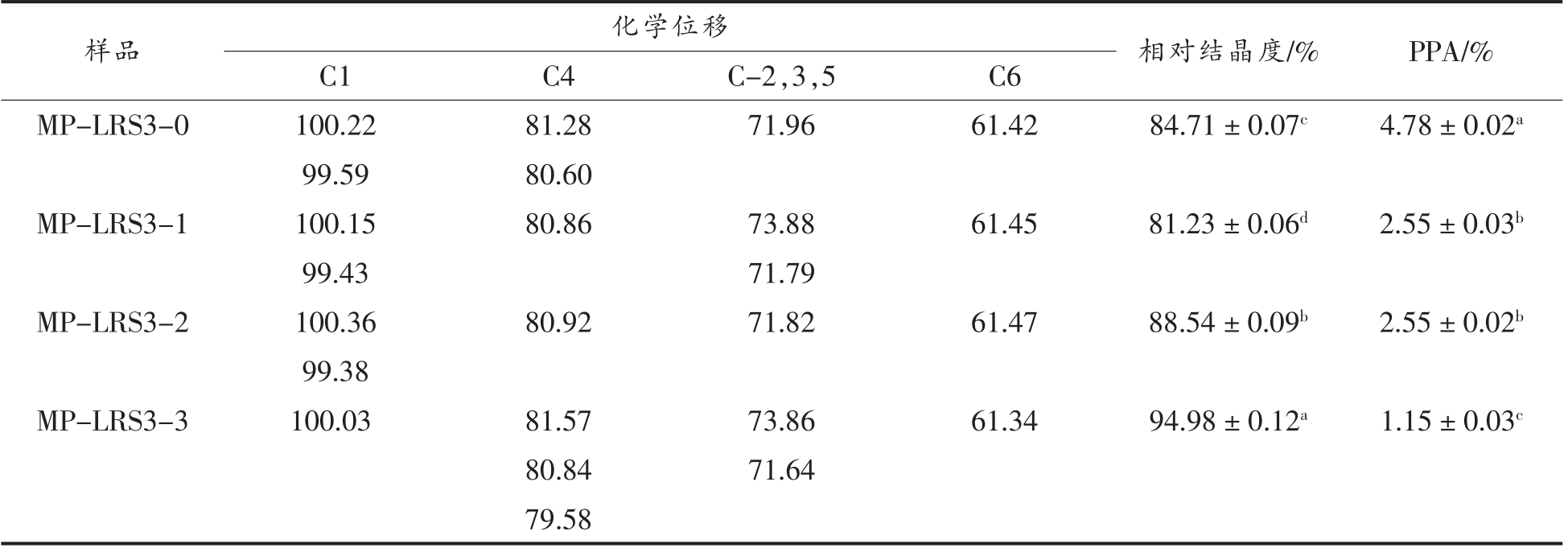
注:PPA 表示淀粉中无定形区含量。
?
表4 各消化阶段WB-LRS3 的化学位移和相对结晶度
Table 4 Chemical shifts and relative crystallinity of WB-LRS3 at each digestive stage
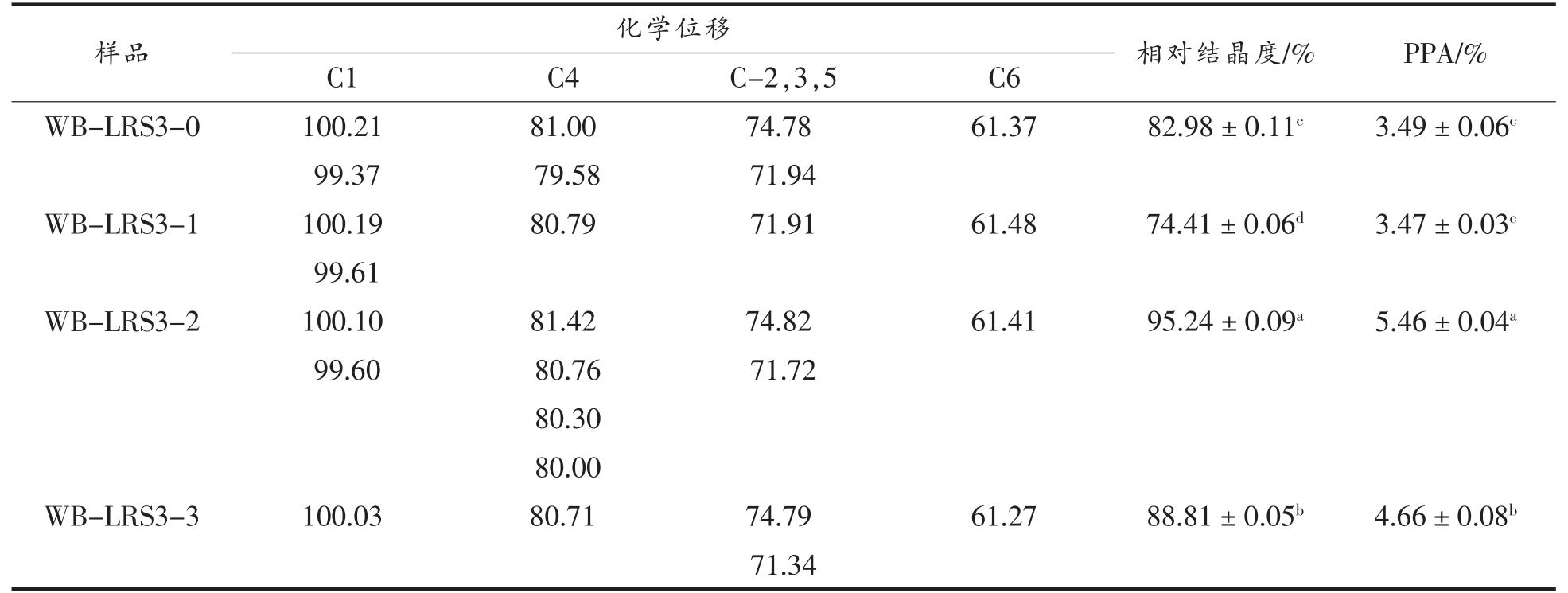
样品 化学位移 相对结晶度/% PPA/%C1 C4 C-2,3,5 C6 WB-LRS3-0 100.21 81.00 74.78 61.37 82.98±0.11c 3.49±0.06c 99.37 79.58 71.94 WB-LRS3-1 100.19 80.79 71.91 61.48 74.41±0.06d 3.47±0.03c 99.61 WB-LRS3-2 100.10 81.42 74.82 61.41 95.24±0.09a 5.46±0.04a 99.60 80.76 71.72 80.30 80.00 WB-LRS3-3 100.03 80.71 74.79 61.27 88.81±0.05b 4.66±0.08b 71.34
淀粉结构中的双螺旋结构含量与无定形区密切相关,无定形区含量越低,双螺旋结构含量越高;而PPA 为C4 位峰值拟合面积与波谱总面积的比值[30]。在模拟消化液作用下,MP-LRS3 的PPA值逐渐降低,说明其双螺旋结构占比增大,解聚作用主要作用于无定形区;而WB-LRS3 未表现出如MP-LRS3 一致的PPA 变化趋势,呈先缓慢升高后降低的趋势,说明二者在消化液中解聚区域的暴露情况不同。WB-LRS3 的PPA 在各阶段均高于MP-LRS3,说明其双螺旋结构占比低于MPLRS3,这与ESEM 和X-射线衍射结果一致,推测这可能与二者制备方式不同导致的晶体三维结构差异有关。
2.4 MP-LRS3 和WB-LRS3 对短双歧杆菌的增殖作用
为证实消化后LRS3 的结构特性对短双歧杆菌增殖的影响,以各消化阶段MP-LRS3 和WBLRS3 为培养基碳源,研究其促短双歧杆菌增殖作用。
如图5所示,4 组不同碳源培养的菌株均在8 h 左右进入对数期,24 h 左右进入稳定期;MPLRS3-0 和WB-LRS3-0 试验组菌株最大增殖速率和最大生长量均显著高于GLU 和HAMS 对照组(P<0.05),说明两种LRS3 均具有比另两种碳源更好的促短双歧杆菌增殖效果,这与Zhang 等[3]结论一致。在对数生长期间,LRS3 表现出与GLU 和HAMS 完全不同的促增殖现象。在菌株生长的8~16 h,LRS3 组菌株的增殖速率明显高于对照组,这表明LRS3 可被短双歧杆菌更快速、有效的利用;而在16~24 h 则相反,增殖速率更趋于平缓,这可能是由于可被利用的LRS3 营养水平逐渐降低,成为菌体增殖速率的关键限制因子所致。此外,在底物浓度一致的前提下,MP-LRS3-0 组菌株的最大增殖速率和最大生长量也显著高于WB-LRS3-0 组(P<0.05),说明前者更易被短双歧杆菌快速、彻底地利用,这可能与其制备方式导致的结构差异有关。结合结构特性,发现MP-LRS3-0 较WB-LRS3-0 结构松散,无定形程度高,推测短双歧杆菌快速增殖的原因是利用了抗性淀粉的无定形区。
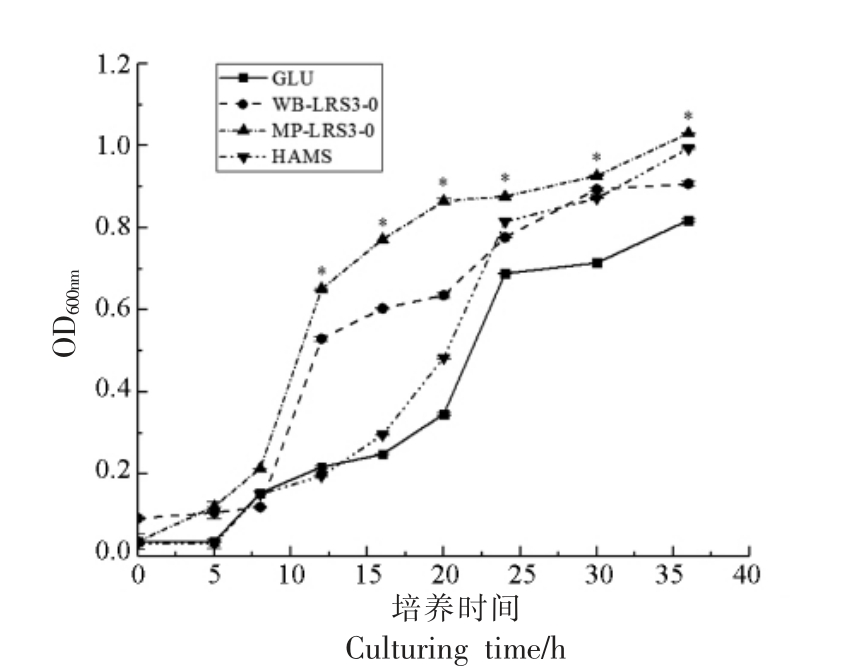
图5 MP-LRS3-0 和WB-LRS3-0 对短双歧杆菌的促增殖作用比较
Fig.5 Comparison of the effects of MP-LRS3-0 and WB-LRS3-0 on the proliferation of B.breve
注:* 表示MP-LRS3-0 与WB-LRS3-0 在12~36 h具有显著性差异(P<0.05)。
此外,经消化液处理的LRS3,极有可能对短双歧杆菌的增殖产生不同的影响。如图6所示,在0~8 h 时,短双歧杆菌在所有培养基中的增殖速率相似,仅GLU 组稍高。所有LRS3 试验组菌株在8 h 时进入对数生长期,而GLU 和HAMS 对照组在8 h 时仍生长缓慢,20 h 后才开始快速增殖。试验组菌株的最终生长量也显著 (P<0.05) 或极显著(P<0.01)高于对照组。这表明无论是否经消化液处理,LRS3 均较GLU 和HAMS 更易被短双歧杆菌利用。
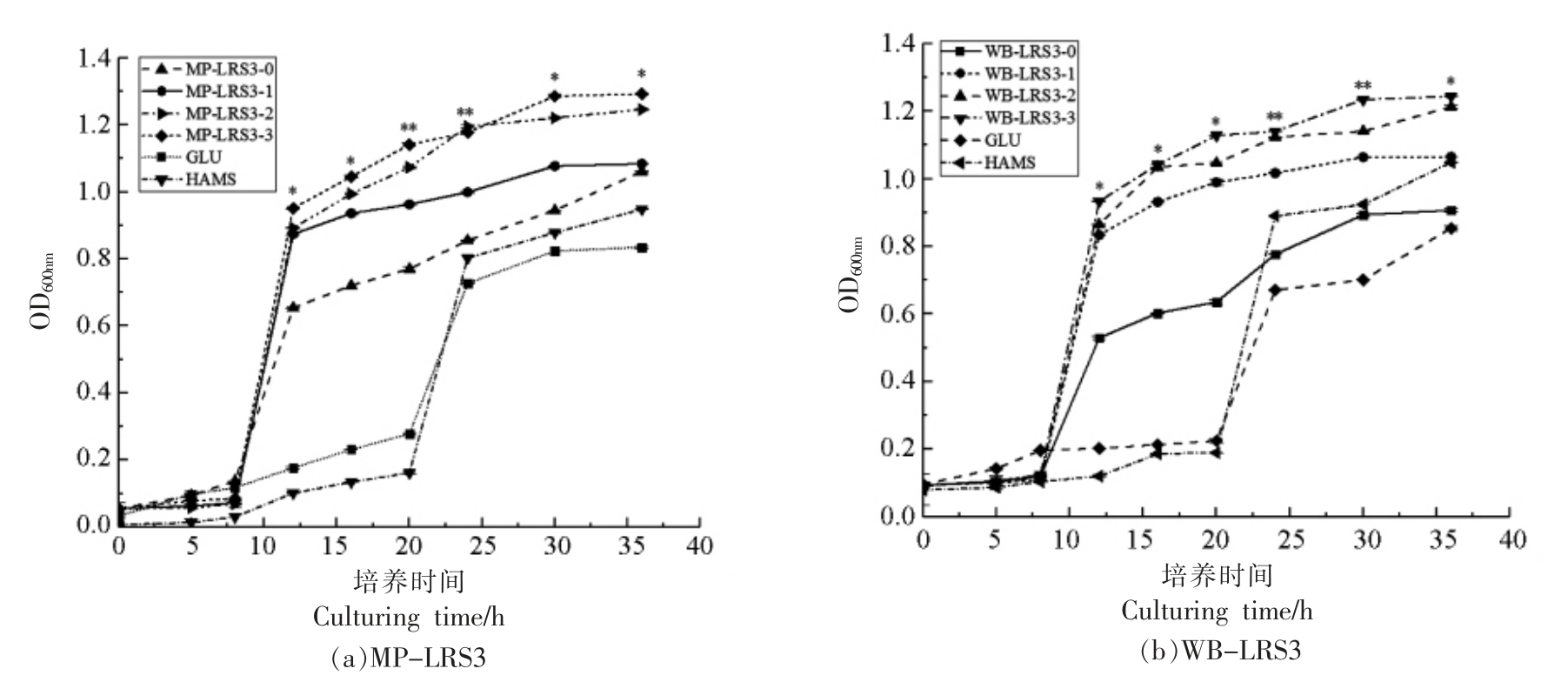
图6 各消化阶段MP-LRS3(a)和WB-LRS3(b)对短双歧杆菌的促增殖作用
Fig.6 Effects of MP-LRS3 (a) and WB-LRS3 (b) at each digestive stage on the proliferation of B.breve
注:* 与** 分别表示MP-LRS3 与WB-LRS3 在12~36 h 具有显著性差异(P<0.05)和极显著差异(P<0.01)。
此外,与消化前相比,消化后各MP-LRS3 和WB-LRS3 组菌株的最大增殖速率和最大生长量均呈显著升高趋势(P<0.05),且随着口腔、胃和小肠消化过程的进行,各组最大生长量也升高,即MP-LRS3-3 >MP-LRS3-2 >MP-LRS3-1 >MPLRS3-0,WB-LRS3-3>WB-LRS3-2>WB-LRS3-1>WB-LRS3-0。经体外消化的LRS3 更有利于短双歧杆菌的增殖,且由消化液导致的LRS3 结构性解聚程度影响其促菌株增殖效果,即消化后的抗性淀粉具有更好的益生作用,意味着抗性淀粉结晶度的提高对促菌株增殖有利,这与文献[31-32]报道一致。
2.5 短双歧杆菌与MP-LRS3 和WB-LRS3 的黏附作用
研究表明,高直链玉米抗性淀粉可提高小鼠肠道双歧杆菌在低pH 值、胆盐环境和肠道通路中的生存能力[1],菌体对淀粉的黏附作用可能是提高细菌活力的可能机制之一[33-34];Crittenden 等[16]指出,黏附极有可能对菌株与淀粉的营养互作具有重要作用。本研究采用经体外消化处理的各阶段MP-LRS3 和WB-LRS3 与短双歧杆菌进行黏附试验,以黏附率为指标,结果如表5所示。
表5 短双歧杆菌对各消化阶段MP-LRS3 和WB-LRS3 的黏附能力
Table 5 Adhesion capacity of B.breve to MP-LRS3 and WB-LRS3 after each digestive stage

注:表中不同的小写字母角标表示同一列数据间具有显著性差异(P<0.05)。
?
根据Crittenden 等[16]的研究结果,与淀粉颗粒黏附的细菌占比超过70%被认为是高黏附,40%~70%之间为中等黏附,而低于40%为低黏附。由表5可知,消化处理前、后MP-LRS3 组和WB-LRS3组黏附率均高于50%,属于中等黏附。MP-LRS3对短双歧杆菌的黏附率普遍高于WB-LRS3,说明微波法较水浴法更有利于LRS3 对菌株的黏附。其中,短双歧杆菌与各阶段MP-LRS3 的黏附率均在65%以上,总体呈上升趋势(P<0.05),且在胃肠消化处理组呈现出超过70%的高黏附率。短双歧杆菌与各阶段WB-LRS3 的黏附率整体较MPLRS3 组稍低,均在50%以上,同样总体呈上升趋势(P<0.05),仅胃液消化处理组略下降。上述结果说明,口腔和胃肠消化液对LRS3 的结构性解聚具有促进短双歧杆菌黏附的作用。这可能与大分子淀粉聚合物与细菌之间的空间位阻有关[16]。由结构测定结果可知,MP-LRS3 和WB-LRS3 经消化液处理后发生颗粒松散,产生凹坑孔洞,以及无定形区解聚等空间结构的变化,均可能使晶体上黏附受体的暴露程度或表面电荷等发生改变,从而导致黏附效果的差异。MP-LRS3 较WB-LRS3更易解聚成高结晶度的结构特性,也与该组黏附率较高的结果一致,验证了由消化介导的LRS3结构解聚利于菌株黏附这一观点。结合抗性淀粉体外消化的结构特性,可推测黏附体系中直链淀粉含量的增加,使得菌与淀粉的黏附率增大。
Flint 等[9]认为,不溶性颗粒淀粉与细菌的黏附作用是其降解过程的首要步骤,也是其有效降解的先决条件。结合之前结果,消化进程与促增殖作用存在相关性的原因,可能与LRS3 晶体结构变化使其黏附菌株能力不同有关,这为抗性淀粉与菌株的营养互作提供结构基础,即:一方面LRS3表面的沟壑状结构为双歧杆菌提供了附着点,是二者黏附的可能机制之一;另一方面这种聚集态结构和黏附作用也保护并促进了双歧杆菌的增殖[3]。这也可能是短双歧杆菌菌株对LRS3 底物的利用率高于其它来源抗性淀粉的原因。
3 结论
研究体外消化后微波法和水浴法制备莲子抗性淀粉的晶体特性,结果发现,消化后MP-LRS3和WB-LRS3 颗粒变小,从大块片层结构变为表面粗糙有凹坑且棱角圆润的小颗粒,晶体结构仍为B-型,结晶区域和双螺旋结构占比增大,无定形区含量整体降低,推测随着消化的进行,LRS3发生结构性解聚,并形成更稳定的双螺旋结构。因制备方式不同,故消化前、后的晶体特性均存在差异,在相同消化阶段,MP-LRS3 较WB-LRS3 的解聚程度更高。
各消化阶段MP-LRS3 和WB-LRS3 均具有比GLU 和HAMS 更好的促短双歧杆菌增殖能力,并可与短双歧杆菌发生中等以上黏附反应。黏附率随LRS3 消化时间的延长而显著升高(P<0.05),且各消化阶段的促增殖作用与其黏附能力呈正相关。这表明由消化液导致的LRS3 结构性解聚影响二者的黏附作用,而其聚集态结构和黏附作用又促进短双歧杆菌的增殖,推测这种LRS3 和双歧杆菌之间的营养互作关系均以抗性淀粉聚集态结构特性为基础。此外,MP-LRS3 较WB-LRS3 有更好的黏附能力和促增殖能力,可被短双歧杆菌更有效利用,这可能与其制备方式导致的空间结构差异有关。LRS3 在消化环境中存在不同程度的晶体结构解聚现象,直接影响其对短双歧杆菌的促增殖效果和黏附能力。这一构效关系的建立对于深入了解抗性淀粉在体内的转化过程提供重要的理论支持,而消化后LRS3 的其它益生作用及内在构效机制还有待深入研究。
[1]WANG X,BROWN I L,EVANS A J,et al.The protective effect of high amylose maize (amylomaize)starch granules on the survival of Bifidobacterium spp.in the mouse intestinal tract[J].Journal of Applied Microbiology,1999,87(5):631-639.
[2]MOREIRA R,CHENLO F,TORRES M D.Effect of sodium chloride,sucrose and chestnut starch on rheological properties of chestnut flour doughs[J].Food Hydrocolloids,2011,25(5):1041-1050.
[3]ZHANG Y,WANG Y,ZHENG B D,et al.The in vitro effects of retrograded starch (resistant starch type 3) from lotus seed starch on the proliferation of Bifidobacterium adolescentis[J].Food & Function,2013,4(11):1609-1616.
[4]谢涛,张淑远,王美桂.马铃薯抗性淀粉消化前后的益生作用与结构变化[J].食品科学,2014,35(15):105-108.
XIE T,ZHANG S Y,WANG M G.Probiotic functions and structural changes of potato resistant starch before and after digestion[J].Food Science,2014,35(15):105-108.
[5]DHITAL S,WARREN F J,BUTTERWORTH P J,et al.Mechanisms of starch digestion by α-amylasestructural basis for kinetic properties[J].Critical Reviews in Food Science and Nutrition,2017,57(5):875-892.
[6]LEHMANN U,JACOBASCH G,SCHMIEDL D.Characterization of resistant starch type III from banana (Musa acuminata)[J].Journal of Agriculture and Food Chemistry,2002,50(18):5236-5240.
[7]曾红华.抗性淀粉的理化性质及其益生效应[D].长沙:长沙理工学院,2013.
ZENG H H.Physico-chemical properties and probiotic effect of resistant starches[D].Changsha:Changsha University of Science & Technology,2013.
[8]LESMES U,BEARDS E J,GIBSON G R,et al.Effects of resistant starch type III Polymorphs on human colon microbiota and short chain fatty acids in human gut models[J].Journal of Agriculture and Food Chemistry,2008,56(13):5415-5421.
[9]FLINT H J,BAYER E A,RINCON M T,et al.Polysaccharide utilization by gut bacteria:Potential for new insights from genomic analysis[J].Nature Reviews Microbiology,2008,6(2):121-131.
[10]ZHANG Y,ZENG H L,WANG Y,et al.Structural characteristics and crystalline properties of lotus seed resistant starch and its prebiotic effects[J].Food Chemistry,2014,155:311-318.
[11]郑宝东,王琦,郑亚凤,等.抗性淀粉的生物学功效及在食品加工中的应用[J].食品科学技术学报,2015,32(5):1-7.
ZHENG B D,WANG Q,ZHENG Y F,et al.Biological functions of resistant starch and its application in food processing[J].Journal of Food Science and Technology,2015,32(5):1-7.
[12]吴小婷.不同方法制备的莲子抗性淀粉性质及其体外益生元作用的研究[D].福州:福建农林大学,2015.
WU X T.Properties and prebiotics effects in vitro of lotus seed resistant starch prepared by different methods[D].Fuzhou:Fujian Agriculture and Forestry University,2015.
[13]曾红华,谢涛,杨莉,等.几种薯类与豆类抗性淀粉的抗消化性及其益生效应[J].中国粮油学报,2012,27(11):31-33.
ZENG H H,XIE T,YANG L,et al.Anti-digestibility of several tubers and legumes resistant starches and their proliferation of probiotics[J].Journal of the Chinese Cereals and Oils Association,2012,27(11):31-33.
[14]陈梦霏,周娟娟,吴书建,等.模拟胃肠消化提高蛹虫草蛋白的体外抗氧化活性[J].现代食品科技,2020,36(2):70-77.
CHEN M F,ZHOU J J,WU S J,et al.Simulated gastrointestinal digestion increase the in vitro antioxidant activity of Cordyceps militaris proteins[J].Modern Food Science and Technology,2020,36(2):70-77.
[15]李贻,贺君,张鹏敏.体外模拟胃肠道消化下刺梨抗氧化成分的释放[J].现代食品科技,2020,36(2):102-107.
LI Y,HE J,ZHANG P M.Antioxidant components release of Rosa roxburghii Tratt by in vitro simulated gastrointestinal digestion[J].Modern Food Science and Technology,2020,36(2):102-107.
[16]CRITTENDEN R,LAITILA A,FORSSELL P,et al.Adhesion of Bifidobacteria to granular starch and its implications in probiotic technologies[J].Applied& Environmental Microbiology,2001,67(8):3469-3475.
[17]NAGULESWARAN S,VASANTHAN T,HOOVER R,et al.Amylolysis of amylopectin and amylose isolated from wheat,triticale,corn and barley starches[J].Food Hydrocolloids,2014,35(3):686-693.
[18]ZHENG Y X,ZHANG C,TIAN Y T,et al.Effects of freeze-thaw pretreatment on the structural properties and digestibility of lotus seed starch-glycerin monostearin complexes [J].Food Chemistry,2021,350:129231.
[19]张本山,张友全,杨连生,等.淀粉多晶体系结晶度测定方法研究[J].华南理工大学学报 (自然科学版),2001,29(5):55-58.
ZHANG B S,ZHANG Y Q,YANG L S,et al.A method of determining crystallinity of starch in multicrystal system[J].Journal of South China University of Technology (Natural Science Edition),2001,29(5):55-58.
[20]MUTUNGI C,PASSAUER L,ONYANGO C,et al.Debranched cassava starch crystallinity determination by Raman spectroscopy:Correlation of features in raman spectra with X-ray diffraction and CP/MAS NMR spectroscopy[J].Carbohydrate Polymers,2012,87(1):598-606.
[21]ZHANG B J,LI X X,LIU J,et al.Supramolecular structure of A-and B-type granules of wheat starch[J].Food Hydrocolloids,2013,31(1):68-73.
[22]CHEETHAM N W,TAO L.Variation in crystalline type with amylose content in maize starch granules:An X-ray powder diffraction study[J].Carbohydrate Polymers,1998,36(4):277-284.
[23]方晨璐,黄峻榕,任瑞珍,等.酶解薯类淀粉适用于电镜观察其颗粒表面及内部结构[J].农业工程学报,2018,34(22):306-312.
FANG C L,HUANG J R,REN R Z,et al.Amylases enzymolysis of tuber starch granules for surface and internal structure observation under scanning electron microscopy[J].Transactions of the Chinese Society of Agricultural Engineering,2018,34(22):306-312.
[24]赵凯,陈威,宫玉晶,等.酶脱支处理对颗粒态缓慢消化淀粉形成的影响[J].食品科学技术学报,2019,37(2):42-47.
ZHAO K,CHEN W,GONG Y J,et al.Effect of enzyme debranching treatment on formation of granular slowly digestible starch[J].Journal of Food Science and Technology,2019,37(2):42-47.
[25]吴晓娟,林亲录,符琼,等.酶法制备不同品种大米淀粉的性质研究[J].粮食与油脂,2016,29(11):46-48.
WU X J,LIN Q L,FU Q,et al.Study on the properties of different varieties of rice starch by pronase hydrolysis[J].Cereals & Oils,2016,29(11):46-48.
[26]FLORES-MORALES A,JIMÉNEZ-ESTRADA M,MORA-ESCOBEDO R.Determination of the structural changes by FT-IR,Raman,and CP/MAS 13C NMR spectroscopy on retrograded starch of maize tortillas[J].Carbohydrate Polymers,2012,87 (1):61-68.
[27]FAN D M,MA W R,WANG L Y,et al.Determining the effects of microwave heating on the ordered structures of rice starch by NMR[J].Carbohydrate Polymers,2013,92(2):1395-1401.
[28]LIN J H,WANG S W,CHANG Y H.Effect of molecular size on gelatinization thermal properties before and after annealing of rice starch with different amylose contents[J].Food Hydrocolloids,2008,22(1):156-163.
[29]ZHENG Y X,OU Y J,ZHANG Y,et al.Effects of pullulanase pretreatment on the structural properties and digestibility of lotus seed starch-glycerin monostearin complexes [J].Carbohydrate Polymers,2020,240:116324.
[30]ATICHOKUDOMCHAI N,VARAVINIT S,CHINACHOTI P.A study of ordered structure in acidmodified tapioca starch by 13C CP/MAS solid-state NMR [J].Carbohydrate Polymers,2004,58 (4):383-389.
[31]LOPEZ-RUBIO A,FLANAGAN B M,GILBERT E P.Molecular rearrangement of starch during in vitro digestion:Toward a better understanding of enzyme resistant starch formation in processed starches[J].Biomacromolecules,2008,9(7):1951-1958.
[32]MUTUNGI C,OOYANGO C,DOERT T,et al.Long-and short-range structural changes of recrystallised cassava starch subjected to in vitro digestion[J].Food Hydrocolloids,2011,25(2):477-485.
[33]AMBALAM P,KONDEPUDI K K,BALUSUPATI P,et al.Prebiotic preferences of human Lactobacilli strains in co-culture with Bifidobacteria and antimicrobial activity against Clostridium difficile[J].Journal of Applied Microbiology,2015,119(6):1672-1682.
[34]LEE S K,KIM Y B,JI G E.Note:Purification of amylase secreted from Bifidobacterium adolescentis[J].Journal of Applied Microbiology,1997,83(3):267-272.