随着人们健康意识的不断增强,扇贝因高营养、低脂肪的特性而受到更多的青睐,在我国的沿海地区被广泛养殖。闭壳肌是扇贝主要的食用部分,又被称为瑶柱,因富含琥珀酸和己氨酸等鲜味氨基酸而使其味道鲜美至极,又因其肉质细嫩、色泽洁白、营养丰富,而被誉为“天下绝品”[1-3]。干制后的闭壳肌更被人们列为“八珍之一”。闭壳肌具有非常丰富的营养以及重要的食用价值,如何保证加工过程中闭壳肌的外观完整、营养成分不丢失和不被破坏已成为生产过程中的关键问题[4]。
超高压技术应用于水产品领域始于杀菌处理工序,研究人员发现在压力升高的过程中,食品中像水分子一样的小分子间距减小,而由蛋白质等大分子构成的成分结构保持不变[5-7]。此时,在充填和渗透作用下,水分子会进入大分子基团内部,并黏附在蛋白质的氨基酸周边,破坏蛋白质三级结构中的非共价键[8-9];而在卸压过程中,压力由高压逐渐降为常压,已变性的蛋白质分子的分子链会伸展开来,使原有的立体结构发生改变,肌肉纤维和黏连组织松懈[10-11],然而,超高压处理只会改变大分子中的非共价键结构,极大限度地保持了小分子的共价键结构,也保护食品的天然品质和营养价值[12-13]。
扇贝以闭壳肌为主要肌肉组织,并直接与贝壳紧密连接,要实现扇贝的脱壳,就必须破坏扇贝贝壳与闭壳肌之间的连接关系,探究闭壳肌在超高压作用下的结构和特性的变化对扇贝脱壳有着十分重要的影响。闭壳肌的主要成分为肌原纤维蛋白和少量的胶原蛋白,在超高压作用下,蛋白质是否会发生变性,对扇贝闭壳肌与界面的连接强度有较大影响。利用拉曼光谱对经过超高压处理的扇贝闭壳肌中蛋白质的结构进行分析,可以为闭壳肌在超高压作用下的力学性能和深入分析扇贝超高压脱壳机理奠定理论基础。
1 材料及方法
1.1 试验材料
1.1.1 试验原料 以购于锦州渤海大学海鲜市场的扇贝为研究对象,受超高压设备入口限制,扇贝的最长轴直径约(95±5)mm。
1.1.2 试样预处理 将扇贝表面清洗干净,将扇贝放入注入淡盐水的PE 包装袋并封口后置入超高压处理设备,施加300 MPa 的试验压力分别保持1,2 min 和3 min 后取出,将扇贝贝壳与闭壳肌分离,取与贝壳连接界面位置的闭壳肌作为试样进行研究。
1.1.3 试剂及设备 2.5%戊二醛固定溶液,南京森贝伽生物科技有限公司;0.2 mol/L 磷酸盐缓冲液,上海跃腾生物技术有限公司;乙醇,天津市津东天正精细化学试剂厂。
HPP.L2-600 型超高压处理设备,天津华泰森淼生物工程技术股份有限公司;S-4800 型场发射扫描电镜,日本日立公司;LabRAM HR Evolution拉曼光谱分析仪,法国HORIBA Jobin Yvon 公司;ALPHA1-2LD plus 冷冻干燥机,德国Martin Christ 公司。
1.2 试验方法
1.2.1 拉曼光谱分析 将经过超高压处理并与贝壳分离后的界面闭壳肌纵切成0.5 cm×0.5 cm×0.2 cm 的小块,设置拉曼光谱分析仪的狭缝为200 μm,功率129 mW,激发波长为515.4 nm,曝光时间60 s,检测的波长范围为400~4 000 cm-1,根据测得数值绘制拉曼光谱,利用Labspec5.0 软件进行处理后再经Alix 软件进行分峰拟合,计算得到蛋白质中各二级结构的质量分数。
1.2.2 扫描电镜分析 将处理好的试样用体积分数2.5%的戊二醛溶液固定24 h,取出后用0.2 mol/L 磷酸盐缓冲液漂洗3 次,每次10 min,然后分别用50%~100%的乙醇梯度洗脱,每次10 min,置入冷冻干燥机干燥后进行离子渐射镀金,在场发射扫描电镜下进行观察、取像[14]。
2 结果与分析
2.1 不同保压时间下扇贝界面闭壳肌蛋白质主链结构的变化
由图1可见,共有11 个特征峰出现在扇贝界面闭壳肌的拉曼光谱图上,这些特征峰主要集中500~1 800 cm-1 的指纹图谱区和2 800~3 050 cm-1的C-H 伸缩振动区,通过分析扇贝界面闭壳肌在这两段拉曼谱带特征峰的峰形、峰强等参数的变化,可以得到不同超高压处理条件对扇贝界面闭壳肌结构的影响[15-17]。扇贝闭壳肌拉曼光谱特征谱带的归属[18-20]如表1所示。

图1 不同保压时间下扇贝界面闭壳肌拉曼光谱图
Fig.1 Raman spectra of adductor muscle at scallop interface under different holding time
表1 扇贝闭壳肌拉曼光谱特征谱带归属明细表
Table 1 Detailed list of characteristic bands of Raman spectra of adductor muscle of scallop
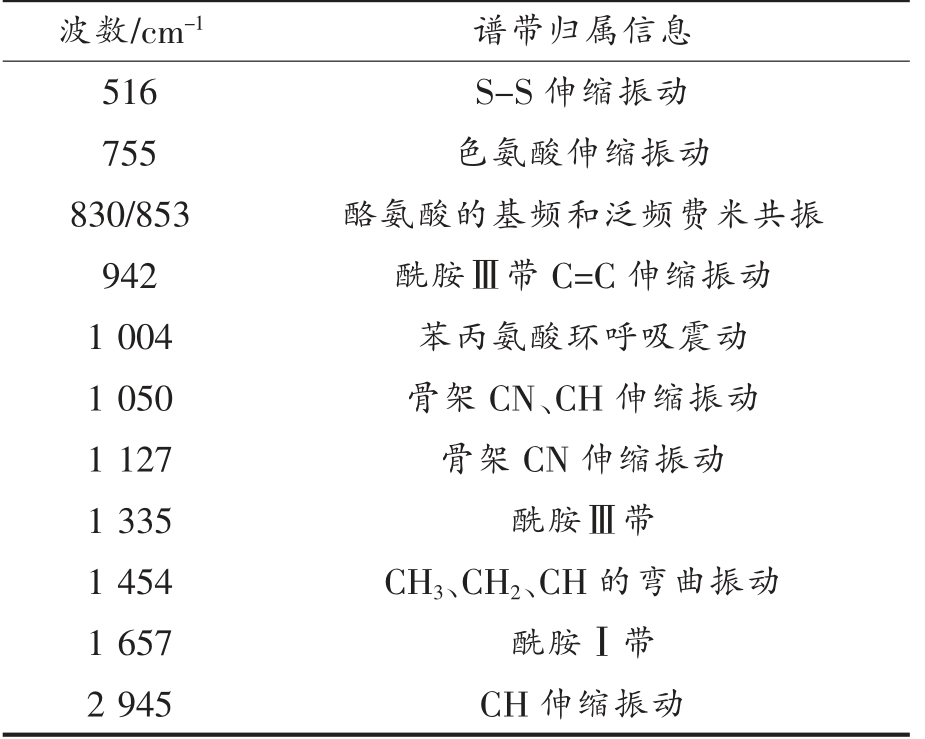
波数/cm-1 谱带归属信息516 S-S 伸缩振动755 色氨酸伸缩振动830/853 酪氨酸的基频和泛频费米共振942 酰胺Ⅲ带C=C 伸缩振动1 004 苯丙氨酸环呼吸震动1 050 骨架CN、CH 伸缩振动1 127 骨架CN 伸缩振动1 335 酰胺Ⅲ带1 454 CH3、CH2、CH 的弯曲振动1 657 酰胺Ⅰ带2 945 CH 伸缩振动
根据图1可以看出,不同保压时间处理后的扇贝界面闭壳肌的拉曼光谱图特征峰的形状在2 min 时发生了非常明显的变化,其它试验条件产生的拉曼光谱图的形状基本未发生变化,各特征峰的出峰位置也未发生大范围偏移,然而峰强有了比较明显的差别。在保压时间为2 min 时,扇贝界面闭壳肌蛋的拉曼光谱比较陡峭,主要原因可能是在这个处理条件下,蛋白质多肽链间的分子作用变化比较明显,蛋白质发生了较大程度的变性。然而,当保压时间延长至3 min 时,扇贝界面闭壳肌蛋白质的拉曼光谱图和初始状态比较接近,持续的超高压力并没有加剧蛋白质的变性和结构的松散程度,反而促进了多肽链间氢键的形成,使蛋白质结构重新变成了有序结构[21-23]。
在图1中,1 335 cm-1 处酰胺Ⅲ带和1 657 cm-1处酰胺Ⅰ带的特征峰强度随着压力的升高而增大,这2 个位置集中体现着蛋白质多肽链中的各种振动伸缩状态,说明在压力作用下,蛋白质分子间的化学键振动作用比较明显,形成了较多新的氢键;942 cm-1 处的α-螺旋结构特征峰在压力作用下,峰强度明显增大,这说明较长的保压时间可以促进氢键的产生,这可能是由于在卸压过程中,蛋白质发生了可逆反应,造成了氢键的重新形成,提高了α-螺旋结构的含量,使得这一位置的特征峰强度增大。
2.2 不同保压时间下扇贝界面闭壳肌蛋白质二级结构变化
将得到的拉曼光谱数据利用Labspec5.0 软件进行处理后,对数据进行归一化处理,利用Alix 计算软件对处理后的数据进行分峰处理,根据所得的峰面积计算出蛋白质的二级结构的质量分数[24],分析得到了不同超高压处理条件下扇贝界面闭壳肌蛋白质二级结构的变化规律,如图2所示。
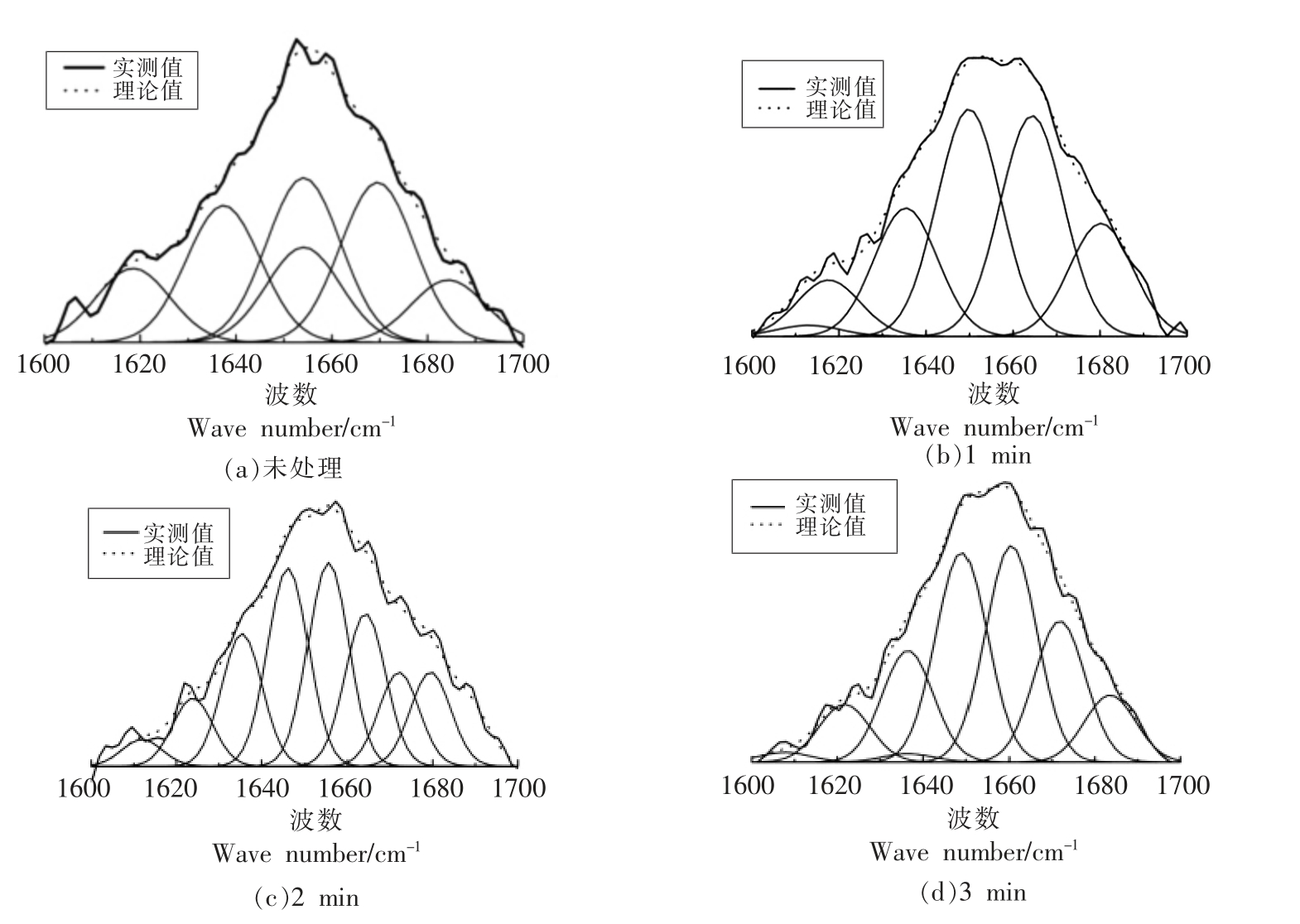
图2 不同保压时间下扇贝界面闭壳肌蛋白质酰胺Ⅰ区分峰拟合曲线
Fig.2 Peak fitting curve of protein amide I region in the adductor muscle of scallop under different pressure holding time
根据图2所示的各处理扇贝界面闭壳肌在酰胺Ⅰ区的分峰和迭代拟合曲线,通过对比蛋白质中的α-螺旋(α-Helix)、β-折叠(β-Sheet)、β-转角(β-Turn)和无规则卷曲(Random coil)所对应的峰面积,得到了扇贝界面位置闭壳肌蛋白质所包含的各二级结构的质量分数,在不同保压时间的条件下,蛋白质的主要二级结构质量分数如图3所示。
由图3可以看出,当试验压力为300 MPa 时,保压时间的延长使得蛋白质的变性程度急剧增强,各个二级结构的主要成分发生了非常明显的规律性变化。在保压时间延长的过程中,蛋白质二级结构中的α-螺旋结构含量大幅度减少、β-折叠结构、β-转角结构和无规则卷曲结构的含量有所增加,这说明蛋白质发生了比较明显的变性,生物活性和水溶性也会随之发生变化。对于α-螺旋结构而言,在300 MPa 的试验压力作用于扇贝闭壳肌的瞬间,蛋白质的二级结构就发生了变化,α-螺旋结构的含量由初始的74.69%逐渐减小,当试验压力分别保持1,2 min 和3 min 时,α-螺旋结构的含量分别为69.22%,57.92%和52.81%,对应初始数值分别减小了5.47%,16.77%和21.88%。由此可以看出,当保压时间为2 min 和3 min 时,α-螺旋结构大幅度减少,说明在这个试验条件下,多肽链间的氢键稳定性减弱,一部分螺旋结构被伸长,转变为β-折叠结构。当保压时间为1 min 时,β-折叠结构含量的增幅并不是很大,由初始的4.54%增大到了8.72%,提高了92.07%;然而当保压时间延长至3 min 时,β-折叠结构的含量为21.30%,此试验条件将蛋白质中的β-折叠结构的含量提高了369.16%,也就是提高了近4 倍,说明蛋白质被伸展的程度是比较大的,扇贝界面位置闭壳肌蛋白质由卷曲结构逐渐转变为片层结构,蛋白质的稳定性逐渐减弱,分子极性增大,水溶性增加。随着保压时间的延长,蛋白质二级结构中的β-转角结构的含量虽有所增大,但增加的幅度较小,由初始的12.15%增加到了保压时间为3 min 时的15.57%,增幅为28.15%,说明在300 MPa 的试验压力下,一部分肽链骨架以180°回折从而改变了肽链的方向和空间构象,使蛋白质的生物性能产生了变化。蛋白质中的无规则卷曲结构的含量也随着保压时间的延长而增多,未经过处理的扇贝界面闭壳肌中的无规则卷曲结构的含量为8.62%,当保压时间为1 min 时,无规则卷曲结构的含量增加到了9.05%,提高了4.99%;当保压时间延长至3 min 时,无规则卷曲结构的含量比未处理扇贝蛋白质中的无规则卷曲结构含量增加了19.72%,说明在超高压力的作用下,蛋白质中越来越多的有序结构被破坏而变成了松散的无序结构,蛋白质的变性程度加剧,丧失了部分生物性的功能。
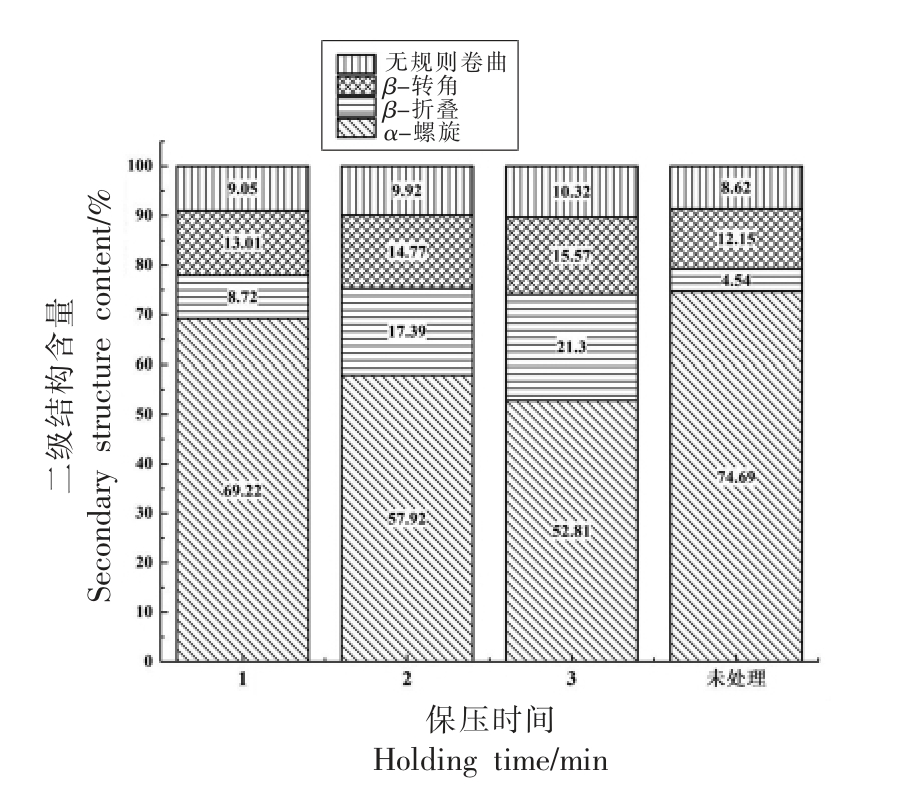
图3 不同保压时间下扇贝界面闭壳肌蛋白质二级结构变化
Fig.3 Changes of protein secondary structure in adductor muscle of scallop at different holding time
综上所述,在300 MPa 的试验压力下,保压时间的延长会加剧蛋白质的变性,使蛋白质二级结构中的α-螺旋结构含量降低、β-折叠结构、β-转角结构和无规则卷曲结构的含量均有增大,且保压时间越长,二级结构的变化趋势越明显。
2.3 不同保压时间下扇贝界面闭壳肌蛋白质侧链构象变化
2.3.1 不同保压时间下酪氨酸残基变化 蛋白质中酪氨酸残基的变化通常通过在830 cm-1 和850 cm-1 附近的吸收峰响度比值进行衡量,图4位不同保压时间下扇贝闭壳肌蛋白质酪氨酸残基的拉曼特征图谱。
根据图4所示的扇贝界面位置闭壳肌蛋白质中酪氨酸残基的拉曼光谱图,在不同的试验条件下,830 cm-1 和850 cm-1 附近均出现特征峰。随着保压时间地延长,830 cm-1 附近的吸收峰强度变化幅度较小,然而850 cm-1 附近的吸收峰强度变化比较大,通过计算峰面积得到了这两处位置所对应的吸收峰强度,并通过吸收峰强度得到了I850/I830 的比值,未处理扇贝界面位置闭壳肌蛋白质中酪氨酸残基在850 cm-1 和830 cm-1 附近的吸收峰强度的比值为1.037,当对试样施加超高压处理时,在保压时间分别为1,2 min 和3 min 的条件下,I850/I830 的比值分别为1.044,1.035,1.092,说明300 MPa 的试验压力保持3 min 可使蛋白质的分子结构有比较大的变化,原本包埋于蛋白质分子内部的酪氨酸残基在多肽链表面暴露,与氢键之间产生了相互作用。
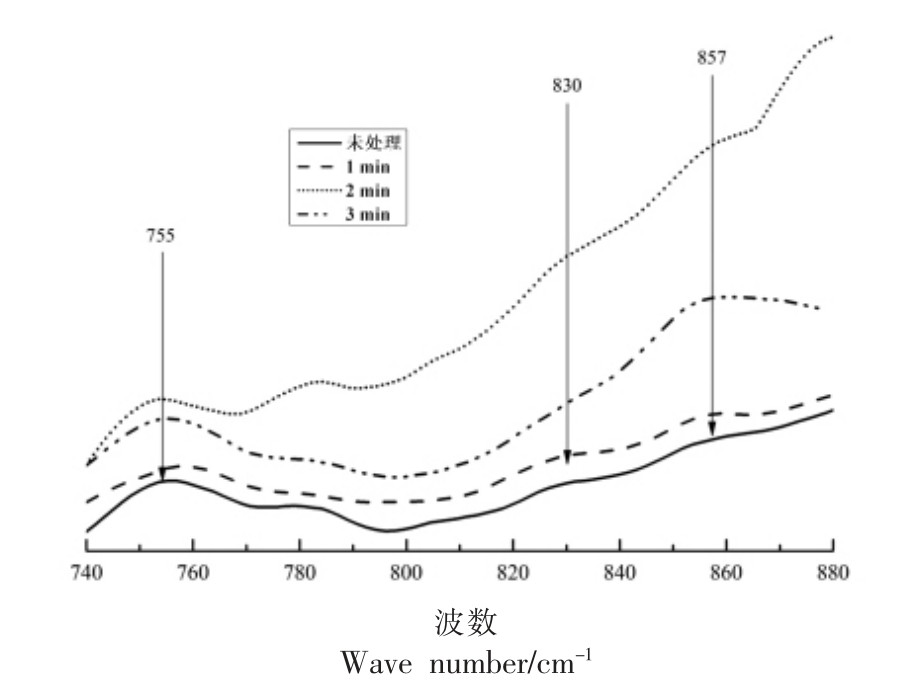
图4 不同保压时间下扇贝界面闭壳肌蛋白质中酪氨酸残基的变化
Fig.4 Changes of tyrosine residues in adductor muscle protein at scallop interface under different holding time
2.3.2 不同保压时间下色氨酸残基变化 在拉曼特征图谱中,755 cm-1 附近的吸收峰表示的是蛋白质色氨酸残基的微环境状态,吸收峰强度反映了色氨酸残基的暴露状态,根据不同保压时间条件下扇贝界面闭壳肌蛋白质的拉曼特征图谱就可以得到色氨酸残基所对应的吸收峰强度的变化,进而了解色氨酸残基的状态。
在图4中呈现了不同试验条件下扇贝界面闭壳肌蛋白质中色氨酸残基的吸收峰特性。随着保压时间的延长,拉曼光谱吸收峰强度逐渐减弱,特别是在保压时间1 min 时,减弱的程度最大,在保压时间为2 min 和3 min 时又有所反弹,基本与未处理扇贝的色氨酸残基特征图谱形状比较接近,这说明300 MPa 的超高压力能够引起色氨酸残基的暴露,然而长时间保持这种较高的试验压力会使蛋白质分子之间发生微小的可逆变化,使色氨酸残基的暴露状态发生改变,这主要与蛋白质分子的二级结构和氢键间的作用力有关。在不同试验条件下,扇贝界面闭壳肌蛋白质分子中的色氨酸残基暴露状态改变并不是非常明显,说明在超高压力的作用下,色氨酸残基暴露的程度比较低,并且受试验条件的影响不是很大。
2.3.3 不同保压时间下蛋白质C-H 键振动作用变化 根据扇贝界面闭壳肌蛋白质的拉曼光谱图可以看到,在2 900 cm-1 附近出现了一个非常强烈且尖锐的吸收峰,这处吸收峰表征的是蛋白质中C-H 键的伸缩振动作用,包括了CH2 的非对称伸缩或者CH3 的对称伸缩振动,即蛋白质的芳香族氨基酸结构及特性的直观反映。另外在拉曼光谱图的2 876 cm-1 附近还发现了一个比较微弱的次峰,这个次峰表征的是CH2 的非对称伸缩振动。扇贝界面闭壳肌蛋白质芳香族氨基酸反映在拉曼光谱图中的吸收峰强度的变化与蛋白质二级结构中α-螺旋结构被拉伸引起的芳香氨基酸C-H 间疏水作用的变化有关,如果在拉曼光谱中表征C-H伸缩振动所对应的拉曼特征峰强度增大,说明羟基在极性微环境中的暴露程度变大。不同保压时间下,蛋白质芳香族氨基酸的拉曼光谱如图5所示。
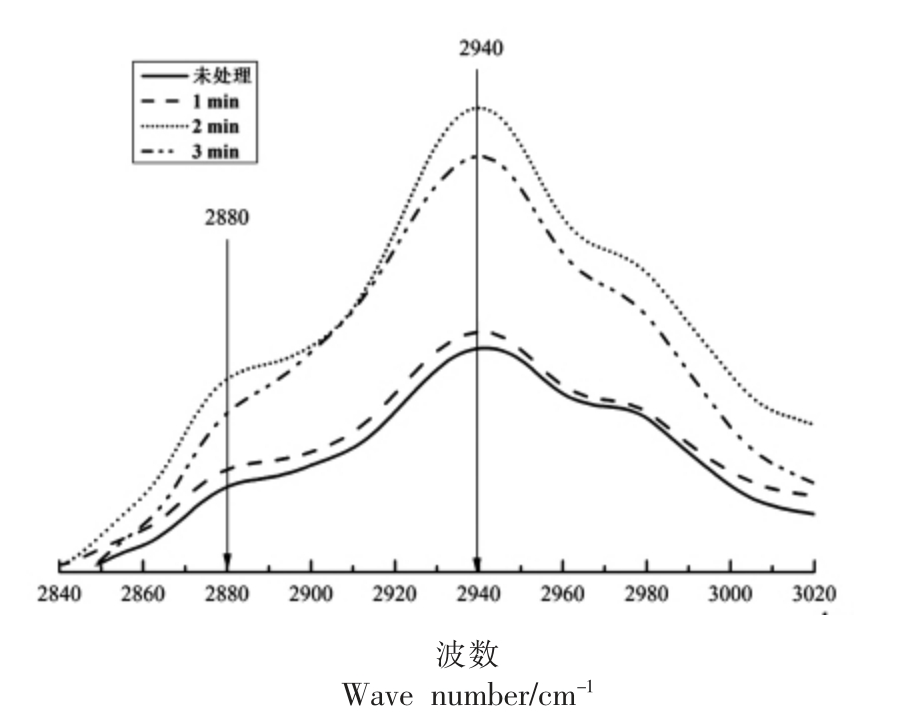
图5 不同保压时间条件下扇贝界面闭壳肌芳香族氨基酸的拉曼光谱图
Fig.5 Raman spectra of aromatic amino acids in adductor muscle of scallop at different holding time
由图5可以看出,在拉曼光谱的2 940 cm-1 和2 880 cm-1 处存在着2 个比较明显的吸收峰,特别是2 940 cm-1 处的吸收峰非常强烈且尖锐,随着保压时间的延长,这两处的吸收峰强度均有一定程度的增强,特别是当保压时间延长到2 min 以上时,吸收峰强度增加的幅度非常明显,说明较长时间保持300 MPa 的试验压力可以引起蛋白质分子间氢键的变化,导致蛋白质变得更加舒展,使得更多数量的芳香族氨基酸侧链暴露在极性环境中,蛋白质的疏水作用增强。当保压时间延长至3 min 时,2 940 cm-1 处的吸收峰强度有较小程度的减弱,这可能是由于蛋白质长时间处于较高试验压力环境中,当压力解除时出现了一定的还原作用,即原本被破坏了的氢键被修复,使得少量芳香族氨基酸侧链重新埋藏于蛋白质分子内部,吸收峰强度减弱。
综上所述,保压时间的变化会引起芳香族氨基酸侧链暴露状态的改变。当保压时间为3 min时,会引起蛋白质氢键的还原,使少量暴露状态的芳香族氨基酸侧链重新变为包埋状态。经过分析,超高压力保持2 min 时,对蛋白质二级结构的破坏程度最大,芳香族氨基酸侧链的暴露程度增加的也最明显,拉曼光谱所对应的吸收峰增强的幅度最大。
2.3.4 保压时间对蛋白质二硫键的影响 二硫键(S-S) 是连接不同肽链或同一肽链不同部分的化学键。它由含硫氨基酸形成,半胱氨酸被氧化成胱氨酸时即形成二硫键。蛋白质分子中的二硫键起着稳定肽链空间结构的作用,蛋白质分子的稳定性也随着二硫键数目的增多而增大。当超高压处理条件变化时,二硫键的结构是否发生变化对明确蛋白质高级结构的稳定性有着比较重要的意义。
二硫键在拉曼光谱中对应的特征吸收谱在500~550 cm-1 区域内,将这一波数区域的拉曼光谱图进行放大就可以得到不同试验条件下蛋白质中二硫键的拉曼特征图谱(见图6)。
由图6可知,未经过处理的扇贝界面闭壳肌蛋白质二硫键的特征峰出现在516 cm-1 附近,当保压时间为1 min 时,特征峰位置基本未发生变化;当保压时间为2 min 时,特征峰位置向高频方向移动了9 cm,出现在了525 cm-1 附近;当保压时间为3 min 时,吸收峰又向低频方向发生了移动,出现在了520 cm-1 附近位置。二硫键特征峰位置的变化说明了其构象的变化,当保压时间为2 min 时,特征峰移动位移最大,已经接近了二硫键扭式-扭式-反式(g-g-t)构象的临界区域,有向反式-扭式-反式(t-g-t)构象转变的趋势;然而当保压时间延长至3 min 时,这种趋势即刻消失,吸收峰又重新出现在了扭式-扭式-反式(g-g-t)构象的区域范围内,这说明长时间的保持较高的试验压力会使蛋白质发生复原现象,原本被破坏了的结构重新得到修复,也使得蛋白质的生物特性得以保持。
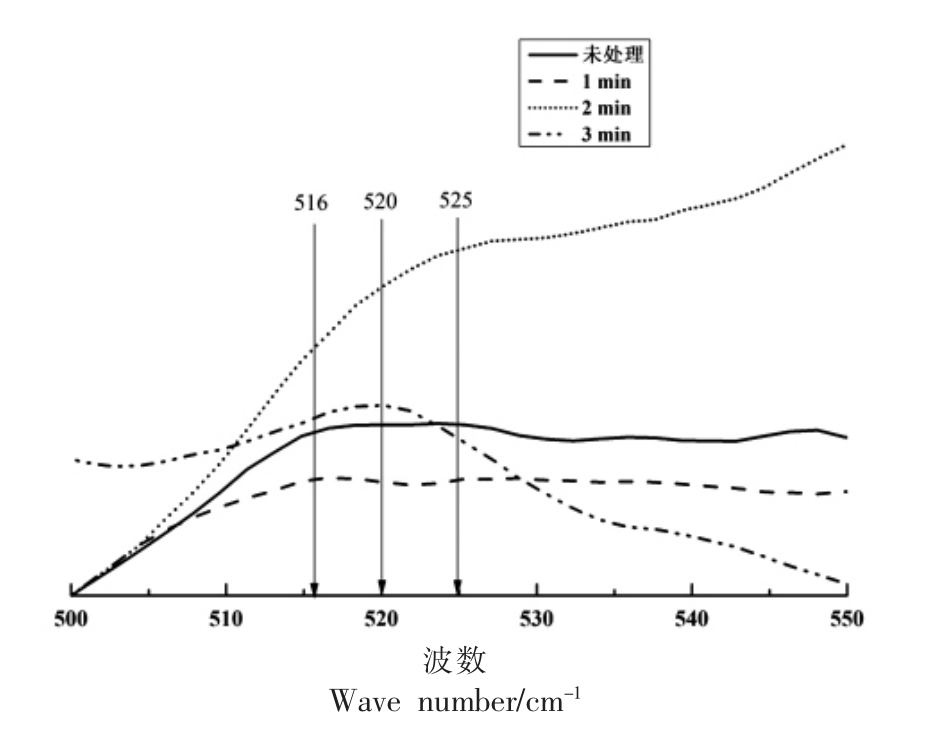
图6 不同保压时间条件下扇贝界面闭壳肌蛋白质二硫键的拉曼光谱图
Fig.6 Raman spectra of protein disulfide bond in adductor muscle of scallop at different holding time
2.4 超高压处理对扇贝界面闭壳肌蛋白质影响的扫描电镜分析
为了研究不同超高压处理条件对扇贝界面位置闭壳肌的影响,首先对未经过处理的扇贝界面位置闭壳肌的形貌进行了扫描,以便进行对比分析,得到的扇贝界面位置闭壳肌的形貌如图7所示。
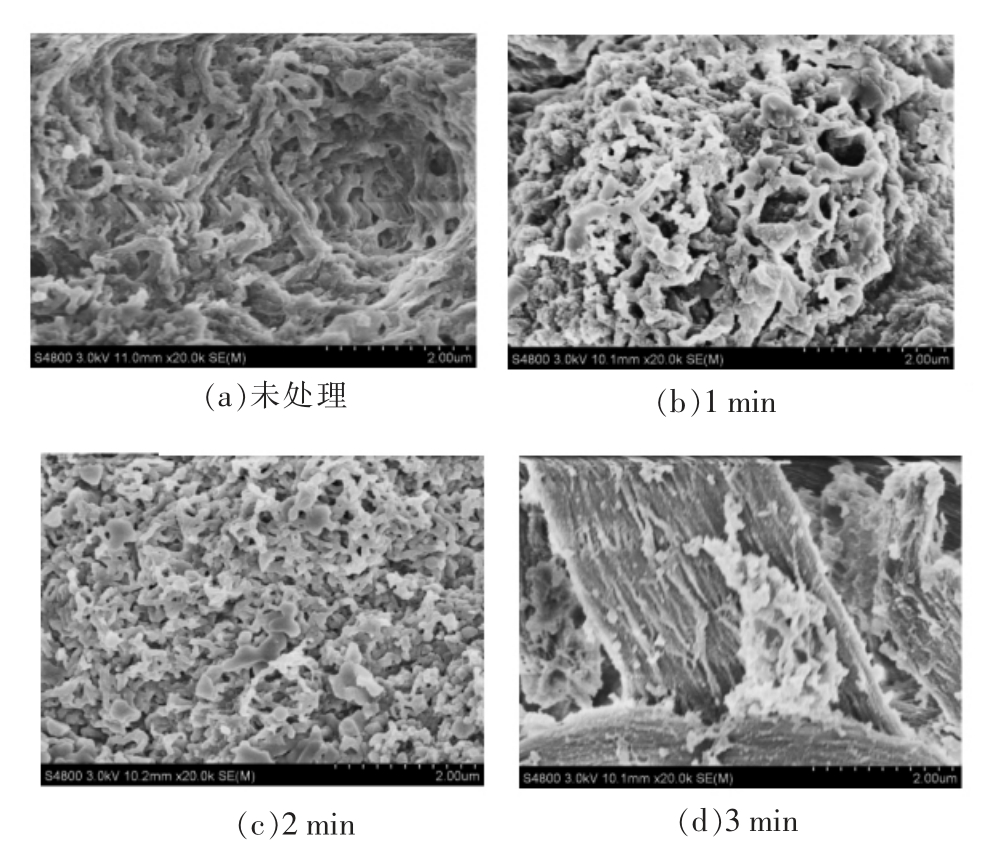
图7 不同保压时间条件下扇贝界面闭壳肌蛋白质的微观结构
Fig.7 Microstructure of the protein in the interface adductor muscle of scallop under different holding time
由图7可知,未经过处理的扇贝界面位置闭壳肌呈现出比较连续完整的纤维状均匀分散,且纤维之间基本保持互相平行分布,形态具有一定的规律性。随着保压时间的延长,扇贝界面闭壳肌的蛋白质纤维变得短而粗且分布越发不均匀。当保压时间延长至3 min 时,闭壳肌纤维原有的柱状截面纤维变成了扁平的片状截面,这可能是由于在试验压力的作用下,闭壳肌蛋白质中的α-螺旋结构被破坏,氢键被打开,螺旋伸展转变成β-折叠结构。综上,在不同保压时间下蛋白质会发生比较明显的变性,弹性消失,空间构象发生变化,增大了贝壳间的作用力,使得闭壳基与贝壳接触面的拉力增大,引起了闭壳肌-贝壳界面的失效。
3 结论
通过分析300 MPa 的试验压力下,不同保压时间对扇贝界面闭壳肌蛋白质主链二级结构、氨基酸侧链状态及二硫键的构象的影响,发现保压时间比较长的超高压处理条件下,蛋白质二级结构中的α-螺旋结构含量降低,β-折叠结构、β-转角结构和无规则卷曲结构的含量均有增大,酪氨酸在极性环境中产生了由暴露状态向包埋状态转变的趋势,色氨酸残基的暴露状态无明显改变。当保压时间延长时,二硫键已经到达构象转变边界的趋势得到了还原,使二硫键的结构得到了修复;随着保压时间的延长,扇贝界面闭壳肌蛋白质中扁平片层状结构逐渐增多,部分氢键被超高压力破坏后形成了β-转角结构;另外有部分氢键被打开后在相邻肽链主链的N-H 和C=O 之间形成了新的有规则的氢键,蛋白质中的β-折叠结构增多,同时由于蛋白质二级结构发生变化,蛋白质侧链结构的暴露程度也有所增强。在超高压力的作用下,蛋白质主链和侧链的结构及空间构象都有了比较明显的变化,这些结构的变化和状态的转变对闭壳肌的弹性、力学特性、与贝壳之间的结合强度及蛋白质的水溶性都有着非常显著的影响,这些力学及生物特性的变化也会影响扇贝超高压脱壳效果,对深入研究扇贝脱壳起到了非常重要的作用。
[1]孔德刚,王颉,李珊珊,等.水射流剥离海湾扇贝贝柱试验研究[J].河北农业大学学报,2016,39(5):128-132.
KONG D G,WANG J,LI S S,et al.Testing and research on water jet peeling for bay scallop adductor muscle[J].Journal of Agricultural University of Hebei,2016,39(5):128-132.
[2]王家忠,李秋实,弋景刚,等.扇贝剥离设备喷嘴内部流场的仿真分析与参数优化[J].现代食品科技,2014,30(1):143-146.
WANG J Z,LI Q S,YI J G,et al.Numerical analysis of water jet processing nozzles' internal flow field [J].Modern Food Science and Technology,2014,30(1):143-146.
[3]CRUZ ROMERO M,KELLY A L,KERRY J P.Effects of high-pressure and heat treatments on physical and biochemical characteristics of oysters[J].Innovative Food Science and Emerging Technologies,2007,8(1):30-38.
[4]胡静艳.新型贻贝单边脱壳技术的研究[D].舟山:浙江海洋大学,2018.
HU J Y.Study on new unilateral shucking technique of mussels[D].Zhoushan:Zhejiang Ocean University,2018.
[5]周果,杨文鸽,崔燕,等.超高压处理对三疣梭子蟹感官及其肌原纤维蛋白生化特性的影响[J].食品科学,2017,38(23):269-274.
ZHOU G,YANG W G,CUI Y,et al.Effect of ultra-high pressure on sensory and biochemical properties of myofibrillar protein from Portunus trituberculatus[J].Food Science,2017,38(23):269-274.
[6]周航,刘斌,岳文亮,等.超高压技术在预制调理食品生产中的应用研究进展[J].包装与食品机械,2017,35(2):47-51.
ZHOU H,LIU B,YUE W L,et al.Research progress on application of ultra-high pressure technology in the production of pre-prepared food[J].Packaging and Food Machinery,2017,35(2):47-51.
[7]姜姝,腾军伟,刘振民,等.超高压处理对再制奶油干酪质构、流变学特性及微观结构的影响[J].食品科学,2021,42(5):84-91.
JIANG S,TENG J W,LIU Z M,et al.Effect of high hydrostatic pressure treatment on the texture,rheology and microstructure of processed cream cheese[J].Food Science,2021,42(5):84-91.
[8]刘书成,邓倩琳,黄万有,等.超高压处理对凡纳滨对虾虾仁蛋白质和微观结构的影响[J].水产学报,2017,41(6):877-887.
LIU S C,DENG Q L,HUANG W Y,et al.Effects of high hydrostatic pressure on protein and microstructure of Litopenaeus vannamei[J].Journal of Fisheries of China,2017,41(6):877-887.
[9]BALASUBRAMANIAM V M,MARTINEZ-MONTEAGUDO S I,GUPTA R.Principles and application of high pressure-based technologies in the food industry [J].Annual Review of Food Science and Technology,2015,6(1):435-462.
[10]王忱,张美莉.超高压对燕麦主要成分及微观结构影响的研究[J].食品科技,2021,46(2):124-129.
WANG C,ZHANG M L.Effect of ultrahigh pressure on the main components and microstructure of oats[J].Food Science and Technology,2021,46(2):124-129.
[11]谭属琼,陈厚荣,刘雄.食品工业中超高压处理技术研究进展[J].食品 与发酵工业,2010,36(12):146-151.
TAN S Q,CHEN H R,LIU X.The new research progress of ultra-high pressure treatment in food industry[J].Food and Fermentation Industries,2010,36(12):146-151.
[12]巩雪,常江,孙智慧,等.扇贝超高压保鲜包装实验[J].包装工程,2017,38(7):49-52.
GONG X,CHANG J,SUN Z H,et al.Experimental study on the high-pressure fresh-keeping packaging of scallop [J].Packaging Engineering,2017,38(7):49-52.
[13]袁超,赵峰,周德庆.超高压处理对冷藏鲍鱼保鲜效果与品质变化的影响[J].食品工业科技,2015,36(17):312-316.
YUAN C,ZHAO F,ZHOU D Q.Effects of ultra high pressure treatment on fresh keeping effect and quality of frozen abalone[J].Food Industry Science and Technology,2015,36(17):312-316.
[14]张登科,张慧恩,朱艳杰,等.超高压处理对养殖大黄鱼肌原纤维蛋白结构的影响[J].食品科学,2019,40(9):61-67.
ZHANG D K,ZHANG H E,ZHU Y J,et al.Effect of high hydrostatic pressure treatment on myofibrillar protein structure of cultured large yellow croaker[J].Food Science,2019,40(9):61-67.
[15]HERRERO A M.Raman spectroscopy for monitoring protein structurein muscle food systems[J].Critical Reviews in Food Science and Nutrition,2008,48(6):512-523.
[16]CARECHE M,GARCIA M L,HERRERO A,et al.Structural properties of aggregates from frozen stored hake muscle proteins[J].Journal of Food Science,2002,67(8):2827-2832.
[17]HERRERO A M.Raman spectroscopy a promising technique forquality assessment of meat and fish:A review[J].Food Chemistry,2008,107(4):1642-1651.
[18]徐建国,徐刚,张绪坤,等.利用核磁共振成像技术分析胡萝卜干燥过程中内部水分传递[J].农业工程学报,2013,29(12):271-276.
XU J G,XU G,ZHANG X K,et al.Moisture transport in carrot during hot air drying using magnetic resonance imaging[J].Transactions of the Chinese Society of Agricultural Engineering,2013,29(12):271-276.
[19]秦影,汤海青,欧昌荣,等.超高压处理对大黄鱼鱼糜水分状态和蛋白质结构的影响[J].农业工程学报,2015,31(23):246-252.
QIN Y,TANG H Q,OU C R,et al.Effect of ultra-high pressure on moisture status and protein structure of large yellow croaker surimi gel [J].Transactions of the Chinese Society of Agricultural Engineering,2015,31(23):246-252.
[20]HERRERO A M,CAMBERO M I,ORDÓÑEZ J A,et al.Raman spectroscopy study of the structural effect of microbial transglutaminase on meat systems and its relationship with textural characteristics[J].Food Chemistry,2008,109(1):25-32.
[21]李仁杰,廖小军,胡小松,等.超高压对蛋白质的影响[J].高压物理学报,2014,28(4):498-506.
LI R J,LIAO X J,HU X S,et al.Effects of high hydrostatic pressure on proteins[J].Chinese Journal of High Pressure Physics,2014,28(4):498-506.
[22]秦洋,邱超,曹金苗,等.干热处理对稻米复配粉及米蛋白性质的影响[J].现代食品科技,2015,31(9):180-184.
QIN Y,QIU C,CAO J M,et al.Effect of dry heat treatment on the properties of glutinous rice mixed flour and rice proteins[J].Modern Food Science and Technology,2015,31(9):180-184.
[23]孙佳悦,钱方,姜淑娟,等.基于红外光谱分析热处理对牛乳蛋白质二级结构的影响[J].食品科学,2017,38(23):82-86.
SUN J Y,QIAN F,JIANG S J,et al.Effect of heat treatments on the secondary structure of milk proteins analyzed by fourier transform infrared spectroscopy[J].Food Science,2017,38(23):82-86.
[24]李顺,张聚华,李秀艳,等.FT-IR 自去卷积法对丝织物蛋白酰胺Ⅲ带二级结构研究初探[J].北京服装学院学报(自然科学版),2011,31(2):68-73.
LI S,ZHANG J H,LI X Y,et al.Primary study of FT-IR self-deconvolution in the secondary structure of amide Ⅲof silk protein[J].Journal of Beijing Institute of Clothing Technology (Natural Science Edition),2011,31(2):68-73.