植物乳杆菌是乳酸菌之一,属于主导肠道微生物区系的厚壁菌门,广泛分布于蔬菜、发酵食品和健康人体肠道黏膜等生态环境中[1]。植物乳杆菌不仅具有降低胆固醇[2],调节免疫力[3],预防癌症[4],治疗肠易激综合症[5]及高血压[6]等作用,也是生产细菌素的重要菌种之一[7-9]。
植物乳杆菌NCU137 是一株来自桑葚果浆中的优良菌株,不仅具有耐酸、耐胆盐、耐高渗、抑菌等良好的生物学特性,而且在果蔬发酵中得到很好的应用。苏能能等[10]用植物乳杆菌NCU137 发酵桑葚,发酵后的桑葚营养和香气物质种类增加,抑菌性能和稳定性均显著提高;Yin 等[11]用植物乳杆菌NCU137 发酵薏苡仁,显著降低了有害物质2-戊基呋喃的含量,增加了可溶性膳食纤维的含量,得到了感官品质更好的产品;程浩等[12]用植物乳杆菌NCU137 发酵枸杞,并对其进行喷雾干燥制成粉末,得到的产品香气浓郁,口感细腻,稳定性高。然而,作为一种具有广阔应用前景的果蔬发酵剂,植物乳杆菌NCU137 高密度培养的研究尚未见报道,亟需开展植物乳杆菌NCU137 高密度培养技术的相关研究。
本文以植物乳杆菌NCU137 为研究对象,以MRS 培养基为基础培养基,活菌数作为指标,通过对培养基成分和静态培养条件的单因素实验、Plackett-Burman、最陡爬坡及中心组合等试验,确定最佳培养基成分与培养条件,为果蔬高活性菌剂制备奠定基础。
1 材料与方法
1.1 材料与试剂
植物乳杆菌NCU137,保藏于南昌大学食品科学与技术国家重点实验室植物基发酵益生菌资源库。
葡萄糖,上海豪申化学试剂有限公司;蛋白胨、牛肉粉、酵母粉,广东环凯微生物科技有限公司;磷酸氢二钾,天津市大茂化学试剂厂;柠檬酸三铵,天津市永大化学试剂有限公司;硫酸镁,上海市青析化工科技有限公司;无水乙酸钠、氢氧化钠、硝酸钾、七水合硫酸亚铁、CuSO4·5H2O、ZnSO4·7H2O、可溶性淀粉、海藻糖、乳清粉、胰蛋白胨、尿素、硫酸铵、硝酸铵,西陇化工股份有限公司;吐温80,上海市青析化工科技有限公司;MnSO4·H2O、MgSO4·7H2O,广东汕头市西陇化工厂;PBS 缓冲液、麦芽糖、蔗糖、乳糖、果糖、甘露醇、菊粉、大豆蛋白胨、鱼蛋白胨、酪蛋白胨、苯丙氨酸、酪氨酸、天冬氨酸、鸟嘌呤、尿嘧啶、VB1、VB2、VB5、VC、VE,北京Solarbio 科技有限公司;麦芽糖浆、果葡糖浆、葡萄糖浆,浙江华康药业股份有限公司;谷氨酸、蛋氨酸、半胱氨酸、缬氨酸、腺嘌呤、胸腺嘧啶,上海阿拉丁生化科技股份有限公司;甘氨酸,国药集团化学试剂有限公司;VB6,上海展云化工有限公司。所用试剂均由南昌大学食品科学与技术国家重点实验室提供。
1.2 仪器与设备
JA2003N 电子天平,上海精密科学仪器有限公司;MLS-3751L-PC 高压蒸汽灭菌锅,松下健康医疗器械株式会社;CJ-1680 超净工作台,苏州市净化设备有限公司;DNP-9272 型生化培养箱:上海精宏实验设备有限公司;KLF 3.7 L 小型发酵罐,瑞士比欧生物工程公司。
1.3 方法
1.3.1 菌株活化 植物乳杆菌NCU137 菌株用脱脂乳冷冻保藏在冻干管中(-80 ℃),每次试验前取适量菌粉于MRS 液体培养基中活化两次后划线,生长24~48 h 后挑取单菌落接种于MRS 液体培养基中,传代两次后进行后续试验。
1.3.2 单因素实验
1.3.2.1 碳源 以MRS 为基础,分别以2%的麦芽糖、乳糖、蔗糖、果糖、海藻糖、甘露醇、菊粉、可溶性淀粉、果葡糖浆、麦芽糖浆、葡萄糖浆代替培养基中的葡萄糖为碳源进行单因素实验。确定碳源后,分别以质量浓度为10,15,20,25,30,35,40 g/L 的碳源进行单因素实验。
1.3.2.2 氮源 在上一步实验基础上,分别以25 g/L 蛋白胨、酵母浸粉、牛肉浸粉、大豆蛋白胨、胰蛋白胨、酪蛋白胨、鱼蛋白胨、尿素、(NH4)2SO4、NaNO3、代替MRS 中的氮源进行单因素实验。根据实验结果,对氮源复配(表1)复配并确定最佳氮源的复配比例。之后,分别加入质量浓度为10,15,20,25,30,35,40,45,50 g/L 的复合氮源进行单因素实验。
表1 不同氮源的复配比例
Table 1 The composition ratio of different nitrogen sources
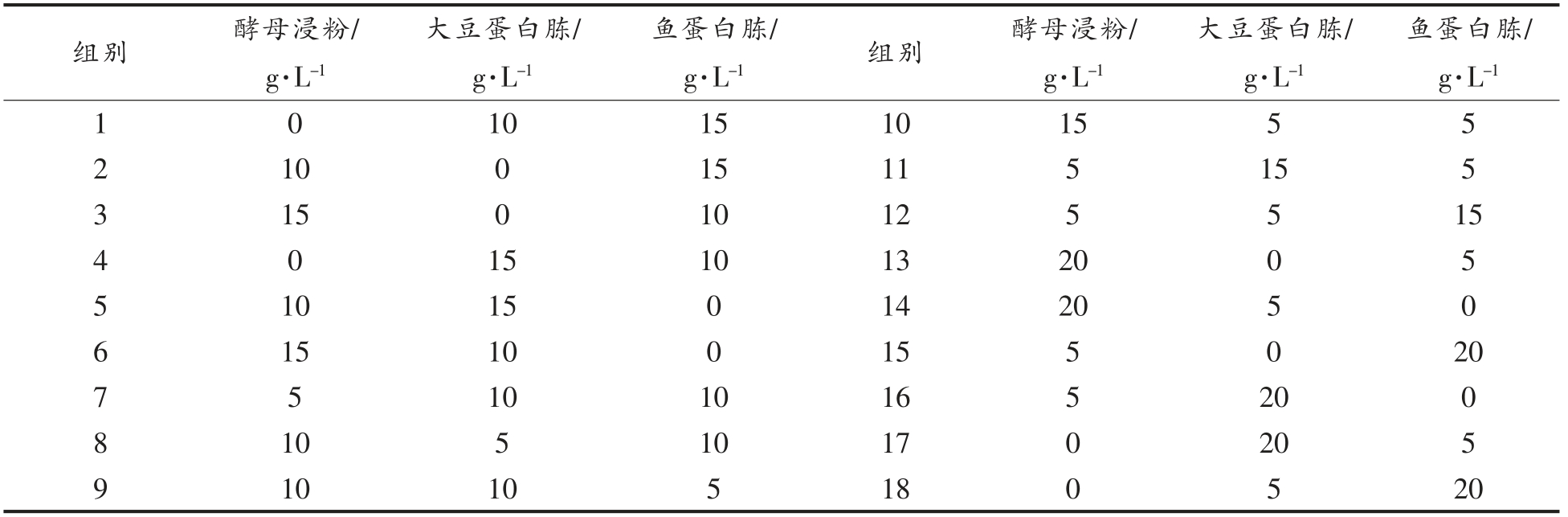
组别 酵母浸粉/g·L-1鱼蛋白胨/g·L-1 1 0 10 15 10 15 5 5 2 10 0 15 11 5 15 5 3 15 0 10 12 5 5 15 4 0 15 10 13 20 0 5大豆蛋白胨/g·L-1鱼蛋白胨/g·L-1 组别 酵母浸粉/g·L-1大豆蛋白胨/g·L-1 10 15 0 14 20 5 0 6 15 10 0 15 5 0 20 7 5 10 10 16 5 20 0 5 10 5 10 17 0 20 5 9 10 10 5 18 0 5 20 8
1.3.2.3 微量元素 在上一步实验基础上,分别加入不同种类、不同质量浓度的微量元素(FeSO4·7H2O、ZnSO4·7H2O、CuSO4·5H2O、MnSO4·H2O、Mg-SO4·7H2O)进行单因素实验。
1.3.2.4 生长因子 加入氨基酸类(谷氨酸、蛋氨酸、半胱氨酸、缬氨酸、苯丙氨酸、甘氨酸、酪氨酸、天冬氨酸)、核苷酸类(腺嘌呤、胸腺嘧啶、鸟嘌呤、尿嘧啶)、维生素类(VB1、VB2、VB5、VB6、VC、VE)等生长因子进行单因素实验。
1.3.3 Plackett-Burman 试验设计 以碳源、氮源、微量元素、生长因子、吐温-80 等因素为考察对象,采用Plackett-Burman 试验设计,以植物乳杆菌NCU137 的活菌数为响应值,筛选出对植物乳杆菌NCU137 生长具有显著影响的因子。
1.3.4 最陡爬坡试验设计 根据Plackett-Burman试验设计得到的回归系数,确定显著影响因子的最陡爬坡试验的方向和梯度,从而获得中心组合试验因素的中心点。
1.3.5 中心组合试验设计 根据Plackett-Burman试验和最陡爬坡试验确定的试验因素和中心点,采用Design-Expert 软件进行响应面优化,以获得响应变量与各因素变量关系的二次多项回归拟合方程。根据方程计算得到植物乳杆菌NCU137 最佳增殖培养基配方。
1.3.6 静态培养条件的优化 以不同初始pH值、接种量、温度进行单因素实验,根据实验结果以活菌数为指标进行L9(34)正交试验(表2),确定最佳静态培养条件。
表2 正交试验因素及水平设计
Table 2 The design levels and factors of orthogonal
experimental
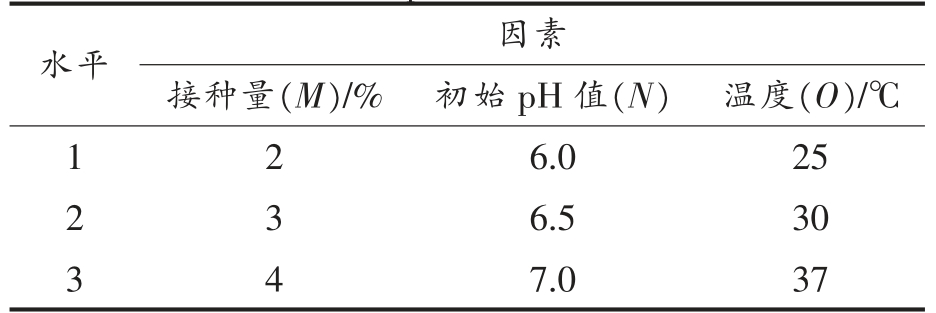
水平 因素接种量(M)/% 初始pH 值(N) 温度(O)/℃1 2 6.0 25 2 6.5 30 3 4 7.0 37 3
1.4 数据处理
采用Design-Expert 软件进行响应面试验设计与分析,采用SPSS 25.0 进行差异性分析,采用Origin 2018 进行图形的绘制。
2 结果与分析
2.1 单因素实验
2.1.1 碳源对植物乳杆菌NCU137 活菌数的影响 碳源是微生物生长必不可少的条件之一,它可以调节微生物的生长代谢及胞内生物活性[13]。由图1和2 可知,麦芽糖促进植物乳杆菌NCU137生长效果最显著,且随着麦芽糖添加量的增加,活菌数呈先上升后下降的趋势,在添加量为25 g/L时达到最高。综上,最优碳源添加量为麦芽糖25 g/L。
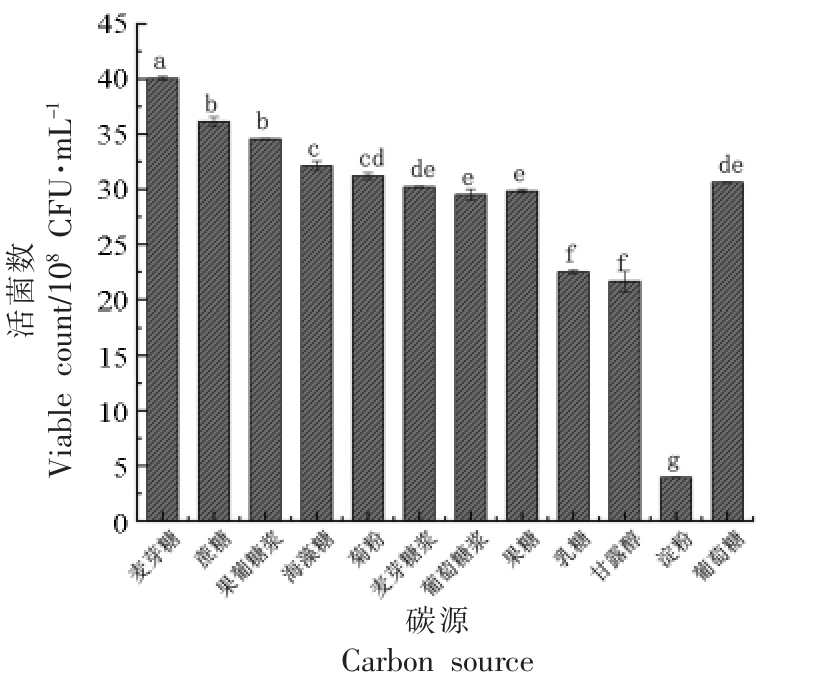
图1 不同碳源对植物乳杆菌NCU137 活菌数的影响
Fig.1 Effects of different carbon sources on viable count of L.plantarum NCU137
注:不同小写字母表示差异显著(P<0.05),下同。
2.1.2 氮源对植物乳杆菌NCU137 活菌数的影响 由图3可知,鱼蛋白胨、酵母浸粉、大豆蛋白胨作为氮源活菌数均较高,而与MRS 培养基中复配氮源相比活菌数略有降低。综上,选择鱼蛋白胨、酵母浸粉、大豆蛋白胨3 种氮源进行复配(表1),并对结果进行方差分析。
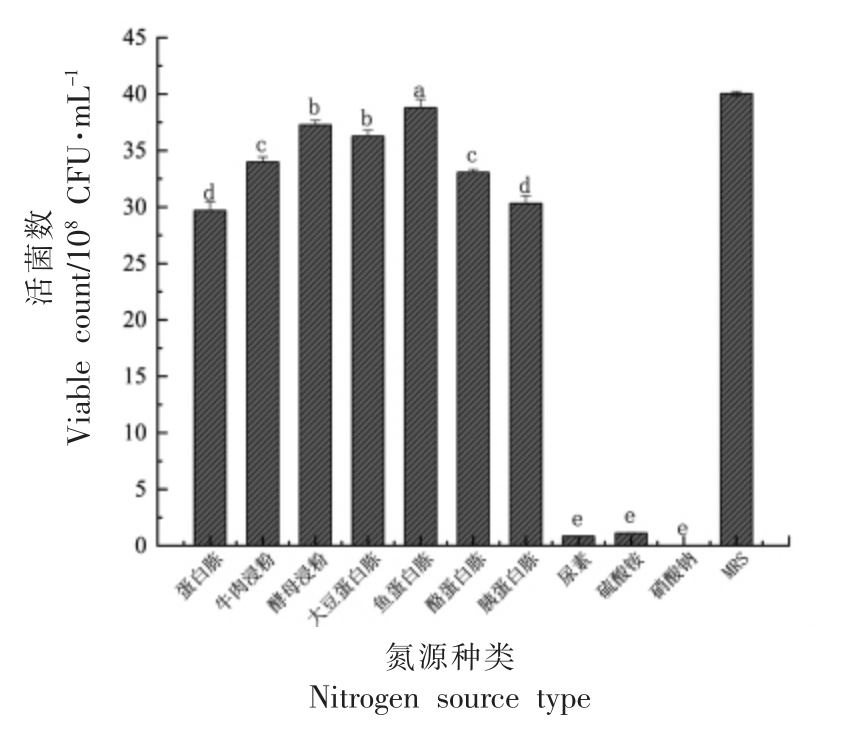
图3 不同氮源对植物乳杆菌NCU137 活菌数的影响
Fig.3 The effects of different nitrogen sources on viable count of L.plantarum NCU137
由图4和5 可知,以15 g/L 的酵母浸粉和10 g/L 的大豆蛋白胨作为复配氮源时,活菌数最高。随着氮源添加量的升高,活菌数呈先上升后下降的趋势,当添加量为40 g/L 时达到最高,然而,与氮源添加量为35 g/L 相比,活菌数无显著性差异,从成本上考虑选择35 g/L 的添加量,既最优氮源:酵母浸粉21 g/L,大豆蛋白胨14 g/L。
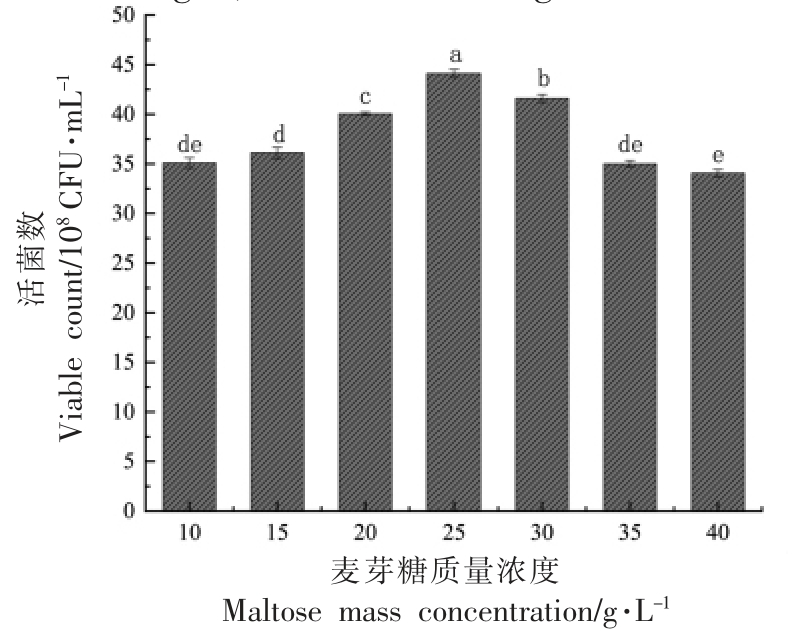
图2 不同麦芽糖质量浓度对植物乳杆菌NCU137活菌数的影响
Fig.2 The effects of different maltose mass concentrations on viable count of L.plantarum NCU137
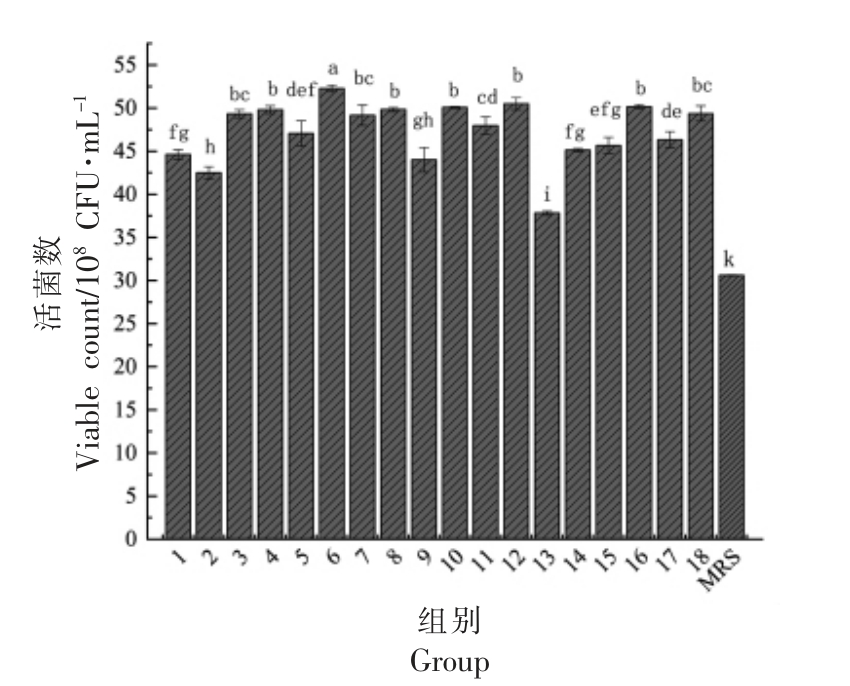
图4 不同复配氮源对植物乳杆菌NCU137活菌数的影响
Fig.4 Effects of different mixed nitrogen sources on viable count of L.plantarum NCU137
2.1.3 微量元素对植物乳杆菌NCU137 活菌数的影响 微量元素是一类量极微却对微生物生长有促进作用的元素,也是某些活性物质的组成成分或者酶的激活剂[14]。由图6可知,添加Cu2+、Fe2+、Zn2+对植物乳杆菌NCU137 的生长没有促进作用,而Mg2+和Mn2+对植物乳杆菌NCU137 的生长有明显的促进作用。当MgSO4·7H2O 和MnSO4·H2O 分别为0.15 g/L 和0.06 g/L 时活菌数达到最高,因此选择其作为微量元素最优添加量。
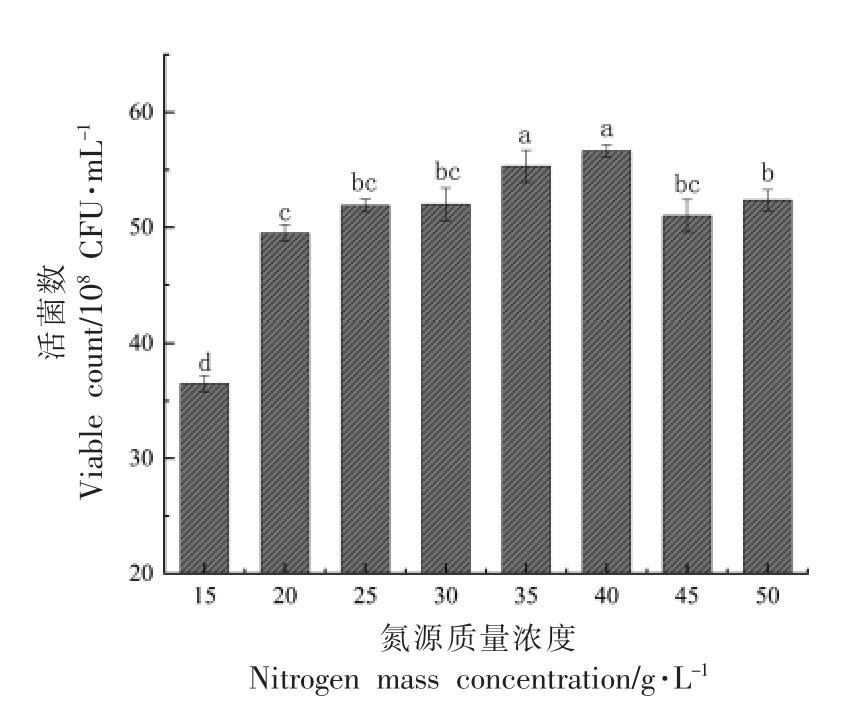
图5 不同氮源质量浓度对植物乳杆菌NCU137活菌数的影响
Fig.5 The influence of different nitrogen mass concentrations on viable count of L.plantarum NCU137

图6 不同质量浓度Cu2+、Fe2+、Zn2+、Mg2+、Mn2+对植物乳杆菌NCU137 活菌数的影响
Fig.6 The effects of different mass concentrations of Cu2+,Fe2+,Zn2+,Mg2+ and Mn2+on viable countof L.plantarum NCU137
2.1.4 生长因子对植物乳杆菌NCU137 活菌数的影响 生长因子是一类调节微生物正常生长代谢所必需的物质[15]。由图7可知,氨基酸类物质中苯丙氨酸对植物乳杆菌NCU137 的生长具有显著的促进作用,核苷酸类物质中腺嘌呤增菌效果显著,维生素类物质对植物乳杆菌NCU137 生长的均无显著促进作用,甚至添加VB1、VE 等维生素会抑制植物乳杆菌NCU137 的生长。由图8可知,苯丙氨酸和腺嘌呤的最佳添加量分别为0.04 g/L 和0.10 g/L。
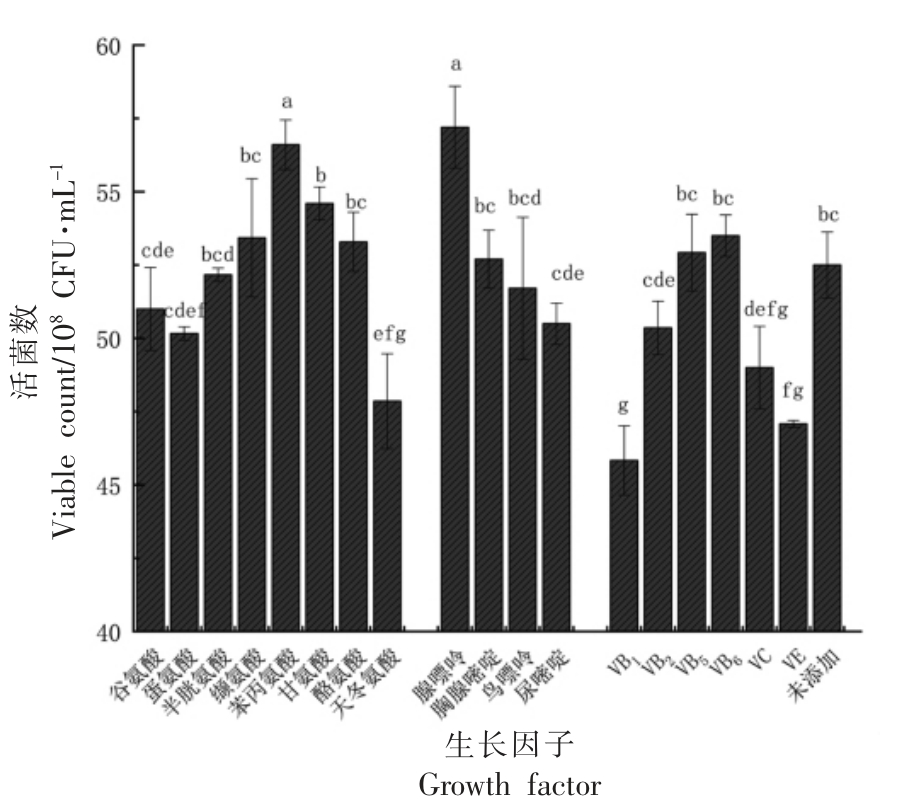
图7 不同生长因子对植物乳杆菌NCU137活菌数的影响
Fig.7 The effects of growth factors on the viable count of L.plantarum NCU137
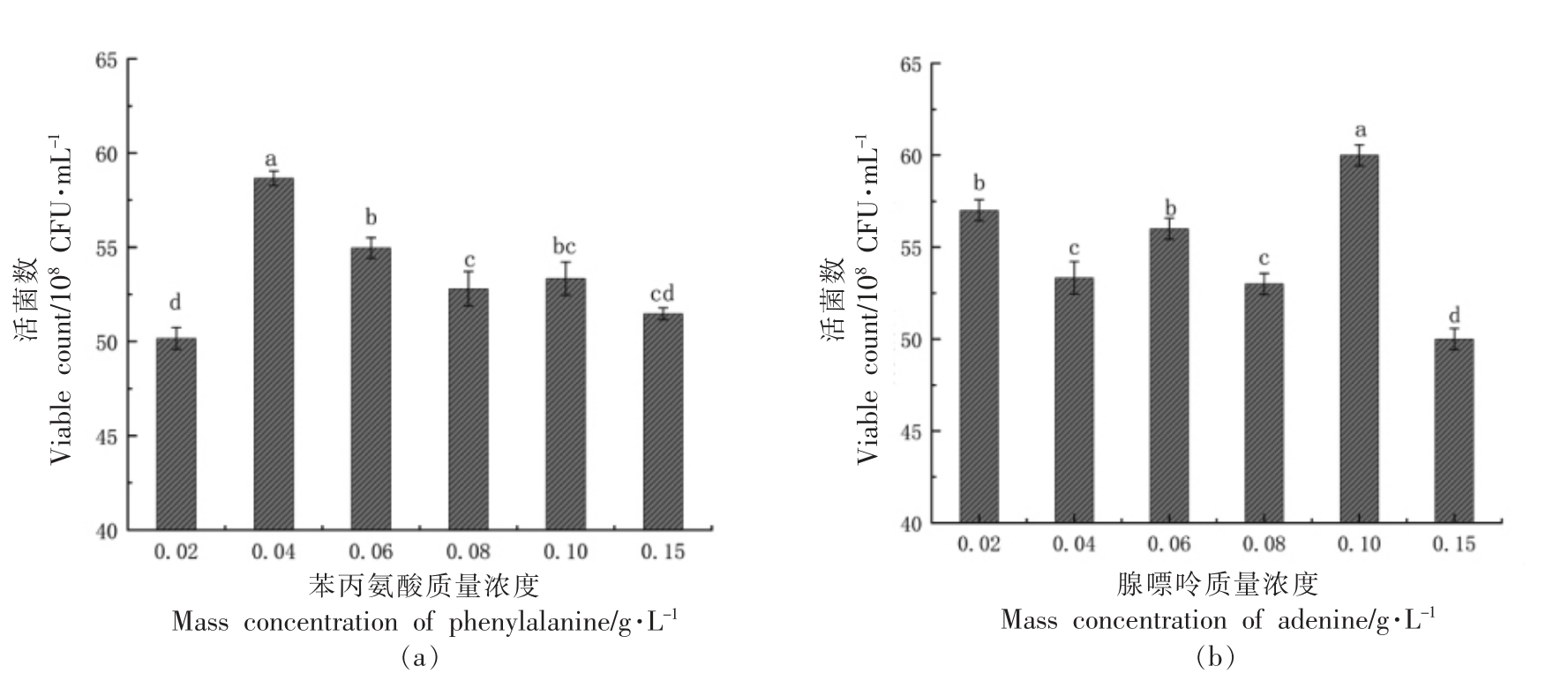
图8 不同苯丙氨酸和腺嘌呤质量浓度对植物乳杆菌NCU137 活菌数的影响
Fig.8 The effects of different mass concentrations of phenylalanine and adenine on viable count of L.plantarum NCU137
2.2 Plackett-Burman 试验筛选显著影响因子
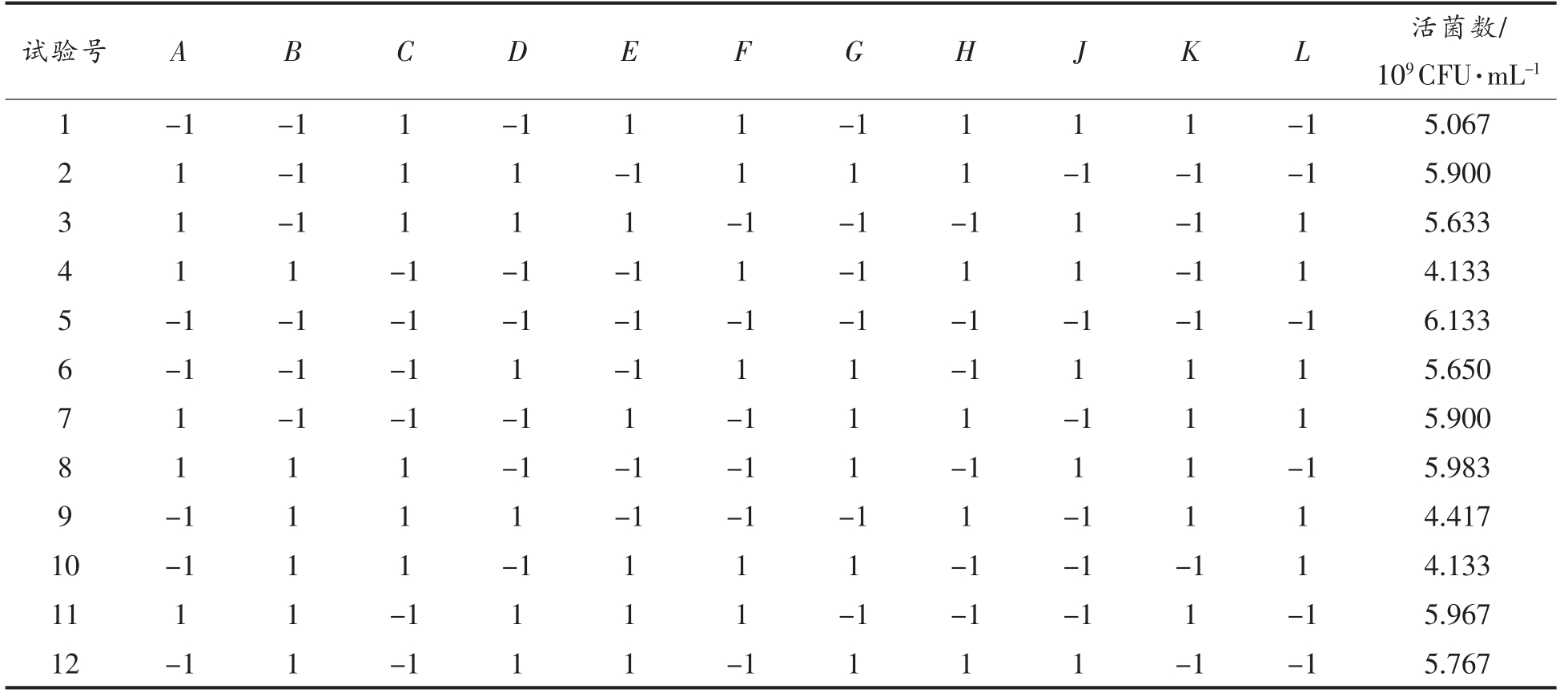
Plackett-Burman 试验设计及结果如表3所示。以麦芽糖(A)、酵母浸粉(B)、大豆蛋白胨(C)、MgSO4·7H2O(D)、MnSO4·H2O(E)、苯丙氨酸(F)、腺嘌呤(G)、吐温-80(H)添加量作为Plackett-Burman 试验的因素及3 个虚拟因素 (J、K、L),根据结果筛选出对植物乳杆菌NCU137 活菌数有显著影响的因素。
表3 Plackett-Burman 试验设计及结果
Table 3 Plackett-Burman experiment design and results
?
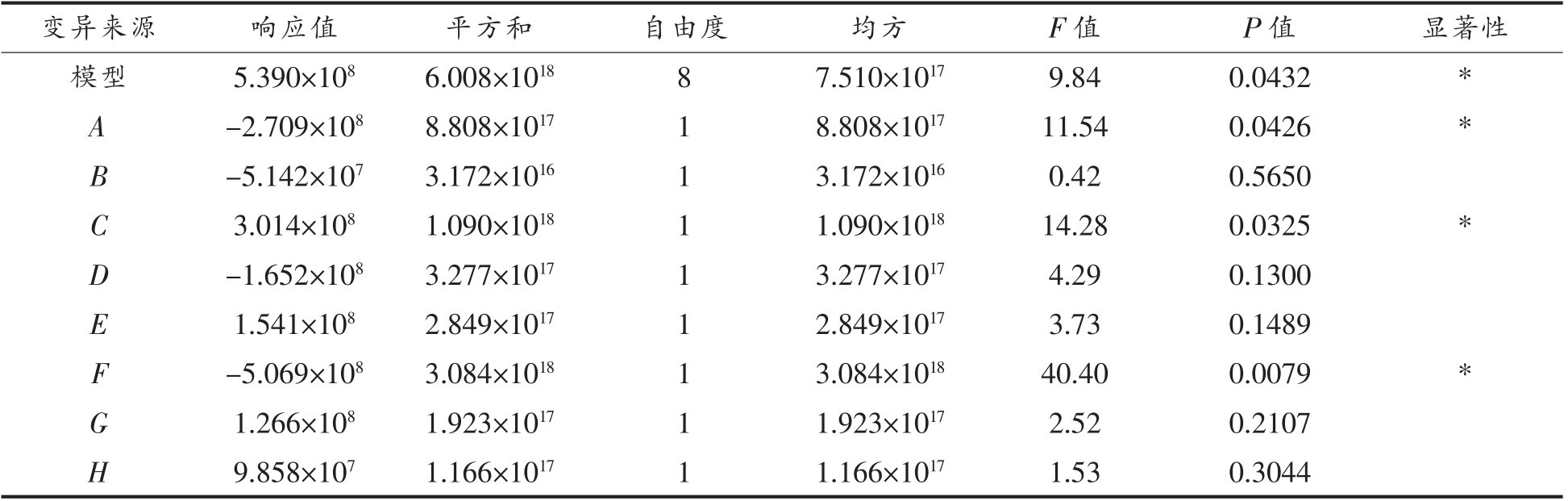
由表4可得模型显著(P<0.05),相关系数R2=0.9633,说明相关性较好,且麦芽糖、大豆蛋白胨、苯丙氨酸3 个因素为显著因素(P<0.05),其余因素为非显著因素。根据Design Expert 软件预测,非显著因素的优化结果为:酵母浸粉21.8 g/L、MnSO4·H2O 0.06 g/L、MgSO4·7H2O 0.15 g/L、腺嘌呤0.13 g/L、吐温-80 1 mL/L。
2.3 最陡爬坡试验
由表4可知,大豆蛋白胨响应值为正值,其最陡爬坡试验值随试验编号的增加而增加,相应的,麦芽糖和苯丙氨酸响应值为负值,其最陡爬坡试验值随试验编号的增加而减少。由表5可知,试验号3 号活菌数最高,既最陡爬坡试验拐点,因此选择第3 组数据作为后续中心组合试验设计的中心点。
表4 Plackett-Burman 试验方差分析
Table 4 Variance analysis of Plackett-Burman design
?
表5 最陡爬坡试验及其结果
Table 5 Steepest climb design with experimental results

试验号 麦芽糖/g·L-1 大豆蛋白胨/g·L-1 苯丙氨酸/g·L-1 活菌数/109 CFU·mL-1 1 30 14 0.06 6.353 2 29 15 0.05 5.800 3 28 16 0.04 6.750 4 27 17 0.03 6.400 5 26 18 0.02 6.217 6 25 19 0.01 6.317
2.4 中心组合试验
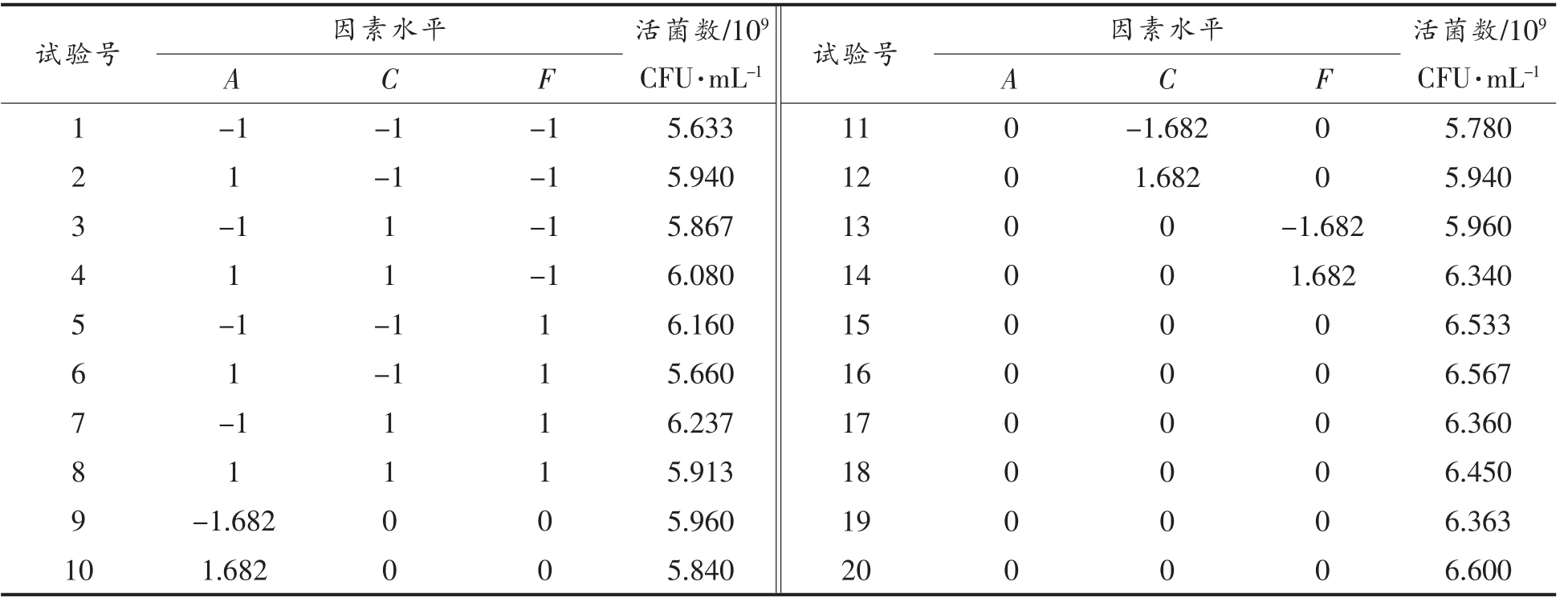
根据Plackett-Burman 试验和最陡爬坡试验结果,以活菌数为响应值,选取麦芽糖、大豆蛋白胨和苯丙氨酸添加量3 个因素进行响应面中心组合试验(表6),试验设计和结果如表7、8 所示。
表6 中心组合设计因子水平表
Table 6 Level table of central composite design factors

?
表7 中心组合试验设计结果
Table 7 Results of central combination test design
试验号 因素水平 活菌数/109 A C F CFU·mL-1 试验号 因素水平 活菌数/109 CFU·mL-1 A C F 1-1-1-1 5.633 11 0-1.682 0 5.780 1-1-1 3-1 1-1 4 1 1-1 5-1-1 1 6 1-1 1 7-1 1 1 8 1 1 1 9-1.682 0 0 10 1.682 0 0 2 5.940 5.867 6.080 6.160 5.660 6.237 5.913 5.960 5.840 12 13 14 15 16 17 18 19 20 000000000 1.682 00000000 0-1.682 1.682 000000 5.940 5.960 6.340 6.533 6.567 6.360 6.450 6.363 6.600
通过软件Design-Expert 8.0.6 对试验结果进行二次多元拟合,得到的方程为Y=6.479×109-3.707 ×107A +7.122 ×107C +7.971 ×107F +1.019 ×107AC-1.681×108AF-5.562×106CF-2.052×108A2-2.194×108C2-1.169×108F2。
由表8可知:F、AF、A2、C2 影响极显著(P<0.01),C 和F2 影响显著(P<0.05);模型效应极显著(P<0.01);失拟项不显著(P>0.05)。模型R2=0.9549,说明该方程与实际情况拟合良好。
表8 响应面二次模型方差分析结果
Table 8 ANOVA for response surface quadratic model

注:“*”表示显著(P<0.05),“**”表示极显著(P<0.01)。
变异来源 平方和 自由度 均方 F 值 P 值 显著性模型 1.676×1018 9 1.862×1017 23.54 <0.0001 **A 1.8 77×1016 26×1016 77×1016 1 1.877×1016 2.37 0.1544 C 6.91 6.926×1016 8.76 0.0143 *F 8.61 8.677×1016 10.97 0.0078 **AC 8.303×1014 1 8.303×1014 0.10 0.7526 AF 2.260×1017 1 2.260×1017 28.57 0.0003 **CF 2.475×1014 1 2.475×1014 0.031 0.8631 A2 6.071×1017 1 6.071×1017 76.76 <0.0001 **C2 6.936×1017 1 6.936×1017 87.70 <0.0001 **F2 1.968×1017 1 1.968×1017 24.88 0.0005 *残差 7.909×1016 10 7.909×1015失拟项 2.521×1016 5 5.042×1015 0.47 0.7878 不显著纯误差 5.387×1016 5 1.077×1016总离差 1.755×1018 19
依据以上回归模型,得到麦芽糖与大豆蛋白胨、麦芽糖与苯丙氨酸、大豆蛋白胨与苯丙氨酸的交互作用图。由图9~11 可知,等高线图呈椭圆形,均存在极点,说明两者之间交互作用显著,与二次模型方差分析结果一致。根据回归模型,得出最优麦芽糖添加量为26.73 g/L,大豆蛋白胨添加量为16.59 g/L,苯丙氨酸添加量为0.051 g/L,此时预测活菌数为7.0126×109 CFU/mL。在此条件下进行验证试验,此时活菌数为6.95×109 CFU/mL,与模型预测值拟合率为99.0%,说明该模型能够较好地预测培养基组成对活菌数的影响。

图9 麦芽糖和大豆蛋白胨交互作用响应面图
Fig.9 Response surface map of interaction between maltose and soybean peptone

图10 大豆蛋白胨和苯丙氨酸交互作用响应面图
Fig.10 Response surface map of interaction between soybean peptone and phenylalanine
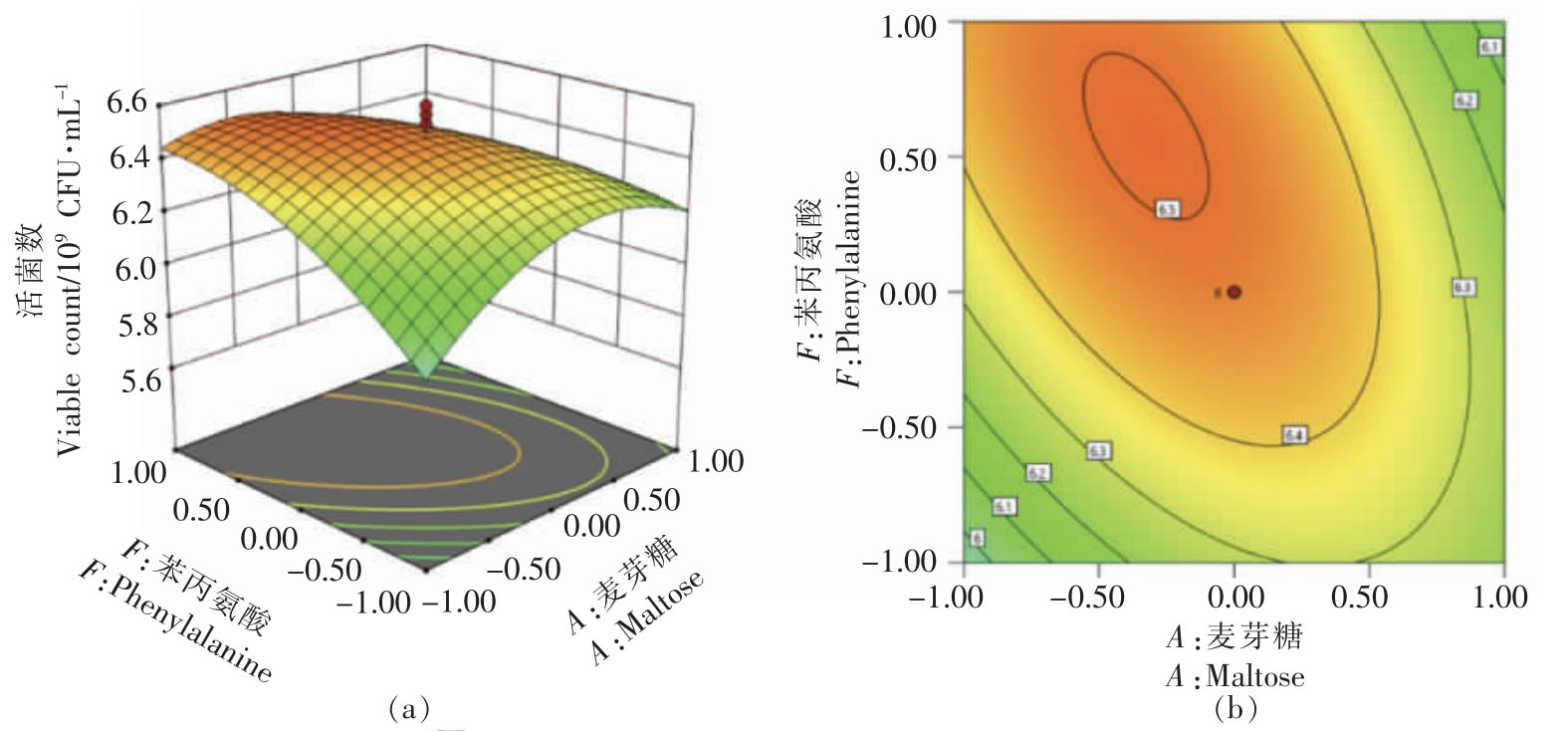
图11 麦芽糖和苯丙氨酸交互作用响应面图
Fig.11 Response surface map of interaction between maltose and phenylalanine
2.5 初始pH 值、接种量与温度对活菌数的影响
2.5.1 单因素实验 合适的初始pH 值可以使细胞膜脂肪酸不饱和度增加,从而细胞膜流动性增加,保持较好的细胞膜完整性[16]。接种量的大小会影响整个发酵过程,接种量过大时将会导致溶解氧快速耗尽,从而抑制菌株的快速生长与代谢产物的生成[17]。温度可一定程度上影响细胞中的酶、蛋白质、DNA、RNA 等大分子的合成与活性[18]。植物乳杆菌NCU137 静态培养条件试验结果如图12所示,调整优化培养基初始pH 值分别为5.0,5.5,6.0,6.5,7.0,7.5,随着初始pH 值的上升,植物乳杆菌NCU137 活菌数呈先上升后下降的趋势,在初始pH 为7.0 时活菌数达到最高。对植物乳杆菌NCU137 接种量分析表明,接种量在1%~3%范围内时,随着接种量的增加活菌数升高,当接种量超过3%后,活菌数开始下降。由此得最适初始pH值为7.0,接种量为3%。改变培养温度时,植物乳杆菌NCU137 活菌数呈先上升后下降的趋势,发现在45 ℃培养时植物乳杆菌NCU137 活菌数降低,表明培养温度过高不利于菌株生长并导致其死亡,培养温度30 ℃和25 ℃时活菌数无显著性差异,达8.5×109 CFU/mL,显著高于在37 ℃下培养的活菌数。
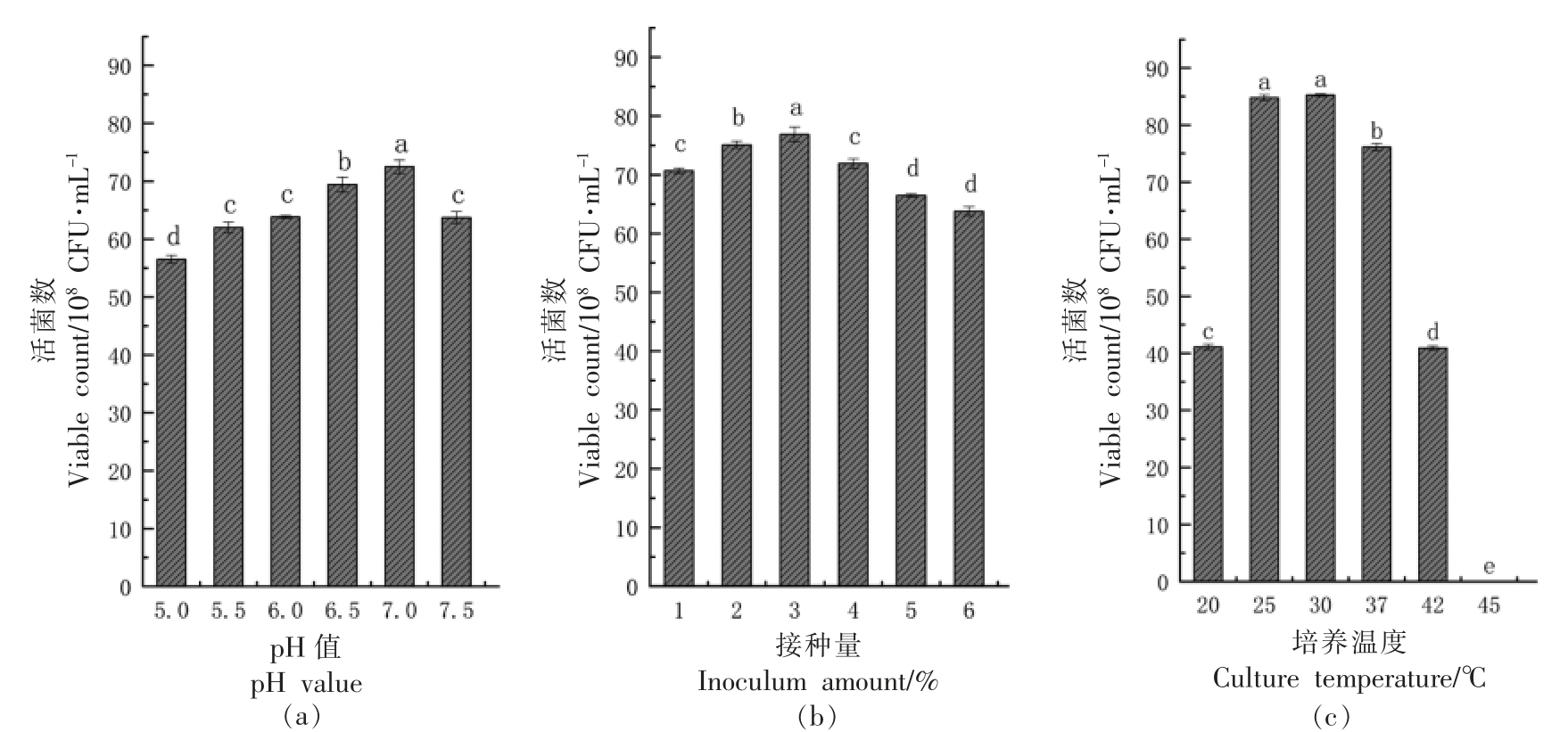
图12 初始pH 值、接种量与温度对植物乳杆菌NCU137 活菌数的影响
Fig.12 Effects of initial pH value,inoculation amount and culture temperature on viable count of L.plantarum NCU137
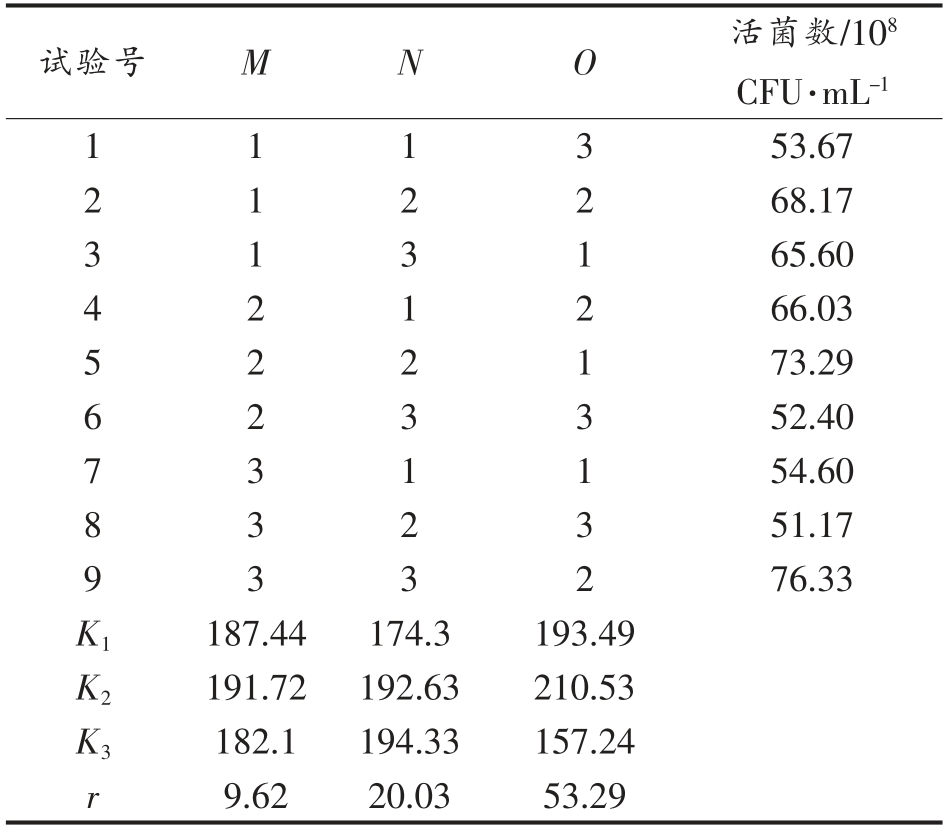
2.5.2 正交试验 由表9结果可知,影响活菌数的主次因素为:温度>初始pH 值>接种量。试验结果确定出的最佳培养条件为:M2N3O2,即接种量3%,初始pH 7.0,温度30 ℃,此时活菌数为9.2×109 CFU/mL。
表9 培养条件正交试验结果
Table 9 L9(34) orthogonal array design and results
?
3 结论
本研究通过对植物乳杆菌NCU137 的培养基成分及培养条件进行优化。得到最优条件:麦芽糖26.73 g/L,酵母浸粉21.8 g/L,大豆蛋白胨16.59 g/L,MgSO4·7H2O 0.15 g/L,MnSO4·H2O 0.06 g/L,腺嘌呤0.13 g/L,苯丙氨酸0.051 g/L,吐温80 1 mL/L,初始pH 值7.0,接种量3%,培养温度30℃,最终活菌数达到9.2×109 CFU/mL,在此优化条件下,于3.5 L 发酵罐中培养,活菌数为1.1×1010 CFU/mL,是基础MRS 普通培养条件的3.67 倍。
[1]SIEZEN R J,TZENEVA V A,CASTIONI A,et al. Phenotypic and genomic diversity of Lactobacillus plantarum strains isolated from various environmental niches[J].Environmental Microbiology,12 (2010):758-773.
[2]LI X P,XIAO Y C,SONG L Q,et al.Effect of Lactobacillus plantarum HT121 on serum lipid profile,gut microbiota,and liver transcriptome and metabolomics in high cholesterol diet-induced hypercholesterolaemia rat model[J].Nutrition,2020,79-80:110966.
[3]周雨霞.内蒙古牧区传统乳制品中乳杆菌生物学特性及其益生作用的研究[D].呼和浩特:内蒙古农业大学,2006.
ZHOU Y X.Study on biological properties and probiotics effect of Lactobacillusfrom traditional dairy products in Inner Mongolia[D].Hohhot:Inner Mongolia Agricultural University,2006.
[4]KWAK S H,CHO Y M,NOH G M,et al.Cancer preventive potential of kimchi lactic acid bacteria(Weissella cibaria,Lactobacillus plantarum) [J].Journal of Cancer Prevention,2014,19(4):253-258.
[5]BAO L,YANG S H.Efficacy of Lactobacillus plantarum in prevention of inflammatory bowel disease[J].Toxicology Reports,2018,5(3):314-317.
[6]LEWIS-MIKHAEL A M,DAVOODVANDI A,JAFARNEJAD S.Effect of Lactobacillus Plantarum containing probiotics on blood pressure:A systematic review and meta-analysis[J].Pharmacological Research,2020,153:104663.
[7]SABO S S,VITOLO M,JMD G,et al.Overview of Lactobacillus plantarum as a promising bacteriocin producer among lactic acid bacteria[J].Food Research International,2014,64:527-536.
[8]PENG S D,SONG J J,ZENG W Y,et al.A broad-spectrum novel bacteriocin produced by Lactobacillus plantarum SHY 21-2 from yak yogurt:Purification,antimicrobial characteristics and antibacterial mechanism[J].LWT,2021,142:110955.
[9]SIDHU P K,NEHRA K.Purification and characterization of bacteriocin Bac23 extracted from Lactobacillus plantarum PKLP5 and its interaction with silver nanoparticles for enhanced antimicrobial spectrum against food-borne pathogens[J].LWT,2021,139:110546.
[10]苏能能,关倩倩,彭珍,等.乳酸菌发酵对桑葚浆品质及抑菌性能的影响[J].食品与发酵工业,2018,44(9):117-124.
SU N N,GUAN Q Q,PENG Z,et al.Effects of lactic acid bacteria on quality and antibacterial properties of mulberry puree[J].Food and Fermentation Industries,2018,44(9):117-124.
[11]YIN H M,ZHONG Y D,XIA S K,et al.Effects of fermentation with Lactobacillus plantarum NCU137 on nutritional,sensory and stability properties of Coix (Coix lachryma-jobi L.) seed[J].Food Chemistry,2019,314:126037.
[12]程浩,秦小彤,熊涛.响应面法优化喷雾干燥制备乳酸菌发酵枸杞粉工艺[J].南昌大学学报(理科版),2020,44(2):135-142.
CHENG H,QIN X T,XIONG T.Response surface optimization of production of lactic acid bacteria fermented lycium barbarum powder by spray drying[J].Journal of Nanchang University (Natural Science),2020,44(2):135-142.
[13]刘毓锋,曾嘉锐,黄文琪,等. 外源碳源对葡萄酵素微生物生长代谢及生物活性的调节作用[J].食品工业科技,2020,41(8):104-110,116.
LIU Y F,ZENG J R,HUANG W Q,et al.Regulating effect of exogenous carbon source on microbial growth and metabolism in grape fermentation and its bioactivity[J].Science and Technology of Food Industry,2020,41(8):104-110,116.
[14]崔树茂.乳酸菌的生长抑制和冻干存活的影响因素及规律[D].无锡:江南大学,2017.
CUI S M.The impact factors and rules of growth inhibition and freeze-drying survival for lactic acid bacteria[D].Wuxi:Jiangnan University,2017.
[15]周德庆.微生物学教程[M].北京:高等教育出版社,2011:90.
ZHOU D Q.Microbiology course[M].Beijing:Higher Education Press,2011:90.
[16]ZHANG Q L,MA L L,E J J,et al.Effects of initial pH on heat resistance of Lactobacillus plantarum LIP-1[J].LWT,2021,138:110748.
[17]王帅.植物乳杆菌培养及冻干技术研究[D].西安:陕西科技大学,2016.
WANG S.Study on cultivation and cryoprotectant of Lactobacillus plantarum[D].Xi'an:Shaanxi University of Science and Technology,2016.
[18]SCHOUG A,FISCHER J,HEIPIEPER H J,et al.Impact of fermentation pH and temperature on freeze-drying survival and membrane lipid composition of Lactobacillus coryniformis Si3[J].Journal of Industrial Microbiology & Biotechnology,2008,35(3):175-181.