乳酸菌(Lactic Acid Bacteria,LAB)是一类发酵碳水化合物产生乳酸的革兰氏阳性细菌[1],近年来,乳酸菌发酵食品行业迅速崛起,在食品工业中占有越来越重要的地位[2]。然而,在乳酸菌在发酵食品的生产、贮藏、销售、食用以及进入人体胃肠道过程中,经常受到多种环境胁迫,严重影响了乳酸菌的正常代谢、发酵产品的品质和益生作用的发挥[3]。
发酵乳制品工业目前已成为国民经济中的“朝阳产业”,但目前发酵乳制品普遍存在后酸化现象,已成为目前发酵乳制品工业亟待解决的技术瓶颈[4]。有研究表明,保加利亚乳杆菌是导致酸奶后酸化的主要菌种[4]。该菌发酵乳制品在贮藏过程中往往会同时遭受多种环境胁迫,不同环境胁迫之间交叉复杂,简单的单一环境胁迫的研究具有一定局限性[5]。目前研究发现:不同环境胁迫之间存在关联,菌体细胞在处于多种环境胁迫时会发生交互保护作用,使菌体细胞抵抗胁迫的能力增强[6-11]。而目前尚缺少有关保加利亚乳杆菌在不同环境胁迫下交互保护作用详尽系统的研究报道。
目前有学者认为: 交互保护作用可能由菌体细胞体内一些环境胁迫应激基因的重叠效应引起[12-14]。此外,作为目前先进的研究方法和技术手段,实时荧光定量PCR(qRT-PCR)技术具有灵敏度高、特异性强、重复性好、定量准确等优点被广泛应用于菌体细胞目的基因表达水平的定量分析研究之中[15]。
本文以保加利亚乳杆菌的模式菌株ATCC 11842 为试验菌株,探究不同环境胁迫条件(酸、盐、胆盐、氧、冷)对菌株存活率的影响,确定菌体细胞在不同环境胁迫(酸、盐、胆盐、氧、冷)下的亚致死条件与最低致死条件;在此基础上,研究菌体细胞在多重环境胁迫下的交互保护作用;根据前期ATCC 11842 菌株在酸奶后酸化不同条件下转录组学测序结果,采用实时荧光定量PCR(qRTPCR)技术,分析响应酸胁迫基因在不同环境胁迫(亚致死条件处理)下转录水平的表达量变化。本研究为进一步揭示保加利亚乳杆菌在多种环境胁迫下抗逆保护机制与定向选育抗逆性菌株,提供科学依据和理论指导。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株 保加利亚乳杆菌(Lactobacillus delbrueckii subsp.buLgaricus ATCC 11842):保加利亚乳杆菌模式菌株,本研究试验菌株,购自中国普通微生物菌种保藏管理中心 (China General Microbiological Culture Collection Center,CGMCC),-80 ℃低温冰箱保存于河北农业大学食品科技学院发酵工程研究室。
1.1.2 培养基和生理盐水 MRS 培养基:液体用于菌种的活化,固体用于活菌计数。
生理盐水:用分析天平准确称取9 g 氯化钠,用蒸馏水稀释至1 L,115 ℃灭菌20 min,用于活菌计数的稀释液。
1.1.3 主要试剂 TaKaRa RNAiso Plus 总RNA提取试剂盒、Prime ScriptTM RT reagent Kit with gDNA Eraser cDNA 第一链合成试剂盒,美国Thermo Fisher Scientific 有限公司;2 ×SYBR Green qPCR Master Mix 荧光定量PCR 试剂盒,苏州宇恒生物科技有限公司。
1.1.4 仪器与设备 高压蒸汽灭菌锅,上海东亚压力容器公司;DW-86L33 超低温保存箱,厦门森态仪器仪表有限公司;Hettich UNIVERSAL 320高速冷冻离心机、Micro 120 型高速离心机,德国hettich 公司;罗氏LightCycler96 实时荧光定量PCR 仪,罗氏诊断产品(上海)有限公司。
1.2 试验方法
1.2.1 ATCC 11842 菌株在不同环境胁迫条件下交互保护作用研究
1.2.1.1 不同环境胁迫条件对ATCC 11842 菌株存活率的影响 ATCC 11842 菌株经MRS 液体培养基42 ℃活化后,以1%(体积分数) 接入起始pH值6.8、100 mL 液体MRS 培养基的锥形瓶中,42 ℃静置培养10 h 至对数中期,4 ℃、6 000 r/min、离心10 min 收集10 mL 菌体并重悬于等体积的液体MRS 培养基中。将重悬液分别按表1不同胁迫条件下处理后,4 ℃、6 000 r/min、离心10 min 收集1 mL 菌体,分别用生理盐水洗涤2 次,分别进行活菌计数,每次试验重复3 次。
表1 不同环境胁迫因素与水平
Table 1 The factors and levels of different environmental stress

胁迫因素胁迫水平酸胁迫(40 min)pH 3.5,pH 3.7,pH 4.0,pH 4.5,pH 4.8,pH 5.0盐胁迫(1 h)NaCl 2%,4%,6%,8%,10%胆盐胁迫(1 h)0.025%,0.05%,0.075%,0.1%,0.125%氧胁迫(1 h)H2O2 5 mmol/L,10 mmol/L,15 mmol/L,20 mmol/L,25 mmol/L冷胁迫(2 h)0 ℃,4 ℃,10 ℃,20 ℃,30 ℃
1.2.1.2 ATCC 11842 菌株在不同环境胁迫条件下的交互保护作用研究 通过上述1.2.1.1 节不同环境胁迫条件对ATCC 11842 菌株存活率的影响试验,确定了ATCC 11842 菌株在不同环境胁迫下的亚致死(菌株存活率50%左右)条件与最低致死(菌株存活率1%左右)条件。在此基础上,进行ATCC 11842 菌株在不同环境胁迫条件下的交互保护作用试验,即首先对ATCC 11842 菌株进行不同环境胁迫下的亚致死条件的处理;然后再对ATCC 11842 菌株进行对应的不同环境胁迫下的最低致死条件的处理。通过检测ATCC 11842菌株在不同环境胁迫下亚致死条件处理后和最低致死条件处理后的活菌数,计算菌株存活率,探明ATCC 11842 菌株在不同环境胁迫条件下的交互保护作用。具体试验方法如下:
①ATCC 11842 菌株先在不同环境胁迫下亚致死条件的处理 ATCC 11842 菌株经液体MRS培养基42 ℃活化后,以1%(体积分数)接入起始pH 值6.8,100 mL 液体MRS 培养基锥形瓶中,42℃静置培养10 h 至对数中期,4 ℃,6 000 r/min,离心10 min 收集10 mL 菌体,分别置于不同环境胁迫亚致死条件的10 mL MRS 培养基离心管中(酸胁迫pH 4.8,40 min;盐胁迫6%,1 h;胆盐胁迫0.1% 牛胆盐,1 h;氧胁迫15 mmol/L H2O2,1 h;冷胁迫10 ℃,2 h)处理后,4 ℃,6 000 r/min,离心10 min 收集1 mL 菌体,菌体分别用生理盐水洗涤2次,分别进行活菌计数,每次试验重复3 次。
②ATCC 11842 菌株再对应不同环境胁迫最低致死条件下的处理 经过1.2.1.2 节①不同环境胁迫下亚致死条件处理后的ATCC 11842 菌体细胞,分别4 ℃,6 000 r/min,离心10 min 收集10 mL 菌体,分别用生理盐水洗涤2 次,再分别置于酸胁迫最低致死条件(pH 3.7,40 min)、盐胁迫最低致死条件(10% NaCl,1 h)、胆盐胁迫最低致死条件(0.125% 牛胆盐,1 h)、氧胁迫最低致死条件(15 mmol/L H2O2,1 h)的10 mL MRS 培养基锥形瓶中进行处理后,分别4 ℃,6 000 r/min,离心10 min 收集1 mL 菌体,用生理盐水洗涤2 次,分别进行活菌计数,每次试验重复3 次。
③ATCC 11842 菌株在不同环境胁迫条件下交互保护作用存活率的计算
式中:NA——经过某环境胁迫亚致死条件处理和对应某环境胁迫最低致死条件处理后的活菌数,CFU/mL;NB——对应NA 经过某环境胁迫亚致死条件处理后的活菌数,CFU/mL。
1.2.2 ATCC 11842 菌株在不同环境胁迫(亚致死
条件处理)下基因表达量分析
1.2.2.1 ATCC 11842 菌株在不同环境胁迫(亚致死条件处理)后样品制备 根据1.2.1.2 节①试验方法对ATCC 11842 菌株在不同环境胁迫下进行亚致死条件处理后,分别4 ℃、6 000 r/min、离心10 min 收集1 mL 菌体,经液氮冷冻后,入-80 ℃冰箱保存备用。
1.2.2.2 ATCC 11842 菌株在不同环境胁迫(亚致死条件处理)后样品总RNA 提取 将各冻藏样品分别在预冷研钵中用液氮研磨至质地细腻的粉末;按照美国Thermo Fisher Scientific TaKaRa RNAiso Plus 总RNA 提取试剂盒说明书方法提取各冻藏样品总RNA;利用2%琼脂糖凝胶电泳检测各样品RNA 质量和完整性;采用紫外分光光度计检测各样品OD260/OD280 与OD260/OD230 的比值,判断各样品总RNA 纯度和浓度。
1.2.2.3 各样品总RNA 反转录合成cDNA 参照PrimeScriptTM RT reagent Kit with gDNA Eraser(Perfect Real Time)试剂盒说明书方法,去除各样品总RNA 中的基因组DNA,反应体系:5×g DNA Eraser Buffer 1 μL,g DNA Eraser 1 μL,总RNA 1 μL,RNase Free dH2O 7 μL;并合成各样品cDNA 第一链,反应体系:上述反应液10 μL,Prime-Script RT Enzyme Mix I 1 μL,RT Primer Mix 1 μL,5×PrimeScript Buffer 2 4 μL,RNase Free dH2O 4 μL。反转录产物-20 ℃冻藏备用。
1.2.2.4 实时荧光定量PCR(qRT-PCR)内参基因与目的基因的选择及其引物设计与合成 本研究以LDB_RS01640 基因为内参基因,以11 个响应酸胁迫的基因为目的基因,根据NCBI 上GenBank中公布的保加利亚乳杆菌ATCC 11842 的基因组中内参基因和目的基因的碱基序列,利用Primer Premier 5.0 和DNAMAN 6.0 软件设计引物,由金唯智生物科技有限公司合成引物序列。内参基因和目的基因引物见表2。
表2 实时荧光定量PCR(qRT-PCR)内参基因与目的基因的引物序列
Table 2 Primers sequence of reference gene and target gene for qRT-PCR

基因名称功能引物序列(5’-3’)产物/bp LDB-RS00810 ABC 糖转运蛋白通透酶F-CTCATACAACGACACTGGCT179 R-CGTAAGCAACCGAGATTTG LDB_RS0023 0 6-磷酸甘露糖异构酶F-GAAGAATGGGATGTTGGC133 R-AGACTGACAGCAAGCGGTA LDB_RS04920 2-羟酸脱氢酶F-TTGCCTGGTGAAGTAATCC174 R-GTCCAAAGTCAAACCGATG LDB_RS02110 谷氨酰胺-果糖-6-磷酸转氨酶(异构化) F-CCCACCCACAATACTCAGA231 R-GCAAGAAGGCGTATGAAC LDB_RS06340 I 型谷氨酸氨连接酶F-GCTTGGTCTGCTCAGTTCAC90 R-CTTCCATTTCCGCAATAACC LDB_RS09405 镉转运P 型ATP 酶F-GGACTTGAAAGAAGGGCA281 R-GCTGACCTGGCTTGATTA LDB_RS05285 铜转运P 型ATP 酶F-CGTTGTCTTAGCGATTCCAGT198 R-AGCGTCATCATTTCAGGAGA LDB_RS05615 分子伴侣DnaKF-AGGATGAAGACGACGAAACT111 R-CACCGTTGGTTGACAGAA LDB_RS06995 分子伴侣GroESF-TTGCTTCCAACGCTAAGG116 R-AACTTCATCGCCCTCTTG LDB-RS01180 热应激蛋白F-AGATGAGCACGAATACACCG139 R-GTTCTTCTTCTTGTCGCTGTCA LDB_RS03130 普遍应激蛋白F-GCTCACCAAAGACCATCATC147 R-TGTCGCAGTCAGCAGTTCT LDB_RS01640 内参基因F-ATGAATCACGCAAGCACG180 R-CCAACTGGGAAACGATAACTC
1.2.2.5 ATCC 11842 菌株在不同环境胁迫(亚致死条件处理)后目的基因的qRT-PCR 扩增试验目的基因的qRT-PCR 扩增程序,根据苏州宇恒生物科技有限公司的2×SYBR Green qPCR Master Mix 试剂盒说明书方法进行,采用罗氏LightCycler96 实时荧光定量PCR 仪完成。qRT-PCR 20 μL 反应体系:2×SYBR Green qPCR Master Mix 10 μL,上、下游引物各1 μL,cDNA template 2 μL,ddH2O 6 μL。qRT-PCR 反应程序:95 ℃ 5 min 激活Taq DNA polymerase 活性;95 ℃变性5 s,51 ℃退火5 s,72 ℃延伸25 s,共45 个循环。每个样品反应重复3 次。根据2-ΔΔCT 法计算目的基因相对表达量。
1.3 试验数据统计分析方法
作图软件为GraphPad Prism 8.0;试验数据采用SPSS Statistics 17.0 进行方差分析并用邓肯氏新复极差法进行多重比较。
2 结果与分析
2.1 ATCC 11842 菌株在不同环境胁迫条件下交互保护作用研究
2.1.1 不同环境胁迫条件对ATCC 11842 菌株存活率的影响 为确定ATCC 11842 菌株在不同环境胁迫下的亚致死(菌株存活率50%左右)条件与最低致死(菌株存活率1%左右)条件,以便后续进行ATCC 11842 菌株在不同环境胁迫条件下的交互保护作用研究,根据1.2.1.1 节试验方法,进行不同环境胁迫条件对ATCC 11842 菌株存活率影响试验,结果见图1a、1b、1c、1d、1e。
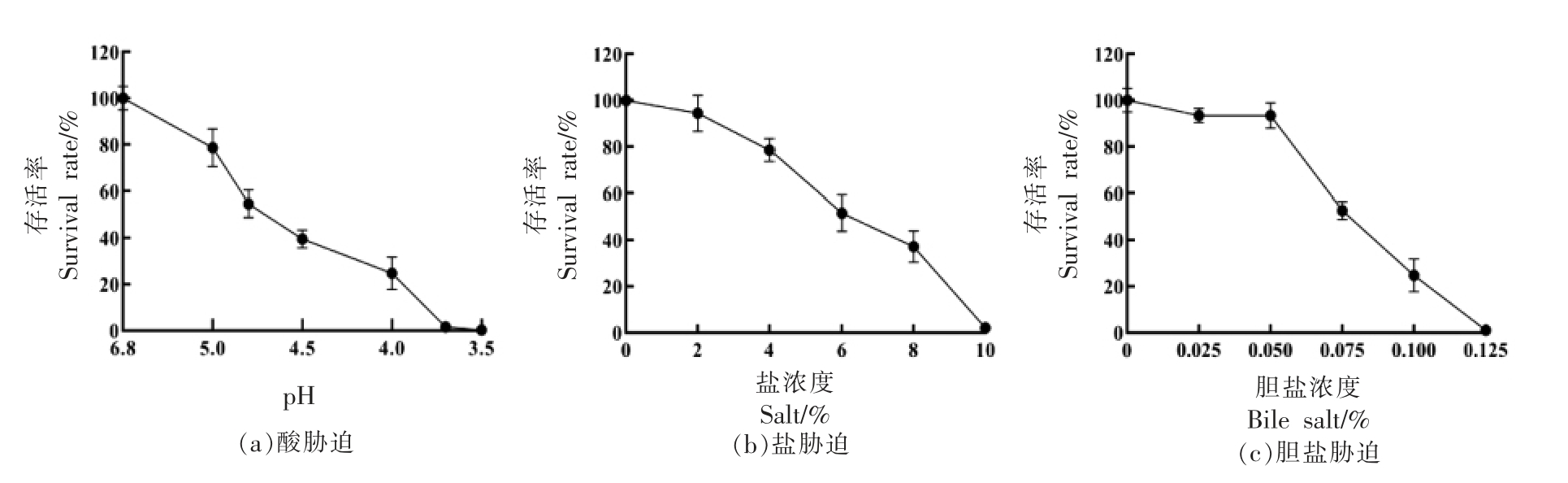
由图1可见:ATCC 11842 菌株在图1a 酸胁迫不同水平的处理中,其亚致死(菌株存活率50%左右)条件和最低致死条件(菌株存活率1%左右)分别为pH 4.8,40 min 和pH 3.7,40 min;在图1b 盐胁迫不同水平的处理中,其亚致死条件和最低致死条件分别为NaCl 6%,1 h 和NaCl 10%,1 h;在图1c 胆盐胁迫不同水平的处理中,其亚致死条件和最低致死条件分别为牛胆盐0.075%,1 h和牛胆盐0.125%,1 h;在图1d 氧胁迫不同水平的处理中,其亚致死条件和最低致死条件分别为H2O2 15 mmol/L,1 h 和H2O2 25 mmol/L,1 h;在图1e 冷胁迫不同水平的处理中,其亚致死条件为10℃,2 h。
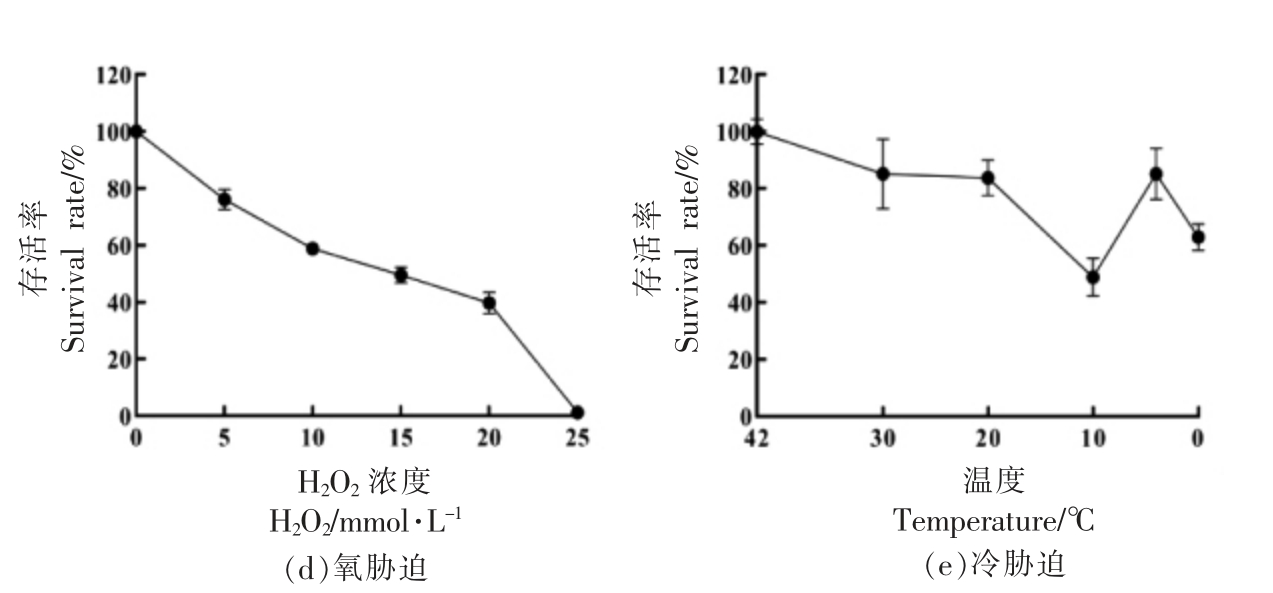
图1 ATCC 11842 菌株在不同环境胁迫条件下的存活率结果
Fig.1 The survival rate of L.bulgaricus ATCC 11842 under different environmental stress
2.1.2 ATCC 11842 菌株在不同环境胁迫条件下的交互保护作用研究 在上述2.1.1 节试验确定了ATCC 11842 菌株在不同环境胁迫下的亚致死(菌株存活率50%左右)条件与最低致死(菌株存活率1%左右)条件的基础上,根据1.2.1.2 节①②③试验方法,进行ATCC 11842 菌株在不同环境胁迫条件下的交互保护作用研究,结果见图2a、2b、2c、2d。
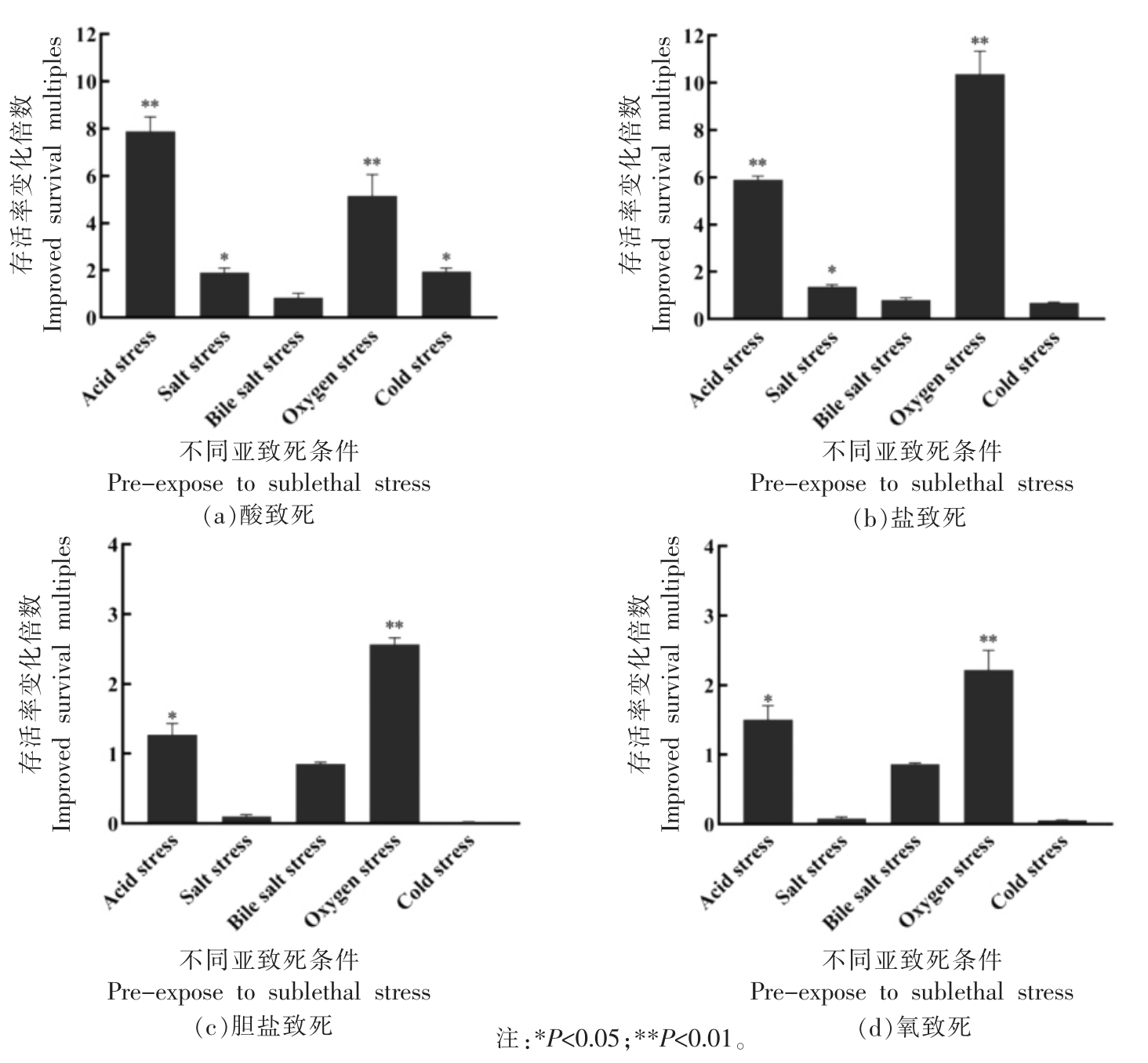
图2 ATCC 11842 菌株经不同环境胁迫亚致死条件处理再对应不同环境胁迫最低致死条件处理后存活率变化结果
Fig.2 The survival rate of L.bulgaricus ATCC 11842 after sublethal treatment corresponding to lowest lethal conditions of different environmental stresses
注:*P<0.05;**P<0.01。
由图2看出:ATCC 11842 菌株在图2a 酸致死交互保护试验中,酸胁迫、盐胁迫、H2O2 胁迫和冷胁迫亚致死处理,均能激活细胞应对酸致死条件的防御作用而提高菌体存活率,其中,酸胁迫和氧胁迫亚致死处理细胞应对酸致死条件的存活率结果差异极显著(P<0.01),菌体存活率分别提高了7.9 倍和5.2 倍;在图2b 盐致死交互保护试验中,酸胁迫和氧胁迫亚致死处理能显著提高菌株在盐致死条件下的存活率(P<0.01),分别提高了5.9 倍和10.4 倍;在图2c 胆盐致死交互保护试验中,酸胁迫和氧胁迫亚致死处理能显著提高菌株在盐致死条件下的存活率,分别提高了1.28 倍(P<0.05)和2.57 倍(P<0.01);在图2d 氧致死交互保护试验中,酸胁迫和氧胁迫亚致死处理能显著提高菌株在盐致死条件下的存活率,分别提高了1.5 倍(P<0.05)和2.22 倍(P<0.01)。
上述结果表明:ATCC 11842 菌株经酸胁迫和氧胁迫亚致死条件预处理均能提高在不同环境致死条件下的交互保护作用,即增强了在不同压力致死条件下的胁迫抗性。我们推测:酸胁迫和氧胁迫亚致死条件预处理,激活了ATCC 11842 菌株体内响应胁迫的抗性基因,使响应胁迫应激抗性基因发生表达量变化,产生响应胁迫应激抗性基因在不同环境致死条件下的重叠效应和交互保护作用。因此,有必要进一步分析ATCC 11842 菌株在不同环境胁迫(亚致死条件处理)下相关胁迫应激抗性基因在转录水平上的表达量变化。
2.2 ATCC 11842 菌株在不同环境胁迫(亚致死条件处理)下基因表达量分析
根据2.1.2 节试验结果以及前期ATCC11842菌株在酸胁迫和酸冷胁迫条件下转录组学测序结果,本试验从ATCC 11842 菌株响应酸胁迫的基因中选取与糖代谢、氨基酸代谢、转运系统、分子伴侣和应激相关基因,利用qRT-PCR 技术,分析这些基因在不同环境胁迫(亚致死条件处理)下转录水平的表达量变化。
2.2.1 不同环境胁迫(亚致死条件处理)对糖代谢相关基因 LDB_RS00810、LDB_RS04920、LDB_RS00230 表达量的影响 根据1.2.2.1~1.2.2.5 节试验方法,进行ATCC 11842 菌株与糖代谢相关基因LDB_RS00810、LDB_RS04920、LDB_RS00230在不同环境胁迫(亚致死条件处理) 下表达量分析,结果见图3a、3b、3c。
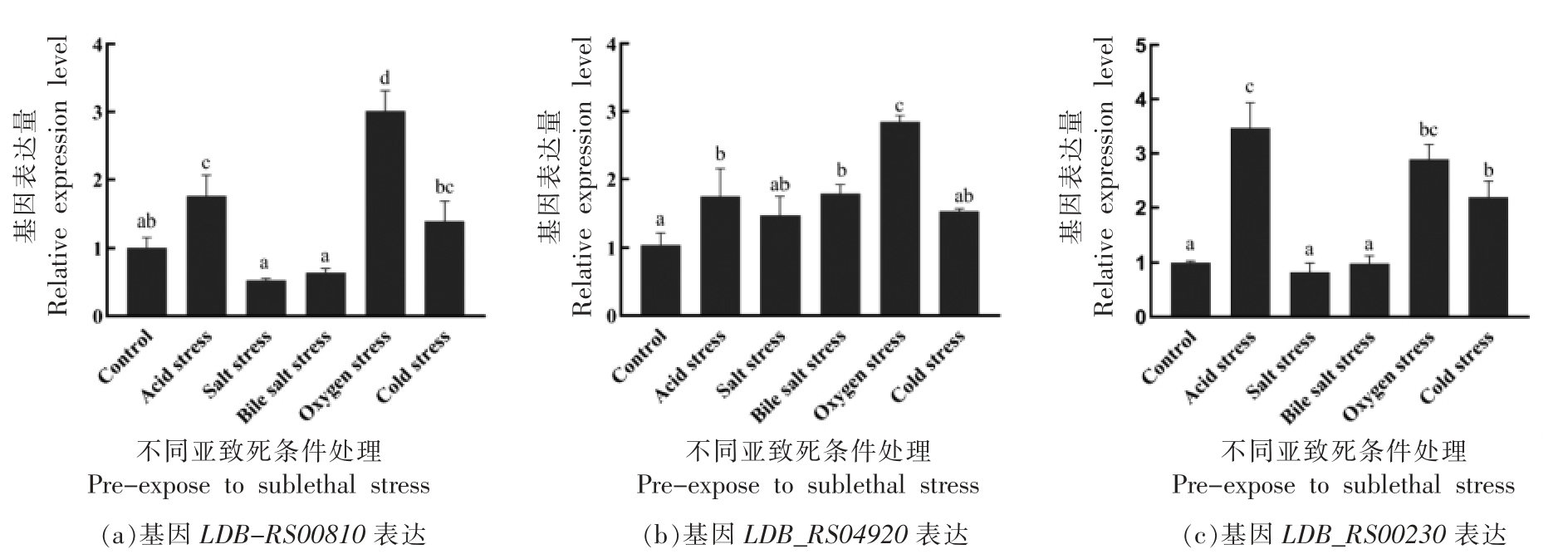
图3 在不同环境胁迫条件下ATCC 11842 中基因LDB_RS00810、LDB_RS04920 和LDB_RS00230 的相对表达量
Fig.3 Relative expression levels of the LDB-RS00810,LDB_RS04920 and LDB_RS00230 gene in L.bulgaricus ATCC 11842 under different stress treatment
注:图中不同小写字母表示差异显著(P<0.05)。
由图3可知:在图3a 中,ATCC 11842 面对不同的环境胁迫时,基因LDB-RS00810 的转录水平通过上调方式适应酸胁迫和氧胁迫(P<0.05);而盐胁迫、胆盐胁迫和冷胁迫对基因LDB-RS00810的表达量无显著影响(P>0.05)。在图3b 中,基因LDB_RS04920 受酸胁迫、胆盐胁迫和氧胁迫的影响而表达量显著上调(P<0.05);而盐胁迫和冷胁迫对基因LDB_RS04920 表达量无显著影响(P>0.05)。在图3c 中,基因LDB_RS00230 的转录水平会通过上调方式适应酸胁迫、氧胁迫和冷胁迫(P <0.05);而盐胁迫和胆盐胁迫对基因LDB_RS00230 的表达量无显著影响(P>0.05)。结果表明: 基因LDB-RS00810 响应酸胁迫和氧胁迫,基因LDB_RS04920 响应酸胁迫、胆盐胁迫和氧胁迫,基因LDB_RS00230 响应酸胁迫、氧胁迫和冷胁迫。
2.2.2 不同环境胁迫(亚致死条件处理)对氨基酸代谢相关基因LDB_RS02110、LDB_RS06340 表达量的影响 根据1.2.2.1~1.2.2.5 节试验方法,进行ATCC 11842 菌株与氨基酸代谢相关基因LDB_RS02110、LDB_RS06340 在不同环境胁迫(亚致死条件处理) 下表达量分析,结果见图4a、4b。
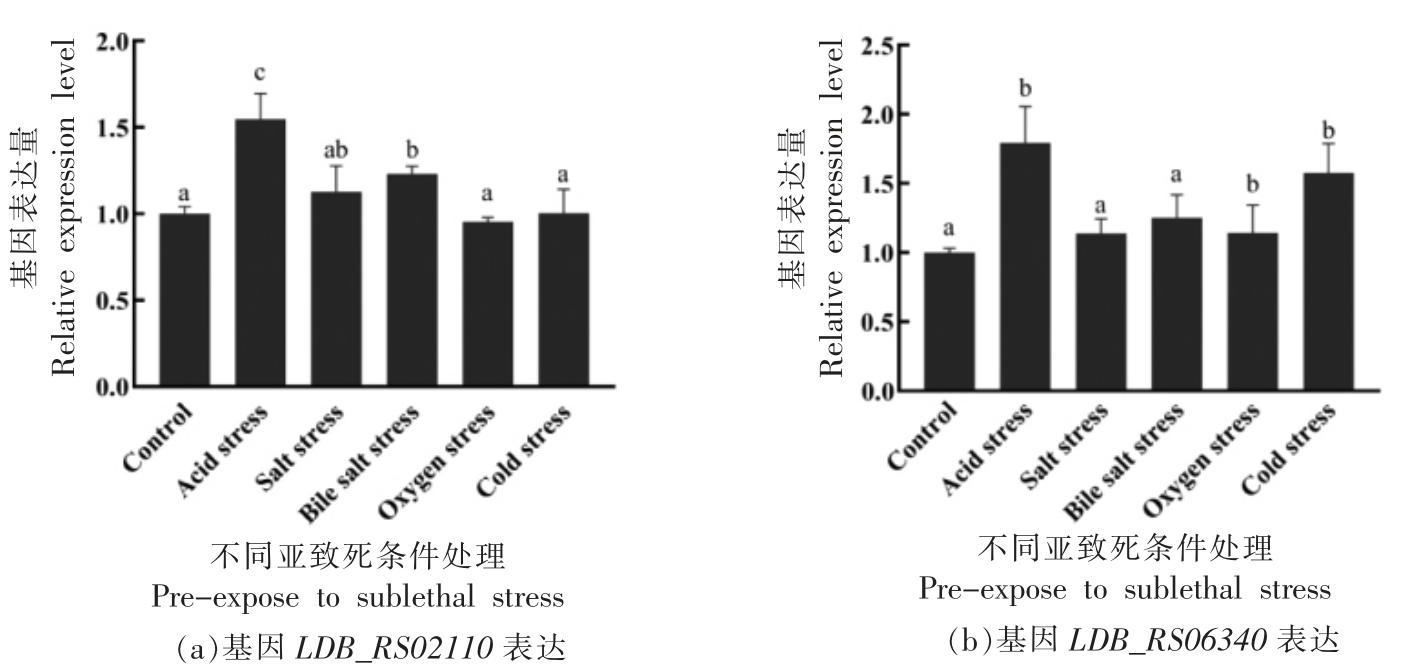
图4 在不同环境胁迫条件下ATCC 11842 中基因LDB_RS02110、LDB_RS06340 的相对表达量
Fig.4 Relative expression levels of the LDB_RS02110,LDB_RS06340 gene in L.bulgaricus ATCC 11842 under different stress treatment
注:图中不同小写字母表示差异显著(P<0.05)。
图4显示:在图4a 中,ATCC 11842 面对不同的环境胁迫时,基因LDB_RS02110 在酸胁迫和胆盐胁迫的调控下,其表达量显著上升(P<0.05);而盐胁迫、氧胁迫和冷胁迫处理对基因LDB_RS02110 的表达无显著影响(P>0.05)。在图4b 中,基因LDB_RS06340 受酸胁迫、氧胁迫和冷胁迫处理的影响,其表达量显著上调(P<0.05);但盐胁迫和胆盐胁迫处理对基因LDB_RS06340 表达量无显著影响 (P>0.05)。由此表明: 基因LDB_RS02110 响应酸胁迫和胆盐胁迫,基因LDB_RS06340 响应酸胁迫、氧胁迫和冷胁迫。
2.2.3 不同环境胁迫(亚致死条件处理)对转运系统相关基因LDB_RS09405、LDB_RS05285 表达量的影响 根据1.2.2.1~1.2.2.5 节试验方法,进行ATCC 11842 菌株与转运系统相关基因LDB_RS09405、LDB_RS05285 在不同环境胁迫(亚致死条件处理)下表达量分析,结果见图5a、5b。
由图5可见:在图5a 中,ATCC 11842 面对不同的环境胁迫时,基因LDB_RS09405 受酸胁迫的诱导,表达量显著上调(P<0.05);而盐胁迫、胆盐胁迫、氧胁迫和冷胁迫对基因LDB_RS09405 的表达量无显著影响 (P>0.05)。在图5b 中,基因LDB_RS05285 受酸胁迫和氧胁迫的诱导,表达量显著上升(P<0.05);而盐胁迫、胆盐胁迫、冷胁迫对基因LDB_RS05285 的表达量无显著影响(P>0.05)。结果表明:基因LDB_RS09405 只响应酸胁迫,基因LDB_RS05285 响应酸胁迫和氧胁迫。
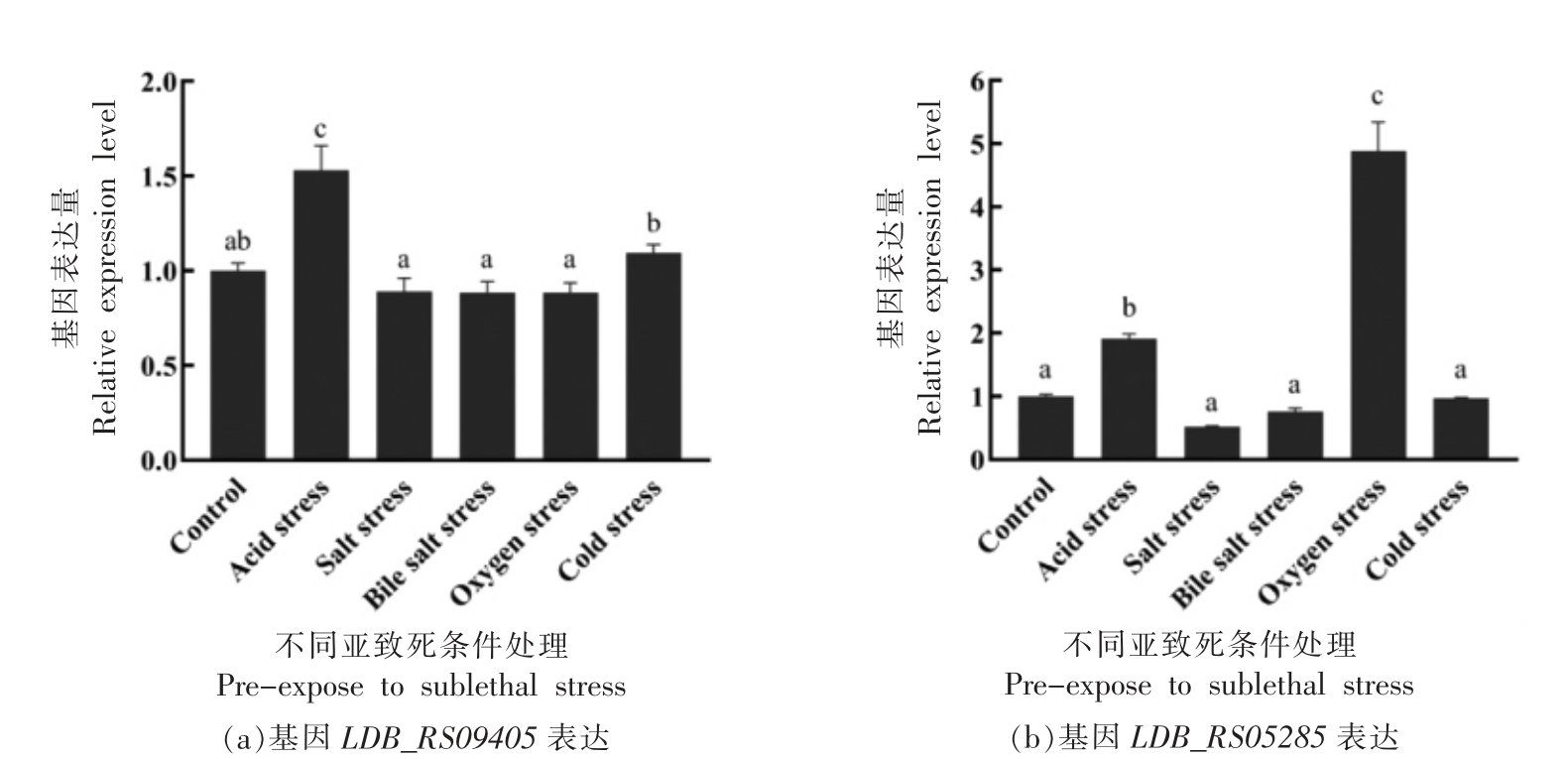
图5 在不同环境胁迫条件下L.bulgaricus ATCC 11842 中基因LDB_RS09405、LDB_RS05285 的相对表达量
Fig.5 Relative expression levels of the LDB_RS09405,LDB_RS05285 gene in L.bulgaricus ATCC 11842 under different stress treatment
注:图中不同小写字母表示差异显著(P<0.05)。
2.2.4 不同环境胁迫(亚致死条件处理)对分子伴侣相关基因LDB_RS05615、LDB_RS06995 表达量的影响 根据1.2.2.1~1.2.2.5 节试验方法,进行ATCC 11842 菌株与分子伴侣相关基因LDB_RS05615、LDB_RS06995 在不同环境胁迫(亚致死条件处理)下表达量分析,结果见图6a、6b。
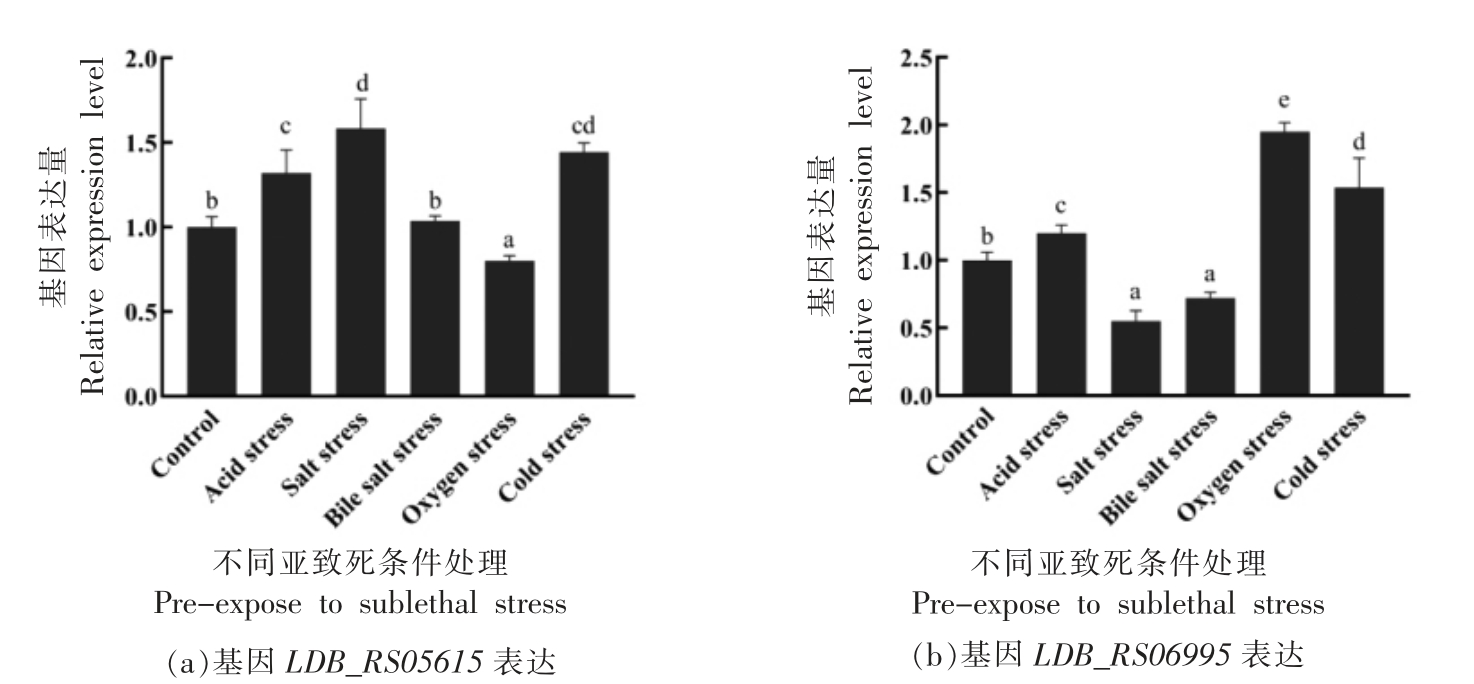
图6 在不同环境胁迫条件下L.bulgaricus ATCC 11842 中基因LDB_RS05615、LDB_RS06995 的相对表达量
Fig.6 Relative expression levels of the LDB_RS05615,LDB_RS06995 gene in L.bulgaricus ATCC 11842 under different stress treatment
注:图中不同小写字母表示差异显著(P<0.05)。
由图6看出:在图6a 中,ATCC 11842 面对不同的环境胁迫时,基因LDB_RS05615 受酸胁迫、盐胁迫和冷胁迫处理的影响,其表达量显著上调(P<0.05),并且在氧胁迫下其表达量显著下降(P<0.05);但胆盐胁迫对基因LDB_RS05615 的表达量无显著影响 (P >0.05)。在图6b 中,基因LDB_RS06995 表达量在酸胁迫、氧胁迫和冷胁迫下显著上调(P<0.05);在盐胁迫和胆盐胁迫下表达量显著下调 (P <0.05)。由此表明: 基因LDB_RS05615 响应酸胁迫、盐胁迫、氧胁迫和冷胁迫,基因LDB_RS06995 响应酸胁迫、盐胁迫、胆盐胁迫、氧胁迫和冷胁迫。
2.2.5 不同环境胁迫(亚致死条件处理)对应激相关基因LDB-RS01180、LDB_RS03130 表达量的影响 根据1.2.2.1~1.2.2.5 节试验方法,进行ATCC 11842 菌株与应激相关基因LDB-RS01180、LDB_RS03130 在不同环境胁迫 (亚致死条件处理)下表达量分析,结果见图7a、7b。
由图7可知:在图7a 中,ATCC 11842 面对不同的环境胁迫时,基因LDB-RS01180 受酸胁迫、氧胁迫和冷胁迫时表达量显著上调 (P<0.05),受盐胁迫时表达量显著下调(P<0.05),而胆盐胁迫对基因LDB-RS01180 表达量无显著影响(P>0.05)。在图7b 中,基因LDB_RS03130 在酸胁迫、盐胁迫、胆盐胁迫、氧胁迫和冷胁迫处理后表达均显著上调(P<0.05)。结果表明:基因LDB-RS01180 响应酸胁迫、盐胁迫、氧胁迫和冷胁迫,基因LDB_RS03130 响应酸胁迫、盐胁迫、胆盐胁迫、氧胁迫和冷胁迫。
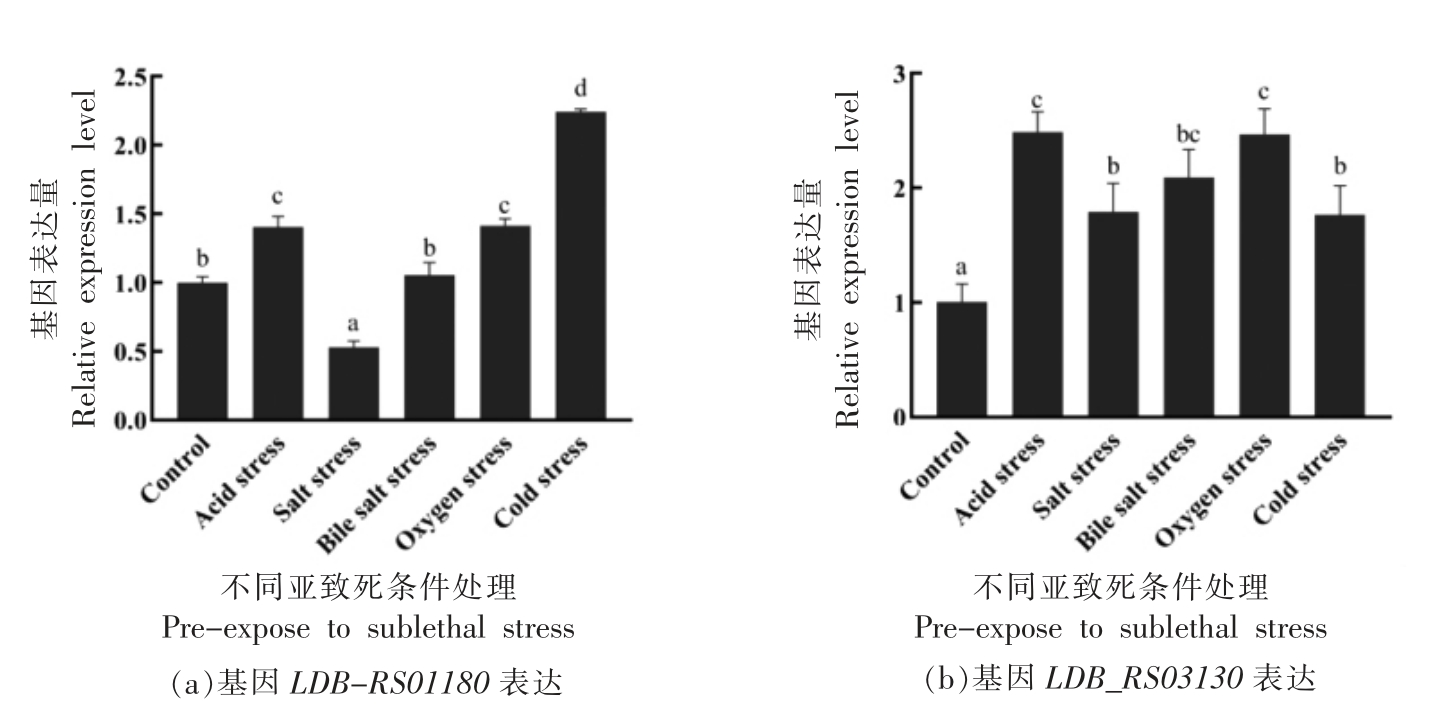
图7 在不同环境胁迫条件下L.bulgaricus ATCC 11842 中基因LDB_RS01180、LDB_RS03130 的相对表达量
Fig.7 Relative expression levels of the LDB_RS01180,LDB_RS03130 gene in L.bulgaricus ATCC 11842 under different stress treatment
注:图中不同小写字母表示差异显著(P<0.05)。
上述2.2 节 (2.2.1~2.2.5 节) 结果表明:在ATCC 11842 菌株体内响应酸胁迫的11 个基因中,发现10 个基因 (除与转运系统相关基因LDB_RS09405 之外) 也响应其它不同环境胁迫(亚致死条件处理),并探明了该10 个响应酸胁迫的基因 (LDB_RS02110、LDB -RS00810、LDB_RS04920、LDB_RS05285、LDB_RS00230、LDB_RS06340、LDB_RS05615、LDB-RS01180、LDB_RS06995、LDB_RS03130)在不同环境胁迫(亚致死条件处理) 下表达量发生显著上调与下调的具体转录水平。
3 讨论
发酵乳制品工业已成为促进国民健康和经济发展的“朝阳产业”,保加利亚乳杆菌既是发酵乳制品的常用菌种,又是引起发酵乳制品后酸化的主要菌种[4]。目前一般运用诱变和原生质体融合育种、改变工艺条件、添加抑菌剂等技术手段来控制发酵乳制品的后酸化[16],但保加利亚乳杆菌发酵乳制品在贮藏期间常会遭受多种环境胁迫,不同环境胁迫之间交叉复杂,在不了解该菌在多种环境胁迫下交叉抗逆保护的基因表达调控机制的情况下,很难从根本上解决发酵乳制品的后酸化问题。因此,研究保加利亚乳杆菌在不同环境胁迫下交互保护作用及其与相关基因表达的应答关系,势在必行。
迄今已有研究表明: 保加利亚乳杆菌ATCC 11842 在2% NaCl 中预处理2 h,冷冻干燥存活率显著提升[17];保加利亚乳杆菌CFL1 经酸胁迫预处理后,抵抗冷胁迫的能力增强[18]。这些研究虽然印证了保加利亚乳杆菌在某些环境胁迫下的交互保护作用,但目前尚缺少保加利亚乳杆菌在不同环境胁迫下交互保护作用的系统研究资料。本研究表明:ATCC 11842 菌株经酸胁迫和氧胁迫亚致死条件(pH 4.8,40 min;15 mmol/L H2O2,1 h)预处理后,均可显著提高在不同环境胁迫(酸、盐、胆盐、氧)最低致死条件下(pH 3.7,40 min;10% NaCl,1 h;0.125%牛胆盐,1 h;25 mmol/L H2O2,1 h)的存活率,即试验菌株经酸胁迫和氧胁迫亚致死条件预处理均能显著提高在不同环境最低致死条件下的交互保护作用,增强了在不同压力致死条件下的胁迫抗性。本研究结果丰富了保加利亚乳杆菌在不同环境胁迫下交互保护作用的系统研究资料。
目前研究发现:乳酸菌在各种环境胁迫下,具有自我调控能力,可通过合成应激蛋白、参与代谢的某些蛋白以及胁迫诱导的特定应激蛋白等各种生理反应来适应不利环境[19]。例如:德氏乳杆菌保加利亚亚种在酸胁迫过程中,分子伴侣基因DanK,GroES 和GroEL 被诱导[20];植物乳杆菌CAUH2 在H2O2 胁迫过程中,铜稳态转录因子CopR 被诱导[21],热激蛋白在盐胁迫、酸胁迫及冷胁迫下也被诱导表达[22-23]。由此说明:在不同环境胁迫下,乳酸菌的应激抗性机制存在一定程度的重叠效应[24]。本研究根据前期ATCC 11842 菌株在酸胁迫和酸冷胁迫条件下转录组学测序结果,从响应酸胁迫的基因中选取与糖代谢相关的基因(LDB_RS00810、LDB_RS04920、LDB_RS00230)、与氨基酸代谢相关的基因(LDB_RS02110、LDB_RS06340)、与转运系统相关的基因(LDB_RS05285、LDB_RS09405)、分子伴侣基因(LDB_RS05615、LDB_RS06995) 和应激相关基因(LDB_RS01180、LDB_RS03130) 等11 个基因,采用RT-qPCR 技术,分析了这11 个响应酸胁迫基因在不同环境胁迫(亚致死条件处理)下转录水平的表达量变化,探明了这11 个响应酸胁迫基因在不同环境胁迫(亚致死条件处理)下表达量发生显著上调与下调的具体转录水平。本研究结果表明:在ATCC 11842 菌株体内响应酸胁迫的11 个基因中,发现10 个基因 (除与转运系统相关基因LDB_RS09405 之外)也响应了其它不同环境胁迫(亚致死条件处理),本研究结果不仅与前人提出的观点相符,而且扩充了保加利亚乳杆菌响应酸胁迫基因在不同环境胁迫下交互保护作用中应答反应的研究资料。根据现有的理论推测:这些响应酸胁迫的基因可能使ATCC 11842 菌株在其它不同环境胁迫下的交互保护作用中产生重叠效应,从而使菌体细胞在亚致死条件下处理后应对其它环境胁迫的抗性增强;此外,ATCC 11842 菌株还可能通过调控胁迫基因的转录水平,起到修复环境胁迫导致的蛋白质的错误折叠、修复维持DNA和蛋白质稳态、调控糖代谢和氨基酸代谢和修复细胞跨膜转运[25-28]等作用,从而进一步调控菌体细胞的生长代谢,缓解胁迫造成的紊乱。
总之,本研究以保加利亚乳杆菌的模式菌株ATCC 11842 为试验菌株,探究了不同环境胁迫条件(酸、盐、胆盐、氧、冷)对菌株存活率的影响,确定了菌体细胞在不同环境胁迫(酸、盐、胆盐、氧、冷) 下的亚致死条件与最低致死条件;在此基础上,比较了不同环境胁迫(酸、盐、胆盐、氧、冷)亚致死条件处理后的菌体细胞在不同环境胁迫(酸、盐、胆盐、氧)最低致死条件下的存活率变化,发现菌株经酸胁迫和氧胁迫亚致死条件 (pH 4.8,40 min;15 mmol/L H2O2,1 h)预处理后,均可显著提高在不同环境胁迫(酸、盐、胆盐、氧)最低致死条件下 (pH 3.7,40 min;10% NaCl,1 h;0.125% 牛胆盐,1 h;25 mmol/L H2O2,1 h)的存活率,即试验菌株经酸胁迫和氧胁迫亚致死条件预处理均能显著提高在不同环境最低致死条件下的交互保护作用;分析了菌株体内11 个响应酸胁迫基因在不同环境胁迫(亚致死条件处理)下转录水平的表达量变化,探明了该11 个响应酸胁迫基因在不同环境胁迫(亚致死条件处理)下表达量发生显著上调与下调的具体转录水平,发现了10 个基因(与转运系统相关基因LDB_RS09405 除外的10 个基因:LDB_RS02110、LDB-RS00810、LDB_RS04920、LDB_RS05285、LDB_RS00230、LDB_RS06340、LDB_RS05615、LDB -RS01180、LDB_RS06995、LDB_RS03130)也响应其它不同环境胁迫(亚致死条件处理)。本研究为进一步揭示保加利亚乳杆菌在多种环境胁迫下抗逆保护机制与定向选育抗逆性菌株,提供了科学依据和理论指导。
[1]吴重德,黄钧,周荣清.调控乳酸菌酸胁迫抗性研究进展[J].微生物学报,2014,54(7): 721-727.
WU C D,HUANG J,ZHOU R Q.Regulating acid stress resistance of lactic acid bacteria-A review[J].Acta Microbiology Sinica,2014,54(7): 721-727.
[2]张筠,孟祥晨.乳酸菌的胁迫应答及其对碳水化合物代谢的影响[J].中国食品学报,2017,17(6):145-151.
ZHANG Y,MENG X C.Stress responses and impact of carbonhydrate metabolism in lactic acid bacteria[J].Journal of Chinese Institute of Food Science and Technology,2017,17(6): 145-151.
[3]SERRAZANETTI D I,GOTTARDI D,MONTANARI C,et al.Dynamic stresses of lactic acid bacteria associated to fermentation processes[M].Lactic Acid Bacteria-R&D for Food,Health and Livestock Purposes,London: Headquarters Intech Open Limited,2013.
[4]李晨,张国文,赵云,等.酸奶后酸化中保加利亚乳杆菌关键基因表达分析[J].中国食品学报,2018,18(7): 256-262.
LI C,ZHANG G W,ZHAO Y,et al.Gene expression analysis of yogurt post-acidification in Lactobacillus delbrueckii subsp.bulgaricus[J].Journal of Chinese Institute of Food Science and Technology,2018,18(7): 256-262.
[5]薛峰,张娟,堵国成,等.交互保护对干酪乳杆菌ATCC 393~(TM)存活的影响[J].微生物学报,2010,50(4): 478-484.
XUE F,ZHANG J,DU G C,et al.Influence of cross-protection on the survival of Lactobacillus casei ATCC 393[J].Acta Microbiology Sinica,2010,50(4): 478-484.
[6]HUANG R,PAN M,WAN C,et al.Physiological and transcriptional responses and cross protection of Lactobacillus plantarum ZDY2013 under acid stress[J].Journal of Dairy Science,2016,99(2): 1002-1010.
[7]FONG K,WANG S.Heat resistance of Salmonella enterica is increased by pre-adaptation to peanut oil or sub-lethal heat exposure[J].Food Microbiology,2016,58: 139-147.
[8]HE S,ZHOU X,SHI C,et al.Ethanol adaptation induces direct protection and cross-protection against freezing stress in Salmonella enterica serovar Enteritidis[J].Journal of Applied Microbiology,2016,120(3): 697-704.
[9]KIM W S,PERL L,JI H P,et al.Assessment of stress response of the probiotic Lactobacillus acidophilus[J].Current Microbiology,2001,43(5):346-350.
[10]GASALUCK P,MAHIDSANAN T.The consequences of implicit factors as cross-protective stresses on freeze-dried Bacillus subtilis SB-MYP-1 with soybean flour during storage[J].LWT,2018,90: 475-482.
[11]杨婕,郭金凤,李宝坤,等.酸-冷交互胁迫对保护冷冻干燥发酵乳杆菌活性的作用[J].食品科学,2020,41(2): 101-106.
YANG J,GUO J F,LI B K,et al.Cryoprotective effect of acid-cold cross stress on Lactobacillus fermentum[J].Food Science,2020,41(2): 101-106.
[12]YE B,HE S,ZHOU X,et al.Response to acid adaptation in Salmonella enterica Serovar Enteritidis[J].Journal of Food Science,2019,84(3): 599-605.
[13]HE S,CUI Y,QIN X,et al.Influence of ethanol adaptation on Salmonella enterica serovar Enteritidis survival in acidic environments and expression of acid tolerance-related genes[J].Food Microbiology,2018,72: 193-198.
[14]叶贝宁.肠炎沙门氏菌酸胁迫效应的分析[D].上海:上海交通大学,2019.
YE B N.Analysis of acid adaptation effect on Salmonella enterica serovar Enteritidis[D].Shanghai:Shanghai Jiaotong University,2019.
[15]刘倩颖.基于RT-PCR 技术对植物乳杆菌耐盐分子机理的研究[D].沈阳: 沈阳农业大学,2014.
LIU Q Y.Research on salt tolerance mechanism of Lactobacillus plantarum based on RT-PCR technique[D].Shenyang: Shenyang Agricultural University,2014.
[16]刘艳玲,张媛,赵丽娜,等.抗酸乳后酸化的研究进展[J].食品科技,2018,43(9): 104-108.
LIU Y L,ZHANG Y,ZHAO L N,et al.Research progress on postacidification of yogurt[J].Food Science and Technology,2018,43(9): 104-108.
[17]LI C,LI P Z,SUN J W,et al.Proteomic analysis of the response to NaCl stress of Lactobacillus bulgaricus[J].Biotechnology Letters,2014,36 (11):2263-2269.
[18]STREIT F,DELETTRE J,CORRIEU G,et al.Acid adaptation of Lactobacillus delbrueckii subsp.bulgaricus induces physiological responses at membrane and cytosolic levels that improves cryotolerance[J].Journal of Applied Microbiology,2008,105(4): 1071-1080.
[19]王学良,韩雪,王海娟,等.乳酸菌在各种胁迫下的应激反应研究进展[J].食品工业科技,2015,36(6): 365-369.
WANG X L,HAN X,WANG H J,et al.Studying progress of lactobacillus's responses in a variety of stress[J].Science and Technology of Food Industry,2015,36(6): 365-369.
[20]LIM E M,EHRLICH S D,MAGUIN E.Identification of stress-inducible proteins in Lactobacillus delbrueckii subsp.bulgaricus[J].Electrophoresis,2000,21(12): 2557-2561.
[21]YANG Y,YIN J,LIU J,et al.The copper homeostasis transcription factor copR is involved in H2O2 stress in Lactobacillus plantarum CAUH2[J].Frontiers in Microbiology,2017,8: 2015.
[22]XIE Y,CHOU L S,CUTLER A,et al.DNA Macroarray profiling of Lactococcus lactis subsp.lactis IL1403 gene expression during environmental stresses[J].Applied and Environmental Microbiology,2004,70(11): 6738-6747.
[23]OUVRY A,WACHE Y,TOURDOT-MARE R L,et al.Effects of oxidoreduction potential combined with acetic acid,NaCl and temperature on the growth,acidification,and membrane properties of Lactobacillus plantarum[J].Fems Microbiology Letters,2002,214(2): 257-261.
[24]陈卫,赵山山,张秋香.乳酸菌的耐盐机制[J].中国食品学报,2013,13(10): 1-7.
CHEN W,ZHAO S S,ZHANG Q X.The mechanism of LAB to salt stress[J].Journal of Chinese Institute of Food Science and Technology,2013,13(10): 1-7.
[25]YEH C H,CHEN Y M,LIN C Y.Functional regions of rice heat shock protein,Oshsp16.9,required forconferring thermotolerance in Escherichia coli[J].Plant Physiology,2002,128(2): 661-668.
[26]JINN T L,CHIU C C,SONG W W,et al.Azetidine-induced accumulation of class I small heat shock proteins in the soluble fraction provides thermotolerance in soybean seedlings[J].Plant & Cell Physiology,2004,45(12): 1759-1767.
[27]乌日娜,宋雪飞,刘倩颖,等.植物乳杆菌分子伴侣蛋白基因在盐胁迫下的表达分析[J].食品科学,2015,36(11): 95-99.
WU R N,SONG X F,LIU Q Y,et al.Expression of chaperone protein genes in Lactobacillus plantarum under salt stress[J].Food Science,2015,36(11): 95-99.
[28]胡敏,黄涛,彭珍,等.胆盐对植物乳杆菌NCU116应激基因和关键生理指标的影响[J].食品与发酵工业,2019,45(9): 1-8.
HU M,HUANG T,PENG Z,et al.Influences of bile salts on stress genes and key physiological indexes of Lactobacillus plantarum NCU116[J].Food and Fermentation Industries,2019,45(9): 1-8.