近年来,恶性肿瘤发病率显著增高,据了解,全球范围内约20%的男性和17%的女性具有一定的患癌风险[1]。在亚洲地区,癌症死亡的人数占全球癌症死亡总人数的50%,其中肝癌是现今较为多见的恶性肿瘤之一,患者自身的生命安全始终得不到有效保障。据2021年统计数据,肝癌是全球第六大常见高发癌症,也是癌症相关死亡的第三大原因,仅次于肺癌和结直肠癌[2],且恶性肿瘤具有早期诊断率低、临床治愈率低的特点,尚无有效的治疗方法。目前主要采用手术及放化疗等手段进行癌症治疗。此外,使用放疗、化疗等治疗手段对人体产生的毒副作用较大,在治疗过程中,药物对肿瘤细胞的识别作用不强,在消除肿瘤细胞的同时,也损害了正常细胞的生长发育,对病患后期的身心健康及生活质量都造成重大的影响。探寻毒副作用小的有效抗肿瘤药物,降低病患的恶性肿瘤死亡率,改善其生存质量,已成为广大医学工作者亟待解决的问题。多糖作为常见的天然活性物质,成为抗肿瘤研究的热点之一。目前已报道香菇多糖[3]、槐角多糖[4]、板栗种仁多糖[5]等具有一定抗肿瘤作用,而有关沙棘多糖的相关研究并不多见。本文以人肝癌细胞(Hep-G2)为研究对象,探讨沙棘多糖SBP-3 组分对肿瘤细胞的影响。
1 材料与方法
1.1 材料与试剂
Hep-G2 人肝癌细胞,武汉普诺赛生命科技有限公司;CCK-8 试剂盒、DMEM 高糖培养基,美国Hyclone 公司;Annexin V-FITC 凋亡试剂盒,碧云天生物试剂公司;BCA 试剂盒,上海易色医疗科技有限公司;p-p38 抗体、MMP-2 抗体、MMP-9抗体,上海户实医药科技有限公司。
1.2 仪器与设备
SW-CJ-IFD 超净工作台,苏州安泰有限公司;SC3614 高速离心机,中佳有限公司;UCTR30-2 倒置光学显微镜,上海普赫有限公司;HERACELL1150i 细胞恒温培养箱,美国Thermo Scientific 公司;Multiscan MK3 酶标仪,美国Thermo Scientific 公司;BG-Power 600i 电泳仪,北京百晶生物技术有限公司。
1.3 方法
1.3.1 沙棘多糖SBP-3 的制备、分组及细胞培养 根据魏晨业等[6]的研究方法,采用DEAE-52 纤维素柱分离纯化,得到酸性多糖SBP-3。将沙棘多糖SBP-3 组分用不含血清的DEAE 培养基配成质量浓度为0.625,1.25,2.5,5 mg/mL 和10 mg/mL的多糖组,以不加多糖的组作为空白对照组。
将冻存Hep-G2 细胞复苏后,置于5% CO2、37 ℃的恒温培养箱中培养。
1.3.2 CCK-8 法检测Hep-G2 细胞增殖率 将Hep-G2 细胞按2×104 个/孔的密度接种于96 孔板,每孔90 μL,设立3 个复孔。分别加入不同浓度的沙棘多糖溶液10 μL,使其终质量浓度分别为62.5,125,250,500,1 000 μg/mL,培养24 h 和48 h 后,每孔加10 μL CCK-8,置于37 ℃、5%CO2 培养箱中培育4 h。用酶标仪检测450 nm 处吸光度OD 值,计算细胞增殖抑制率。计算公式[7]:
式中:OD1——含多糖样品吸光度;OD2——不含多糖样品吸光度。
1.3.3 流式细胞术检测Hep-G2 细胞的凋亡率按1.3.2 节方法处理Hep-G2 细胞,通过CCK-8试验选择不同浓度沙棘多糖溶液作为凋亡试验的剂量,即用125,250,500 μg/mL 作用细胞,培养24 h 和48 h 后,用PBS 溶液反复洗涤细胞,使其混合均匀,加入胰蛋白酶(不含EDTA)消化,观察细胞是否从培养板壁上脱落。将0.5 mL 细胞悬液转移至无菌离心管中,加入1.25 μL Annexin V-FITC混匀后加入10 μL PI,室温避光反应15 min,用流式细胞仪检测[8]。
1.3.4 划痕试验检测Hep-G2 细胞迁移能力 将Hep-G2 细胞接种于6 孔板中,用显微镜观察细胞生长密度达到80%后,用移液器吸头将细胞垂直划伤,用PBS 贴壁缓慢加入润洗,分别加入不同质量浓度的沙棘多糖溶液(125,250,500 μg/mL)培养48 h 后,置于显微镜下观察并拍照[9]。
1.3.5 Transwell 小室检测Hep-G2 细胞侵袭能力 将Hep-G2 细胞接种于Transwell 板[10],上室中加入含1%血清的细胞悬液100 μL,下室中加入500 μL 含15% FBS 的各浓度组培养液,放入37℃,5% CO2 恒温培养箱,培养48 h 后取出小室,用PBS 反复润洗后加入结晶紫染色5 min,清洗后用棉签擦去内侧坏死细胞,随机选取5 个视野观察并计数穿越小室的侵袭性细胞数目。
1.3.6 Western blot 检测p-p38、MMP-2、MMP-9蛋白表达水平 按1.3.3 节方法处理Hep-G2 细胞,分别加入不同质量浓度的沙棘多糖溶液(125,250,500 μg/mL)培养48 h,经胰蛋白酶消化后,提取蛋白,用BCA 蛋白浓度测定试剂盒定量。通过SDS-PAGE 垂直板电泳,电转至PVDF 膜上,放入5%脱脂奶粉封闭液中,封闭1 h,一抗孵育,将PVDF 膜放入稀释好的 p-p38、MMP-2、MMP-9抗体中,4 ℃过夜。第2 天将PVDF 膜放入对应的二抗中,室温培养2 h,TBST 洗膜3 次,每次10 min,ECL 显色,用凝胶成像分析仪系统拍照[11],计算机扫描并分析处理结果。
1.3.7 数据处理 运用SPSS 20.0 对试验数据进行单因素方差分析,结果以均数±标准差(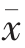 ±s)表示,图、表采用origin 8.5 绘制。
±s)表示,图、表采用origin 8.5 绘制。
2 结果与分析
2.1 SBP-3 对Hep-G2 细胞增殖的影响
CCK-8 法是一种准确度和灵敏度较高且常用于测定细胞增殖的比色法[12]。由图1可知,与空白组相比,Hep-G2 细胞经SBP-3 各剂量组作用24 h,对其抑制率逐渐升高(P<0.05)。当SBP-3 质量浓度升至1 000 μg/mL 时抑制效果最佳,达28.83%;经SBP-3 各剂量组作用48 h,各组细胞抑制率也显著升高(P<0.01),其中SBP-3 质量浓度为125,500 μg/mL 和1 000 μg/mL 时的抑制率分别为26.62%,27.3%和60.43%。以上结果说明沙棘多糖SBP-3 组分在62.5~1 000 μg/mL 浓度范围,能够抑制Hep-G2 细胞的增殖,且抑制率随其浓度的增加、作用时间的延长而呈上升趋势。
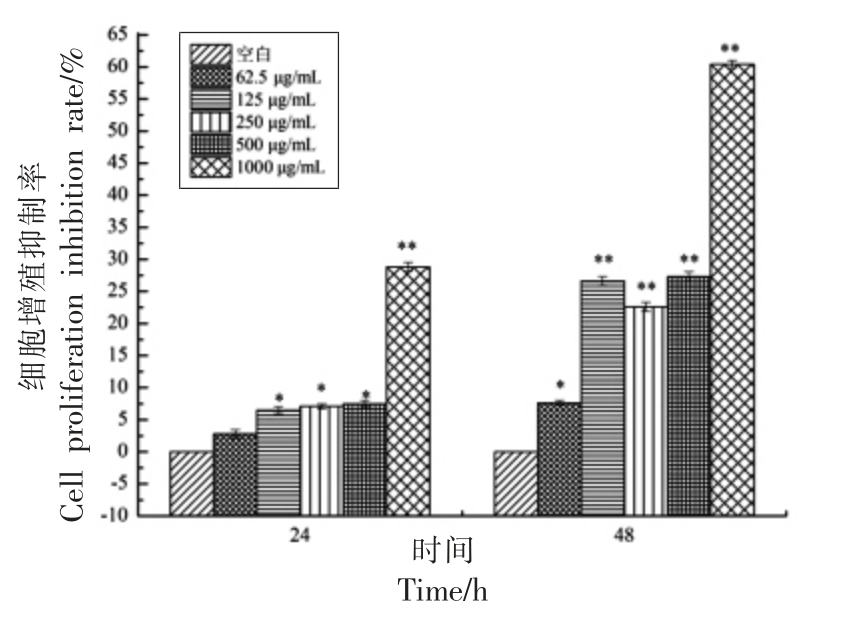
图1 沙棘多糖SBP-3 组分对Hep-G2 的抑制作用
Fig.1 Inhibitory effect of SBP-3 fraction of seabuckthorn polysaccharides on Hep-G2
注:* 表示与空白组比较差异显著 (P<0.05);** 表示与空白组比较差异极显著(P<0.01);下同。
2.2 SBP-3 对Hep-G2 细胞凋亡的影响
根据SBP-3 对Hep-G2 细胞增殖的作用结果,选择125,250 μg/mL 和500 μg/mL 3 个质量浓度梯度,作用24 h 和48 h 为Hep-G2 细胞的培养条件,试验结果见图2。与空白组相比,各SBP-3 浓度组均能诱导Hep-G2 细胞产生凋亡作用,且细胞凋亡率随SBP-3 浓度的增加而逐渐升高。125 μg/mL SBP-3 作用24 h,细胞凋亡率为5.23%;500 μg/mL SBP-3 时细胞凋亡率最高为6.41%。当作用时间48 h 时,细胞凋亡率极显著上升(P<0.01),当SBP-3 多糖质量浓度分别为125,250 μg/mL 和500 μg/mL 时,细胞凋亡率分别为31.68%,36.59%和37.32%。SBP-3 作用48 h 的效果明显优于24 h,最终选择SBP-3 作用48 h 为后续试验条件。图3中,Q1 表示坏死细胞;Q2 表示晚期凋亡细胞;Q3 表示早期凋亡细胞;Q4 表示正常细胞,Q2+Q3 表示凋亡细胞[13]。通过测定Hep-G2 细胞凋亡信号,发现48 h 内沙棘多糖SBP-3 组分各剂量组凋亡细胞比例显著增加,说明SBP-3 能够诱导Hep-G2 细胞的凋亡。

图2 流式细胞术检测Hep-G2 细胞凋亡
Fig.2 Detection of Hep-G2 cell apoptosis by flow cytometry
注:A,E 分别为作用24h 和48h 空白对照组;B,F 为125 μg/mL SBP-3;C,G 为500 μg/mL SBP-3;D,H 为1 000 μg/mL SBP-3。
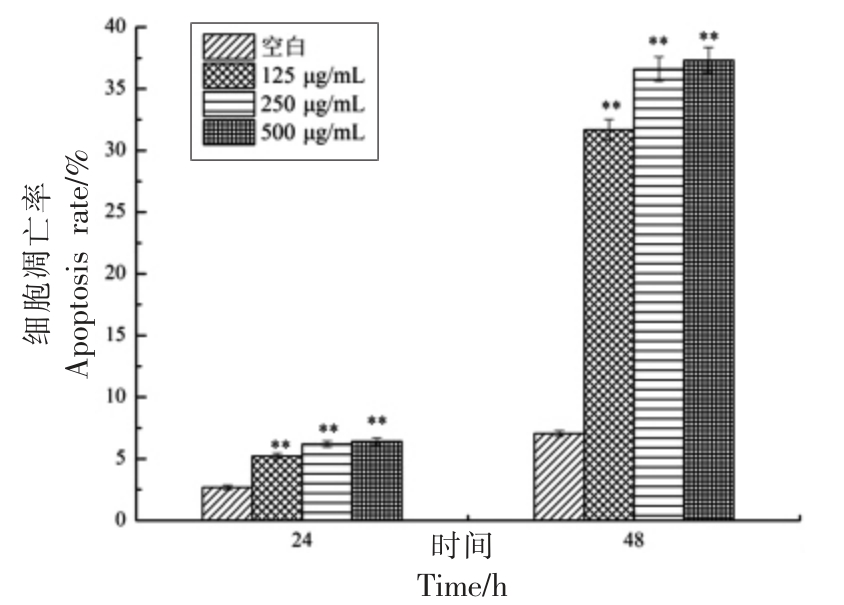
图3 Hep-G2 细胞凋亡率
Fig.3 Apoptosis of Hep-G2 cells
2.3 SBP-3 对Hep-G2 细胞迁移的影响
肿瘤细胞在不断发育生长的阶段,当其分化速度及迁移能力在短时间内呈现异常性变化时,转化为恶性肿瘤的可能性急剧增加,将对人体的生命安全及治疗产生巨大的危害,沙棘多糖SBP-3 对Hep-G2 细胞转移能力的影响可通过伤口愈合试验进行评估[14]。单层Hep-G2 细胞覆盖在6 孔板上,在汇合细胞层的中心形成具有尖端的伤口,中央伤口的恢复率表明Hep-G2 细胞的迁移能力。当给予不同浓度的沙棘多糖SBP-3作用Hep-G2 细胞48 h,试验结果如图4所示。与未添加多糖的空白对照组相比,沙棘多糖SBP-3作用的各组Hep-G2 细胞的迁移能力随其剂量的增加,得到不同程度地抑制,划痕闭合范围明显减小。当SBP-3 质量浓度增到500 μg/mL 时,对Hep-G2 细胞的抑制效果最佳,细胞迁移率仅5.59%,即SBP-3 的刺激可以显著减少迁移到聚碳酸酯膜下侧的Hep-G2 细胞数量 (P<0.01),这表明沙棘多糖SBP-3 组分呈剂量依赖性抑制Hep-G2 细胞的迁移。
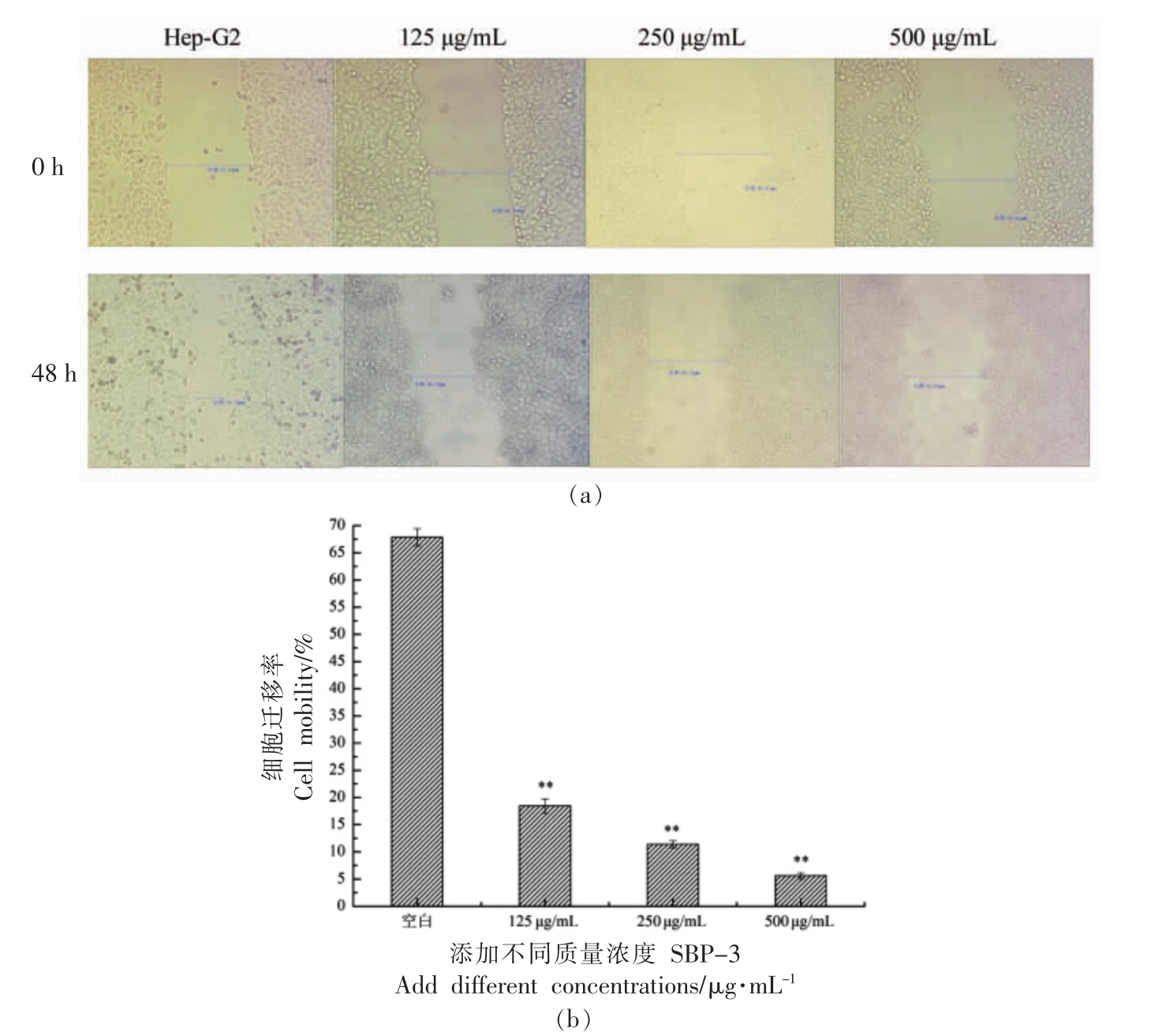
图4 SBP-3 对Hep-G2 细胞迁移能力的影响
Fig.4 Effects of different SBP-3 concentrations on Hep-G2 cell migration
2.4 SBP-3 对Hep-G2 细胞侵袭的影响
Transwell 法检测细胞侵袭的状况,结果显示:空白对照组HepG2 细胞具有较强的迁移能力[15]。培养48 h 后,可观察到大量颜色深浅不一的HepG2 细胞,形状为长梭形,且分布十分密集(图5a)。随着SBP-3 药物浓度的增加,细胞穿越小室基底膜的数量明显减少,HepG2 细胞聚集的密度显著降低,呈零星分散状态,由此可判断SBP-3 使HepG2 细胞侵袭穿透能力减弱(图5b、5c、5d)。与空白对照组相比,经SBP-3 作用的各剂量组侵袭细胞数量在48 h 内显著减少(P<0.01,图6),且呈剂量依赖性抑制Hep-G2 细胞侵袭,即SBP-3 浓度越大,侵袭细胞数越少,其中SBP-3 质量浓度500 μg/mL 时,细胞侵袭率仅为16.42%,抑制Hep-G2 转移能力最佳。
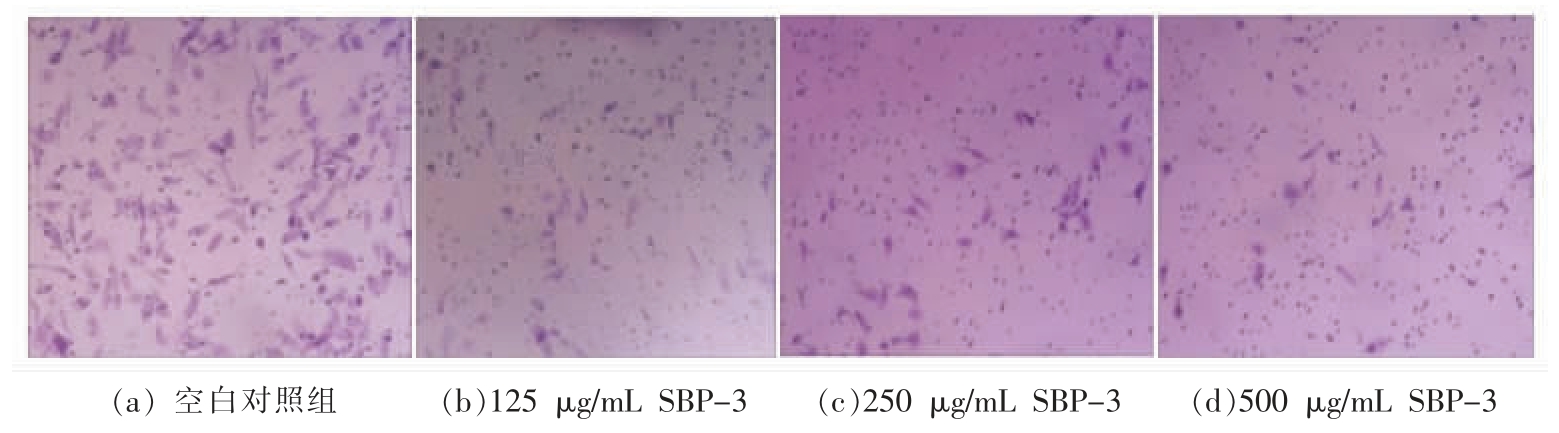
图5 SBP-3 对Hep-G2 细胞侵袭能力的影响
Fig.5 Effect of SBP-3 on invasion of Hep-G2 cells
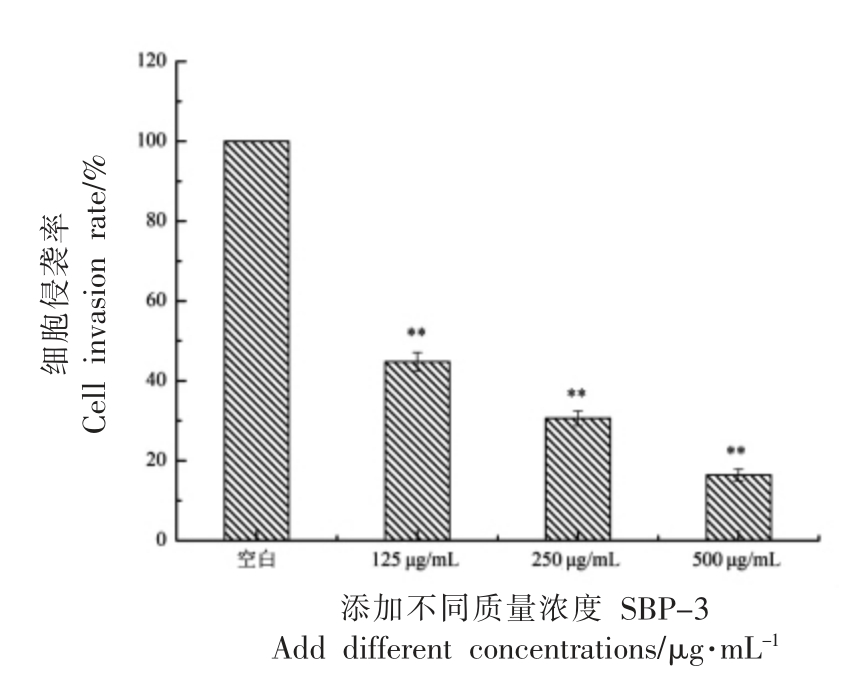
图6 SBP-3 对Hep-G2 细胞侵袭作用影响
Fig.6 Effect of SBP-3 on invasion of Hep-G2 cells
2.5 SBP-3 对Hep-G2 细胞p-p38、MMP-2 及MMP-9 蛋白表达的影响
通过Western blot 法测定SBP-3 对Hep-G2细胞p38MAPK 信号通路中关键蛋白p-p38、MMP-2 及MMP-9 的表达[16],结果表明,与空白对照Hep-G2 组相比,沙棘多糖SBP-3 各剂量组pp38、MMP-2 及MMP-9 表达水平随SBP-3 浓度的增加而逐渐降低(P<0.01),当SBP-3 质量浓度达500 μg/mL 时,下调蛋白表达的能力最强,说明沙棘多糖SBP-3 能够抑制p38 通路中p-p38、MMP-2 及MMP-9 的表达,初步推测SBP-3 呈剂量依赖性抑制p38 信号通路中相关蛋白的表达,进而降低细胞的侵袭和迁移能力并诱导Hep-G2细胞凋亡。
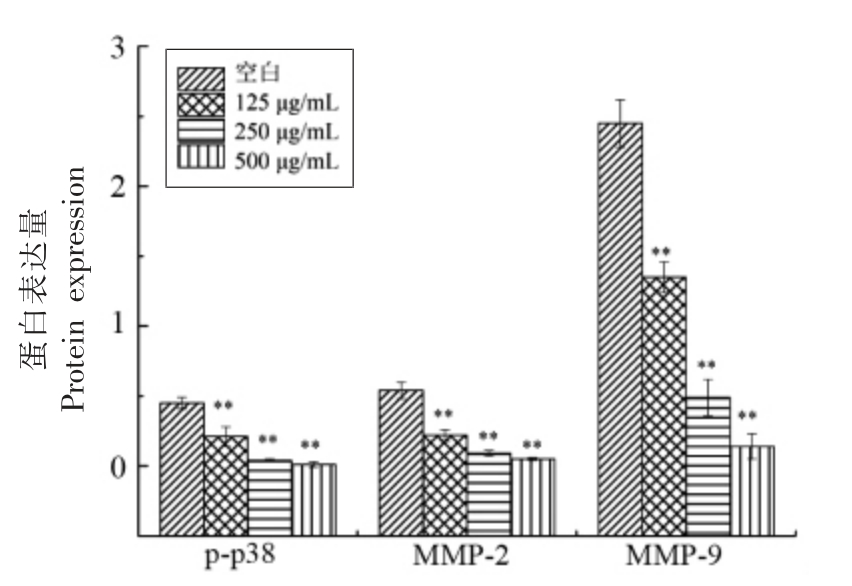
图7 SBP-3 对p-p38、MMP-2 和MMP-9 蛋白表达的影响
Fig.7 Effect of SBP-3 on protein expression of p-p38、MMP-2 and MMP-9
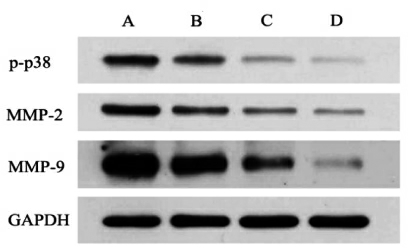
图8 Western Blot 检测p-p38、MMP-2和MMP-9 蛋白表达水平
Fig.8 Expression levels of p-p38,MMP-2 and MMP-9 proteins by Western blot
注:A.空白对照组;B.125 μg/mL SBP-3;C.250 μg/mL SBP-3;D.500 μg/mL SBP-3。
3 讨论
正常条件下,细胞增殖和凋亡是一个动态平衡过程,若此过程中出现平衡失调的状态,则可能导致肿瘤细胞的产生和扩散。肿瘤细胞的发展与多通道信号的传递密不可分[17]。丝裂原活化蛋白激酶(mitogen-activated potein kinase,MAPK)级联反应是细胞内连接并产生信号的常见通路之一[18]。p38 是MAPK 信号通路中重要的子系统,通常参与细胞整体生长发育过程[19],当p38 蛋白在磷酸化后才能发挥其活性,即通过磷酸化形成pp38 对Hep-G2 细胞生长、转移及侵袭的调节。肿瘤细胞在生长过程中由于未受到正常细胞的接触抑制,进而不断地侵袭和排挤正常组织并突破底部基膜,当其增殖到一定体积后,通过基质金属蛋白酶(matrix metalloprot-einase,MMP),如IV 型胶原酶降解细胞外基质,促使转移通路形成,最终形成继发性肿瘤。通过提高基质金属蛋白酶(matrix metalloprot-einase,MMP)表达水平,促使转移通路形成,最终形成继发性肿瘤。
p38MAPK 通路通过调节MMPs 的蛋白表达量,实现肿瘤细胞在短时间内的迁移和侵袭。首先激活p38 信号通路中相关磷酸化蛋白,其次增强下游如MMP-2 和MMP-9 等多个结合靶点的表达与活化。唐治蓉等[20]等发现,当归多糖对Hela细胞中的p38 通路产生抑制作用,从而降低Hela细胞的迁移率。Zheng 等[21]发现红豆杉多糖能够下调MMP-2 和MMP-9 的表达,改善黑色素瘤细胞的迁移及侵袭速率,即MMP-2 和MMP-9 主要参与肿瘤细胞的侵袭及转移过程,提示抑制基质金属蛋白酶的表达或抑制其活性可以预防肿瘤细胞的转移[22]。本结果表明SBP-3 对Hep-G2 细胞生长、凋亡、转移及侵袭具有一定的调节作用,推测可能通过下调p38 MAPK 通路的活性,降低MMP-2 和MMP-9 蛋白的表达,进而对Hep-G2细胞迁移及侵袭能力产生抑制作用,具有一定的抗肿瘤作用。多糖对肿瘤微环境的调节,即治疗机制并非直接产生抗肿瘤作用,而是通过间接增强免疫调节,抑制肿瘤生长、凋亡、侵袭和转移来实现的[23]。多糖的结构在一定程度上能够影响其生物活性,后续可从分子水平研究其作用机制,阐明多糖的构效关系,用分子修饰等方法改善其活性,更深层次探讨其作用价值。
4 结论
本研究表明沙棘多糖SBP-3 能够抑制肝癌细胞Hep-G2 的增殖、凋亡、迁移和侵袭,初步推测是通过下调p38MAPK 信号通路活性,抑制MMP-2 和MMP-9 表达,从而产生抗肿瘤作用。
[1]边亮,陈华国,周欣.植物多糖的抗肿瘤活性研究进展[J].食品科学,2020,41(7): 275-282.
BIAN L,CHEN H G,ZHOU X.Recent advances in understanding the antitumor activity of polysaccharides from plants[J].Food Science,2020,41(7): 275-282.
[2]周泽文,刘颖春,向邦德,等.原发性肝癌的全球展望: 流行情况、危险因素和人群归因分值[J].中国癌 症防治杂志,2021,13(1): 14-21.
ZHOU Z W,LIU Y C,XIANG B D.Global outlook for primary liver cancer: prevalence,risk factors,and population attributable scores[J].Chinese Journal of Oncology Prevention and Treatment,2021,13(1): 14-21.
[3]张琪琳.香菇多糖的结构鉴定及抗肿瘤作用机制研究[D].武汉: 华中科技大学,2015.
ZHANG Q L.Structure identification and antitumor mechanism of Lentinan[D].Wuhan: Huazhong University of Science and Technology,2015.
[4]王杰.槐角多糖分离纯化、结构分析及生理活性研究[D].北京: 北京林业大学,2019.
WANG J.Isolation,purification,structure and physiological activity of polysaccharides from sophorae frutus[D].Beijing: Beijing Forestry University,2019.
[5]何俊平,李晓菁,孟迪,等.板栗种仁多糖的提取纯化及体外抗肿瘤活性筛选[J].食品工业科技,2020,41(22): 134-141,149.
HE J P,LI X J,MENG D,et al.Extraction,purification and in vitro antitumor screening of polysaccharides from chestnut kernel[J].Science and Technology of Food Industry,2020,41(22): 134-141,149.
[6]魏晨业,包晓玮,王娟,等.沙棘多糖分离纯化及抗氧化活性[J].食品科学,2021,42(4): 227-232.
WEI C Y,BAO X W,WANG J,et al.Isolation,purification and antioxidant activity of polysaccharides from the Fruit of Hippophae rhamnoides[J].Food Science,2021,42(4): 227-232.
[7]杨焕治,熊芳琪,杨岚,等.不同组分羧甲基茯苓多糖对HepG2 细胞增殖的影响[J].中国食物与营养,2019,25(12): 26-28,39.
YANG H Z,XIONG F Q,YANG L,et al.Effects of carboxymethyl Poria cocos polysaccharides on proliferation of HepG2 cells[J].Food and Nutrition in China,2019,25(12): 26-28,39.
[8]张爱龙,赵飞,金周雨,等.金针菇多糖抑制肝癌HepG2 细胞增殖并诱导细胞凋亡[J].吉林农业大学学报,2019,41(5): 521-525.
ZHANG A L,ZHAO F,JIN Z Y,et al.Flammulina velutipes polysaccharide inhibits proliferation and induces apoptosis of HepG2 cells[J].Journal of Jilin Agricultural University,2019,41(5): 521-525.
[9]LI H Q,SU J,JIANG J Y,et al.Characterization of polysaccharide from Scutellaria barbata and its antagonistic effect on the migration and invasion of HT-29 colorectal cancer cells induced by TGF-β1[J].International Journal of Biological Macromolecules,2019,131(15): 886-895.
[10]CHEN Y,LIU Z J,LIU J,et al.Inhibition of metastasis and invasion of ovarian cancer cells by crude polysaccharides from rosa roxburghii tratt in vitro[J].Asian Pacific Journal of Cancer Prevention,2014,15(23): 1-4.
[11]ZHANG D,LI Y H,MI M,et al.Modified apple polysaccharides suppress the migration and invasion of colorectal cancer cells induced by lipopolysaccharide[J].Nutrition Research,2013,33(10): 839-848.
[12]GAO P Y,BIAN J,XU S H,et al.Structural features,selenization modification,antioxidant and anti -tumor effects of polysaccharides from alfalfa roots[J].International Journal of Biological Macromolecules,2020,149(2): 207-214.
[13]LIU XI X,LIU F,ZHAO S,et al.Purification of an acidic polysaccharide from Suaeda salsa plant and its anti-tumor activity by activating mitochondrial pathway in MCF-7 cells[J].Carbohydrate Polymers,2019,215(6): 99-107.
[14]KRAMER N,WALZL A,UNGER C,et al.In vitro cell migration and invasion assays[J].Mutation Research,2013,75(2): 10-24.
[15]YAN K H,LEE L M,YAN S H,et al.Tomatidine inhibits invasion of human lung adenocarcinoma cell A549 by reducing matrix metalloproteinases expression[J].Chemico Biology Interaction,2013,203(3): 580-587.
[16]张悦,符乔珊.苦参碱对宫颈癌HeLa 细胞黏附和侵袭的抑制作用及其机制[J].山西医科大学学报,2015,46(12): 1198-1202.
ZHANG Y,FU Q S.Effect and mechanism of matrine on adhesion and invasion of cervical cancer HeLa cells[J].Journal of Shanxi Medical University,2015,46(12): 1198-1202.
[17]姜恩平,王卓,陈建光,等.ERK 信号途径介导五味子多糖对Hela 细胞凋亡和侵袭的作用[J].时珍国医国药,2015,26(8): 1892-1895.
JIANG E P,WANG Z,CHEN J G,et al.ERK signaling pathway mediates the effect of Schisandra chinensis polysaccharide on HeLa cell apoptosis and invasion[J].Lishizhen Medicine and Materia Medica Research,2015,26(8): 1892-1895.
[18]乔静,张秋芳.p38MAPK 信号传导通路与肿瘤细胞多药耐药的关系[J].山西医药杂志,2013,42(9):1020-1022.
QIAO J,ZHANG Q F.Relationship between p38MAPK signal transduction pathway and multidrug resistance of tumor cells[J].Shanxi Medical Journal,2013,42(9): 1020-1022.
[19]常蕊静,李佩佩,梁丽峰,等.p38MAPK 在肺鳞癌组织中的表达及临床意义[J].现代肿瘤医学,2013,21(5): 1025-1029.
CHANG R J,LI P P,LIANG L F,et al.Expression and clinical significance of p38MAPK in lung squamous cell carcinoma[J].Journal of Modern Oncology,2013,21(5): 1025-1029.
[20]唐治蓉,龙琼先,刘欣雅,等.当归多糖通过调节p38 通路抑制宫颈癌Hela 细胞生长、迁移和侵袭[J].中国免疫学杂志,2020,36(3): 332-337.
TANG Z R,LONG Q X,LIU X Y,et al.Angelica sinensis polysaccharide inhibits growth,migration and invasion of cervi- cal cancer Hela cells by regulating p38 pathway[J].Chinese Journal of Immunology,2020,36(3): 332-337.
[21]ZHENG Z Q,FU Y Y,LI B H,et al.PSY-1,a Taxus chinensis var.mairei extract,inhibits cancer cell metastasis by interfering with MMPs[J].Natural Product Communications,2014,9(2): 241-245.
[22]LEE K R,LEE J S,KIM Y R,et al.Polysaccharide from Inonotus obliquus inhibits migration and invasion in B16-F10 cells by suppressing MMP-2 and MMP-9 via downregulation of NF-κB signaling pathway[J].Oncology reports,2014,31(5): 2447-2453.
[23]谭西,周欣,陈华国.植物多糖构效关系研究进展[J].中国中药杂志,2017,42(21): 4104-4109.
TAN X,ZHOU X,CHEN H G.Structure-activity relationship of plant polysaccharides[J].China Journal of Chinese Materia Medica,2017,42(21): 4104-4109.