谷子(Setaria italica)起源于我国黄河流域,是我国华北地区主要种植的农作物,其生长时间短且需水量较低[1]。大量研究[2]表明谷子中含有膳食纤维、蛋白质、维生素、氨基酸等营养物质,还含有一些抗氧化性物质,包括维生素E、酚类化合物等。现代医学研究也揭示谷子能够有效降血糖,防止心脑血管疾病,防癌,抗氧化,提高人体免疫力,增强肠道健康等[3]。基于谷子的营养价值和保健功效,以及人们生活水平的提高和保健意识的增强,谷子类食品逐渐受到青睐。
膳食纤维作为一类碳水化合物聚合物[4],它在小肠不能被消化吸收,但可在大肠中被肠道菌群所发酵,发挥生物活性功能[5]。膳食纤维的结构是其生物活性的基础。研究表明膳食纤维能降低血糖血脂,预防结肠癌、心血管疾病等多种慢性疾病[6-10],这些功能的发挥与其理化性质,如持油力、溶解性、吸附胆固醇、吸附NO2-等密切相关。我国膳食纤维原料资源丰富,种类繁多,谷物膳食纤维是其中的一个重要部分,如小麦膳食纤维、燕麦膳食纤维、大麦膳食纤维、玉米膳食纤维和米糠膳食纤维等。目前对谷子膳食纤维的研究很少。膳食纤维可分为可溶性膳食纤维(Soluble Dietary Fiber,SDF)和不溶性膳食纤维(Insoluble Dietary Fiber,IDF)。SDF 能被肠道菌群所发酵,产生短链脂肪酸(short-chain fatty acids,SCFAs),使大肠内pH 值降低,促进有益菌的生长,通过改变肠道菌群的丰度来提高机体的免疫力[11-15]。目前对谷子SDF 的研究尚处于初级阶段,未见有关其对肠道菌群方面的研究报道。
本试验中,以谷子为原料,采用酶法制备SDF,并测定SDF 的持油力、溶解度及其对胆固醇和NO2-的吸附能力等理化性质。通过红外光谱(FT-IR)分析SDF 的官能团,离子色谱法(ICS)检测SDF 的单糖组成,高效凝胶渗透色谱法(HPGPC)检测SDF 分子质量及纯度。通过研究植物乳杆菌、鼠李糖乳杆菌、发酵乳杆菌、嗜酸乳杆菌、短双歧杆菌、大肠杆菌、金黄色葡萄球菌生长过程中培养基OD 值、培养基pH 值等,探究谷子SDF 对7 种肠道菌群生长的影响,包括肠道益生菌和有害菌,找到适宜肠道有益菌生存的pH 环境。探索谷子SDF 进一步开发成功能性食品或药品的新思路,为SDF 的深入研究及谷子资源开发提供理论基础。
1 材料与方法
1.1 材料与试剂
谷子(晋谷21 号),购自山西省农业科学院,磨成粉后塑封袋密封保存,备用。
植物乳杆菌(Lactobacillus plantarum)、大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus),太原师范学院生物系微生物学实验室;鼠李糖乳杆菌(Lactobacillus rhamnosus)、嗜酸乳杆菌(Lactobacillus acidophilus)、发酵乳杆菌 (Lactobacillus fermentum)、短双歧杆菌(Bifidobacterium breve),北京北纳创联生物技术研究院(BNCC)。
碱性蛋白酶(≥200 000 U/g)、α-高温淀粉酶(≥40 000 U/g)、纤维素酶(≥50 U/mg)、胆固醇标准品,北京索莱宝科技有限公司;单糖标品:岩藻糖、葡萄糖及半乳糖等均为色谱纯级,上海源叶生物科技有限公司;其它化学试剂均为国产分析纯级。
1.2 仪器与设备
UV752 紫外-可见分光光度计,上海赫尔普国际贸易有限公司;傅里叶变换红外光谱仪FTIR650,天津港东科技发展股份有限公司;LC-10A高效液相色谱仪、RI-10A 示差检测器Shimadzu;BRT105-104-102 串联凝胶柱 (8 mm×300 mm),BoRui Saccharide;Thermo ICS5000 离子色谱系统,Thermo Fisher Scientific;RE-2000 旋转蒸发器,上海亚荣生化仪器厂;MS-H-Pro+数显加热磁力搅拌器,大龙兴创实验仪器(北京)股份公司;LC-4012 低速离心机,安徽中科中佳科学仪器有限公司;BGZ-246 电热鼓风干燥箱,上海博迅实业有限公司医疗设备厂;BSD-YX3200 立式摇床,上海博迅实业有限公司医疗设备厂;FD-1B-50 冷冻干燥机,上海比朗仪器制造有限公司;YQX-II厌氧培养箱,上海龙跃仪器设备有限公司;HH-2数显恒温水浴锅,拓赫机电科技(上海)有限公司。
1.3 方法
1.3.1 谷子SDF 的制备及纯化 SDF 的制备参考黄冬云[16]的方法并略作修改。将一定量的谷子粉称重并记录质量(A1,g),经石油醚除脂后,以料液比1∶12(m∶V)加水搅拌均匀,60 ℃水浴2 h,8 000 r/min 离心10 min,取沉淀,按料液比1∶12(m∶V)加水搅拌均匀,95 ℃糊化0.5 h,依次加α-高温淀粉酶95 ℃水浴0.5 h,碱性蛋白酶45 ℃水浴5 h,然后沸水浴10 min 灭酶,4 000 r/min 离心20 min,保留上清液备用。将沉淀按料液比1∶10(m∶V)加柠檬酸钠缓冲液搅拌均匀,加入纤维素酶50℃水浴3 h,沸水浴10 min 灭酶,4 000 r/min 离心20 min,取上清液。将两次上清液合并后旋蒸、醇沉12 h,冷冻干燥后即得SDF,称重并记录质量(A2,g)。
按文献[4]计算SDF 提取率:
上述SDF 经透析 (100 u),DEAE 纤维素52(26 mm×30 cm)纯化,上样质量浓度为50 mg/mL,水为洗脱剂,洗脱流速为1.0 mL/min,采用苯酚硫酸法[17]跟踪检测洗脱液,将SDF 洗脱峰合并,浓缩、冻干后得到纯化的SDF。
1.3.2 理化性质指标测定
1.3.2.1 持油力 称取一定量SDF,记录质量(m,g),置于离心管中,加入食用油20 g,3 000 r/min离心30 min,去掉上层油,用滤纸吸干游离的油,将结合了油的样品转移到表面皿上称重[18]。
式中:OHC——SDF 的持油力,g/g;m1——样品离心后湿重-样品离心前干重,g。
1.3.2.2 溶解度 称取一定量SDF,记录质量(m,g),置于100 mL 烧杯中,加入50 mL 蒸馏水,25℃保温30 min,离心(5 000 r/min,10 min),将上清液加入烧杯(恒质量)中,在105 ℃烘箱中烘干,计算得SDF 的溶解度与溶解性[19]。
式中:SN——SDF 的溶解度,g/100mL;m1——上清液干燥后固形物含量,g;L——蒸馏水的体积,mL。
式中:SI——SDF 的溶解性,%;m1——上清液干燥后固形物含量,g。
1.3.2.3 吸附胆固醇能力 参照 《食品安全国家标准 食品中胆固醇的测定》GB 5009.128-2016方法测定SDF 对胆固醇的吸附能力,绘制胆固醇标准曲线。
吸附效果测定参考肖盾[20]的方法:取市售鲜鸡蛋的蛋黄,用9 倍体积的蒸馏水充分搅拌成乳液,测定吸附前蛋黄液中的胆固醇量。称取一定量SDF,记录质量(m,g),置于250 mL 锥形瓶中,加入50 g 稀释蛋黄液搅拌均匀,分別模拟小肠和胃环境,设置pH 值为7.0 和2.0,置37 ℃摇床中振荡培养2 h,4 000 r/min 离心20 min,取0.04 mL 上清液,采用硫酸铁铵法测定OD560nm,代入标准曲线,计算吸附后胆固醇量。
式中:OMC——SDF 对胆固醇的吸附量,μg/g;m1——吸附前蛋黄液中胆固醇量-吸附后上层清液中胆固醇量,μg。
1.3.2.4 吸附亚硝酸根离子能力 参照 《食品安全国家标准 食品中亚硝酸盐与硝酸盐的测定》GB 5009.33-2016 方法测定SDF 对亚硝酸根离子的吸附能力,绘制亚硝酸根离子标准曲线。
吸附效果测定参考吕钟钟[21]的方法:分別模拟小肠和胃环境,设置吸附环境为pH 7.0 和pH 2.0,亚硝酸根离子浓度为100 μmol/L,加入一定量SDF,记录质量(m,g),反应总体积100 mL,置于37 ℃恒温磁力搅拌器,分別在5,15,30,60,120,180,240 min 后各取1 mL 样液,测定亚硝酸根离子的浓度,同时各做空白试验。根据标准曲线计算SDF 对亚硝酸根离子的吸附量。
式中:ONC——SDF 对亚硝酸根离子的吸附量,μg/g;m1——吸附前亚硝酸根离子含量-吸附后亚硝酸根离子含量,μg。
1.3.3 SDF 结构表征测定
1.3.3.1 红外光谱(FT-IR)分析 称取SDF 2 mg和溴化钾200 mg,压制成片,在4 000~400 cm-1 的波长范围内扫描记录。
1.3.3.2 高效凝胶渗透色谱法(HPGPC)测定分子质量 称取SDF 和葡聚糖标准品(5 000,11 600,23 800,48 600,80 900,148 000,273 000,409 800,667 800 u),配成质量浓度为5 mg/mL 的溶液,12 000 r/min 离心10 min,上清液用0.22 μm的微孔滤膜过滤后采用HPGPC 测定分子质量。色谱条件:流动相:0.05 mol/L NaCl 溶液;流速:0.6 mL/min,柱温:40 ℃;进样量:20 μL;色谱柱:BRT105-104-102 串联凝胶柱 (8 mm×300 mm);检测器:示差检测器RI-10A。
1.3.3.3 离子色谱法(ICS)测定单糖组成 称取SDF 5 mg,加入1 mL 2 mol/L TFA 酸溶液,105℃加热6 h。通氮气,吹干。加入甲醇清洗,再吹干,重复甲醇清洗3 次。加入无菌水溶解,采用ICS 测定单糖组成。色谱条件: 液相色谱柱:DionexTM CarboPacTM PA10(250 mm×4.0 mm,10 μm);进样量5 μL。流动相A(0.1 mol/L NaOH),流动相B(0.1 mol/L NaOH,0.2 mol/L NaAc),流速0.5 mL/min;柱温30 ℃。
1.3.4 SDF 对7 种肠道菌群生长的影响
1.3.4.1 SDF 对7 种肠道菌群促增殖或抑制作用 用无菌水溶解SDF,经0.22 μm 微孔滤膜过滤后,依次加到10 mL 培养基中,使培养基中SDF的终质量浓度为0,5,10,15,20 mg/mL,分别接种鼠李糖乳杆菌、植物乳杆菌、嗜酸乳杆菌、发酵乳杆菌、短双歧杆菌、大肠杆菌和金黄色葡萄球菌。鼠李糖乳杆菌、植物乳杆菌、嗜酸乳杆菌和发酵乳杆菌所用培养基为MRS 培养基,短双歧杆菌所用培养基为BBL 液体培养基,其中鼠李糖乳杆菌、嗜酸乳杆菌、发酵乳杆菌和短双歧杆菌于37 ℃恒温厌氧培养箱中培养20 h;植物乳杆菌于35 ℃恒温厌氧培养箱中培养36 h;大肠杆菌和金黄色葡萄球菌所用培养基为牛肉膏蛋白胨培养基,将两株菌置于37 ℃恒温摇床中培养12 h,培养结束后分别测定培养液在600 nm 处的光密度值(OD600nm)。
1.3.4.2 SDF 对7 种肠道菌群生长曲线及pH 值的影响 在1.3.4.1 节的基础上,向MRS 培养基、BBL 培养基和牛肉膏蛋白胨培养基中添加SDF,分别接种7 种菌株,每隔一定时间取样,测定600 nm 处的光密度值(OD600)和液体培养基的pH 值,绘制肠道菌群生长曲线。
1.4 数据统计与处理
所有试验均做3 次重复,所得数据表示为平均值±标准差 (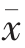 ±s)。数据经 Origin 8.5 处理、SPSS17.0 统计分析,采用单因素方差分析(ANOVA)进行多重比较,多个均数间的两两比较用Duncan 多重比较法,不同字母表示差异显著(P<0.05)。
±s)。数据经 Origin 8.5 处理、SPSS17.0 统计分析,采用单因素方差分析(ANOVA)进行多重比较,多个均数间的两两比较用Duncan 多重比较法,不同字母表示差异显著(P<0.05)。
2 结果与分析
2.1 谷子SDF 提取及理化性质
谷子SDF 得率为 (0.25±0.02)g/g,且得率稳定。
SDF 持油力、吸附胆固醇能力、吸附NO2-能力是显示其体外活性的重要指标。SDF 持油力越强,越能吸附油脂,并随着粪便一起排出,降低体内脂肪酸含量,从而达到减肥功效[22]。人体胆固醇含量过高,会引发动脉硬化、冠心病、脑血管疾病等,而SDF 能够吸附胆固醇,进而减少这些疾病的发生率[23]。NO2-进入体内可以产生强致癌物质,膳食纤维能够吸附NO2-,从而起到预防癌症的作用[24]。SDF 作为一种可溶性产品,溶解度是评价的重要指标,溶解性的好坏直接影响产品的质量与应用,优良的溶解性可使SDF 作为功能性食品添加剂[25]。
由表1可知,谷子SDF 持油力为(4.05±0.06)g/g,在25 ℃的溶解度为(1.78±0.01) g/100 mL,溶解性为(88.93±0.55)%。SDF 持油力比朱玉[26]在小米米糠中获得的SDF 持油力(2.32 g/g)高。SDF溶解度比张荣等[27]从小米中获得的SDF 溶解度(1.434 g/100 mL)高。本试验谷子SDF 持油力和溶解性较好,可用于制作减肥的功能性食品或作为人体补充膳食纤维的饮品添加剂。
表1 谷子SDF 理化性质指标
Table 1 Determination of physical and chemical properties of SDF

种类持油力/g·g-1g·(100 mL)-1溶解性/%对胆固醇吸附作用/μg·g-1 pH 2.0pH 7.0 SDF4.05 ± 0.061.78 ± 0.0188.93 ± 0.5516.22 ± 0.7726.31 ± 1.16溶解度/?
在模拟胃液环境(pH 2.0)时,谷子SDF 对胆固醇的吸附量为(16.22±0.77) μg/g,而在模拟肠道环境(pH 7.0)下,谷子SDF 对胆固醇的吸附量为 (26.31±1.16) μg/g。说明在中性条件下谷子SDF 对胆固醇的吸附能力优于酸性条件,与燕麦、麦麸等SDF 吸附胆固醇的能力测定结果 [28] 相一致。
谷子SDF 对亚硝酸根离子吸附量如图1所示。在模拟胃液环境(pH 2.0)时,谷子SDF 对亚硝酸根离子的吸附作用优于模拟肠道环境下(pH 7.0)的吸附作用。在pH 2.0 时,谷子SDF 在60 min 内对亚硝酸根离子的吸附能力呈上升趋势,60 min 后趋于平缓,酸性条件下谷子SDF 对亚硝酸根离子的吸附量与吸附时间呈极显著的正相关性(R=0.887)(P<0.01)。在pH 7.0 时,谷子SDF 在30 min 内对亚硝酸根离子的吸附能力呈上升趋势,30 min 后呈下降趋势并趋于平缓,中性条件下谷子SDF 对亚硝酸根离子的吸附量与吸附时间呈负相关性(R=-0.338)。以上结果提示谷子SDF对亚硝酸根离子的吸附主要在胃中进行,这可能是因为SDF 结构复杂,其中的多糖可与酚酸作用形成复合物。酚酸在胃部酸性环境下,可与亚硝酸根离子发生反应,阻断致癌物N-硝基化合物。进入小肠后,由于pH 值升高,含羧基化合物(糖醛酸、阿魏酸等)上的羧基解离,增大了膳食纤维表面的负电荷密度,从而排斥亚硝酸根离子,使之释放出来,发生解吸[29]。可以认为SDF 在正常胃液条件下对癌症有一定的预防作用。

图1 谷子SDF 对NO2-的吸附作用
Fig.1 Determination of nitrite ion adsorption capacity of foxtail millet SDF
2.2 谷子SDF 结构表征
2.2.1 FT-IR 光谱分析糖类特征吸收峰 谷子SDF 的红外光谱图如图2所示。3 386 cm-1 是O-H的伸缩振动吸收峰,是糖类的特征峰[30]。在2 925 cm-1 处有吸收峰,归属于C-H 伸缩振动[30]。在1 740 cm-1 和1 650 cm-1 处的吸收峰,归属于C=O伸缩振动[31]。在1 405 cm-1 和1 149 cm-1 处的吸收峰,归属于C-O 伸缩振动[31]。在1 022 cm-1 处有吸收峰,归属于O-H 变角振动[30]。在927 cm-1 处有吸收峰,可能为吡喃环的非对称伸缩振动。在842 cm-1 处有吸收峰,可能为β-端基差向异构的C-H变角振动[32]。在1 731 cm-1 左右未观察到明显的特征峰,说明SDF 中糖醛酸含量较低[33],这与SDF单糖组成测定结果一致。

图2 SDF 的红外光谱图
Fig.2 FT-IR spectrum of SDF
2.2.2 SDF 分子质量 谷子SDF 的分子质量采用HPGPC 法测定。如图3所示,谷子SDF 的洗脱曲线仅为一个尖锐且较对称的峰,表明谷子SDF 纯度较高,分子质量分布范围较窄,为均一多糖。根据标准葡聚糖回归直线方程y = -0.1985x + 12.509(R2=0.9964),代入SDF 保留时间46.8 min,得SDF 分子质量为1 784 u。

图3 SDF 的高效凝胶渗透色谱图
Fig.3 High performance gel permeation chromatography of SDF
2.2.3 谷子SDF 单糖组成 谷子SDF 的单糖组成采用ICS 测定。由图4可知,谷子SDF 是由岩藻糖、阿拉伯糖、半乳糖、葡萄糖、甘露糖、葡萄糖醛酸6 种单糖构成的杂多糖,其物质的量比为0.02∶0.27∶0.26∶98.34∶0.95∶0.15。

图4 SDF 的离子色谱图
Fig.4 Ion chromatography spectrum of SDF
注:1.岩藻糖;2.D-氨基半乳糖盐酸盐;3.鼠李糖;4.阿拉伯糖;5.盐酸氨基葡萄糖;6.半乳糖;7.葡萄糖;8.木糖;9.甘露糖;10.果糖;11.核糖;12.半乳糖醛酸;13.古罗糖醛酸;14.葡萄糖醛酸;15.甘露糖醛酸。
2.3 SDF 对7 种肠道菌群生长的影响
肠道菌群多样性是健康和代谢能力的标志物,膳食纤维的摄入与肠道菌群的多样性密切相关。益生菌是肠道中对宿主有益,可以通过调节菌群平衡对宿主产生功效的微生物[34],而有害菌反之。鼠李糖乳杆菌、植物乳杆菌、嗜酸乳杆菌、发酵乳杆菌和短双歧杆菌是公认的肠道益生菌,而大肠杆菌和金黄色葡萄球菌经常被作为肠道有害菌来研究。SDF 可以抵御人体中胃酸和消化酶的水解,对人体的肠道健康起着重要的调节作用[35]。
2.3.1 SDF 对益生菌生长的影响 由图5a、5b、5c、5d 和5e 可知,SDF 对鼠李糖乳杆菌、植物乳杆菌、发酵乳杆菌、嗜酸乳杆菌和短双歧杆菌都有促增殖作用,且呈剂量依赖性(R 鼠李糖乳杆菌=0.971,R 植物乳杆菌=0.921,R 发酵乳杆菌=0.988,R 嗜酸乳杆菌=0.984,R 短双歧杆菌=0.971)(P<0.01)。在SDF 质量浓度5~20 mg/mL 范围,当其质量浓度超过15 mg/mL 后,鼠李糖乳杆菌、植物乳杆菌和短双歧杆菌的增长趋势变缓。

图5 SDF 对鼠李糖乳杆菌(a)、植物乳杆菌(b)、发酵乳杆菌(c)、嗜酸乳杆菌(d)和短双歧杆菌(e)的增殖作用
Fig.5 Proliferative effect of SDF on Lactobacillus rhamnosus (a),Lactobacillus plantarum (b),Lactobacillus fermentans (c),Lactobacillus acidophilus (d) and Bifidobacterium brevis (e)
由图6a、6b、6c、6d 和6e 可知,接种鼠李糖乳杆菌、植物乳杆菌、发酵乳杆菌、嗜酸乳杆菌和短双歧杆菌后,随着培养时间的延长,两株菌的OD600nm 值均先升高后趋于平稳,且在相同时间添加SDF 的培养基的OD600nm 值比未添加SDF 的培养基的OD600nm 值高,表明添加SDF 后能显著促进5 株肠道益生菌的生长。从pH 值与培养时间的关系曲线看,随着培养时间的延长,pH 值均随菌体浓度的增加而呈现先下降后趋于平稳的趋势,且在相同培养时间下添加SDF 的培养基的pH 值比未添加SDF 的培养基的pH 值略低。这可能是因为SDF 作为碳源,被肠道菌群利用发酵后被分解成为短链脂肪酸(乙酸、丁酸等),随着培养时间的增长,菌体产生的酸增加,导致培养液的pH 值下降。菌体生长趋于稳定期后,碳源基本被消耗完,pH 值趋于稳定。提示低pH 值环境有益于肠道益生菌的生长。


图6 鼠李乳杆菌(a)、植物乳杆菌(b)、发酵乳杆菌(c)、嗜酸乳杆菌(d)和短双歧杆菌(e)的生长曲线和pH 值
Fig.6 Growth curves and pH values of Lactobacillus rhanosus (a),Lactobacillus plantarum (b),Lactobacillus fermentans (c),Lactobacillus acidophilus (d) and Bifidobacterium brevis (e)
注:A.添加SDF 的MRS 或BBL 培养基OD600;B.MRS 或BBL 培养基OD600;C.MRS 或BBL 培养基pH 值;D.添加SDF 的MRS 或BBL 培养基pH 值。
2.3.2 SDF 对有害菌生长的影响 从图7a 和图7b 可知,在SDF 质量浓度5~20 mg/mL 范围,大肠杆菌(a)和金黄色葡萄球菌(b)的OD600nm 值和SDF 质量浓度呈极显著的负相关性 (R 大肠杆菌=-0.914,R 金黄色葡萄球菌=-0.979)(P<0.01),表明SDF能够显著抑制两种肠道有害菌的生长。

图7 SDF 对大肠杆菌(a)和金黄色葡萄球菌(b)的抑制作用
Fig.7 Inhibitory effect of SDF on Escherichia coli (a) and Staphylococcus aureus (b)
图8可知,接种大肠杆菌(a)和金黄色葡萄球菌(b)后,在相同培养时间添加SDF 的牛肉膏蛋白胨培养基的OD600nm 值比未添加SDF 的牛肉膏蛋白胨培养基的OD600nm 值低,说明SDF 能够抑制两种肠道有害菌的生长。从pH 值与培养时间的关系曲线看,大肠杆菌和金黄色葡萄球菌在未添加SDF 的牛肉膏蛋白胨培养基中的pH 值随培养时间的延长先上升后趋于平稳,而添加SDF 的牛肉膏蛋白胨培养基中的pH 值随培养时间的延长降低后趋于平稳。可能是因为未添加SDF 的牛肉膏蛋白胨培养基,随培养时间的延长,大肠杆菌和金黄色葡萄球菌的数量逐渐增多,碳源和氮源基本消耗殆尽,在菌株培养的稳定期产生一些碱性物质,然而pH 值仍未超过7.0,而培养基中添加SDF 后,在菌株培养的稳定期后,SDF 逐渐被发酵产生一些短链脂肪酸,从而降低培养液中的pH值,进而达到抑制大肠杆菌和金黄色葡萄球菌的作用。阚旭等[36]研究海洋多糖对人体肠道大肠杆菌、双歧杆菌、乳酸菌等的影响,研究表明:随着时间的延长,发酵液的pH 值呈下降趋势。这与本研究结果一致,提示低pH 值环境适合有益菌生长,抑制有害菌生长。

图8 大肠杆菌(a)和金黄色葡萄球菌(b)的生长曲线和pH 值
Fig.8 Growth curves and pH of Escherichia coli (a) and Staphylococcus aureus (b)
注:A.SDF 培养基OD 值;B.牛肉膏蛋白胨培养基OD 值;C.SDF 培养基pH 值;D.牛肉膏蛋白胨培养基pH 值。
3 结论
从谷子中提取得率稳定且品质良好的可溶性膳食纤维(SDF),其持油力为(4.05±0.06)g/g,溶解度(1.78±0.01) g/100 mL,溶解性(88.93±0.55)%,且SDF 能够吸附胆固醇与亚硝酸根离子。中性环境下SDF 对胆固醇的吸附作用优于酸性环境,在pH 2.0 时,SDF 对胆固醇的吸附能力为16.22 μg/g;在pH 7.0 时,SDF 对胆固醇的吸附能力为26.31 μg/g。而SDF 对NO2-的吸附作用则是酸性环境优于中性环境,pH 2.0 时SDF 对NO2-的吸附能力为6.97 μg/g,pH 7.0 时SDF 对NO2-的吸附能力为2.77 μg/g。红外光谱分析表明SDF 具有典型的多糖特征。色谱分析表明SDF 是一种分子质量为1 784 u 的杂多糖,由岩藻糖、阿拉伯糖、半乳糖、葡萄糖、甘露糖、葡萄糖醛酸6 种单糖构成,物质的量比分别为0.02∶0.27∶0.26∶98.34∶0.95∶0.15。SDF 质量浓度在5~20 mg/mL 范围,能够促进植物乳杆菌、鼠李糖乳杆菌、发酵乳杆菌、嗜酸乳杆菌、短双歧杆菌的增殖,抑制大肠杆菌和金黄色葡萄球菌的生长,且均呈现出浓度依赖性。此外,低pH 值环境有利于肠道中有益微生物的生长繁殖。以上结论说明谷子SDF 是潜在的一种益生元或功能性食品之一。未来益生元可能成为定制UC 结肠炎食疗法的膳食补充剂。
[1]AMADOU I,LE G W,AMZA T,et al.Purification and characterization of foxtail millet -derived peptides with antioxidant and antimicrobial activities[J].Food Research International,2013,51 (1):422-428.
[2]王纶,王星玉,温琪汾,等.中国黍稷种质资源研究与利用[J].植物遗传资源学报,2005,6(4):474-477.
WANG L,WANG X Y,WEN Q F,et al.Study and utilization of millet germplasm resources in China[J].Journal of Plant Genetic Resources,2005,6(4): 474-477.
[3]MANN J I,CUMMINGS J H.Possible implications for health of the different definitions of dietary fibre[J].Nutrition,Metabolism and Cardiovascular Diseases,2009,19(3): 226-229.
[4]扈晓杰,韩冬,李铎.膳食纤维的定义、分析方法和摄入现状[J].中国食品学报,2011,11(3): 133-137.
HU X J,HAN D,LI D.Definition,analysis method and intake status of dietary fiber[J].Journal of Chinese Institute of Food Science and Technology,2011,11(3): 133-137.
[5]孙元琳,陕方,赵立平.谷物膳食纤维——戊聚糖与肠道菌群调节研究进展[J].食品科学,2012,33(9): 326-330.
SUN Y L,SHAN F,ZHAO L P.Research progress of dietary fiber - Pentosan and intestinal flora regulation[J].Food Science,2012,33(9): 326-330.
[6]陈尔真.膳食纤维预防结肠癌作用机理的实验研究[D].上海: 上海第二医科大学,2003: 1-10.
CHEN E Z.Effects of dietary fiber on prevention of colon cancer[D].Shanghai: Shanghai Second Medical University,2003: 1-10.
[7]ZHAO L P,ZHANG F,DING X Y,et al.Gut bacteria selectively promoted by dietary fibers alleviate type 2 diabetes[J].Science,2018,359(6380):1151-1156.
[8]MING J,LIU J,WU S R,et al.Structural characterization and hypolipidemic activity of a polysaccharide PGEB-3H from the fruiting bodies of Gastrodia elata Blume[J].Procedia Engineering,2012,37: 169-173.
[9]KACZMARCZYK M M,MILLER M J,FREUND G G.The health benefits of dietary fiber: beyond the usual suspects of type 2 diabetes mellitus,cardiovascular disease and colon cancer[J].Metabolism,2012,61(8): 1058-66.
[10]LIN D R,WU J J,YANG Y M,et al.The antilipidemic role of soluble dietary fiber extract from okara after fermentation and dynamic high-pressure microfluidization treatment to Kunming mice[J].Journal of food Science and Technology -Mysore,2020,57(4): 1-10.
[11]WANG H W,HE C,LIU Y T,et al.Soluble dietary fiber protects intestinal mucosal barrier by improving intestinal flora in a murine model of sepsis[J].Biomedicine & Pharmacotherapy,2020,129:110343.
[12]华梅,樊美玲,李志满,等.人参水溶性膳食纤维对大鼠糖脂代谢、氧化应激和肠道健康的影响[J].食品科学,2021,42(13): 127-135.
HUA M,FAN M L,LI Z M,et al.Effects of ginseng water-soluble dietary fiber on glucose and lipid metabolism,oxidative stress and intestinal health in rats[J].Food Science,2021,42(13): 127-135.
[13]YU J W,FU Y X,DENG Z Y,et al.Effects of soluble dietary fiber from soybean residue fermented by on the intestinal flora in rats[J].Food & Function,2020,11(9): 1-13.
[14]高美玲,余诚玮,范亚苇,等.甘薯渣中可溶性膳食纤维对肠道菌群代谢产物的影响[J].中国食品学报,2020,20(12): 56-61.
GAO M L,YU C W,FAN Y W,et al.Effects of soluble dietary fiber in sweet potato residue on metabolites of intestinal flora[J].Journal of Chinese Institute of Food Science and Technology,2020,20(12): 56-61.
[15]XUE Z H,MA Q Q,CHEN Y,et al.Structure characterization of soluble dietary fiber fractions from mushroom Lentinula edodes (Berk.) Pegler and the effects on fermentation and human gut microbiota in vitro[J].Food Research International,2020,129:1-32.
[16]黄冬云.米糠膳食纤维的酶法改性及功能性质研究[D].无锡: 江南大学,2014: 7-8.
HUANG D Y.Study on enzymatic modification and functional properties of rice bran dietary fiber[D].Wuxi: Jiangnan University,2014: 7-8.
[17]DUBOIS M,GILLES K A,HAMILTON J K,et al.Colorimetric method for determination of sugars and related substances[J].Analytical Chemistry,1956,28: 350-356.
[18]姬玉梅.小麦麸皮膳食纤维提取方法研究与组分分析[J].粮食问题研究,2017,5: 21-25.
JI Y M.Study on extraction method and component analysis of dietary fiber from wheat bran[J].Grain Research,2017,5: 21-25.
[19]徐广超.豆渣可溶性膳食纤维的制备及功能性的研究[D].无锡: 江南大学,2005: 35-36.
XU G C.Preparation and functional study of soluble dietary fiber from soybean residue[D].Wuxi: Jiangnan University,2005: 35-36.
[20]肖盾.沙果渣膳食纤维发酵法制备及其功能性研究[D].大庆: 黑龙江八一农垦大学,2010: 35-38.
XIAO D.Study on the preparation and function of dietary fiber from sand fruit dreg by fermentation[D].Daqing: Heilongjiang Bayi Agricultural University,2010: 35-38.
[21]吕钟钟.海藻复合膳食纤维的制备及其生物活性研究[D].青岛: 中国海洋大学,2009: 28-30.
LÜ Z Z.Study on the preparation and biological activity of seaweed compound dietary fiber[D].Qingdao: Ocean University of China,2009: 28-30.
[22]梁文康,苏平,魏丹.复合酶法提取黄秋葵可溶性膳食纤维的工艺优化及其理化特性、结构表征[J].食品工业科技,2020,41(17): 199-205,218.
LIANG W K,SU P,WEI D.Optimization techniques for the extraction of soluble dietary fiber from Okra with complex enzymes and its physicochemical properties and structure characterization[J].Science and Technology of Food Industry,2020,41(17): 199-205,218.
[23]陈欢欢.藕节改性可溶性膳食纤维对胰脂酶和胆固醇的吸附作用研究[D].武汉: 华中农业大学,2019:13-17.
CHEN H H.Adsorption of pancreatic lipase and cholesterol by modified soluble dietary fiber [D].Wuhan: Huazhong Agricultural University,2019:13-17.
[24]钟希琼,胡文娥,林丽超.膳食纤维对油脂、胆固醇、胆酸钠和亚硝酸根离子吸附作用的研究[J].食品工业科技,2010,31(5): 134-136.
ZHONG X Q,HU W E,LIN L C.Study on the adsorption of lipid,cholesterol,sodium cholate and nitrite ions by dietary fiber[J].Food Industry Science and Technology,2010,31(5): 134-136.
[25]许锡凯,辛嘉英,任佳欣,等.好食脉孢霉发酵麦麸制备可溶性膳食纤维及其理化性质[J].食品工业科技,2021,42(2): 170-176,191.
XU X K,XIN J Y,REN J X,et al.Preparation of solubility dietary fiber from wheat bran by Mycocystis glutinosa[J].Food Industry Science and Technology,2021,42(2): 170-176,191.
[26]朱玉.小米糠膳食纤维降胆固醇活性的研究[D].南京: 南京农业大学,2015: 24-28.
ZHU Y.Study on cholesterol-lowering activity of rice bran dietary fiber[D].Nanjing: Nanjing Agricultural University,2015: 24-28.
[27]张荣,任清,罗宇.小米可溶性膳食纤维提取及其理化性质分析[J].食品科学,2014,35(2): 69-74.
ZHANG R,REN Q,LUO Y.Extraction of soluble dietary fiber from millet and analysis of its physical and chemical properties[J].Food Science,2014,35(2): 69-74.
[28]王珍.热加工方式对燕麦全谷可溶性膳食纤维理化及功能特性影响研究[D].郑州: 郑州轻工业学院,2016: 1-25.
WANG Z.Effect of thermal processing on physicochemical and functional properties of whole grain soluble dietary fiber of oat[D].Zhengzhou: Zhengzhou Institute of Light Industry,2016: 1-25.
[29]牛广财,朱丹,肖盾,等.沙果膳食纤维对胆固醇和亚硝酸根离子吸附作用的研究[J].中国酿造,2011(9): 47-50.
NIU G C,ZHU D,XIAO D,et al.Study on adsorption of cholesterol and nitrite ions by dietary fiber of sand fruit[J].China Brewing,2011(9): 47-50.
[30]徐雅琴,付雪婷,王丽波,等.乙酰化修饰对黑穗醋栗果实多糖结构特性及活性的影响[J].精细化工,2019,36(12): 2467-2475.
XU Y Q,FU X T,WANG L B,et al.Effects of acetylation modification on the structure and activity of polysaccharides from black currant fruit[J].Fine Chemical Industry,2019,36(12): 2467-2475.
[31]HOU Y J,GONG T,ZHANG J T,et al.Structural characterization and emulsifying properties of thinned-young apples polysaccharides[J].Biochemical and Biophysical Research Communications,2019,516(4): 1175-1182.
[32]李美凤,袁明昊,邹仕赟,等.松露多糖的提取、分离纯化和结构鉴定[J].食品与发酵工业,2020,46(16): 196-200.
LI M F,YUAN M H,ZOU S Y,et al.Extraction,purification and structure identification of polysaccharides from truffles[J].Food and Fermentation Industry,2020,46(16): 196-200.
[33]YU X H,LIU Y,WU X L,et al.Isolation,purification,characterization and immunostimulatory activity of polysaccharides derived from American ginseng[J].Carbohydrate Polymers,2017,156: 9-18.
[34]王丽波,高婧宇,李腾飞.硒化蒲公英多糖的制备、结构表征及益生菌促增殖活性[J].食品科学,2021,42(7): 169-175.
WANG L B,GAO J Y,LI T F,et al.Preparation,structural characterization and probiotics activity of selenated dandelion polysaccharide[J].Food Science,2021,42(7): 169-175.
[35]HARMSEN H J,WILDEBOERVELOO A C,RAANGS G C,et al.Analysis of intestinal flora development in breast-fed and formula-fed infants by using molecular identification and detection methods[J].Journal of Pediatric Gastroenterology and Nutrition,2000,30(1): 61-67.
[36]阚旭,刘怡廷,孙黎明,等.三种海洋多糖对人体肠道菌群的影响[C]//中国食品科学技术学会第十二届年会暨第八届中美食品业高层论坛论文摘要集.北京: 中国食品科学技术学会,2015: 2.
KAN X,LIU Y T,SUN L M,et al.Effects of three marine polysaccharides on human intestinal flora [C]// Abstracts of Food Summit in China 2015 and 12th Annual Meeting of Chinese Institute of Food Science and Technology.Beijing: Chinese Institute of Food Science and Technology,2015: 2.