叶酸是一类人体必需的B 族维生素,在碳代谢、氨基酸代谢和细胞增殖生长中起着重要作用[1-2]。叶酸缺乏会导致一些健康问题,例如衰老过程中出现的认知障碍可能与体内低叶酸水平有关[3],孕妇摄入的叶酸不足会导致胎儿出现神经管缺陷[4-5]和腭裂[6],叶酸缺乏甚至还会导致一些癌症的发生[7]。可见,补充叶酸对于人体健康是十分重要的,然而,天然食品中叶酸种类多,含量低且不稳定[8],人体通过摄食天然食品获取叶酸很有限。
L-5-甲基四氢叶酸钙(calcium L-5-methyltetrahydrofolate,L-5-MTHF-Ca) 是一种可以代替叶酸的新型营养补充剂,与叶酸相比,L-5-MTHF-Ca 具有更稳定且成本更低的优势[9]。有研究发现,这两种化合物在等摩尔剂量下具有相当的生理活性、生物利用度和吸收率[10-12],甚至在某些方面摄取L-5-MTHFCa 比摄取叶酸的效果可能会更好[13-14]。目前生产L-5-MTHF-Ca 的方法多为人工合成,也有人通过基因工程的方法生产L-5-甲基四氢叶酸[15-16],然而,无论哪种方法,最终得到的产品中都会含有少量的D-5-甲基四氢叶酸钙 (calcium D-5-methyltetrahydrofolate,D-5-MTHF-Ca),而对于D 型异构体的安全性目前尚无相关报道。建立一种可以对L-5-MTHF-Ca 进行分离、定量的检测方法意义重大。目前的检测方法多为高效液相色谱法和液相色谱串联质谱法[17-19],这类检测方法虽可以测定5-甲基四氢叶酸的含量,但无法检测其中L-5-MTHF-Ca 的含量。针对这类问题,Gill 等[20]利用手性色谱法成功分离出RRR-α-生育酚。江锋等[21]采用手性高效液相色谱法成功测出白酒中D-乳酸和L-乳酸的含量。黄晓婉等[22]应用配位交换手性柱对L-硒-甲基硒代半胱氨酸进行分离与测定。
本文应用手性色谱法对L-5-MTHF-Ca 与其D 型异构体进行分离,并研究L-5-MTHF-Ca 的定量方法,同时进行方法学验证的相关指标测定,旨在为L-5-MTHF-Ca 含量的测定提供一个高效、可靠的方法。
1 材料与方法
1.1 材料与试剂
L-5-MTHF-Ca 对照品(纯度≥98.6%),Merck公司;D,L-5-MTHF-Ca 对照品 (纯度≥98.8%,L 型=49.8%),美国USP;乙腈 (纯度≤100%),Merck 公司;磷酸二氢钠(纯度≥99.5%),天津科密欧化学试剂有限公司;氢氧化钠 (纯度≥96.0%),国药集团化学试剂有限公司。
1.2 仪器与设备
1260 Infinity II 型高效液相色谱系统,美国Agilent 公司;FA224 型电子天平,上海舜宇恒平科学仪器有限公司;CHIRALPAK HSA 手性色谱柱(4 mm×150 mm,5 μm),上海大赛璐药物手性技术有限公司;PHS-3C 酸度计,郑州宝晶电子科技有限公司;MV-100 型涡旋混匀仪,武汉塞维尔生物科技有限公司。
1.3 试验方法
1.3.1 色谱条件 色谱柱:CHIRALPAK HSA 手性色谱柱(4 mm×150 mm,5 μm);流动相:按照磷酸二氢钠缓冲溶液(称取4.54 g 磷酸二氢钠,用水溶解定容至1 000 mL):乙腈=90∶10(V/V)的比例混合,用32%的氢氧化钠溶液调节pH 值至6.8 后过滤脱气;柱温:30 ℃;流速:0.6 mL/min;进样量:5 μL;检测器:VWD 紫外检测器;检测波长:280 nm。
1.3.2 L-5-MTHF-Ca 含量计算 根据试样溶液的色谱峰面积与标准曲线方程计算得到的L-5-MTHF-Ca 质量分数W,数值以%表示,计算公式如下:
式中:f (A)——通过将试样溶液的色谱峰面积代入标准曲线方程得到的L-5-MTHF-Ca 的质量,mg;m——样品的质量,mg。
1.3.3 专属性检测 准确称取D,L-5-MTHF-Ca对照品5 mg 于25 mL 容量瓶中,用水定容后超声溶解得到混标溶液。准确称取L-5-MTHF-Ca 对照品2.5 mg 于25 mL 容量瓶中,用水定容后超声溶解得到单标溶液。对这两种标准溶液分别进样,记录色谱图,确定各物质保留时间与分离度。
1.3.4 标准曲线的绘制 准确称取10 mg 的D,L-5-MTHF-Ca 对照品,置于50 mL 容量瓶中,用水定容至刻度后超声溶解。准确吸取0.6,1.2,1.8,3.0,5.0 mL 的上述溶液至5 mL 容量瓶中,用水定容至刻度后超声溶解。色谱进样前用0.45 μm 孔径的水相滤膜对样液进行过滤处理,进样5 μL,记录色谱图。以L-5-MTHF-Ca 的峰面积为纵坐标Y,每次所进样液中L-5-MTHF-Ca 的质量(μg)为横坐标X,绘制得到标准曲线。
1.3.5 定量限与检出限的检测 准确配制质量浓度为0.1 mg/mL 的D,L-5-MTHF-Ca 对照品溶液,用水成比例依次稀释得到一系列浓度梯度的待测溶液,将这些待测溶液依次进样,根据色谱图中L型峰的信噪比S/N≥10 和S/N≥3 为依据,得到该色谱条件下L-5-MTHF-Ca 的定量限与检出限。
1.3.6 精密度检测 配制线性关系下质量浓度为0.16 mg/mL 的D,L-5-MTHF-Ca 对照品溶液,重复进样6 次,以L-5-MTHF-Ca 的百分含量计算相对标准偏差(RSD)。
1.3.7 稳定性检测 配制线性关系下质量浓度为0.1 mg/mL 的L-5-MTHF-Ca 对照品溶液,分别在0,2,4,6,8,10 和12 min 时进样,以各时刻得到的色谱图中L-5-MTHF-Ca 的峰面积计算相对标准偏差(RSD)。
1.3.8 回收率检测 配制加标回收率检测溶液,将1 mg 的D,L-5-MTHF-Ca 对照品与0.75 mg 的L-5-MTHF-Ca 对照品混合置于5 mL 容量瓶,用水溶解定容至刻度得到检测溶液(1);将1 mg 的D,L-5-MTHF-Ca 对照品与1 mg 的L-5-MTHFCa 对照品混合置于5 mL 容量瓶,用水溶解定容至刻度得到检测溶液 (2);将1 mg 的D,L-5-MTHF-Ca 对照品与1.25 mg 的L-5-MTHF-Ca 对照品混合后置于5 mL 容量瓶,用水溶解定容至刻度得到检测溶液(3);将1 mg 的D,L-5-MTHF-Ca对照品置于5 mL 容量瓶,用水溶解定容至刻度得到标准溶液。将检测溶液的L 型峰面积减去标准
溶液的L 型峰面积后再代入线性回归方程求得各检测溶液的L 型物测定加入量,从而计算得到加标回收率。
1.3.9 系统适用性检测 配制0.2 mg/mL 的D,L-5-MTHF-Ca 混标溶液与0.1 mg/mL 的L-5-MTHF-Ca 单标溶液,取1 mL 混标溶液,用单标溶液稀释到50 mL,进样记录色谱图得到D-5-MTHF-Ca 与L-5-MTHF-Ca 的分离度。
1.3.10 统计分析 本文中重复测定的结果以平均值±标准差表示。使用SPSS 统计分析软件进行数据分析。
2 结果与分析
2.1 专属性检测
由图1(A)L-5-MTHF-Ca 单标色谱图可知,L-5-MTHF-Ca 的保留时间为15.026 min,由图1(B) 可得,D-5-MTHF-Ca 的保留时间为10.052 min。D,L-5-MTHF-Ca 的分离度为3.24,不小于1.5,说明在此色谱条件下这两种手性物质可以得到较好的分离。
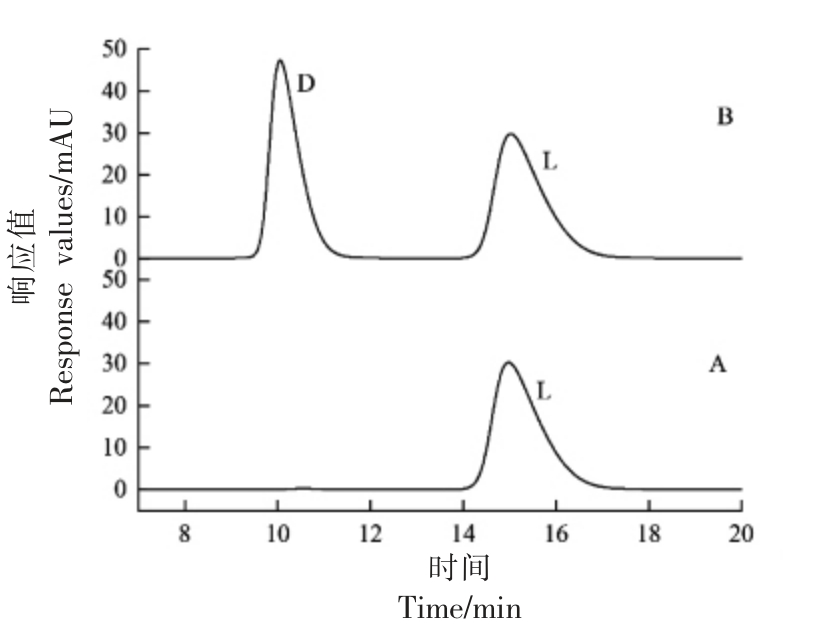
图1 L-5-MTHF-Ca 专属性检测图谱
Fig.1 Chromatograms to determine the specificity for L-5-MTHF-Ca
2.2 标准曲线的绘制
按照1.3.4 节配制标准曲线检测溶液,依次进样后记录色谱图,以L-5-MTHF-Ca 的峰面积为纵坐标Y,每次所进溶液中L-5-MTHF-Ca 的质量(μg)为横坐标X,绘制得到标准曲线(图2),得到的曲线方程为Y=4 289.28X-100.81,R2=0.9997,线性质量浓度范围为0.016~0.100 mg/mL,在此范围内线性关系良好。
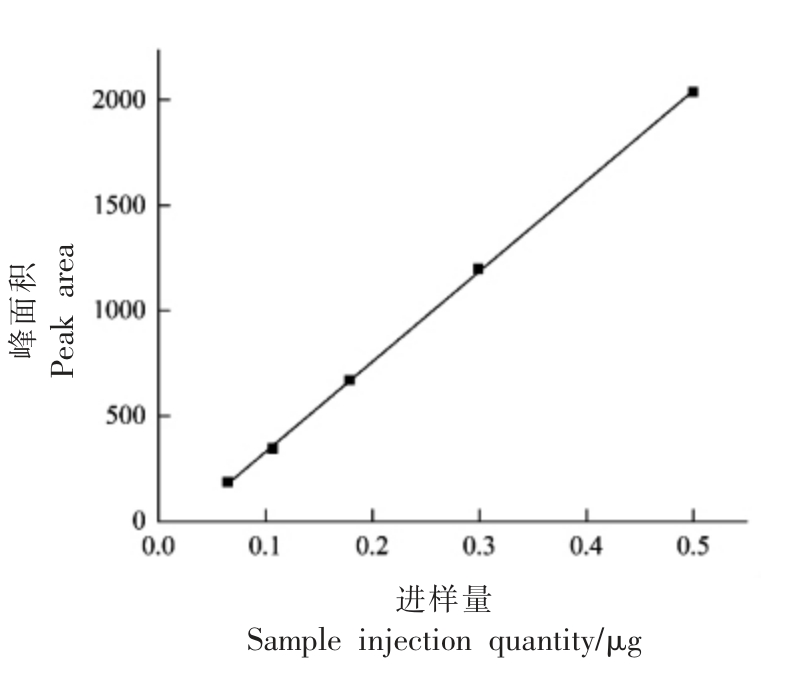
图2 L-5-MTHF-Ca 标准曲线
Fig.2 Standard curve of L-5-MTHF-Ca
2.3 定量限与检出限的检测
按照1.3.5 节配制定量限与检出限待测溶液,依次稀释后进样,以信噪比S/N≥3 为检出限,信噪比S/N≥10 为定量限,测得在此色谱条件下L-5-MTHF-Ca 的检出限和定量限分别为3.11 μg/mL 和4.98 μg/mL。
2.4 精密度检测
按照1.3.6 节配制精密度检测溶液,取6 份检测溶液依次进样并记录色谱,以L-5-MTHF-Ca的百分含量进行计算,计算结果见表1,可知相对标准偏差(RSD)为0.36%,不大于2%,说明在此色谱条件下测定的精密度良好。
表1 L-5-MTHF-Ca 精密度检测试验结果表
Table 1 Experimental results of L-5-MTHF-Ca precision detection
?
2.5 稳定性检测
由图3可知,L-5-MTHF-Ca 的峰面积 (含量)随着时间的推移不断减少,杂质的峰面积(含量) 则随着时间的推移不断增加,说明L-5-MTHF-Ca 在放置过程会缓慢降解从而转变为其它杂质物质。相较于0 min 时L-5-MTHF-Ca 的峰面积,由12 min 时的峰面积计算得到的相对标准偏差(RSD)为0.66%,小于2%,而由2 min时的峰面积计算得到的相对标准偏差 (RSD)为0.13%,远小于2%,这也说明了虽然L-5-MTHF-Ca 会随时间缓慢降解,但只要在制样完成后尽快进样分析,那么由于物质降解造成的误差就可以忽略不计。
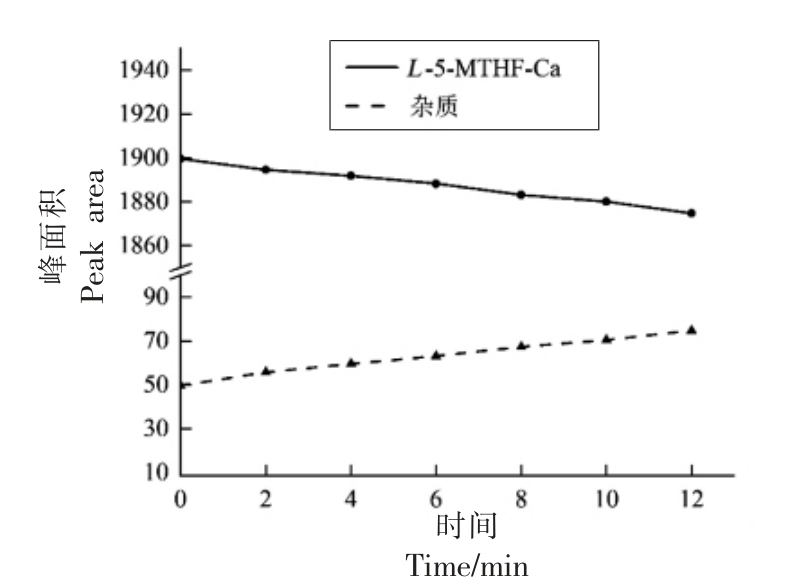
图3 L-5-MTHF-Ca 稳定性检测试验结果图
Fig.3 Experimental results of L-5-MTHF-Ca stability test
2.6 回收率检测
按照1.3.8 节配制3 组回收率检测溶液,分别进样后记录色谱图。回收率测定结果见表2,计算得到的加标平均回收率为103.71%,在80%~120%之间,说明在此色谱条件下测定的回收率良好。
表2 L-5-MTHF-Ca 回收率检测试验结果表
Table 2 Experimental results of L-5-MTHF-Ca recovery detection

?
2.7 系统适用性检测
按照1.3.9 节配制系统适用性溶液,进样后记录色谱图。由测定得到的谱图(图4)可知,D,L-5-MTHF-Ca 的分离度为3.0,不小于1.5,说明溶液中D-5-MTHF-Ca 在约0.002 mg/mL 的低质量浓度下也能与L-5-MTHF-Ca 很好地分离开来。
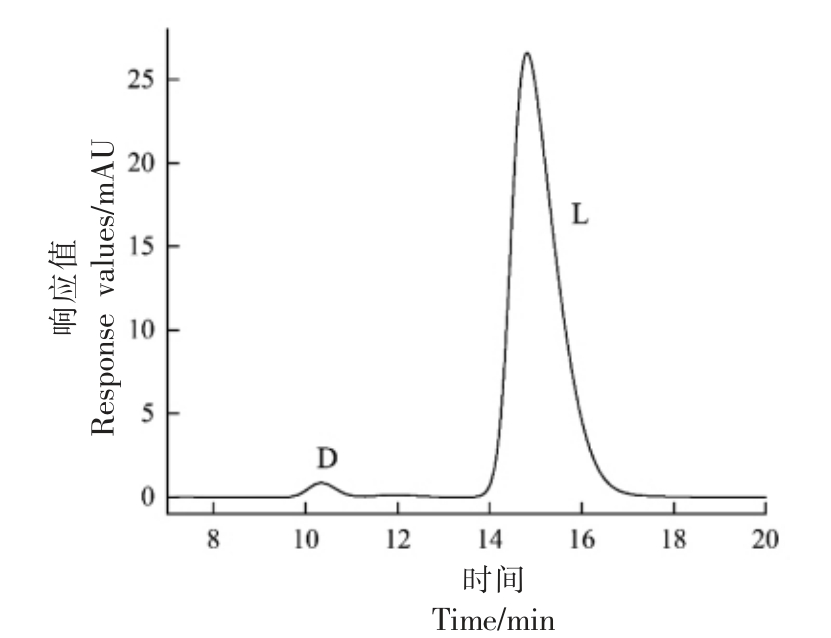
图4 L-5-MTHF-Ca 系统适用性检测谱图
Fig.4 Chromatogram for testing the applicability of L-5-MTHF-Ca system
3 结论
研究应用手性色谱法分离测定L-5-MTHFCa 的含量,测定方法使用高效液相色谱系统,色谱柱为CHIRALPAK HSA 手性色谱柱,检测波长为280 nm,流动相为磷酸二氢钠缓冲溶液∶乙腈=90∶10 的混合溶液,流速0.6 mL/min,进样量5 μL,柱温30 ℃。方法学验证结果表明,应用手性色谱法可以很好地分离D,L-5-MTHF-Ca 这一对手性物质,分离度达到3.24,并且在D 型物微量的情况下分离度也能达到3.0,L-5-MTHF-Ca 在0.016~0.100 mg/mL 质量浓度范围内线性关系良好,相关系数为0.9997,测得的检出限与定量限分别为3.11 μg/mL 和4.98 μg/mL,精密度测定的RSD 为0.38%,稳定性检测结果表明L-5-MTHF-Ca 会随时间缓慢降解需尽快进样测定,测得的加标平均回收率为103.71%。试验结果表明手性色谱法测定L-5-MTHF-Ca 含量的方法具有分离度高、精密度高、回收率高的优点,可以应用于各种食品与保健品中L-5-MTHF-Ca 的含量测定,也可以为其它手性物质的分离测定提供参考。
[1]SAINI R K,NILE S H,KEUM Y S.Folates:chemistry,analysis,occurrence,biofortification and bioavailability[J].Food Research International,2016,89(1): 1-13.
[2]GOUGH K R,READ A E,MCCARTHY C F,et al.Megaloblastic anaemia due to nutritional deficiency of folic acid[J].The Quarterly Journal of Medicine,1963,32(3): 243-256.
[3]ROSENBERG I H,MILLER J W.Nutritional factors in physical and cognitive functions of elderly people[J].The American Journal of Clinical Nutrition,1992,55(6): 1237-1243.
[4]RELTON C L,WILDING C S,LAFFLING A J,et al.Low erythrocyte folate status and polymorphic variation in folate-related genes are associated with risk of neural tube defect pregnancy[J].Molecular Genetics and Metabolism,2004,81(4): 273-281.
[5]MITCHELL L E,ADZICK N S,MELCHIONNE J,et al.Spina bifida[J].Lancet,2004,364(9448):1885-1895.
[6]MALDONADO E,MURILLO J,BARRIO C,et al.Occurrence of cleft-palate and alteration of Tgf-beta(3) expression and the mechanisms leading to palatal fusion in mice following dietary folic-acid deficiency[J].Cells Tissues Organs,2011,194(5):406-420.
[7]SAUBADE F,HEMERY Y M,ROCHETTE I,et al.Influence of fermentation and other processing steps on the folate content of a traditional African cereal-based fermented food[J].International Journal of Food Microbiology,2017,266(2): 79-86.
[8]王博伦,顾丰颖,刘子毅,等.食品中叶酸测定方法的研究进展[J].食品科学,2020,41(9): 294-300.
WANG B L,GU F Y,LIU Z Y,et al.Progress in the determination of folic acid in food[J].Food Science,2020,41(9): 294-300.
[9]PIETRZIK K,BAILEY L,SHANE B.Folic acid and L-5-methyltetrahydrofolate: Comparison of clinical pharmacokinetics and pharmacodynamics[J].Clin Pharmacokinet,2010,49(8): 535-548.
[10]PENTIEVA K,MCNULTY H,REICHERT R,et al.The short-term bioavailabilities of [6S]-5-methyltetrahydrofolate and folic acid are equivalent in men[J].The Journal of Nutrition,2004,134(3): 580-585.
[11]PRINZ-LANGENOHL R,LAMERS Y,MOSER R,et al.Effect of folic acid preload on the bioequivalence of [6S]-5-methyltetrahydrofolate and folic acid in healthy volunteers[J].Journal of Inherited Metabolic Disease,2003,26(1): 124.
[12]MELSE-BOONSTRA A,VERHOEF P,WEST C.Quantifying folate bioavailability: A critical appraisal of methods[J].Current Opinion in Clinical Nutrition& Metabolic Care,2004,7(5): 539-545.
[13]HOUGHTON L A,SHERWOOD K L,PAWLOSKY R,et al.[6S]-5-Methyltetrahydrofolate is at least as effective as folic acid in preventing a decline in blood folate concentrations during lactation[J].The American Journal of Clinical Nutrition,2006,83(4): 842-850.
[14]LAMERS Y,PRINZ-LANGENOHL R,BRÄMSWIG S,et al.Red blood cell folate concentrations increase more after supplementation with [6S]-5 -methyltetrahydrofolate than with folic acid in women of childbearing age [J].The American Journal of Clinical Nutrition,2006,84(1): 156-161.
[15]韩琳,许激杨,卞筱泓,等.重组甘氨酸脱羧酶基因工程菌生产L-5-甲基四氢叶酸[J].生产医学前沿,2013,22(20): 2379-2382.
HAN L,XU J Y,BIAN X H,et al.Production of L-5-methyltetrahydrofolate by recombinant glycine decarboxylase gene engineering strain[J].Frontier of Production Medicine,2013,22(20): 2379-2382.
[16]刘娅梅,卞筱泓,许激扬,等.基因工程法生产L-5-甲基四氢叶酸的研究[J].中国生化药物杂志,2012,33(3): 244-247.
LIU Y M,BIAN X H,XU J Y,et al.Production of l-5-methyltetrahydrofolate by genetic engineering[J].Chinese Journal of Biochemical Medicine,2012,33(3): 244-247.
[17]郭丽琼,吴厚玖.高效液相荧光检测法测定柑橘中5-甲基四氢叶酸的含量[J].饮料工业,2013,16(9): 30-34.
GUO L Q,WU H J.Determination of 5-methyltetrahydrofolate in Citrus by high performance liquid chromatography with fluorescence detection[J].Beverage Industry,2013,16(9): 30-34.
[18]王博伦,顾丰颖,张帆,等.玉米中5-甲基四氢叶酸提取方法的优化及高效液相色谱法定量分析[J].食品科学,2020,41(18): 196-202.
WANG B L,GU F Y,ZHANG F,et al.Optimization of extraction method of 5-methyltetrahydrofolate from corn and its quantitative analysis by HPLC[J].Food Science,2020,41(18): 196-202.
[19]彭絮,邹迎曙,杨宗兵,等.同位素稀释液相色谱串联质谱法测定人血清中5-甲基四氢叶酸[J].临床检验杂志,2018,36(3): 161-165.
PENG X,ZOU Y S,YANG Z B,et al.Determination of 5-methyltetrahydrofolate in human serum by isotope dilut ion liquid chromatography tandem mass spectrometry[J].Journal of Clinical Laboratory,2018,36(3): 161-165.
[20]GILL B D,INDYK H E.Separation of RRR-α-Tocopherol by chiral chromatography[J].Journal of AOAC INTERNATIONAL,2020,103(5): 1288-1292.
[21]江锋,赵振宇,聂叶,等.高效液相色谱法对白酒中的L-乳酸和D-乳酸的手性分离和测定[J].酿酒科技,2019,40(9): 93-97.
JIANG F,ZHAO Z Y,NIE Y,et al.Chiral separation and determination of L-lactic acid and Dlactic acid in Baijiu by high performance liquid chromatography[J].Brewing Technology,2019,40(9): 93-97.
[22]黄晓婉,王杉,揭琴丰,等.手性色谱法测定L-硒-甲基硒代半胱氨酸含量的研究[J].现代食品科技,2015,31(9): 309-313.
HUANG X W,WANG S,JIE Q F.Determination of L-Se-methylselenocysteine content by chiral chromatography[J].Modern Food Science and Technology,2015,31(9): 309-313.