分离乳清蛋白(Whey protein isolate,WPI)是将浓缩乳清蛋白经工艺处理得到的高纯度乳清蛋白[1],具有优良的乳化性、起泡性和凝胶性等,是公认的优质蛋白质之一[2]。 目前,WPI 不仅可以作为活性成分应用于食品中,增加营养价值,也可以作为载体用于生物活性物质的传递体系的构建[3],然而WPI 单独构建的传递体系化学稳定性通常较差,并存在生物活性物质易发生氧化降解等缺点[4],而蛋白-多糖复合物可以弥补以上缺陷[5]。 研究证实,蛋白-多糖的共价接枝可以改善单一蛋白的乳化性能和其水包油乳液的物理稳定性[6]。
沙蒿胶 (Artemisia sphaerocephala Krasch.gum,ASG) 是从沙蒿籽中提取的一种亲水性杂多糖,主要由葡萄糖、半乳糖和木糖等糖基以及糖醛酸组成,不溶于水、一般有机溶剂和热的稀酸、稀碱溶液[7-8]。 沙蒿胶具备天然乳化剂的潜力[9],常作为增稠剂、稳定剂和保水剂等,广泛应用于食品和医药等行业[10-11]。沙蒿胶与外源蛋白结合可以通过美拉德反应改变外源蛋白结构,进而改变其乳化性、溶解性、凝胶性和热稳定性等[12]。袁程程等[13]研究证实添加一定量的沙蒿胶可明显增强虾蛄肌原纤维蛋白凝胶的保水性和凝胶弹性; 沙蒿胶的黏度为明胶的1 800 倍,并具有优良的热稳定性[14]。
蛋白质通常作为乳化剂存在于乳液中,具有快速降低油-水界面的表面张力以及防止液滴絮凝和聚集的能力,而多糖主要作为稳定剂。蛋白质改性主要有物理、化学和生物酶法,本文运用的糖基化法属于化学改性[15]。 蛋白质的糖基化改性是蛋白质分子中氨基酸侧链的自由氨基与糖分子还原末端的羰基之间发生的羰氨反应[16],以共价键结合的方式将糖类物质与蛋白质分子上的ε-或α-氨基连接,反应后所得的糖蛋白同时具备蛋白质大分子特性和糖类物质的亲水性,其乳化能力、热稳定性和凝胶性等功能特性均相对提高[17]。 有研究表明,利用糖和蛋白质通过糖基化交联,可以改善蛋白质部分功能特性[18-19]。 An 等[20]发现卵清蛋白与羧甲基纤维素经糖基化反应,其乳化特性明显增强。
糖基化修饰可实现蛋白质改性,而利用沙蒿胶与蛋白质进行共价复合的研究鲜见报道。 本试验利用分离乳清蛋白和沙蒿胶混合,通过美拉德反应途径制备糖基化产物,测定其在不同条件下的乳化活性和乳化稳定性。 采用单因素实验及响应面试验确定WPI-ASG 共价复合物的最佳工艺参数,并分析比较分离乳清蛋白和沙蒿胶在反应前、后分子结构及功能特性方面的差异,以期为分离乳清蛋白的乳化性能提升和蛋白-多糖共价复合物的制备,物理稳定性的提高,应用蛋白或糖类的开发提供一定参考。
1 材料与仪器
1.1 主要材料与试剂
分离乳清蛋白,郑州康源化工产品有限公司;野生沙蒿籽,农户收购;菜籽油,当地超市;SDSPAGE 试剂及耗材,Biorad 公司; 其它试剂均为分析纯级。
1.2 主要仪器与设备
DXR 真空冷冻干燥机,美国赛默飞公司;T6紫外分光光度计,北京普析仪器有限公司;微型旋涡混合仪、DSC 800003061404 差示扫描量热仪(DSC),美国Perkin Elmer; 傅里叶红外光谱仪(FTIR-ATR)、Mastersizer30000303081002全自动激光粒度分析仪,英国Malvern;970CRT 荧光分光光度计,上海双旭电子有限公司;L-8900 型全自动氨基酸自动分析仪、Ultra-Turrax T25 超高速电子搅拌机,德国IKA 公司。
2 试验方法
2.1 样品的准备
分别准备分离乳清蛋白 (WPI),沙蒿胶(ASG),蛋白和胶混合物(MIX)及反应产物(WPI-ASG),MIX 和WPI-ASG 在相同温度(75,80,85,90,95 ℃) 和时间(0,30,60,90,120,150,180,210,240 min)条件下处理,主要为蛋白和胶共价复合,产物裂解以及类黑精等物质生成3 个反应阶段。
2.1.1 沙蒿胶的制备 沙蒿籽以1∶100 的体积比在蒸馏水中溶解,用5%盐酸调节溶液pH 值至2.0,将溶液在80 ℃水浴1.5 h,高速搅打至胶质与种皮分离,4 000 r/min 离心15 min 后,取沉淀物进行真空冷冻干燥,即得到沙蒿胶。
2.1.2 单因素实验设计 将分离乳清蛋白与沙蒿胶以体积比5∶1 混合,质量分数为5%,依次确定不同的反应时间(0,30,60,90,120,150,180,210,240 min),反应温度(75,80,85,90,95 ℃),反应初始pH 值(9.5,10,10.5,11,11.5),在磁力搅拌器中进行美拉德反应,对其中间产物、褐变值、乳化活性进行测定,并按公式(1)计算其乳化稳定性。
式中,ES——乳状液乳化稳定性(min);C0,C10——乳状液0 min 和10 min 时,500 nm 波长处的吸光值。
2.1.3 WPI-ASG 优化试验设计 根据单因素实验结果,为确定分离乳清蛋白改性的最佳工艺条件,运用Box-Benhnken 中心组合试验设计原理,选取时间(A)、温度(B)、反应初始pH 值(C)为因素,以乳化活性和乳化稳定性为响应指标建立模型,试验因素及水平见表1。
表1 Box-Benhnken 试验因素及水平
Table 1 Box-Benhnken test factors and level
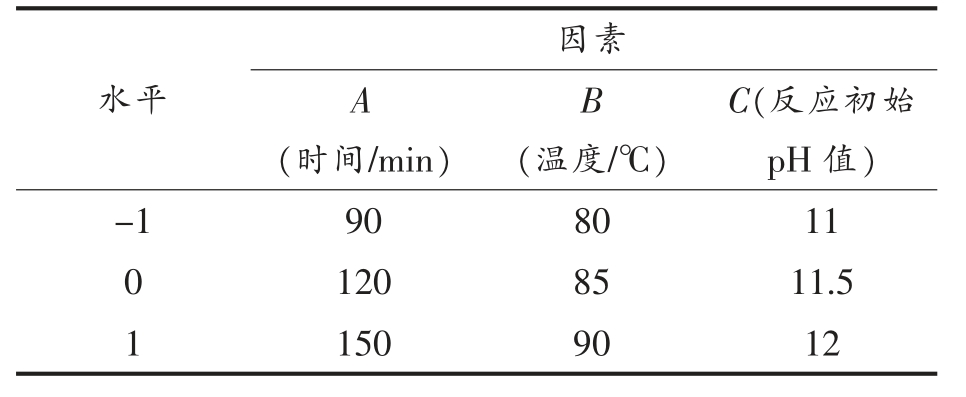
水平因素A(时间/min)B(温度/℃)C(反应初始pH 值)-1 90 80 11 0 120 85 11.5 1 150 90 12
2.2 糖基化产物的鉴定
2.2.1 糖基化不同反应阶段指标测定 将样液与蒸馏水以体积比1∶9 混合,加入体积分数10%的菜籽油,10 000 r/min 均质2 min 制得乳状液,均质后分别在0 min 和10 min 吸取乳状液底部50 μL,与5 mL SDS 溶液(1 g/L)混匀,紫外-可见分光光度计测定294,420 nm 以及500 nm 波长处的吸光值,分别表示为中间产物含量、褐变指数和乳状液乳化活性[21-22],重复测定3 次。按公式(1)计算乳状液乳化稳定性。
2.2.2 交联产物氨基酸组成的测定 样品氨基酸组成采用L-8900 氨基酸自动分析仪测定,测定前先将样品进行预处理: 取样品约5 mg 于试管中,与10 mL 盐酸溶液(6 mol/L)混匀,于110 ℃水解24 h 后,冷却至室温,用蒸馏水稀释溶液至50 mL。 取1 mL 稀释液进行冷冻干燥,将所得干粉末在5 mL 蒸馏水中溶解,再次冷冻干燥,重复3 次,该过程以除去盐酸[23]。
2.3 红外光谱(FTIR-ATR)分析
将2 mg 冷冻干燥样品粉末与200 mg 溴化钾混合并研磨均匀,压片测定FTIR。 测量样品前记录背景,以空气的吸收光谱为准,并在样品光谱中自动减去,测样期间用干燥N2 不断淋洗测量室,以防止水蒸汽光谱吸收干扰。 在4 cm-1 分辨率,4 000~450 cm-1 频率范围内,测定吸收光谱,扫描16 次[24]。
2.4 凝胶电泳(SDS-PAGE)分析
准确称取冻干的各样品粉末100 mg,与500 μL 氯化钠-磷酸缓冲液(50 mmol/L,pH 7.0)充分混匀,3 000 r/min 离心10 min 后,取上清液保存于冷藏条件下。 取上清液200 μL,沸水浴3 min,样品上样量15 μL,浓缩胶质量分数5%,分离胶质量分数12%。 调节样品浓缩胶阶段电压为60 V,保持该电压电泳40 min,分离胶阶段调至电压为120 V,至溴酚蓝指示剂到达分离胶底部时停止电泳。 浸泡染色液中染色2 h 后,于50%乙酸-甲醇溶液中脱色12 h,至蛋白质条带清晰,运用凝胶成像系统拍照并分析结果[25]。
2.5 乳液粒径测定
将质量分数为0.5%的各样品粉末充分溶解于纯水中,缓慢滴入质量分数为5%菜籽油于样品溶液中,在15 000 r/min 转速下,利用超高速电子搅拌机冰浴搅拌3 min,制备乳液。 利用Mastersizer 激光粒度仪在室温条件下测量乳液的粒径,用平均粒径(nm)表示。
2.6 荧光光谱
采用荧光光谱测定稀释50 倍样品的荧光强度。 设置275 nm 为激发波长,入射狭缝宽为10 nm,灵敏度为3,中速荧光光谱扫描,波长为200~650 nm[26]。
2.7 微观结构观察
调节扫描电镜(SEM) 加速电压为20 kV,在200 倍,20 μm 放大倍数下,观察样品粉末微观结构。
2.8 差示扫描热量分析
参考文献[27]的方法并略作改进,采用差示扫描热量仪(DSC)测定样品的热学特性。称取5~10 mg 样品粉末,分别放入铝盒中并加盖密封,铝盖中央扎孔,以空盒作为空白对照。 在30 mL/min 氮气流速中,以5 ℃/min 的升温速率,在30~250 ℃范围内升温,分析样品变性温度及热焓值变化。
2.9 统计学分析
试验重复3 次,试验数据取均值,采用Design Expert 11、Origin 9.8 以及SPSS 26 软件进行试验作图和数据分析。
3 结果与分析
3.1 WPI-ASG 的效果
3.1.1 反应时间 如图1a 所示,随着反应时间的延长,pH 值的变化可能抑制了反应,使部分产物发生降解,当反应时间为0~150 min 时,糖基化反应中间产物含量呈增加趋势,当反应时间为150~240 min 时,糖基化反应中间产物含量呈降低趋势;溶液的褐变指数显著性增大(P<0.05),之后有所下降并逐渐趋于稳定;乳化性逐渐升高,在120 min 左右时达到最大。 同时,图1b 表明乳化稳定性在120 min 左右时达到最大,可能由于分离乳清蛋白与沙蒿胶中的糖或糖降解产物反应发生了交联,使得溶液的乳化性逐渐提高。随着反应时间的延长,蛋白质分子的乳化性能缓慢下降,一方面是由于蛋白质分子中的Lys 被破坏,另一方面,蛋白质间的相互作用增加,导致溶解度下降[28],从而引起乳化性的降低,故确定最佳反应时间为120 min。
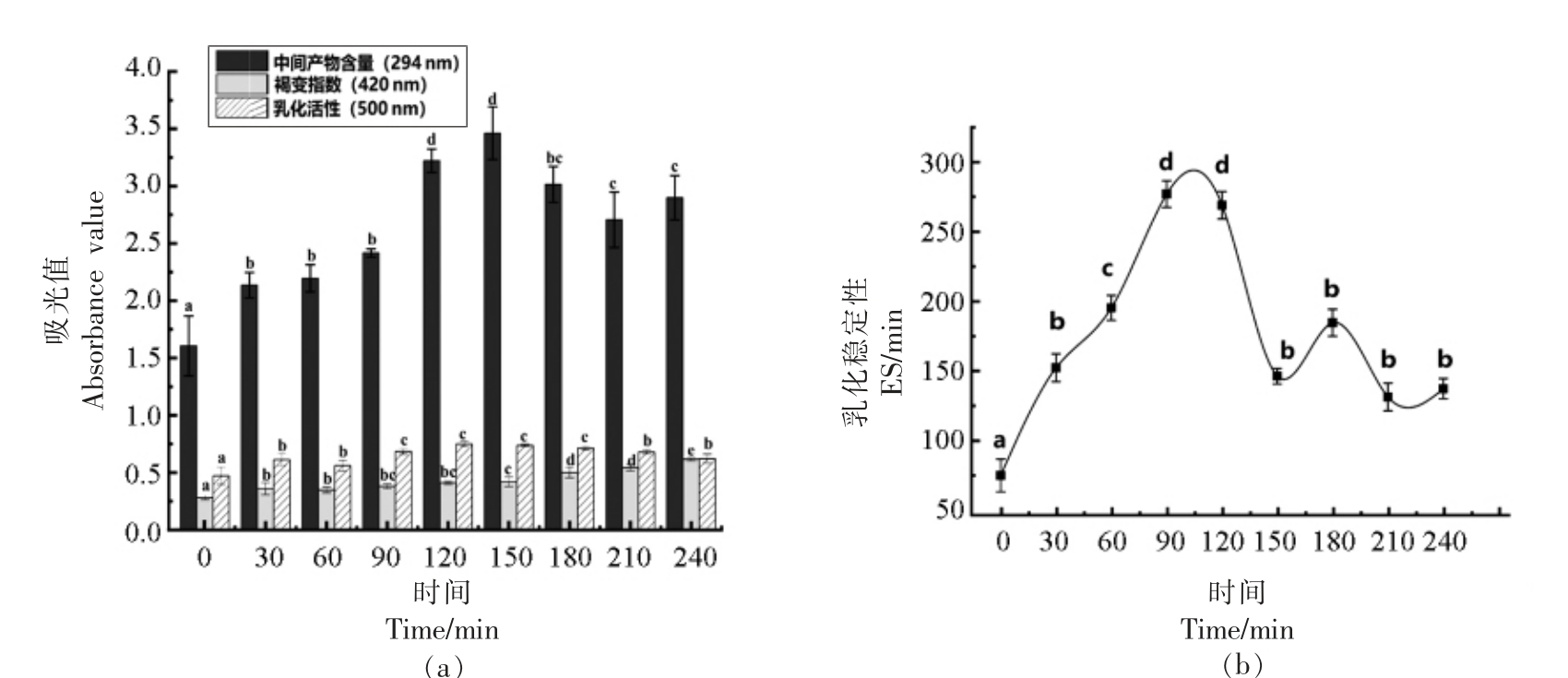
图1 时间对美拉德反应各指标的影响
Fig.1 The effect of time on each index of Maillard reaction
注:不同小写字母表示差异显著(P<0.05)。
3.1.2 反应温度 如图2a 所示,随着时间的延长,糖基化反应中间产物含量和褐变指数逐渐增加;在90~95 ℃时,产物的乳化能力最高,由于温度越高,美拉德反应速度越快,反应程度也越大,容易生成交联的大分子产物。 如图2b 所示,乳状液乳化稳定性在75~90 ℃,呈先增加后降低的趋势,后随着温度的升高,乳化稳定性上升,而水浴温度超过95 ℃后,溶液极易沸腾,严重影响设备的稳定性,并且难以继续提升温度,导致成本消耗增加,故确定反应温度90 ℃为最适条件。
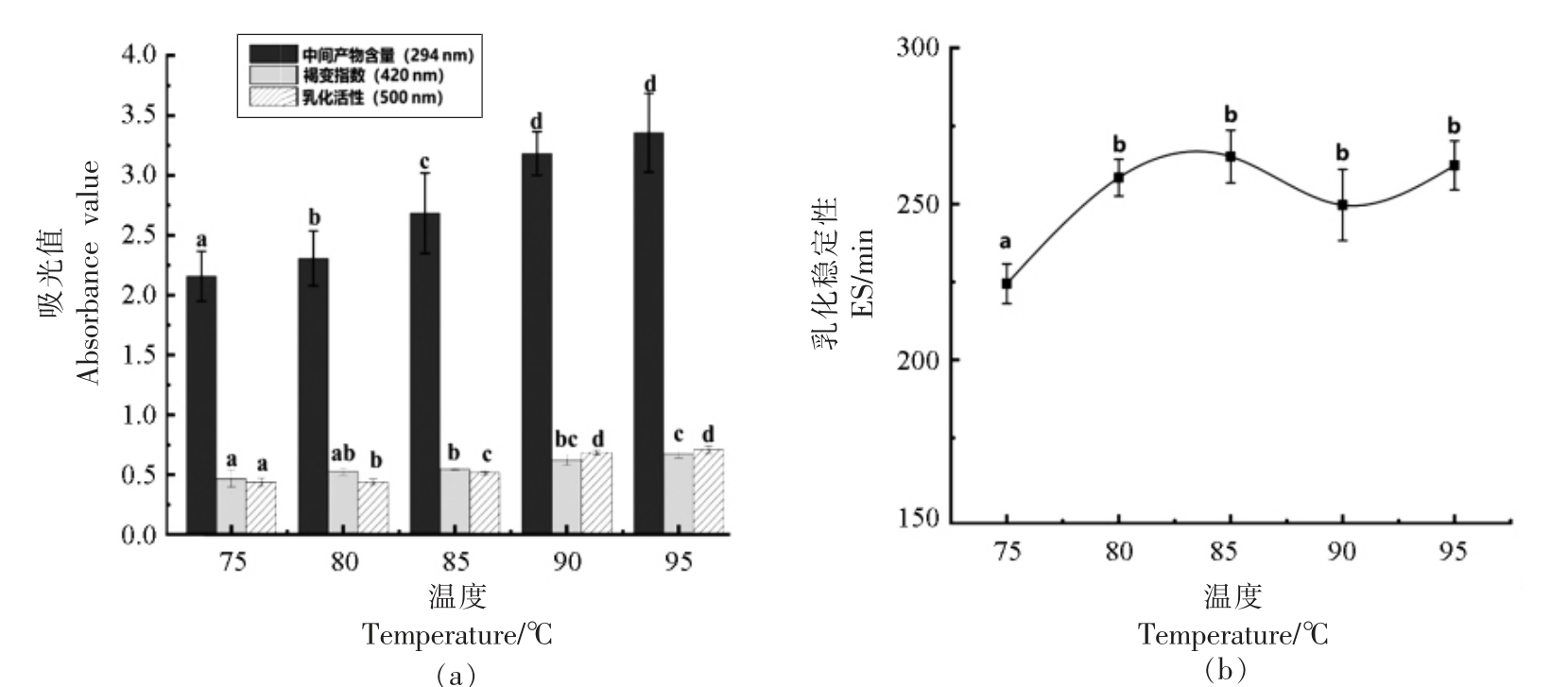
图2 温度对美拉德反应各指标的影响
Fig.2 Effect of temperature on each index of Maillard reaction
注:不同小写字母表示差异显著(P<0.05)。
3.1.3 反应初始pH 如图3a 所示,糖基化反应中间产物含量和褐变指数随起始pH 值的增大呈上升趋势,pH 值为11 时,乳化能力最强,当pH 值至11.5 时,乳化能力有所下降;如图3b 所示,pH值在9.5~10.5 时,乳化稳定性呈上升趋势,pH 值在10.5~11.5 时,乳化稳定性呈下降趋势。 由于氨基酸在碱性介质中呈阴离子,反应活性较强,易发生褐变,因此,一般在偏碱性环境下有利于美拉德反应的进行,而在偏酸性环境中美拉德反应被抑制,反应速率降低[29]。 此外,较高的pH 值离WPI的等电点较远,会引起较强的分子内静电排斥力,蛋白质逐渐变性,导致变性蛋白所含氨基酸残基暴露和更高的溶解度,增强了与油相之间的作用,有助于改善接枝反应,使得蛋白乳化活性更好[30-31]。因此,选择pH 11 为最适条件。
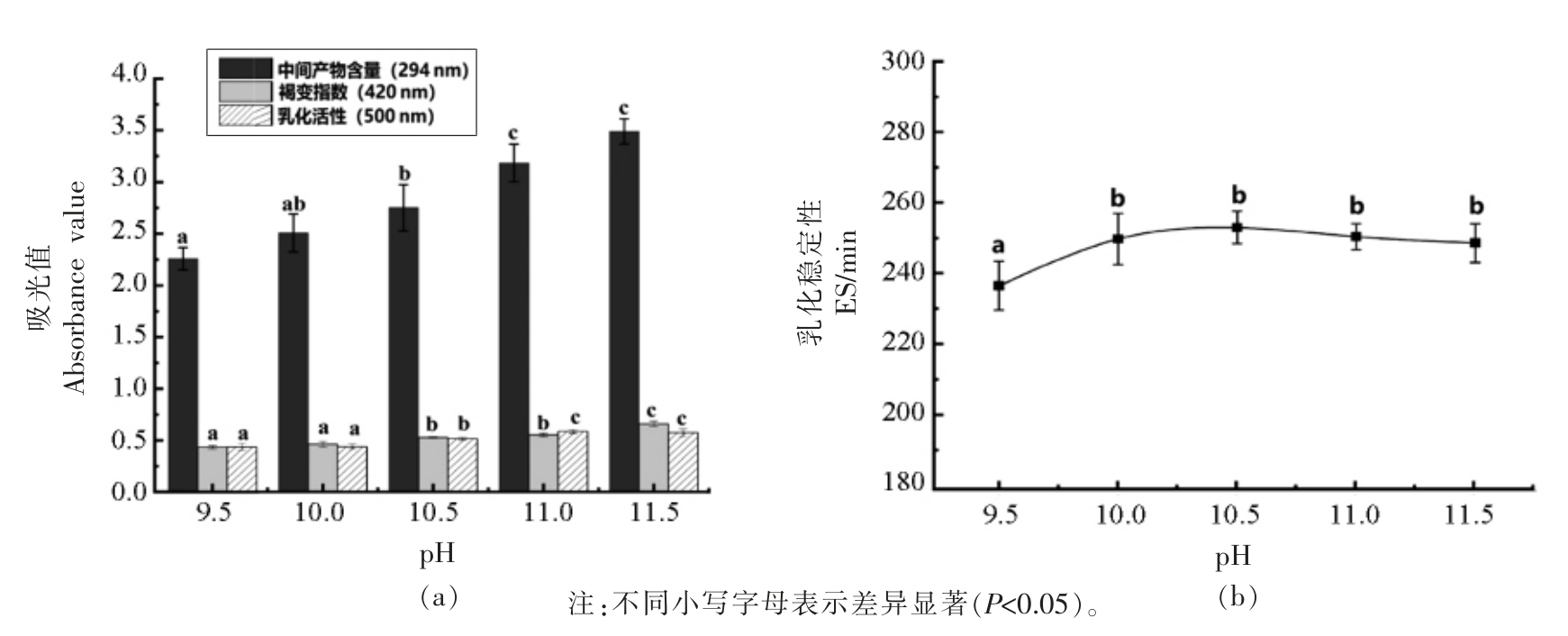
图3 pH 值对美拉德反应各指标的影响
Fig.3 The effect of pH value on each index of Maillard reaction
3.1.4 WPI-ASG 工艺优化 在单因素实验基础上,采用Box-Behnken 方法,确定自变量为时间(A)、温度(B)、初始pH 值(C),响应值为乳化活性(Y1)和乳化稳定性(Y2),设计三因素三水平响应面试验,设计方案及结果见表2。
表2 Box-Behnken 试验设计及结果
Table 2 Box-Behnken test design and result
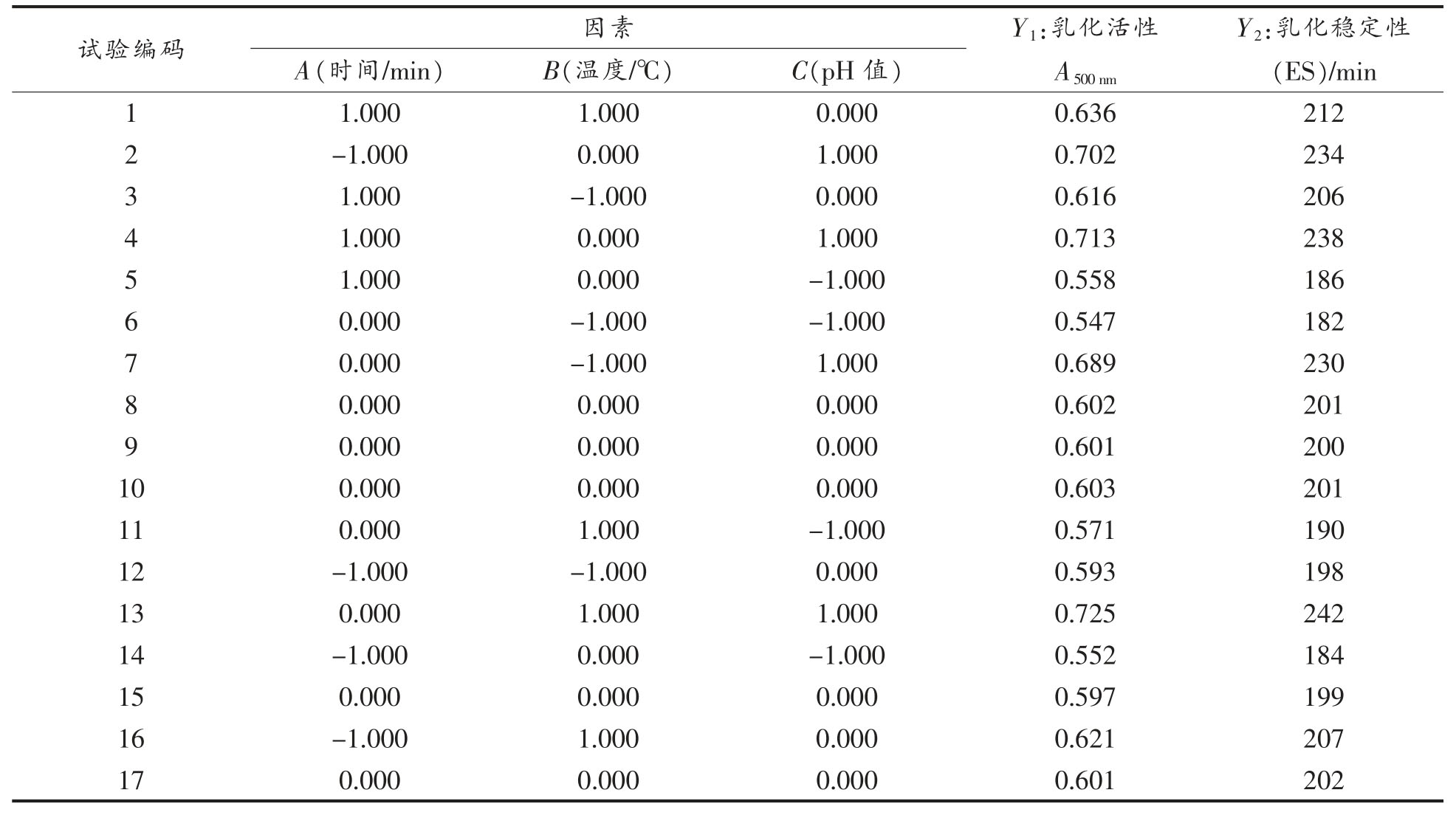
试验编码 因素 Y1:乳化活性A500 nm Y2:乳化稳定性(ES)/min A(时间/min) B(温度/℃) C(pH 值)1 1.000 1.000 0.000 0.636 212 2-1.000 0.000 1.000 0.702 234 3 1.000 -1.000 0.000 0.616 206 4 1.000 0.000 1.000 0.713 238 5 1.000 0.000 -1.000 0.558 186 6 0.000 -1.000 -1.000 0.547 182 7 0.000 -1.000 1.000 0.689 230 8 0.000 0.000 0.000 0.602 201 9 0.000 0.000 0.000 0.601 200 10 0.000 0.000 0.000 0.603 201 11 0.000 1.000 -1.000 0.571 190 12 -1.000 -1.000 0.000 0.593 198 13 0.000 1.000 1.000 0.725 242 14 -1.000 0.000 -1.000 0.552 184 15 0.000 0.000 0.000 0.597 199 16 -1.000 1.000 0.000 0.621 207 17 0.000 0.000 0.000 0.601 202
将试验所得数据进行多元回归拟合,得到乳化活性(Y1)和乳化稳定性(Y2)对时间(A)、温度(B)和反应初始pH 值的回归方程:
Y1=0.6008+0.0069A+0.0135B+0.0751C-0.0020AB +0.0013AC +0.0030BC +0.0070A2 +0.0087B2+0.0235C2
Y2=200.60+2.37A+4.37B+25.25C-0.75AB+0.5AC+1BC+2.33A2+2.83B2+7.57C2
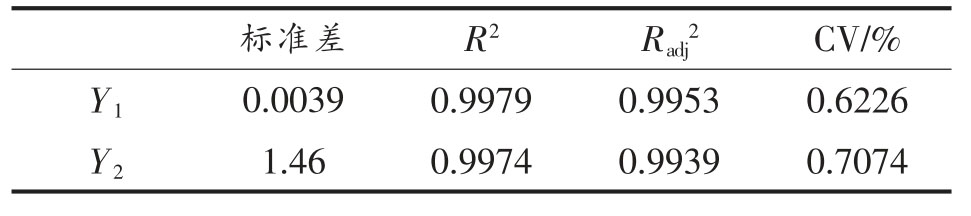
由表3 和表4 可知,回归方程因变量与自变量线性关系明显,该模型回归显著并与试验拟合良好,失拟项不显著(P>0.05)。
表3 回归方程方差分析
Table 3 Analysis variance of regression equation
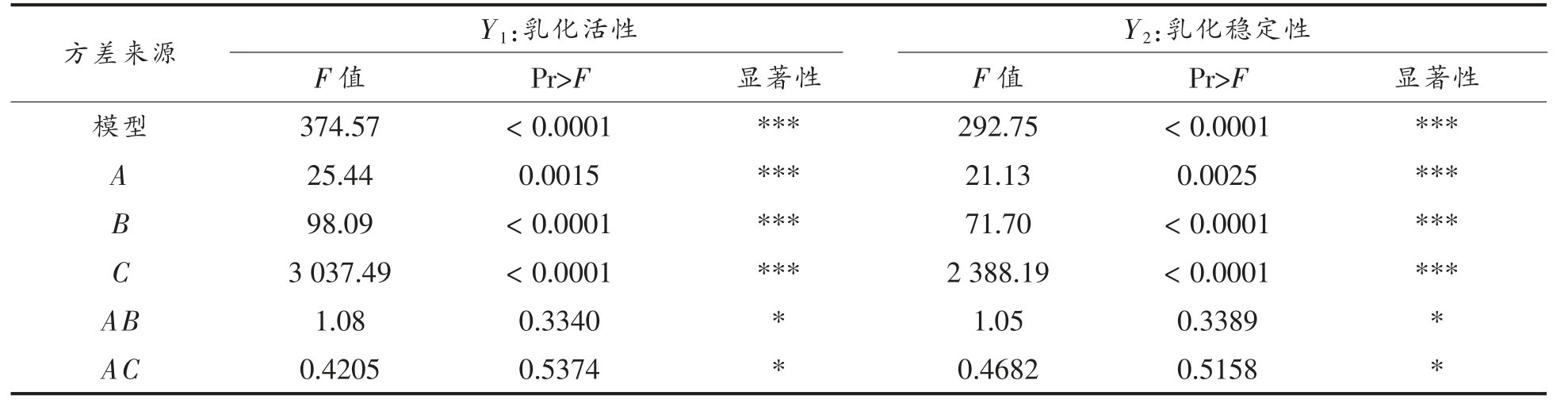
方差来源 Y1:乳化活性 Y2:乳化稳定性F 值 Pr>F 显著性 F 值 Pr>F 显著性模型 374.57 < 0.0001 *** 292.75 < 0.0001 ***A 25.44 0.0015 *** 21.13 0.0025 ***B 98.09 < 0.0001 *** 71.70 < 0.0001 ***C 3 037.49 < 0.0001 *** 2 388.19 < 0.0001 ***AB 1.08 0.3340 * 1.05 0.3389 *AC 0.4205 0.5374 * 0.4682 0.5158 *
(续表3)
注:*.不显著(P>0.05),**.差异显著(P<0.05),***.差异极显著(P<0.01)。
?
表4 回归方程拟合度分析
Table 4 Analysis fitting degree of the regression equation
?
因素A、B、C 对响应值Y1 和Y2 两两交互作用的响应面图如图4 所示,响应曲面均为开口向下的凸型曲面,说明响应值Y1 和Y2 在因素A、B、C所设计的范围内均存在最大值,等高线均趋向于圆形,响应值Y1 和Y2 随着另一因素的变化趋势相同,表明两两因素之间的交互作用均不显著,这与方差分析的结果一致。响应曲面坡度陡峭、等高线密集成椭圆形表示两因素交互影响大,而坡度平缓、等高线呈圆形则与之相反[32]。 结合表中交互项值的分析结果表明,变量A、B、C 对响应值Y1和Y2 均有较大影响[33]。

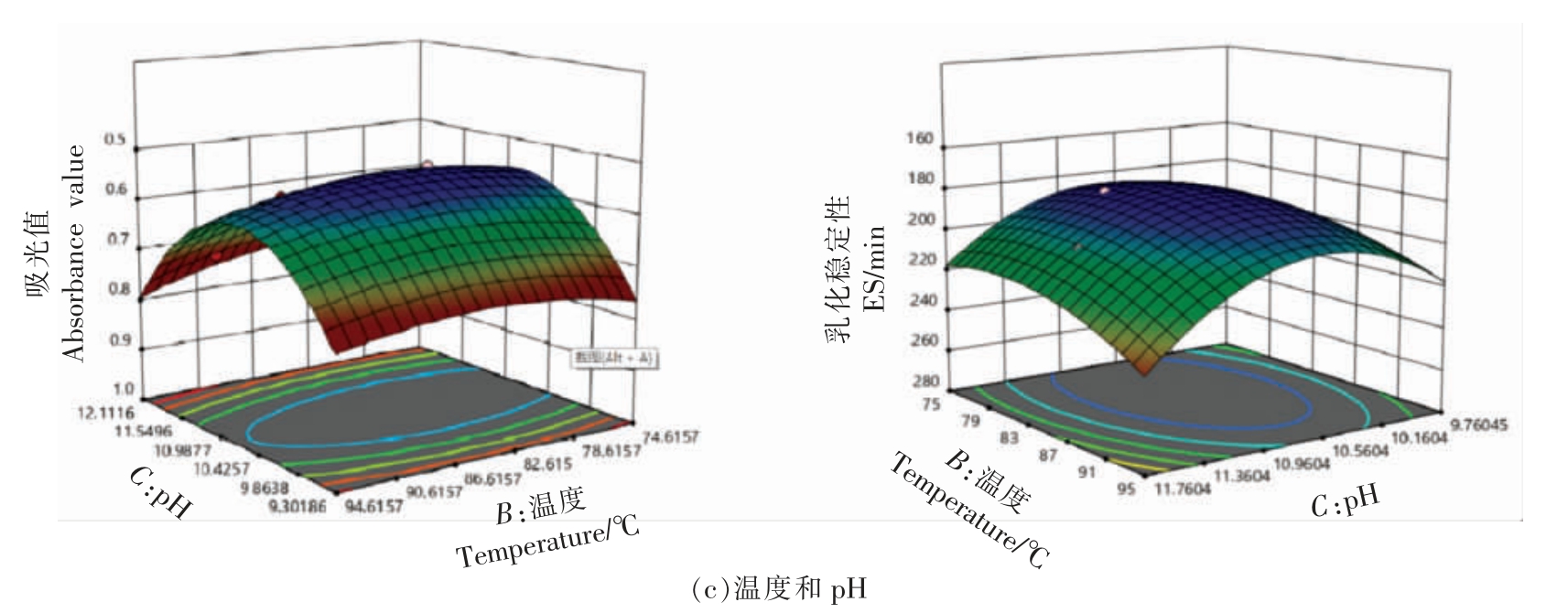
图4 交互项对乳化活性和乳化稳定性的影响
Fig.4 Effects of interaction terms on the emulsifying activity and the emulsification stability
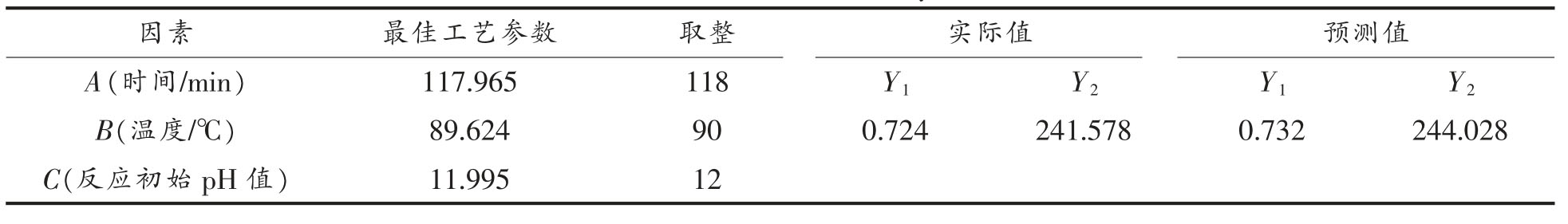
按照最佳工艺参数取整验证响应面法所得结果的可靠性,如表5 所示,预测值与实际值之间拟合良好,证明了模型的有效性。
表5 美拉德产物乳化活性和乳化稳定性试验验证
Table 5 Verification of emulsifying activity and emulsifying stability of Maillard products
?
3.2 WPI-ASG 接枝物氨基酸组成的测定
接枝反应是糖的还原羰基和蛋白质的氨基之间作用,在反应过程中游离氨基酸不断变化,然而只有部分氨基酸参与反应,主要是赖氨酸(Lys)残留物ε-氨基和精氨酸(Arg)胍基,其它氨基酸反应程度较低[34]。 因此可以通过氨基酸含量变化来判断。 如表6 所示,WPI-ASG 中Lys 和Asg 含量均低于单一蛋白WPI,MIX 中Lys 和Arg 分别减少了11.9%和4.4%,WPI-ASG 中Lys 和Arg 分别减少了23%和31.1%。 表明Lys 和Asg 很可能是蛋白质中参与接枝反应的游离氨基酸。因此,这两种氨基酸含量可以判断美拉德反应程度,在MIX和WPI-ASG 中均发生了不同程度的美拉德反应。
表6 各样品中赖氨酸和精氨酸含量
Table 6 Lysine and arginine content in each sample

?
3.3 红外光谱(FTIR-ATR)分析
FTIR-AT 通过分子振动引起辐射吸收,提供大分子的官能团和化学键信息,因此可用于研究WPI-ASG 的分子结构和其相互作用。 如图5 所示,与WPI 相比,MIX 和WPI-ASG 分别在波长1 000~1 750 cm-1 和3 200~3 700 cm-1 范围内均出现明显吸收峰,这可能是肽链中羟基和C-O-C 糖苷键数量增加并伸缩振动产生,表明ASG 以共价键与WPI 形成复合物[35]。WPI-ASG 在波长2 800~3 000 cm-1 范围内,吸收峰强度明显减弱,这可能是由于多糖和蛋白质之间互相作用导致亚甲基振动减弱,进一步说明ASG 的共价接枝使WPI 的功能特性因其结构变化得到改善。
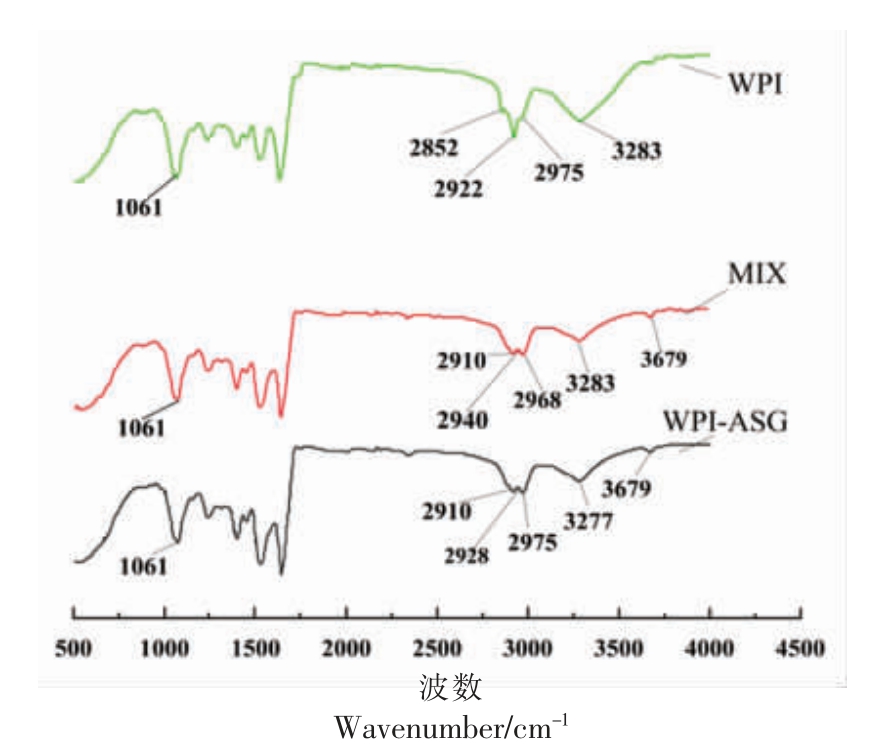
图5 各样品红外光谱谱图
Fig.5 Infrared spectrum of each sample
3.4 十二烷基硫酸钠-聚丙乙烯酰胺凝胶电泳(SDS-PAGE)分析
采用SDS-PAGE 分析ASG 共价接枝对WPI分子质量的影响,结果如图6 所示。 可以看出,泳道2 大约在13.8,18.0,66.0 ku 处显示为α-乳清蛋白、β-乳球蛋白和牛血清白蛋白3 种清晰的蛋白质条带[36],而4 泳道上面部分相比2、3 泳道没有相应条带聚集,说明有糖蛋白产生。 与WPI 相比,接枝物的条带强度均有所下降,并在凝胶顶部周围出现了分子质量更高的新条带,然而接枝物的条带均没有高出WPI 条带太多,说明ASG 的接枝使WPI 的分子质量增大,并且每个蛋白质分子共价接连的ASG 数量有限。 电泳过程中所用的SDS 或β-巯基乙醇没有将这些高分子质量的接枝物分解,说明接枝物是由WPI 和ASG 通过共价键结合形成[37]。
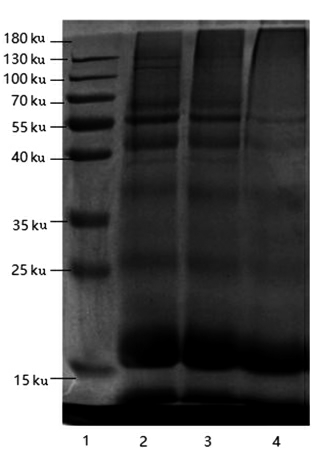
图6 处理后各样品电泳图像
Fig.6 Electrophoretic image of each sample after treatment
注: 电泳图像中泳道1 为Marker,泳道2 为WPI,泳道3 为MIX,泳道4 为WPI-ASG。
3.5 WPI-ASG 乳状液粒径分析
如图7 所示,WPI 和WPI-ASG 乳状液粒径分布相似,均呈单峰分布并在0.3~0.5 μm 之间,表明乳液粒径具有良好的均一性,WPI-ASG 的共价接枝可以提高WPI 乳状液的乳化性。 主要是由于接枝物WPI-ASG 能够在油-水界面上形成较厚的界面膜,提高WPI 乳化性能;并在液滴间产生排斥作用以阻止液滴聚集,从而提高乳状液稳定性[38]。Yang 等[39]发现通过美拉德反应途径制备的蛋白-大豆多糖共价接枝物,其粒径变化有效改善了乳状液稳定性,这与本文的研究结果相吻合。
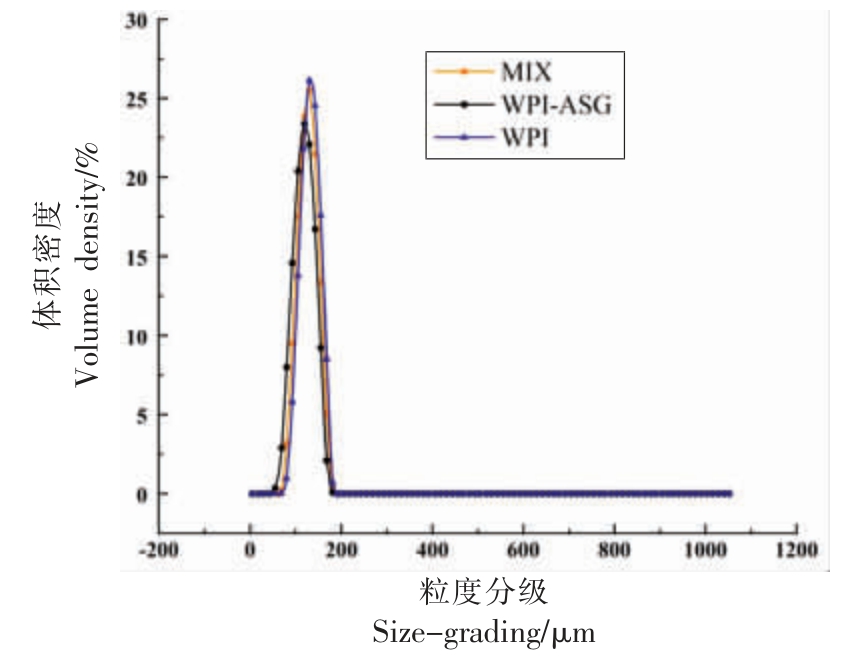
图7 处理后各样品乳液粒径分布情况
Fig.7 Particle size distribution of each sample emulsion after treatment
3.6 内源荧光光谱分析
通过荧光光谱法可以获得蛋白质三级结构的信息,该方法被认为是一种有效提供蛋白质周围微环境结构信息变化的技术手段。 色氨酸和酪氨酸是蛋白质内源荧光的主要来源,均可在280 nm激发波长下发射荧光,且色氨酸残基的最大发射波长在340 nm 左右[40]。 如图8 所示,各样品最大发射波长均在340 nm 左右,表明WPI-ASG 美拉德反应产物荧光特性的主要来源是色氨酸残基。ASG 的共价接枝导致WPI 荧光强度明显降低,荧光强度的降低是由于部分色氨酸参与了接枝反应,也可能是由于蛋白和多糖的相互作用,包括复合物的形成、 分子的重排和能量的转移等对其荧光强度的淬灭作用[41-42]。多糖链的屏蔽作用也能引起荧光强度的降低,Jimenez 等[43]在葡聚糖β-乳球蛋白糖基化的研究中也得到了类似的结果。 本文中荧光强度发生淬灭可能是由于沙蒿多糖的苯环与分离乳清蛋白中的酪氨酸基团共价复合,使得溶剂中酪氨酸残基暴露减少导致。
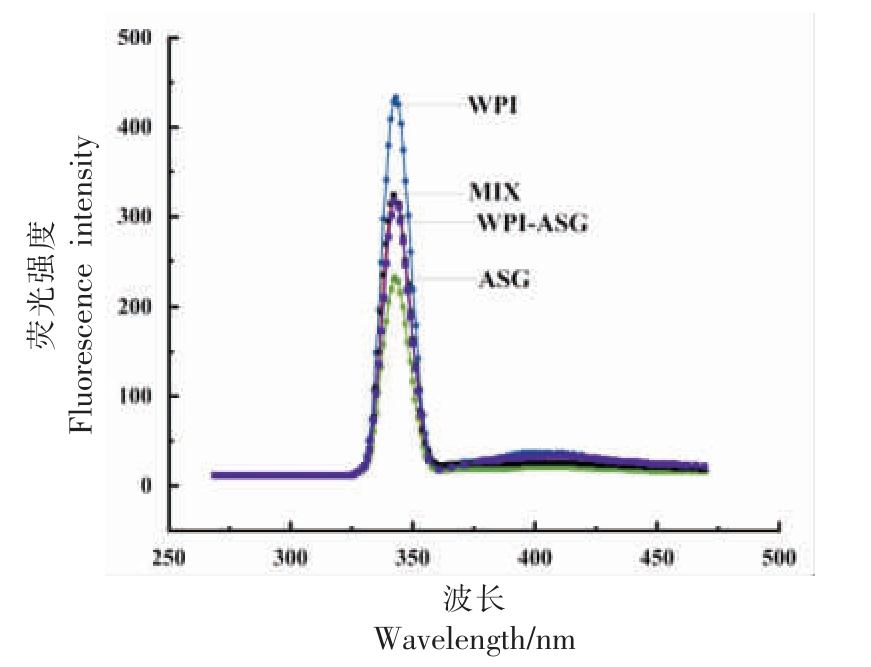
图8 各样品的荧光光谱图
Fig.8 Fluorescence spectrogram of each sample
3.7 扫描电镜分析
运用扫描电镜(SEM)在200 倍下拍摄各样品的电镜图,如图9 所示,沙蒿胶在200 倍电子显微下,分子结构呈落叶状散布,大小不均匀,表面平整; 分离乳清蛋白结构呈光滑球状,大小相对均匀,结构疏松;MIX 结构变小呈碎玻璃状,表面平整,界限分明;WPI-ASG 结构相比MIX 更小,呈紧密的碎块状散落,阐述了美拉德反应前、后不同的微观结构变化。 这一变化可能是因为蛋白与沙蒿多糖共价结合,致使分子间聚集减少,也有可能是因为在加热条件下,蛋白质分子结构发生了改变[44]。

图9 各样品在200 倍-20 μm 条件下的微观结构
Fig.9 The microstructure of each sample under the condition of 200 times -20 μm
注:标尺为20 μm,放大倍数为200×。
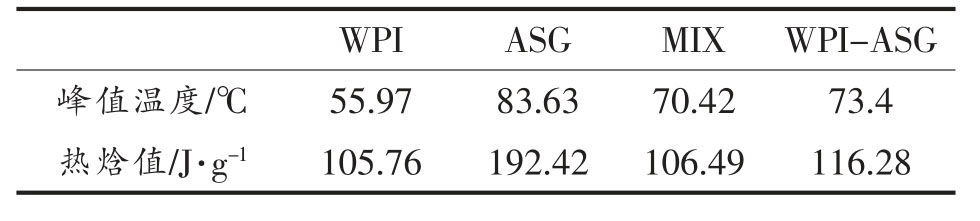
3.8 差示热量DSC 分析
如表7 所示,与分离乳清蛋白相比,MIX 和WPI-ASG 的峰值温度分别上升了14.45,17.43℃,热焓值分别上升了0.73,10.52 J/g,表明分离乳清蛋白引入糖基后其热稳定性升高。 与沙蒿胶相比,其复合物热变性峰值温度分别下降了13.21,10.23 ℃,热焓值分别下降了85.93,76.14 J/g,表明沙蒿胶自身的热稳定性较好,与蛋白共价复合后热稳定性下降。 其复合物和接枝产物与沙蒿胶和蛋白之间差异显著(P<0.05),而复合物和接枝物之间差异不显著 (P>0.05)。 其原因可能是WPIASG 在复合接枝过程中,蛋白质内氢键断裂,导致分子结构展开,这个过程发生时会吸收能量,使得MIX 和WPI-ASG 峰值温度升高,此过程称之为热变性。 由于热变性温度和热焓值可以反映蛋白质的热稳定性,以及蛋白质分子的疏水性和亲水性[45],因此,在反应过程中WPI 结构受到影响而发生变化。
表7 各样品的峰值温度和热焓值
Table 7 Peak temperature and enthalpy of each sample
?
4 结论
本试验选用沙蒿胶对分离乳清蛋白进行糖基化改性,在单因素实验基础上,采用响应面试验优化分离乳清蛋白改性工艺,得到最佳工艺参数为:时间118 min,温度90 ℃,反应初始pH 12,在该条件下WPI-ASG 的乳化活性为0.732,乳化稳定性为244.028,试验值与预测值接近,表明利用响应面法优化工艺所得参数可靠,具备实用价值。
用优化的工艺参数制备糖基化产物WPIASG,比较WPI、ASG 和WPI-ASG 的结构及功能性质,结果显示:其微观结构差异显著,粒径分布相似,相比单一蛋白,赖氨酸和精氨酸含量下降,荧光强度降低;FTIR-ART 光谱图显示,对应吸收峰有明显的减弱或增强,由SDS-PAGE 图谱显示蛋白质与多糖发生了反应,WPI-ASG 泳道强度下降且上面部分没有相应条带聚集,并形成蛋白质-多糖共聚物;由DSC 测得改性后的分离乳清蛋白峰值温度和热焓值均高于单一蛋白而低于沙蒿胶。结果表明,分离乳清蛋白与沙蒿多糖发生了接枝反应,明确了蛋白结构变化和特性改善之间的关系。
[1] SANTOS M J,TEIXEIRA J A,RO DRIGUES L R.Fractionation of the major whey proteins and isolation of β-Lactoglobulin variants by anion exchange chromatography[J].Separation and Purification Technology,2012,90: 133-139.
[2] DE CASTRO R J S,DOMINGUES M A F,OHARA A,et al.Whey protein as a key component in food systems: Physicochemical properties,production technologies and applications[J].Food Structure-Netheriands,2017,14: 17-29.
[3] RAMOS O L,PEREIRA R N,MARTINS A,et al.Design of whey protein nanostructures for incorporation and release of nutraceutical compounds in food[J].Critical Reviews in Food Science and Nutrition,2017,57(7): 1377-1393.
[4] 顾璐萍.儿茶素-蛋清蛋白抗氧化性载体材料的制备、表征及其应用[D].无锡: 江南大学,2018.
GU L P.Preparation,characterization and application of catechin-egg white protein antioxidant carrier materials[D].Wuxi: Jiangnan University,2018.
[5] 陈卫军,刘东红,李云成,等.制备方法对乳清分离蛋白-绿原酸共价接枝物结构和功能性质的影响[J].食品科学,2021,42(13): 43-50.
CHEN W J,LIU D H,LI Y C,et al.Effect of preparation method on covalent graft structure and functional properties of whey isolated protein-chlorogenic acid[J].Food Science,2021,42(13): 43-50.
[6] 刘郁琪,覃小丽,阚建全,等.酪蛋白与可溶性大豆多糖的酶促糖基化产物制备及其性能分析[J].食品科学,2020,41(19): 74-82.
LIU Y Q,QIN X L,KAN J Q,et al.Preparation and properties of enzymatic glycolation of casein and soluble soybean polysaccharide[J].Food Science,2020,41(19): 74-82.
[7] GUO Q B,CUI S W,WANG Q,et al.Extraction,fractionation and physico chemical characterization of water-soluble polysaccharides from Artemisia sphaerocephala Krasch seed [J].Carbohydrate Polymers,2011,86(2): 831-836.
[8] 刘敦华,谷文英,丁霄霖.沙蒿胶对面团流变性质的影响及在面包加工中的应用[J].农业工程学报,2009,25(增刊1): 233-236.
LIU D H,GU W Y,DING X L.Effects of Artemisia gum on rheological properties of dough and its application in bread processing[J].Agricultural Engineering,2009,25 (Supplement 1): 233-236.
[9] 刘敦华.沙蒿籽胶性质、 结构及应用的研究[D].无锡: 江南大学,2006.
LIU D H.Study on properties,structure and application of Artemisia gum[D].Wuxi: Jiangnan University,2006.
[10] CHEN J,LI J,SUN A D,et al.Supercritical CO2 extraction and pre-column derivatization of polysacchar ides from Artemisia sphaerocephala Krasch.seeds via gas chromatography[J].Industrial Crops and Products,2014,60: 138-143.
[11] XING X H,ZHANG Z M,HU X,et al.Antidiabetic effects of Artemisia sphaerocephala Krasch.gum,a novel food additive in China,on streptozotocin-induced type 2 diabetic rats [J].Journal of Ethnopharmacology,2009,125(3): 410-416.
[12] DING X Y,ZENG N,ZHANG G W,et al.Inflence of tran ASG lutaminase-assisted ultrasound treatment on the structure and functional properties of soy protein isolate[J].Journal of Food Processing& Preservation,2019.
[13] 袁程程,张坤生,任云霞.沙蒿胶对虾蛄肌原纤维蛋白凝胶特性的影响[J].食品科学,2017,38(5):111-115.
YUAN C C,ZHANG K S,REN Y X.Effect of Artemisia gum on properties of muscle fibrin gel in mantis shrimp[J].Food Science,2017,38(5): 111-115.
[14] 杨续金,刘阳,范贵生,等.影响沙蒿籽胶表观黏度的因素[J].食品科学,2015,36(17): 114-117.
YANG X J,LIU Y,FAN G S,et al.Factors affecting the apparent viscosity of Artemisia seed gum[J].Food Science,2015,36(17): 114-117.
[15] BENJAKUL S,LERTITTIKUL W,BAUER F.Antioxidant activity of Maillard reaction products from a porcine plasma protein -sugar model system [J].Food Chemistry,2005,93(2): 189-196.
[16] LI Y,LU F,LUO C R,et al.Functional properties of the Maillard reaction products of rice protein with sugar[J].Food Chemistry,2009,117(1): 69-74.
[17] 宋春丽,赵新淮.食品蛋白质的糖基化反应: 美拉德反应或转谷氨酰胺酶途径[J].食品科学,2013,34(9): 369-374.
SONG C L,ZHAO X H.Glycosylation of food proteins: Maillard reaction or transglutamase pathway[J].Food Science,2013,34(9): 369-374.
[18] YIN S W,TANG C H,WEN Q B,et al.Effects of acylation on the functional properties and in vitro trypsin digestibility of red kidney bean (Phaseolus vulgaris L.) protein isolate[J].Journal of Food Science,2009,74(9): 938-945.
[19] DONG S,WEI B,CHEN B,et al.Chemical and antioxidant properties of casein peptide and its glucose Maillard reaction products in fish oil-in-water emulsions[J].Journal of Agricultural and Food Chemistry,2011,59(24): 13311-13317.
[20] AN Y,CUI B,WANG Y,et al.Functional properties of ovalbumin glycosylated with carboxymethyl cellulose of different substitution degree[J].Food Hydrocolloids,2014,40: 1-8.
[21] YU X Y,ZHAO M Y,HU J,et al.Correspondence analysis of antioxidant activity and UV-Vis absorbance of Maillard reaction products as related to reactants[J].LWT-Food Science and Technology,2012,46(1): 1-9.
[22] PEARCE K N,KINSELLA J E.Emulsifying properties of proteins: Evaluation of a turbidimetric technique[J].Journal of Agricultural and Food Chemistry,1978,26(3): 716-723.
[23] LI Y,ZHONG F,JI W,et al.Functional properties of Maillard reaction products of rice protein hydrolysates with mono-,oligo-and polysaccharides[J].Food Hydrocolloids,2013,30(1): 53-60.
[24] ZHA F C,DONG S Y,RAO J J,et al.The structural modification of pea protein concentrate with gum Arabic by controlled Maillard reaction enhances its functional properties and flavor attributes[J].Food Hydrocolloids,2019,92: 30-40.
[25] 王延青.大豆蛋白-多糖共价复合物的制备及功能性质研究[D].郑州: 河南工业大学,2010.
WANG Y Q.Preparation and functional properties of soybean protein-polysaccharide covalent complex[D].Zhengzhou: Henan University of Technology,2010.
[26] 朱小燕,毛锦远,赵强,等.谷氨酰胺转氨酶对米渣蛋白糖基化反应产物结构和流变性的影响[J].现代食品科技,2016,32(3): 98-105.
ZHU X Y,MAO J Y,ZHAO Q,et al.Effect of glutamine transaminase on the structure and rheology of rice slag protein glycosylation reaction products[J].Modern Food Technology,2016,32(3): 98-105.
[27] TANG C H,CHOI S M,MA C Y.Study of thermal properties and heat-induced denaturation and aggregation of soy proteins by modulated differential scanning calorimetry[J].International Journal of Biological Macromolecules,2007,40(2): 100-104.
[28] 王鲁慧,肖军霞,徐同成,等.湿热条件下大豆分离蛋白与葡萄糖、 麦芽糖的美拉德反应[J].食品科学,2018,39(16): 19-26.
WANG L H,XIAO J X,XU T C,et al.Maillard reaction of soybean protein isolated by heat and heat with glucose and maltose [J].Food Science,2018,39(16): 19-26.
[29] BRANDS C M J,BOEKEL M A J S V.Kinetic modelling of reactions in heated disaccharide-casein systems[J].Food Chemistry,2003,83(1): 13-26.
[30] KASRAN M,CUI S W,GOFF H D.Covalent attachment of fenugreek gum to soy whey protein isolate through natural Maillard reaction for improved emulsion stability[J].Food Hydrocolloids,2013,30(2): 552-558.
[31] LAWAL O S,ADEBOWALE K O,OGUNSANWO B M,et al.On the functional properties of globulin and albumin protein fractions and flours of African locust bean (Parkia biglobossa)[J].Food Chemistry,2005,92(4): 681-691.
[32] JIA J Q,MA H L,ZHAO W R,et al.The use of ultrasound for enzymatic preparation of ACE -inhibitory peptides from wheat germ protein[J].Food Chemistry,2010,119(1): 336-342.
[33] 刘婕,姜竹茂,刘晓,等.美拉德反应对褐色益生菌羊乳饮料品质的影响[J].中国乳品工业,2018,46(8): 61-66.
LIU J,JIANG Z M,LIU X,et al.Effect of Maillard reaction on the quality of brown probiotics goat milk drinks[J].China Dairy Industry,2018,46(8):61-66.
[34] AN Y P,CUI B,WANG Y T,et al.Functional properties of ovalbumin glycosylated with carboxymethyl cellulose of different substitution degree[J].Food Hydrocolloids,2014,40(10): 1-8.
[35] XU W H,LIU B Y,YANG H S,et al.Effect of γ-irradiation on the physicochemical properties of mixed soy protein isolate/starch material[J].African Journal of Biotechnology,2012,11(28): 7238-7246.
[36] LIU L,LI X D,ZHU Y M,et al.Effect of microencapsulation with Maillard reaction products of whey proteins and isomaltooligosaccharide on the survival of Lactobacillus rhamnosus[J].Lwt Food Science & Technology,2016,73: 37-43.
[37] WU X L,LU Y Q,XU H X,et al.Reducing the allergenic capacity of β-lactoglobulin by covalent conjugation with dietary polyphenols[J].Food Chemistry,2018,256: 427-434.
[38] PACHEKREPAPOL U,Home D S,LUCEY J A.Interactions between acidified dispersions of milk proteins and dextran or dextran sulfate[J].Journal of Dairy Science,2014,97(9): 5371-5382.
[39] YANG Y X,CUI S W,GONG J H,et al.A soy protein-polysaccharides Maillard reaction product enhanced the physical stability of oil-in-water emulsions containing citral[J].Food Hydrocolloids,2015,48: 155-164.
[40] LI L,MURIEL S.Study of the acid and thermal stability of β-lactoglobulin-ligand complexes using fluorescence quenching[J].Food Chemistry,2012,132(4): 2023-2029.
[41] 刘夫国.蛋白质-多酚-碳水化合物共价复合物制备及其对功能因子稳态作用[D].北京: 中国农业大学,2017.
LIU F G.Preparation of protein-polyphenols-carbohydrate covalent complex and its effect on steady stability of functional factors[D].Beijing: China Agricultural University,2017.
[42] ALBRECHT C.Principles of fluorescence spectroscopy,3rd Edition[J].Analytical and Bioanalytical Chemistry,2008,390(5): 1223-1224.
[43] JIMENEZ -CASTANO L,LOPEZ -FANDINO R,OLANO A,et al.Study on β-lactogiobulin glycosylation with dextran: Effect on solubility and heat stability[J].Food Chemistry,2005,93(4): 689-695.
[44] 葛伟,李晓东,夏琪娜,等.超声协同美拉德反应对酪蛋白乳化性和凝胶性的影响[J].中国食品学报,2016,16(10): 73-79.
GE W,LI X D,XIA Q N,et al.Effects of ultrasound collaboration with Maillard on emulsification and gel of casein[J].China Food Journal,2016,16(10): 73-79.
[45] CARLOS A,VANESSA G.RENDUELES M,et al.Functional properties of isolated porcine blood proteins modified by Maillard's reaction[J].Food Hydrocolloids,2012,28(2): 267-274.