胶原蛋白是细胞外基质的主要成分,约占总蛋白的30%[1]。目前,已从不同的动物组织中发现29 种类型的胶原蛋白,且每种胶原蛋白都有其独特的氨基酸序列、结构和功能[2]。其中,I 型胶原蛋白具有稳定的三螺旋结构,高度的生物相容性和良好的生物降解性,在制药、组织工程、保健品、化妆品等行业具有广泛的应用潜力[3]。大部分胶原蛋白主要来自牛、猪等陆生动物的皮肤和骨骼。然而,随着牛海绵状脑病、传染性海绵状脑病和口蹄疫等烈性传染病在世界各地的相继爆发,来源于陆生动物的胶原蛋白因可能引发人畜交叉感染这一涉及人类自身安全的敏感问题而引起科学界的普遍关注。来源于陆生动物组织的胶原蛋白的应用受到很大限制。寻找更安全、经济的胶原蛋白来源成为人们关注的热点,科学界逐渐将研究目标聚焦于水生生物。许多学者研究了鱼类中提取的胶原蛋白,与陆生动物胶原蛋白相比,鱼类胶原蛋白更安全、更容易被接受,因此人们研究鱼类胶原蛋白的兴趣日益增加[4-5]。
鲟鱼隶属于硬骨鱼纲、辐鳍亚纲、软骨硬鳞总目、鲟形目,是现存起源最早的脊椎动物之一。我国是世界上鲟鱼产量最大的国家,2020 年我国鲟鱼养殖产量达到10.4 万t,其中主要集中于西南及华东地区[6]。鲟鱼皮质量占鲟鱼总质量的5%~7%,鲟鱼属于硬鳞鱼类,鱼皮无法直接食用,据统计,我国每年有700 t 以上的鲟鱼皮因加工不当而被丢弃,造成资源浪费[7]。鲟鱼皮中含有丰富的胶原蛋白,可以将其作为天然优质胶原蛋白的原料[8],对其精深加工可提高鲟鱼加工的综合利用率和产品附加值。
酸提取法是常用的胶原蛋白提取方法之一,是利用低浓度的酸溶液来破坏胶原蛋白分子间的Schiff 键和离子键,从而使没有交联的胶原蛋白和含有醛胺类交联键的胶原蛋白溶出,酸法提取对胶原蛋白的交联键破坏程度小,不会破坏胶原蛋白的三螺旋结构[9]。近年来,超声波因具有高效、节能、环保等优点而被广泛应用于各种蛋白质的制备,以提高蛋白质的可得性、功能特性和理化特性[10],Ali 等[11]研究了超声波辅助酸法和酶法提取鲫鱼鱼皮中的胶原蛋白并探究其理化特性;Zou等[5]研究了超声波辅助提取对甲鱼裙边胶原蛋白理化特性和功能特性的影响。
本研究以鲟鱼皮为原料,采用两种方法提取鲟鱼皮胶原蛋白,对酸提法制备的胶原蛋白(Acid-soluble collagen,ASC)和超声波辅助酸法制备的胶原蛋白(Ultrasonic-assisted acid-soluble collagen,UASC)的蛋白结构、理化性质进行比较,探讨超声波辅助提取法对鲟鱼皮胶原蛋白提取率及理化特性的影响,以期获得安全、稳定的鲟鱼皮胶原蛋白。
1 材料与方法
1.1 材料与试剂
新鲜鲟鱼,河北省保定市河北农大科技市场;L-羟脯氨酸、乙酸、氯化钠、无水乙酸钠、氢氧化钠、柠檬酸、正丙醇、异丙醇、硝酸银、高氯酸(均为分析纯级)、溴化钾(色谱纯级),国药集团化学试剂有限公司;SDS-PAGE 凝胶制备试剂盒,康为世纪生物科技有限公司。
1.2 仪器与设备
超滤管,美国Millipore 公司;JY92-IIDN 超声波细胞粉碎机,宁波新芝生物科技股份有限公司;TGL-16MC 高速台式冷冻离心机,长沙湘锐离心机有限公司;LGJ-12A 真空冷冻干燥机,北京四环起航科技有限公司;Scimitar2000 傅里叶变换红外光谱仪,美国Agilent 公司;乌氏粘度计,上海化科实验器材有限公司;TESCAN MIRA4 扫描电子显微镜,泰思肯(中国)有限公司;日本理学X 射线衍射仪Ultima IV 系列,日本理学公司。
1.3 鲟鱼皮预处理
将鲟鱼皮切碎,5 mm×5 mm 左右,用0.1 mol/L氯化钠溶液在4 ℃下浸泡除去鱼皮的杂蛋白、脱色,用10%异丙醇溶液于4 ℃下浸泡过夜除去鱼皮上的脂肪,浸泡结束后用蒸馏水充分洗涤,沥干,置于-20 ℃冰柜里储存备用[12]。
1.4 鲟鱼皮胶原蛋白的提取
1.4.1 乙酸提取鲟鱼皮胶原蛋白 称取2 g 预处理的鲟鱼皮,用乙酸溶液浸泡,固液比为1 ∶10(g/mL),在20 ℃条件下搅拌提取24 h,4 ℃下离心20 min,转速为10 000 r/min,取上清,将沉淀的鱼皮继续用相同浓度和体积的乙酸复提1 次,混合2次上清液,得到鲟鱼皮ASC 粗提液。
1.4.2 超声波辅助乙酸提取鲟鱼皮胶原蛋白 称取2 g 预处理好的鲟鱼皮,用乙酸溶液浸泡,固液比为1∶10(g/mL),经过之前探究超声提取工艺的响应面试验,得到最优条件为超声波功率491 W,处理11 min,探头频率20 kHz[12],利用此条件对鲟鱼皮和乙酸的混合物进行超声处理,控制超声温度在20 ℃以下,超声处理结束后将样品转移到20℃条件下继续进行搅拌提取24 h,在4 ℃下离心20 min,转速为10 000 r/min,取上清,将沉淀的鱼皮用相同浓度和体积的乙酸复提1 次,混合2 次上清液,得到鲟鱼皮UASC 粗提液。
1.5 鲟鱼皮胶原蛋白的纯化
分别向ASC 和UASC 粗提液中缓慢加入NaCl 至盐浓度为2.5 mol/L,搅拌均匀,在4 ℃条件下静止盐析24 h,然后在温度为4 ℃,转速为10 000 r/min 条件下离心20 min,弃上清液,沉淀用0.5 mol/L 乙酸充分溶解,将不溶物继续离心除去。将得到的溶液在透析袋中透析以除去Cl-,分别用0.1 mol/L 乙酸和去离子水进行透析,透析过程每4 h 换1 次透析液,用硝酸银检验透析液中是否含有Cl-,无白色沉淀透析结束。将透析得到的溶液在室温条件下用截留分子质量为100 ku的超滤管超滤45 min,超滤过程中离心机转速为6 000 r/min,超滤结束后收集超滤管中被截留的胶原蛋白溶液进行真空冷冻干燥。
1.6 羟脯氨酸含量的测定
参考《肉与肉制品 羟脯氨酸含量测定》(GB/T 9696.23-2008)[13]中的方法,对ASC 和UASC 样品中羟脯氨酸的含量进行测定。
1.7 胶原蛋白提取率的测定
胶原蛋白的提取率按照式(1)计算:
式中,X——胶原蛋白提取率(%);W——羟脯氨酸含量(g);11.1——羟脯氨酸换算系数[14];M——鲟鱼皮中蛋白质含量(g)。
1.8 SDS-PAGE
参照温慧芳等[15]的方法,取2 mg 的冻干胶原蛋白用1 mL 蒸馏水充分溶解得到2 mg/mL 的胶原蛋白溶液,与上样缓冲液以4∶1 的体积比混合均匀,在沸水浴中煮沸5 min 后,用冷冻离心机在转速为10 000 r/min 下离心2 min 除去不溶物。样品上样量为10 μL,Maker 上样量4 μL。采用5%的浓缩胶和8%的分离胶对胶原蛋白进行电泳分离。采用直压恒流电源,浓缩胶为80 V,分离胶为120 V。电泳结束后在恒温水浴摇床上用染色液染色30 min,然后用脱色液脱色2 h,直至背景色透明为止,胶片在凝胶成像仪中成像。
1.9 紫外可见光谱
参考Huang 等[16]的方法,将冻干胶原蛋白用0.5 mol/L 的乙酸充分溶解,溶解后胶原蛋白溶液质量浓度为1 mg/mL。以0.5 mol/L 乙酸为基线,在室温下采用扫描仪进行扫描,扫描波长为200~400 nm。
1.10 傅里叶变换红外光谱
参考Noorzai 等[17]的方法,先将溴化钾在110℃烘箱中烘24 h,将冻干的胶原蛋白与溴化钾混合均匀研磨成粉末进行压片,然后放入样品室扫描,以溴化钾作为基线,扫描波数范围为4 000~500 cm-1。
1.11 光谱曲线拟合
参考王立宇等[18]的方法,使用PeakFit v4.12软件分别对ASC 和UASC 的酰胺I 带进行二阶导数高斯曲线拟合分析,通过多次拟合来区分具有重叠最小残差的不同波段。当拟合的标准误差最小时,确定各个峰与各个二级结构之间的对应关系,然后根据其积分面积最后得出胶原蛋白不同二级结构的相对含量百分比。
1.12 黏度
参考Zhang 等[19]的方法根据黏度变化测量,并稍作修改。用0.5 mol/L 乙酸来溶解冻干的胶原蛋白,溶解后溶液中胶原蛋白的质量浓度为0.5 mg/mL。使用乌式粘度计测量不同温度下的胶原蛋白溶液的分数黏度,测量的温度范围为15~45℃,测量过程中每个温度下保持10 min,每点测量3 次,取平均值。利用方程确定各温度下的分数黏度:
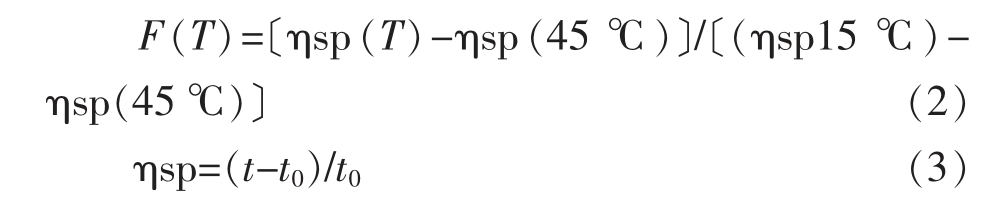
式中,t——胶原蛋白溶液的流出时间(s);t0——乙酸溶液的流出时间(s)。
胶原蛋白的热变性温度(Td)取分数黏度为0.5 时所对应的温度。
1.13 差示扫描量热
将冻干的胶原蛋白放入坩埚中密封,以空坩埚为对照,升温进行测试。测试温度范围为20~250 ℃,升温速度为5 ℃/min,得到鲟鱼皮胶原蛋白的差示扫描量热图。
1.14 X 射线衍射
参考张建旭等[20]的方法,将冻干的胶原蛋白样品黏附在样品台上,在电压40 kV,电流40 mA的条件下,在Cu-Ku 靶(λ=0.154 nm)辐照下,在5°~50°(2θ)角范围内,扫描速度为5°/min 下进行试验,得到鲟鱼皮胶原蛋白的X 射线衍射图。
1.15 扫描电子显微镜
参考张强等[21]的方法,将冻干的胶原蛋白样品固定在载物台上,铂金靶材喷金处理,用扫描电子显微镜在加速电压为10 keV 下,放大不同的倍数观察ASC 和UASC 的微观结构。
1.16 数据处理与分析
所有试验重复3 次进行,结果表示为“平均值±标准偏差”,使用Microsoft Office Excel 2019进行数据处理,应用Origin 2018 软件绘图。
2 结果与分析
2.1 鲟鱼皮ASC 和UASC 的提取率比较
以鲟鱼皮为原料,常规酸提法和超声波辅助酸提法得到鲟鱼皮中胶原蛋白的提取率分别为(7.330±0.42)%和(27.527±0.65)%(干重),相比于常规酸提取法,超声波辅助提取胶原蛋白的提取率提高了20.197%,这是由于超声波的空化作用产生了巨大的压力,使细胞组织破壁,分离未交联的胶原分子,强化了胶原蛋白的提取过程,从而提高了胶原蛋白提取率[22]。Ong 等[23]研究了超声辅助下刺鳐皮中的胶原蛋白提取率,表明UASC(48.37%)和UPSC(56.65%)的胶原提取率均高于相应未超声辅助下ASC(20.48%)和PSC(34.84%)的提取率。李根等[24]研究了经过超声处理的鲵皮胶原蛋白的提取率(37.36%)明显高于未经超声处理的鲵皮胶原蛋白的提取率(17.56%)。这些研究与本研究结果类似,均表明超声波能有效提高水生生物胶原蛋白提取率。
2.2 鲟鱼皮ASC 和UASC 的SDS-PAGE 结果分析
SDS-PAGE 图谱能够直观地判断出胶原蛋白的亚基组成和类型。图1 为鲟鱼皮胶原蛋白的SDS-PAGE 图谱,从图1 可以看出ASC 和UASC均由3 条链构成,分别是2 条不同的α肽链(α1 和α2)和1 条β 肽链(α 肽链的二聚体)。在α 肽链中颜色较深的是α1 条带,分子质量约为125 ku,颜色较浅的为α2 条带,分子质量在100~125 ku 范围内。典型的I 型胶原蛋白由2 条α1 链和1 条α2 链组成的三聚体结构,而图1 中的电泳图基本符合I型胶原蛋白的肽链特征,表明鲟鱼皮中提取的ASC 和UASC 为I 型胶原蛋白,这一结果与杨玲等[25]的研究一致。由图1 可以看出,ASC 和UASC凝胶电泳图谱没有明显差别,表明超声波对胶原蛋白的三螺旋结构没有造成破坏和损伤。
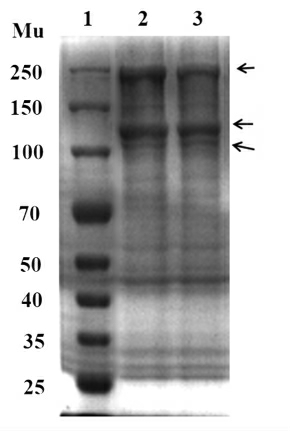
图1 鲟鱼皮胶原蛋白SDS-PAGE 图谱
Fig.1 SDS-PAGE patterns of sturgeon skin collagen
注:1.Marker;2.ASC;3.UASC。
2.3 鲟鱼皮ASC 和UASC 的紫外可见光谱分析
胶原蛋白的多肽链存在C=O、-COOH 和-CO-NH-官能团,使其在约230 nm 波长处有1个显著的吸收峰[26]。根据胶原蛋白的紫外吸收光谱图,不仅可以判断出胶原蛋白中是否有酪氨酸和色氨酸等带有共轭π 键生色团的氨基酸的存在,还可以判断多肽链中非螺旋端肽的完整性[27]。图2 为鲟鱼皮胶原蛋白的紫外可见光谱图,由图可知ASC 和UASC 均在235 nm 波长处有较为明显的吸收峰,与Li[28]研究的海参(236.5 nm)、罗非鱼皮(235.5 nm)、猪皮(235 nm)中提取的胶原蛋白的最大吸收峰相近,与程波等[29]研究的鲟鱼皮胶原蛋白的吸收峰波长一致,符合I 型胶原蛋白的紫外吸收特征。本研究中的ASC 和UASC 样品在280 nm 波长附近没有明显的吸收峰,表明提取的产物中具有共轭π 键生色团的芳香族氨基酸的含量极低,这一结果符合I 型胶原蛋白氨基酸组成特征。以上结果再次证明了鲟鱼皮中提取的ASC和UASC 均属于I 型胶原蛋白。
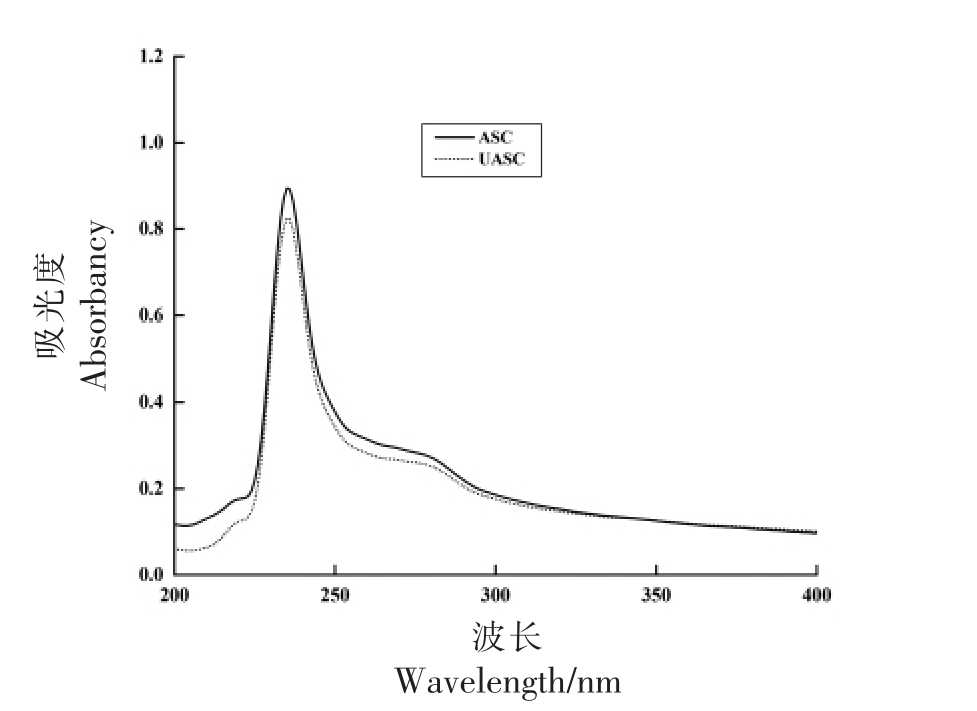
图2 鲟鱼皮胶原蛋白的紫外吸收光谱图
Fig.2 Ultraviolet absorption spectra of collagen from sturgeon skin
2.4 鲟鱼皮ASC 和UASC 的傅里叶变换红外光谱分析
傅里叶变换红外光谱广泛应用于蛋白质二级结构的分析,可以根据样品的红外吸收峰的位置推断出样品中存在的特征基团,从而确定其化学结构[30]。图3 为鲟鱼皮ASC 和UASC 的红外吸收光谱图,鲟鱼皮胶原蛋白因其具有独特的三螺旋结构和胶原蛋白分子上的氨基和亚氨基结构,使其傅里叶变换红外光谱图主要表现为5 个特征吸收峰。酰胺A 带属于N-H 伸缩振动,波数在3 400~3 440 cm-1 范围内,由图3 可知,ASC 和UASC 的酰胺A 带的吸收峰分别为3 306 cm-1 和3 308 cm-1,低于波数范围,这是由于胶原蛋白的N-H 基团与C=O 形成了氢键,导致酰胺A 带向低频移动[31]。酰胺B 带代表CH2 的不对称伸缩振动[32],它的吸收峰波数在2 877~3 084 cm-1 范围内,图3 中ASC和UASC 酰胺B 带的吸收峰分别为2 938 cm-1 和2 936 cm-1。酰胺Ⅰ带代表C=O 伸缩振动,其波数范围为1 600~1 700 cm-1,ASC 和UASC 的酰胺I带吸收峰均为1 653 cm-1。酰胺Ⅱ带归属于C-N伸缩振动和N-H 弯曲振动,波数在1550~1 600 cm-1 范围内,当胶原蛋白肽链中含有氢键时,酰胺II 带波数会向低频移动[33],ASC 和UASC 的酰胺II带的波数均为1 541 cm-1,低于波数范围,再次证明了肽链中含有氢键。酰胺Ⅲ带归属为N-H 弯曲振动,波数范围为1200~1300cm-1[34],ASC 和UASC的酰胺III 带吸收峰分别为1 242 cm-1 和1 240 cm-1,当酰胺III 带的吸收强度和1 450 cm-1 的吸收强度的比值接近1 时,证明胶原蛋白三螺旋结构保存完整[35]。本研究得到鲟鱼皮ASC 和UASC 的酰胺Ⅲ带和1450 cm-1 的吸收强度比分别约为1.06 和1.10。以上特征吸收峰的分析结果表明,ASC 和UASC 的二级结构相似,ASC 和UASC 都较好的保留了胶原蛋白的三螺旋结构。
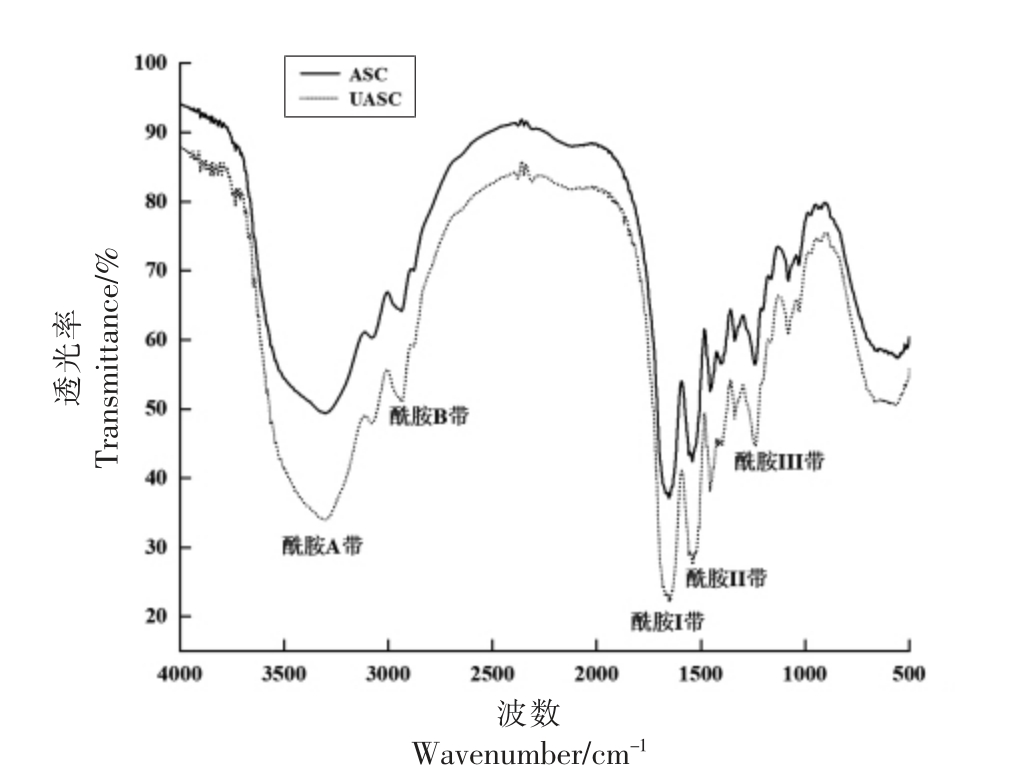
图3 鲟鱼皮胶原蛋白的傅里叶变换红外光谱图
Fig.3 Fourier transform infrared spectroscopy of sturgeon skin collagen
2.5 鲟鱼皮ASC 和UASC 的光谱曲线拟合分析
在红外光谱中,二阶导数红外光谱不仅可以提高表观分辨率,还可以分离重叠峰和肩峰。蛋白质红外光谱的酰胺I 带具有丰富的二级结构信息[36],因此本研究对鲟鱼皮胶原蛋白的酰胺I 带采用二阶导数和高斯拟合分析。图4 为ASC 和UASC 根据导数光谱得到酰胺I 区的6 个主要波段,并计算了二级结构成分的百分比,包括α-螺旋、β-折叠、β-转角和无规则卷曲[37]。α-螺旋具有更紧密的结构和更大的稳定性,波数在1 650~1 660 cm-1 范围内[38]。β-折叠波数范围为1 600~1 640 cm-1,β-折叠具有较少的分子间氢键,因此导致二级结构不如α-螺旋稳定。β-转角和无规则卷曲波数分别在1 660~1 700 cm-1 和1 640~1 650 cm-1 范围内。计算ASC 和UASC 中二级结构组成所占的含量结果如图5 所示,由图5 可知UASC的α-螺旋含量略高于ASC,UASC 中β-折叠含量略低于ASC,两者的β-转角含量相近,说明超声波辅助提取使鲟鱼皮胶原蛋白二级结构中的β-折叠转换成了α-螺旋,证明UASC 的二级结构稳定性高于ASC。二级结构成分占比的结果表明超声波辅助提取的胶原蛋白使胶原蛋白二级结构连接更为稳定。
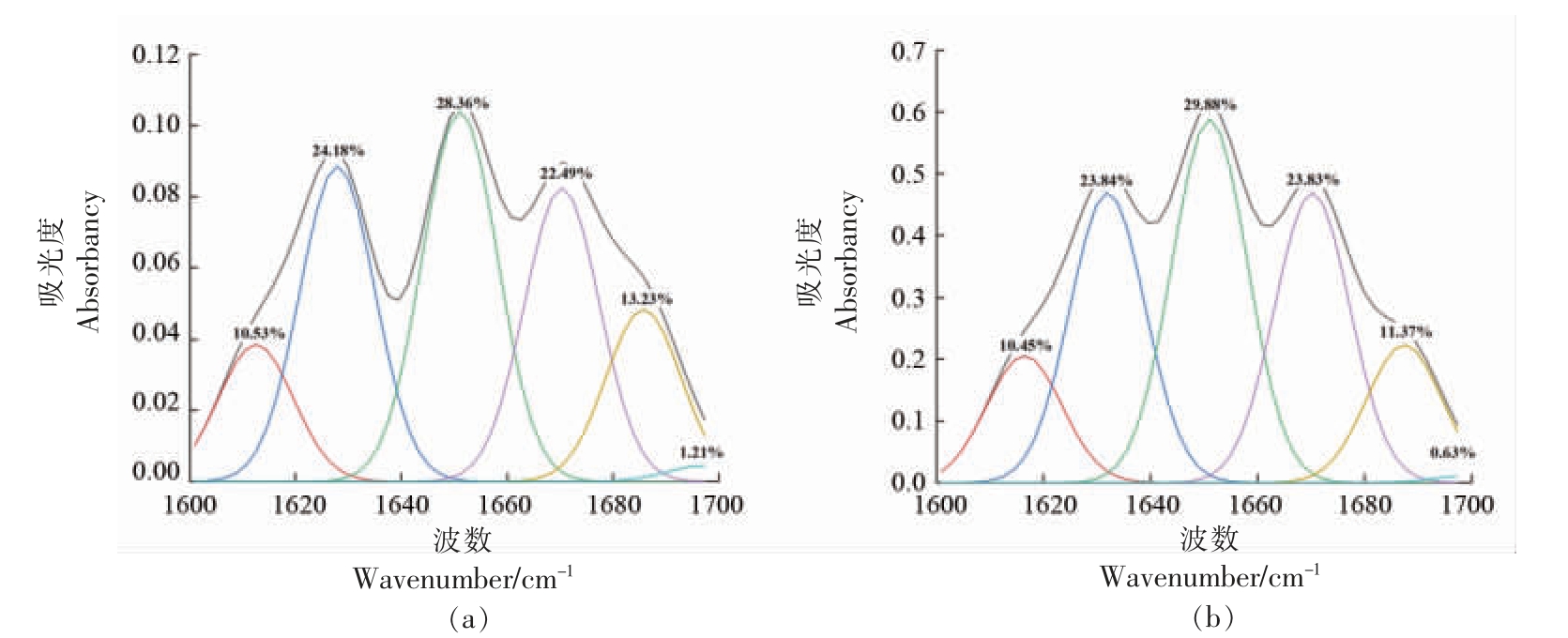
图4 鲟鱼皮ASC(a)和UASC(b)酰胺I 带拟合光谱分析
Fig.4 Fitting spectral analysis of collagen amide I bands in sturgeon skin
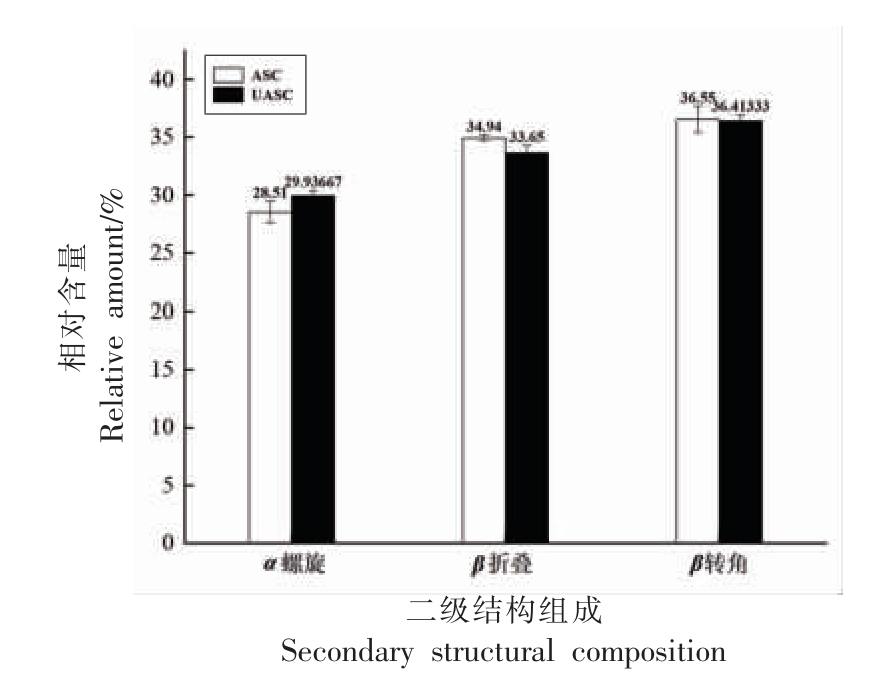
图5 鲟鱼皮胶原蛋白的二级结构组成
Fig.5 Secondary structural composition of sturgeon skin collagen
2.6 鲟鱼皮ASC 和UASC 的黏度分析
在不同条件下胶原蛋白的溶解度、黏度等物理特性会发生变化,常以胶原蛋白的黏度来确定其变性温度(Td)[39]。在黏度曲线中,黏度值下降到最大值一半的温度称为热变性温度。图6 为两种提取方法得到的胶原蛋白在不同温度处理下的黏度曲线,随着温度升高,两种方法得到的胶原蛋白的黏度曲线均呈急剧下降的趋势,黏度的降低可能与胶原蛋白的变性和三螺旋结构的改变有关[40]。由图6 可知,乙酸提取的胶原蛋白的热变性温度为29.57 ℃,超声波辅助乙酸提取的胶原蛋白的热变形温度为30.21 ℃。不同的物种中提取的胶原蛋白的热变性温度不同,从淡水鱼鱼皮中提取的胶原蛋白的热稳定性通常会比从海洋鱼类鱼皮中提取的胶原蛋白的热稳定性要高,例如Sun 等[3]研究的从大西洋鳕鱼皮中提取的胶原蛋白的热变性温度为14.5 ℃,低于鲟鱼皮胶原蛋白的热变性温度。由图6 可知,UASC 的热变性温度稍高于ASC 的热变性温度,说明超声波辅助酸提取鲟鱼皮胶原蛋白增加了胶原蛋白的热稳定性。该结果与邹烨等[41]的研究结果一致,证明了经过超声波辅助酸法提取的鲟鱼皮胶原蛋白的结构更为稳定。
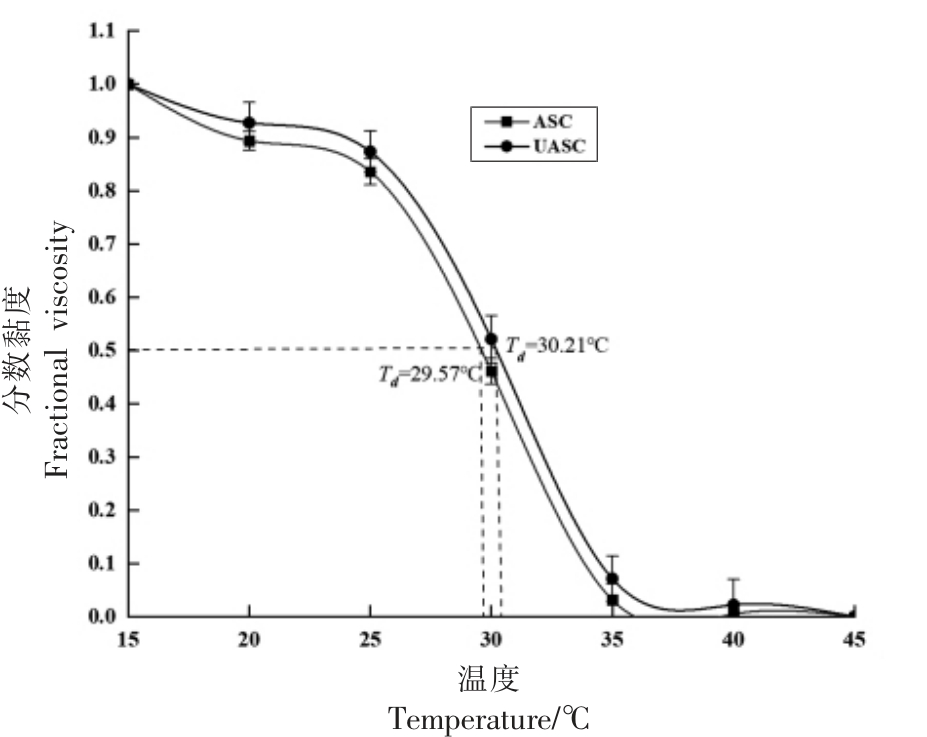
图6 鲟鱼皮胶原蛋白的黏度变化曲线
Fig.6 Viscosity variation curve of sturgeon skin collagen
2.7 鲟鱼皮ASC 和UASC 的差示扫描量热分析
图7 为两种提取方法得到的胶原蛋白的差示扫描量热图,图中显示出在两个温度下的吸热峰。乙酸提取的胶原蛋白的第1 个吸热峰温度为62.19 ℃,超声波辅助乙酸提取的胶原蛋白的第1个吸热峰的温度为64.90 ℃,该峰所对应的温度为胶原蛋白的热收缩温度(Ts)。热收缩温度(Ts)是指胶原蛋白纤维因胶原蛋白失水而收缩,使其长度减少到原来长度的三分之一的温度,热收缩温度表示胶原蛋白的三螺旋结构和生物活性的保留情况[42]。胶原蛋白Ts 值的大小与其三螺旋结构稳定性成正相关。ASC 和UASC 的热收缩温度均高于Cui 等[43]研究的牛皮中的胶原蛋白(62 ℃)。图7 中另一个吸热峰分别在211.90 ℃和212.47 ℃,此峰与交联胶原蛋白的结构变化有关,该峰所对应的温度为胶原蛋白熔化温度(Tm),是胶原蛋白变性速度最大时的温度[37]。由图7 可知,超声波辅助提取使胶原蛋白的Ts 和Tm 升高,这是由于超声空化作用打破了颗粒物质的胞膜,与Shaik 等[44]研究结果一致,该结果进一步证明了经过超声波辅助酸提取的胶原蛋白的结构更加趋于稳定。
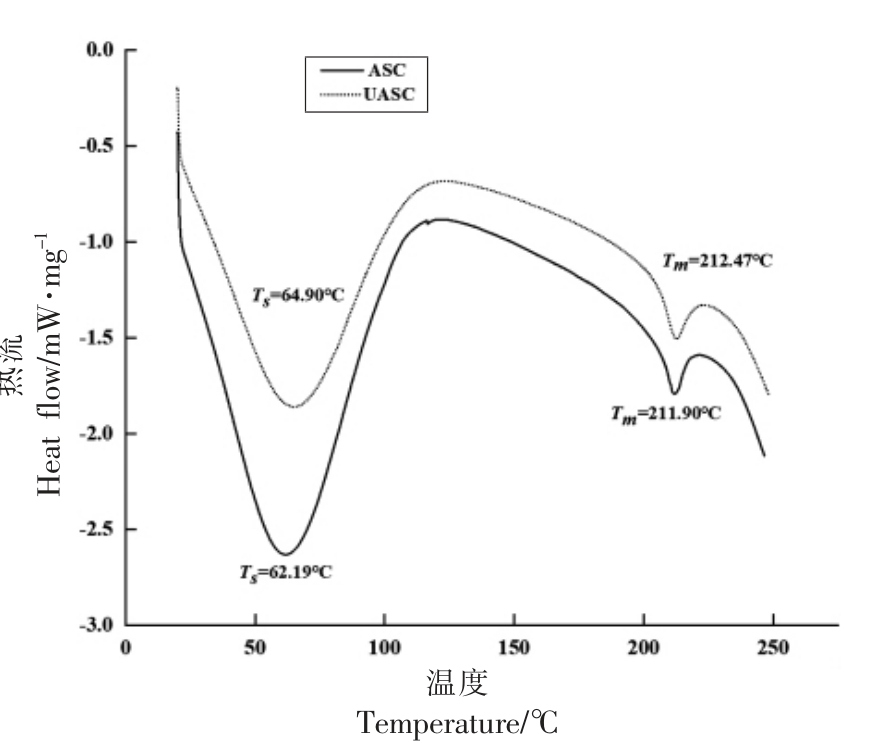
图7 鲟鱼皮胶原蛋白的差示扫描量热图
Fig.7 DSC of sturgeon skin collagen
2.8 鲟鱼皮ASC 和UASC 的X 射线衍射结果分析
X 射线衍射可以对胶原蛋白的结构变化的各个定量参数进行测定,根据ASC 和UASC 的X 射线衍射图来判断的超声波辅助提取对胶原蛋白结构的影响。图8 是两种方法提取胶原蛋白的X 射线衍射图,两种样品的X 射线衍射图均含有2 个胶原蛋白的特征峰。图8 中第1 个峰(用C 来表示)代表的是胶原蛋白分子链之间的距离,峰C 的衍射角(2θ)一般在5°~10°范围内,与胶原蛋白的三螺旋结构有关;第2 个峰(用A 表示)代表的是胶原蛋白内部非结晶部分含量所占整体的比例,峰A的衍射角(2θ)一般在20°附近[45]。根据布拉格方程2dsinθ=λ,计算出各个峰所对应距离“d”值,在布拉格方程中λ,d 和θ 分别对应的是X 射线波长(0.154 nm),原子晶格平面间距(nm)和布拉格衍射角(°)[46]。根据Scherrer 公式D=Kλ/βcosθ,可以得到胶原蛋白的晶粒度大小D 值,在Scherrer 公式中K 为常数(K=0.89);λ 为X 射线波长(0.154 nm);β 为衍射峰半高宽(需转化为弧度)(rad);θ 为X 射线衍射角(°);D 为晶粒度大小(nm)。D 值的大小与胶原蛋白的有序程度有一定的关系,D 值越大则胶原蛋白有序程度越高[47]。根据图8 峰C 和峰A 所对应的衍射角来计算各个峰所对应的距离d 值和晶粒度大小D 值。计算得到ASC 和UASC 胶原蛋白链之间的距离均约为1.10 nm,与Chen 等[31]研究结果相似。计算得到UASC 在峰C 和峰A 的D 值均略高于ASC,说明UASC 的有序程度高于ASC,证明超声波辅助酸提取胶原蛋白会增加胶原蛋白结构的有序程度,提高胶原蛋白的结构稳定性。
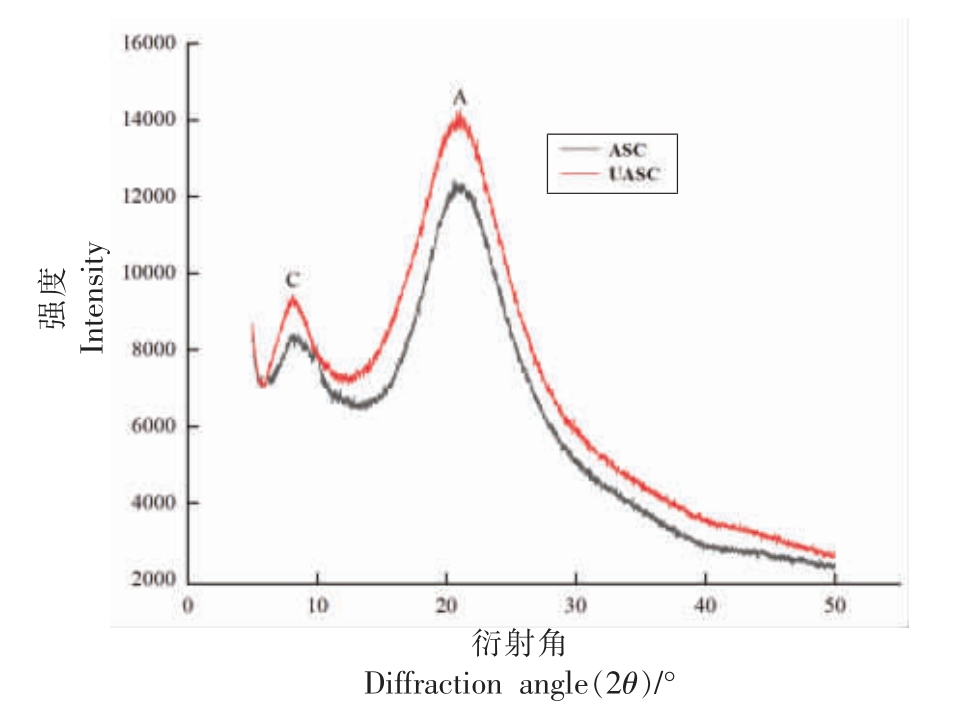
图8 鲟鱼皮胶原蛋白的X 射线衍射分析图
Fig.8 X-ray diffraction analysis of sturgeon skin collagen
2.9 鲟鱼皮ASC 和UASC 的微观结构比较
胶原蛋白的微观结构,如孔隙度、纤维形状和相互连接是生物材料评估的关键参数。图9a1 和图9b1 分别为肉眼观察冻干后的鲟鱼皮ASC 和UASC,两者相似,均呈现白色的海绵状。图9a2 和图9b2 分别是ASC 和UASC 放大200 倍得到的图像,图9a3 和图9b3 分别是放大1 000 倍得到的图像。可以观察到ASC 和UASC 的微观结构呈规则的、多孔的纤维网状结构,根据放大1 000 倍的图像可以看出ASC 和UASC 表面结构光滑。本研究与马帅[48]研究的鲽鱼鱼皮胶原蛋白扫描电镜图大致相似,都呈多孔的网络结构。根据以上分析表明,两种方法提取的胶原蛋白微观结构无明显差别,这表明超声波辅助提取鲟鱼皮胶原蛋白对胶原蛋白的微观结构没有明显影响,这种胶原蛋白均具有复杂多孔和纤维网络结构,可以用作水合剂、伤口敷料、细胞增殖基质或其它基本生物医学应用[49]。
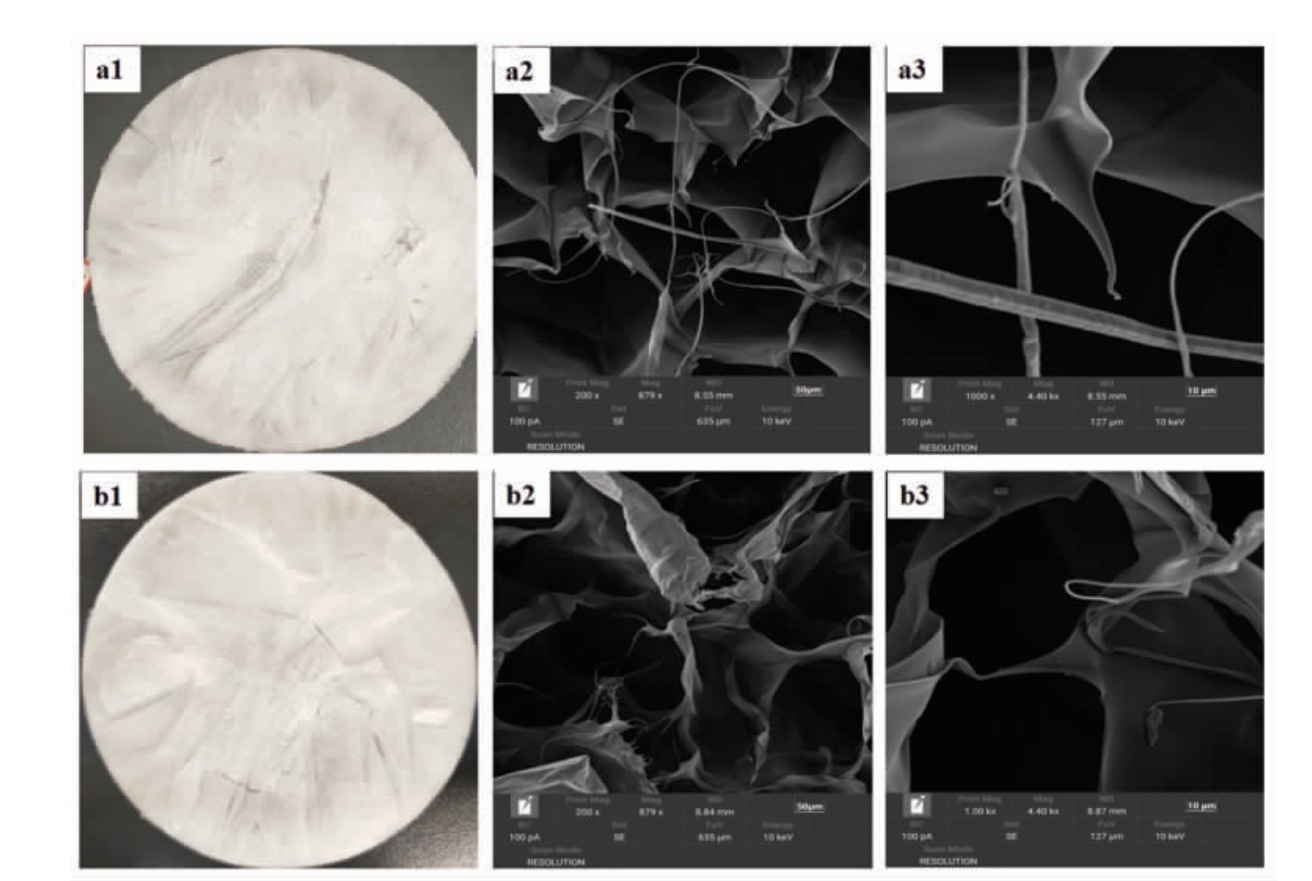
图9 鲟鱼皮胶原蛋白肉眼观察图(a1、b1)和扫描电镜图(a2、a3、b2、b3)
Fig.9 Sturgeon skin collagen as viewed in naked eye(a1,b1)and SEM micrograph(a2,a3,b2,b3)
注:a1、a2、a3 为ASC;b1、b2、b3 为UASC。
3 结论
超声波辅助可以促进乙酸对胶原蛋白的提取,常规酸提法和超声波辅助酸提法得到的胶原蛋白的提取率分别为7.330%和27.527%。UASC和ASC 均属于I 型胶原蛋白,同时两者均保持完整的三螺旋结构。与常规酸提法相比,超声波辅助使胶原蛋白的结构有序程度、二级结构稳定性以及热稳定性得到改善。两种提取方法得到的鲟鱼皮胶原蛋白的微观结构无明显差别。本研究结果表明,超声辅助可有效提高鲟鱼皮胶原蛋白的提取率,对鲟鱼胶原蛋白结构无明显破坏作用且能增强胶原蛋白的结构稳定性,本研究结果为超声辅助酸法应用于鲟鱼皮胶原蛋白提取提供了理论依据和实践指导。
[1] SONG W K,LIU D,SUN L L,et al.Physicochemical and biocompatibility properties of type I collagen from the skin of nile tilapia(Oreochromis niloticus)for biomedical applications [J].Marine Drugs,2019,17(3):137.
[2] LIU D,LI L,REGENSTEIN J M,et al.Extraction and characterisation of pepsin-solubilised collagen from fins,scales,skins,bones and swim bladders of bighead carp(Hypophthalmichthys nobilis)[J].Food Chemistry,2012,133(4):1441-1448.
[3] SUN L,LI B,SONG W,et al.Characterization of Pacific cod(Gadus macrocephalus)skin collagen and fabrication of collagen sponge as a good biocompatible biomedical material[J].Process Biochemistry,2017,63:229-235.
[4] SUBHAN F,HUSSAIN Z,TAUSEEF I,et al.A review on recent advances and applications of fish collagen[J].Critical Reviews in Food Science and Nutrition,2020,61(6):1027-1037.
[5] ZOU Y,WANG L,CAI P,et al.Effect of ultrasound assisted extraction on the physicochemical and functional properties of collagen from soft-shelled turtle calipash[J].Int J Biol Macromol,2017,105(Pt 3):1602-1610.
[6] 李沛洋,朱学芝,李昭林,等.鲟鱼营养研究进展[J].广东饲料,2021,30(8):33-38.LI P Y,ZHU X Z,LI Z L,et al.Research progress in sturgeon nutrition[J].Guangdong Feed,2021,30(8):33-38.
[7] 胡智力,陈金芳,钱明,等.人工养殖鲟鱼皮的有效利用与制革实验研究[J].武汉工程大学学报,2008(3):4-7.HU Z L,CHENG J F,QIAN M,et al.Study of tannery technology for sturgeon skin[J].Journal of Wuhan Institute of Technology,2008,30(3):4-7.
[8] 朱丽君,毛竞永,陈金芳.鲟鱼皮研究现状及其发文统计分析[J].武汉工程大学学报,2014,36(7):73-78.ZHU L J,MAO J Y,CHEN J F.Statistical analysis of sturgeon skin based on published articles[J].Journal of Wuhan Institute of Technology,2014,36(7):73-78.
[9] 周瑞,陈舜胜.鱼皮胶原蛋白提取方法研究及其在食 品中的应用[J].上海农 业学报,2021,37(1):129-135.ZHOU R,CHEN S S.Research progress on extraction methods of fish skin collagen and its application in food industry[J].Acta Agriculturae Shanghai,2021,37(1):129-135.
[10] JIANG Y J,WANG H B,DENG M X,et al.Effect of ultrasonication on the fifibril-formation and gel properties of collagen from grass carp skin[J].Materials Science and Engineering C,2016,59:1038-1046.
[11] ALI A,KISHIMURA H,BENJAKUL S.Extraction efficiency and characteristics of acid and pepsin soluble collagens from the skin of golden carp(Probarbus Jullieni)as affected by ultrasonication [J].Process Biochemistry,2018,66:237-244.
[12] 公维洁,卓先勤,许环浪.响应面优化超声波辅助提取马面鱼皮胶原蛋白工艺研究[J].食品工业,2018,39(7):92-96.GONG W J,ZHUO X Q,XU H L.Optimization of ultrasound -assisted extraction of collagen from Navodon septentionalis skin by response surface methodology[J].Food Industry,2018,39(7):92-96.
[13] 国家质量监督检验检疫总局.食品安全国家标准 肉与肉制品 羟脯氨酸含量测定:GB 9695.23-2008[S].北京:中国标准出版社,2008:1-4.General Administration of Quality Supervision,Inspection and Quarantine of the People’s Republic of China.National food safety standards of meat and meat products-determination of hydroxyproline content:GB 9695.23-2008[S].Beijing:China Standards Press,2008:1-4.
[14] 段宙位,申铉日,陈秀明,等.罗非鱼尾胶原蛋白的提取与鉴定[J].食品科学,2012,33(6):59-64.DUAN Z W,SHEN X R,CHEN X M,et al.Extraction and identification of collagen from tilapia tail[J].Food Science,2012,33(6):59-64.
[15] 温慧芳,陈丽丽,白春清,等.基于不同提取方法的鮰鱼皮胶原蛋白理化性质的比较研究[J].食品科学,2016,37(1):74-81.WEN H F,CHEN L L,BAI C Q,et al.Comparative study on physical and chemical properties of collagens obtained by different extraction methods from the skin of the Chinese longsnout catfish Leiocassis longirostris[J].Food Science,2016,37(1):74-81.
[16] HUANG Y R,SHIAU C Y,CHEN H H,et al.Isolation and characterization of acid and pepsinsolubilized collagens from the skin of balloon fish(Diodon holocanthus)[J].Food Hydrocolloids,2011,25(6):1507-1513.
[17] NOORZAI S,VERBEEK C J R,LAY M C,et al.Collagen extraction from various waste bovine hide sources[J].Waste and Biomass Valorization,2020,11(11):5687-5698.
[18] 王立宇,夏杨毅,赵鸾.碱发温度对毛肚胶原蛋白结构的影响[J/OL].食品工业科技:1-16[2022-01-11].https://kns.cnki.net/kcms/detail/11.1802.TS.2022 0104.1745.012.html.WANG L Y,XIA Y Y,ZHAO L.Study on the effect of processing temperatures on the structure of tripe collagen[J/OL].Science and Technology of Food Industry:1-16 [2022-01-11].https://kns.cnki.net/kcms/detail/11.1802.TS.20220104.1745.012.html.
[19] ZHANG Y,LIU W,LI G,et al.Isolation and partial characterization of pepsin -soluble collagen from the skin of grass carp(Ctenopharyngodon idella)[J].Food Chemistry,2007,103(3):906-912.
[20] 张建旭,王旭旭,孙一丹,等.电解水在小龙虾壳脱矿物质和蛋白质中的应用[J].中国食品学报,2021,21(1):157-165.ZHANG J X,WANG X X,SUN Y D,et al.The application of electrolyzed water in demineralization and deiproteinization of crayfish shell[J].Journal of Chinese Institute of Food Science and Technology,2021,21(1):157-165.
[21] 张强,黄鑫,符安卫,等.中华鳖裙边胶原蛋白的提取、鉴定及其理化性质[J].食品与发酵工业,2019,45(12):176-182.ZHANG Q,HUANG X,FU A W,et al.Extraction and characterization of collagens in Chinese sturgeon calipash[J].Food and Fermentation Industries,2019,45(12):176-182.
[22] 宫萱,包建强,黄可承,等.鱼骨胶原蛋白提取、纯化工艺及应用的研究进展[J/OL].食品与发酵工业:1-7[2022-01-24].https://kns.cnki.net/kcms/detail/11.1802.TS.20220104.1745.012.html.GONG X,BAO J Q,HUANG K C,et al.Progress on extraction,purification and application of fish bone collagen[J/OL].Food and Fermentation Industries:1-7 [2022-01-24].https://kns.cnki.net/kcms/detail/11.1802.TS.20220104.1745.012.html.
[23] ONG T Y,SHAIK M I,SARBON N M.Isolation and characterization of acid and pepsin soluble collagen extracted from sharpnose stingray(Dasyatis zugei)skin[J].Food Research,2021,5(3):214-224.
[24] 李根,任国艳,李倩,等.超声辅助提取鲵皮胶原蛋白工艺优化及结构特征分析[J].食品工业科技,2021,42(22):160-168.LI G,REN G Y,LI Q,et al.Optimization of ultrasound-assisted extraction and structural characteristics analysis of collagen from chinese giant salamander(Andrias davidianus)skin[J].Science and Technology of Food Industry,2021,42(22):160-168.
[25] 杨玲,赵燕,鲁亮,等.鲟鱼鱼皮胶原蛋白的提取及其理化性能分析[J].食品科学,2013,34(23):41-46.YANG L,ZHAO Y,LU L,et al.Isolation and characterization of collagens from the skin of sturgeon[J].Food Science,2013,34(23):41-46.
[26] CRUZ -LÓPEZ H,RODRÍGUEZ -MORALES S,ENRÍQUEZ-PAREDES L M,et al.Comparison of collagen characteristic from the skin and swim bladder of Gulf corvina(Cynoscion othonopterus)[J].Tissue and Cell,2021,72(3):101593.
[27] 张晓洁,张宇昊,马良,等.超声辅助提取兔皮胶原蛋白及其理化特性[J].食品与机械,2017,33(1):169-173.ZHAO X J,ZHANG Y H,MA L,et al.Ultrasound-assisted extraction and physicochemical characteristics of collagen from rabbit-skin[J].Food and Machinery,2017,33(1):169-173.
[28] LI P H,LU W C,CHAN Y J,et al.Extraction and characterization of collagen from sea cucumber(Holothuria cinerascens)and its potential application in moisturizing cosmetics [J].Aquaculture,2020,515:734590.
[29] 程波,吴洁,张玉蓉,等.酶法提取人工养殖鲟鱼皮中胶原蛋白的工艺研究[J].食品研究与开发,2009,30(3):1-4.CHENG B,WU J,ZHANG Y R,et al.Study on the extraction of collagen with enzyme from the skin of farmed sturgeon[J].Food Research and Development,2009,30(3):1-4.
[30] 乔从德,杨文轲,刘钦泽,等.红外光谱在高分子物理实验教学中的应用[J].化学教育(中英文),2021,42(14):47-50.QIAO C D,YANG W K,LIU Q Z,et al.Application of infrared spectroscopy in polymer physics experiment teaching[J].Chemical Education(Chinese and English),2021,42(14):47-50.
[31] CHEN J,LI J,LI Z,et al.Physicochemical and functional properties of type I collagens in red stingray(Dasyatis akajei)skin[J].Marine Drugs,2019,17(10):558-576.
[32] CHEN J,LI L,YI R,et al.Extraction and characterization of acid-soluble collagen from scales and skin of tilapia(Oreochromis niloticus)[J].LWT -Food Science and Technology,2016,66:453-459.
[33] 冯玲玲,冯进,李春阳.海蜇Ⅰ型胶原蛋白的提取及结构特性研究[J].食品工业科技,2021,42(7):15-21.FENG L L,FENG J,LI C Y.Extraction and structural characteristics of type I collagen from Rhopilema esculenta[J].Science and Technology of Food Industry,2021,42(7):15-21.
[34] SUN L,HOU H,LI B,et al.Characterization of acid-and pepsin-soluble collagen extracted from the skin of Nile tilapia(Oreochromis niloticus)[J].International Journal of Biological Macromolecules,2017,99:8-14.
[35] TERZI A,GALLO N,BETTINI S,et al.Sub-and supramolecular X-ray characterization of engineered tissues from equine tendon,bovine dermis,and fish skin type-I collagen[J].Macromolecular Bioscience,2020,20(5):e2000017.
[36] YL A,LY A,SW A,et al.Structural,functional,rheological,and biological properties of the swim bladder collagen extracted from grass carp(Ctenopharyngodon idella)[J].LWT -Food Science and Technology,2022,153:112518.
[37] YU X,J LI,YANG M,et al.Role of epigallocatechin gallate in collagen hydrogels modification based on physicochemical characterization and molecular docking[J].Food Chemistry,2021,360(3):130068.
[38] XU J,CHEN Z J,HAN D,et al.Structural and functional properties changes of β-conglycinin exposed to hydroxyl radical generating systems [J].Molecules,2017,22(11):1893.
[39] TANG Y,JIN S,LI X,et al.Physicochemical properties and biocompatibility evaluation of collagen from the skin of giant croaker(Nibea japonica)[J].Marine Drugs,2018,16(7):222.
[40] FARALIZADEH S,RAHIMABADI E Z,BAHRAMI S H,et al.Extraction,characterization and biocompatibility evaluation of collagen from silver carp(Hypophthalmichthys molitrix)skin by -product [J].Sustainable Chemistry and Pharmacy,2021,22:100454.
[41] 邹烨,蔡盼盼,王立,等.超声辅助酶法提取中华鳖裙边胶原蛋白及其热稳定性能[J].食品科学,2018,39(2):254-259.ZOU Y,CAI P P,WANG L,et al.Ultrasonic-assisted enzymatic extraction and thermal stability of collagen from softshelled turtle calipash[J].Food Science,2018,39(2):254-259.
[42] 王艳.草鱼皮胶原蛋白的提取、性质研究及膜性能表征[D].天津:天津科技大学,2014.WANG Y.Extraction and properties of collagen from grass carp skins and characterization of films[D].Tianjin:Tianjin University of Science and Technology,2014.
[43] CUI F X,XUE C H,LI Z J,et al.Characterization and subunit composition of collagen from the body wall of sea cucumber Stichopus japonicus[J].Food Chemistry,2007,99(3):1120-1125.
[44] SHAIK M I,JIA Y C,SARBON N M.Effect of ultrasound -assisted extraction on the extractability and physicochemical properties of acid and pepsin soluble collagen derived from Sharpnose stingray(Dasyatis zugei)skin[J].Biocatalysis and Agricultural Biotechnology,2021,38:102218.
[45] SHAN C,WANG W,LI Y,et al.Cross-linking and film-forming properties of transglutaminase-modified collagen fibers tailored by denaturation temperature[J].Food Chemistry,2018,271:527-535.
[46] YAN M,QIN S,LI B.Purification and structural aspects of type I collagen from walleye pollock(Theragra chalcogramma)skin[J].Journal of Aquatic Food Product Technology,2017,26(10):1166-1174.
[47] 张奇,唐春雪,丁克毅,等.光谱分析在改性胶原蛋白结构表征中的应用(Ⅱ)——X 射线衍射和核磁共振[J].中国皮革,2019,48(9):23-28.ZHANG Q,TANG C X,DING K Y,et al.Application of spectrum analysis on characterization of modified collagen's structure(Ⅱ)——XRD and NMR[J].China Leather,2019,48(9):23-28.
[48] 马帅.鲽鱼鱼皮胶原蛋白的提取及其理化和功能特性的研究[D].锦州:渤海大学,2017.MA S.Study on the extraction of flounder skin’s collagen and physicochemical and functional characterisitics[D].Jinzhou:Bohai University,2017.
[49] TAMILMOZHI S,VEERURAJ A,ARUMUGAM M.Isolation and characterization of acid and pepsinsolubilized collagen from the skin of sailfish(Istiophorus platypterus)[J].Food Research International,2013,54(2):1499-1505.