低聚半乳糖(Galactooligosaccharides,GOS)是人乳中含量较多的低聚糖[1],由半乳糖残基和末端葡萄糖通过β-糖苷键连接而成的低聚糖。目前的商业GOS 是含有大量单糖和双糖的混合低聚糖;不同供应商的GOS 的连接类型和聚合程度差异很大[2]。GOS 具有优良的益生功能,抵抗近端胃肠道消化的能力极强,能够促进双歧杆菌的定殖。人体摄入一定量的GOS 可以提高肠道吸收镁和铁元素的能力,在改善儿童缺铁性贫血方面具有积极作用[3]。此外,GOS 还具有降低龋齿发生率、促进脂质代谢、保护肝脏、预防结肠癌等功能[4-5]。
大部分双歧杆菌(Bifidobacterium)是从婴儿粪便中分离得到的,它是一种对人体肠道极其重要的微生物[6]。双歧杆菌不仅可以促进机体生长发育,抑制肿瘤和衰老,还可以调节肠道动态平衡,促进肠道屏障的完整性,减轻结肠炎症状,增强机体免疫力[7-11]。双歧杆菌可以分解各种饮食来源和宿主肠道内的碳水化合物,从而显著促进宿主的新陈代谢,这一特征不仅保证其在肠道中的定殖,而且通过交叉喂养策略为宿主和其它肠道微生物提供营养[12-13]。
双歧杆菌发酵GOS 的能力依赖于GOS 的聚合度和糖苷键类型。有研究证明双歧杆菌更加倾向于分解利用高聚合度的GOS[14]。Taskwan 等[15]分析双歧杆菌与乳酸菌利用的GOS 的情况,发现婴儿双歧杆菌M63 和婴儿双歧杆菌ATCC 15697 能够很好地利用短链低聚半乳糖(Short chain galacto-oligosaccharides,SC-GOS)。SC-GOS 可以调节肠道微生物组成,增加双歧杆菌的丰度,改善乳糖不耐受症[16]。Xiao 等[17]给小鼠喂食含2’-岩藻糖基乳糖、SC-GOS 和长链低聚果糖(Long chain fructo-oligosaccharides,LC-FOS)的混合物,发现小鼠的肠道微生物区系组成发生变化,并且代谢功能和免疫系统功能得到改善。有研究证实给婴儿食用SC-GOS、LC-FOS 与短双歧杆菌M-16V的混合物,可使其粪便变软,粪便中双歧杆菌的数量大大增加[18]。婴儿食用含有SC-GOS 和LC-FOS的婴配粉可以降低肠绞痛的发生率[19],预防轮状病毒引起的腹泻症状[20],促进婴儿的生长发育[21]。然而,目前有关利用SC-GOS 的双歧杆菌研究较少,菌株资源较为有限。
本课题组从婴儿粪便中分离得到126 株双歧杆菌,以SC-GOS 为唯一碳源,从中筛选高效利用SC-GOS 的双歧杆菌,结合基因测序技术确定其种属。评价胞外多糖含量、菌体表面蛋白含量、表面疏水性和自聚集能力、模拟胃液耐受能力、胆盐耐受能力以及上清液抑菌能力,以期获得高效利用SC-GOS 且益生特性优良的双歧杆菌菌株,为开发出含有GOS 和双歧杆菌的产品提供菌株资源。
1 材料与方法
1.1 微生物菌株
婴儿双歧杆菌M63(Bifidobacterium longum subsp.infantis M63,BI_M63)为实验室保藏菌种,婴儿双歧杆菌ATCC 15697(Bifidobacterium longum subsp.infantis ATCC 15697,BI_15697)及大肠杆菌ATCC 25922(Escherichia coli ATCC 25922,EC_25922)购自中国微生物菌种保藏中心。
1.2 主要材料与试剂
低聚半乳糖(GOS)、葡萄糖、乳糖,上海源叶生物科技有限公司;MRS 肉汤培养基,青岛海博生物公司;L-半胱氨酸盐酸盐(L-Cysteine HCl),德国BioFroxx 公司;猪胆盐,上海瑞永生物科技有限公司;胃蛋白酶,天津阿尔法生物科技有限公司;DNA 提取试剂盒Omega D4015-01,Omega Bio-Tek 公司
1.3 主要仪器与设备
CMax Plus 酶标仪,美谷分子仪器(上海)有限公司;SPL-150 生化培养箱,天津市莱玻特瑞仪器设备有限公司;ZWY-A2102C 恒温培养振荡器,上海智城分析仪器制造有限公司;TGL-23 离心机,四川蜀科仪器有限公司;BSC-1100-L ⅡA2生物安全柜,北京东联哈尔仪器制造有限公司。
1.4 培养基
还原液配制方法如下:10 g/L 细菌蛋白胨,5 g/L 氯化钠,0.5 g/L L-Cysteine HCl,1 mL/L 吐温80。121 ℃灭菌15 min。RB 琼脂培养基参照郭春峰[22]的方法配制,118 ℃灭菌15 min。MRSC 培养基配制方法如下:MRS 肉汤培养基添加0.5 g/L LCysteine HCl,加入15 g/L 琼脂制成MRSC 固体培养基,118 ℃灭菌15 min。无碳源MRSC 培养基配制方法如下:10 g/L 细菌蛋白胨、5 g/L 酵母浸粉、0.5 g/L L-Cysteine HCl、2 g/L 磷酸氢二钾、5 g/L无水乙酸钠、2 g/L 柠檬酸铵、0.2 g/L 七水硫酸镁、0.05 g/L 一水硫酸锰、1 mL/L 吐温80,118 ℃灭菌15 min。
不同碳源培养基配制方法如下:在上述无碳源MRSC 培养基中分别添加10 g/L 的P-GOS/GOS/葡萄糖/乳糖,118 ℃灭菌15 min。
1.5 试验方法
1.5.1 菌株活化 将课题组前期从婴儿粪便中筛选分离得到的126 株双歧杆菌菌株活化,即以1%接种量接种至MRSC 液体培养基,37 ℃厌氧培养24 h,传代18 h 备用。
1.5.2 SC-GOS 的制备 根据Taksawan 等[15]的方法制备SC-GOS。即将0.15 mg/mL GOS 加样到已装填好Sephadex G-25 凝胶(Sigma-Aldrich)的XK 16/100 柱(GE Healthcare Life Science)中,洗脱收集。以乳糖为对照,应用苯酚-硫酸法[23]确定GOS 和乳糖的出峰时间,收集GOS 和乳糖不重合部分,混合冻干得到SC-GOS,用于后续试验。利用基质辅助激光解析电离飞行时间质谱分析确定所得到SC-GOS 中不含有单糖和双糖。
1.5.3 可利用SC-GOS 的双歧杆菌筛选 取1 mL 上述1.5.1 节菌液离心(10 000×g,5 min,4℃),水洗沉淀并重悬制备菌悬液。分别取200 μL SC-GOS-培养基、GOS-培养基、葡萄糖-培养基、乳糖-培养基至96 孔板中,以1%接种量接种菌悬液,设置对照组(无碳源MRSC 培养基、SCGOS-培养基、GOS-培养基、葡萄糖-培养基、乳糖-培养基以及加菌的无碳源MRSC 培养基)。37℃厌氧培养,测定0,24,48 h 的OD595nm 值以确定能利用SC-GOS 的双歧杆菌。
1.5.4 利用SC-GOS 双歧杆菌的生物学鉴定 利用细菌基因组DNA 提取试剂盒Omega D4015-01提取细菌基因组DNA。根据郑慧娟等[24]的研究用双歧杆菌特异引物(Bif164-F:5’-GGGTGGTAATGCCGGATG-3’;Pbi R2:5’-GACCATGCACCACCTGTGAA-3’)对菌株DNA 进行扩增,1%琼脂糖凝胶电泳,送至上海生工生物科技有限公司测序。序列进行BLAST 比对分析,确定菌株种属。
1.5.5 利用SC-GOS 双歧杆菌形态观察取1 mL 上述1.5.1 节菌液离心(10 000×g,5 min,4℃),PBS 洗涤,应用孙明明等[25]方法处理。即用2.5%戊二醛处理12 h,乙醇系列脱水并冷冻干燥,应用钨灯丝扫描电子显微镜S-3400N 观察菌体形态。
1.5.6 益生特性分析
1.5.6.1 胞外多糖产量测定 取10 mL 上述1.5.1节菌液离心(6 000×g,10 min,4 ℃),将上清液与3倍体积乙醇混合,4 ℃沉淀16 h,用3.5 ku 透析袋透析,每8 h 换1 次水,透析48 h。用Alcian Blue法[26]测定胞外多糖产量。
1.5.6.2 菌体表面蛋白含量测定 取10 mL 上述1.5.1节菌液离心(6 000×g,10 min,4 ℃),PBS 洗2次,加入2 mL 5 mol/L LiCl,恒温振荡反应(200 r/min,1 h,37 ℃),离心(6 000×g,10 min,4 ℃),将上清液与2 倍体积冰丙酮混合,-20 ℃放置过夜。应用Bradford 法[27]测定菌体表面蛋白含量。
1.5.6.3 表面疏水性的测定 取3 mL 上述1.5.1节菌液,加入等体积二甲苯,恒温振荡反应(250 r/min,10 min,37 ℃),静置1 h。吸取水相测定波长595 nm 处的吸光度。重复进行3 次,取平均值。疏水性(H)计算公式:
式中,A0——0 h 吸光度;A1——不同时间吸光度。
1.5.6.4 自聚集能力的测定 取5 mL 上述1.5.1节菌液离心(4 500×g,15 min,4 ℃),PBS 缓冲液洗涤并重悬制备菌悬液,测定0,2,4,6 h 上述菌悬液在595 nm 下的吸光度。自聚集率(A)计算公式:
式中,A0——0 h 吸光度;At——不同时间吸光度。
1.5.6.5 模拟胃液耐受能力分析 取上述1.5.1节菌液按体积比1∶5 接种至pH 值为2.0 的人工胃液(胃蛋白酶10 g/L,加入盐酸溶液调节pH 值)中,37 ℃静置培养,分别在0 h、30 min、3 h 时菌落计数。1.5.6.6 胆盐耐受能力分析 取1 mL 上述1.5.1节菌液离心(10 000×g,5 min,4 ℃),洗涤菌体2次,重悬于含0.2%猪胆盐的MRSC 培养液中,37℃厌氧培养,分别在0 h 和30 min 时菌落计数。1.5.6.7 无细胞上清液抑菌能力测定 取5 mL上述1.5.1 节菌液离心(10 000×g,5 min,4 ℃),将上清液通过0.22 μm 的微孔滤膜。以EC_25922 为指示菌,应用牛津杯法[28]评估各菌株抑菌能力。
1.6 数据处理与分析
所有试验均独立进行3 次,结果以平均值±标准差(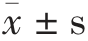 )表示。试验数据使用SPSS 软件进行沃勒-邓肯显著性分析,P<0.05,差异显著。使用Origin 8.0 和GraphPad Prism 8 进行绘图。
)表示。试验数据使用SPSS 软件进行沃勒-邓肯显著性分析,P<0.05,差异显著。使用Origin 8.0 和GraphPad Prism 8 进行绘图。
2 结果与分析
2.1 利用SC-GOS 的双歧杆菌筛选及16S rDNA 鉴定结果
Thomson 等[29]发现BI_15697 在0.5% GOS 上生长48 h 的OD595nm 在0.3 左右,本研究发现BI_15697 在1% SC-GOS 和GOS 培养基中生长48 h 的OD595nm 分别为0.25 和0.63,故以BI_15697和BI_M63 作为对照菌株,SC-GOS、GOS 作为筛选的标志物,共54 株利用SC-GOS 效果优于BI_15697。根据菌落形态、来源、镜检结果等,最终选择7 株利用SC-GOS 能力(OD595nm﹥0.80)远强于BI_15697(P<0.05)的双歧杆菌进行16S rDNA鉴定。鉴定结果显示,1 株长双歧杆菌婴儿亚种BI_Y46,2 株两歧双歧杆菌(BB_Y22、BB_S7),2株假小链双歧杆菌(BP_Y43、BP_YA)以及2 株长双歧杆菌(BL_S34、BL_H26)。双歧杆菌利用SCGOS 情况及发育树见图1,序列比对结果见表1。
表1 NCBI BLAST 比对结果
Table 1 NCBI BLAST comparison results

表2 各试验菌株自聚集能力(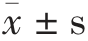 ,n=3)
,n=3)
Table 2 The self-aggregation ability of each experimental strain(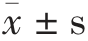 ,n=3)
,n=3)
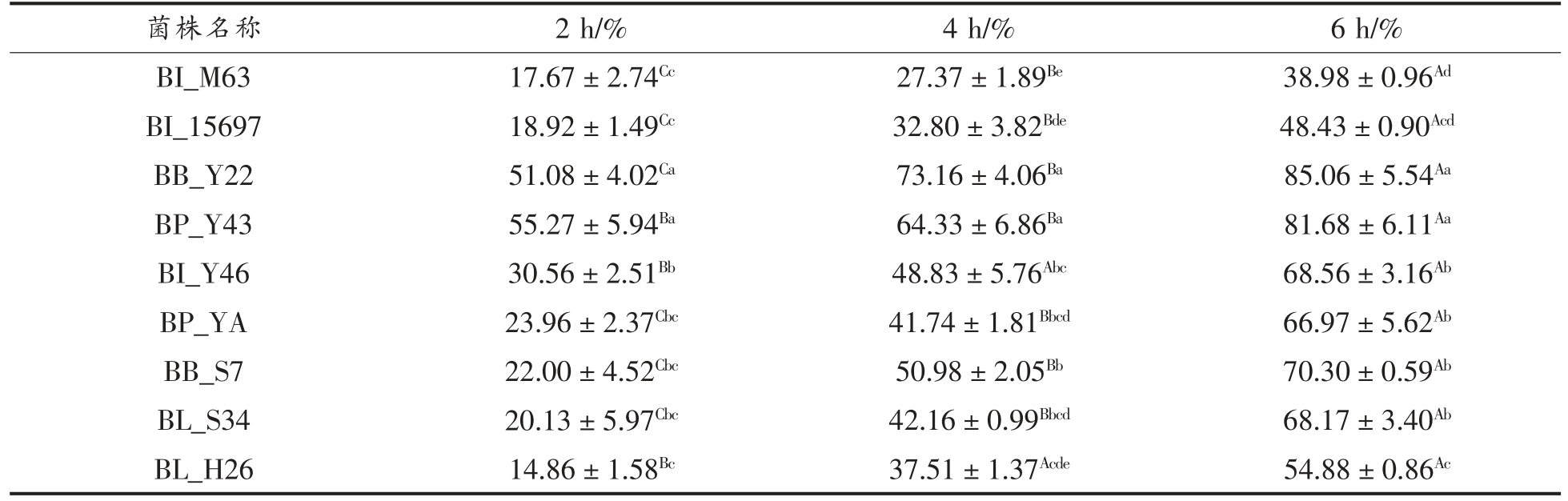
注:不同大写字母为同一菌株不同时间差异显著(P<0.05),不同小写字母为不同菌株同一时间差异显著(P<0.05)。
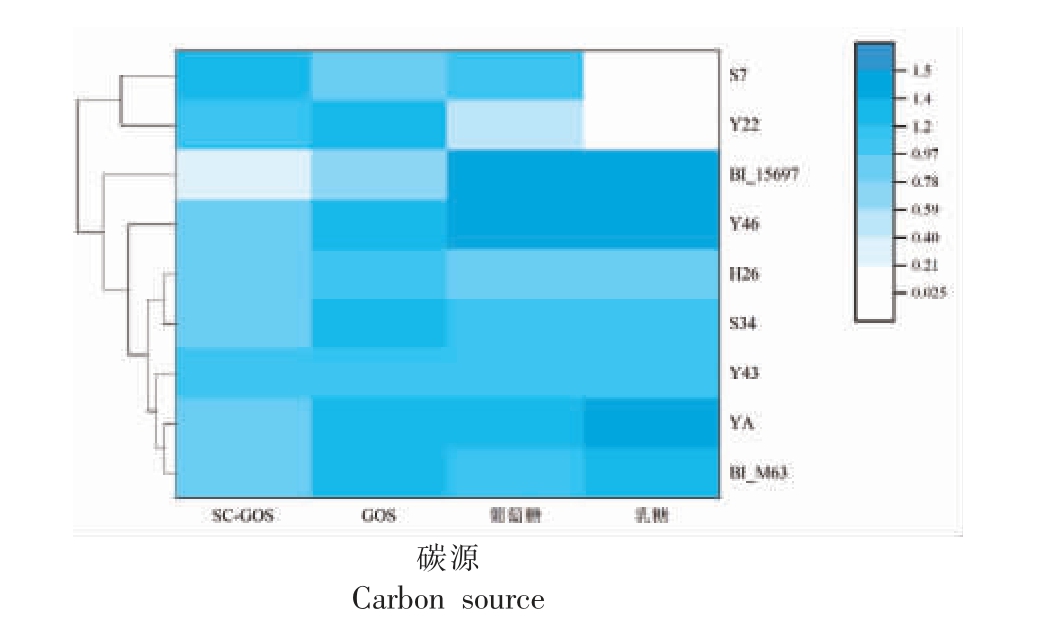
图1 碳源利用情况及系统发育树
Fig.1 Utilization of carbon sources and phylogenetic tree
2.2 扫描电镜观察双歧杆菌形态
扫描电镜观察菌株形态如图2 所示,BL_S34(f)和BL_H26(g)呈勺状;BP_YA(d)中含分叉结构;BB_Y22(a)为弯杆状、BP_Y43(b)和BB_S7(e)为长杆状,表面均较为光滑。值得注意的是,BI_Y46(c)具有独特的菌毛结构,Francesca 等[30]发现两歧双歧杆菌PRL2010 具有的菌毛结构有助于其黏附,并且具有免疫调节活性。短双歧杆菌UCC2003 中也存在菌毛结构,虽然短双歧杆菌UCC2003 不能单独利用3’-唾液酸乳糖或部分岩藻糖,但可以与两歧双歧杆菌PRL2010 共培养形成交叉喂养,发挥益生作用[31-32]。因此推断菌体表面存在菌毛的BI_Y46 可能具有较强黏附能力,同时具有抑制病原菌等功能,未来将通过更多试验进行验证。

图2 SEM 观察利用SC-GOS 的双歧杆菌形态图
Fig.2 Observation of Bifidobacterium morphology using SC-GOS by SEM
2.3 利用SC-GOS 的双歧杆菌胞外多糖产量
利用SC-GOS 的双歧杆菌胞外多糖产量见图3。其中,BB_Y22 胞外多糖产量最高,为(0.49±0.04)mg/mL,BI_Y46 以及BL_H26 胞外多糖产量在0.4~0.45 mg/mL 之间。目前针对高产胞外多糖的双歧杆菌研究较少,一般胞外多糖产量在几十到几百毫克每升不等,蔡静静等[33]分离得到双歧杆菌胞外多糖产量在0.4 mg/mL 左右,故BB_Y22、BP_Y43 属于产胞外多糖能力较强的菌株,为未来应用提供一定参考。
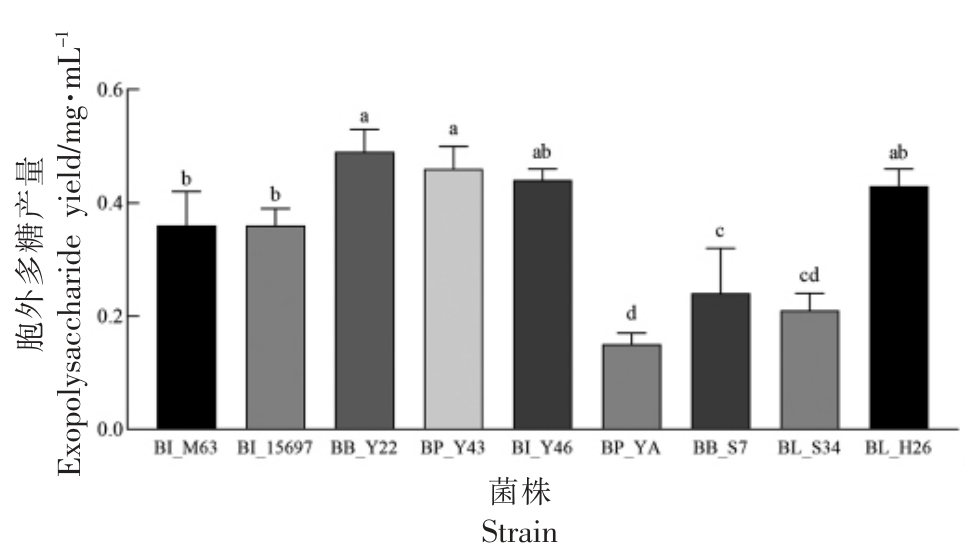
图3 利用SC-GOS 双歧杆菌的胞外多糖产量( ,n=3)
,n=3)
Fig.3 The exopolysaccharide yield of Bifidobacteria able to utilize SC-GOS( ,n=3)
,n=3)
注:不同小写字母表示差异显著(P<0.05),下同。
2.4 利用SC-GOS 的双歧杆菌菌体表面蛋白含量分析
表面蛋白可以延长益生菌在肠道发挥作用的时间[34],本试验测定菌体表面蛋白,为后续分析其具体成分或探讨其黏附功能及机制奠定基础。各试验菌株菌体表面蛋白含量见图4。结果表明,BL_H26 菌体表面蛋白含量较高,为(0.74±0.07)mg/mL(P<0.05),而BB_Y22、BB_S7、BL_S34 含量接近,均在0.35~0.45 mg/mL 范围;所有菌株表面蛋白含量均超过BI_15697。目前有关双歧杆菌菌体表面蛋白的报道不多,后续将对双歧杆菌的表面蛋白进一步分离,以探讨其的功能特性。
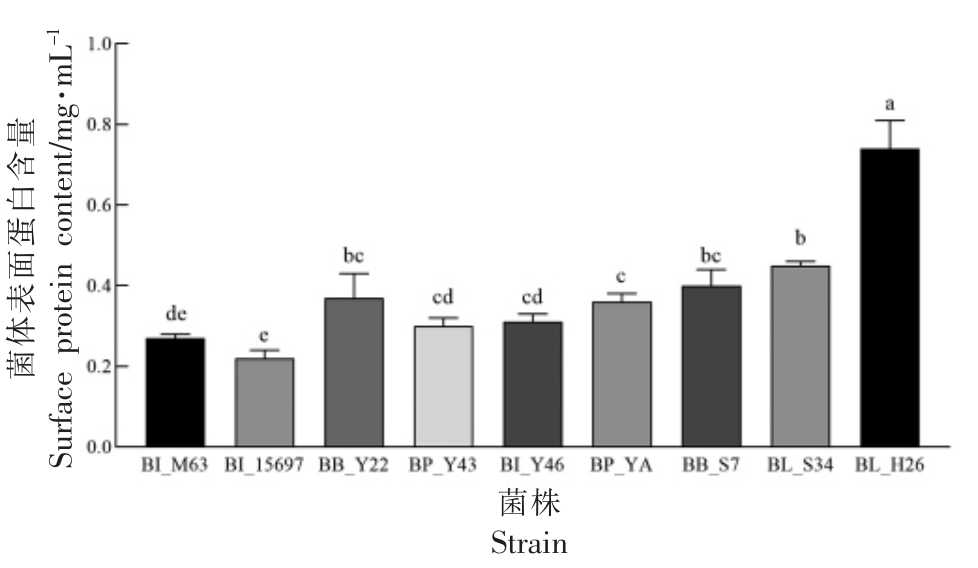
图4 利用SC-GOS 双歧杆菌菌体表面蛋白含量( ,n=3)
,n=3)
Fig.4 Surface protein content of Bifidobacteria able to utilize SC-GOS( ,n=3)
,n=3)
2.5 表面疏水性和自聚集能力
表面疏水性和自聚集能力与黏附能力密切相关,具有良好黏附能力的益生菌株可以抑制致病菌的侵袭[35]。以BI_M63 和BI_15697 作为对照,各试验菌株表面疏水性如图5 所示。结果表明,BP_Y43、BP_YA 表面疏水性为24.96%,24.90%,与BI_15697、BI_M63 的表面疏水性差异较小,而显著高于BI_Y46 和BL_H26(P<0.05);其余菌株如BB_Y22、BB_S7、BB_S34 表面疏水能力处于中等水平,均在15%左右,低于陈美瑄[36]筛选得到的双歧杆菌Probio-M9(50%),可能是由于处理条件不同导致的。
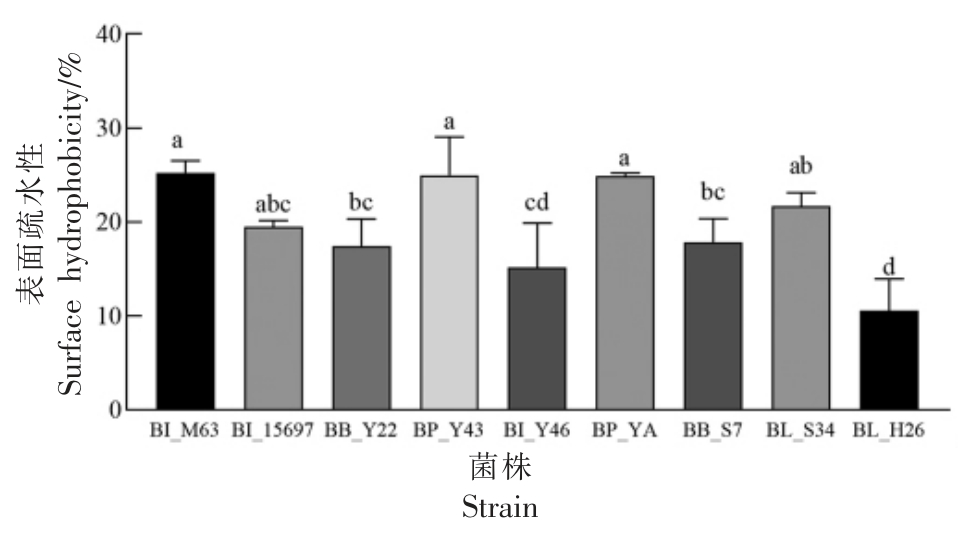
图5 各试验菌株表面疏水性(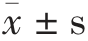 ,n=3)
,n=3)
Fig.5 Surface hydrophobicity of each experimental strain(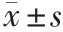 ,n=3)
,n=3)
自聚集试验表明,BB_Y22 和BP_Y43 整体自聚集能力较强,BL_H26 较弱。在2 h 时,BB_Y22和BP_Y43 的自聚集百分比分别为(51.08±4.02)%和(55.27±5.94)%,明显高于其它菌株(P<0.05),其余菌株与赵笑笑等[37]的研究基本一致,在10%~30%范围。在4 h 时,BB_Y22 高达(73.16±4.06)%,提高了20%左右,同时BP_Y43、BI_Y46、BP_YA、BB_S7 以及BL_S34 都有显著提升,而BI_M63 和BI_15697 变化较小,在4 h 时分别为(27.37±1.89)%和(32.80±3.82)%;在6 h 时,BB_Y22 和BP_Y43 达到了80%以上,远高于其它菌株(P<0.05),同时超过陈美瑄[36]筛选得到的双歧杆菌Probio-M8(58%)和Probio-M9(78%)。
2.6 利用SC-GOS 的双歧杆菌模拟胃液耐受情况分析
双歧杆菌为到达并稳定地定居在大肠,必须应对胃肠道上发生的大量氧化、渗透、胆盐或胃液应激挑战[38]。以BI_M63 和BI_15697 作为对照,各试验菌株在模拟胃液pH 2.0 时的耐受情况如表3 所示。处理30 min 与0 h 相比,BI_M63、BP_YA、BB_S7 菌落数量略微增长或持平,而其余菌株菌落数量减少,BI_15697 相对减少菌落数量最多(P<0.05);处理3 h 与0 h 相比,BI_15697 的存活率最低(P<0.05),BI_M63 菌落数量增加,这可能与应激反应产生的物质相关,即受到刺激后产生促进自身生长的物质。其余菌株存活率接近100%,说明菌株具有较强的胃液耐受性,所有筛选得到菌株在pH 2.0 模拟胃液刺激下的存活率高于胡鹏钰等[39]分离得到的两株双歧杆菌在pH 2.5 模拟胃液刺激下的存活率(73%,75%),较强胃液耐受菌株在今后产品中的应用具有广阔前景。
表3 菌株在模拟胃液(pH 2.0)耐受情况(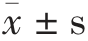 ,n=3)
,n=3)
Table 3 Simulated gastric juice tolerance of srtains at pH 2.0(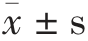 ,n=3)
,n=3)
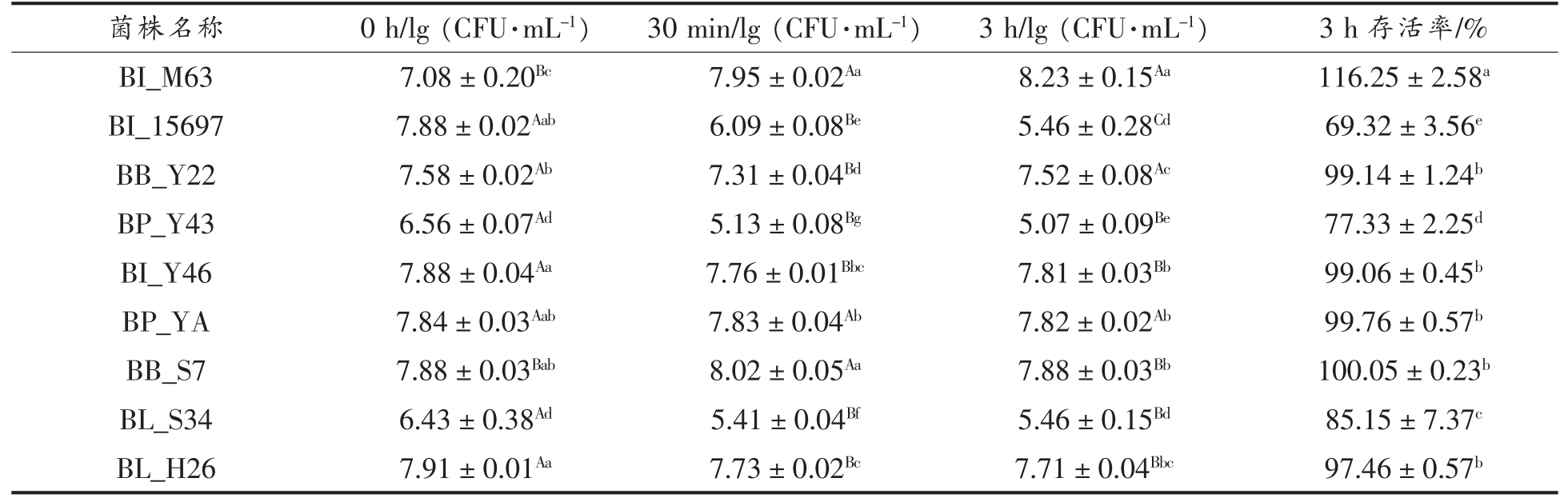
注:大写字母不同为同一菌株不同时间生长情况差异显著(P<0.05),小写字母不同为不同菌株同一时间以及3 h 存活率的差异显著(P<0.05)。
2.7 利用SC-GOS 的双歧杆菌胆盐耐受情况分析
潜在的益生菌要有较强的胆盐耐受能力,各试验菌株在0.2%猪胆盐处理30 min 时相较0 h的细菌数量减少情况如图6 所示。结果表明,在胆盐存在的条件下,所有菌株存活能力受到不同程度的影响,BP_Y43 的菌落数量减少5.5×108 CFU/mL,其余菌株菌落数量减少1.0×107 CFU/mL 左右(P<0.05)。这个结果表明除BP_Y43 外,其余试验菌株胆盐耐受性强(P<0.05)。黄巧芬[40]分离的长双歧杆菌NCU712 在0.3%猪胆盐刺激下,菌数减少了3.9×107 CFU/mL,可能是由于菌株不同和所用的胆盐不同,未来将进一步探讨0.3%胆盐下的耐受情况。
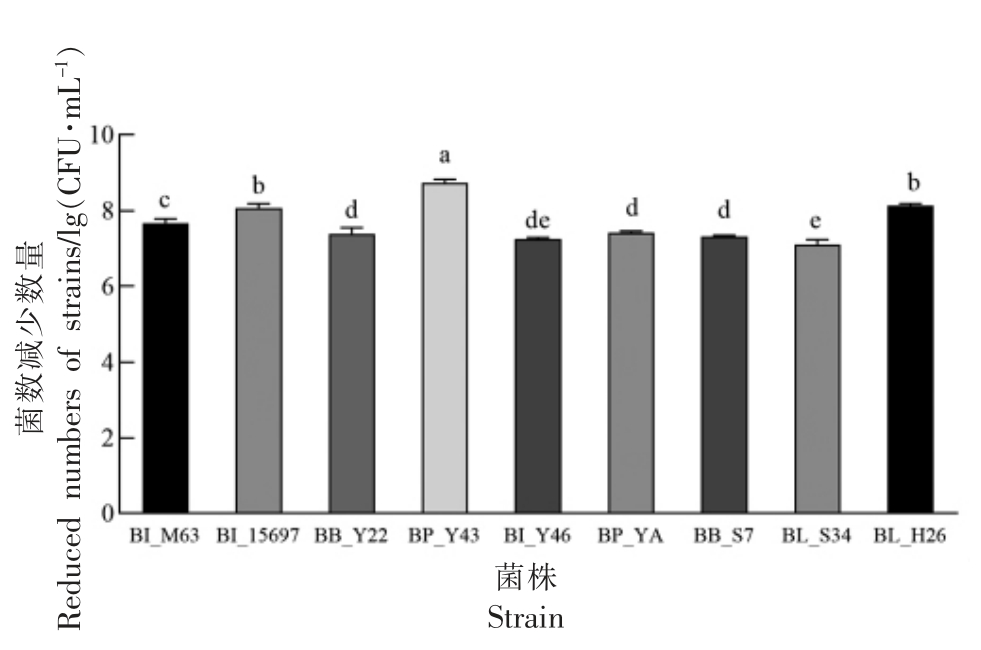
图6 胆盐耐受情况( ,n=3)
,n=3)
Fig.6 Bile salt tolerance( ,n=3)
,n=3)
2.8 利用SC-GOS 的双歧杆菌上清液抑菌能力评价
Delcaru 等[41]证实了双歧杆菌对大肠杆菌产生拮抗作用,目前已经提出了部分益生菌对致病菌产生拮抗作用的机制,如竞争排斥、宿主免疫调节等[42]。以无菌的MRSC 培养基作为对照,各试验菌株的上清液抑制EC_25922 能力见表4。结果表明,BI_15697 上清液没有抑菌效果;BP_Y43、BP_YA 抑菌效果较强,抑菌环直径分别为10.33 mm 和10.17 mm;BB_Y22、BL_S34、BL_H26 菌 株上清液抑菌能力强,抑菌环直径在11~12.5 mm 之间,而BI_M63、BI_Y46 以及BB_S7 上清液对大肠杆菌抑制作用更加明显,抑菌环直径可以达到12.5 mm 以上。
表4 菌株上清液对EC_25922 抑制作用(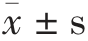 ,n=3)
,n=3)
Table 4 Inhibitory effect of strain supernatant on EC_25922(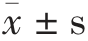 ,n=3)
,n=3)

注:牛津杯外径8 mm。-.没有抑菌作用;+.抑菌环直径8~9.5 mm;++.抑菌环直径9.5~11 mm;+++.抑菌环直径11~12.5 mm;++++.抑菌环直径>12.5 mm。
3 结论
从粪便样品中分离得到7 株高效利用SCGOS 的双歧杆菌,分别为两歧双歧杆菌BB_Y22和BB_S7、假小链双歧杆菌BP_Y43 和BP_YA、长双歧杆菌婴儿亚种BI_Y46 以及长双歧杆菌BL_S34、BL_H26。
观察形态并分析益生特性,发现BI_Y46 具有菌毛结构,蛋白含量较高,为(0.31±0.02)mg/mL,同时BI_Y46 上清液对EC_25922 的抑菌效果较强(P<0.05);BB_Y22 的胞外多糖产量最高,为(0.49±0.04)mg/mL,菌体表面蛋白含量为(0.37±0.06)mg/mL,具有较强表面疏水性和自聚集能力,还具有较强的胃液耐受性(P<0.05);BP_Y43 也同样具有较高胞外多糖产量和高菌体蛋白含量,表面疏水性与自聚集能力也较强,同时具有较强胆盐耐受能力,有利于其在肠道中的定殖(P<0.05)。
综上,本试验分离高效利用短链低聚半乳糖的双歧杆菌中,长双歧杆菌婴儿亚种BI_Y46、两歧双歧杆菌BB_Y22 以及假小链双歧杆菌BP_Y43 具有较好的益生潜力,为开发益生菌产品、婴儿配方乳粉提供一定的参考,也为后续研究提供菌株资源。
[1] 归莉琼,魏东芝.生物活性物质-低聚半乳糖[J].中国乳品工业,1998(4):9-12.GUI L Q,WEI D Z.Biologically active substance -Galactooligosaccharide[J].China Dairy Industry,1998(4):9-12.
[2] GÄNZLE G M.Enzymatic synthesis of galacto -oligosaccharides and other lactose derivatives(hetero-oligosaccharides)from lactose [J].International Dairy Journal,2012,22(2):116-122.
[3] CHEN J H,WANG Y Y,PAN J L,et al.Prebiotic oligosaccharides enhance iron absorption via modulation of protein expression and gut microbiota in a dose-response manner in iron-deficient growing rats[J].Molecular Nutrition &Food Research,2022,66(10):e2101064-e2101064.
[4] 贾建萍,裘娟萍.低聚半乳糖的研究进展[J].中国乳品工业,2003(1):23-26.JIA J P,QIU J P.Advance in the research of galactooligosaccharides[J].China Dairy Industry,2003(1):23-26.
[5] QAMAR T R,IQBAL S,SYED F,et al.Impact of novel prebiotic galacto-oligosaccharides on various biomarkers of colorectal cancer in wister rats[J].International Journal of Molecular Sciences,2017,18(9):1785.
[6] 胥振国,蔡玉华,刘修树,等.双歧杆菌研究进展及应用前景[J].中国生物制品学杂志,2017,30(2):215-220.XU Z G,CAI Y H,LIU X S,et al.Research progress and application prospect of Bifidobacterium[J].Chin J Biologicals February,2017,30(2):215-220.
[7] ZHANG M,ZHOU L,ZHANG S,et al.Bifidobacterium longum affects the methylation level of forkhead box P3 promoter in 2,4,6-trinitrobenzenesulphonic acid induced colitis in rats [J].Microbial Pathogenesis,2017,110(1):426-430.
[8] HIDALGO-CANTABRANA C,DELGADO S,RUIZ L,et al.Bifidobacteria and their health-promoting effects[J].Microbiol Spectr,2017,5(3):73-98.
[9] ALESSANDRI G,OSSIPRANDI M C,MACSHARRY J,et al.Bifidobacterial dialogue with its human host and consequent modulation of the immune system[J].Frontiers in Immunology,2019,10(2348):1-12.
[10] LORENA R,SUSANA D,PATRICIA R M,et al.Bifidobacteria and their molecular communication with the immune system[J].Frontiers in Microbiology,2017,8(2345):1-9.
[11] WANPING A,SHINJI F.Protective effects of Bifidobacteria against enteropathogens [J].Microbial Biotechnology,2019,12(6):1097-1100.
[12] QUINN E M,JOSHI L,HICKEY R M.Symposium review:Dairy-derived oligosaccharides -Their influence on host-microbe interactions in the gastrointestinal tract of infants[J].Journal of Dairy Science,2020,103(4):3816-3827.
[13] THOMSON P,MEDINA D A,GARRIDO D,et al.Human milk oligosaccharides and infant gut bifidobacteria:Molecular strategies for their utilization[J].Food Microbiology,2017,75(17):37-46.
[14] BGER M,LEEUWEN S,BUEREN A,et al.Structural identity of galactooligosaccharide molecules selectively utilized by single cultures of probiotic bacterial strains [J].Journal of Agricultural Food Chemistry,2019,67(50):13969-13977.
[15] TAKSAWAN T,HOEFLINGER J L,JOMAY C,et al.Prebiotic galactooligosaccharide metabolism by probiotic Lactobacilli and Bifidobacteria[J].Journal of Agricultural and Food Chemistry,2017,65(20):4184-4192.
[16] AZCARATE-PERIL M A,RITTER A,SAVAIANO D,et al.Impact of short-chain galactooligosaccharides on the gut microbiome of lactose-intolerant individuals[J].Proceedings of the National Academy of Sciences of the United States of America,2017,114(3):E367-E375.
[17] XIAO L,ENGEN P A,LEUSINK M,et al.The combination of 2' -fucosyllactose with short -chain galacto -oligosaccharides and long -chain fructo -oligosaccharides that enhance influenza vaccine responses is associated with mucosal immune regulation in mice[J].The Journal of Nutrition,2019,149(5):856-869.
[18] KOSUWON P,LAO -ARAYA M,UTHAISANGSOOK S,et al.A synbiotic mixture of scGOS/lcFOS and Bifidobacterium breve M-16V increases faecal Bifidobacterium in healthy young children[J].Benef Microbes.2018,9(4):541-552.
[19] VANDENPLAS Y,THOMAS L,HETTY B,et al.Randomised controlled trial demonstrates that fermented infant formula with short -chain galacto -oligosaccharides and long-chain fructo-oligosaccharides reduces the incidence of infantile colic[J].Acta Paediatrica(Oslo,Norway:1992),2017,106(7):1150-1158.
[20] AZAGRA-BORONAT I,MASSOT-CLADERA M,KNIPPING K,et al.Supplementation with 2′-FL and scGOS/lcFOS ameliorates rotavirus-induced diarrhea in suckling rats[J].Frontiers in Cellular and Infection Microbiology,2018,8(23):372.
[21] HUET F,ABRAHAMSE-BERKEVELD M,TIMS S,et al.Partly fermented infant formulae with specific oligosaccharides support adequate infant growth and are well-tolerated[J].Journal of Pediatric Gastroenterology &Nutrition,2016,63(4):e43-e53.
[22] 郭春锋.人源性益生菌降胆固醇机制及影响因素研究[D].哈尔滨:哈尔滨工业大学,2011.GUO C F.Study on mechanisms and influencing factors of cholesterol-lowering function of human origin probiotics [D].Harbin:Harbin Institute of Technology,2011.
[23] TATSUYA M,AKIO M,NORIMASA I,et al.Carbohydrate analysis by a phenol-sulfuric acid method in microplate format [J].Analytical Biochemistry,2005,339(1):69-72.
[24] 郑慧娟,白晓晔,高旭,等.双歧杆菌属特异性测序引物筛选及优化[J].微生物学通报,2019,46(7):1736-1747.ZHENG H J,BAI X Y,GAO X,et al.Screcning and optimization of Bifidobacterium -specific sequencing primers[J].Microbiology China,2019,46(7):1736-1747.
[25] 孙明明,吕世翔,李智媛,等.大豆菌核病菌丝侵染茎叶过程扫描电镜观察研究[J].大豆科学,2020,39(1):123-129.SUN M M,LÜ S X,LI Z Y,et al.Study of scanning electron microscopic observation on the mycelium infection process of soybean Sclerotinia sclerotirum on leaf and stem[J].Soybean Science,2020,39(1):123-129.
[26] ZHANG L L,CHICHLOWSKI M,GROSS G,et al.Milk fat globule membrane protects Lactobacillus rhamnosus GG from bile stress by regulating exopolysaccharide production and biofilm formation[J].Journal of Agricultural and Food Chemistry,2020,68(24):6646-6655.
[27] BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein -dye binding [J].Analytical Biochemistry,1976,72(1/2):248-254.
[28] 王毅超.肠源益生性抑菌乳酸菌的分离筛选及其抑菌物质的研究[D].哈尔滨:东北农业大学,2019.WANG Y C.Screening of beneficial bacteriostatic lactic acid bacteria from intestine and study on bacteriostatic substances[D].Harbin:Northeast Agricultural University,2019.
[29] THOMSON P,MEDINA D A,GARRIDO D.Human milk oligosaccharides and infant gut bifidobacteria:Molecular strategies for their utilization [J].Food Microbiol,2018,75(14):37-46.
[30] FRANCESCA T,FAUSTA S,ELENA F,et al.Role of sortase-dependent pili of Bifidobacterium bifidum PRL2010 in modulating bacterium-host interactions[J].Proceedings of the National Academy of Sciences of the United States of America,2013,110(27):11151-11156.
[31] EGAN M,O'CONNELL M,VENTURA M,et al.Metabolism of sialic acid by Bifidobacterium breve UCC2003[J].Applied and Environmental Microbiology,2014,80(14):4414-4426.
[32] MOTHERWAY M O C,O'BRIEN F,O'DRISCO L L T,et al.Carbohydrate syntrophy enhances the establishment of Bifidobacterium breve UCC2003 in the neonatal gut [J].Scientific Reports,2018,8(10):10623-10633.
[33] 蔡静静,徐晓裕,张艳,等.新疆维吾尔族肠道中高产胞外多糖双歧杆菌的筛选及其抗氧化活性[J].食品科学,2020,41(8):144-151.CAI J J,XU X Y,ZHANG Y,et al.Screening for and antioxidant activities of high exopolysaccharide-producing Bifidobacterium from the intestinal tract of uygur infants and their mothers in Xinjiang[J].Food Science,2020,41(8):144-151.
[34] 孟珺.乳杆菌表层蛋白的理化性质和生物学功能研究[D].无锡:江南大学,2016.MENG J.Study of the physicochemical properties and biological functions of Lactobacillus surface layer proteins[D].Wuxi:Jiangnan University,2016.
[35] 张汝京.具有潜在益生性的乳酸菌的筛选及其拮抗沙门氏菌黏附Caco-2 细胞的机理研究[D].南京:南京农业大学,2019.ZHANG R J.Screening of lactic acid bacteria with potential probiotics and study on the mechanism of anti-salmonella adhesion to Caco-2 cells[D].Nanjing:Nanjing Agricultural University,2019.
[36] 陈美瑄.母乳中益生乳杆菌和双歧杆菌的初步筛选及特性研究[D].呼和浩特:内蒙古农业大学,2020.CHEN M X.Preliminary screening and characterization of probiotic Lactobacillus and Bifidobacterium isolated from human breast milk[D].Hohhot:Inner Mongolia Agricultural University,2020.
[37] 赵笑笑,王光强,夏永军,等.婴幼儿粪便中双歧杆菌的分离及其菌株特性研究[J].工业微生物,2019,49(2):1-6.ZHAO X X,WANG G Q,XIA Y J,et al.Screening and characteristics of Bifidobacteria from infant feces[J].Industrial Microbiology,2019,49(2):1-6.
[38] GIULIA A,DOUWE V S,MARCO V.The genus Bifidobacterium:From genomics to functionality of an important component of the mammalian gut microbiota running title:Bifidobacterial adaptation to and interaction with the host[J].Computational and Structural Biotechnology Journal,2021,19(3):1472-1487.
[39] 胡鹏钰,于俊娟,王鹏,等.母乳来源益生菌的筛选及潜在益生特性研究[J].食品与发酵工业,2021,47(14):190-195.HU P Y,YU J J,WANG P,et al.Screening of probiotics from breast milk and its potential probiotic characteristics[J].Food and Fermentation Industries,2021,47(14):190-195.
[40] 黄巧芬.优良双歧杆菌的筛选及其生理功能研究[D].南昌:南昌大学,2014.HUANG Q F.Screening and physiological function of Bifidobacteria[D].Nanchang:Nanchang University,2014.
[41] DELCARU C,ALEXANDRU I,PODGOREANU P,et al.Antagonistic activities of some Bifidobacterium sp.strains isolated from resident infant gastrointestinal microbiota on Gram-negative enteric pathogens[J].Anaerobe,2016,39(2):39-44.
[42] 赵梓雯,杨虹.短双歧杆菌对鼠伤寒沙门氏菌的抑制[J].微生物学通报,2019,46(10):2673-2688.ZHAO Z W,YANG H.Inhibition of Salmonella typhimurium by Bifidobacterium breve[J].Microbiology China,2019,46(10):2673-2688.