毛豆(Glycine max(L.)Merr)又称菜用大豆,豆荚呈嫩绿色,籽粒饱满,富含蛋白质、维生素等成分,营养价值高,是一种重要的豆类蔬菜[1-2]。毛豆采收期集中在高温、高湿的8~10 月,因其含水量大,生理代谢旺盛,故采后极易出现失水、腐烂、黄化、褐变等现象,从而降低毛豆的食用品质和商品价值[3]。色泽是消费者衡量果蔬品质变化的重要指标,果蔬贮藏过程中色泽由绿到黄的变化主要是由叶绿素降解引起的[4]。叶绿素降解往往伴随类胡萝卜素的生成,使果蔬表面的绿色减少,同时显现出红、橙、黄等颜色[5]。当叶绿素降解时,叶绿素a(Chlorophyll a,Chl a)首先在叶绿素酶(Chlorophyllase,CLH)的催化作用下发生脱植基反应,然后进行脱镁反应生成脱镁叶绿酸a,其在脱镁叶绿酸a 加氧酶(Pheophorbide a oxygenase,PAO)和红色叶绿素代谢产物还原酶(Red chlorophyll catabolite reductase,RCC)催化下转化成初生荧光叶绿素代谢产物(Primary fluorescent chlorophyll catabolites,pFCC),pFCC 发生非酶学的异构化形成非荧光叶绿素代谢产物(Nonfluorescent chlorophyll catabolites,NCC),从绿色降解成无色化合物,最终完成叶绿素降解[6-8]。王军萍等[9]研究发现通过抑制叶绿素降解相关酶活性,可以有效抑制西兰花叶绿素降解和黄化。据研究,毛豆在贮藏期间豆荚的黄化现象可能是由叶绿素降解引起的[10-11]。因此,寻找一种合适的贮藏方式来抑制毛豆荚叶绿素降解、控制黄化现象具有重要意义。
气调保鲜主要通过调节贮藏过程中CO2 和O2比例以及温、湿度,抑制果蔬呼吸作用、乙烯生成等生理代谢过程,从而延缓果蔬成熟、衰老和褐变,维持其贮藏品质,保持较好的色泽[12-13]。由于气调具备安全、环保等优点,因此近年来被广泛用于果蔬保鲜。王利斌等[14]研究发现:与冷藏相比气调能够保持四季豆较高的叶绿素含量,有利于贮藏期品质的保持,延长货架期。类似地,孙志文等[15]发现,在固定50% O2 的前提下,40% CO2 能够有效延缓西兰花叶绿素的降解;而CO2 体积分数过高易造成西兰花无氧呼吸生成乙醇、乙醛等物质,过低的CO2 会加速叶绿素降解,均可导致西兰花黄化。此外,马阳历等[16]发现高O2 处理能够提高西兰花叶绿素降解酶基因的表达,进一步加快叶绿素降解,引起西兰花黄化加速。值得注意的是:不同果蔬在气调贮藏过程中所需的CO2 和O2 比例不同,即使相同的气体环境也可能对果蔬品质和色泽有不同影响。
气调贮藏过程中最佳的气体组合范围是1%~5% O2 与适当CO2 配比[17]。本研究固定5% O2,探究不同体积分数CO2 对毛豆贮藏过程中叶绿素降解的影响,确定一个较佳的气调条件,旨在为毛豆贮藏过程中品质及色泽控制提供理论依据。
1 材料与方法
1.1 材料与试剂
毛豆品种为“台湾64 号”,购于绿康配送农产品有限公司。挑选新鲜、大小一致、无病虫害、无机械损伤的毛豆。
无水乙醇、丙酮、无水乙醚(分析纯级),上海凌峰化学试剂有限公司;乙酸乙酯、甲醇(色谱纯级),上海麦克林生化科技有限公司;叶绿素a、b标准品,上海阿拉丁试剂有限公司。
1.2 仪器与设备
Cintra404 紫外分光光度计,澳大利亚GBC 公司;Waters e2695 分析型高效液相色谱仪,美国Waters 公司;YS-XCAB/G401-03 型果蔬气调实验设备,杭州屹石科技有限公司;CR410 手持色差仪,日本SEMSING 公司;XMTD-8222 水浴锅,上海精宏实验设备有限公司;Bifugo stratos 高速冷冻离心机,美国Thermo 公司;H7650-TEM 电子显微镜,日立高新技术公司。
1.3 试验方法
1.3.1 处理方法 根据预试验固定5% O2,将新鲜毛豆分别置于1)5% O2+4% CO2;2)5% O2+8%CO2;3)5% O2+12% CO2 的气体环境中贮藏,以自然空气处理作为对照组。调节气调箱温度(4 ±1)℃,湿度85%~90%。贮藏期间每4 d 取样1 次,每组随机取210 g 毛豆测定色泽等品质指标;同时分离毛豆荚和毛豆仁,液氮速冻后,冻存于-80 ℃冰箱,用于后续相关指标测定。试验设置3 个生物学重复。
1.3.2 测定指标和方法
1.3.2.1 色泽 参考卢瑞雪等[18]的方法,使用手持色差仪测定毛豆荚a*、b*值,每个处理组取20 个毛豆,每个毛豆随机测4 个点,取平均值。
1.3.2.2 叶绿素含量 参考严锐等[19]的方法,称取研磨成粉的毛豆荚样品0.5 g,加入5 mL 丙酮-乙醇(体积比2∶1)溶液,4 ℃避光浸提3 h,过滤取上清液分别于波长663 nm 和645 nm 处测定吸光度,用体积分数2∶1 的丙酮-乙醇溶液调零。
1.3.2.3 叶绿素酶(CLH)活性的测定 参考Keiji等[20]的方法提取酶液,并略作修改。称取液氮研磨成粉的毛豆荚样品2.0 g,加入10 mL -20 ℃预冷的丙酮,浸泡残渣直至无色,残渣于4 ℃放置过夜,加5 mL 50 mmol/L 磷酸缓冲液(pH 7.0,含50 mmol/L KCl 和2.4 g/L Triton X-100),4 ℃条件下浸 提1 h 后,4 ℃、12 000 r/min 条件下离心15 min,上清液即为粗酶提取液。
底物叶绿素a 丙酮溶液的制备方法如下:参考宋小青等[21]的方法。称取20.0 g 菠菜,加入100 mL 的预冷丙酮,冰浴研磨匀浆,真空抽滤,向滤液加入1/7 体积的杂环己烷,边振荡边缓慢加入1/6体积的蒸馏水。0.5 h 后,于4 ℃、10 000 r/min 条件下离心20 min,弃上清,向沉淀中加入30 mL 混合溶液(V丙酮∶V杂环己烷∶V蒸馏水=20∶3∶7)。静置1 h 后,再次离心上清液,沉淀用丙酮溶解,于-30 ℃避光保存。
酶活性的测定方法如下:参考Aiamla-Or 等[22]的方法,略有修改。反应体系包括:0.1 mL 0.1 μmol/mL 叶绿素a 丙酮溶液,0.5 mL 100 mmol/L Tris-HCl 缓冲液(pH 8.5),0.5 mL 叶绿素酶提取液(蒸馏水作为空白),充分混匀,黑暗条件下50℃恒温水浴1 h,不断地搅拌。加入4 mL 预冷丙酮结束反应,再加入4 mL 正己烷,剧烈摇动,静置分层后取下层丙酮层测定波长667 nm 处的吸光度值,以每克毛豆鲜样每小时变化1 个吸光度值为U,结果以U/g 表示。
1.3.2.4 脱镁螯合酶(MDCase)活性的测定 酶液提取方法同1.3.2.3 节叶绿素酶的提取方法。
底物叶绿酸a 溶液的制备方法如下:参考Balschun 等[23]的方法略有改动。取4.5 mL 8.0 μg/mL 叶绿素a 丙酮溶液,加入1.12 mL 蒸馏水,再加入8.4 mL 石油醚剧烈摇动。弃去下层水相,用4.2 mL 蒸馏水洗涤上层醚相3 次,然后加入50 μL 30% KOH(甲醇溶解),脱镁叶绿酸a 开始沉淀,离心后将沉淀溶于10 mL 蒸馏水中,并用1 mol/L Tris-HCl 调节pH 值至9.0,即得底物叶绿酸a 溶液。
酶活性测定参考Kaewsuksaeng 等[24]的方法。反应体系包含:1.6 mL 50 mmol/L Tris-HCl(pH 9.0,含0.1% Triton X-100),200 μL 叶绿酸a 溶液和400 μL 酶液,混合均匀,在25 ℃避光条件下反应30 min,于波长687 nm 处测定溶液吸光度值,以每克毛豆鲜样每小时变化1 个吸光度值为U,结果以U/g 表示。
1.3.2.5 脱镁叶绿素酶(PPH)活性的测定 酶液提取参考范林林等[25]的方法。称取液氮研磨成粉的毛豆荚2.0 g,加入10 mL -20 ℃预冷丙酮,浸泡残渣直至无色,残渣于4 ℃放置过夜,加入10 mL 50 mmol/L 磷酸钠缓冲液(pH 8.0),4 ℃条件下浸提1 h,于4 ℃、12 000 r/min 条件下离心15 min,上清液即为酶提取液。
底物制备方法如下:取10 mL 89.29 μg/mL 叶绿素a 丙酮溶液加入0.1 mol/L HCl 溶液,反应2 min 后加入0.1 mol/L NaOH 溶液中和多余的酸,以此作为脱镁叶绿素酶的底物溶液。
酶活测定参考Schelbert 等[26]方法略作修改。反应体系包含:0.5 mL 50 mmol/L Tris-HCl(pH 8.0),150 μL 脱镁叶绿素a 丙酮溶液和500 μL 酶液。混合物于25 ℃培养40 min,加入2 mL 丙酮终止反应。在波长667 nm 处测定吸光值,以每克毛豆鲜样每小时变化1 个吸光度值为U,结果以U/g表示。
1.3.2.6 叶绿素衍生物含量HPLC 分析 脱镁叶绿素a/b 溶液制备:在3 mL 500 μg/mL 叶绿素a/b丙酮溶液中分别加入30 μL 1 mol/L 盐酸;脱植基叶绿素a 溶液制备参考Chen 等[27]的方法,20 g 橙皮研磨后丙酮浸提脱色,残渣中加入测定CLH 酶的提取液,离心后上清液加无水硫酸铵析出酶蛋白,将蛋白溶于100 mmol/L pH 7.0 磷酸缓冲液中,加入1 mL 150 μg/mL 叶绿素a 丙酮溶液,和5 mL 100 mmol/L Tris-HCl 缓冲液(pH 8.0),37 ℃恒温振荡1 h;脱镁叶绿酸a 溶液制备:500 μL 脱植基叶绿素a 加入30 μL 浓盐酸振荡混匀。以上制备液均用乙醚萃取后纯净水洗涤4 次,氮吹干后溶于1 mL -20 ℃预冷丙酮,0.22 μm 有机滤膜过滤后,HPLC 分析测定。
叶绿素衍生物含量测定参考朱玲玲[28]的方法,称取4 g 毛豆荚,用20 mL 预冷丙酮于4 ℃超声提取20 min,静置30 min 至组织无色,过滤。将上清液转移至分液漏斗中,加入10 mL 10% NaCl和20 mL 无水乙醚,剧烈振荡后静置3 min 分层,弃下层,乙醚相中加超纯水洗涤(重复3 次),加无水硫酸钠后氮吹干,溶于1 mL 丙酮溶液,0.22 μm 有机滤膜过滤,HPLC 分析测定。
液相色谱条件参考张丽华[29]的方法,流动相A:V甲醇(色谱级)∶V超纯水=3∶1 混合溶液,流动相B:色谱级乙酸乙酯,柱温35 ℃,检测波长430 nm,进样量20 μL。
1.3.2.7 叶绿体超微结构观察 参考Cheng 等[30]的方法,将对照组和8% CO2 处理组贮藏0 d 和24 d 的毛豆荚切成1 mm×2 mm 的小块,在4 ℃下用2.5%戊二醛固定过夜,0.1 mol/L 磷酸盐缓冲液洗涤(pH 7.0)用0.1 mol/L 四氧化锇(OsO4)固定3 h,乙醇(50%,70%,80%,90%,95%,100%)梯度脱水,100% 丙酮脱水。样品嵌入Spur 树脂(SpiChem,Spur,PA)中包埋24 h。超微切割机切片后用碱性柠檬酸铅和醋酸铀酰染色,使用H7650-TEM 电子显微镜观察和记录图像。
1.4 数据统计分析
数据统计和整理采用Excel 2010 软件,采用IBM SPSS 22.0 软件显著性分析(P<0.05),Graph-Pad Prism 8 软件进行图表绘制。
2 结果与分析
2.1 气调贮藏对毛豆荚色泽的影响
a*、b* 值分别代表果蔬色泽的红绿和蓝黄水平,a*值越大表明绿色越弱,b*值越大表明黄化程度越严重[31]。如图1a 所示,贮藏过程中毛豆荚a*值逐渐增大,贮藏第8 天开始气调组a*值显著地低于对照组(P<0.05);贮藏20 天时,对照组a* 值比4% CO2、8% CO2 及12% CO2 组分别高8.48%,39.12%,31.81%,说明8% CO2 和12%CO2 贮藏组能够更好的抑制毛豆荚贮藏期间绿色的减弱。如图1b 所示,b*值在贮藏过程中整体呈先上升后下降的趋势,可能是因为贮藏后期毛豆荚发生褐变,所以b*值开始下降。贮藏后期气调组b*值显著低于对照组(P<0.05)。综上,气调贮藏能够有效延缓毛豆荚的黄化,达到较好的保绿效果,5% O2+8% CO2 贮藏组效果最佳,5% O2+12% CO2 贮藏组次之。
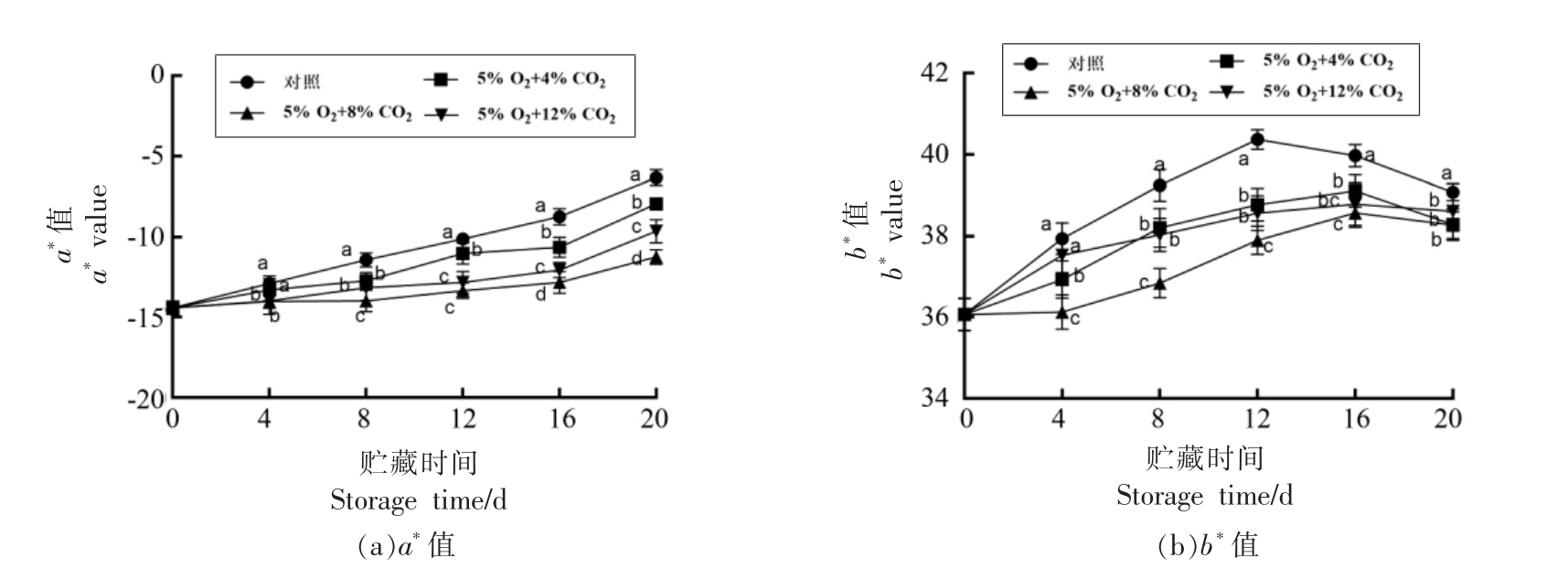
图1 气调贮藏对毛豆荚色泽的影响
Fig.1 Effects of controlled atmosphere storage on the color of soybeans
注:不同小写字母表示不同贮藏组间差异显著(P<0.05),下同。
2.2 气调贮藏对毛豆荚叶绿素含量的影响
毛豆采后贮藏过程中色泽的变化与叶绿素含量密切相关[32]。如图2a 所示,毛豆在贮藏过程中叶绿素含量随贮藏时间逐渐下降,其中对照组下降最为迅速,贮藏20 d 时其叶绿素含量下降了49.83%;气调贮藏组能够显著延缓叶绿素含量的下降(P<0.05),其中5% O2+8% CO2 贮藏组保持较高的叶绿素含量。

图2 气调贮藏对毛豆荚叶绿素含量的影响
Fig.2 Effects of controlled atmosphere storage on the chlorophyll concent of soybeans
叶绿素含量是由叶绿素a 和叶绿素b 含量共同决定。由图2b 和2c 可知,毛豆贮藏期间叶绿素a 和叶绿素b 含量均逐渐下降,对照组叶绿素a/b含量均显著低于气调贮藏组(P<0.05),其中5%O2+8% CO2 贮藏组维持了较高的叶绿素a/b 含量,贮藏20 天时其含量最高分别为40.32 μg/g 和20.37 μg/g,12% CO2 贮藏组次之,而对照组含量仅30.61 μg/g 和11.00 μg/g,提示5% O2+8% CO2贮藏组能够显著抑制毛豆贮藏期间叶绿素的降解(P<0.05),维持较高的叶绿素含量,保持较好的色泽与品质。与5% O2+8% CO2 贮藏组相比,4%和12% CO2 贮藏组加速了叶绿素的降解,CO2 体积分数过高或过低都会导致叶绿素降解,从而使毛豆出现黄化现象[15]。
2.3 气调贮藏对毛豆荚叶绿素降解酶活性的影响
CLH 是果实成熟过程中的分解酶,也是叶绿素降解的限速酶,能够催化叶绿素降解生成脱脂基叶绿素[33]。如图3a 所示,贮藏过程中,毛豆荚CLH 活性整体呈先上升后下降的趋势,对照组保持较高的CLH 活性,贮藏20 天时对照组CLH 活性最高为0.87 U/g,4% CO2 和12% CO2 贮藏组活性分别为0.74 U/g 和0.63 U/g,5% O2+8%CO2 贮藏组CLH 活性最低为0.50 U/g 相比对照下降了42.53%。因此,与4% CO2 和12% CO2 贮藏组相比,5% O2+8%CO2 贮藏组能够显著地抑制CLH活性(P<0.05)。
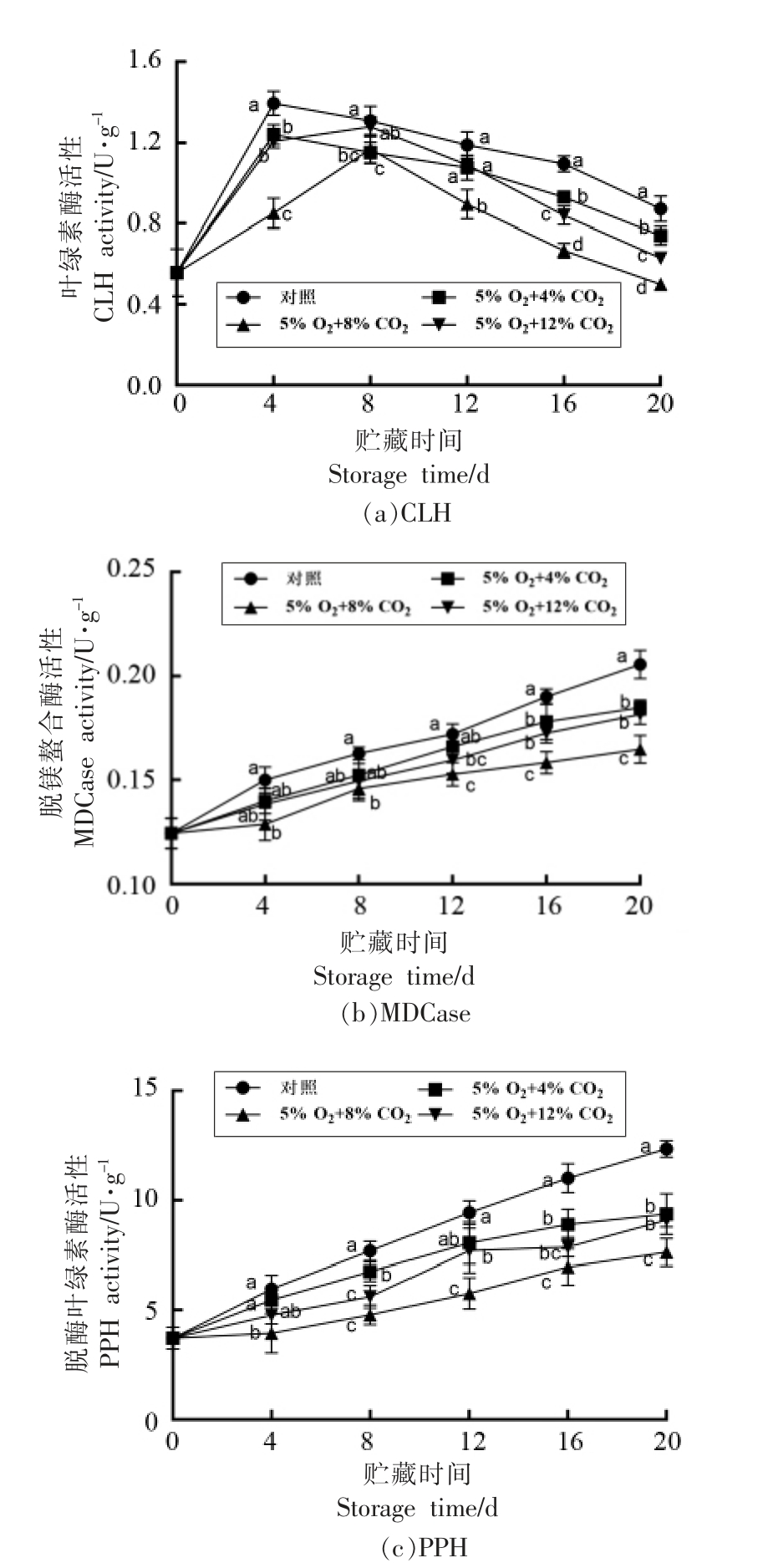
图3 气调贮藏对毛豆荚CLH、MDCase和PPH 活性的影响
Fig.3 Effects of controlled atmosphere storage on the activities of CLH,MDCase and PPH in soybeans
MDCase 和PPH 在叶绿素降解过程中起重要作用。如图3b 和3c 所示,毛豆荚MDCase 和PPH活性均随贮藏时间延长而逐渐上升。贮藏前期对照组MDCase 和PPH 活性显著高于5% O2+8%CO2 处理组(P<0.05),与另外两个处理组之间差异不显著;对照组MDCase 和PPH 活性快速上升,至贮藏20 天时分别上升了42.86%和73.33%,其活性显著高于气调贮藏组(P<0.05);其中8% CO2贮藏组MDCase 和PPH 活性最弱,12% CO2 贮藏组次之,而4%和12% CO2 贮藏组间差异不显著。结果表明,气调贮藏能够有效钝化MDCase 和PPH 活性,延缓叶绿素的降解,使毛豆在贮藏期间保持较好的绿色,其中5% O2+8%CO2 贮藏组效果最佳。
2.4 气调贮藏对毛豆荚叶绿素衍生物含量的影响
由图4a 和4b 可知,随贮藏时间延长毛豆荚脱镁叶绿素a 含量呈先上升后下降的趋势。贮藏第8 天时各贮藏组保持较高的叶绿素a 含量,其中8% CO2 贮藏组含量最高为10.10 μg/g,显著高于其它贮藏组(P<0.05);贮藏8 d 以后各贮藏组脱镁叶绿素a 含量迅速下降,至贮藏20 d 时对照组含量仅3.166 μg/g,显著低于气调贮藏组(P<0.05)。脱镁叶绿素b 含量则随贮藏时间逐渐减少,气调贮藏组脱镁叶绿素b 含量显著高于对照组(P<0.05),其中5% O2+8% CO2 贮藏组保持了较高的含量,4% CO2 和12% CO2 贮藏组含量虽显著低于8% CO2 贮藏组,但两贮藏组之间无显著性差异。

图4 气调贮藏对毛豆荚叶绿素衍生物含量的影响
Fig.4 Effects of controlled atmosphere storage on the content of chlorophyll derivatives in soybeans
如图4c 和图4d 所示,脱植基叶绿素a 和脱镁叶绿酸a 含量随贮藏时间延长整体呈上升趋势。其中,脱植基叶绿素a 含量在贮藏前8 天变化缓慢,贮藏第12 天时上升速度加快,贮藏20 天时对照组含量最高为1.78 μg/g 上升了49.43%;气调贮藏组变化较为平缓,贮藏20 天时4% CO2 和12% CO2 贮藏组含量分别为1.48 μg/g 和1.38 μg/g,8% CO2 贮藏组含量最低仅1.07 μg/g,显著低于对照组(P<0.05)。对照组脱镁叶绿酸a 含量在贮藏8 天前迅速上升,在贮藏后期上升趋势较为平缓,贮藏20 天时对照组含量最高为5.20 μg/g,4%CO2、8% CO2 以及12% CO2 贮藏组脱镁叶绿酸a 含量分别为4.74,4.09 μg/g 和4.44 μg/g。气调贮藏显著抑制了脱镁叶绿酸a 含量的上升(P<0.05),8% CO2 贮藏组效果最好。因此,与对照相比气调贮藏组显著延缓了脱镁叶绿酸a 和脱植基叶绿素a 含量的上升,其中5% O2+8% CO2 贮藏组效果最佳,4%和12% CO2 贮藏组与8% CO2 贮藏组相比加快了毛豆叶绿素的降解,在贮藏后期效果更加明显。
2.5 毛豆荚叶绿体超微结构观察
在果蔬贮藏过程中叶绿素降解往往伴随着叶绿体超微结构的变化[34]。由图5 可知,鲜荚毛豆采后随贮藏时间叶绿体结构逐渐解体。采收当天叶绿体结构完整,基质片层与基粒片层排列规则,嗜锇颗粒分散其中,双层膜结构完整。毛豆采后贮藏20 天时,对照组叶绿体结构破坏,基粒片层模糊不清,双层膜结构消失;5% O2+8% CO2 处理组叶绿体结构较完整呈椭圆形,基粒片层发生部分断裂,排列轻微松散。结果表明人工气调处理能够延缓鲜荚毛豆贮藏过程中叶绿体超微结构的分解,延长鲜荚毛豆的贮藏时间。
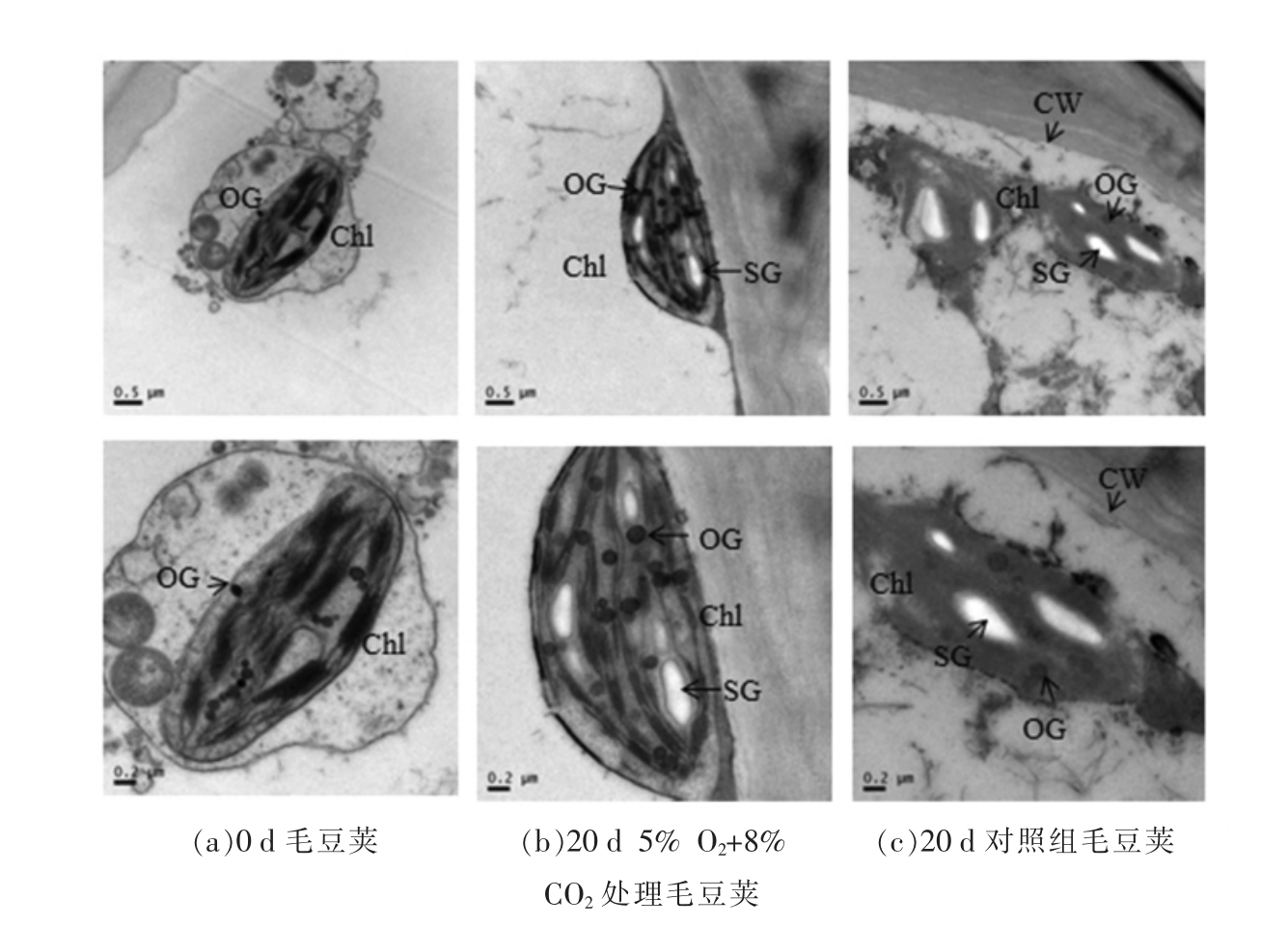
图5 气调贮藏对毛豆荚叶绿体超微结构的影响
Fig.5 Effects of controlled atmosphere storage on chloroplast ultrastructure of soybean pods
注:Chl.叶绿体;CW.细胞壁;OG.嗜锇颗粒;SG.淀粉粒。
3 讨论
毛豆贮藏过程中的黄化现象主要是由叶绿素降解引起的。有研究表明适宜的CO2 能够有效延缓果蔬贮藏过程中绿素降解,然而CO2 体积分数过高或过低都会对果蔬造成一定损伤,加速其叶绿素的降解,从而加快果蔬黄化的进程[17]。在西兰花贮藏过程中,CO2 体积分数过高易造成西兰花无氧呼吸生成乙醇、乙醛,过低则会造成西兰花CLH、和PPH 活性升高,加快叶绿素降解,使西兰花发生黄化[15]。李栋[34]的研究也发现,10%和20%CO2 处理能够有效延缓果实采后硬度与色泽的变化,而30% CO2 处理会造成果实色泽的劣变,高CO2 能够诱导叶绿素合成相关基因表达,并抑制叶绿素降解相关基因表达。这与本研究结果相似,4%,8%和12% CO2 贮藏组均能钝化CLH、MDCase 和PPH 活性,维持叶绿素含量,减慢毛豆荚贮藏过程中的黄化现象,其中5% O2+8% CO2 贮藏组保绿效果最佳。
随着贮藏时间的延长,毛豆叶绿素含量整体呈下降趋势。从叶绿素降解衍生物含量变化来看,气调贮藏组脱镁叶绿素a 含量呈先上升后下降的趋势,脱镁叶绿素b 含量在贮藏初期较高,在贮藏后期含量呈现下降趋势;而脱植基叶绿素a 和脱镁叶绿酸a 含量随贮藏时间延长逐渐上升,出现积累现象,气调贮藏延缓了其含量的上升。这可能是因为在毛豆贮藏过程中呈黄绿色的叶绿素b 在叶绿素还原酶的的催化下转化为叶绿素a,叶绿素a 又在CLH 和MDCase 的作用下生成脱镁叶绿酸a;MDCase 也会以脱镁叶绿素作为中间产物,先除去镁离子,随后在PPH 的作用下除去植基,最终转化生成脱镁叶绿酸a[35]。叶绿素的降解可能会受到酶类的控制[36],其酶活性的高低可能会影响叶绿素降解的进程。在本研究中气调贮藏能够显著钝化CLH、MDCase、PPH 等酶的活性,从而延缓了脱镁叶绿素a/b 转化为脱植基叶绿素a 和脱镁叶绿酸a 的进程[21],抑制了叶绿素降解。5% O2+8%CO2 贮藏组保绿效果最佳,较好地维持了毛豆的色泽,12% CO2 贮藏组次之。4% CO2 贮藏组由于CO2 体积分数较低,导致叶绿素降解酶活性升高,加快了叶绿素的降解。万永红[37]、宋慕波等[38]研究发现适宜的CO2 能够通过抑制MDCase、PPH 等酶的活性,从而延缓叶绿素a 的降解,维持果蔬较长的货架期。Yu 等[39]研究发现可以通过抑制叶绿素酶和磷酰氧化物a 加氧酶等的酶活性和基因表达从而减缓采后茶叶叶绿素的降解。同时高体积分数CO2 可以加快PPH、PAO 等叶绿素降解相关酶基因的表达,促进叶绿素的降解,加快柑橘果皮颜色的变化[40]。细胞超微结构的变化是果实发育成熟及衰老过程的重要特征。随贮藏时间的延长,果实细胞及其超微结构严重破坏,叶绿体发生解体[41]。本研究发现5% O2+8% CO2 贮藏组与对照相比能够保持较为完整的叶绿体超微结构,减缓了细胞结构与叶绿体的损伤,从而减缓叶绿素的降解。
4 结论
气调贮藏能够显著抑制毛豆贮藏期间叶绿素的降解,保持较好的外观品质,贮藏8 d 开始5 O2+8% CO2 处理组与4% CO2 和12% CO2 处理组相比更好地保持了色泽,钝化了鲜荚毛豆贮藏过程中CLH、PPH 以及MDCase 活性升高,抑制了叶绿素含量的下降,延缓了脱植基叶绿素a 和脱镁叶绿酸a 含量的增加。5 O2+8% CO2 贮藏组保持了相对完整毛豆荚叶绿体结构。因此5 O2+8%CO2 处理能够通过钝化叶绿素降解相关酶活性的上升,延缓叶绿素衍生物含量的增加,从而延缓叶绿素的降解,使其维持较好的色泽和品质,为鲜荚毛豆货架期延长提供理论依据。
[1] ZHANG G W,XU S C,MAO W H,et al.Determination of the genetic diversity of vegetable soybean[Glycine max(L.)Merr.] using EST-SSR markers[J].Journal of Zhejiang University -Science B(Biomedicine &Biotechnology),2013,14(4):279-288.
[2] 张秋英,李彦生,王国栋,等.菜用大豆品质及其影响因素研究进 展[J].大豆 科学,2010,29(6):1065-1070.ZHANG Q Y,LI Y S,WANG G D,et al.Quality and factors involved in vegetable soybean production[J].Soybean Science,2010,29(6):1065-1070.
[3] 荆红彭,张旭,关文强,等.不同温度下微孔膜包装青毛豆的保鲜效果研究[J].食品工业科技,2015,36(3):335-339,344.JING H P,ZHANG X,GUAN W Q,et al.Research of micro-perforated plastic film storage performance of green soybean at different temperature[J].Science and Technology of Food Industry,2015,36(3):335-339,344.
[4] 刘春泉,卓成龙,宋江峰,等.毛豆仁低温冻藏期叶绿素和色泽降解动力学[J].江苏农业学报,2011,27(4):858-862.LIU C Q,ZHUO C L,SONG J F,et al.Degradation kinetics of color and chlorophyll in frozen edamames[J].Jiiangsu Journal of Agricultural Sciences,2011,27(4):858-862.
[5] KONG K W,KHOO H E,RASAD K N.Carotenoids and their isomers:Color pigments in fruits and vegetables[J].Molecules,2011,16(2):1710-1738.
[6] 肖怀娟,刘珂珂,马勇斌,等.外源脱落酸调控下辣椒叶片衰老过程的生理生化变化[J].河南农业大学学报,2019,53(3):357-364.XIAO H J,LIU K K,MA Y B,et al.Physiological and biochemical changes during leaf senescence under the regulation of exogenous ABA in Capsicum annuum L.[J].Journal of Henan Agricultural University,2019,53(3):357-364.
[7] HORTENSTEINER S,KRAUTLER B.Chlorophyll breakdown in higher plants[J].Biochimica et Biophysica Acta(BBA)-Bioenergetics,2011,1807(8):977-988.
[8] GUYER L,SALINGER K,KRÜGEL U,et al.Catalytic and structural properties of pheophytinase,the phytol esterase involved in chlorophyll breakdown[J].Journal of Experimental Botany,2017,69(4):879-889.
[9] 王军萍,宋留丽,郁志芳.2,4-表油菜素内酯处理对不同温度贮藏中小白菜品质和生理生化的影响[J].食品工业科技,2022,43(9):349-358.WANG J P,SONG L L,YU Z F.Effects of 2,4-epibrassinolide treatment on quality,physiology and biochemistry of pakchoi(Brassica chinensis L.)during storage at different temperatures[J].Science and Technology of Food Industry,2022,43(9):349-358.
[10] 杜传来,吴胜.不同预处理对鲜荚毛豆低温贮藏过程中品质的影响[J].现代食品科技,2009,25(4):362-365.DU C L,WU S.Effects of pretreatments on the quality of fresh soybean pods in low-temperature storage[J].Modern Food Science and Technology,2009,25(4):362-365.
[11] 赵菲,张旭,荆红彭,等.不同冻结速率对毛豆冻藏过程中品质的影响[J].制冷学报,2015,36(5):113-118.ZHAO F,ZHANG X,JING H P,et al.Effects of different freezing rates on the characteristics of vegetable soybean during frozen storage[J].Journal of Refrigeration,2015,36(5):113-118.
[12] 田雪婷,吴晗笑,王雷,等.1-MCP 处理对采后‘澳洲青苹’ 苹果叶绿素降解的影响 [J].果树学报,2020,37(5):734-742.TIAN X T,WU H X,WANG L,et al.Effect of 1-MCP treatment on chlorophyll degradation in postharvest 'Granny Smith' apple fruit[J].Journal of Fruit Science,2020,37(5):734-742.
[13] 张丽华.乙烯、气调贮藏与温度对中华猕猴桃品种‘华优’ 果肉黄化的影响[D].西安:陕西师范大学,2016.ZHANG H L.Effects of ethylene,controlled atmosphere storage and temperature on flesh yellowing of Chinese kiwifruit variety 'Huayou'[D].Xian:Shaanxi Normal University,2016.
[14] 王利斌,姜丽,石韵,等.气调贮藏对四季豆生理生化特性的影响[J].食品科学,2013,34(8):289-293.WANG L B,JIANG L,SHI Y,et al.Physiobiochemical characteristics of Phaseolus vulgaris L.during controlled atmosphere storage[J].Food Science,2013,34(8):289-293.
[15] 孙志文,吕凤艳,郭衍银,等.O2/CO2 气调中CO2对西兰花叶绿素降解及保鲜作用[J].食品科学,2016,37(18):313-317.SUN Z W,LÜ F Y,GUO Y Y,et al.Effect of CO2 concentration in O2/CO2 controlled atmosphere on chlorophyll degradation and quality preservation in chilled broccoli[J].Food Science,2016,37(18):313-317.
[16] 马阳历,张玉笑,郭衍银,等.气调过程中O2 含量对西兰花叶绿素降解的影响[J].北方园艺,2021(23):98-105.MA Y L,ZHANG Y X,GUO Y Y,et al.Effect of O2 content on the chlorophyll degradation in broccoli heads under cnotrolled atmospheres [J].Northern Horticultur,2021(23):98-105.
[17] 陈勇,张玉笑,郭衍银,等.O2/CO2 主动自发气调对西兰花活性氧代谢及保鲜效果的影响[J].山东理工大学学报(自然科学版),2020,34(4):1-6.CHEN Y,ZHANG Y X,GUO Y Y,et al.Effects of O2/CO2 active modified atmosphere packaging on reactive oxygen species metabolism and storage quality of broccoli[J].Journal of Shandong University of Technology(Natural Science Edition),2020,34(4):1-6.
[18] 卢瑞雪,韩延超,陈杭君,等.褪黑素处理对小青菜贮藏品质的影响[J].中国食品学报,2022,22(1):198-205.LU R X,HAN Y C,CHEN H J,et al.Effect of melatonin treatment on storage quality of Brassica chinensis L.[J].Journal of Chinese Institute of Food Science and Technology,2022,22(1):198-205.
[19] 严锐,韩延超,吴伟杰,等.真空预冷对鲜食莲子采后贮藏品质的影响[J].食品工业科技,2021,42(13):331-337.YAN R,HAN Y C,WU W J,et al.Effect of vacuum pre-cooling on postharvest storage quality of fresh lotus seeds[J].Science and Technology of Food Industry,2021,42(13):331-337.
[20] KEIJI I,NAGAO O,ATUSI T.A simple method for extraction and partial purification of chlorophyll from plant material,using dioxane[J].Journal of Biochemistry,1974,76(4):901-904.
[21] 宋小青,任亚梅,张艳宜,等.采后猕猴桃叶绿素降解机制及1-MCP 处理对其代谢的影响[J].食品科学,2017,38(17):260-265.SONG X Q,REN Y M,ZHANG Y Y,et al.Mechanism of chlorophyll degradation and effect of 1 -MCP treatment on chlorophyll metabolism in postharvest kiwifruit [J].Food Science,2017,38(17):260-265.
[22] AIAMLA -OR S,KAEWSUKSAENG S,SHIGYO M,et al.Impact of UV-B irradiation on chlorophyll degradation and chlorophyll-degrading enzyme activities in stored Broccoli(Brassica oleracea L.Italica group)florets[J].Food Chemistry,2010,120(3):645-651.
[23] BALSCHUN T C,FRANKE A,SINA C,et al.Effects of postharvest ethanol vapor treatment on activities and gene expression of chlorophyll catabolic enzymes in broccoli florets[J].Postharvest Biology &Technology,2010,55(2):97-102.
[24] KAEWSUKSAENG S,URANO Y,AIAMLA-OR S,et al.Effect of UV-B irradiation on chlorophyll-degrading enzyme activities and postharvest quality in stored lime(Citrus latifilia Tan.)fruit[J].Postharvest Biology &Technology,2011,61(2/3):124-130.
[25] 范林林,史君彦,吕佳煜,等.不同贮藏方式对大白菜叶绿素降解的影响[J].安徽农业科学,2016,44(20):86-89,175.FAN L L,SHI J Y,LÜ J Y,et al.Effects of storage methods on chlorophyll degradation in chinese cabbage[J].Journal of Anhui Agricultural Sciences,2016,44(20):86-89,175.
[26] SCHELBERT S,AUBRY S,BURLA B,et al.Pheophytin pheophorbide hydrolase(pheophytinase)is involved in chlorophyll breakdown during leaf senescence in arabidopsis[J].Plant Cell,2009,21(3):767-785.
[27] CHEN K W,RÍOS J J,ROCA M,et al.Development of an accurate and high-throughput methodology for structural comprehension of chlorophylls derivatives.(II)dephytylated derivatives[J].Journal of Chromatography A,2015,1412:90-99.
[28] 朱玲玲.褪黑素处理对鲜切青花菜采后衰老的调控机理研究[D].沈阳:沈阳农业大学,2018.ZHU L L.Regulation mechanism of melatonin treatment on postharvest senescence of fresh cut broccoli[D].Shenyang:Shenyang Agricultural University,2018.
[29] 张丽华.猕猴桃果实制浆中叶绿素降解机理及其护绿方法研究[D].杨凌:西北农林科技大学,2012.ZHANG L H.Study on chlorophyll degradation mechanism and green protection methods in kiwi fruit pulping[D].Yangling:Northwest A&F University,2012.
[30] CHENG Y D,DONG Y,YANA H G,et al.Effects of 1-MCP on chlorophyll degradation pathwayassociated genes expression and chloroplast ultrastructure during the peel yellowing of Chinese pear fruits in storage[J].Food Chemistry,2012,135(2):415-422.
[31] 张玉蕾,张誉丹,牛晓峰,等.电生功能水处理对菜豆贮藏品质的影响[J].食品工业科技,2016,37(19):324-329.ZHANG Y L,ZHANG Y D,NIU X F,et al.Effect of electrolyzed functional water on quality of Phaseolus vulgaris L.during storage[J].Science and Technology of Food Industry,2016,37(19):324-329.
[32] CAI J H,CHENG S C,LUO F,et al.Influence of ethylene on morphology and pigment changes in harvested broccoli[J].Food and Bioprocess Technology,2019,12(5):883-897.
[33] WANG Y S,LUO Z S,DU R X.Nitric oxide delays chlorophyll degradation and enhances antioxidant activity in banana fruits after cold storage[J].Acta Physiologiae Plantarum,2015,37(4):74.
[34] 李栋.高浓度CO2 处理调控采后草莓花色苷合成机制研究[D].杭州:浙江大学,2021.LI D.Regulation of anthocyanin synthesis in postharvest strawberry by high concentration CO2 treatment[D].Hangzhou:Zhejiang University,2021.
[35] LI D,ZHANG X C,LI L,et al.Elevated CO2 delayed the chlorophyll degradation and anthocyanin accumulation in postharvest strawberry fruit[J].Food Chemistry,2019,285:163-170.
[36] 丁跃,吴刚,郭长奎.植物叶绿素降解机制研究进展[J].生物技术通报,2016,32(11):1-9.DING Y,WU G,GUO C K.Research advance on chlorophyll degradation in plants [J].Biotechnology Bulletin,2016,32(11):1-9.
[37] 万永红.CO2 气体调节剂结合ClO2 对西兰花常温保鲜效果的研究[D].沈阳:沈阳农业大学,2020.WAN Y H.Study on the effect of CO2 gas regulator combined with ClO2 on the preservation of broccoli at room temperature[D].Shenyang:Shenyang Agricultural University,2020.
[38] 宋慕波,帅良,唐路平,等.高浓度CO2 对香蕉和大蕉后熟及果皮叶绿素降解的影响[J].食品工业科技,2017,38(6):313-318.SONG M B,SHUAI L,TANG L P,et al.Effect of high CO2 on the ripening and peel chlorophyll degradation in banana and plantain fruits[J].Science and Technology of Food Industry,2017,38(6):313-318.
[39] YU X L,HU S,HE C,et al.Chlorophyll metabolism in postharvest tea(Camellia sinensis L.)leaves:Variations in color values,chlorophyll derivatives,and gene expression levels under different withering treatments[J].Journal of Agricultural and Food Chemistry,2019,67(38):10624-10636.
[40] LU Y T,LI D,LI L,et al.Effects of elevated CO2 on pigment metabolism of postharvest mandarin fruit for degreening[J].Food Chemistry,2020,318:126462.1-121462.10.
[41] 朱璇,侯媛媛,贾燕,等.水杨酸处理对冷藏杏果实细胞超微结构的影响[J].食品科学,2014,35(14):193-197.ZHU X,HOU Y Y,JIA Y,et al.Effect of salicylic acid treatment on cell ultrastructure of apricot fruit during cold storage[J].Food Science,2014,35(14):193-197.