食源性生物活性肽(Food-derived bioactive peptides,FBPs)是指以食品蛋白质为主要原料,用酶解或微生物发酵生产的,相对分子质量通常在6 000 u 以下,以肽为主要成分且具有特定生物活性的蛋白水解物。FBPs 的开发和利用是食品科学领域的研究热点之一。现代科学研究表明,FBPs具有安全性和营养价值高、吸收性好等优点[1]。FBPs 在食品、功能性食品及特殊医学用食品领域具有广泛的应用前景。
肠内分泌细胞(Enteroendocrine cells,EECs)是一大类存在于胃肠道表面,能够分泌多种激素的锥体形或圆形细胞(图1)[2]。在肠腔特定营养物质的刺激下,EECs 可选择性分泌多种肽类和(或)胺类激素,包括胆囊收缩素(CCK)、胰高血糖素样肽-1(GLP-1)、葡萄糖依赖性胰岛素释放肽(GIP)、酪酪肽(PYY)等[3]。这些胃肠激素可进一步通过脑-肠轴调节机体的重要生理活动,如调控食欲、胃肠运动、消化酶分泌、血压和血糖等[4]。大量研究表明,FBPs 对胃肠激素的分泌具有显著的影响,并且可通过调控胃肠激素分泌影响机体健康。基于此,本文对近年来FBPs 调控胃肠激素分泌的研究进展进行归纳总结,并对未来研究方向进行展望,以期为FBPs 在调控胃肠激素分泌及促进机体健康方面的研究和应用提供参考。
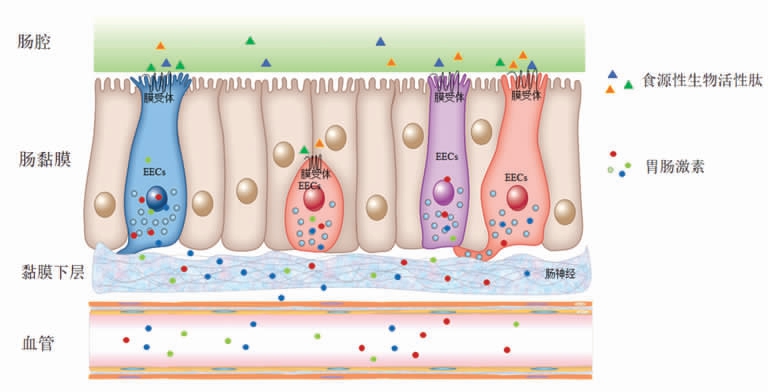
图1 肠内分泌细胞(EECs)感受食源性生物活性肽(FBPs)分泌胃肠激素的过程
Fig.1 The process of enteroendocrine cells(EECs)secreting gastrointestinal hormones by sensing food-derived bioactive peptides(FBPs)
1 肠内分泌细胞与胃肠激素
EECs 位于肠腔表面,多为开放型,顶端表面覆盖微绒毛,与管腔成分直接接触。虽然EECs 数量在整个消化道肠上皮细胞中的比例<1%,但它们分散于整个消化道的表面[5]。迄今为止,研究已发现15 种类型的EECs 亚型,主要有K 细胞、L 细胞、I 细胞、D 细胞和G 细胞等。这些EECs 亚型能够特异性识别营养物质,并有差别的分泌多种激胃肠素(图2)。例如,定位于远端小肠、结肠的L细胞可分泌胰高血糖素样肽-1(GLP-1)、胰高血糖素样肽-2(GLP-2)、酪酪肽(PYY)、胃泌酸调节素和胰岛素样肽5(INSL5);位于近端小肠的I 细胞可分泌胆囊收缩素(CCK);存在于近端小肠的K 细胞可分泌葡萄糖依赖性胰岛素释放肽(GIP);存在于胃部和十二指肠的G 细胞可分泌胃泌素;存在于十二指肠、空肠的M 细胞可分泌胃动素;存在于回肠的N 细胞可分泌神经降压素(NT);存在于整个胃肠道的D 细胞可分泌生长抑素(SST)等[4,6]。在体外试验中,STC-1 细胞已作为一种成熟的EECs 模型用以研究营养物质对胃肠激素表达和分泌的影响。STC-1 细胞最初被用作产生CCK的天然I 细胞模型,而现有研究发现,STC-1 细胞除了表达和分泌CCK 外,还表达和分泌多种胃肠激素,包括GIP、PYY、GLP-1、GLP-2[7]。虽然STC-1 细胞分泌这些激素的水平可能与机体EECs 存在差异,但STC-1 细胞作为相对可靠的EECs 模型仍被广泛使用。
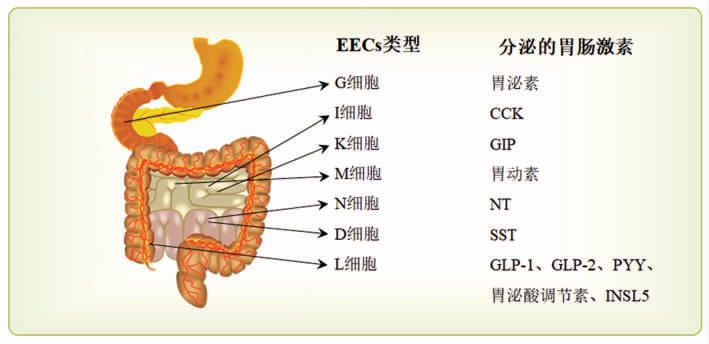
图2 肠内分泌细胞(EECs)种类及其分泌的胃肠激素
Fig.2 Types of enteroendocrine cells(EECs)and their secreted gastrointestinal hormones
EECs 感知腔内营养素并分泌相关胃肠激素[8]。分泌的激素可以进入血液,以内分泌方式发挥生理功能,也可与邻近的肠细胞、肠神经元或内皮细胞以旁分泌方式发挥作用(图1)。一些EECs还可直接与肠神经元突触接触,以快速传达有关肠道营养状况的信息[9]。胃肠激素具有多种生理功能,其中最受关注的是其对食欲的调控作用。食物摄入调节强烈依赖于肠-脑轴[6],大量研究指出EECs 释放的胃肠激素发挥重要作用。与碳水化合物和脂肪相比,膳食蛋白质的消化产物可使机体产生最高程度的饱腹感[10]。蛋白消化产物可引起胃肠激素CCK、GIP、GLP-1、PYY 的合成和分泌。这些胃肠激素除了具有调控食欲的作用外,还具有其它重要生理功能。
1.1 CCK
CCK 主要由位于近端小肠的肠内分泌I 细胞分泌。研究已证实CCK 是调控食欲的内分泌激素因子[11]。CCK 能在不同程度上调节摄食,其可以延缓胃排空,促进胰腺腺泡分泌各种消化酶,从而诱导饱腹感信号的产生,进而减少食物摄入量[12]。相比碳水化合物和脂肪,膳食蛋白质引起的饱腹感更强,并且是肠道CCK 释放的主要刺激物[13-14]。此外,CCK 还具有其它多种生理功能。在消化系统中,CCK 可以调节胆囊收缩、胰酶分泌、胰腺生长和胃肠蠕动等[15];在心血管系统中,CCK 参与心率和血压的调节[16];在神经系统中,CCK 则作为神经递质,在疼痛、体温及情绪等方面发挥调节作用[17]。
1.2 GIP
GIP 由近端小肠的K 细胞分泌。GIP 和GLP-1 在十二指肠和空肠近端的K 或L 细胞亚群中也有共表达[18]。GIP 通过与胰腺β 细胞上表达的GIP受体结合,以葡萄糖依赖的方式刺激胰岛素分泌[19]。与GLP-1 不同,GIP 可在低血糖情况下刺激胰腺α 细胞分泌胰高血糖素,对食欲或胃肠动力几乎没有影响[20]。此外,GIP 表现出许多额外的升血糖作用;阻断小鼠的GIP 信号可增加脂肪氧化,减少脂肪细胞和骨骼肌中的脂肪堆积,减少甘油三酯在肝脏中的沉积,并在过度摄食的情况下防止肥胖[21]。
1.3 GLP-1
GLP-1 是一种促进胰岛素分泌和胰岛细胞增殖的胰岛素样激素,它通过发挥促胰岛素分泌作用调节血糖,并促进饱腹感和进食量的减少[22]。GLP-1 的主要作用是作为胃排空的抑制剂,它能够有效地减缓胃排空和增加胰岛素的分泌[23]。GLP-1 是肠道L 细胞因营养摄入而释放的一种胰岛素激素,主要定位于回肠末端和结肠[24]。通过刺激胰岛素分泌和抑制胰高血糖素分泌发挥血糖调节作用,GLP-1 还可抑制胃排空和食物摄取。
1.4 PYY
PYY 是由肠L 细胞分泌的一种由36 个氨基酸组成的蛋白肽,在机体食物摄取和消化调节中发挥关键作用[25]。PYY 具有广泛的功能,包括抑制受葡萄糖刺激的胰岛素释放,降低胃肠运动和胆囊收缩,抑制胰液分泌等[26-27]。对PYY 分泌最有力的刺激是脂质;与葡萄糖和蛋白质相比,富含脂肪的膳食会导致PYY 显著且持续的升高[28]。PYY 对啮齿动物和人类都有减缓胃排空的作用,从而能够减慢胃肠道运动并减少机体对食物的摄入,注射PYY 可降低食欲和体质量[29]。
2 食源性生物活性肽对肠道激素分泌的影响
食源性生物活性肽来源广泛,植物蛋白和动物蛋白是常见的生物活性肽的蛋白来源。当前,已有大量研究利用细胞试验和动物实验评价了不同来源生物活性肽对多种肠道激素分泌的影响,如表1 所示。
表1 食源性生物活性肽对肠道激素分泌影响
Table 1 Effects of food-derived peptides on gut hormones secretion

(续表1)

Hira 等[30]利用STC-1 细胞研究了大豆β-伴球蛋白肽(BconP)对CCK 分泌的影响,将STC-1细胞接种于48 孔培养板中,用不同质量浓度的β-伴球蛋白肽(0~5 mg/mL)孵育STC-1 细胞,用酶联免疫吸附法测定细胞培养上清液中CCK 浓度,发现β-伴球蛋白肽可剂量依赖性地诱导STC-1 细胞分泌CCK。Catiau 等[31]利用糜蛋白酶(Chymotrypsin)制备得到了α-乳清蛋白水解物,并评价了其对STC-1 细胞CCK 分泌的影响,发现α-乳清蛋白水解物具有显著的促CCK 分泌活性;同时,使用液相色谱-质谱联用技术(LC-MS/MS)对多肽水解物进行了表征,发现了水解物中21 条肽具有潜在的促CCK 分泌活性。
Santos-Hernández 等[32]表征了蛋清蛋白的消化产物并研究其刺激CCK 和GLP-1 分泌的能力,发现蛋清消化物中是肽成分而非游离氨基酸,能够有效地促进GLP-1 的分泌,同时大分子蛋白质对GLP-1 分泌的促进作用较弱;对于CCK 的分泌,肽和游离氨基酸而不是蛋白质有助于CCK 的分泌。疏水性带负电荷的肽组分能够刺激CCK 的分泌,而疏水性带正电荷的肽组分可显著刺激GLP-1 的分泌,表明CCK 和GLP-1 的分泌涉及不同受体或活性位点的参与。鉴定参与激素分泌的肽序列和受体可以为控制食物摄入和葡萄糖代谢开辟新的途径。
Hira 等[33]也研究了玉米蛋白水解物(ZeinH)对GLP-1 分泌的影响,发现ZeinH 能够强烈刺激肠内分泌GLUTag 细胞GLP-1 的分泌。将ZeinH注射在小肠的不同部位后,通过肝门静脉导管收集血液并测定血液中的GLP-1 浓度。ZeinH 在十二指肠、空肠和回肠给药后均可剂量依赖地增加门静脉GLP-1 浓度。ZeinH 在回肠部位刺激GLP-1 的分泌要高于十二指肠或空肠。十二指肠静脉和回肠肠系膜静脉的直接采血方法显示,ZeinH 给到结扎的十二指肠中虽可增强回肠系膜静脉中的GLP-1 浓度,但不会增加十二指肠静脉中的GLP-1 浓度。这些现象证实了十二指肠中的ZeinH 可通过间接机制诱导位于回肠的L 细胞分泌GLP-1。因此,ZeinH 可通过大鼠肠道中的直接和间接机制诱导GLP-1 分泌。
机体GLP-1 的分泌可诱导胰岛素的释放进而影响机体的糖耐量。Kato 等[34]研究了小麦蛋白水解物(LWP)对大鼠肠道GLP-1 分泌及胰岛素分泌和糖耐量的影响,研究结果表明小分子小麦蛋白水解物显著促进GLP-1 的分泌,而大分子小麦蛋白水解物对GLP-1 的分泌无明显促进作用。LWP 可通过刺激GLP-1 分泌和诱导胰岛素分泌来改善大鼠的高血糖。
鱼蛋白水解物(FPH)作为生物活性肽的重要来源广泛受到研究者的关注。Cudennec 等[38]研究了来自蓝鳕鱼(Micromesistius poutassou)和棕色虾(Penaeus aztecus)的FPH 对EECs 释放CCK的影响,证明了FPH 能够高度刺激STC-1 细胞分泌CCK,并且这种刺激作用主要是由于肽分子发挥。分离纯化发现,能够刺激CCK 分泌的活性肽的相对分子质量在在1 000~1 500 u 范围。此外,为了寻找来自鱼蛋白水解物的食欲抑制因子,进一步利用细胞和动物实验进行了研究,以证明蓝鳕鱼肌肉(BWMH)产生的水解物具有饱腹作用。BWMH 能够增强STC-1 细胞CCK 和GLP-1 的分泌。通过动物实验进一步研究了BWMH 对大鼠食物摄入和代谢血浆标志物水平的影响,发现BWMH 可减少大鼠短期食物摄入量,而这与CCK和GLP-1 血浆水平的增加有关[35]。此外,研究结果也发现长期使用BWMH 会导致大鼠体质量减少。
Sufian 等[39]在前期发现大豆β-伴球蛋白肽(BconP)可与大鼠小肠刷状缘膜(BBM)结合并刺激EECs 抑制CCK 的释放,进而抑制大鼠食物摄入的基础上,为寻找新的食欲抑制多肽,研究了鸡肉、猪肉、牛肉、牛肝和蛋清水解物与大鼠小肠BBM 结合活性、对STC-1 细胞释放CCK 的活性以及诱导大鼠饱腹感的活性。研究结果表明,鸡肉和猪肉蛋白胨(ChickP 和PorkP)与BBM 结合的能力最高;PorkP 和ChickP 刺激STC-1 细胞释放CCK 的能力高于BconP,且呈剂量依赖关系,其中PorkP 的刺激作用最强。此外,动物实验结果表明PorkP 可直接与小肠CCK 分泌细胞相互作用促进CCK 的分泌并抑制大鼠的食欲。
大米在亚洲一直作为碳水化合物的主要来源,而人们对大米蛋白质作为饮食因素的功能作用研究较少。基于此,Ishikawa 等[40]研究了来自大米的蛋白肽是否可以刺激GLP-1 分泌,从而通过正常大鼠的肠促胰岛素效应降低血糖。将大米胚乳或米糠蛋白酶解制备水解物,并利用小鼠肠内分泌细胞系GLUTag 细胞研究这些水解物对GLP-1 分泌的影响。口服大米蛋白水解物后,在麻醉状态或在大鼠葡萄糖耐量实验期间收集血浆,测定GLP-1 和二肽基肽酶-IV(DPP-IV)活性。大米胚乳蛋白(REPH)和米糠蛋白(RBPH)水解物可有效刺激GLUTag 细胞分泌GLP-1,而胃消化物的作用更为明显。口服REPH 或RBPH 可升高大鼠血浆GLP-1 浓度,导致葡萄糖耐量试验下血糖降低。此外,在回肠处给予REPH 或RBPH 后,血浆DPP-IV 活性减弱,这导致血浆中完整(活性)的GLP-1 与总GLP-1 的比例更高。这些结果表明,大米蛋白水解物对GLP-1 分泌具有强大的刺激作用,有助于减少餐后血糖,这些肽对血浆DPP-IV 活性的抑制作用可能增强GLP-1 的肠促胰岛素作用。
乳清蛋白已被证明可以抑制饮食引起的肥胖、葡萄糖不耐症以及延缓II 型糖尿病的发生。Gillespie 等[44]研究了乳清粗蛋白、完整的单个乳清蛋白和β-乳球蛋白水解物对STC-1 细胞的影响。将STC-1 细胞与几种浓度的酸奶乳清(YW)、奶酪乳清(CW)、β-乳球蛋白(BLG)、α-乳清蛋白(ALA)和牛血清白蛋白(BSA)一起孵育,结果表明BLG 刺激STC-1 细胞增殖,以及GLP-1 分泌(用糜蛋白酶或胰蛋白酶水解后失去效果)。ALA 是一种高效的促GLP-1 分泌剂,可以增加细胞内GLP-1 的水平,而乳清蛋白和水解物对GIP 分泌几乎没有影响。
3 调控肠道激素分泌的生物活性肽序列
当前大部分研究多采用细胞试验和动物实验评价不同蛋白来源的生物活性肽或水解物对胃肠激素分泌的影响,然而关于分离鉴定具有刺激胃肠激素分泌能力的生物活性肽序列方面的研究仍然有限。具有调控肠道激素分泌的生物活性肽序列归纳总结于表2。
表2 刺激肠道激素分泌的生物活性肽的序列
Table 2 Sequences of bioactive peptides that can stimulate gut hormones secretion
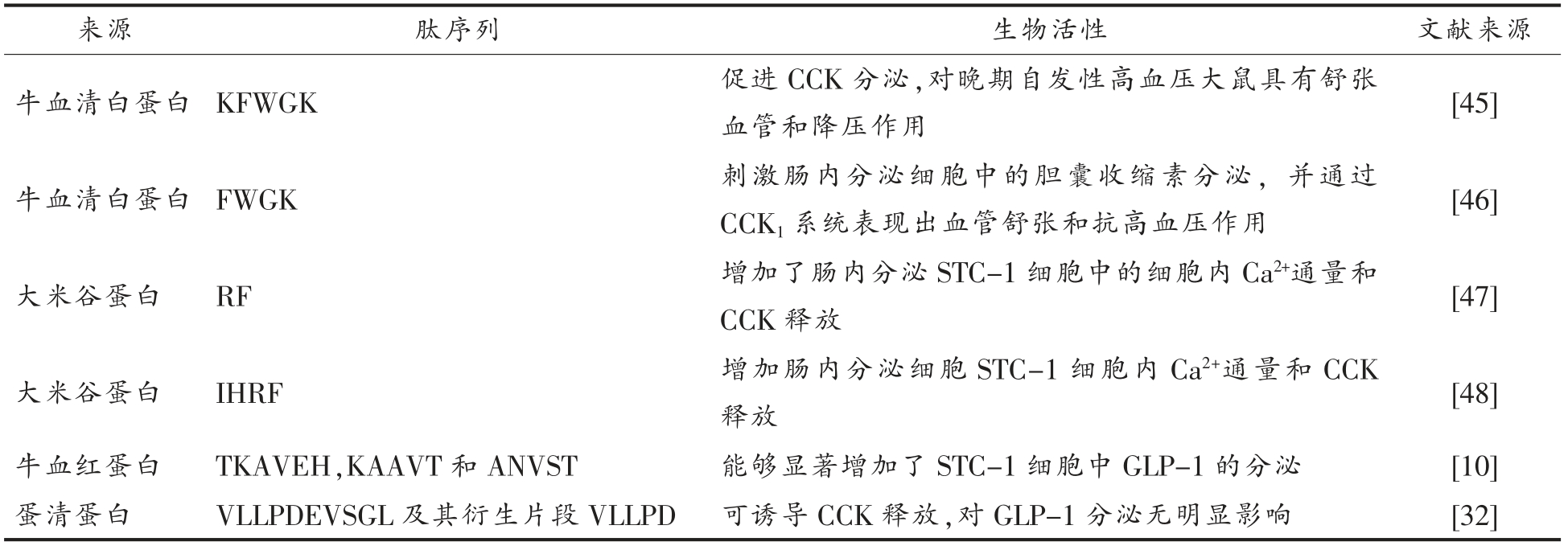
Koyama 等[45]研究了一种来自牛奶蛋白的多肽KFWGK 对自发性高血压大鼠(SHR)的血管松弛和降压作用。该多肽来源于从牛血清白蛋白的枯草杆菌蛋白酶酶解产物。研究结果发现,KFWGK对肠系膜动脉的松弛作用可被CCK1 受体拮抗剂氯戊米特所抑制。与较早期SHR 相比,KFWGK 对晚期SHR 有更强的血管松弛作用。口服KFWGK对具有高血压的自发性高血压大鼠有明显的降压作用(最小有效剂量为5 μg/kg),CCK 拮抗剂也可阻断KFWGK 的降压作用。
Kagebayashi 等[47]发现一种二肽Arg-Phe(RF)在自发性高血压大鼠(SHR)的肠系膜动脉上具有血管松弛活性,并通过研究它的作用机制,阐明了它的生理功能。RF 多肽具有血管松弛活性,而二肽FR 没有活性,这表明RF 序列对于有效的血管松弛作用非常重要。一氧化氮(NO)和前列腺素(PGs)是已知的血管松弛因子。然而,一氧化氮合酶抑制剂L-硝基-精氨酸甲酯(L-NAME)和环氧合酶(COX)抑制剂吲哚美辛都不能抑制RF 的血管松弛活性。RF 的血管松弛活性可被CCK 受体拮抗剂氯谷胺阻断,而RF 可刺激CCK 的释放。口服RF 可降低SHR 的血压,这种降压作用也可被CCK1 拮抗剂阻断。RF 对食物摄取和胃肠转运具有抑制作用,其可增加肠内分泌STC-1 细胞内Ca2+通量和CCK 释放。RF 序列经常在天然食品蛋白质氨基酸序列中观察到。Kontani 等[48]进一步使用胃肠道蛋白酶研究了从大米谷蛋白(一种主要的储存蛋白)释放RF 相关肽的酶条件,并且表征了RF 及相关肽。结果表明大米谷蛋白的部分结构在胰凝乳酶消化过程中释放出RF 和Ile-His-Arg-Phe(IHRF)。IHRF 对应于大米谷蛋白的155~158 位氨基酸序列,在自发性高血压大鼠的肠系膜动脉中具有血管弹性活性。口服IHRF 可降低SHR 的收缩压。IHRF 诱导的血管松弛活性不是被一氧化氮合酶和环氧合酶抑制剂阻断的,而是被CCK1 受体的拮抗剂阻断的。IHRF 在食物摄入和胃肠道运输中也具有CCK 样抑制活性。IHRF 增加了肠内分泌细胞STC-1 中的细胞内Ca2+通量和CCK 释放。
Theysgeur 等[49]鉴定了罗非鱼副产物水解物中与刺激肠道激素CCK 和GLP-1 分泌有关的新肽序列。鉴于DPP-IV 可显著调控GLP-1 的活性,因此肽对DPP-IV 活性的影响也被研究。膳食蛋白质的模拟消化产生的水解产物对STC-1 细胞中的CCK 和GLP-1 分泌以及DPP-IV 抑制活性具有增强作用。Theysgeur 等[49]利用LC-MS-MS 技术对活性肽序列进行鉴定,发现肽序列LKPT 对GLP-1 分泌具有刺激作用,序列GPFPLLV,VAPEEHPT,VADTMEVV,DPLV 和FAMD 可对DPP-IV 具有抑制活性。
4 食源性生物活性肽调控肠道激素分泌的作用机制
4.1 EECs 表达的主要受体
EECs 表面表达多种受体用于感知生物活性肽。生物活性肽则通过激活特定的受体来激活EECs,表3 总结了EECs 表达的主要感应受体。味觉受体(TRs)是由2 个主要家族组成的G 蛋白偶联受体家族(GPCRs):T1R 家族由3 个受体(T1R1、T1R2 和T1R3)组成;T2R 家族检测一系列不同的苦味化合物。在回肠远端的I、K 和L 细胞中可检测到高表达的鲜味受体T1R1/T1R3[50]。GPR93(也称为GPR92 或LPAR5)在小鼠和人类的小肠中比其它营养感受器表达得更多,主要在位于小肠和结肠远端的L 细胞中表达[51-52]。GPRC6A 与CaSR 密切相关,表达于I 细胞,其可被钙离子、L-氨基酸及一些肽激活,特别是带正电荷的氨基酸,如精氨酸、赖氨酸和鸟氨酸。然而,一些对GPRC6A 基因缺失小鼠的研究表明,高蛋白饮食对小鼠的影响并不需要这种受体,碱性氨基酸诱导的GLP-1 的释放也可以不依赖于这种受体而发生[52]。GPR142 可以调节胃肠激素的释放,在小鼠的K 和L 细胞中表达[53]。在EECs 中,CaSR需要钙离子来诱导电压门控钙通道的开放,在缺乏钙的情况下,这种受体不能被其它激动剂激活[54-55]。PepT1 是一种质子偶联的二肽和三肽转运蛋白,已在从小肠到结肠的L 细胞中检测到。STC-1 细胞和分离的天然I 细胞表达PepT,而目前的数据表明该转运蛋白并不直接介导蛋白水解物引起的CCK 分泌[55-56]。
表3 EECs 表达的主要受体
Table 3 Major receptors expressed by EECs

4.2 食源性生物活性肽促进胃肠激素分泌的作用机制
生物活性肽通过特定受体来激活EECs 后进而通过胞内一系列信号转导通路引起肠道激素的合成的分泌。上述受体多属于GPCRs,主要通过与一系列G 蛋白偶联而发挥作用,包括Gq、Gi/o、Gs、G12/13。刺激Gq 可激活磷脂酶C(PLC),引起肌醇-3-磷酸(IP3)生成增加,进而促使内质网中Ca2+释放,使细胞内钙离子([Ca2+]i)增加;刺激Gi/o 可抑制腺苷酸环化酶(AC),减少cAMP 的生成;而刺激Gs 则可促进AC 活性,增加cAMP 的生成;刺激G12/13 可生成Ras 相似物A(RhoA)基因,进而活化磷脂酶D(PLD)产生磷脂酸以调节下游的信号转导途径。此外,GPCRs 亦可激活丝裂原活化的蛋白激酶(MAPKs,包括Erk、JNK、P38)以及PI3K/Ak等信号转导通路[57-59]。当前,虽然已有很多学者对不同来源的食源性生物活性肽促进肠道激素分泌的作用进行了大量的研究,但对活性肽发挥促肠道激素分泌作用的分子机制研究较少,主要集中于生物活性肽促进CCK 分泌的作用机制研究。
Choi 等[60]发现G 蛋白偶联受体GPR93 可被膳食蛋白水解物激活,提出了GPR93 可能参与了蛋白水解物诱导的CCK 表达和分泌。作者使用肠内分泌STC-1 细胞作为模型进行研究,发现增加GPR93 的表达可以增加蛋白水解物诱导的内源性CCK mRNA 水平。由820 bp CCK 启动子驱动的荧光素酶报告基因活性也表明CCK 转录的增加,也观察到对剂量低至 6.25 mg/mL 的蛋白水解物的反应。蛋白水解物诱导的CCK 转录的上调涉及ERK1/2、PKA 和钙调蛋白依赖性蛋白激酶介导的途径。此外,蛋白水解物对GPR93 的激活会在15 min 时诱导CCK 释放的反应,该反应持续2 h。过表达GPR93 的STC-1 细胞中cAMP 水平受水解物诱导的程度大于溶血磷脂酸(LPA),表明蛋白水解物和LPA 对CCK 转录和分泌的不同影响。这些结果表明GPR93 介导蛋白水解物诱导的CCK表达和分泌,并提供了G 蛋白偶联受体可以转导胃肠道饮食信号的证据。
大豆β-伴球蛋白肽(BconP)能够刺激CCK分泌,Hira 等[30]对其发挥促CCK 分泌活性的作用机制进行了研究,发现细胞内钙离子螯合剂BAPTA-AM 可减少BconP 诱导的CCK 分泌;用二苯基硼酸-2-氨基乙酯(2-APB)处理后,CCK 分泌亦减少。此外,经Gαq 蛋白抑制剂YM254890 处理后,BconP 不能诱导CCK 分泌。说明Gαq 通路参与了BconP 诱导的STC-1 细胞CCK 的分泌。与大豆β-伴球蛋白肽发挥作用的机制不同,Némoz-Gaillard 等[61]研究发现,卵清蛋白水解物促进CCK分泌的机制涉及激活Gi/o 蛋白和增加胞内Ca2+浓度。
Zhou 等[62]分别通过模拟胃肠消化(KPHSD)和碱性蛋白酶水解(KPHAP)制备了南极磷虾蛋白水解物,并利用STC-1 细胞模型研究了水解产物对胆囊收缩素(CCK)分泌和cAMP 反应元件结合蛋白(CREB)活化的影响;同时,通过使用信号蛋白抑制剂研究了水解产物诱导CCK 分泌的信号机制。研究结果表明,KPHSD 和KPHAP 均能显著刺激CCK 分泌和CREB 活化;对CCK 释放的刺激作用与相对分子质量在1 000~3 000 u 范围的肽的相对含量呈正相关关系,表明该肽组分是主要活性成分。钙敏感受体、PKA、Ca2+/CaMKII、p38-MAPK 抑制剂和细胞内钙螯合剂均抑制磷虾蛋白水解物诱导的CCK 分泌和CREB 活化,表明Ca2+/CaM/CaMK、cAMP/PKA 和MAPK 通路在蛋白水解物促进CCK 分泌中的作用。
5 结论与展望
食源性生物活性肽在食品领域具有重要的应用价值和广泛的应用前景。当前,围绕不同蛋白来源的食源性生物活性肽在促进肠道激素分泌的活性评价方面已经开展了较多的研究,并取得了一些研究结果,而对食品性生物活性肽发挥促肠道激素分泌活性的结构特征及具体作用机制研究仍然不够充分。建议后续可围绕以下几个方面开展研究:1)食源性生物活性肽的蛋白来源和制备方式影响其活性,有必要加强肽结构特征和促进肠道激素分泌活性的关系研究,明确促肠道激素分泌肽的构效关系;2)深入系统研究食源性生物活性肽发挥促肠道激素分泌活性的作用机制,为其应用提供理论依据;3)开展临床试验,明确食源性生物活性肽对人体肠道激素分泌及生理功能的影响,进而开发相应的健康食品。
[1] CHEN X A,ZHAI X Y,TONG C Q,et al.Research progress on interaction between bioactive peptides and gut microbiota[J].Journal of Food Safety &Quality,2022,13(4):1044-1049.
[2] GRIBBLE F M,REIMANN F.Function and mechanisms of enteroendocrine cells and gut hormones in metabolism[J].Nature Reviews Endocrinology,2019,15(4):226-237.
[3] WORTHINGTON J J,REIMANN F,GRIBBLE F M.Enteroendocrine cells-sensory sentinels of the intestinal environment and orchestrators of mucosal immunity[J].Mucosal Immunology,2018,11(1):3-20.
[4] GRIBBLE F M,REIMANN F.Enteroendocrine cells:Chemosensors in the intestinal epithelium[J].Annual Review of Physiology,2016,78:277-299.
[5] MCCAULEY H A.Enteroendocrine regulation of nutrient absorption[J].The Journal of Nutrition,2020,150(1):10-21.
[6] LATORRE R,STERNINI C,DE GIORGIO R,et al.Enteroendocrine cells:A review of their role in brain-gut communication[J].Neurogastroenterology &Motility,2016,28(5):620-630.
[7] KUHRE R E,ALBRECHTSEN N J W,DEACON C F,et al.Peptide production and secretion in GLUTag,NCI-H716 and STC-1 cells:A comparison to native L-cells[J].Journal of Molecular Endocrinology,2016,56(3):201.
[8] CHAUDHRI O B,FIELD B,BLOOM S R.Gastrointestinal satiety signals[J].International Journal of Obesity,2009,32(Suppl 7):S28-S31.
[9] SANTOS-HERNÁNDEZ M,MIRALLES B,AMIGO L,et al.Intestinal signaling of proteins and digestion-derived products relevant to satiety[J].Journal of Agricultural and Food Chemistry,2018,66(39):10123-10131.
[10] CARON J,CUDENNEC B,DOMENGER D,et al.Simulated GI digestion of dietary protein:Release of new bioactive peptides involved in gut hormone secretion[J].Food Research International,2016,89:382-390.
[11] NISHI T,HARA H,HIRA T,et al.Dietary protein peptic hydrolysates stimulate cholecystokinin release via direct sensing by rat intestinal mucosal cells [J].Experimental Biology and Medicine,2001,226(11):1031-1036.
[12] CAWCHON C R,DE LA SERRE C B.The critical role of CCK in the regulation of food intake and diet-induced obesity[J].Peptides,2021,138,170492.
[13] SANTOS-HERNÁNDEZ M,AMIGO L,RECIO I.Induction of CCK and GLP-1 release in enteroendocrine cells by egg white peptides generated during gastrointestinal digestion[J].Food Chemistry,2020,329:127188.
[14] BEN-HARCHACHE S,ROCHE H M,CORISH C A,et al.The impact of protein supplementation on appetite and energy intake in healthy older adults:A systematic review with meta-analysis[J].Advances in Nutrition,2021,12(2):490-502.
[15] MORLEY J E.The ascent of cholecystokinin(CCK)-From gut to brain[J].Life Sciences,1982,30(6):479-493.
[16] RAYBOULD H E.Mechanisms of CCK signaling from gut to brain[J].Current Opinion in Pharmacology,2007,7(6):570-574.
[17] HÖKFELT T,REHFELD J F,SKIRBOLL L,et al.Evidence for coexistence of dopamine and CCK in meso-limbic neurones[J].Nature,1980,285(5765):476-478.
[18] GRESPAN E,GIORGINO T,NATALI A,et al.Different mechanisms of GIP and GLP-1 action explain their different therapeutic efficacy in type 2 diabetes[J].Metabolism,2021,114:154415.
[19] NAUCK M A,BALLER B,MEIER J J.Gastric inhibitory polypeptide and glucagon-like peptide-1 in the pathogenesis of type 2 diabetes[J].Diabetes,2004,53(S3):S190-S196.
[20] BAGGIO L L,DRUCKER D J.Biology of incretins:GLP-1 and GIP[J].Gastroenterology,2007,132(6):2131-2157.
[21] MCCLEAN P L,IRWIN N,CASSIDY R S,et al.GIP receptor antagonism reverses obesity,insulin resistance,and associated metabolic disturbances induced in mice by prolonged consumption of high-fat diet[J].American Journal of Physiology-Endocrinology and Metabolism,2007,293(6):E1746-E1755.
[22] RINDI G,LEITER A B,KOPIN A S,et al.The "normal" endocrine cell of the gut:Changing concepts and new evidences[J].Annals of the New York Academy of Sciences,2004,1014(1):1-12.
[23] MÜLLER T D,FINAN B,BLOOM S R,et al.Glucagon -like peptide 1(GLP -1)[J].Molecular Metabolism,2019,30:72-130.
[24] DRUCKER D J.The biology of incretin hormones[J].Cell Metabolism,2006,3(3):153-165.
[25] EKBLAD E,SUNDLER F.Distribution of pancreatic polypeptide and peptide YY[J].Peptides,2002,23(2):251-261.
[26] BOHÓRQUEZ D V,CHANDRA R,SAMSA L A,et al.Characterization of basal pseudopod-like processes in ileal and colonic PYY cells[J].Journal of Molecular Histology,2011,42(1):3-13.
[27] BATTERHAM R L,COHEN M A,ELLIS S M,et al.Inhibition of food intake in obese subjects by peptide YY3 -36 [J].New England Journal of Medicine,2003,349(10):941-948.
[28] SHI Y C,HAMMERLE C M,LEE I C J,et al.Adult -onset PYY overexpression in mice reduces food intake and increases lipogenic capacity[J].Neuropeptides,2012,46(4):173-182.
[29] STEINERT R E,GERSPACH A C,GUTMANN H,et al.The functional involvement of gut-expressed sweet taste receptors in glucose-stimulated secretion of glucagon-like peptide-1(GLP-1)and peptide YY(PYY)[J].Clinical Nutrition,2011,30(4):524-532.
[30] HIRA T,MAEKAWA T,ASANO K,et al.Cholecystokinin secretion induced by β-conglycinin peptone depends on Gαq-mediated pathways in enteroendocrine cells[J].European Journal of Nutrition,2009,48(2):124-127.
[31] CATIAU L,DELVAL-DUBOIS V,GUILLOCHON D,et al.Characterization and identification of a chymotryptic hydrolysate of alpha-lactalbumin stimulating cholecystokinin release in STC-1 cells[J].Applied Biochemistry and Biotechnology,2011,165(5):1264-1273.
[32] SANTOS-HERNÁNDEZ M,AMIGO L,RECIO I.Induction of CCK and GLP-1 release in enteroendocrine cells by egg white peptides generated during gastrointestinal digestion[J].Food Chemistry,2020,329:127188.
[33] HIRA T,MOCHIDA T,MIYASHITA K,et al.GLP-1 secretion is enhanced directly in the ileum but indirectly in the duodenum by a newly identified potent stimulator,zein hydrolysate,in rats[J].American Journal of Physiology-Gastrointestinal and Liver Physiology,2009,297(4):G663-G671.
[34] KATO M,NAKANISHI T,TANI T,et al.Lowmolecular fraction of wheat protein hydrolysate stimulates glucagon-like peptide-1 secretion in an enteroendocrine L cell line and improves glucose tolerance in rats[J].Nutrition Research,2017,37:37-45.
[35] CUDENNEC B,FOUCHEREAU-PERON M,FERRY F,et al.In vitro and in vivo evidence for a satiating effect of fish protein hydrolysate obtained from blue whiting(Micromesistius poutassou)muscle[J].Journal of Functional Foods,2012,4(1):271-277.
[36] SUFIAN M K N B,HIRA T,ASANO K,et al.Peptides derived from dolicholin,a phaseolin-like protein in country beans(Dolichos lablab),potently stimulate cholecystokinin secretion from enteroendocrine STC-1 cells[J].Journal of Agricultural and Food Chemistry,2007,55(22):8980-8986.
[37] YANG Y,GUO Q Q,GUAN H N,et al.Effects of soy protein isolate hydrolysates on cholecystokinin released by rat intestinal mucosal cells and food intake in rats[J].Journal of Food Science and Technology,2020,57(12):4459-4468.
[38] CUDENNEC B,RAVALLEC-PLÉ R,COUROIS E,et al.Peptides from fish and crustacean by-products hydrolysates stimulate cholecystokinin release in STC-1 cells[J].Food Chemistry,2008,111(4):970-975.
[39] SUFIAN M,HIRA T,MIYASHITA K,et al.Pork peptone stimulates cholecystokinin secretion from enteroendocrine cells and suppresses appetite in rats[J].Bioscience,Biotechnology,and Biochemistry,2006,70(8):1869-1874.
[40] ISHIKAWA Y,HIRA T,INOUE D,et al.Rice protein hydrolysates stimulate GLP-1 secretion,reduce GLP-1 degradation,and lower the glycemic response in rats[J].Food &Function,2015,6(8):2525-2534.
[41] CHEN W,HIRA T,NAKAJIMA S,et al.Wheat gluten hydrolysate potently stimulates peptide -YY secretion and suppresses food intake in rats[J].Bioscience,Biotechnology,and Biochemistry,2018,82(11):1992-1999.
[42] IZUMI H,ISHIZUKA S,INAFUNE A,et al.α-Lactalbumin hydrolysate stimulates glucagon -like peptide-2 secretion and small intestinal growth in suckling rats[J].The Journal of Nutrition,2009,139(7):1322-1327.
[43] O'HALLORAN F,BRUEN C,MCGRATH B,et al.A casein hydrolysate increases GLP-1 secretion and reduces food intake[J].Food Chemistry,2018,252:303-310.
[44] GILLESPIE A L,CALDERWOOD D,HOBSON L,et al.Whey proteins have beneficial effects on intestinal enteroendocrine cells stimulating cell growth and increasing the production and secretion of incretin hormones[J].Food Chemistry,2015,189:120-128.
[45] KOYAMA D,SASAI M,MATSUMURA S,et al.A milk-derived pentapeptide reduces blood pressure in advanced hypertension in a CCK system-dependent manner[J].Food &Function,2020,11(11):9489-9494.
[46] SASAI M,SUN X H,OKUDA C,et al.Orally active anti -hypertensive peptides found based on enteroendocrine cell responses to a dipeptide library[J].Biochemical and Biophysical Research Communications,2018,503(2):1070-1074.
[47] KAGEBAYASHI T,KONTANI N,YAMADA Y,et al.Novel CCK-dependent vasorelaxing dipeptide,Arg-Phe,decreases blood pressure and food intake in rodents[J].Molecular Nutrition &Food Research,2012,56(9):1456-1463.
[48] KONTANI N,OMAE R,KAGEBAYASHI T,et al.Characterization of Ile-His-Arg-Phe,a novel ricederived vasorelaxing peptide with hypotensive and anorexigenic activities[J].Molecular Nutrition &Food Research,2014,58(2):359-364.
[49] THEYSGEUR S,CUDENNEC B,DERACINOIS B,et al.New bioactive peptides identified from a tilapia byproduct hydrolysate exerting effects on DPP-IV activity and intestinal hormones regulation after canine gastrointestinal simulated digestion [J].Molecules,2020,26(1):136.
[50] TIAN M,HENG J H,SONG H Q,et al.Branched chain amino acids stimulate gut satiety hormone cholecystokinin secretion through activation of the umami taste receptor T1R1/T1R3 using an in vitro porcine jejunum model[J].Food &Function,2019,10(6):3356-3367.
[51] SPRECKLEY E,MURPHY K G.The L-cell in nutritional sensing and the regulation of appetite[J].Frontiers in Nutrition,2015,2:1-16.
[52] SYMONDS E L,PEIRIS M,PAGE A J,et al.Mechanisms of activation of mouse and human enteroendocrine cells by nutrients[J].Gut,2015,64(4):618-626.
[53] NORTON M,MURPHY K G.Targeting gastrointestinal nutrient sensing mechanisms to treat obesity[J].Current Opinion in Pharmacology,2017,37:16-23.
[54] CONIGRAVE A D,WARD D T.Calcium-sensing receptor(CaSR):Pharmacological properties and signaling pathways [J].Best Practice &Research Clinical Endocrinology &Metabolism,2013,27(3):315-331.
[55] DIAKOGIANNAKI E,PAIS R,TOLHURST G,et al.Oligopeptides stimulate glucagon-like peptide-1 secretion in mice through proton-coupled uptake and the calcium-sensing receptor[J].Diabetologia,2013,56(12):2688-2696.
[56] LIOU A P,CHAVEZ D I,ESPERO E,et al.Protein hydrolysate -induced cholecystokinin secretion from enteroendocrine cells is indirectly mediated by the intestinal oligopeptide transporter PepT1 [J].American Journal of Physiology-Gastrointestinal and Liver Physiology,2011,300(5):G895-G902.
[57] HILGER D,MASUREEL M,KOBILKA B K.Structure and dynamics of GPCR signaling complexes[J].Nature Structural &Molecular Biology,2018,25(1):4-12.
[58] RIBAS C,PENELA P,MURGA C,et al.The G protein-coupled receptor kinase(GRK)interactome:Role of GRKs in GPCR regulation and signaling[J].Biochimica et Biophysica Acta(BBA)-Biomembranes,2007,1768(4):913-922.
[59] LATORRACA N R,MASUREEL M,HOLLING -SWORTH S A,et al.How GPCR phosphorylation patterns orchestrate arrestin -mediated signaling [J].Cell,2020,183(7):1813-1825.e18.
[60] CHOI S,LEE M,SHIU A L,et al.GPR93 activation by protein hydrolysate induces CCK transcription and secretion in STC-1 cells[J].American Journal of Physiology Gastrointestinal &Liver Physiology,2007,292(5):G1366.
[61] NÉMOZ-GAILLARD E,BERNARD C,ABELLO J,et al.Regulation of cholecystokinin secretion by peptones and peptidomimetic antibiotics in STC-1 cells[J].Endocrinology,1998,139(3):932-938.
[62] ZHOU D Y,LIU Z Y,ZHAO J,et al.Antarctic Krill(Euphausia superba)protein hydrolysates stimulate cholecystokinin release in STC-1 cells and its signaling mechanism[J].Journal of Food Processing and Preservation,2017,41(3):e12903.