类胡萝卜素与人类的健康有紧密的联系。人和动物均不可以实现其在身体内部合成,只能经由食物的途径摄取[1]。有研究证明类胡萝卜素在抗氧化[2]、抗肿瘤[3]、降脂[4]、抗糖尿病[5]、增强免疫力[6]和预防心脑血管疾病[7]等方面展示了巨大潜力。
在研究蛋白质与小分子互作机制时,人血清白蛋白(Human serum albumin,HSA)是最普遍使用的模型蛋白[8]。HSA 是单肽链的蛋白,其结构中有3 个同源结构域(I、II、III),每个结构域又可细分为A 和B 两个亚结构域,独特的结构能实现和内源及外源性的小分子化合物结合,并跟随血液循环对小分子实现靶向递送[9-10]。在体外模拟的生理条件下,对天然活性成分和HSA 的结合进行研究,有利于在分子水平上探索天然活性成分在体内的作用机制。
在人体血浆中含量最高的类胡萝卜素包括β-胡萝卜素(β-CA)、番茄红素(LYC)、叶黄素(LUT)[11]。它们具有抗氧化、抗肿瘤、抗糖尿病等多种生理活性。又因类胡萝卜素种类繁多,各自的功能也会有所不同。β-CA 是合成维生素A 的前体[12],LUT 是构成人体视网膜黄斑区域的重要物质[13],LYC 对心血管疾病具有一定的预防功能[14]。然而,水溶性差,受光、热、氧的影响易异构化,限制了类胡萝卜素应用[15]。
目前,关于酚类化合物、药物等与HSA 相互作用的研究较为多,而有关比较不同类胡萝卜素与HSA 结合的报道较少。本文以HSA 为载体蛋白,选取3 种类胡萝卜素为配体分子,通过荧光光谱技术探究3 种类胡萝卜素与HSA 相互作用的机制,为类胡萝卜素的活性开发、靶向递送提供参考。
1 材料与方法
1.1 材料与试剂
HSA(纯度≥98%),购自上海伊卡生物科技有限公司;LUT(纯度≥98%)、β-CA(纯度≥98%)、LYC(纯度≥98%),购自上海萌芽生物科技有限公司;保泰松(PHE,纯度≥99%)和布洛芬(IBU,纯度≥99%),购自北京百灵威科技有限公司;试验用水为超纯水,磷酸氢二钠、无水乙醇、二甲基亚砜(DMSO)、柠檬酸等均为分析纯级,购自生工生物工程(上海)股份有限公司。
1.2 仪器与设备
F-7000 荧光分光光度计,日本日立高新技术公司;FE20PH 计,梅特勒-托利多仪器(上海)有限公司;Milli-Q Reference 型超纯水机,德国默克密理博有限公司。
1.3 方法
1.3.1 溶液的配制 磷酸缓冲液(PBS,pH 7.4)用柠檬酸、磷酸氢二钠配制,浓度为0.2 mol/L,HSA溶液用PBS 缓冲液配制成1.2×10-4 mol/L 的储备液。LUT、PHE 用无水乙醇配制,浓度为7.2×10-4 mol/L。IBU 用PBS 缓冲液配制,浓度为7.2×10-4 mol/L。β-CA、LYC 用DMSO 配制,浓度为7.2×10-4 mol/L。以上试剂均存放于4 ℃的冰箱中备用。
1.3.2 LUT/β-CA/LYC 与HSA 相互作用的荧光光谱测定
1.3.2.1 荧光发射光谱 先将一定体积PBS 缓冲溶液加入离心管,然后加入30 μL 的HSA,最后加入一定体积的LUT、β-CA、LYC,得到混合溶液3 mL,静置30 min,使之充分反应,最后使HSA 浓度为1.2×10-6 mol/L,LUT、β-CA、LYC 的浓度为0,6×10-6,12×10-6,18×10-6,24×10-6,30×10-6,36×10-6,42×10-6 mol/L。设定反应温度为298 K、310 K,激发和发射光栅分别设置为2.5 nm 和5 nm,激发波长为280 nm,290~450 nm 范围内记录荧光光谱。
1.3.2.2 同步荧光光谱 设Δλ 分别为60 nm 和15 nm,在310 K、激发光栅2.5 nm、发射光栅5 nm 条件下,在波长250~350 nm 范围测定同步荧光光谱。
1.3.2.3 三维荧光光谱 固定HSA 的浓度为1.2×10-6 mol/L,LUT、β-CA、LYC 的浓度为6×10-6 mol/L,在310 K、200~350 nm 的激发波长和250~500 nm 发射波长下测量HSA 以及加入LUT、β-CA、LYC 后的三维荧光。
1.3.3 LUT/β-CA/LYC 与人血清白蛋白的结合位点分析 参照1.3.2 节的方法,先加入PHE/IBU,使其浓度为6.0×10-6 mol/L,然后加入LUT/β-CA/LYC 后续操作与1.3.2 节相同。
1.3.4 分子对接 采用AutoDock vina 4.0 软件研究LUT、β-CA、LYC 与HSA 对接。HSA(ID:1HA2)来源于RCSB PDB 数据库,LUT(CID:5281243)、β -CA(CID:5280489)、LYC(CID:446925)结构来源于PubChem。通过Pymol 软件去除HSA 结构中存在的水,并添加H 原子。网格大小保持在82×104×80,间距为1 Å,以覆盖整个受体分子。HSA 设为刚性对接,配体设为柔性对接。其它对接参数保持默认,选择结合能最低的对接构象进行评估。对接后相互作用力的分析是用Discovery Studio v17.2.0 进行。
1.4 统计分析
试验均重复设3 组,结果表示为xˉ±s,采用Origin V9.0 软件进行绘图。
2 结果与讨论
2.1 类胡萝卜素对HSA 的荧光猝灭作用
图1 为在298 K 和310 K 时,加入LUT(图1a)、β-CA(图1b)和LYC(图1c)前、后的HSA 荧光发射光谱图。当激发波长为280 nm 时,HSA 的最大发射波长(λmax)在340 nm 处。随着LUT、β-CA 和LYC 浓度的递增,HSA 的荧光强度逐渐减弱,且峰形无显著变化,峰值分别下降了35.4%,72.7%和62.8%。这些结果表明LUT、β-CA 和LYC可以与HSA 发生相互作用,并且对HSA 内源荧光强度的猝灭能力为β-CA>LYC>LUT。在加入LUT、β-CA 后,HSA 的λmax 均发生了2 nm 的微弱蓝移,而加入LYC 后最大吸收峰未发生移动,这说明LUT、β-CA 的存在,改变了荧光发色团附近的微环境,疏水性增强。


图1 LUT(a)、β-CA(b)、LYC(c)对HSA 荧光猝灭作用
Fig.1 Fluorescence quenching of HSA by LUT(a),β-CA(a)and LYC(c)
注:1~8 配体浓度依次为0,6,12,18,24,30,36,42 μmol/L。
2.2 荧光猝灭机理和结合常数
通常用荧光猝灭机理来研究HSA 和小分子之间的相互作用。荧光猝灭类型主要分为静态和动态[16-17]。通过Stern-Volmer 方程(1)和Acharya方程(2)分析荧光猝灭机理。
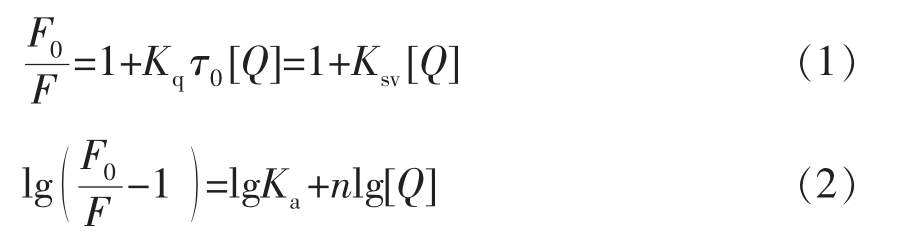
式中,F0——未加入LUT/β-CA/LYC 时HSA的荧光强度;F——加入LUT/β-CA/LYC 时HSA的荧光强度;[Q]——LUT/β-CA/LYC 的浓度,mol/L;Kq——双分子猝灭速率常数,L/(mol·s);τ0 为荧光团的平均寿命,其值为10-8 s;Ksv 为猝灭常数,L/mol;Ka——结合常数,L/mol;n——结合位点数,个。
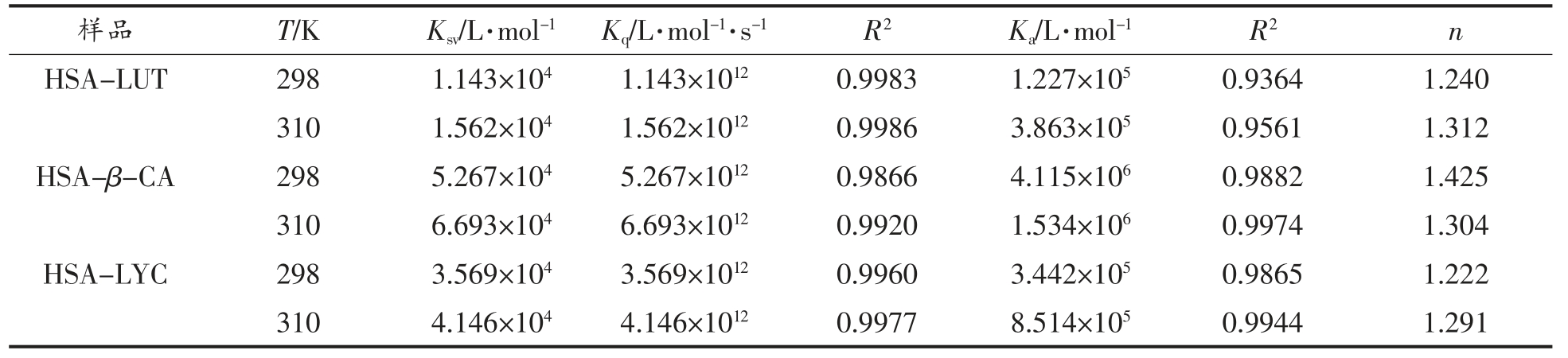
由表1 可知,R2 的值越接近于1,数据越精确。根据方程(1),可计算不同条件下LUT/β-CA/LYC 与HSA 结合的猝灭常数Ksv。如表1所示,在HSA 中分别加入LUT、β-CA、LYC 后,Ksv 的值与温度呈正相关,而Kq 均远大于2×1010 L/(mol·s)(生物分子的最大散射碰撞猝灭常数),说明LUT、β-CA、LYC 均对HSA 产生静态猝灭,即LUT、β-CA、LYC 与HSA 结合形成了复合物[18]。根据方程(2),分别计算出LUT、β-CA、LYC 与HSA 结合常数都在104~106 数量级,证明LUT、β-CA、LYC 与HSA 的结合能力均较强[19],结合能力β-CA>LYC>LUT。如表1所示,HSA 与LUT、β-CA、LYC 的结合位点数(n)均在1 附近,因此可以推断LUT、β-CA、LYC 均与HSA 均有单个结合位点。
表1 LUT、β-CA、LYC 与HSA 相互作用的常数
Table 1 Interaction constants of LUT,β-CA,LYC with HSA
样品T/KKsv/L·mol-1Kq/L·mol-1·s-1R2Ka/L·mol-1R2n HSA-LUT2981.143×1041.143×10120.99831.227×1050.93641.240 3101.562×1041.562×10120.99863.863×1050.95611.312 HSA-β-CA2985.267×1045.267×10120.98664.115×1060.98821.425 3106.693×1046.693×10120.99201.534×1060.99741.304 HSA-LYC2983.569×1043.569×10120.99603.442×1050.98651.222 3104.146×1044.146×10120.99778.514×1050.99441.291
2.3 热力学性质和作用力类型
热力学参数采用Van't Hoff 方程(3)和热力学方程(4)计算。
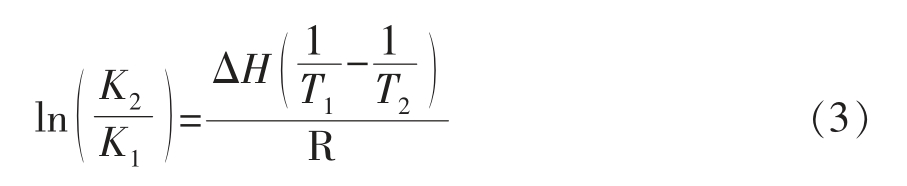
式中,K1——T1 时蛋白与小分子的结合常数,K;K2——T2 时蛋白与小分子的结合常数,L/mol;ΔH——焓变,kJ/mol;ΔG——吉布斯自由能变,kJ/mol;ΔS——熵变,J/(mol·K);R——气体摩尔常数,8.314 J/(mol·K)。
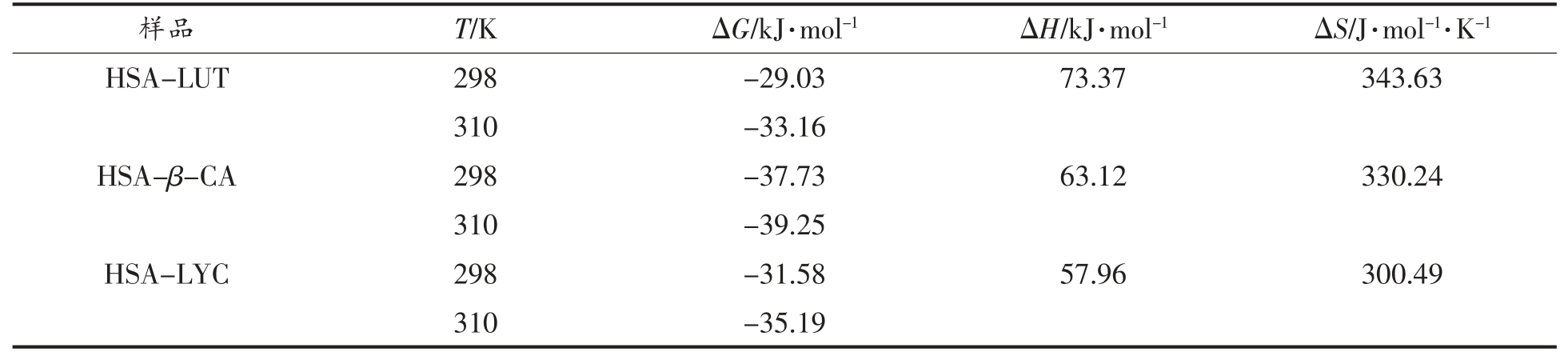
从理论上讲,当ΔH<0 且ΔS>0,主要作用力为静电相互作用;当ΔH>0,ΔS<0 时,主要作用力为静电相互作用和疏水相互作用;当ΔH<0,ΔS<0时,主要作用力为氢键与范德华力;ΔH>0,ΔS>0时,主要作用力为疏水相互作用[20]。由表2,LUT、β-CA、LYC 分别与HSA 结合时,ΔH>0,ΔS>0,ΔG增加(ΔG<0),熵变化的正值表明水分子以有序的方式排列在HSA 附近,LUT、β-CA、LYC 的相互作用使其随机化排列[21]。ΔH 为正值证实了HSA-类胡萝卜素复合物的形成本质上是吸热的。ΔG 的值由热力学方程计算,其值为负表明LUT、β-CA、LYC 与HSA 的相互作用是自发的[22]。ΔS 和ΔH 均为正值,表明LUT、β-CA、LYC 主要通过疏水相互作用与HSA 结合,进一步说明了LUT、β-CA、LYC可以与HSA 发生反应形成复合物。
表2 LUT、β-CA、LYC 与HSA 相互作用的热力学常数
Table 2 Thermodynamic constants for the interaction between LUT,β-CA,LYC with HSA
?样品T/KΔG/kJ·mol-1ΔH/kJ·mol-1ΔS/J·mol-1·K-1 HSA-LUT298-29.0373.37343.63 310-33.16 HSA-β-CA298-37.7363.12330.24 310-39.25 HSA-LYC298-31.5857.96300.49 310-35.19
2.4 LUT、β-CA、LYC 与HSA 相互作用的同步荧光光谱
采用同步荧光光谱技术对荧光团氨基酸残基Trp 和Tyr 的微环境变化进行分析。Tyr 的微环境信息在Δλ=15 nm 处获得,而Trp 的微环境信息在Δλ=60 nm 处获得[23]。HSA 中氨基酸残基的λmax 与环境的疏水性有关。若λmax 蓝移,则HSA 暴露于疏水环境,其极性降低,反之亦然[24]。因此,可以通过观察λmax 的偏移判断HSA 构象的变化。
图2所示的同步荧光光谱,伴随LUT 浓度的升高,荧光发射光谱中记录的Tyr 和Trp 的荧光强度逐渐降低,Trp 的荧光强度降低更显著。Tyr残基的λmax 向长波长(约1 nm)方向移动,这反映出Trp 残基处附近的环境极性更强,更容易在溶剂里暴露;相反,Trp 残基λmax 的轻微蓝移(约1 nm)表明其附近暴露的环境疏水性增强。伴随β-CA 的加入,Trp 残基的λmax 未出现明显移动,Tyr残基的λmax 红移了1 nm。LYC 逐渐加入后,Δλ=60 nm 时,λmax 略微蓝移1 nm。以上结果可以推测出LUT、β-CA、LYC 均与HSA 发生相互作用,并且使HSA 的构象发生了变化。

图2 LUT(a)、β-CA(b)、LYC(c)与HSA 相互作用的同步荧光光谱
Fig.2 Synchronous fluorescence spectra of HSA without and with LUT(a),β-CA(b)and LYC(c)
注:1~8 配体浓度依次为0,6,12,18,24,30,36,42 μmol/L。
2.5 LUT、β-CA、LYC 与HSA 相互作用的三维荧光光谱
三维荧光光谱可同时获取激发和发射的两个不同维度的荧光强度信息,从而更全面、更直观地观察HSA 的结构变化[25]。对于荧光光谱,峰a 主要反映色氨酸由于n→π*跃迁引起的光谱变化,峰b反映π→π*引起的HSA 多肽骨架的光谱变化[26]。
图3 为HSA 以及LUT、β-CA、LYC 分别与HSA 结合后的三维荧光光谱图。HSA 的荧光团Trp 和Tyr 残基在波长280 nm 处激发,由峰a 表示(λex=278 nm,λem=340 nm)。多肽骨架的特征峰由峰b 表示(λex=228 nm,λem=340 nm),荧光强度分别为8 331 和4 510。峰b 的λmax 蓝移了2 nm。峰b 强度降低及蓝移,表明HSA 中荧光基团周围的微环境非极性增强。随着LUT 的加入,HSA 的峰a 和峰b 的荧光强度分别降低了3.2%和2.8%,峰a 强度降低,表明LUT 的加入使HSA 多肽链发生变化,进而改变了HSA 的构象;峰b 的λmax 蓝移2 nm,反映出HSA 荧光团残基的微环境被改变,非极性增强。随着β-CA 的加入,HSA 的峰a和峰b 的荧光强度分别降低了19.52%和65.81%,峰b 的λmax 蓝移4 nm,这表明β-CA 的加入改变了HSA 荧光团残基的微环境。随着LYC 的加入,HSA 的峰a 和峰b 的荧光强度分别降低了13.42%和64.66%。以上结果均表明LUT 或β-CA 或LYC的加入,使得HSA 的构象发生了变化。
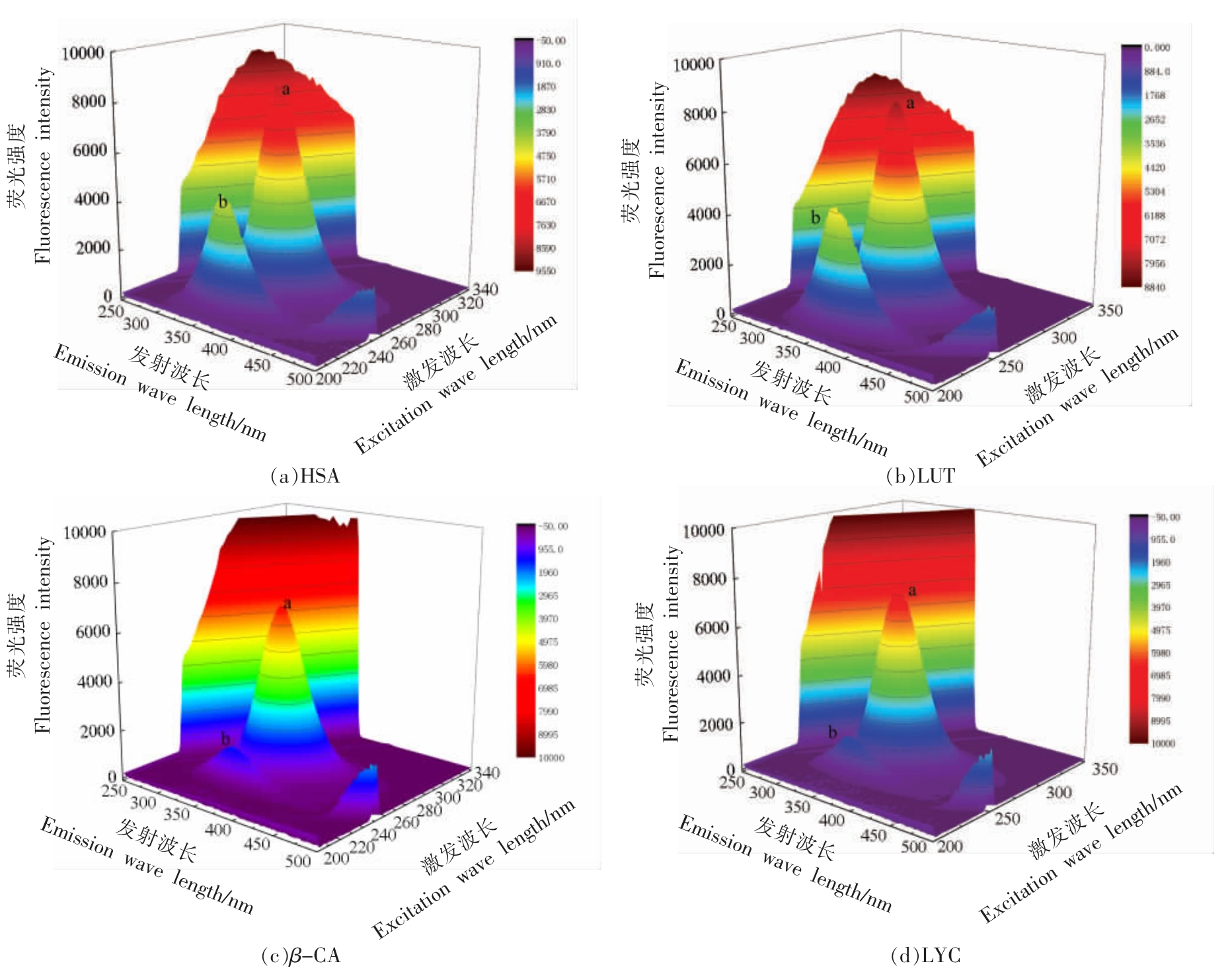
图3 HSA 及LUT、β-CA(c)、LYC 与HSA 相互作用的三维荧光光谱图
Fig.3 Three-dimensional fluorescence spectra of HSA(a),and the interaction of LUT,β-CA,LYC with HSA
2.6 LUT、β-CA、LYC 与HSA 结合位点的分析
位点1 和位点2 是HSA 的主要药物结合位点。已建立的特异性位点标记通常用于了解分子与HSA 的确切结合位点[27]。保泰松(PHE)作为IIA子域(Sudlow's site I)的既定位点标记,布洛芬(IBU)作为IIIA 子域(Sudlow's site II)位点的荧光探针[28]。进行位点竞争试验更加深入了解LUT、β-CA、LYC 与HSA 上这些位点的结合。
图4 表示两个荧光探针对于LUT/β-CA/LYC与HSA 结合荧光光谱的影响。如图4所示,IBU的存在,对LUT/β-CA/LYC 与HSA 的结合没有产生影响,从内插图可以看出IBU 的存在对HSA 猝灭率影响不大,表明LUT/β-CA/LYC 与HSA 的结合位点与IBU 的不同,说明LUT/β-CA/LYC 与HSA 的结合不在亚结构域IIIA 附近。而PHE 的存在,降低了LUT/β-CA/LYC 与HSA 的结合,表明LUT/β-CA/LYC 与HSA 的结合位点与PHE 的相同,在亚结构域IIA 附近(Sudlow's site I)。
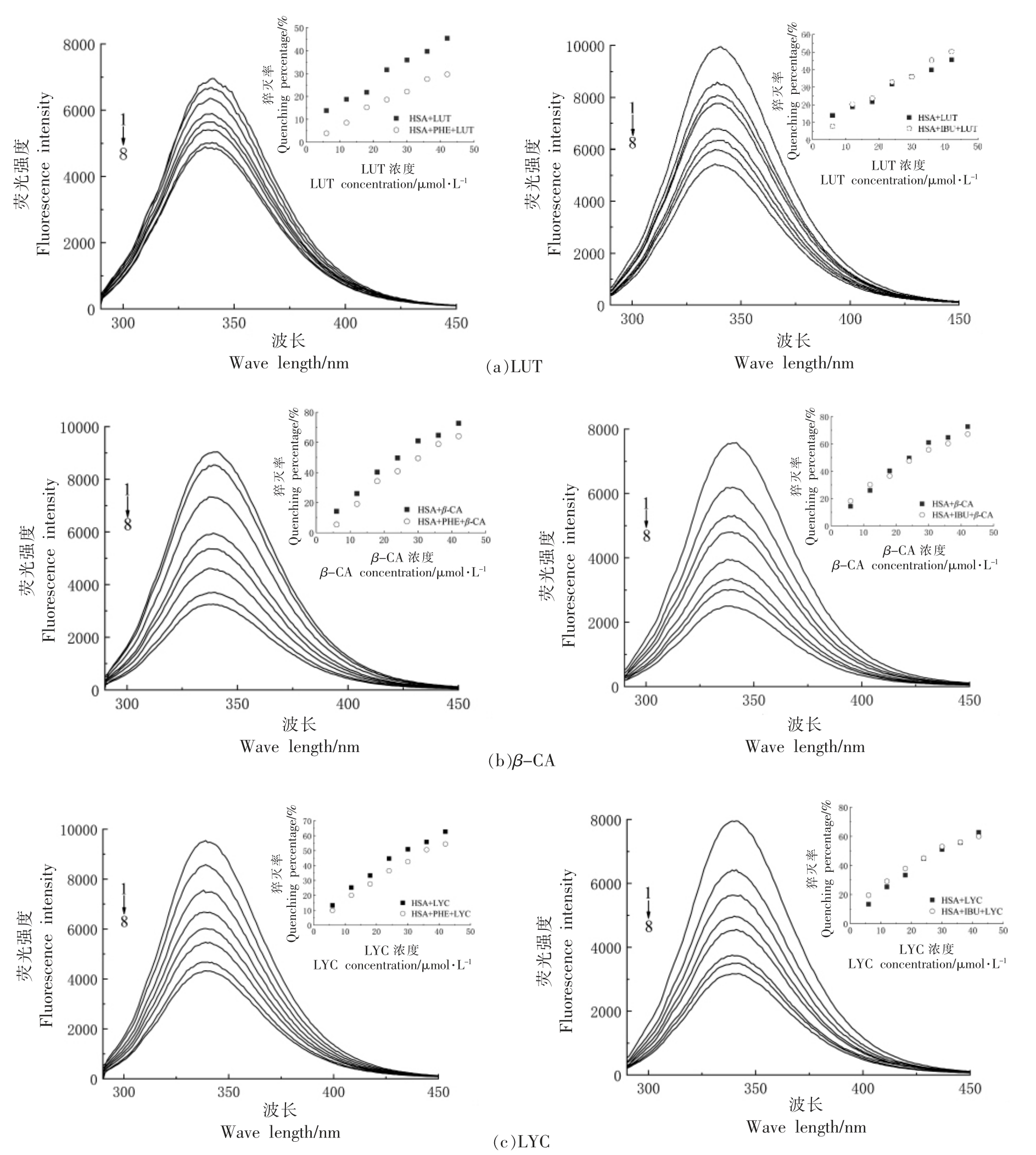
图4 PHE 或IBU 存在下,LUT、β-CA、LYC 对HSA 荧光光谱的影响
Fig.4 Fluorescence quenching of HSA by LUT,β-CA and LYC at the present of PHE or IBU
注:1~8 配体浓度依次为0,6,12,18,24,30,36,42 μmol/L。
2.7 分子模拟
分子对接技术能在短时间内提供小分子与生物大分子的结合的详细信息,在新治疗药物的开发中发挥积极作用[29]。利用Autodock vina 软件分析LUT、β-CA、LYC 在HSA 上可能存在的结合位点。对于每种配体,Autodock vina 分析出10 种对接结果,根据结合能最小的部位选取最佳构象。LUT、β-CA、LYC 与HSA 结合得出的ΔG 分别为-38.11 kJ/mol,-43.07 kJ/mol,-45.62 kJ/mol,由图5可知,LUT 结合在site I 位点,位于主荧光Trp214附近,主要作用力为疏水相互作用与Lys195、Ala291、Trp214、Leu198、Lys199、Phe211、Ala210等残基形成。β-CA 位于IA 与IIA 之间,主要作用力为疏水相互作用,与Leu251、Ala258、Leu284、Pro152、Leu22、Phe27、Val23 等残基形成。LYC 位于IA 与IIA 之间,与Ala258、Pro152、Leu283、Phe27、Leu251、Val46、Phe49 等残基形成疏水相互作用,并且为主要表现力。以上分析与位点竞争试验和计算的热力学常数的结果一致。

图5 LUT、β-CA、LYC 与HSA 的预测结合位点、结合位点氨基酸及作用力
Fig.5 Predicted binding sites,the binding sites amino acids and interaction forces of between LUT,β-CA,LYC with HSA
3 结论
采用荧光光谱法研究了3 种类胡萝卜素LUT、β-CA、LYC 与HSA 的结合作用,经过分析计算出相关信息,采用同步荧光结合三维荧光研究3 种类胡萝卜素对HSA 构象的影响,采用位点Marker 试验结合分子对接分析结合位点。结果表明,LUT、β-CA、LYC 对HSA 均产生猝灭作用,表现为静态猝灭,其中β-胡萝卜素对HSA 有最强的猝灭作用,最大的结合常数,说明β-胡萝卜素与HSA 更容易结合;热力学参数分析表明LUT、β-CA、LYC 与HSA 主要通过疏水相互作用结合;同步荧光结合三维荧光结果说明3 种类胡萝卜素影响了HSA 的构象;位点研究表明,LUT、β-CA、LYC 与HSA 的结合位点位于亚结构域ⅡA 附近。研究证明,LUT、β-CA、LYC 均可以与HSA 结合,这将为探究类胡萝卜素体内转运机制,活性保护载体开发提供思路。
[1]DESMARCHELIER C,BOREL P.Overview of carotenoid bioavailability determinants:From dietary factors to host genetic variations[J].Trends in Food Science & Technology,2017,69(Part B):270-280.
[2]TORALES L I E,GARCÍA-ALONSO J,PERIAGO M J.Nutritional importance of carotenoids and their effect on liver health:A review[J].Antioxidants,2019,8(7):229.
[3]PAUR I,LILLEBY W,BHN S K,et al.Tomatobased randomized controlled trial in prostate cancer patients:Effect on PSA[J].Clinical Nutrition,2017,36(3):672-679.
[4]YIN Y M,ZHENG Z C,JIANG Z Q.Effects of lycopene on metabolism of glycolipid in type 2 diabetic rats [J].Biomedecine & Pharmacotherapie,2018,109:2070-2077.
[5]QI S S,SHAO M LI,SUN Z,et al.Lycopene ameliorates diabetic osteoporosis via anti-inflammatory,anti-oxidation,and increasing osteoprotegerin/RANKL expression ratio[J].Journal of Functional Foods,2021,83:104539.
[6]万丽葵,潘洪志,陈文华,等.番茄红素对四氯化碳急性损伤的保护作用[J].中国食品卫生杂志,2006,18(1):44-46.WANG L K,PAN H Z,CHEN W H,et al.Protective effect of lycopene against acute injury induced by carbon tetrachloride in rats[J].Chinese Journal of Food Hygiene,2006,18(1):44-46.
[7]HUANG Y,CHEN H,SU Y H,et al.Increased blood alpha-carotene,all-trans-beta-carotene and lycopene levels are associated with beneficial changes in heart rate variability:A CVD-stratified analysis in an adult population-based study[J].Nutrition Journal,2021,20(1):43.
[8]ALAM M M,QAIS F A,AHMAD I,et al.Multispectroscopic and molecular modelling approach to investigate the interaction of riboflavin with human serum albumin[J].Journal of Biomolecular Structure& Dynamics,2018,36(3):795-809.
[9]BOSE A.Interaction of tea polyphenols with serum albumins:A fluorescence spectroscopic analysis[J].Journal of Luminescence,2016,169(Pt.A):220-226.
[10]CARUSO I P,BARBOSA-FILHO J M,DE-ARAUJO A S,et al.An integrated approach with experimental and computational tools outlining the cooperative binding between 2-phenylchromone and human serum albumin [J].Food Chemistry,2016,196:935-942.
[11]MARHUENDA -MUÑOZ M,HURTADO S,TRESSERRA-RIMBAU A,et al.A review of factors that affect carotenoid concentrations in human plasma:Differences between Mediterranean and Northern diets[J].European Journal of Clinical Nutrition,2019,72(2):18-25.
[12]LI S Y,LO A C Y.Lutein protects RGC-5 cells against hypoxia and oxidative stress[J].International Journal of Molecular Sciences,2010,11(5):2109-2117.
[13]袁旭鹏,王文欢,张文晔,等.β-胡萝卜素的主要生理功能及其在畜禽中的应用研究进展[J].中国畜牧杂志,2021,57(4):27-33.YUAN X P,WANG W H,ZHANG W Y,et al.Advances in the physiological functions of β -carotene and its application in livestock production[J].Chinese Journal of Animal Science,2021,57(4):27-33.
[14]HE Y,XIA P,JIN H,et al.Lycopene ameliorates transplant arteriosclerosis in vascular allograft transplantation by regulating the NO/cGMP pathways and Rho-associated kinases expression[J].Oxidative Medicine and Cellular Longevity,2016,2016:3128280.
[15]吴婉仪,李璐,李达鸿,等.番茄红素纳米乳液体系的稳定性能研究[J].中国食品学报,2019,19(12):96-103.WU W Y,LI L,LI D H,et al.Stability studies for lycopene-load nanoemulsions system[J].Journal of Chinese Institute of Food Science and Technology,2019,19(12):96-103.
[16]BAGHERI M,FATEMI M H.Fluorescence spectroscopy,molecular docking and molecular dynamic simulation studies of HSA-Aflatoxin B1 and G1 interactions[J].Journal of Luminescence,2018,202:345-353.
[17]GOKARA M,SUDHAMALLA B,AMOORU D G,et al.Molecular interaction studies of trimethoxy flavone with human serum albumin[J].PLoS One,2010,5(1):8834.
[18]ZHANG H,YU D D,SUN J,et al.Interaction of milk whey protein with common phenolic acids[J].Journal of Molecular Structure,2014,1058:228-233.
[19]付珊琳,钟俊桢,姚文俊,等.去折叠态β-乳球蛋白与表没食子儿茶素没食子酸酯的相互作用[J].食品科学,2019,40(4):7-13.FU S L,ZHONG J Z,YAO W J,et al.Interaction between unfolded bovine β-lactoglobulin and epigallocatechin gallate[J].Food Science,2019,40(4):7-13.
[20]顾佳丽,李东玲,赵刚,等.辣条中糖精钠含量测定及其与牛血清白蛋白的相互作用[J].中国食品学报,2018,18(5):257-263.GU J L,LI D L,ZHAO G,et al.Determination of saccharin sodium content in spicy gluten and spectroscopic analysis on the interaction of saccharin sodium with bovine serum albumin[J].Journal of Chinese Institute of Food Science and Technology,2018,18(5):257-263.
[21]ZHANG H M,WU P R,WANG Y Q,et al.Affinity of miriplatin to human serum albumin and its effect on protein structure and stability[J].International Journal of Biological Macromolecules,2016,92:593-599.
[22]吴春,马琳,孙天一.改性柑橘皮渣对牛血清白蛋白吸附行为的研究[J].包装工程,2021,42(1):25-31.WU C,MA L,SUN T Y.Adsorption behavior of bovine serum albumin by modified citrus peel residue[J].Packaging Engineering,2021,42(1):25-31.
[23]AL-MEHIZIA A A,BAKHEIT A H,ZARGAR S,et al.Evaluation of biophysical interaction between newly synthesized pyrazoline pyridazine derivative and bovine serum albumin by spectroscopic and molecular docking studies[J].Journal of Spectroscopy,2019,2019:3848670.
[24]HUANG S,LI H M,LIU Y,et al.Comparable investigation of in vitro interactions between three ruthenium(II)arene complexes with curcumin analogs and ctDNA[J].Polyhedron,2019,167:51-61.
[25]汤小玉,罗云敬,魏安琪,等.同步与三维荧光光谱法研究日落黄和人血清蛋白的相互作用[J].光谱学与光谱分析,2018,38(10):3129-3135.TANG X Y,LUO Y J,WEI A Q,et al.Application of synchronous and three-dimensional fluorescent spectrometry in studies on interaction between sunset yellow and human serum albumin[J].Spectroscopy and Spectral Analysis,2018,38(10):3129-3135.
[26]ZHANG Q L,ZHU Z,NI Y N.Interaction between aspirin and vitamin C with human serum albumin as binary and ternary systems[J].Spectrochimica Acta Part A Molecular and Biomolecular Spectroscopy,2020,236:118356.
[27]WANI T A,BAKHEIT A H,ZARGAR S,et al.Molecular docking and experimental investigation of new indole derivative cyclooxygenase inhibitor to probe its binding mechanism with bovine serum albumin[J].Bioorganic Chemistry,2019,89:103010.
[28]BENVIDI A,REZAEINASAB M,GHARAGHANI S,et al.Experimental and theoretical investigation of interaction between bovine serum albumin and the mixture of caffeic acid and salicylic acid as the antioxidants[J].Electrochimica Acta,2017,255(11):428-441.
[29]REMO R,ITAI B,HEINZ S,et al.Molecular flexibility in ab initio drug docking to DNA:Binding-site and binding-mode transitions in all-atom Monte Carlo simulations[J].Nucleic Acids Research,2005,33(22):7048-7057.