淀粉作为人们日常饮食中的主要成分,是人体新陈代谢的主要能量来源。然而,快消化淀粉会对某些人群(譬如糖尿病、肥胖等患者)的健康产生负面影响,长期大量摄入会导致人体血糖快速上升,易引发肥胖,加重糖尿病症状[1-3]。慢消化淀粉和抗性淀粉能使人体的餐后血糖缓慢上升,有利于控制和缓解这类疾病的发生。近年来,随着Ⅱ型糖尿病、肥胖人数在全球范围内的快速增长,通过各种方式来减缓人类膳食中的淀粉消化已经成为当前研究的热点。有研究指出淀粉消化与淀粉的结晶结构、直链淀粉含量,淀粉颗粒大小等有关[4-7],食品体系中其它组分如蛋白质的存在也会影响淀粉的消化率[8]。另外,某些蛋白质可能具有类胰岛素功能,有研究表明与仅摄入碳水化合物相比,摄入碳水化合物和小麦蛋白混合的水解液能在很大程度上刺激胰岛素的产生和增活[9]。
蛋白质对淀粉消化的影响已有较多报道。Khatun 等[10]发现将稻米中大米蛋白除去,导致大米淀粉消化率增加,且大米淀粉体外消化率与大米蛋白的残留量呈负相关。此外,向大米淀粉中添加提取的大米蛋白,以浓度依赖的方式降低了大米淀粉的体外消化率。Ding 等[11]将薏米中的内源蛋白去除后,发现薏米淀粉的最终水解浓度(C∞)显著提高,脱蛋白后葡萄糖释放速度加快,导致快消化淀粉(RDS)含量显著增加,抗性淀粉(RS)含量降低。Xu 等[12]将面筋蛋白与小麦淀粉混合,探究了面筋蛋白及其水解物对小麦淀粉消化率的影响,其发现面筋蛋白的加入降低了小麦淀粉体外消化的一级动力学常数(k)和120 min 时的淀粉水解率。面筋蛋白与α-淀粉酶结合可降低酶的活性,从而抑制小麦淀粉的消化。Liu 等[13]研究了在高粱面条中加入外源蛋白后淀粉的消化率,结果表明:小麦蛋白、乳清分离蛋白和蛋清蛋白均能降低其淀粉消化率,增加抗性淀粉含量。
综上所述,蛋白质对淀粉的消化和减缓餐后血糖的上升有重要影响。目前,关于蛋白质与淀粉消化性的研究大都是集中在小麦、玉米、大米等内源性蛋白及乳清蛋白和蛋清蛋白等外源动物蛋白方面[14-15],而关于外源植物蛋白,譬如一些杂粮等蛋白质对淀粉消化的影响研究较少。
有研究指出,外源蛋白对淀粉消化的影响机制多为分子间的相互作用,蛋白质的碱性氨基酸残基能与带负电的淀粉结合而影响淀粉的水解,同时一些杂粮蛋白还能与米面中的氨基酸互补,有助于提高米面的营养价值[16]。本研究基于蛋白质对淀粉消化影响以及营养互补两方面考虑,在前期研究基础上,选择从燕麦、藜麦、黑豆、扁豆等4 种杂粮中提取的蛋白质,探究这4 种外源植物蛋白对小麦淀粉消化特性的影响,并进一步探究其对α-淀粉酶和α-葡萄糖苷酶两种淀粉消化酶的抑制作用,为杂粮蛋白在淀粉类食品中的应用,以及开发糖尿病、肥胖病患者功能性食品提供理论支持。
1 材料与方法
1.1 材料与试剂
小麦淀粉,上海源叶生物科技有限公司;燕麦(原料产地:内蒙古赤峰)、藜麦(原料产地:青海省海西蒙古族藏族自治州)、黑豆(原料产地:辽宁朝阳)、扁豆(原料产地:内蒙古赤峰)均购自赣州康瑞农产品有限公司;燕麦、藜麦、黑豆、扁豆等4 种蛋白质,实验室自制。
α-淀粉酶(12 U/mg)、α-葡萄糖苷酶(700 000 U/mL)上海源叶生物科技有限公司;4-硝基苯基-α-D-吡喃葡糖苷(pNPG)、3,5-二硝基水杨酸,上海麦克林生化科技股份有限公司;其余试剂均购自天津科密欧化学试剂有限公司。
1.2 仪器与设备
TDL-5A 台式低速离心机,江苏省金坛市医疗仪器厂;UV-1600B 紫外-可见分光光度计,上海美谱达仪器有限公司;101FX-1 电热恒温鼓风干燥箱,上海树立仪器仪表有限公司;PHS-3C 雷磁酸度计,上海仪电科学仪器股份有限公司;HZT-B5000 电子天平,福州华志科学仪器有限公司;MVS-1 旋涡混合器,北京金北德工贸有限公司;SHZ-82 数显水浴恒温振荡器,金坛华峰仪器有限公司;DZKW-S-6 电热恒温水浴锅,北京市永光明医疗仪器有限公司;FA1004 电子分析天平,上海上平仪器公司。
1.3 方法
1.3.1 葡萄糖标准曲线的绘制 准确称取0.50 g无水葡萄糖于50 mL 的容量瓶中定容,配制成1%的葡萄糖标准溶液。
准确称取3.15 g 3,5-二硝基水杨酸于烧杯中,加入600 mL 蒸馏水,在水浴锅中45 ℃加热,然后边搅拌边加入20.00 g 氢氧化钠,搅拌至溶液澄清透明。再加入91.00 g 酒石酸钾钠、2.50 g 苯酚和2.50 g 亚硫酸钠。继续45 ℃加热,同时再补加300 mL 蒸馏水,不断搅拌至物质全部溶解。冷却至室温后,转移到容量瓶中定容至1 000 mL,配制成3,5-二硝基水杨酸(DNS)溶液,将溶液储存在棕色瓶中,室温下避光保存,存放7 d 后可使用。
取11 支洗净烘干的试管,按照表1 向试管中加入1%的葡萄糖标准溶液、DNS 试剂和蒸馏水混匀后于沸水中水浴5 min,用蒸馏水定容至25 mL,于波长520 nm 处测定吸光度。
表1 葡萄糖标准曲线的绘制
Table 1 Drawing of glucose standard curve
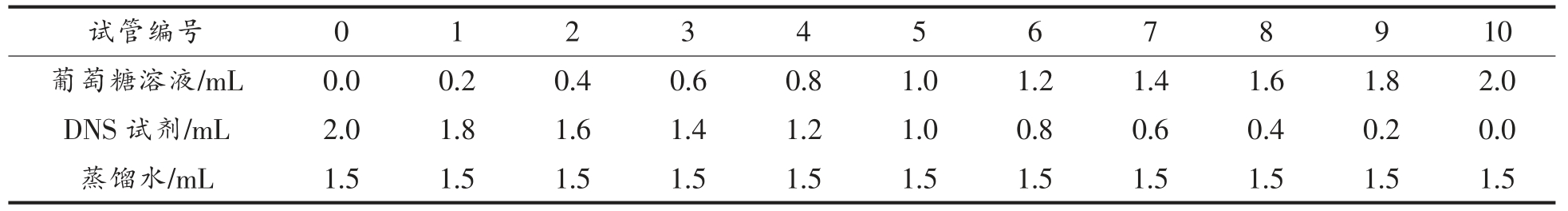
试管编号012345678910葡萄糖溶液/mL0.00.20.40.60.81.01.21.41.61.82.0 DNS 试剂/mL2.01.81.61.41.21.00.80.60.40.20.0蒸馏水/mL1.51.51.51.51.51.51.51.51.51.51.5
1.3.2 4 种外源植物蛋白对小麦淀粉体外模拟消化的影响 参考Englyst 等[17]的方法并稍作修改:准确称取0.2 g 小麦淀粉和燕麦、藜麦、黑豆、扁豆4 种蛋白于25 mL 具塞试管中,使蛋白的质量占小麦淀粉干基的10%,20%,40%。向试管中加入0.2 mol/L pH 5.2 的醋酸钠缓冲溶液7.5 mL,涡旋振荡混匀后85 ℃糊化30 min,在37 ℃条件下冷却平衡15 min,加入5 mL 已预热15 min 的α-淀粉酶(300 U/mL)和α-葡萄糖苷酶(60 U/mL)的混酶溶液,并向每个试管中放入5 颗玻璃珠,混匀后开始振荡反应并准确计时。分别在0,20,40,60,120,180 min 时在每个试管中吸取1 mL 的水解液,加5 mL 无水乙醇灭酶,3 500 r/min 离心10 min 后准确移出1 mL 上清液,采用DNS 法测定生成的葡萄糖含量。计算公式如下:
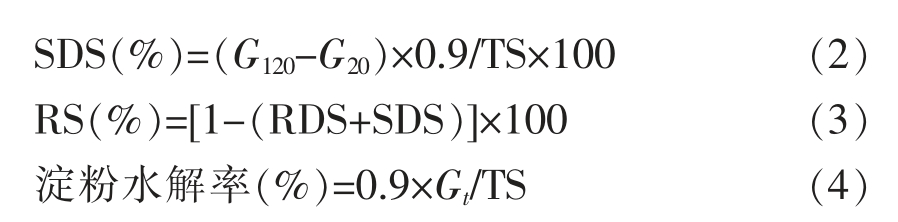
式中,G0——水解前淀粉中的葡萄糖含量,mg;G20——淀粉水解20 min 时淀粉水解液中的葡萄糖含量,mg;G120——淀粉水解120 min 时淀粉水解液中生成的葡萄糖含量,mg;Gt 表示t 时刻产生的葡萄糖含量,mg;TS——样品中的总淀粉含量,mg。
1.3.3 4 种外源植物蛋白对淀粉消化动力学和血糖指数的影响 根据Goñi 等[18]的方法,测定了淀粉的体外消化性,淀粉的水解曲线遵循一级动力学方程如下:
式中,Ct——淀粉消化t 时刻时的葡萄糖质量浓度,mg/mL;t——消化时间,min;C∞——淀粉水解液在终点时刻的葡萄糖质量浓度,mg/mL;k——一级反应动力学常数,s-1。
使用Origin 拟合曲线得到C∞和k,然后计算水解曲线下的面积,公式如下:
式中,tf——反应终止时间,min;t0——反应起始时间,min。
根据式(6)计算样品的水解指数(HI)和血糖指数(GI)。
式中,AUCG——样品组淀粉反应,AUCW——空白组反应面积。
1.3.4 4 种外源植物蛋白对淀粉消化酶的活性抑制测定
1.3.4.1 4 种外源植物蛋白对α-淀粉酶的活性抑制测定 以小麦淀粉作为底物进行测定,将淀粉和蛋白溶解在0.2 mol/L pH 6.8 的磷酸盐缓冲溶液中,分别得到质量浓度为1 g/100 mL 的淀粉溶液和1,5,10,15,20 mg/mL 的蛋白溶液,将溶解后的淀粉于85 ℃条件下糊化30 min 备用。向试管中加入250 μL 的蛋白溶液和250 μL α-淀粉酶溶液(300 U/mL),混合均匀后于37 ℃,150 r/min 的水浴恒温振荡器中反应10 min,然后在每个试管中加500 μL 淀粉溶液继续反应10 min,加1 mL DNS 显色剂终止反应。之后沸水浴5 min,待冷却至室温后用去离子水定容至25 mL。使用紫外-可见分光光度计在波长540 nm 处测定吸光度。计算不同蛋白在不同质量浓度下对α-淀粉酶活性的抑制作用,公式如下:
式中,A 样品——蛋白质、底物、α-淀粉酶和DNS 显色剂的混合物的吸光度;A 样品对照——蛋白质底物和DNS 显色剂的混合物的吸光度,用磷酸盐缓冲液代替α-淀粉酶;A 空白——底物、α-淀粉酶和DNS 显色剂的混合物的吸光度,用缓冲液代替蛋白质抑制剂;A 空白对照——底物和DNS 显色剂的混合物的吸光度。
1.3.4.2 4 种外源植物蛋白对α-葡萄糖苷酶的活性抑制测定 将α-葡萄糖苷酶(60 U/mL)和底物pNPG(15 mmol/L)溶解在0.2 mol/L pH 6.8 的磷酸盐缓冲溶液中。同时在磷酸盐缓冲溶液中制备质量浓度分别为1,5,10,15,20 mg/mL 的蛋白溶液。向试管中加800 μL 蛋白溶液和400 μL 的α-葡萄糖苷酶溶液,混合均匀后于37 ℃,150 r/min的水浴恒温振荡器反应10 min,再向每个试管中加200 μL pNPG 溶液继续反应,30 min 后加5 mL 0.2 mol/L 的Na2CO3 终止反应,并在波长405 nm 处测定吸光度。计算蛋白质对α-葡萄糖苷酶的活性抑制效果,公式如下:
式中,A 样品——蛋白质、底物、α-葡萄糖苷酶和DNS 显色剂的混合物的吸光度;A 样品对照——蛋白质、底物和DNS 显色剂的混合物的吸光度,用磷酸盐缓冲液代替α-葡萄糖苷酶;A 空白——底物、α-葡萄糖苷酶和DNS 显色剂的混合物的吸光度,用缓冲液代替蛋白质抑制剂;A 空白对照——底物和DNS 显色剂的混合物的吸光度。
1.3.5 数据处理 试验数据处理使用SPSS 25 和Microsoft Excel 2016 软件完成,绘图使用Origin 2017 软件完成,其中水解动力学模型拟合使用Origin 2017 软件非线性拟合BoxLucas1 函数进行拟合,结果表示为平均值±标准偏差(n = 3),P<0.05 表示为显著差异,P<0.01 表示差异极显著。
2 结果与分析
2.1 葡萄糖标准曲线的绘制
图1 为所得的葡萄糖标准曲线,Y=0.5897X-0.0178,R2=0.9983。式中X 表示葡萄糖含量,Y 表示吸光度,曲线拟合良好。
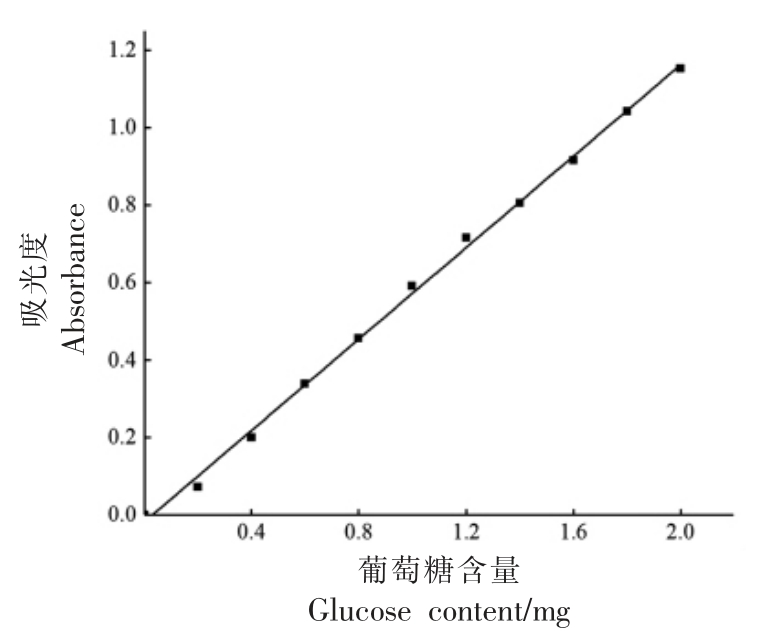
图1 葡萄糖标准曲线
Fig.1 Glucose standard curve
2.2 4 种外源植物蛋白对小麦淀粉体外模拟消化的影响分析
图2 是添加4 种外源植物蛋白后小麦淀粉的水解率。从淀粉的水解曲线可以看出淀粉在前20 min 内的水解速率迅速上升,20 min 以后水解速率缓慢上升,在120 min 以后趋于平衡。4 种外源植物蛋白的加入均可以降低小麦淀粉各阶段的消化率,且随着蛋白添加量的增加,淀粉的水解速率逐渐减小。其中燕麦蛋白和藜麦蛋白对小麦淀粉水解率的影响较为显著。蛋白能降低淀粉消化率可能是因为蛋白能在淀粉周围形成物理屏障阻碍淀粉与淀粉酶的接触,也可能是由于外源蛋白能进一步与淀粉颗粒相互作用限制了淀粉的糊化,进而影响了淀粉在后续消化过程中的水解率。此外,蛋白质在加热过程中变性会导致内部的疏水性氨基酸暴露,淀粉的中存在大量羟基能与蛋白质的碱性氨基酸(精氨酸、赖氨酸、组氨酸)残基发生离子相互作用影响淀粉的消化[19]。燕麦蛋白中含有大量的精氨酸,这也可能是燕麦蛋白比其它几种蛋白作用效果更强的主要原因。
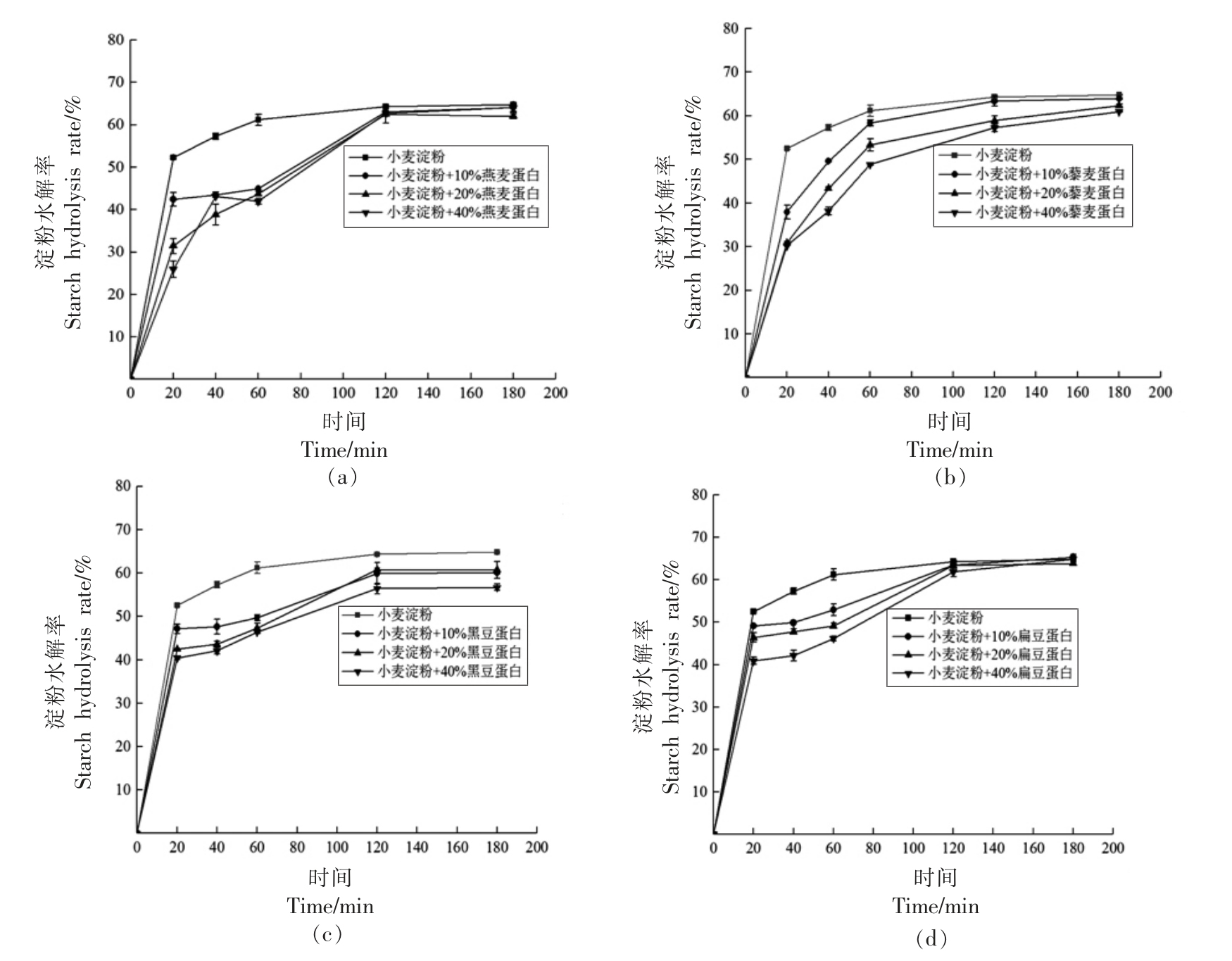
图2 淀粉水解率
Fig.2 Starch hydrolysis rate
图3 显示了燕麦蛋白、藜麦蛋白、黑豆蛋白和扁豆蛋白4 种外源植物蛋白与小麦淀粉混合物体外消化后3 种类型淀粉含量的变化。4 种外源植物蛋白均能对RDS、SDS 和RS 的含量产生显著性影响,但影响效果有所不同。4 种外源植物蛋白都降低了RDS 的含量,随着蛋白添加量的增加RDS含量显著下降,其中燕麦蛋白和藜麦蛋白对RDS的影响较大,当添加量达到40%时,分别将RDS的含量从(52.50±0.22)%降至(27.32±1.94)%和(30.22±0.11)%。随着4 种外源植物蛋白的添加,SDS 含量增加,其中燕麦蛋白对其影响最为显著。当燕麦蛋白添加量为40%时,可将SDS 含量从(11.83±0.54)%增加到(35.33±1.62)%。此外,4 种外源植物蛋白能增加RS 的含量,但与添加量不成正比,其中黑豆蛋白对RS 含量的影响最大,当黑豆蛋白添加量为40%时,RS 的含量从(35.67±0.32)%增加到(43.61±1.19)%。
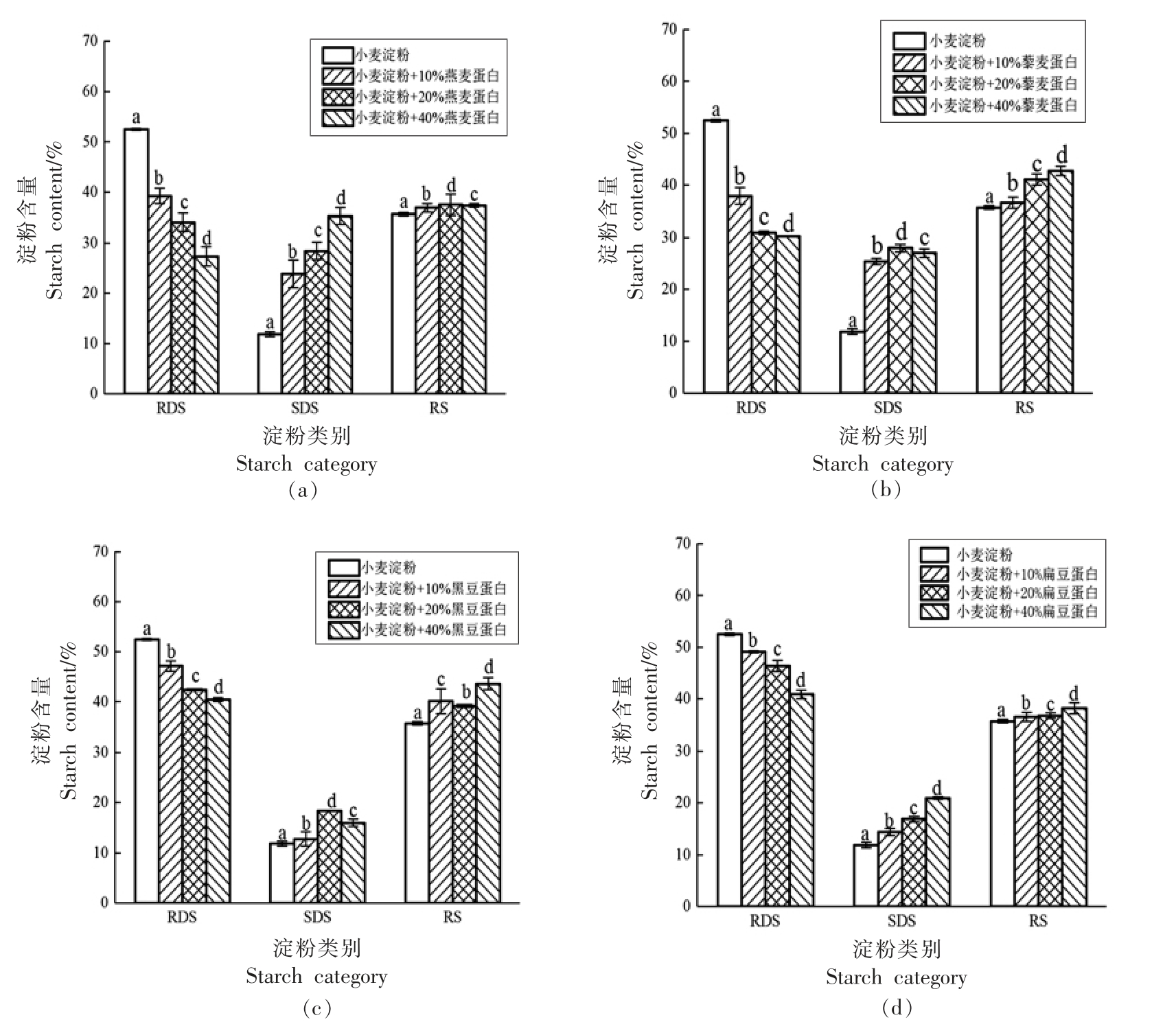
图3 4 种外源植物蛋白与小麦淀粉混合物体外消化
Fig.3 In vitro digestion of mixture of four exogenous plant proteins and wheat starch
注:图中不同字母表示不同样品之间存在显著性差异(P<0.05)。
淀粉的消化与许多因素有关,Lu 等[20]的研究表明:蛋白质与淀粉混合后,能够在淀粉周围形成一种连续的网络结构,阻碍淀粉的快速消化,也会抑制淀粉颗粒在糊化过程中的吸水膨胀,导致颗粒中残存的有序结构影响淀粉酶的酶解,从而使RDS 含量减少,RS 含量增加。本研究中4 种外源植物蛋白的加入使得RDS 降低,RS 含量的增加的试验结果与此文献的研究结果一致,可能是因为蛋白在淀粉外形成了致密的网络结构包裹淀粉。另外,在淀粉糊化过程中,淀粉的颗粒被破坏会导致直链淀粉的析出。蛋白可能与析出的直链淀粉发生了相互作用,形成了蛋白质-直链淀粉复合物,其中还有一些稳定性较弱的直链淀粉-直链淀粉复合物,这些复合物会导致SDS 含量的增加。
2.3 4 种外源植物蛋白对淀粉消化动力学和血糖指数的影响分析
表2 是4 种外源植物蛋白在不同水平下对小麦淀粉模拟动力学参数的影响。一般情况下血糖指数(GI)是根据白面包(GI=100)在体外消化作为参考依据来定义和分类的。在本研究,为了准确反映添加的4 种外源植物蛋白对小麦淀粉消化的影响,将纯小麦淀粉的HI 值作为100 来计算血糖指数。由表2 可以看出,添加外源植物蛋白后k 值呈下降趋势。 k 值被用来表示淀粉的水解敏感程度,k 值高说明淀粉容易消化。随外4 种外源植物蛋白添加,k 值和预测血糖值(pGI)均减小,且随添加量的增加呈规律性下降。当燕麦蛋白和黑豆蛋白添加量为40%时,分别将预测血糖值降低至84.98 和84.62,说明外源植物蛋白能够与小麦淀粉发生相互作用降低小麦淀粉的水解敏感性。
表2 不同蛋白水解模型参数及血糖指数
Table 2 Different proteins hydrolysis model parameters and glycemic index

蛋白种类及添加量小麦淀粉水解参数C∞/%k/min-1R2HIpGI 0%62.87±1.280.084±0.0110.99336100.0094.61 10%燕麦蛋白60.35±5.360.039±0.0130.9150488.3088.19 20%燕麦蛋白62.60±3.870.026±0.0050.9705383.8285.73 40%燕麦蛋白64.70±3.330.022±0.0030.9839382.4784.98 10%藜麦蛋白63.50±0.970.042±0.0020.9973393.8991.26 20%藜麦蛋白61.32±1.030.033±0.0020.9972986.8587.39 40%藜麦蛋白59.83±2.090.029±0.0030.9894182.5185.01 10%黑豆蛋白55.74±2.980.078±0.0250.9565988.2188.13 20%黑豆蛋白57.47±4.040.048±0.0140.9400986.5387.22 40%黑豆蛋白53.61±3.160.053±0.0140.9552181.8184.62 10%扁豆蛋白60.07±3.460.068±0.0210.9524694.0191.32 20%扁豆蛋白59.13±4.070.058±0.0190.9375691.0789.71 40%扁豆蛋白61.00±5.050.036±0.0100.9293887.9487.99
2.4 4 种外源植物蛋白对淀粉消化酶的活性抑制测定
2.4.1 4 种外源植物蛋白对α-淀粉酶活性的抑制测定 4 种外源植物蛋白对α-淀粉酶抑制作用曲线如图4所示。4 种外源植物蛋白中燕麦蛋白、藜麦蛋白和黑豆蛋白均能抑制α-淀粉酶的活性,而扁豆蛋白对α-淀粉酶的活性没有影响(图4 未显示)。随着燕麦蛋白、藜麦蛋白和黑豆蛋白3 种蛋白添加量的增加,抑制作用逐渐增强。其中,黑豆蛋白的抑制效果优于燕麦蛋白和藜麦蛋白。当添加量增加到一定量时,燕麦蛋白和藜麦蛋白对其抑制作用不再随质量浓度的增加而明显增强,而黑豆蛋白对α-淀粉酶的抑制作用却在随质量浓度的增大一直增强。陈旭[9]指出蛋白能够通过与α-淀粉酶结合或与淀粉和α-淀粉酶形成的中间产物结合来抑制α-淀粉酶活性,且结合强度与蛋白质的来源和溶解性密切相关。这可能也是这4种外源植物蛋白对α-淀粉酶的抑制效果有所差异的原因。扁豆蛋白的溶解度比较好,加热后能在溶液中均匀分散无法与酶结合,而黑豆蛋白的溶解性较差,能随着加热变性在溶液中形成密集的网络结构,因此对α-淀粉酶的抑制效果最强。
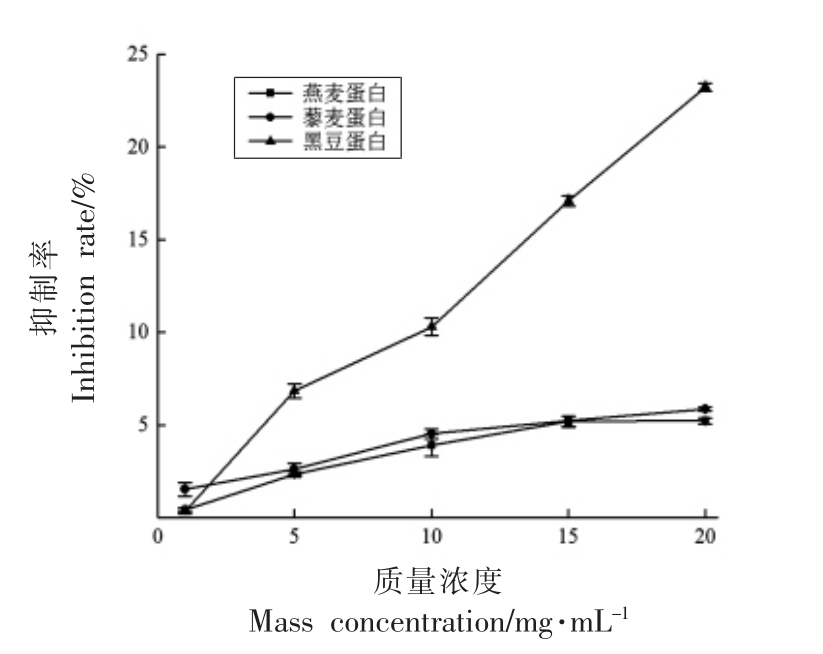
图4 4 种外源植物蛋白对α-淀粉酶的活性抑制作用曲线
Fig.4 Four exogenous plant protein inhibition curve of α-amylase activity
2.4.2 4 种外源植物蛋白对α-葡萄糖苷酶活性的抑制测定 4 种外源植物蛋白对α-葡萄糖苷酶的活性抑制作用见图5。4 种外源植物蛋白中扁豆蛋白和黑豆蛋白对α-葡萄糖苷酶的活性有显著抑制作用,燕麦蛋白和藜麦蛋白对α-葡萄糖苷酶活性没有影响(未在图5 中显示)。从图中可以看出黑豆蛋白和扁豆蛋白在不同质量浓度范围内均对α-葡萄糖苷酶有抑制作用,且随质量浓度增加抑制作用增强。此外,在质量浓度达到15 mg/mL 后抑制效果不再明显增强。Yu 等[21]研究表明大麦醇溶蛋白和谷蛋白在消化过程中可以与酶结合。因此,黑豆蛋白和扁豆蛋白很可能在某种程度上与酶发生非催化结合,或者覆盖了α-葡萄糖苷酶对淀粉的作用位点导致了酶的催化活性降低。

图5 4 种外源植物蛋白对α-葡萄糖苷酶的活性抑制作用曲线
Fig.5 Four exogenous plant protein inhibition curve of α-glucosidase activity
蛋白质与小麦淀粉的体外消化试验结果表明,蛋白质能降低小麦淀粉的消化是蛋白质与淀粉相互作用和蛋白质与淀粉消化酶共同作用的结果。蛋白质不仅能与淀粉发生相互作用阻碍淀粉被消化,而且能与淀粉消化酶结合减低酶的活性来降低淀粉的消化,这对糖尿病患者稳定血糖很有帮助。
3 结论
通过燕麦蛋白、藜麦蛋白、黑豆蛋白和扁豆蛋白4 种外源植物蛋白对小麦淀粉的体外消化及对两种淀粉消化酶的活性抑制作用两方面的研究,得到结论如下:4 种外源植物蛋白的加入均能减缓小麦淀粉的水解速率,导致RDS 含量减少,SDS和RS 含量增加,降低了小麦淀粉的预测血糖值,其中添加40%燕麦蛋白能将RDS 含量从(52.50±0.22)%降至(27.32±1.94)%,SDS 含量从(11.83±0.54)%增加到(35.33±1.62)%。4 种外源植物蛋白中燕麦蛋白、藜麦蛋白和黑豆蛋白对α-淀粉酶的活性具有较强的抑制作用,而扁豆蛋白对α-淀粉酶的活性没有影响,其中,黑豆蛋白对α-淀粉酶的抑制效果最好,当黑豆蛋白质量浓度为20 mg/mL 时抑制率达到了(23.24±0.21)%。4 种外源植物蛋白中黑豆蛋白和扁豆蛋白对α-葡萄糖苷酶的活性具有较好的抑制效果,而燕麦蛋白和藜麦蛋白对其活性没有影响,其中扁豆蛋白对α-葡萄糖苷酶的抑制作用强于黑豆蛋白,蛋白质量浓度为20 mg/mL 时抑制率分别为(21.32±0.80)%和(8.49±0.40)%。
[1]YANG C H,ZHONG F,DOUGLAS GOFF H,et al.Study on starch-protein interactions and their effects on physicochemical and digestible properties of the blends[J].Food Chemistry,2019,280(12):51-58.
[2]GUO J,ALEGNA R,ALYSSA G,et al. In vitro digestibility profiles of different types of resistant starch with bioactive guest inhibitors[J].Current Developments in Nutrition,2021,5(2):583.
[3]WANG X X,LAO X,BAO Y,et al.Effect of whole quinoa flour substitution on the texture and in vitro starch digestibility of wheat bread[J].Food Hydrocolloids,2021,119:106840.
[4]刘飞雁,朱科学,郭晓娜.杂粮原料对其挂面淀粉消化性的影响及内在因素研究[J].中国粮油学报,2020,35(10):35-41.LIU F Y,ZHU K X,GUO X N.Effect of coarse grain raw materials on the digestibility of vermicelli starch and its internal factors[J].Journal of the Chinese Cereals and Oils Association,2020,35(10):35-41.
[5]SHEN S D,CHI C D,ZHANG Y P,et al.New insights into how starch structure synergistically affects the starch digestibility,texture,and flavor quality of rice noodles[J].International Journal of Biological Macromolecules,2021,184(5):731-738.
[6]TAMURA M,TSUJII H,SAITO T,et al.Relationship between starch digestibility and physicochemical properties of aged rice grain[J].LWT- Food Science and Technology,2021,150(3):111887.
[7]CHI C D,LI X X,HUANG S X,et al.Basic principles in starch multi-scale structuration to mitigate digestibility:A review[J].Trends in Food Science & Technology,2021,109(1):154-168.
[8]ZHOU X L,YU W W,LI C.Protein content correlates with the in vitro starch digestibility of raw barley flour[J].Food Bioscience,2021,43(9):101292.
[9]陈旭.蛋白和脂质对淀粉消化特性的影响机理研究[D].广州:华南理工大学,2017.CHEN X.Effects of protein and lipid on starch digestion[D].Guangzhou:South China University of Teachnology,2017.
[10]KHATUN A,WATERS D L E,LIU L.The impact of rice protein on in vitro rice starch digestibility[J].Food Hydrocolloids,2020,109(3):106072.
[11]DING Y Y,CHENG J J,LIN Q Y,et al.Effects of endogenous proteins and lipids on structural,thermal,rheological,and pasting properties and digestibility of adlay seed(Coix lacryma-jobi L.)starch[J].Food Hydrocolloids,2021,111(3/4):106254.
[12]XU H B,ZHOU J P,YU J L,et al.Mechanisms underlying the effect of gluten and its hydrolysates on in vitro enzymatic digestibility of wheat starch[J].Food Hydrocolloids,2021,113(4):106507.
[13]LIU F Y,GUO Y Z,XING X N,et al.Influence of protein type,content and polymerization on in vitro starch digestibility of sorghum noodles[J].Food Research International,2021,142(2):110199.
[14]ZHENG M Z,YU X,SHUANG Y,et al.Effect of adding zein,soy protein isolate and whey protein isolate on the physicochemical and in vitro digestion of proso millet starch [J].International Journal of Food Science & Technology,2020,55(2):776-784.
[15]AK A,HAG A,RASA B,et al.Effect of maize germ protein hydrolysate addition on digestion, in vitro antioxidant activity and quality characteristics of bread[J].Journal of Cereal Science,2020,97(3):15-23.
[16]李兆钊,吴卫国,廖卢艳,等.杂粮中辅助调节血糖功效成分研究进展[J].中国粮油学报,2020,35(7):195-202.LI Z Z,WU W G,LIAO L Y,et al.Research progress on effective components of auxiliary regulation of blood glucose in coarse cereals[J].Journal of the Chinese Cereals and Oils Association,2020,35(7):195-202.
[17]ENGLYST H,KINGMAN S,CUMMINGS J.Classification and measurement of nutritionally important starch fractions[J].European Journal of Clinical Nutrition,1992,46(Suppl 2):S33.
[18]GOÑI I,GARCIA-ALONSO A,SAURA-CALIXTO F.A starch hydrolysis procedure to estimate glycemic index[J].Nutrition Research,1997,17(3):427-437.
[19]KOROLEZUK J,BRETON-DOLLET V,TISSIER J.et al.Rheological properties and microstructure of maize starch/milk protein gels [J].Zywn Technol Jakose,1996,2(12):67-74.
[20]LU Z H,DONNER E,YADA R,et al.Physicochemical properties and in vitro starch digestibility of potato starch/protein blends[J].Carbohydrate Polymers,2016,154(8):214-222.
[21]YU W,WEI Z,DHITAL S,et al.The adsorption of α-amylase on barley proteins affects the in vitro digestion of starch in barley flour[J].Food Chemistry,2018,2419(9):493-501.