禽蛋被定义为所有可食用鸟类蛋的总称,主要包括鸡蛋、鸽蛋、鹌鹑蛋和鸭蛋等多种。研究发现禽蛋有许多活性物质[1-3],其中,禽蛋蛋清蛋白质的功能最为丰富,具有抗菌活性、抗黏附性能、免疫调节、抗癌、抗高血压活性和抗氧化性能等[4-8]。然而,不同禽蛋营养特性是否存在差异,消化之后抗氧化能力的差别尚未得到系统的研究。
在人体内,食品中的大分子物质(如蛋白质)虽然一般不能被直接降解消化,但是它们可以被体内相关的酶降解成小分子肽和氨基酸,这些小分子物质均较容易消化吸收[9]。目前关于禽蛋的研究主要集中在全蛋或者禽蛋中的蛋清和蛋黄的基础营养指标,如水分、蛋白质、脂质等进行评价,而对禽蛋进行体外模拟消化操作,比较其消化产物的营养价值以及消化后抗氧化能力等方面的研究极少[10-11]。
本文以市面上较为常见的鸡蛋、鸽蛋、鹌鹑蛋和鸭蛋4 种禽蛋为原料,取蛋清进行体外模拟消化试验。采用静态模拟消化模型,模拟胃消化及小肠消化,对其消化产物进行分析。另外,以DPPH自由基清除能力、铁离子还原能力、羟自由基还原能力、超氧阴离子还原能力4 种抗氧化指标评价禽蛋蛋清未消化液、胃消化液、胃肠消化液的抗氧化性,评估不同禽蛋蛋白质的营养价值,为满足消费者对禽蛋的个性化营养提供科学依据,为禽蛋多肽的深度开发提供一些试验数据。
1 材料与方法
1.1 材料与试剂
新鲜鸡蛋、鸽蛋、鹌鹑蛋和鸭蛋均购自广州当地超市。
盐酸购自珠海市华成达化工有限公司;氢氧化钠、氯化钠、磷酸二氢钾、四硼酸钠、十二烷基硫酸钠、无水乙醇、Tris 碱、冰乙酸、三氯乙酸、磷酸氢二钠、Na2B4O7·10H2O 购自广州化学试剂厂;过硫酸铵、丙烯酰胺、1.0 mol/L Tris-HCL 溶液(pH 6.8)、1.5 mol/L Tris-HCL 溶液(pH 8.8)、四甲基乙二胺、SDS-PAGE 蛋白上样缓冲液、彩色预染蛋白分子质量Marker、考马斯亮蓝R250、水杨酸、硫酸亚铁、抗坏血酸、铁氰化钾、邻苯三酚、DPPH 购自于碧云天生物技术公司;邻苯二甲醛、二硫苏糖醇、甘氨酸、乙腈、甲醇购自于上海麦克林生化科技公司;胃蛋白酶1∶10000、丝氨酸购自于美国Sigma-Aldrich 公司;胰蛋白酶(猪胰腺)1 ∶250 购自于美国Ameresco 公司。
1.2 仪器和设备
FA2204B 型电子天平,上海精密科学仪器有限公司;GZX-9240MBE 型电热恒温鼓风干燥箱、SHZ-B 型水浴恒温振荡器,博讯实业有限公司;KQ 型超声波清洗器,仪瑞达机械厂;HR/T20M 型台式高速冷冻离心机,赫西仪器装备有限公司;PHS-3C 型pH 计,上海雷磁仪器厂;79-1 型磁力搅拌器,金城国胜实验仪器厂;UV-1780 型紫外-可见分光光度计,岛津仪器(苏州)有限公司;KHW-D-2LC 型数显恒温水浴锅,亿捷科技有限公司ESY160 型匀浆机,上海仪驰实业有限公司;JY04S-3C 型电泳仪,君意东方电泳设备公司;Agilent 1260 型高效液相色谱仪,Agilent 科技有限公司。
1.3 方法
1.3.1 样品处理 将4 种禽蛋(鸡蛋、鸽蛋、鹌鹑蛋以及鸭蛋)的蛋清与蛋黄分离,保留蛋清液。
1.3.2 体外模拟消化 参考Jiménez-Escrig 等[12]的方法并略作改动,将4 种禽蛋(鸡蛋、鸽蛋、鹌鹑蛋以及鸭蛋)的蛋清液与蒸馏水混合,配置成蛋白质含量为3%的混合液,85~95 ℃水浴10 min[13-14]。均质,待液体冷却至室温后,用2 mol/L 的HCl 溶液调节混合液的pH 值至2.0。于37 ℃的摇床预热10 min 后,加入预先配置好的3.2 mg/mL 胃蛋白酶溶液(酶/底物=2%),置于37 ℃、170 r/min 条件的摇床孵育4 h,将取得的胃消化4 h 的消化液置于沸水浴灭酶10 min 终止消化,冷却后用2 mol/L的NaOH 溶液调节pH 值至6.8 左右,留样,放入4 ℃冰箱处备用。
将未灭酶的胃蛋白酶酶解样品放入37 ℃的摇床预热10 min 后,加入预先配置好的10 mg/mL胰蛋白酶溶液(酶/底物=5%),于上述相同条件的摇床孵育8 h,其中每间隔1 h 取一次样,取得的肠消化液置于沸水浴灭酶10 min,放入4 ℃冰箱处备用。
1.3.3 蛋白水解度的测定 本试验中蛋白水解度的测定采用邻苯二甲醛法[15],分别测定4 种禽蛋胃消化4 h、肠消化1~8 h 的蛋白水解度,以表征体外模拟消化程度。将经过处理的样品溶液与当天配制好的OPA 试剂充分混匀后,避光反应2 min,在波长340 nm 处测定其吸光度。
1.3.4 SDS-PAGE 凝胶电泳 分别取20 μL 的4种禽蛋的胃消化4 h、肠消化2 h、肠消化4 h 以及肠消化8 h 的蛋白样品与20 μL 的2×上样缓冲液至离心管,100 ℃水浴5 min 后,再置于离心机10 000 r/min 离心3 min。进行SDS-PAGE 分析。
1.3.5 游离氨基酸的测定 分别取样品5.00 g,添加15 mL 5%三氯乙酸,均质后将溶液定容至25 mL。超声30 min,放置1 h 后,取滤液进行10 000 r/min 离心10 min,用0.22 μm 水系滤膜过滤。然后采用Agilent 自动在线衍生的方法,用高效液相色谱仪分析。流动相A 为10 mmol/L Na2HPO4 和10 mmol/L Na2B4O7(pH=8.2),流动相B 为V 乙腈∶V 甲醇∶V 水=9∶9∶2。
1.3.6 肽分子质量测定 样品经过4 000 r/min 离心15 min 后,取上清液过0.22 μm 水系滤膜,进入高效液相色谱仪分析。色谱柱采用TSKGel-G2000-SWXL(7.8 mm×300 mm),流动相为磷酸盐溶液,流速为0.5 mL/min,进样量为10 μL,30 ℃的柱温,检测时间为30 min,紫外检测波长为214 nm。
1.3.7 抗氧化能力测定 按照1.3.2 节处理4 种禽蛋,将①胃消化样品(胃蛋白酶处理4 h)、②胃肠消化样品(胃处理4 h 之后胰蛋白酶处理8 h)、③空白样品(不加酶的相同条件下处理)。分别配制为3,5,8,15 mg/mL 的溶液,参考吴烨婷等[16]的方法进行并适当调整,测定羟自由基清除能力、铁离子还原能力、超氧阴离子自由基清除能力;参考郑淋等[17]和杨珊珊等[18]的方法并进行适当调整,测定样品液对DPPH 自由基的清除能力。
1.3.8 数据分析 除了SDS-PAGE 凝胶电泳试验外,本文试验均采取3 次平行测定。使用SPSS 26.0 软件分析试验数据,并使用Origin 2018 软件进行作图。
2 结果与讨论
2.1 禽蛋蛋清体外模拟消化液水解度的变化
图1 和图2 分别表示4 种禽蛋蛋清胃模拟消化后水解度和肠模拟消化间水解度变化趋势。通过图1 胃模拟消化后的水解度发现,各个禽蛋蛋清液水解度随着水解时间增加而增加,其中水解4 h 后,鸡蛋的蛋白水解度最高为(5.43±0.06)%,鸽蛋和鹌鹑蛋次之且差异不显著,其蛋白水解度分别为(3.14 ± 0.01)%和(2.84 ± 0.07)%,而鸭蛋的蛋白水解度最低,仅有不到(0.5±0.03)%。胃的模拟消化阶段中蛋白水解度较低,其原因可能是胃蛋白酶是一种内肽酶,主要破坏链内肽键,只能产生分子质量较大的肽段,完成初步酶解[19-20]。
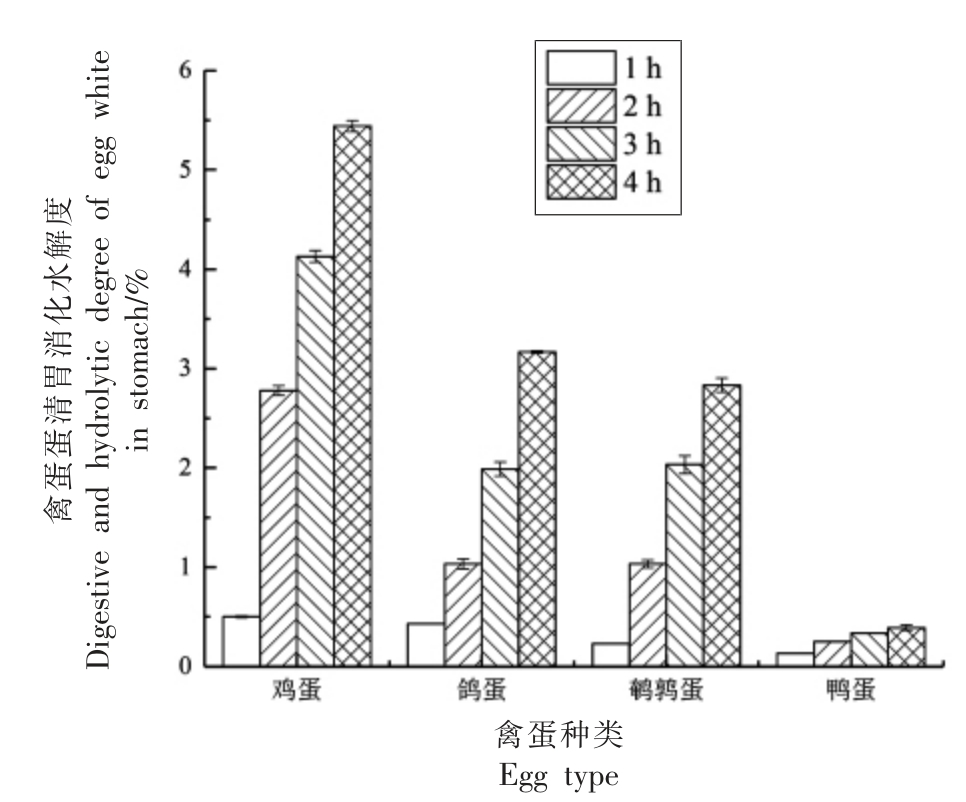
图1 禽蛋蛋清体外模拟胃消化4 h 的蛋白水解度
Fig.1 The 4 h protein hydrolysis degree of poultry egg white in vitro simulated gastric digestion
由图2 为禽蛋蛋清液肠模拟消化间的蛋白水解度变化趋势,可以看出4 种禽蛋蛋清在肠模拟消化阶段的蛋白水解度较胃模拟消化阶段均有提升,其中鸡蛋、鸽蛋和鹌鹑蛋的蛋白水解度在肠消化1 h 较胃消化4 h 提升了接近3 倍,鸭蛋则提升了接近2 倍。从单种禽蛋来分析,得到4 种禽蛋蛋清的蛋白水解度随着肠模拟消化时间的增加而均呈现出上涨趋势。经过肠模拟消化8 h 之后,鸡蛋在肠模拟消化阶段中的蛋白水解度相较于其它禽蛋仍最高,达到【(28.42±1.03)%】;其次就是鸽蛋和鹌鹑蛋,【分别为(22.11 ± 0.51)%和(21.93 ±0.84)%】差异不显著,而在肠消化2 h 至肠消化6 h 之间,鸽蛋的蛋白水解度总体上略高于鹌鹑蛋;鸭蛋的蛋白水解度在肠模拟消化阶段依旧是4 种禽蛋中最低,即使在肠消化8 h【(6.23±0.71)%】也显著低于其余3 种禽蛋。从胃模拟消化和肠模拟消化来看,总体上鸡蛋蛋清的消化程度最高,接着是鸽蛋,其次是鹌鹑蛋,最低的是鸭蛋。
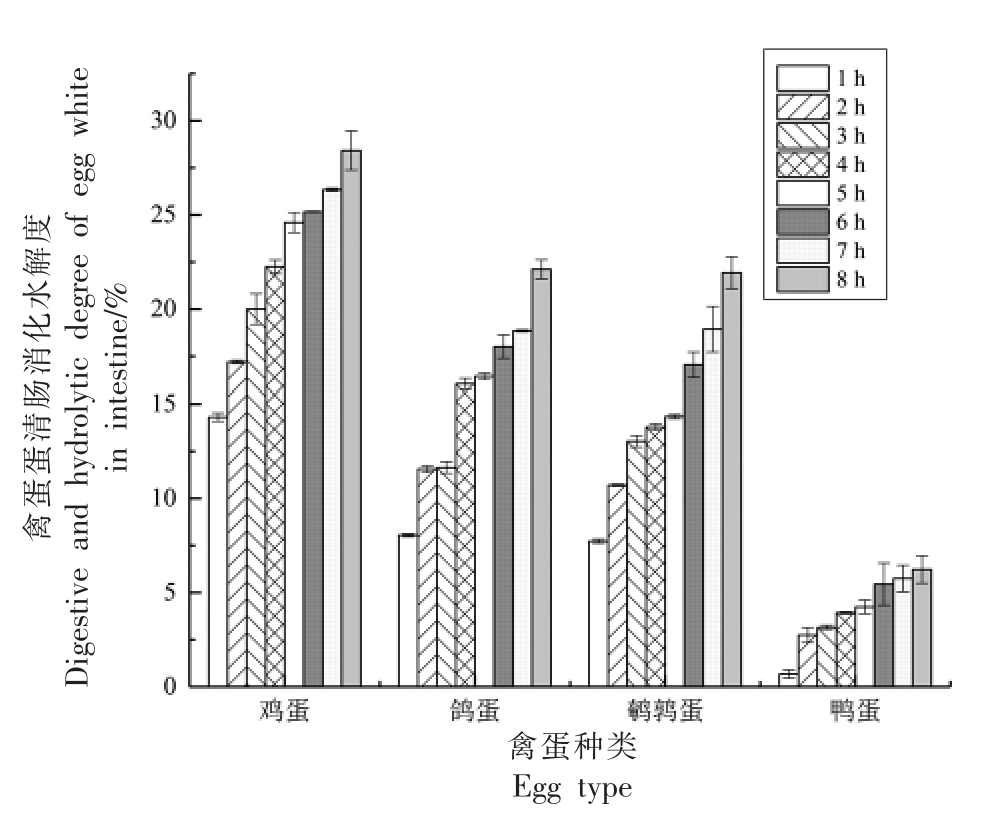
图2 禽蛋蛋清体外模拟肠消化蛋白水解度
Fig.2 Poultry egg white in vitro simulated intestinal digestion protein hydrolysis degree
2.2 禽蛋蛋清体外模拟消化液的营养物质含量变化
2.2.1 蛋白降解情况(SDS-PAGE 凝胶电泳分析)
图3 分别表示了鸡蛋、鸽蛋、鹌鹑蛋以及鸭蛋的蛋清总蛋白和体外胃肠消化液的SDS-PAGE 图谱。利用SDS-PAGE 凝胶电泳来观测4 种禽蛋蛋清在未消化、胃消化和肠消化这3 个阶段中的蛋白分子质量变化。禽蛋蛋清中主要含有卵转铁蛋白、卵白蛋白和卵球蛋白,其中卵白蛋白含量最高[21]。其中卵转铁蛋白的分子质量为78 ku,卵白蛋白的分子质量为45 ku,卵球蛋白分子质量为55 ku。经图3 中泳道0 可得,4 种禽蛋蛋清中均含有这3 种主要蛋白质的条带。

图3 禽蛋蛋清体外模拟消化液SDS-PAGE 分析
Fig.3 SDS-PAGE analysis of in vitro simulated digestive juice of poultry egg white
注:M.Marker;0.4 种蛋清蛋白;1~4.分别为4 种蛋清体外模拟消化不同时间(胃消化4 h、肠消化2 h、肠消化4 h、肠消化8 h)的消化液。
鸡蛋蛋清在经过胃消化4 h 后,泳道1 的卵转铁蛋白、卵球蛋白条带消失;卵白蛋白条带虽仍然存在但明显变浅。因此可得,鸡蛋蛋清在经过胃消化后,卵转铁蛋白、卵球蛋白等较大分子的蛋白被初步水解为较小分子蛋白。在肠消化中(泳道2~4),3 条泳道的蛋白分布虽无较大差异,但是可以明显看到条带变浅,含量变少且卵白蛋白条带消失。
鸽蛋蛋清在经过胃模拟消化阶段后,泳道1的卵转铁蛋白、卵球蛋白、卵白蛋白条带虽显著变浅,但仍可见条带。由此得,鸽蛋蛋清在经过胃消化后,大分子蛋白在降解,降解程度低于鸡蛋蛋清。在泳道2~4 中,卵转铁蛋白条带消失,而卵球蛋白条带和卵白蛋白条带到泳道4 才消失,说明鸽蛋蛋清的大分子蛋白肠消化8 h 才被完全降解。
鹌鹑蛋蛋清在经过胃模拟消化阶段后,泳道1 中的卵转铁蛋白条带消失,卵球蛋白条带、卵白蛋白条带显著变浅,只剩下一条模糊的条带,说明鹌鹑蛋胃消化程度和鸽蛋虽无较大差异,但均低于鸡蛋。在泳道2~4 中,3 种蛋白条带均已消失,表明在经过肠模拟消化阶段后,鹌鹑蛋蛋清中大分子全部被水解。
鸭蛋蛋清在经过胃模拟消化阶段后,泳道1中的卵转铁蛋白、卵球蛋白、卵白蛋白条带仅变浅,在泳道2~4 中,鸡蛋、鸽蛋和鹌鹑蛋的电泳图谱可发现蛋白分子的分布与泳道1 并无太大差别。随着肠消化时间的增加,稍大分子的蛋白亚基条带逐渐变浅,而小分子蛋白的亚基条带逐渐加深。由此表明,鸭蛋蛋清在胃肠消化阶段中的消化程度不高,显著低于其它3 种禽蛋。
根据4 种禽蛋胃消化情况,从蛋白分子质量的角度来看,在胃模拟消化过程中,位于1 泳道的蛋白条带,仅鸡蛋中所有蛋白条带位于52 ku 以下,因此禽蛋蛋清蛋白消化程度排名为:鸡蛋>鹌鹑蛋>鸽蛋>鸭蛋。在肠模拟消化最后的消化程度排名为,鸡蛋、鸽蛋、鹌鹑蛋均明显大于鸭蛋消化程度。综合而言,经过体外胃肠模拟消化,鸡蛋消化程度最好,鹌鹑蛋及鸽蛋次之,鸭蛋消化程度最差。
2.2.2 游离氨基酸变化情况 由前文可得,在禽蛋蛋清的体外模拟消化中,肠消化阶段的消化程度显著大于胃消化阶段,与文献指出在胃部消化过程中游离氨基酸的释放较少,而在肠道消化过程中释放了大量游离氨基酸结果一致[22-27]。由于氨基酸的吸收主要是在小肠内进行,因此在测定消化液的游离氨基酸时,着重考虑其在肠消化阶段的变化情况。
由表1 知,4 种禽蛋在肠消化阶段中,随着消化时间的增长,总氨基酸的含量也随之不断增加。鸽蛋肠消化8 h 后得到的氨基酸含量达到21.28 g/100 g,鸡蛋和鹌鹑蛋的总氨基酸含量无较大差异,分别为16.10 g/100 g 和15.35 g/100 g,而鸭蛋的总氨基酸含量7.94 g/100 g,远低于其它蛋类。对肠消化后必需氨基酸含量进行分析发现,同样鸽蛋肠消化8 h 后的必须氨基酸含量最高为9.60 g/100 g,鸡蛋和鹌鹑蛋的含量分别达到8.21 g/100 g和7.52 g/100 g,鸭蛋仅含有3.83 g/100 g。除此之外,鸽蛋中一些功能性氨基酸如精氨酸、赖氨酸和脯氨酸等含量均显著高于其它3 种禽蛋,以肠消化8 h 为例,鸽蛋的游离精氨酸含量为2.02 g/100 g,赖氨酸为2.52 g/100 g,脯氨酸为3.58 g/100 g,均明显高于其它3 种禽蛋,因此可以推断出,食用鸽蛋的功能作用更多。
表1 禽蛋蛋清体外模拟消化液氨基酸组成及含量(g/100 g)
Table 1 Amino acid composition and content of poultry egg white in vitro simulated digestive juice(g/100 g)
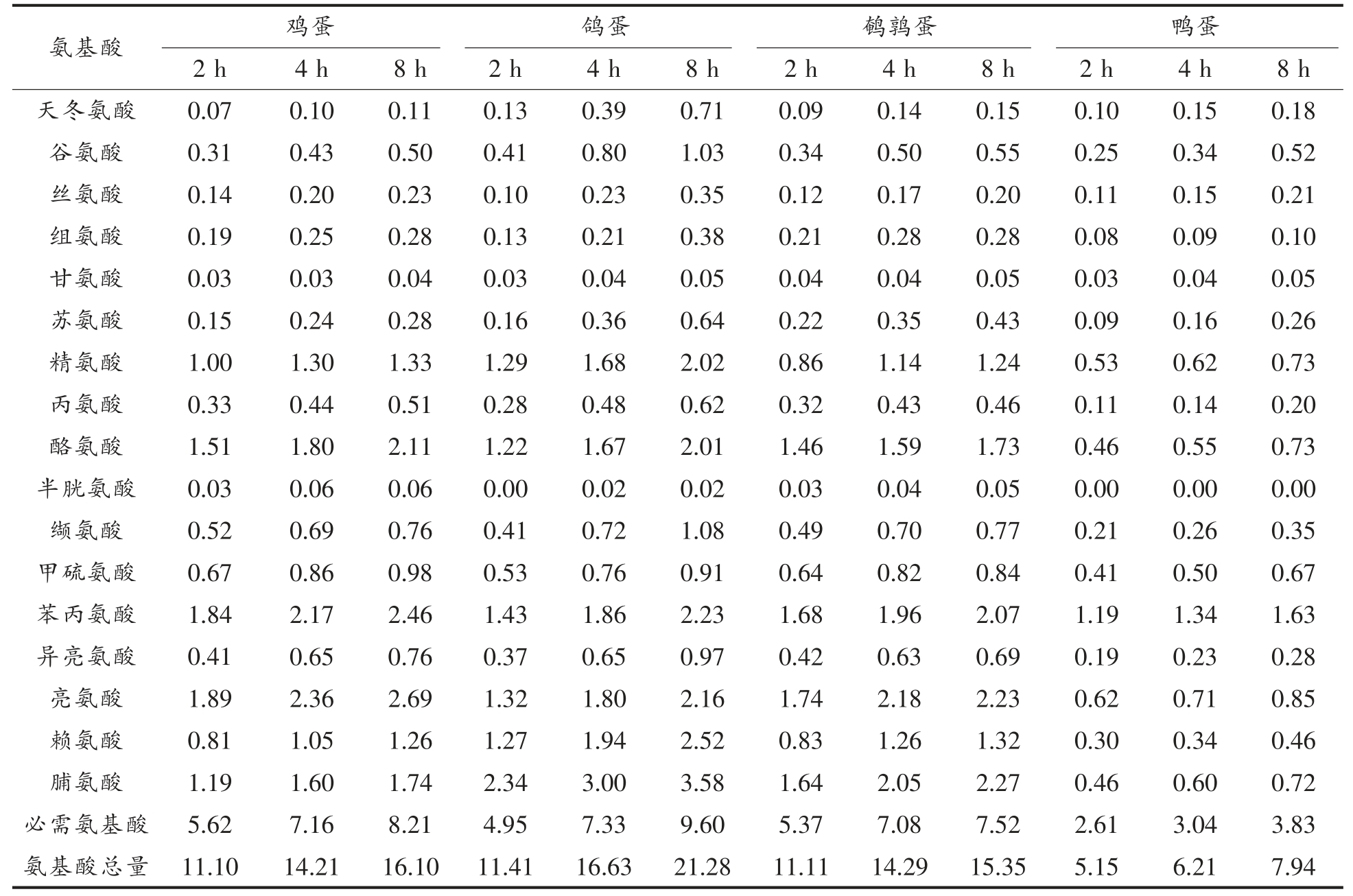
氨基酸鹌鹑蛋鸭蛋2 h4 h8 h2 h4 h8 h2 h4 h8 h2 h4 h8 h天冬氨酸0.070.100.110.130.390.710.090.140.150.100.150.18谷氨酸0.310.430.500.410.801.030.340.500.550.250.340.52丝氨酸0.140.200.230.100.230.350.120.170.200.110.150.21组氨酸0.190.250.280.130.210.380.210.280.280.080.090.10甘氨酸0.030.030.040.030.040.050.040.040.050.030.040.05苏氨酸0.150.240.280.160.360.640.220.350.430.090.160.26精氨酸1.001.301.331.291.682.020.861.141.240.530.620.73丙氨酸0.330.440.510.280.480.620.320.430.460.110.140.20酪氨酸1.511.802.111.221.672.011.461.591.730.460.550.73半胱氨酸0.030.060.060.000.020.020.030.040.050.000.000.00缬氨酸0.520.690.760.410.721.080.490.700.770.210.260.35甲硫氨酸0.670.860.980.530.760.910.640.820.840.410.500.67苯丙氨酸1.842.172.461.431.862.231.681.962.071.191.341.63异亮氨酸0.410.650.760.370.650.970.420.630.690.190.230.28亮氨酸1.892.362.691.321.802.161.742.182.230.620.710.85赖氨酸0.811.051.261.271.942.520.831.261.320.300.340.46脯氨酸1.191.601.742.343.003.581.642.052.270.460.600.72必需氨基酸5.627.168.214.957.339.605.377.087.522.613.043.83氨基酸总量 11.1014.2116.10 11.4116.6321.2811.1114.2915.355.156.217.94鸡蛋鸽蛋
2.2.3 肽分子质量的变化情况 肽分子质量是反映蛋白质消化水解的一个重要参数,与蛋白质水解物的生物活性相关。研究表明,蛋白质水解产物的分子质量是产生具有预期生物活性最重要因素之一,低分子质量肽更具有较高的抗氧化和抗菌作用[28-29]。如图4所示,随着体外模拟消化时间的增加,4 种禽蛋蛋清消化液的肽分子质量在逐渐降低,主要体现在>10 ku 的部分肽分子质量比例逐渐减少,<10 ku 的部分肽分子质量比例均逐渐增加,且胃消化阶段和肠消化阶段的不同肽分子质量比例差异极显著。主要原因是胃蛋白酶只进行初步消化,经胰蛋白酶消化后,蛋白质才被完全水解,同时佐证了上述蛋白水解度和SDS-PAGE凝胶电泳变化结果。
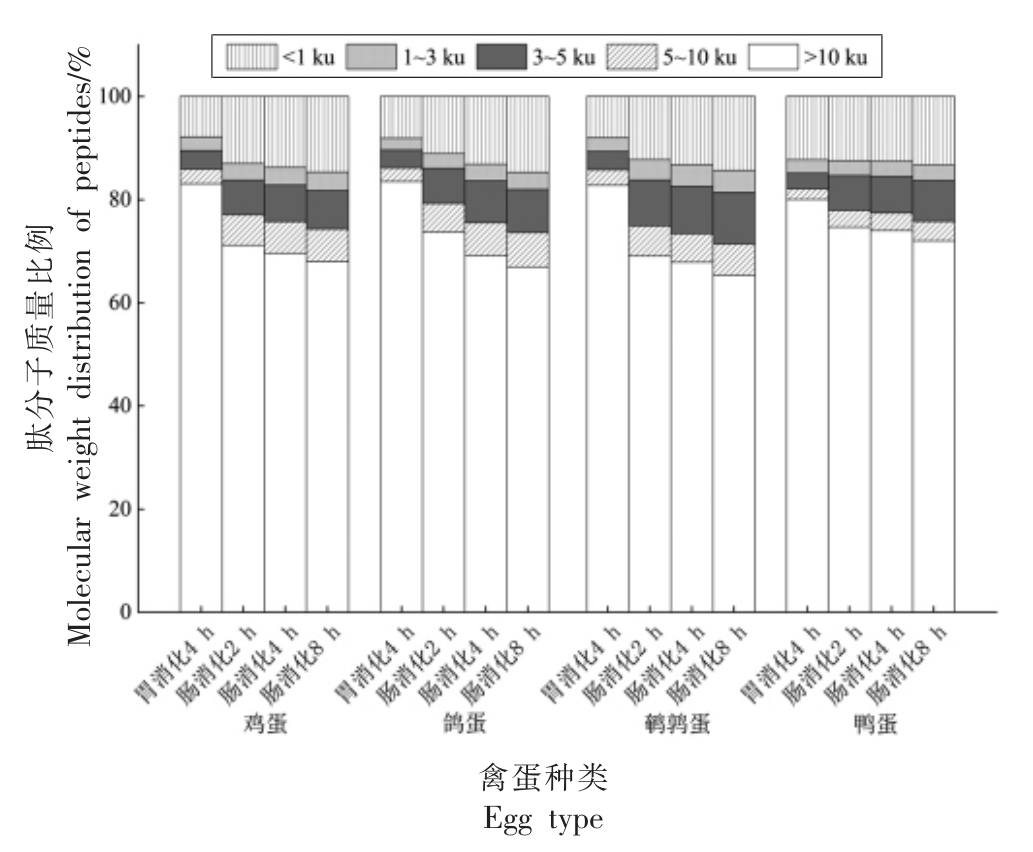
图4 禽蛋蛋清体外模拟消化液肽分子质量分布
Fig.4 Molecular weight distribution of peptides in vitro simulated digestive juice of poultry egg white
研究显示,经过胃肠消化后所产生的小分子肽(尤其是二肽和三肽),通过细胞旁路转运能够更容易地被人体所吸收,更具有较强活性[30-32]。在胃肠模拟消化过程中,4 种禽蛋肽分子质量<1 ku的肽段数量逐渐增多。4 h 的胃消化到8 h 的肠消化中,4 种禽蛋<1 ku 的肽段比例变化为:鸭蛋<1 ku 的肽段由12.3%增加13.3%、鸽蛋由8.2%增加到14.9%、鹌鹑蛋由8%增加到14.3%,鸡蛋从7.8%到14.5%,因此可以得到鹌鹑蛋、鸡蛋、鸽蛋在肠消化阶段中产生了更多的小分子肽,而鸭蛋与其它3 种禽蛋比较,其消化程度最低。
2.3 禽蛋蛋清体外模拟消化液的抗氧化能力测定
以DPPH 自由基清除能力、铁离子还原能力、羟自由基还原能力、超氧阴离子还原能力4 种抗氧化指标对比4 种禽蛋蛋清未消化液、胃消化液、肠消化液的抗氧化能力。从图5 得到,4 种抗氧化指标测定结果均呈现随质量浓度增加其抗氧化能力增强的趋势。此结果与黄慧娜[33]和吴烨婷等[16]采用碱性蛋白酶处理样品获得蛋清多肽以及陈晨等[34]利用5 种蛋白酶对蛋清蛋白处理的蛋白酶解液的变化结果一致。不仅如此,还发现在测定4 种抗氧化指标的过程中,肠消化液的结果往往最高、胃消化结果次之、未消化结果最小,说明禽蛋蛋清在胃消化和肠消化过程中,能够产生具有抗氧化性的多肽,且胰蛋白酶酶解后的消化液抗氧化性比胃蛋白酶酶解后的消化液抗氧化性更好。产生这一现象的原因主要是:4 种禽蛋经胃消化后大分子的蛋白被初步水解,使其产生具有抗氧化性的肽,而在肠消化之后,蛋白质被完全水解,小分子物质增多,同时抗氧化能力也增强。这一结果与Chen 等[35]发现蛋清蛋白肽中具有较强的抗氧化活性,且分子质量越小,抗氧化活性越强的结论相同。
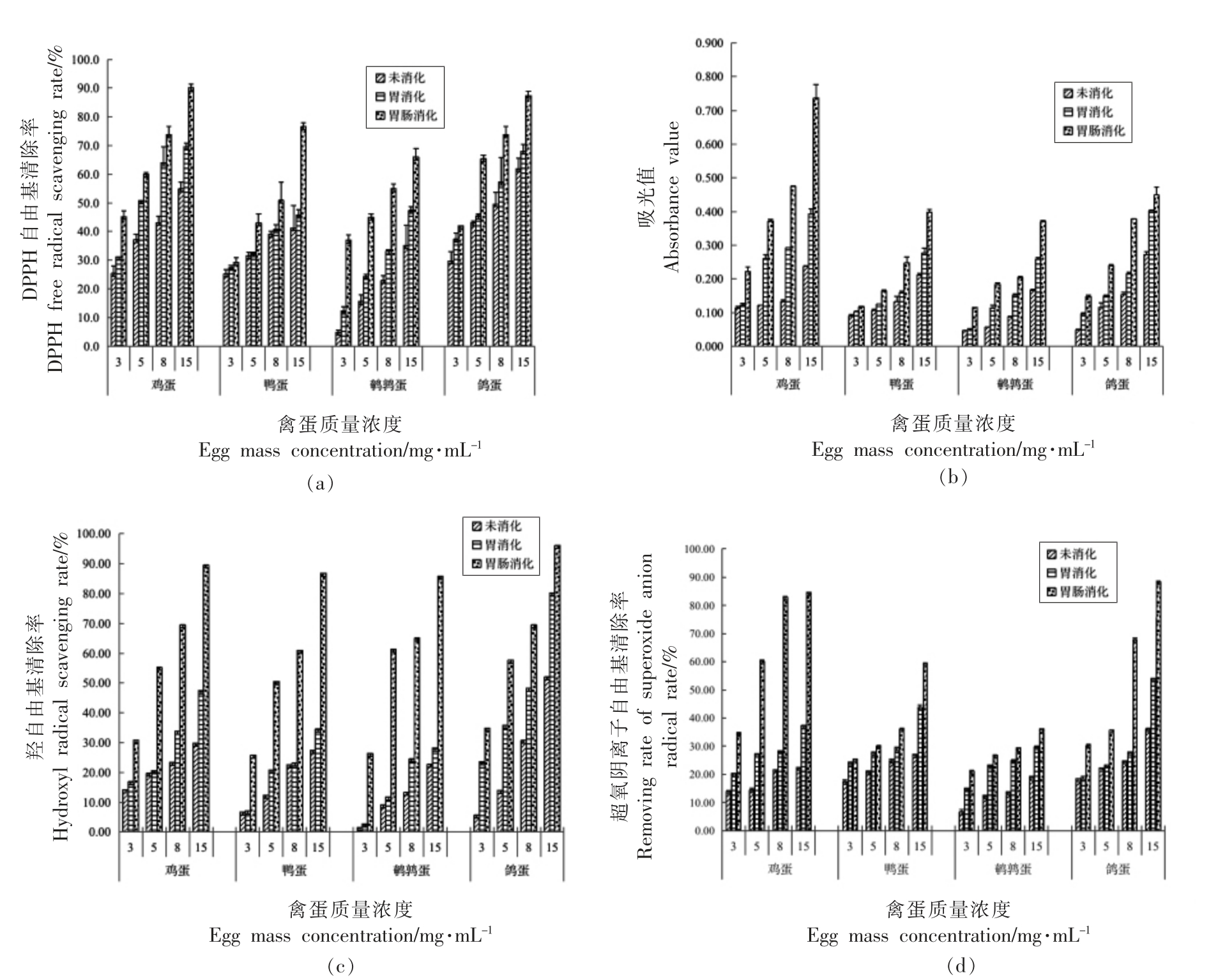
图5 禽蛋蛋清体外模拟消化液抗氧化能力测定
Fig.5 Molecular weight distribution of peptides in vitro simulated digestive juice of poultry egg white
同时,鸽蛋在肠消化之后羟基自由基清除率最高,达到(96.06±0.14)%,显著高于鸡蛋【(89.56±0.14)%】、鸭蛋【(86.89±0.14)%】、鹌鹑蛋【(86.89±0.00)%】。而Fe3+还原能力测定中,鸡蛋肠消化的最高达到(0.736±0.041),其次是鸽蛋(0.449±0.023),最后是鸭蛋(0.398±0.008)和鹌鹑蛋(0.370±0.004)。超氧阴离子清除能力测定中,鸽蛋清除能力最高达【(88.38±0.26)%】、其次是鸡蛋【(84.44±0.23)%】,最后是鸭蛋【(59.34±0.31)%】和鹌鹑蛋【(35.89±0.26)%】。DPPH 清除能力测定,鸡蛋和鸽蛋肠消化清除率无明显差异,分别为(90.09±1.34)%和(87.44±1.56)%、其次为鸭蛋(76.61±1.41)%、鹌鹑蛋(66.10±1.82)%。通过对4种抗氧化指标的比较,认为鸽蛋和鸡蛋在胃肠消化之后的抗氧化能力优于鹌鹑蛋和鸭蛋,这同时也佐证了2.1 节和2.2 节中鸡蛋和鸽蛋的水解度更高,蛋白质水解更彻底,所以抗氧化能力也更强的结果。
3 结论
本试验通过对鸡蛋、鸽蛋、鹌鹑蛋以及鸭蛋的蛋清进行体外模拟消化试验,对其体外模拟胃消化及肠消化的消化液分别进行了蛋白水解度的测定、SDS-PAGE 凝胶电泳试验、游离氨基酸以及肽分子质量分布的测定,以此来探究4 种禽蛋蛋清在体外胃肠模拟消化中的消化程度趋势、比较4种禽蛋的消化能力,以及评估和对比4 种禽蛋的营养价值,为消费者在选择不同禽蛋时提供科学的依据。
指标结果显示,4 种禽蛋蛋清在体外模拟消化中的消化程度随着时间的增加而加大,主要表现为4 种禽蛋随着消化时间的增加,其蛋白水解度、游离氨基酸含量以及小分子物质占比均上升。通过蛋白水解度的测定得到,4 种禽蛋中,鸡蛋水解度最高,鸽蛋和鹌鹑蛋次之,鸭蛋最低。SDSPAGE 凝胶电泳分析试验得出,鸡蛋消化程度最好,鹌鹑蛋及鸽蛋次之,鸭蛋最难以被消化。通过抗氧化性评价,得到在一定质量浓度范围内,随着质量浓度升高,4 种禽蛋的未消化、胃消化、肠消化的蛋清液抗氧化性均增强,并且肠消化液抗氧化能力高于未消化、胃消化,其中,鸽蛋肠消化液羟自由基清除能力【(96.06±0.14)%】,DPPH 自由基清除能力【(87.44±1.56)%】、超氧阴离子还原能力【(88.38±0.26)%】最好。鸡蛋铁离子还原能力(0.736±0.041)最好。通过游离氨基酸分析发现鸽蛋不仅必需氨基酸含量最多,达9.60 g/100 g,且在功能性氨基酸分析中得到,鸽蛋也凸显优势,其中精氨酸达2.02 g/100 g、脯氨酸达3.58 g/100 g。最后通过肽分子质量佐证上述结果,得到鸽蛋消化液中<1 ku 的肽段最多,达到14.9%。
综上所述,与另外3 种禽蛋相比,鸽蛋更易被人体吸收,抗氧化能力更强,其营养价值更高。为人们日常使用选择、后续食品产业加工及研究奠定了一定基础。本文为禽蛋筛选加工提供了理论支持,蛋清作为一种来源广泛的蛋白质,在提取合成抗氧化多肽上具有一定的开发意义。
[1]FATAH A.三种禽蛋蛋清水解物抗氧化活性研究[D].武汉:华中农业大学,2014.FATAH A.Study on the antioxidant activity of three poultry egg white hydrolysates[D].Wuhan:Huazhong Agricultural University,2014.
[2]杨月欣,张环美.《中国居民膳食指南(2016)》简介[J].营养学报,2016,38(3):209-217.YANG Y X,ZHANG H M.Introduction to 'dietary guidelines for Chinese residents(2016)'[J].Chinese Journal of Nutrition,2016,38(3):209-217.
[3]冯晓璇,梁天一,曾晓房,等.鸽蛋的营养及与其他禽蛋营养的比较分析[J].农产品加工,2020,9(17):44-49.FENG X X,LIANG T Y,ZENG X F,et al.The nutrition of pigeon eggs and the comparative analysis with other poultry eggs[J].Agricultural Products Processing,2020,9(17):44-49.
[4]KOVACS-NOLAN J,PHILLIPS M,MINE Y.Advances in the value of eggs and egg components for human health[J].Journal of Agricultural and Food Chemistry,2005,53(22):8421-8431.
[5]YAN Z,ZHANG Y C,JIANKE L,et al.Formation mechanism of ovalbumin gel induced by alkali[J].Food Hydrocolloids,2016,61:390-398.
[6]马斌,张琪,付星,等.卵转铁蛋白生物活性肽功能研究进展[J].食品工业科技,2020,41(22):364-370.MA B,ZHANG Q,FU X,et al.Research progress in the function of ovotransferrin bioactive peptides[J].Food Industry Science and Technology,2020,41(22):364-370.
[7]FRANCESCO G,LORIS L,FRANCESCO A,et al.The nutraceutical properties of ovotransferrin and its potential utilization as a functional food[J].Nutrients,2015,7(11):9105-9115.
[8]MIGUEL M,MANSO M A,R LÓPEZ-FANDI O,et al.Comparative study of egg white proteins from different species by chromatographic and electrophoretic methods[J].European Food Research &Technology,2005,221(3/4):542-546.
[9]马玉荣.加热及模拟胃肠道消化处理对豆浆活性成分和抗氧化能力的影响[D].广州:华南理工大学,2014.MA Y R.The effect of heating and simulated gastrointestinal digestion on the active ingredients and antioxidant capacity of soymilk[D].Guangzhou:South China University of Technology,2014.
[10]AFONIN S,JURETI C D,SEPAROVIC F,et al.Special issue on membrane-active peptides[J].European Biophysics Journal,2011,40(4):347-348.
[11]BOHN T,CARRIERE F,DAY L,et al.Correlation between in vitro and in vivo data on food digestion.What can we predict with static in vitro digestion models?[J].Critical Reviews in Food Science and Nutrition,2018,58(13):2239-2261.
[12]JIMÉNEZ-ESCRIG A,ALAIZ M,VIOQUE J,et al.Health-promoting activities of ultra-filtered okara protein hydrolysates released by in vitro gastrointestinal digestion:Identification of active peptide from soybean lipoxygenase[J].European Food Research and Technology,2010,230(4):655-663.
[13]LIU Y F,OEY I,BREMER P,et al.Proteolytic pattern,protein breakdown and peptide production of ovomucin-depleted egg white processed with heat or pulsed electric fields at different pH[J].Food Research International,2018,108:465-474.
[14]曾齐,蔡朝霞,刘亚平,等.禽蛋源生物活性肽的研究进展[J].食品科学,2021,42(19):362-378.ZENG Q,CAI Z X,LIU Y P,et al.Research progress of bioactive peptides derived from poultry eggs[J].Food Science,2021,42(19):362-378.
[15]NIELSEN P M,PETERSEN D,DAMBMANN C.Improved method for determining food protein degree of hydrolysis[J].Journal of Food Science,2001,66(5):642-646.
[16]吴烨婷,黄慧娜,施宝珠,等.蛋清酶解多肽的制备及其清除自由基活性[J].食品工业科技,2018,39(11):90-98.WU Y T,HUANG H N,SHI B Z,et al.Preparation and free radical scavenging activity of egg white enzymatic peptides[J].Food Industry Science and Technology,2018,39(11):90-98.
[17]郑淋,林松毅,刘静波,等.蛋清蛋白酶解物清除DPPH 自由基活性研究[J].食品工业,2009,30(3):1-3.ZHENG L,LIN S Y,LIU J B,et al.Study on the activity of scavenging DPPH free radicals by egg white proteolysis[J].Food Industry,2009,30(3):1-3.
[18]杨珊珊,刘会平,张璐,等.蛋清多肽体内外抗氧化活性的研究[J].食品工业科技,2019,40(22):40-43,48.YANG S S,LIU H P,ZHANG L,et al.Antioxidant activity of egg white peptides in vivo and in vitro[J].Food Industry Science and Technology,2019,40(22):40-43,48.
[19]佟晓红,王欢,刘宝华,等.生物解离大豆蛋白酶解物体外模拟消化抗氧化活性变化[J].食品科学,2019,40(15):50-56.TONG X H,WANG H,LIU B H,et al.Bio-dissociated soybean proteolysis in vitro simulated digestion and antioxidant activity[J].Food Science,2019,40(15):50-56.
[20]梅辉,王海滨.酶解鸭蛋清制备抗氧化肽的研究[J].食品科技,2013,38(8):113-117,122.MEI H,WANG H B.Study on the preparation of antioxidant peptides from duck egg white by enzymatic hydrolysis[J].Food Science and Technology,2013,38(8):113-117,122.
[21]梁天一.鸽蛋卵转铁蛋白的提取及抗氧化活性的研究[D].哈尔滨:哈尔滨商业大学,2020.LIANG T Y.Study on the extraction and antioxidant activity of pigeon egg transferrin[D].Harbin:Harbin University of Commerce,2020.
[22]ADIBI S A.Intestinal transport of dipeptides in man:Relative importance of hydrolysis and intact absorption[J].Journal of Clinical Investigation,1971,50(11):2262.
[23]陈晨,贾才华,赵思明,等.米发糕的体外模拟胃肠消化特性研究[J].中国粮油学报,2018,33(11):7-13.CHEN C,JIA C H,ZHAO S M,et al.Study on the in vitro simulated gastrointestinal digestion characteristics of rice cakes[J].Journal of the Chinese Cereals and Oils Association,2018,33(11):7-13.
[24]王良峡,刘若颖,林福鸿,等.支链氨基酸在运动中的作用研究进展[J].氨基酸和生物资源,2015,37(1):7-12.WANG L X,LIU R Y,LIN F H,et al.Research progress on the role of branched-chain amino acids in exercise [J].Amino Acids and Biological Resources,2015,37(1):7-12.
[25]FEDEWA M V,SPENCER S O,WILLIAMS T D,et al.Effect of branched-chain amino acid supplementation on muscle soreness following exercise:A Meta-analysis[J].International Journal for Vitamin and Nutrition Research,2019,89(5/6):348-356.
[26]YAO K,YIN Y,CHU W,et al.Dietary arginine supplementation increases mTOR signaling activity in skeletal muscle of neonatal pigs[J].The Journal of Nutrition,2008,138(5):867-872.
[27]晋超,吴德,方正峰,等.精氨酸对妊娠母猪繁殖性能的调节作用[J].动物营养学报,2010,22(6):1495-1500.JIN C,WU D,FANG Z F,et al.Regulating effect of arginine on reproductive performance of pregnant sows[J].Journal of Animal Nutrition,2010,22(6):1495-1500.
[28]TEUSCHER A C,STATZER C,PANTASIS S,et al.Assessing collagen deposition during aging in mammalian tissue and in Caenorhabditis elegans[J].Methods in Molecular Biology,2019,1944:169-188.
[29]RISKI M.禽蛋蛋清水解物的抗菌活性与抗氧化活性研究[D].武汉:华中农业大学,2015.RISKI M.Study on the antibacterial activity and antioxidant activity of poultry egg white hydrolysate[D].Wuhan:Huazhong Agricultural University,2015.
[30]SUNANTHA K,OSCAR M,SOOTTAWAT B,et al.Gelatin hydrolysates from farmed giant catfish skin using alkaline proteases and its antioxidative function of simulated gastro-intestinal digestion[J].Food Chemistry,2016,192:34-42.
[31]PHANIPA P,SOOTTAWAT B,WONNOP V,et al.Use of pyloric caeca extract from bigeye snapper(Priacanthus macracanthus)for the production of gelatin hydrolysate with antioxidative activity[J].LWT- Food Science and Technology,2009,43(1):86-97.
[32]刘阳峰,申铉日,张培,等.体外模拟胃肠道消化体系中EGCG 对罗非鱼皮明胶水解物分子量分布的影响[J].食品科技,2016,41(5):258-262.LIU Y F,SHEN X R,ZHANG P,et al.The effect of EGCG on the molecular weight distribution of tilapia skin gelatin hydrolysate in simulated gastroin testinal digestion system in vitro[J].Food Science and Technology,2016,41(5):258-262.
[33]黄慧娜.蛋清抗氧化肽的制备及特性研究[D].杨凌:西北农林科技大学,2016.HUANG H N.Study on the preparation and characteristics of egg white antioxidant peptides[D].Yangling:Northwest A&F University,2016.
[34]陈晨,迟玉杰,刘丽.蛋清的蛋白酶解物清除自由基能力的研究[J].营养学报,2009,31(5):471-474.CHEN C,CHI Y J,LIU L.Study on the scavenging ability of egg white protein hydrolysate[J].Chinese Journal of Nutrition,2009,31(5):471-474.
[35]CHEN C,CHI Y J,ZHAO M Y,et al.Purification and identification of antioxidant peptides from egg white protein hydrolysate[J].Amino Acids,2012,43(1):457-466.